Method Article
Stabilimento di larvale Zebrafish come modello animale per indagare Trypanosoma cruzi motilità In Vivo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
In questo protocollo, fluorescente contrassegnati T. cruzi sono stati iniettati in larve di zebrafish trasparente e motilità del parassita è stata osservata in vivo mediante microscopia a fluorescenza foglio leggero.
Abstract
Malattia di Chagas è un'infezione parassita causata dal Trypanosoma cruzi, cui motilità non è solo importante per la localizzazione, ma anche per l'associazione cellulare e invasione. Attuali modelli animali per lo studio di T. cruzi permettono l'osservazione limitata di parassiti in vivo, che rappresentano una sfida per capire comportamento del parassita durante le fasi iniziali dell'infezione in esseri umani. Questo protozoo ha un palco flagellare sia vettoriale che ospita mammiferi, ma non esistono studi che descrivono la motilità in vivo. L'obiettivo di questo progetto era di stabilire un modello di zebrafish vertebrati dal vivo per valutare la motilità di T. cruzi nel sistema vascolare. Zebrafish trasparente larve sono state iniettate con fluorescente etichettati tripomastigoti e osservata mediante microscopia a fluorescenza foglio leggero (LSFM), un metodo non invasivo per visualizzare organismi vivi con alta risoluzione ottica. I parassiti potrebbero essere visualizzati per lunghi periodi di tempo dovuto il rischio relativamente basso di questa tecnica di photodamage rispetto al confocale o epifluorescenza. T. cruzi parassiti sono stati osservati in viaggio nell'apparato circolatorio di zebrafish dal vivo in diverse dimensioni di vasi sanguigni e il tuorlo. Essi potrebbe anche essere visto attaccati alla parete del sacco vitellino e alla valvola atrioventricolare nonostante le forze di forte associato a contrazioni cardiache. LSFM di T. cruzi-larve di zebrafish inoculato è un metodo importante che può essere utilizzato per visualizzare i parassiti di circolazione e valuta loro tropismo, modelli di migrazione e la motilità nell'ambiente dinamico del sistema cardiovascolare di un animale vivo.
Introduzione
Malattia di Chagas è causata dal protozoo parassita T. cruzi. Circa 6 a 7 milioni di persone nel mondo sono infettati con T. cruzi. La malattia è trasmessa principalmente in America Latina, ma è stata segnalata in Stati Uniti, Canada e molti paesi europei nonché di alcuni paesi del Pacifico occidentale, principalmente a causa della migrazione di individui infettati1. Chagas è in gran parte trasmesse da vettori e trasmesso agli esseri umani dal contatto con le feci di hematophagic insetti nella sottofamiglia eziologico, comunemente noto come "kissing bugs". Tuttavia, T. cruzi possono essere trasmessi anche tramite trasfusioni di sangue, traslazione verticale da madre a bambino, o ingestione di alimenti contaminati con parassiti2. La fase acuta, l'infezione è prevalentemente asintomatica o costitutivamente sintomatico e dura da 6 a 8 settimane, dopo di che impegno del sistema immunitario controlla il carico del parassita, ma non eliminare completamente l' infezione3. Maggior parte degli individui, quindi immettere una fase cronica asintomatica; Tuttavia, quasi 30% dei pazienti sviluppano una fase cronica sintomatica, in cui il sistema cardiaco e meno frequentemente il digerente e sistema nervoso sono compromessi4. Questo scenario rappresenta una sfida per il trattamento di malattia e controllo poiché non esistono vaccini disponibili, e ci sono solo due farmaci efficaci per Chagas: benznidazole e nifurtimox. Entrambi i trattamenti richiedono la somministrazione prolungata e possono avere gravi effetti collaterali2.
Aumentato la comprensione del comportamento di T. cruzi comportamento in vivo è chiave a determinare la migrazione parassitaria, cellulare allegato e invasione all'interno dell'ospite; una mancanza di modelli in vivo limita lo sviluppo di nuovi approcci terapeutici. Studi in vitro di T. cruzi infezione hanno dimostrato che la motilità dei tripomastigoti è importante per l'associazione a host delle membrane cellulari e la successiva invasione cellulare5. Svuotamento di energia in tripomastigoti in co-coltura con una linea di cellulari sensibili ha dimostrato di ridurre l'invasione cellulare6. È interessante notare che, in trypanosomatids, movimento flagellare è stato caratterizzato anche come un meccanismo di evasione contro gli anticorpi di parassita-specific7.
Motilità flagellare è stato estesamente studiato in vitro in Trypanosoma brucei, un parassita strettamente correlato che causa la tripanosomiasi africana8. Gli studi in vitro la motilità di questi trypanosomes hanno mostrato che la simulazione delle condizioni di sangue o fluidi corporei, tra cui la viscosità e la presenza di ostacoli rappresentativi delle cellule del sangue, è importante per il movimento in avanti del parassita9 . Come di ancora non e ' stato possibile visualizzare il movimento dei parassiti nella circolazione sanguigna in vivo.
Larve di zebrafish sono un potente modello per lo studio di interazioni ospite-patogeno in vivo. Sono piccoli, poco costoso e relativamente facile da allevare se confrontato con altri modelli vertebrati stabiliti per la malattia di Chagas. Zebrafish hanno innato e un sistema immunitario simile agli esseri umani, ma loro sistema immunitario adattativo comincia a svilupparsi a 4 giorni post fertilizzazione (dpf) e non è maturo per un altro diverse settimane10. Durante lo sviluppo iniziale, quando solo i macrofagi sono presenti, c'è una grande finestra per studiare il comportamento di parassita senza interferenza immunitaria immediata10. Tuttavia, il più grande vantaggio di utilizzare larve di zebrafish come modello per studiare il comportamento patogeno vertebrato risiede nella loro trasparenza ottica, che li rende suscettibili di screening al microscopio e imaging11. Inoltre, ci sono più strumenti per manipolare la genetica di pesce. Ad esempio, il ceppo di Casper è una linea mutante di zebrafish con nessuna pigmentazione, rendendo l'animale completamente trasparente e utile per la visualizzazione dei singoli organi e per il monitoraggio in tempo reale di cellule iniettate12.
Una limitazione chiave di osservazione longitudinale dei parassiti rapidamente muovendo in zebrafish dal vivo utilizzando confocale o epifluorescenza si trova nell'impossibilità di imaging a acquisizione ad alta velocità e profondità di penetrazione grande con immagini di buona qualità e basso rischio di fotodanneggiamento. Foglio leggero fluorescenza micsroscopy (LSFM) è una tecnica di imaging emergente che supera queste limitazioni per consentire queste osservazioni. Usando un obiettivo per rilevare la fluorescenza e un secondo obiettivo di illuminazione ortogonali che illumina solo il piano focale dell'obiettivo di rilevamento, è possibile ottenere sezioni ottiche ad alta risoluzione come in un microscopio confocale, ma con significativamente ridotta photodamage, anche rispetto a epifluorescenza microscopia13. La tecnica LSFM usata qui è chiamata singolo aereo illuminazione microscopia (SPIM), in cui un sottile foglio di luce illumina un singolo aereo entro le larve di zebrafish.
L'obiettivo di questa metodologia è quello di stabilire larvale zebrafish come un modello di infezione non praticabile per la comprensione della motilità T. cruzi e relative al comportamento in vivo. A tale scopo, abbiamo iniettato larve di zebrafish trasparente con fluorescente contrassegnati tripomastigoti, la forma cellulare responsabile di infezione degli esseri umani ed abbiamo identificato il movimento di T. cruzi nella circolazione cardiovascolare di zebrafish utilizzando LSFM.
Protocollo
i seguenti protocolli sono stati approvati dal istituzionale Animal Care e uso Comitato di Los Andes University (CICUAL). Livello di biosicurezza 2 (BSL-2) linee guida dovrebbero essere seguite rigorosamente per evitare la contaminazione con l'agente patogeno T. cruzi.
Nota: manutenzione e cura degli animali: Casper zebrafish, un ceppo geneticamente modificato di zebrafish (Danio rerio) è usato in questo protocollo a causa della loro trasparenza ottica prezioso in tutte le fasi inerenti allo sviluppo. Pesci vengono modificati utilizzando il sistema di cura ottimale le condizioni per la specie 14, in un 14 h luce-10 h ciclo scuro, a 28 ± 1 ° C, in un pH (7.0-7.4) controllate multi-serbatoio ricircolo acqua. Gli animali sono alimentati due volte al giorno con live di Artemia (Artemia salina) e arricchiti con allevamento di cibo. Tutti i protocolli sono stati approvati dal CICUAL presso Universidad de los Andes (C.FUA_14-017).
1. preparazione dell'uovo acqua
- preparare 0,6 g/L acquario sale in reverse osmosis (RO) o acqua deionizzata (DI) e aggiungere alla soluzione di blu di metilene 0,01 mg/L.
Nota: La conducibilità misurata deve essere di 400-500 µS/cm e pH livello a 7.2-7.9. Per abbassare il pH, aerare l'acqua uovo per poche ore.
2. Preparazione della soluzione Stock di tricaina
soluzione madre di tricaina 0,4%- preparare sciogliendo 400mg tricaina (MS-222) in 97,9 mL di acqua distillata (ddH 2 O). Dopo che la polvere è completamente sciolta, regolare il pH a 7.0 utilizzando 2,1 mL 1M Tris (pH 9.0) e conservare in frigorifero la soluzione.
3. Preparazione del 1,0% basso punto di fusione dell'agarosi
- sciogliere la polvere di agarosio punto di fusione basso nell'uovo acqua ad una concentrazione finale pari all'1,0%. Riscaldare la miscela in un forno a microonde o su una piastra calda con mescolando di continuo fino a quando la soluzione di agarosio appare omogenea.
- Conservare le aliquote a 4 ° C per non più di una settimana.
4. Accoppiamento di analisi e raccolta degli embrioni
- tre giorni prima iniezioni impostare accoppiamenti utilizzando coppie di sane dei pesci maschi e femmine in vasche di allevamento. Arricchimento con biglie di vetro e piante artificiali migliora la deposizione delle uova. Accoppiamenti dovrebbero essere istituiti durante il pomeriggio e durante la notte.
- La mattina successiva, raccogliere le uova generate svuotamento della vasca attraverso un colino e lavando le uova con l'acqua di uovo. Rimuovere tutte le uova invertendo il colino e versare l'uovo acqua attraverso il filtro in una capsula di Petri. Per mantenere gli embrioni sani, loro acqua pulita rimuovendo eventuali residui ed embrioni morti con una pipetta di plastica trasferimento.
- Trasferire gli embrioni in un incubatore a una temperatura stabile di 28,5 ° C per consentire lo sviluppo degli embrioni secondo il zebrafish stadiazione standard 15. Esaminare gli embrioni due volte al giorno e scartare le uova inviable per mantenere sana la frizione.
5. Embrione Dechorionation
Nota: questa procedura è necessaria se gli embrioni non hanno covato al momento dell'iniezione. In questa procedura, " larve " sono animali fuori loro corion da 48 h post fertilizzazione (hpf) in poi.
- Il giorno dell'esperimento, porre la capsula di Petri contenente gli embrioni sani sotto uno stereoscopio dissezione.
- Afferrare le estremità opposte del corion con due pinze taglienti (Dumont #5), e allo strappo e tirare aprire delicatamente il corion. Circa 5-6 larve vengono iniettate in un momento e in genere 3-4 sono Imaging.
- Rimuovere il chorions dall'acqua utilizzando una pipetta di trasferimento.
6. Preparazione del materiale di iniezione
- preparare 1.0 mm aghi utilizzando tubi capillari in vetro a parete sottile e un dispositivo estrattore micropipetta con le seguenti impostazioni: 2 pesi leggeri + 1 peso pesante, estrazione superiore 2 mm + 5 mm inferiore pull, 75,9 ° C (fase 1) + 78,2 ° C ( Passo 2). Conservare gli aghi in una capsula Petri su una striscia di argilla di modellistica. L'ago ideale dovrebbe avere una punta stretta, come T. cruzi misura circa 20 x 1-3 µm e passa facilmente attraverso l'ago. La lunghezza della punta può variare: una punta più lunga è utile per raggiungere le strutture più profonde, ma una punta più corta sarà più rigida una iniezione più facile per l'utente.
Nota: Il formato di punta dell'ago dipende dalla temperatura utilizzata: una temperatura più alta per la fase 2 si traduce in una punta più lunga e più sottile. - Preparare una soluzione di agarosio 1.5% in ddH 2 O e versarlo in una capsula di Petri di 10 cm. Coprire una profondità di circa 1,0 cm.
- Posiziona uno stampo prefabbricato microinjection l'agarosio e lasciarlo solidificare.
- Sollevare lo stampo di microiniezione prefabbricate fuori e aggiungere acqua di uovo per la conservazione a 4 ° C. Questo impedisce di seccarsi l'agarosio.
- Aggiungete dell'acqua di uovo per la soluzione di riserva di tricaina ad una concentrazione finale di 150 mg/L. Store a 4 ° C.
7. Coltura cellulare per la crescita del parassita
- parassiti sono mantenuti in una linea di cellule di astrocitoma umano (CRL-1718) utilizzando il metodo descritto da Vargas-Zambrano et al. 16
- avviare la coltura di cellule umane in un matracci di cultura T25 (superficie = 25 cm 2) ad una densità di 2 x 10 5 o 4 x 10 5 celle in 4 mL di medium RPMI-1640 con 10% di siero fetale di vitello (FCS), completati con 2 mM L-Glutammina, glucosio di 4,5 g/L, 10 mM HEPES, piruvato di 1 mM e 1% di penicillina-streptomicina (riferito come " completare media "). Incubare le colture di astrocitoma a 37 ° C in un 5% CO 2 ambiente.
- Una volta che un monostrato confluente, scollegare le celle utilizzando 2 mL di 0,25% di tripsina-EDTA incubando li per 3 min a 37 ° C. visivamente controllo celle per distacco e bloccare la soluzione di tripsina con 3 mL di RPMI-1640 con 10% FCS in una provetta da 15 mL.
- Centrifugare la sospensione cellulare per 5 min a 1.350 x g.
- Lavare il pellet cellulare risultante in mezzo DMEM in un tubo da 15 mL e centrifugare per 5 min a 1.350 x g a 22 ° C.
- Contare le celle manualmente in un camera di Neubauer e verificare per la vitalità in un microscopio ottico a 40 ingrandimenti.
- Delicatamente nuovamente sospeso il cellulare della pallina in 4 mL di multimediale completo e utilizzarlo per creare nuove colture di cellule con 2 x 10 5 celle per Ogni matraccio di cultura T25.
8. T. cruzi cultura ed etichettatura
- parassiti sono un ceppo originariamente ottenuta da un essere umano infetto e caratterizzata come T. cruzi DA ceppo (MHOM/CO/01/DA), genotipo TcI discreti digitando unità (DTU) 16. Dopo 3 o 4 giorni di coltura, raccogliere i parassiti commoventi dal supernatante di coltura delle cellule di astrocitoma umano e centrifugare per 5 min 1.350 g. x eliminare il terreno.
Nota: I parassiti in terreno completo possono essere utilizzati per ri-cultura in rapporto 1:1 con cellule di astrocitoma in matracci di cultura T25. - Delicatamente, risospendere il pellet in 10 mL sterili 1x tampone fosfato (PBS) con 0,1% FCS e centrifugare per 5 min al 1.350 x g.
- Eliminare il supernatante e risospendere in 1 mL di PBS. Prendere 10 µ l per contare i parassiti liberamente natante in una camera di Neubauer.
- Prendere il resto dei parassiti ri-sospensione (990 µ l) e aggiungere 1 µ l di Carboxyfluorescein diacetato SuccinimiDyl Ester (CFSE), concentrazione finale 5.0 µM. Incubare per 10 minuti a temperatura ambiente.
Nota: CFSE stock a 5 millimetri dovrebbe essere aliquotati e mantenuto a -20 ° C. - Pellet i parassiti (1.350 x g, 5 min). Ricostituire il pellet di parassita, spostando il tubo e lavare in 10 mL di 1X PBS-0.1% FCS seguita da un giro successivo (1.350 x g, 5 min).
- Scartare il surnatante e delicatamente risospendere il pellet con etichetta parassita in 1X PBS con il volume appropriato per ottenere una concentrazione finale di circa 10-20 parassiti/nL iniettabile.
- Utilizzare un piccolo volume (∼ 10 µ l, circa 1 x 10 4 -2 x 10 4 parassiti) di tripomastigoti per valutare la fattibilità e l'etichettatura. Un microscopio a fluorescenza invertito può essere utilizzato per la visualizzazione diretta dei parassiti. Nella modalità luce trasmessa, verificare che i parassiti si muovano. In modalità di fluorescenza, utilizzare il filtro della fluorescina isotiocianato (FITC) per valutare parassita etichettatura.
9. L'iniezione di larve di Zebrafish
- parassita caricamento
- prendere 10 µ l di parassiti da risospensione (100 µ l) e caricarli negli aghi di vetro sigillato utilizzando un puntale di 10 µ l microloader.
- Inserire l'ago di vetro il porta aghi del micromanipolatore, utilizzare un supporto magnetico e posto accanto lo stereoscopio.
- Utilizzando una pinzetta sotto lo stereoscopio, tagliata l'ago creando un aperto smussato fine e misurare le dimensioni della goccia per ottenere un volume di iniezione di 1 nL (questo è equivalente ad un diametro di perlina di 0,12-0,13 mm quando misurata in olio minerale 17). Una punta più lunga è preferita in modo che l'ago può raggiungere strutture dentro il pesce senza danneggiare il tessuto. In questo protocollo, viene utilizzato un ago smussato, ma un ago smussato può essere usato pure.
- Di montaggio
- anestetizzare le larve di 48 hpf, con tricaina 150 mg/L. Controllare che non rispondono al tocco, ma assicurarsi che il cuore sta battendo.
- Posto le larve nello stampo dell'agarosi microiniezione in posizione laterale.
- Posizionare l'ago titolare accanto lo stereoscopio e regolare il micromanipolatore, in modo che la punta dell'ago è al centro del campo visivo. Spostare il piatto di Petri preparato nei passaggi 6.2 - 6.4 in modo che il tuorlo larvale è vicino la punta dell'ago. Controllare la condizione della larva per garantire che il cuore continua pestaggio.
- Impostare i valori di microinjector come segue: 9,6 libbre per pollice (psi) di pressione di iniezione; tenere pressione: 20 psi; gamma di 100 ms di gating; valore di periodo di 1,9 (corrisponde a 10,9 ms). Il volume di iniezione deve essere compresa tra 1-3 nL, con circa 10-20 parassiti/nL.
10. Iniezione del parassita
- Inject il pesce nella parte anteriore-superiore del tuorlo al dotto di Cuvier. Questo passaggio dovrebbe essere praticato per garantire la sopravvivenza degli animali dopo l'iniezione. Ci vogliono circa 10 minuti per iniettare con successo 5-6 larve.
- Come un controllo, iniettare 1-2 larve con lo stesso volume del veicolo (1x PBS).
- Trasferire immediatamente la larva all'acqua fresca all'uovo.
11. LSFM montaggio di larve iniettato
- trasferire la larva iniettata con parassiti di una capsula di Petri vuota e rimuovere con cura l'acqua circostante con una pipetta di plastica e carta assorbente. Immediatamente aggiungere 100 µ l di preriscaldato 1,0% basso dell'agarosi punto di fusione (vedere il passaggio 3 per la preparazione di agarosio) per coprire la larva. Garantire l'agarosio non è più di 40 ° C.
- Inserire un filo dritto all'interno di un capillare in vetro 1,0 mm e usarlo come uno stantuffo per aspirare la larva in posizione verticale. Assicurarsi di lasciare una piccola quantità di agarosio sopra la larva. Attendere che l'agarosio si solidifica prima di esporre la larva (questo richiederà pochi minuti). Se necessario, spingere fuori dell'agarosi in eccesso sotto la larva e tagliarlo off.
- Inserire il capillare supporto microscopio e spingere fuori l'estremità contenente la larva fino a quando si blocca gratis dal capillare. La camera di esemplare dovrebbe essere riempita con soluzione di tricaina (150 mg/L) e la temperatura impostata a 28 ° C.
- Posizionare la larva davanti la pupilla dell'obiettivo di rilevamento utilizzando un sistema XYZ-micromanipolatore. Per le rotazioni intorno all'asse verticale, utilizzare una fase di rotazione. Posizionamento della larva dovrebbe essere fatto in modalità luce trasmessa chiaramente identificare strutture larvali.
12. LSFM Imaging di parassiti iniettato
- cambiamento di fluorescenza modalità e regolare l'intensità dell'illuminazione, nonché il tempo di esposizione per diminuire photodamage e ottimizzare la risoluzione temporale. Per questi esperimenti particolari, abbiamo usato una potenza di 2.8-3.0 mW per il campione ed esposti ogni fotogramma per 200 ms utilizzando una macchina fotografica con 6,45 µm pixel e ~ 70% efficienza quantica alle lunghezze d'onda di rilevamento. Queste impostazioni dovrebbero causare immagini adeguatamente esposte alle circa 5 fotogrammi/s. Assicurarsi di utilizzare un obiettivo con la massima apertura numerica possibile.
- Avviare un'acquisizione video della regione di interesse (ROI). Nel nostro caso, i parassiti sono osservati allegata alle valvole e liberamente commovente intorno alla zona del cuore. Si consiglia di prendere un video di un unico piano nel corso del tempo, o di utilizzare il sistema micromanipolatore o piezo-galvo a fuoco diversi piani mentre si muove il parassita.
Nota: Questa procedura è utile per i tempi di acquisizione breve fino a 2 h. Per acquisizione a lungo termine, le larve dovrebbero essere montate utilizzando metodi alternativi 20.
13. Elaborazione di immagini e analisi dei dati acquisiti
Nota: elaborazione delle immagini è stata effettuata su un personal computer con un processore di 2.90 GHz, 8,00 GB di memoria e una scheda video con 1,00 GB di memoria.
- Apri le acquisite dataset nel software di scelta di elaborazione delle immagini. Apri il software FiJi è consigliato per LSFM elaborazione dati e analisi 21.
- Del software di analisi di immagine, regolare i livelli di luminosità e contrasto per migliorare le immagini.
Nota: In assenza di parametri fissi è usati in questo caso, ma selezionando la " Auto " opzione può essere utile per ottenere un miglioramento iniziale. - Selezionare il ROI.
Nota: Per il tracciamento individuali parassiti, FiJi ha entrambi i plugin rilevamento manuale e automatico disponibili.
14. Recupero Imaged larve
- Rimuovi la larva attentamente dal agarosio utilizzando una pinzetta e dei capelli strumento loop. Trasferire il pesce torna a acqua fresca all'uovo e controllare per il recupero dopo 15 min. riporre la larva incubatore a 28 ± 0,5 ° C.
- In alternativa, procedere alla eutanasia le larve imaged con una overdose di tricaina. Poi, introdurre le larve in una soluzione di ipoclorito di sodio (6,15% NaClO) per 5 min uccidere il parassita. Smaltire secondo l'istituzione ' protocolli standard s.
Risultati
Condizioni ottimali per l'iniezione:
Gruppi di larve di zebrafish sono stati iniettati a 24, 48, 72, 96 e 120 hpf, presso diverse sedi anatomiche e la loro sopravvivenza è stato esaminato ogni giorno per 5 giorni. Dopo 5 giorni dopo l'iniezione, embrioni iniettati in 24 hpf aveva 6,25% sopravvivenza (2/32), considerando che il 95% (38/40) delle larve iniettate alle 48 hpf è sopravvissuto. Come controllo, le larve sono state iniettate con 1x PBS come veicolo. Non c'erano differenze nella sopravvivenza tra larve veicolo-iniettati e parassita-iniettato, che indica nessun effetto parassita-dipendente sul tasso di sopravvivenza dei pesci (p = 0,08). Larve iniettate tra 72-120 hpf avevano tassi di sopravvivenza paragonabili a 48 hpf-iniettato larve al volume di iniezione costante. Per tutte le procedure qui presentate, 48 larve hpf sono state utilizzate a causa della loro facilità di manipolazione e avendo sviluppato organi e pelle facilmente penetrabile senza danni evidenti dopo l'iniezione.
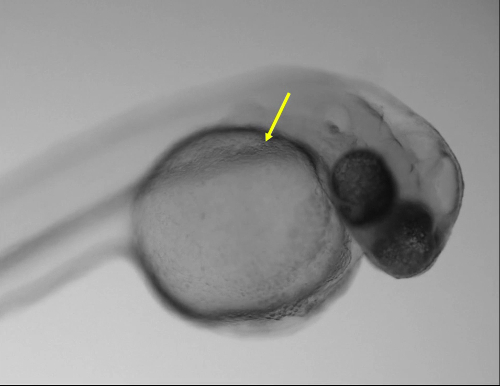
Larve iniettate alle 48 hpf sono stati iniettati nello spazio pericardico, coda muscolare, ventricolo hindbrain, vescicola otica, notocorda e dotto di Cuvier nel sacco vitellino. C'erano differenze nella sopravvivenza delle larve iniettato in differenti sedi anatomiche. Tuttavia, la regione più semplice e veloce per iniettare era che il dotto di Cuvier situato nella parte anteriore del sacco vitellino (Figura 1, Movie 1). Iniezioni in quel sito ha permesso l'introduzione di volumi elevati con un minor rischio di lesioni alle strutture vitali. Inoltre, tra 24-72 hpf, questa regione è un luogo ottimo per accedere direttamente al sistema vascolare in via di sviluppo e cuore11.
Visualizzazione di parassita utilizzando LSFM:
Entro 8-10 min dopo l'iniezione di T. cruzi nel condotto di Cuvier, parassiti sono stati identificati nelle larve di zebrafish utilizzando LSFM a causa del loro segnale fluorescente CFSE e la trasparenza ottica delle larve. Dopo l'inoculazione, i parassiti sono stati osservati che sia aderito alle pareti intorno il sistema circolatorio o viaggiando nella direzione del flusso sanguigno (Figura 2, Figura 3). Quando un parassita rimane attaccato alla struttura cardiaca, come la valvola atrioventricolare, oscilla con le contrazioni del cuore, che indica che i meccanismi molecolari per l'aderenza dei parassiti potrebbero essere efficaci nel nostro modello vertebrato (2 film, film 3 Film supplementare 1). T. cruzi anche aderito alle pareti del sacco vitellino larvale ( Figura 2, il film 2), una struttura che più tardi sarà riassorbita e diventare parte di zebrafish dell'intestino22. Questo potrebbe essere simile a quanto avviene durante la fase di malattia cronica negli esseri umani infetti, dove i parassiti sono trovati nei cardiomiociti e nel sistema nervoso digestivi23,24. Quando non collegato, i parassiti alla deriva attraverso il flusso di sangue nella stessa direzione come gli eritrociti ( Figura 3, Movie 4). I parassiti potrebbero essere osservati nel navi diverse dimensioni del pesce, ma erano più abbondanti nello spazio pericardico e della regione adiacente tuorlo contenente il flusso di sangue ( Figura 2, Figura 3, film supplementare 2).
A 10 min dopo l'iniezione, è stato più difficile da individuare singole forme del parassita a causa della loro distribuzione lungo il sistema vascolare e un'incapacità di siti a anatomiche differenti della rapidamente schermo del pesce a causa di un limitato campo di vista di LSFM (a 40 ingrandimenti ). Dopo 24 h dopo l'iniezione (hpi), il segnale CFSE inizia ad accumularsi nella regione vicino l'intestino in via di sviluppo (complementare figura 1).

Figura 1: Sito di iniezione ottimale. (A) immagine di larva 48 hpf mostrando il sito di iniezione ottimale al dotto di Cuvier (freccia gialla) utilizzando uno stereoscopio regolare. (B) Magnified Mostra di casella in un mostrando il dotto di Cuvier (freccia gialla). Barra della scala = 200 µm (A), 50 µm (B). Clicca qui per visualizzare una versione più grande di questa figura.
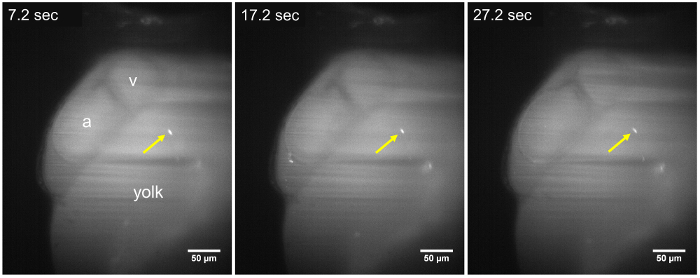
Figura 2: Immagini LSFM di un parassita statico in una larva di hpf 48. Il parassita di T. cruzi (freccia gialla) rimane aderito alle pareti del sacco vitellino, durante tutta la sequenza di time-lapse (7.2 s, 17,2 s e 27,2 s), circa ~ 15 min dopo l'iniezione del parassita. Nessun cambiamento nella posizione del parassita è osservato durante un periodo di acquisizione di almeno 30 s. a, atrio; v, ventricolo. Barra della scala = 50 µm. Clicca qui per visualizzare una versione più grande di questa figura.
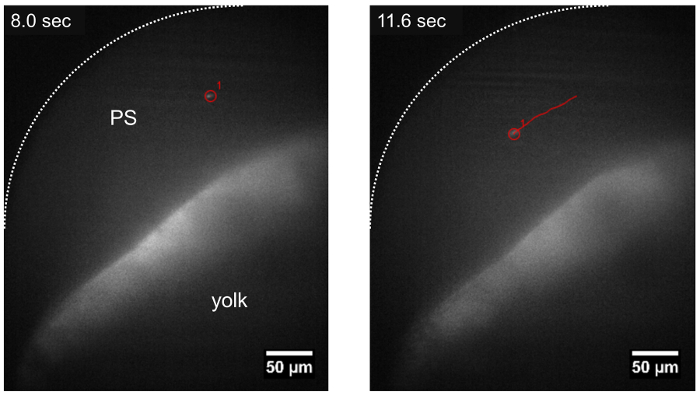
Figura 3: Traiettoria di un parassita che viaggiano nello spazio pericardico utilizzando LSFM. Il T. cruzi parassita può essere rintracciato mentre vanno alla deriva nello spazio pericardico (PS), seguendo la direzione del flusso sanguigno (traccia mostrato in rosso) circa ~ 15 min dopo l'iniezione del parassita. Barra della scala = 50 µm. Clicca qui per visualizzare una versione più grande di questa figura.
Movie 1: Valle di circolazione di sangue del tuorlo in una larva 48 hpf. Film di una larva 48 hpf mostrando la valle di circolazione sanguigna o condotto di Cuvier utilizzando uno stereoscopio regolare. Diverse regioni si concentrano durante il video per mostrare i globuli rossi circolanti in tutto il condotto. Freccia gialla indica il sito di iniezione ottimale. Il film è stato registrato circa 10-15 minuti dopo l'iniezione del parassita. Per favore clicca qui per scaricare il video.
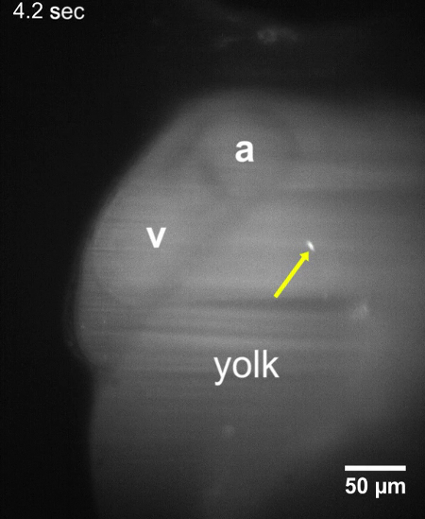
Film 2: T. cruzi parassiti attaccati alle pareti del sacco vitellino. Film LSFM di una proiezione di hpf larva 48 che T. cruzi parassiti rimangono rispettati il sacco vitellino circa 10-15 minuti dopo l'iniezione del parassita. Nessun cambiamento nella posizione del parassita è stato osservato durante un periodo di acquisizione di almeno 30 s. a, atrio; v, ventricolo. Per favore clicca qui per scaricare il video.

Film 3: T. cruzi parassiti fissato alle pareti del cuore. Il film di una larva 48 LSFM hpf mostrando che T. cruzi parassiti remain aderito alla parete cardiovascolare, nonostante le contrazioni del cuore forte circa 10-15 minuti dopo l'iniezione del parassita. Eritrociti possono essere osservati come ombre nere arrotondate. Per favore clicca qui per scaricare il video.

Movie 4: parassiti in movimento nello spazio pericardico. Film LSFM di un parassiti di T. cruzi larva 48 hpf visualizzando alla deriva nello spazio pericardico. Due parassiti possono essere rintracciati in diversi momenti (ID 1, nel cerchio rosso e ID 2 nel cerchio giallo), seguendo una traiettoria simile. Il film è stato registrato circa 10-15 minuti dopo l'iniezione del parassita. Per favore clicca qui per scaricare il video.
Supplementare figura 1: il segnale fluorescente accumulo di CFSE nel tuorlo. Immagini di stereoscopio di una larva di wildtype iniettato alle 48 hpf al dotto di Cuvier. Segnale fluorescente CFSE si accumula progressivamente nel tuorlo, dopo due giorni dopo l'iniezione (48 hpi). Barra della scala = 500 µm. per favore clicca qui per scaricare la figura.
Supplementare Movie 1: parassiti attaccato alle pareti e alle valvole del sistema circolatorio. Immagini di serie di tempo stereoscopio di una larva di tipo selvaggio iniettato alle 48 hpf. Immagini sono presi a 0,2 s intervalli, catturando i parassiti di T. cruzi muoversi in sincronia con le contrazioni del muscolo cardiaco presso la valvola atrioventricolare. Il film è stato registrato circa 30 min dopo l'iniezione del parassita. Per favore clicca qui per scaricare il video.
Supplementare Movie 2: movimento e aderiti parassiti nello spazio periventricular e tuorlo. Film LSFM di parassiti di T. cruzi una larva 48 hpf visualizzando alla deriva o aderito a spazio pericardico o tuorlo. Una vista di luce trasmessa è stata osservata per i primi 5 s. La vista di fluorescenza è stata osservata da 5.2-25.8 s. Il film è stato registrato circa 10-15 minuti dopo l'iniezione del parassita. Per favore clicca qui per scaricare il video.
Discussione
Questo studio evidenzia i vantaggi di zebrafish come modello animale per studiare comportamento patogeno in vivo. In particolare, questo studio propone un metodo per visualizzare l'agente patogeno T. cruzi nel suo ambiente naturale: circolazione ematica. L'ambiente del microambiente circolatorio nei pesci è paragonabile a quella dei mammiferi, e trypanosomatids si sono evoluti meccanismi per viaggiare, eludere il sistema immunitario e allegare alle cellule per l'infezione in quel ambiente25. Questo protocollo offre una descrizione di una procedura ottima per la cultura di T. cruzi in una linea cellulare umana e isolamento successivo di flagellare forme per l'etichettatura fluorescente. Viene quindi illustrato le impostazioni appropriate per iniezione successo dei parassiti in zebrafish trasparente per montaggio più tardi e la visualizzazione utilizzando LSFM. Infine, questo protocollo offre suggerimenti per efficienti ed efficaci in vivo imaging del parassita posizione e gli spostamenti in circolazione utilizzando LSFM.
Il flagello dei tripanosomi emerge dalla sua regione posteriore, che scorre dal corpo cellulare, e si blocca connessione alla parte anteriore del organismo26. T. cruzi si aziona agitando il flagello prima del corpo, che ondeggia tutto il corpo del parassita. Flagellari movimento non è solo indispensabile per la motilità del parassita, come nel caso del T. brucei27 (l'agente causativo di tripanosomiasi africana), ma serve anche per l'infezione cellulare, come è stato dimostrato in T. cruzi5 ,28. Anche se zebrafish non sono l'ospite naturale per T. cruzi, motilità del parassita possono essere studiate in un sistema di circolazione cardiovascolare sviluppo utilizzando i protocolli descritti qui. Inoltre, ci sono specie di trypanosomes che infettano i ciprinidi, la classe di zebrafish, ad esempio T. carassii e T. borreli25. Queste specie di parassita potrebbero essere usate per studiare in tempo reale i movimenti e meccanismi di aggancio di questi trypanosomatids; tali studi possono prestare spaccato il processo di infezione di cellule di mammifero.
In questo studio, iniettato motili T. cruzi parassiti sono stati osservati in viaggio attraverso la circolazione cardiovascolare di pesce inoculati, spostare insieme opachi eritrociti e aderendo alle strutture nelle pareti del sistema cardiovascolare. Abbiamo usato un LSFM casa costruita con un 10x acromatico lunga distanza di lavoro obiettivo di aria (17,6 mm) per il braccio di illuminazione con un'apertura numerica di 0,25. Un 40 X obiettivo a immersione in acqua apocromatico con un'apertura numerica di 0,8 e una distanza di 3,5 mm è stato utilizzato per il braccio di rilevamento. L'obiettivo della rilevazione è stato immerso nel pozzetto di misurazione, mentre l'obiettivo di illuminazione era fuori dall'aula. Una porta nella camera sigillata con un vetrino coprioggetto e ottica colla ammessi per il fascio di illuminazione ad entrare nella camera, come raffigurato in Lorenzo et al. 18 per l'illuminazione, abbiamo utilizzato un laser DPSS 50 mW a 488 nm cui potenza è stata modulata da un acusto ottico sintonizzabile filtro. Il percorso di rilevamento utilizzato filtri compatibili con la proteina fluorescente verde (GFP) o FITC. Un microscopio di foglio leggero dotato di una porta campione capillare (idealmente con rotazione automatica) e il controllo della temperatura della camera del campione dovrebbe essere adatto per questa applicazione. Il microscopio dovrebbe essere allineato e calibrato secondo le istruzioni del produttore o protocolli standard di laboratorio dell'utente prima dell'acquisizione, se necessario. In questo protocollo, abbiamo controllato il microscopio usando il software SPIM19.
È importante notare che nella circolazione di zebrafish, larve parassitarie allegato è efficace. Nella vena cardinale, parassiti è rimasto attaccati per fino a diversi minuti; nel cuore, essi tennero su valvole e pareti, oscillante con contrazioni cardiache. Ulteriori studi rimangono per delucidare se T. cruzi interagisce con gli eritrociti che scorrenti che deriva nella direzione del flusso sanguigno. Precedenti studi in vitro hanno dimostrato che la presenza di strutture solide (cioè, cellule del sangue), o una maggiore viscosità del liquido per imitare sangue in vitro, ha un effetto significativo sulla motilità e velocità del parassita 9.
Ci sono molte domande riguardanti il decorso dell'infezione di T. cruzi in esseri umani dopo la fuga di amastigoti cellule fagocitiche, il tipo di cellula infettata inizialmente29. Ad esempio, come arrivano ai loro organi bersaglio? Quali sono i meccanismi per tropismo per gli organi preferiti, quali cardiaco, digerente e sistema nervoso centrale? È interessante notare che, in questo studio i parassiti erano imaged inizialmente nel cuore perché era il luogo di più alta densità di parassiti. Tuttavia, il segnale CFSE successivamente accumulato nell'intestino in via di sviluppo di 7 giorni dopo l'iniezione. Anche se l'anatomia dei pesci e di mammiferi è diverso, i risultati di questo studio dimostrano una forma di tropismo, come è stato osservato che i parassiti hanno esibito il tropismo verso gli organi bersaglio privilegiato noto nonostante differenze organismal. Una significativa limitazione di questo studio riguarda la temperatura utilizzata negli esperimenti. Larve di zebrafish dovrebbero essere tenute circa 28 °C durante l'intera procedura. Se questa temperatura potrebbe essere simile all'host di vettore (insetti della sottofamiglia eziologico), è molto diverso da mammiferi a sangue caldo che compongono i padroni di casa finale (circa 37 ° C). T. cruzi è noto per avere forme viventi flagellari in entrambi gli host; Tuttavia, è importante tenere a mente che questo fattore potrebbe avere un effetto nel comportamento del animale in vivo.
Anche se il sistema immunitario adattativo di fish´s non è maturo fino a 4 settimane dopo la fecondazione, il sistema immunitario innato è attivo all'inizio del sviluppo10. Più presto 48 o 96 hpf, cellule fagocitiche sono state osservate dopo aver inghiottito etichettato trypanosomes (dati non mostrati). Questo limita l'intervallo di tempo per la visualizzazione del parassita. Tuttavia, se uno studio è stato quello di concentrarsi sulla valutazione della risposta immunitaria fish´s, iniezione nelle fasi successive può essere raccomandato. Inoltre, l'iniezione di parassiti in linee di pesci transgenici con macrofagi con etichettati o altre cellule del sistema immunitario possono essere utile nello studio allegato parassita e meccanismi di endocitosi possibili. È importante notare che se i parassiti sono etichettati con CFSE, le etichette delle cellule transgeniche non dovrebbero essere GFP e un marcatore alla fine giallo o rosso dello spettro è richiesto.
Per valutare la direzione dettagliata del movimento parassita, può essere utile seguire la loro traiettoria in 3 dimensioni (3D). Per la visualizzazione 3D e la ricostruzione del processo, è necessario un sistema ad alta velocità. Con l'apparecchiatura utilizzata nel presente protocollo, è solo possibile visualizzare i parassiti in un unico piano. In questo caso, abbiamo una priorità mantenere la stabilità del piano focale durante il movimento di parassita e registrando la sua traiettoria in un unico piano.
La metodologia qui proposta spiana la strada per indagare ulteriormente il comportamento del parassita in circolazione cardiovascolare. In sintesi, i passaggi essenziali ai parassiti vivi fluorescenti all'interno di larve di zebrafish di imaging sono:(i) utilizzare di embrioni covati in anticipo (24-48 hpf) o larve di animali tra 72-96 hpf senza pigmentazione in modo che essi sono trasparente e facile da iniettare; (ii) le larve immagine più presto possibile dopo l'iniezione per evitare la liquidazione parassita dalle cellule fagocitiche; e (iii) concentrano la LSFM sul sito di interesse (ad es., regione pericardica) e mantenere lo stato attivo. Questa procedura innovativa consente la visualizzazione dei tripomastigoti in un ambiente paragonabile alla sua nicchia di infezione naturale, fornendo per la prima volta la possibilità di studiare T. cruzi in un organismo vivente.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato dalla Convocatoria Interfacultades da Vicerrectoría de Investigaciones de la Universidad de los Andese il programma USAID ricerca e innovazione Fellowship. Ringraziamo Juan Rafael Buitrago e Yeferzon Ardila per assistenza e manutenzione di pesce.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Micropipette | Fisherbrand | 21-377-815 | |
| Agarose RA | Amresco | N605 | Regular |
| Agarose SFR | Amresco | J234 | Low Melting point |
| Aquarium salt | Instant ocean | SS15-10 | |
| Cell Count chamber | Boeco | Neubauer | |
| Cell culture flasks | Corning | 430639 | |
| Centrifuge | Sorvall | Legend RT | |
| CFSE | ThermoFisher | C34554 | |
| Detection objective | Nikon 40x 0.8NA | 40x CFI APO NIR | |
| DMEM medium | Sigma-Aldrich | D5648 | |
| Dumont #5 fine forceps | World precision Instruments | ||
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | A5040 | |
| Fetal calf serum (FCS) | Eurobio | CVFSVF00-01 | |
| Filter | Chroma | ET-525/50M | |
| Glass capillaries for embryo mounting | Vitrez Medical | 160215 | |
| Glass capillaries for pulling needles | World precision instruments | TW100-4 | |
| Glucose | Gibco | A2494001 | |
| HEPES | Gibco | 156300-80 | |
| Incubator | Thermo Corporation | Revco | |
| Larval microinjection mold | Adaptive Science Tools | I-34 | |
| Laser | Crystalaser | DL488-050 | |
| L-glutamine | Gibco | 250300-81 | |
| Methylene blue | Albor Químicos | 12223 | |
| Micromanipulator | Narishige | MN-153 | |
| Micromanipulator system | Sutter Instrument | MP-200 | For LSFM |
| Micropipette puller device | Narishige | PC-10 | |
| Microscope | Olympus | CX31 | |
| Microscope (inverted) | Olympus | CKX41 | |
| Multipurpose microscope | Nikon | AZ100M | |
| Neubauer counting chamber | Boeco Germany | ||
| Penicillin-streptomycin | Gibco | 15140-163 | |
| Petri dish 94x16 | Greiner bio-one | 633181 | |
| Plastic pasteur pipette | Fisherbrand | 11577722 | |
| Rotation stage | Newport | CONEX-PR50CC | |
| RPMI-1640 medium | Sigma-Aldrich | R4130 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| Stereoscope | Nikon | C-LEDS | |
| Tricaine (MS-222) | Sigma-Aldrich | 886-86-2 | |
| TRIS | Amresco | M151 | |
| Trypsin-EDTA (0.25%) | Gibco | R-001-100 | |
| Tubes 15 ml | Corning | 05-527-90 |
Riferimenti
- Bern, C. Chagas's Disease. New England Journal of Medicine. 373 (5), 456-466 (2015).
- Sosa Estani, S., Segura, E. L., Ruiz, A. M., Velazquez, E., Porcel, B. M., Yampotis, C. Efficacy of chemotherapy with benznidazole in children in the indeterminate phase of Chagas’ disease. The American Journal of Tropical Medicine and Hygiene. 59 (4), 526-529 (1998).
- Rosas, F., Roa, N., Cucunuba, Z. M., Cuellar, A., Gonzalez, J. M., Puerta, J. C. Chagasic Cardiomyopathy. Cardiomyopathies - From Basic Research to Clinical Management. , (2012).
- Finkelsztein, E. J., et al. Altering the motility of Trypanosoma cruzi with rabbit polyclonal anti-peptide antibodies reduces infection to susceptible mammalian cells. Experimental Parasitology. 150, 36-43 (2015).
- Martins, R. M., Covarrubias, C., Rojas, R. G., Silber, A. M., Yoshida, N. Use of L-Proline and ATP Production by Trypanosoma cruzi Metacyclic Forms as Requirements for Host Cell Invasion. Infection and Immunity. 77 (7), 3023-3032 (2009).
- Engstler, M., et al. Hydrodynamic Flow-Mediated Protein Sorting on the Cell Surface of Trypanosomes. Cell. 131 (3), 505-515 (2007).
- Uppaluri, S., et al. Impact of Microscopic Motility on the Swimming Behavior of Parasites: Straighter Trypanosomes are More Directional. PLoS Computational Biology. 7 (6), e1002058 (2011).
- Heddergott, N., et al. Trypanosome Motion Represents an Adaptation to the Crowded Environment of the Vertebrate Bloodstream. PLoS Pathogens. 8 (11), e1003023 (2012).
- Gratacap, R. L., Wheeler, R. T. Utilization of zebrafish for intravital study of eukaryotic pathogen–host interactions. Developmental & Comparative Immunology. 46 (1), 108-115 (2014).
- Meijer, A. H., Spaink, H. P. Host-Pathogen Interactions Made Transparent with the Zebrafish Model. Current Drug Targets. 12 (7), 1000-1017 (2011).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Huisken, J. Slicing embryos gently with laser light sheets. BioEssays. 34 (5), 406-411 (2012).
- Westerfield, M. . The zebrafish book: A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Vargas-Zambrano, J. C., Lasso, P., Cuellar, A., Puerta, C. J., González, J. M. A human astrocytoma cell line is highly susceptible to infection with Trypanosoma cruzi. Memórias do Instituto Oswaldo Cruz. 108 (2), 212-219 (2013).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. JoVE (Journal of Visualized Experiments). (25), e1115-e1115 (2009).
- Lorenzo, C., et al. Live cell division dynamics monitoring in 3D large spheroid tumor models using light sheet microscopy. Cell Division. 6, 22 (2011).
- Edelstein, A. D., Tsuchida, M. A., Amodaj, N., Pinkard, H., Vale, R. D., Stuurman, N. Advanced methods of microscope control using μManager software. Journal of Biological Methods. 1 (2), e10 (2014).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer Mounting for Long-term Light Sheet Microscopy of Zebrafish. Journal of Visualized Experiments. (84), (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Ng, A. N. Y., et al. Formation of the digestive system in zebrafish: III. Intestinal epithelium morphogenesis. Developmental Biology. 286 (1), 114-135 (2005).
- Higuchi, M. D. L., et al. Correlation between Trypanosoma cruzi parasitism and myocardial inflammatory infiltrate in human chronic chagasic myocarditis: Light microscopy and immunohistochemical findings. Cardiovascular Pathology: The Official Journal of the Society for Cardiovascular Pathology. 2 (2), 101-106 (1993).
- Vago, A. R., Silva, D. M., Adad, S. J., Correa-Oliveira, R., d'Avila Reis, D. Chronic Chagas disease: presence of parasite DNA in the oesophagus of patients without megaoesophagus. Transactions of the Royal Society of Tropical Medicine and Hygiene. 97 (3), 308-309 (2003).
- Wiegertjes, G. F., Forlenza, M., Joerink, M., Scharsack, J. P. Parasite infections revisited. Developmental & Comparative Immunology. 29 (9), 749-758 (2005).
- De Souza, W. Basic cell biology of Trypanosoma cruzi. Current Pharmaceutical Design. 8 (4), 269-285 (2002).
- Langousis, G., Hill, K. L. Motility and more: the flagellum of Trypanosoma brucei. Nature Reviews. Microbiology. 12 (7), 505-518 (2014).
- Johnson, C. A., et al. Cellular response to Trypanosoma cruzi infection induces secretion of defensin α-1, which damages the flagellum, neutralizes trypanosome motility, and inhibits infection. Infection and Immunity. 81 (11), 4139-4148 (2013).
- Magalhães, L. M. D., Viana, A., Chiari, E., Galvão, L. M. C., Gollob, K. J., Dutra, W. O. Differential Activation of Human Monocytes and Lymphocytes by Distinct Strains of Trypanosoma cruzi. PLoS neglected tropical diseases. 9 (7), e0003816 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon