Method Article
Bioprinting da cartilagem e Analogs de tecido de pele utilizando um romance passiva unidade técnica de mistura para Bioink Precellularization
Neste Artigo
Resumo
Análogos de cartilagem e pele foram bioprinted usando um bioink de nanocellulose-alginato com base. Os bioinks era compartimentados antes da impressão através de uma unidade de mistura passiva de passo único. As construções foram demonstradas para ser uniformemente compartimentado, têm alta viabilidade e exibem favoráveis marcadores de diferenciação.
Resumo
Bioprinting é uma técnica poderosa para a fabricação rápida e reprodutível de construções para aplicações de engenharia de tecidos. Neste estudo, análogos de cartilagem e a pele foram fabricados depois de pre-cellularization de bioink utilizando um romance passiva técnica unidade de mistura. Esta técnica foi desenvolvida com o objectivo de simplificar as etapas envolvidas na mistura de uma suspensão de células em uma bioink altamente viscoso. A resolução de filamentos depositados através de bioprinting exige a garantia de uniformidade na distribuição de célula antes da impressão para evitar a deposição de regiões sem células ou retenção de aglomerados de células grandes que pode entupir a agulha. Podemos demonstrar a capacidade de misturar-se rapidamente uma suspensão de células com um bioink antes da bioprinting de análogos de cartilagem e a pele. Ambos os análogos de tecido podem ser cultivados por até 4 semanas. A análise histológica demonstrou tanto a viabilidade celular e a deposição de marcas específicas da matriz extracelular (ECM) do tecido como glicosaminoglicanos (GAGs) e colágeno respectivamente.
Introdução
Nos últimos anos, a tecnologia tridimensional (3D) bioprinting tornou-se mais acessível aos pesquisadores, permitindo que a técnica para se tornar mais amplamente utilizado para a fabricação de análogos de tecido. Bioprinting promete revolucionar a investigação biomédica, facilitando a fabricação rápida e repetível de construções de tecido multifacetado. O cerne da tecnologia bioprinting estabelece-se na capacidade de controlar com precisão a deposição de biomateriais (conhecido como bioinks) em três dimensões. Isto permite a geração de andaimes complexos com regiões distintas de células que com mais precisão podem recapitular a estrutura do tecido nativo, fatores bioativos e composições de matriz.
Bioprinting tem sido utilizada para a fabricação de construções para muitas aplicações de tecido, incluindo cartilagem1, pele2, músculo3e osso4. Estes tecidos são atraentes para bioprinting devido à suas intrínsecas estriadas micro arquiteturas que são apropriados para recapitulação por deposição de camada por camada. Em particular, a pele possui uma estrutura bem definida de várias camadas5, que é apropriado para a fabricação através de técnicas de deposição de camada por camada, como bioprinting. Além disso, bioprinting pode ser utilizado para gerar construções que possuem as dimensões anatômicas necessárias e formas para reparar o tecido de defeitos. A capacidade de gerar biomateriais com paciente específico de tamanho e forma6 pode começar a tratar a demanda por reparos parciais de muitos tecidos, incluindo mas não limitado a defeitos ósseos, lesão da cartilagem e lesões de pele, cuja extensão varia de paciente para paciente.
Neste estudo, dois análogos de tecido (pele e cartilagem articular) foram fabricados através do bioprinting de bioinks pre-cellularized. Garantir a mistura adequada de um bioink com suspensão de células que pode garantir a distribuição uniforme da célula enquanto preservando a viabilidade celular pode ser um desafio. Bioinks adequados para bioprinting através da extrusão são muitas vezes altamente viscosos e, portanto, exigem a mistura extensa para garantir uma mistura homogênea. Danos mecânicos às células podem ocorrer sob condições severas de mistura e afetar negativamente a viabilidade. Estudos têm mostrado que a maioria das morte celular durante o processo de impressão jato de tinta ocorre durante a preparação como a mistura de7,8. Enquanto mistura tradicional com agitação9 pode ser suficiente para bioinks de baixa viscosidade adequada para impressão de jato de tinta10, mistura de células em um bioink de alta viscosidade mais adequada para bioprinting de extrusão é mais difícil. Abordar esta necessidade, a utilização de bocais de mistura tornou-se mais popular para a mistura de bioinks durante o processo da impressão11. Estes misturadores também têm sido amplamente utilizados na pesquisa de microfluídica onde a mistura de líquidos com baixo número de Reynolds é importante12. A utilização de um contínuo processo de mistura para misturar-se uma suspensão de células em um bioink permita a uniformidade durante o processo de impressão. No entanto, desde suspensões celulares possuem baixa viscosidade comparada com um bioink, as dificuldades surgirão em impedir a sedimentação das células durante a impressão processo9,13,14. Alternativamente, a mistura de células em um bioink antes da impressão pode resolver esse problema.
Para minimizar a morte celular durante a mistura para um bioink, desenvolvemos uma técnica baseada em uma unidade de mistura passiva se misturar as células em um bioink do número mínimo de passos. A mistura caótica gerada através do fluxo dos materiais através da unidade de mistura é suficiente para reproducibly mistura dois componentes juntos15,16. Este método foi desenvolvido principalmente para simplificar a mistura de qualquer suspensão de células com qualquer bioink que adequado para bioprinting de extrusão. O número de etapas no processo de mistura foi minimizado para eliminar o usuário a variação na mistura. Etapas de mistura excessivas podem ser demorado e não é aplicável a todos os bioinks, particularmente quando as células estão envolvidas. Secundário, visamos desenvolver um processo de mistura que era auto-suficiente para preservar a esterilidade e minimizar a perda de amostra.
Neste manuscrito, demonstramos que a mistura de uma suspensão de células com um bioink usando um passivo técnica de unidade que minimiza a manipulação e resulta em pilha alta viabilidade e uniforme distribuição de mistura. Estes bioinks pre-cellularized são então utilizados para bioprint uma cartilagem ou pele construir com um ou dois tipos de células, respectivamente que são cultivados por até 6 semanas. O bioink utilizado é uma mistura de alginato-nanocellulose, que anteriormente demonstrou aptidão para a bioprinting1.
Protocolo
Este protocolo segue as diretrizes do Comitê de ética de pesquisa humana da Universidade de Chalmers.
Nota: Todas as etapas devem ser executadas dentro de uma armário de biossegurança estéril.
1. preparação de materiais de consumo, Bioink e células
- Obter duas seringas, uma seringa (Figura 1um) é a suspensão de células, enquanto a outra seringa é para o bioink (Figura 1b).
- Obter uma estéril passiva unidade de mistura (Figura 1c) que pode ser acoplada com seringas duas através de uma conexão de fechamento de Luer.
- Obter uma unidade de distribuição (Figura 1d) que pode expulsar um volume de duas seringas esterilizadas simultaneamente a uma velocidade controlada.
Nota: A relação de mistura utilizada neste estudo é de 10:1. Portanto, use uma seringa de 12 mL e uma seringa de 1 mL, conforme exigido pela unidade de mistura 1:10. - Obter um cartucho estéril (Figura 1e) e um conector de fechamento de Luer fêmea-fêmea estéril para misturado diretamente a suspensão bioink e célula em.
- Obter ou preparar o bioink para misturar-se com uma suspensão de células.
Nota: No presente protocolo, foi utilizado um bioink de nanocellulose/alginato com base. Este bioink é reticulado através da adição de uma solução estéril 100 mM CaCl2 post de impressão. - Separar as células usando uma solução de tripsina/EDTA 0,5% e conte o número total de células usando o de método de exclusão azul trypan17.
Nota: No presente protocolo, fibroblastos humanos foram utilizados. - Determine a densidade de pilha que é desejada na construção final impressa. Calcule usando as seguintes equações a concentração das células colhidas que devem ser diluídos para alcançar esta densidade de final de célula de destino.
Nota: No presente protocolo, foi utilizada uma densidade de célula final de 5 x 106 células/mL.- Selecione uma concentração de célula desejado para os experimentos: Ccélula (células/mL).
- Calcule a quantidade de bioink necessário, Vbioink, com base no número total de construções desejado:
Vbioink = × Vconstruir NContructs
Nota: por exemplo, o volume de bioink por construção é 100 µ l. Se 30 construções são impressos, então, o volume de bioink necessário é 3 mL. - Calcule o número de células necessárias:
Ncélulas = Ccélula (1,1 × Vbiolink) - Ressuspender as células (Ncélulas) em 1/10th o volume da bioink:
Vsuspensão de células = 0,1 × Vbiolink
Nota: por exemplo, se Vbioink = 3 mL, então Vsuspensão de células = 0,1 × 3 mL = 0,3 mL
2. mistura de suspensão de células e Bioink
- Transferi a suspensão de células para a seringa de suspensão celular.
- Transferir o bioink para outra seringa ou obter uma seringa contendo o bioink.
- Puxe o êmbolo da seringa bioink e inserir a seringa na unidade de distribuição. Posicione a unidade verticalmente com o bloqueio conector Luer para cima (Figura 1f1).
- Puxe o êmbolo da seringa célula para um comprimento semelhante como a seringa de bioink e inserir a unidade de distribuição (Figura 1f2).
- Fixe as duas seringas para a unidade de mistura rodando os conectores Luer lock (Figura 1f3).
- Prime o sistema de mistura empurrando na unidade aplicadora para expulsar o ar na seringa. Pare a escorva antes a solução atingindo o conector Luer-lock (Figura 1g4).
- Após a preparação, anexe o cartucho de enchimento até o fim da unidade misturadora através do conector Luer de bloqueio (Figura 1g5). Certifique-se de que o êmbolo no cartucho de enchimento é no fundo antes da penhora.
- Lentamente, comprima (Figura 1h6) unidade aplicadora para misturar a suspensão bioink e celular juntos dentro do cartucho (Figura 1i7).
- Empurre o êmbolo no enchimento cartucho para baixo com uma ponta de pipeta estéril para entrar em contato com a mistura de bioink-célula após a mistura. Manter a distribuição até comprimido para garantir que a mistura de célula/bioink não é expulsada volta para a unidade de mistura.
- Tampa do cartucho e bata levemente sobre a superfície de trabalho para mover quaisquer bolhas de ar para o topo do cartucho (final do pistão).
Nota: Neste ponto, a mistura de célula/bioink está pronta para impressão. As seções a seguir irão delinear procedimentos impressão e aplicações específicas.
3. a determinação da viabilidade celular usando uma unidade de mistura em comparação com espátula Manual de mistura
- Desanexar fibroblastos humanos (trecho 7) com uma solução de tripsina/EDTA 0,5% na confluência de 80%, contar o número e Resuspenda em meio de cultura em densidade de células suficientes para obter uma concentração final após a mistura com o bioink (01:10 célula: bioink ratio) de 5 x 10 6 células/mL.
- Mistura de células para o bioink usando qualquer o passivo que mistura técnica unidade (etapa 2) ou através de espátula para avaliar o efeito de ambas as técnicas na viabilidade celular.
- Misture as células no bioink usando o passivo mistura técnica de unidade 1, 2, ou 3 vezes antes da dispensação em um molde para cross-linking usando 100 mM CaCl2.
Nota: Para executar misturas adicionais, misture a célula/bioink diretamente em uma seringa, ao invés de um cartucho. Então remix da mistura através da unidade de mistura seguindo o protocolo anterior, mas sem o componente de seringa de célula. - Misture as células em um bioink separado usando mecânica manual de mistura através de uma espátula para durações de 30, 60 ou 90 s. transferência as misturas (para cada tempo de mistura) em um molde para cross-linking usando 100 mM CaCl2.
- Transferi as amostras para um prato bem após a conclusão do cross-linking e cultura sob condições normais.
- Depois de 1 dia de cultura, lave as construções (n = 3-4 por grupo) no meio de cultura celular isento de soro de 30 min. manchar as células as construções com uma solução de coloração (4 µM calceína AM, 1 µM Ethidium homodímero-1) por 30 min.
- Lave duas vezes adicionais e incubar as amostras em meio de cultura celular isento de soro para um total de 1 h a 37 ° C.
4. Bioprinting de análogos de cartilagem com um único tipo de células
- Desenhe um modelo 3D do tecido desejado analógico. Converter um arquivo Gcode para bioprinting e carregar o arquivo Gcode no bioprinter1.
Nota: No presente protocolo, uma estrutura quadrada com dimensões 4.8 x 4.8 x 0,9 mm3 foi exportada como um arquivo STL. Um arquivo Gcode foi gerado da estrutura reticular usando as seguintes configurações: espessura de camada, 0,3 mm; padrão de preenchimento, retilíneo; densidade de enchimento, 25%; velocidade, 10 mm/s. - Isolar e cryopreserve primários condrócitos humanos nasais (hNC) de pacientes seguindo o protocolo referenciado1.
- Descongelar e expanda hNCs criopreservado e, uma vez na cultura monocamada usando meio de cultura padrão 37 ° C. Separar células na confluência de 80-90% com uma solução de tripsina/EDTA 0,5% e contar usando um protocolo de exclusão de azul de Tripan. Todos os experimentos foram conduzidos usando hNCs no passage 2.
- Ressuspender o hNCs em 100 x 106 células/mL dentro de 300 µ l de meio de cultura suplementado com 10% de soro fetal bovino, penicilina-estreptomicina de 1% e 50 µ g/mL o ácido ascórbico, em preparação para a mistura com o bioink.
- Mistura a hNC suspensão de células em um nanocellulose/alginato com base bioink seguinte protocolo de unidade em uma proporção de suspensão de 10:1 bioink:cell para obter uma concentração final de célula de 9 x 106 células/mL de mistura o passivo.
- Certifique-se de que o bioprinter é esterilizado através de exposição aos raios UV e limpeza para baixo com etanol a 70%. Manter a esterilidade, colocando em um fluxo laminar do armário.
- Anexar os bocais de impressão estéril para os cartuchos contendo as misturas de suspensão bioink/célula e insira o bioprinter.
- Calibre o bioprinter manualmente ou pelos protocolos específicos para a impressora.
- Bioprint o retículo-estruturado, construções de célula-carregado usando os seguintes parâmetros de impressão: bocal cónico de 25G a uma pressão de 25 kPa. Bioprint célula livre de construções (misturadas com meio celular contendo sem células) como um controle.
- Cross-link as construções, adicionando uma solução iônica de 100 mM CaCl2 5 min. enxaguar as construções e incubar em meio de cultura sob condições padrão de cultura (37 ° C, 5% de CO2e 95% de humidade relativa). Mude a mídia cada segundo ou terceiro dia.
- Colete amostras para análise histológica em semanas 2 e 4. Manche as amostras para a produção de mordaça usando uma mancha azul de Alcian18.
5. Bioprinting de análogos de pele com dois tipos de células
- Desenhar um modelo 3D do tecido desejado analógico e converter para um arquivo Gcode para bioprinting. Carrega o arquivo Gcode sobre o bioprinter.
Nota: No presente protocolo, uma estrutura quadrada com dimensões 4.8 x 4.8 x 0,9 mm3 foi exportada como um arquivo STL. Em seguida, um arquivo Gcode foi gerado da estrutura reticular usando as seguintes configurações: espessura de camada, 0,3 mm; padrão de preenchimento, retilíneo; densidade de enchimento, 25%; velocidade, 10 mm/s. - Prepare as células para mistura com à bioink para bioprinting. Para a preparação de análogos de pele, foram utilizados dois tipos de células. Os tipos de dois célula foram misturou o bioink e bioprinting.
- Obter o HDF primário. Manter estas células em meios de crescimento DMEM suplementados com 10% de soro fetal bovino, penicilina-estreptomicina de 1% e 50 µ g/mL de ácido ascórbico. Separe células na confluência de 80-90% com uma solução de tripsina/EDTA 0,5% e a contagem.
- Isolar e cryopreserve hNC primário de pacientes seguindo o protocolo referenciado1. Descongelar e expandir hNCs criopreservado em cultura monocamada. Separe células na confluência de 80-90% com uma solução de tripsina/EDTA 0,5% e a contagem.
- Resuspenda os dois tipos de célula em 100 x 106 células/mL dentro de meios de crescimento. Misture as suspensões celulares juntos na proporção de 1:1 para obter uma concentração final de total de 100 x 106 células/mL em 300 µ l de mídia.
- Mistura a suspensão de células de 50: 50 de HDF e hNC em um nanocellulose/alginato com base bioink seguinte protocolo de unidade em uma proporção de suspensão de 10:1 bioink:cell para obter uma concentração final de célula de 9 x 106 células/mL de mistura o passivo.
- Certifique-se que o bioprinter é esterilizado ou é colocado em um fluxo laminar do armário para manter a esterilidade.
- Anexar os bocais de impressão estéril para os cartuchos contendo as misturas de suspensão bioink/célula e insira o bioprinter.
- Calibrar o bioprinter também manualmente ou os protocolos específicos para a impressora.
- Bioprint o retículo-estruturado, construções de célula-carregado usando os seguintes parâmetros de impressão: bocal cónico de 25G a uma pressão de 25 kPa. Bioprint célula livre de construções (misturadas com meio celular contendo sem células) como um controle.
- Cross-link as construções, adicionando uma solução iônica de 100 mM CaCl2 5 min. enxaguar as construções e incubar em meio de cultura sob condições padrão de cultura (37 ° C, 5% de CO2e 95% de humidade relativa). Mude a mídia cada segundo ou terceiro dia.
- Colete amostras para análise histológica em semanas 2 e 4. Manchar as amostras de colágeno produção usando de tricromo de Masson, um19.
Resultados
Resultados neste manuscrito são divididos em duas seções. Primeiro, a viabilidade celular foi analisada após mistura com o método mecânico ou a unidade de mistura passiva. Em seguida, as construções de cartilagem e pele foram cultivadas e analisadas por marcadores histológicos relevantes.
Distribuição de célula apareceu homogênea em ambos os casos. No entanto, a ação de mistura à mão usando uma espátula (Figura 2b) tem mais variação do que a mistura com uma unidade de mistura passiva (Figura 2a). A medida, velocidade e técnica de mistura com uma espátula é altamente dependente do usuário. No entanto, misturando as células em um bioink com uma unidade de mistura passiva padroniza a mistura e minimiza a variação entre lotes. Além disso, a 30, 60 e 90 s mistura tempo maio não ser suficiente para a mistura de uma grande quantidade de células em uma grande quantidade de bioink. Mistura mais rigorosa através de mistura com uma espátula pode ser necessário. Em comparação, utilizando uma unidade de mistura passiva melhor mantém a relação de mistura das células de bioink durante a mistura e garante que uma mistura homogênea é executada. Além disso, a perda de amostra é uma preocupação com as técnicas tradicionais de mistura onde bioink pode ser deixado para trás na placas de Petri, tubos e ferramentas de mistura, devido a sua alta viscosidade. A viabilidade celular foi elevada para a mistura com uma unidade de mistura (> 90%) 1, 2 ou 3 vezes. Quando a unidade de mistura passiva foi utilizada, misturando levou cerca de 1 min a um ritmo lento de misturando constante. Enquanto a mistura com uma espátula exibiu alta viabilidade após a mistura para 30 e 60 s, maior que 90 s de mistura resultou em uma diminuição significativa em comparação com os outros grupos de viabilidade (77,9 ± 14%, p < 0,05) (Figura 2c). Isto pode ser devido a excesso de mistura que causa danos às células. A longo prazo ao vivo/morto coloração após 14 dias e 28 dias de cultura é mostrado na Figura complementar 1. Células começam a espalhar-se pelo dia 14 e são altamente espalhadas por dia 28 e indicam boa viabilidade.
Após cultura, análogos de tecido de cartilagem e a pele foram analisados através de histologia. Análise das construções de cartilagem nos dias 0, 14 e 28 mostra um aumento na quantidade e cobertura de GAGs como demonstrado através de uma mancha azul de Alcian (Figura 3a-3_c). A ausência da mancha é notada no dia 0, enquanto no dia 14 de coloração é limitado aos locais proximais para as células. No entanto, no dia 28 de cultura, o azul de Alcian encontra-se em toda a construção, demonstrando a formação de um chondrocytic ECM. Bioprinted construções de pele foram analisadas através de coloração histológica de colágeno que utilizando tricromo de Masson, um (Figura 3d-3f). Semelhante para as construções de cartilagem, amostras dia 0 exibiram sem deposição de colágeno. No dia 14 de cultura, depósitos substanciais de colágeno foram anotados ao redor das células e ao longo da superfície da construção. Isto foi reforçado por dia 28, como camadas de colagénio denso foram encontradas na superfície de construção e dentro da massa.

Figura 1 : Passivo sistema de unidade de mistura. (uma) seringa de 1 mL de suspensão de células, seringa de 12 mL (b) com bioink (c) unidade aplicadora, unidade de mistura passiva (d), (e) encher o cartucho, (f) montagem da seringa bioink (1) e célula seringa de suspensão (2) na unidade de distribuição, fixação da unidade de mistura passiva à extremidade de seringas (3), (g) fixação do conector fêmea-fêmea Luer lock (4) e fixação do enchimento cartucho (5) completa o conjunto, (h ) comprimir a unidade aplicadora para prime da mistura (6), (eu) continuam a empurrar para baixo na unidade aplicadora para misturar a suspensão de células com o bioink e dispensar dentro do cartucho de enchimento (7). Clique aqui para ver uma versão maior desta figura.
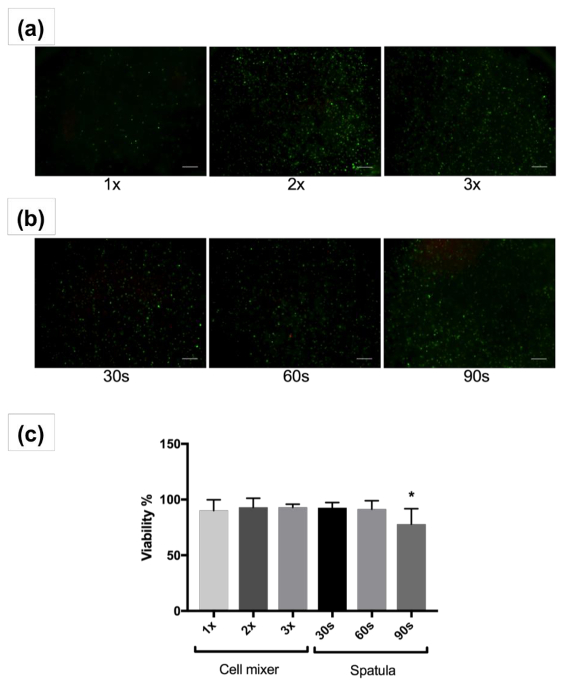
Figura 2 : Imagens de viabilidade e análise celular. Imagens representativas, mostrando ao vivo (verde) e fibroblastos humanos mortos (vermelho), após a mistura com o passivo que mistura vezes unidade 1, 2 ou 3 (um) ou espátula para 30, 60 ou 90 segundos (b) e cultura 3D para 1 dia. São mostradas imagens com ampliação de 4x. Escala barras indicam 200 µm. (c) porcentagem média viabilidade dos fibroblastos humanos após a mistura com o passivo que mistura unidade ou espátula e cultura 3D para o dia 1. Barras de erro mostram o desvio-padrão da média, * 0.005. Clique aqui para ver uma versão maior desta figura.
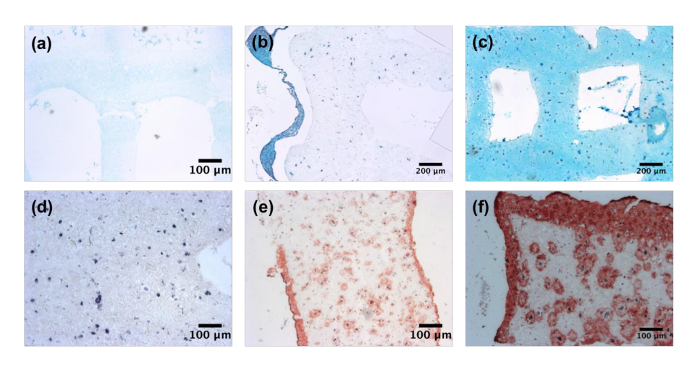
Figura 3: deposição de matriz extracelular específica do tecido. Construções de cartilagem Bioprinted manchado de glicosaminoglicanos utilizando Alcian azul em (um) dia 0, (b) 14 e (c) 28. Imagens capturadas na ampliação de X 5. Bioprinted construções de pele manchadas por colágeno I usando Trichrome de Masson (d) dia 0, (e) 14 e (f) 28. Imagens capturadas na ampliação de X 5. Clique aqui para ver uma versão maior desta figura.
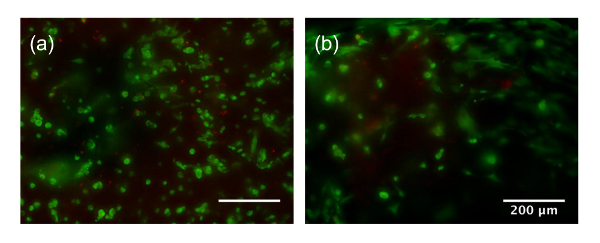
Complementar a Figura 1: viabilidade celular no dia 14 (uma) e dia 28 (b). Barra de escala é 200 µm, verde refere-se a células vivas, vermelho refere-se a células mortas. Clique aqui para ver uma versão maior desta figura.
Discussão
Conforme demonstrado neste manuscrito, bioinks pre-cellularized foram bioprinted para fabricar ou cartilagem ou análogos que foram cultivados por até 4 semanas para a pele. Viabilidade celular após a mistura usando o passivo técnica unidade de mistura foi maior do que os tradicionais métodos de misturando. Além disso, a simplificação do processo de mistura, com a unidade de mistura minimiza o número de etapas de manipulação e permite melhor coerência na extensão da mistura. Em última análise, isso resulta em melhor reprodutibilidade em ambos distribuição de célula dentro da bioink e entre construções e grupos experimentais. Deposição de componentes específicos de ECM tecido como GAGs e colágeno foi observada para a cartilagem e a pele análogos, respectivamente, após 4 semanas da cultura. Isso indica que a flexibilidade de ambos a técnica de mistura e a geometria de construção escolhido para fabricar alvos de diferentes tecidos. Fabricação de análogos de cartilagem e a pele exposta a flexibilidade de ambos o uso de um bioink de nanocellulose-alginato e a técnica de bioprinting para alvos distintos engenharia de tecido. Vamos discutir dois componentes do estudo abaixo: (1) o passivo que mistura a unidade técnica e (2) o comportamento de células dentro de análogos de cartilagem e pele.
O desenvolvimento e a otimização de uma técnica para a mistura de uma suspensão de células em um bioink foi fundamental para a fabricação dessas construções. Ao contrário de materiais de hidrogel tradicional de baixa viscosidade, alta viscosidade da bioinks resultou em dificuldade em pre-cellularization de um bioink antes da impressão. Como uma alternativa ao método tradicional de incorporação de célula em uma bioink, um protocolo para a mistura de uma etapa de uma suspensão de células em um bioink viscoso foi desenvolvido e discutido. Além disso, avaliou-se a aplicação prática desta técnica de mistura na fabricação de construções de tecido. Esta abordagem mistura um passo tem várias vantagens sobre o tradicional mistura técnicas incluídas controlada relação de mistura, minimização de tensões de cisalhamento de altos e irregulares, e um sistema fechado para eliminar amostra fechar em vasos de mistura. No entanto, existem várias etapas críticas nesta técnica para assegurar suas vantagens sobre os métodos tradicionais para a mistura de célula/bioink. É fundamental para garantir que as células a seringa de célula são suspensos e bem misturadas antes da mistura. Demasiado grande de um intervalo de tempo entre o levantamento e a transferência das células na seringa e iniciando o processo de mistura pode causar as células de sedimentos, que resultará em uma mistura desigual e distribuição em um filamento impresso. Se sedimentação observado, simples inversão (2 - 3 vezes) de Assembleia de unidade mistura passiva, imediatamente antes da mistura é suficiente para Ressuspender as células e assegurar uma distribuição uniforme antes da mistura. Também é fundamental que as bolhas de ar nas seringas são eliminadas ou minimizados prévio para garantir que a relação de mistura permanece constante. Se as bolhas de ar grandes permanecem no cartucho bioink antes da mistura, é recomendável que a solução ser executado através da unidade de mistura, um tempo adicional para assegurar uma mistura completa. Se as bolhas de ar permanecem, batendo suave da seringa/cartucho de impressão pode deslocar as bolhas de ar residual. Além disso, se mistura (várias unidades de mistura ou materiais) do material múltiplo é necessário para construções mais complexas, as concentrações das suspensões bioinks/célula para ser misturado devem ser ajustadas para garantir que após diluição através de mistura, o próprio concentração final ainda é alcançada.
Em comparação com outras técnicas de mistura, a unidade de mistura passiva é uma nova abordagem para o cellularize bioinks. Ao contrário de outras técnicas de mixagem, como seringa dupla mistura, ou mexendo com uma espátula ou outra ferramenta, a unidade de mistura passiva permite mais consistência na mistura através de lotes e os usuários. A natureza das técnicas de mistura manuais, tais como uma espátula a mistura, resulta em maior variação de usuário para o usuário na extensão de e taxa de mistura. Além disso, sistemas fechados, tais como a unidade e seringa dupla mistura mistura passiva não têm pouca ou nenhuma perda de amostra em relação ao manual de mistura dentro de um tubo de ensaio ou tubo.
Ambos os análogos de tecido fabricados neste manuscrito consistiam de um único tipo de bioink e um ou dois tipos de células. No entanto, o bioprinting de análogos de tecido que consistem em arquiteturas que contêm regiões de distintas bioinks com tipos distintos de células pode ser necessário para a fabricação de mais tecido fisiológico construções20,21, 22. Mais especializados bioinks com composições originais ou funcionalidades podem ser geradas através da mistura de vários tipos de bioinks existentes para criar bioinks multimaterial que têm distintas composições ou funcionalidades23, 24. Isto pode ser particularmente importante em regiões de transição tecidos como a pele a camada subcutânea ou a cartilagem ao osso da região um tecido onde um gradiente de composição de bioink25,26 pode ser necessário para assegurar o desenvolvimento de Estas regiões críticas encontradas em tecidos nativos27. Além disso, uma unidade de mistura poderia ser utilizada para misturar-se em fatores de crescimento e morphogens para o bioinks antes da bioprinting. A eliminação da perda de amostra com o sistema fechado de mistura é atraente para o uso de fatores bioativos caro e baixa concentração, onde a perda de amostra pode resultar em uma mudança a sua concentração final no prazo de construção de bioprinted, particularmente quando gradientes são envolvidos.
Uma limitação com qualquer técnica de mistura, incluindo o passivo mistura unidade utilizada neste estudo, é o risco de danos aos tipos de células sensíveis mecanicamente. Isolado por exemplo, pilhas de haste da medula óssea ou embrião ou células-tronco pluripotentes induzidas são mais suscetíveis a danos mecânicos28,29. O ato de misturar transmite tensões mecânicas anormais nas células, devido à força de cisalhamento envolvida no processo de mistura, e eles devem ser equilibrados para preservar a viabilidade de30. Enquanto o uso de primários fibroblastos e condrócitos neste estudo resultou em boa viabilidade (Figura 2), mais estudos são necessários para determinar taxas de mistura seguras e rácios para tipos de células mais sensíveis. Até então, recomenda-se que a mistura seja realizada sob um ritmo constante e lento para maximizar a viabilidade. Além disso, a densidade celular escolhida neste estudo foi determinada com base em anteriores estudos1. Esta densidade da célula pode não ser ideal para todos os tipos de célula.Em particular, as células em uma concentração mais elevada de mistura pode resultar em contatos aumento celular que podem melhorar a viabilidade celular e formação de tecido31,32. Em uma veia similar, a unidade de mistura passiva pode ser aplicável à mistura esferoides de célula ou outra célula agregados33 com a bioinks.
Como o proposto e demonstrado neste estudo, um passivo sistema de unidade de mistura rápida pode misturar uma suspensão de células em um bioink viscoso. Enquanto o risco de danos mecânicos às células ainda permanece, a abordagem permite mais consistência na mistura em um único estudo e entre os usuários. Pre-Cellularized bioinks utilizando esta abordagem foram usados para fabricar as duas cartilagens e análogos que foram cultivadas por até 4 semanas e demonstraram a deposição de marcadores específicos de ECM tecido de pele. Futuros estudos incidirá sobre a utilização da unidade sistema para misturar especializada bioinks de bioinks padronizada para a fabricação de análogos de tecido mais complexos de mistura o passivo.
Divulgações
Os autores deste manuscrito são empregados da CELLINK LLC.
Agradecimentos
Os autores têm sem agradecimentos.
Materiais
| Name | Company | Catalog Number | Comments |
| STARTINK Kit | CELLINK | SK0001 | Kit that contained all the elements for the CELLMIXER procedure |
| Live/Dead Kit | Life Technologies | L3224 | Kit for the analysis of cell viability after mixing |
| Masson's Trichrome | Sigma Aldrich | HT15-1KT | Kit for the analysis of collagen I deposition in the skin constructs |
| Alcian Blue | Sigma Aldrich | B8438-250ML | Kit for the analysis of glycosaminoglycan deposition in the skin constructs |
| INKREDIBLE+ bioprinter | CELLINK | Gen1+ | Printer utilized in the study |
| DMEM with Glutamax | Thermofisher | 10566016 | Media for culture of the cells |
| 10% fetal bovine serum | Thermofisher | A3160402 | Media supplement |
| Penicillin-Streptomycin | Life Technologies | 15070063 | Media supplement |
| live cell imaging solution | thermofisher | A14291DJ | component utilized using live/dead imaging |
| inverted microscope | Olympus | IX73 | microscope utilized |
| a digital color camera | Olympus | XC10 | microscope camera utilized |
| cellSens imaging software | Olympus | n/a | stock software with the microscope |
| ImageJ | NIH | n/a | open source image analysis software |
| GraphPad Prism 7 | GraphPad | n/a | software for statistical analysis |
| Slic3r software (v1.2.9) | Slic3r | n/a | open-source software to convert .stl file to gcode |
| primary adult human dermal fibroblasts | ATCC | PCS-201-012 | cell source for fibroblasts |
Referências
- Avila, H. M., Schwarz, S., Rotter, N., Gatenholm, P. 3D bioprinting of human chondrocyte-laden nanocellulose hydrogels for patient-specific auricular cartilage regeneration. Bioprinting. 1, 22-35 (2016).
- Lee, V., et al. Design and fabrication of human skin by three-dimensional bioprinting. Tissue Eng Part C Methods. 20 (6), 473-484 (2013).
- Costantini, M., et al. Microfluidic-enhanced 3D bioprinting of aligned myoblast-laden hydrogels leads to functionally organized myofibers in vitro and in vivo. Biomaterials. 131, 98-110 (2017).
- Fedorovich, N. E., et al. Biofabrication of Osteochondral Tissue Equivalents by Printing Topologically Defined, Cell-Laden Hydrogel Scaffolds. Tissue Eng Part C Methods. 18 (1), 33-44 (2011).
- Vijayavenkataraman, S., Lu, W. F., Fuh, J. Y. H. 3D bioprinting of skin: a state-of-the-art review on modelling, materials, and processes. Biofabrication. 8 (3), 032001 (2016).
- Peltola, S. M., Melchels, F. P. W., Grijpma, D. W., Kellomäki, M. A review of rapid prototyping techniques for tissue engineering purposes. Ann Med. 40 (4), 268-280 (2008).
- Xu, T., Jin, J., Gregory, C., Hickman, J. J., Boland, T. Inkjet printing of viable mammalian cells. Biomaterials. 26 (1), 93-99 (2005).
- Cui, X., Dean, D., Ruggeri, Z. M., Boland, T. Cell damage evaluation of thermal inkjet printed Chinese hamster ovary cells. Biotechnol Bioeng. 106 (6), 963-969 (2010).
- Parsa, S., Gupta, M., Loizeau, F., Cheung, K. C. Effects of surfactant and gentle agitation on inkjet dispensing of living cells. Biofabrication. 2 (2), 025003 (2010).
- Derby, B. Inkjet printing of functional and structural materials: fluid property requirements, feature stability, and resolution. Annu Rev Mater Res. 40, 395-414 (2010).
- Colosi, C., et al. Microfluidic Bioprinting of Heterogeneous 3D Tissue Constructs Using Low-Viscosity Bioink. Adv Mater. 28 (4), 677-684 (2016).
- Ober, T. J., Foresti, D., Lewis, J. A. Active mixing of complex fluids at the microscale. Proc Natl Acad Sci. 112 (40), 12293-12298 (2015).
- Shabnam, P., Madhuja, G., Frédéric, L., Karen, C. C. Effects of surfactant and gentle agitation on inkjet dispensing of living cells. Biofabrication. 2 (2), 025003 (2010).
- Chahal, D., Ahmadi, A., Cheung, K. C. Improving piezoelectric cell printing accuracy and reliability through neutral buoyancy of suspensions. Biotechnol Bioeng. 109 (11), 2932-2940 (2012).
- Niu, X., Lee, Y. -. K. Efficient spatial-temporal chaotic mixing in microchannels. J Micromech Microeng. 13 (3), 454 (2003).
- Liu, R. H., et al. Passive mixing in a three-dimensional serpentine microchannel. J Microelectromech Syst. 9 (2), 190-197 (2000).
- Strober, W. Trypan blue exclusion test of cell viability. Curr protoc immunol. , (2001).
- Scott, J., Dorling, J. Differential staining of acid glycosaminoglycans (mucopolysaccharides) by alcian blue in salt solutions. Histochem Cell Biol. 5 (3), 221-233 (1965).
- Garvey, W. Modified elastic tissue-Masson trichrome stain. Stain technol. 59 (4), 213-216 (1984).
- Xu, T., Zhao, W., Zhu, J. -. M., Albanna, M. Z., Yoo, J. J., Atala, A. Complex heterogeneous tissue constructs containing multiple cell types prepared by inkjet printing technology. Biomaterials. 34 (1), 130-139 (2013).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Adv Mater. 26 (19), 3124-3130 (2014).
- Kolesky, D. B., Homan, K. A., Skylar-Scott, M. A., Lewis, J. A. Three-dimensional bioprinting of thick vascularized tissues. Proc Natl Acad Sci. 113 (12), 3179-3184 (2016).
- Rutz, A. L., Hyland, K. E., Jakus, A. E., Burghardt, W. R., Shah, R. N. A multimaterial bioink method for 3D printing tunable, cell-compatible hydrogels. Adv Mater. 27 (9), 1607-1614 (2015).
- KÖpf, M., Campos, D. F. D., Blaeser, A., Sen, K. S., Fischer, H. A tailored three-dimensionally printable agarose-collagen blend allows encapsulation, spreading, and attachment of human umbilical artery smooth muscle cells. Biofabrication. 8 (2), 025011 (2016).
- Gurkan, U. A., et al. Engineering anisotropic biomimetic fibrocartilage microenvironment by bioprinting mesenchymal stem cells in nanoliter gel droplets. Mol Pharm. 11 (7), 2151-2159 (2014).
- Ma, Y., Ji, Y., Huang, G., Ling, K., Zhang, X., Xu, F. Bioprinting 3D cell-laden hydrogel microarray for screening human periodontal ligament stem cell response to extracellular matrix. Biofabrication. 7 (4), 044105 (2015).
- Lu, H. H., Thomopoulos, S. Functional attachment of soft tissues to bone: development, healing, and tissue engineering. Annu Rev Biomed Eng. 15, 201-226 (2013).
- Aguado, B. A., Mulyasasmita, W., Su, J., Lampe, K. J., Heilshorn, S. C. Improving viability of stem cells during syringe needle flow through the design of hydrogel cell carriers. Tissue Eng Part A. 18 (7-8), 806-815 (2011).
- Parisi-Amon, A., Mulyasasmita, W., Chung, C., Heilshorn, S. C. Protein-Engineered Injectable Hydrogel to Improve Retention of Transplanted Adipose-Derived Stem Cells. Adv Healthc Mater. 2 (3), 428-432 (2013).
- Qiu, X., De Jesus, J., Pennell, M., Troiani, M., Haun, J. B. Microfluidic device for mechanical dissociation of cancer cell aggregates into single cells. Lab Chip. 15 (1), 339-350 (2015).
- Cukierman, E., Pankov, R., Yamada, K. M. Cell interactions with three-dimensional matrices. Curr Opin Cell Biol. 14 (5), 633-640 (2002).
- Loessner, D., et al. Bioengineered 3D platform to explore cell-ECM interactions and drug resistance of epithelial ovarian cancer cells. Biomaterials. 31 (32), 8494-8506 (2010).
- Lin, R. Z., Chang, H. Y. Recent advances in three-dimensional multicellular spheroid culture for biomedical research. Biotechnol J. 3 (9-10), 1172-1184 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados