Method Article
Multiplexar Cytokine perfilação de Mouse estimulada Splenocytes usando uma plataforma baseada em Cytometric Bead imunoensaio
Neste Artigo
Resumo
Este protocolo descreve a quantificação de alvos múltiplos de citocinas simultaneamente em sobrenadantes de cultura de tecidos coletados de rato estimulada splenocytes usando multiplex do grânulo imunoensaio baseado em plataforma e um citômetro de fluxo.
Resumo
Imunoensaios baseados em grânulo empregam o mesmo princípio básico como imunoensaios de sanduíche. Captura de grânulos, que podem ser diferenciados pelo tamanho e intensidade de fluorescência allophycocyanin interno (APC), são conjugados com anticorpos específicos para um determinado analito. Em seguida, um painel selecionado de captura definidos conjuntos de grânulo é incubado com uma amostra biológica contendo alvo analitos específicos para os anticorpos de captura. Um anticorpo de detecção biotinilado cocktail é adicionado, o que leva à formação de sanduíches de anticorpo do grânulo-analito-deteção de captura.
Finalmente, é adicionado streptavidin-ficoeritrina (SA-PE), que liga-se anticorpos de deteção biotinilado, fornecendo intensidades de sinal fluorescente proporcionalmente à quantidade de analito acoplado. O PE fluorescente sinal de regiões específicas do analito grânulos é quantificada usando citometria de fluxo, e as concentrações dos analitos específicos são determinadas usando software de análise de dados e a curva padrão gerado no ensaio.
Neste experimento, usamos um painel de cytokine do rato T auxiliar para quantificar simultaneamente a concentração de 13 destinos de cytokine separado em sobrenadantes de cultura de tecidos coletados de rato splenocytes cultivadas sob diferentes condições estimulatórios.
Introdução
Em seu papel como moléculas sinalizadoras solúveis, citocinas mediam os processos altamente coordenados e multifatoriais que governam as respostas imunológicas do hospedeiro. Eles são expressos durante todas as fases do processo inflamatório, de iniciação à resolução e regulam uma rede de interação complexa que inclui sua própria síntese e dos seus receptores celulares1. Esta rede de comunicação é mergulhado com uma complexidade que ultrapassa as relações sinérgicas ou antagônicas que possam existir entre componentes individuais. Com efeito, muitas citocinas são conhecidas para compartilhar funções redundantes ou pelo menos parcialmente sobrepostas2,3.
Abordagens de biologia de sistemas integrados que quantificam simultaneamente vários analitos de citocinas são, atualmente, fornecendo uma compreensão cada vez mais abrangente do único cytokinomes que orquestrar as respostas imunes subjacente a várias doenças 4,5, afirma. Estas doenças Estados variam de inflamação generalizada para câncer, doenças neuro-degenerativas e doenças cardiovasculares6,7,8,9.
Essas redes de citocina podem ser interrogadas eficazmente usando os imunoensaios baseados no grânulo de LEGENDplex. Estes ensaios são baseados no mesmo princípio que o sanduíche do ensaio de imunoabsorção Enzyme-Linked (ELISA) e usam microesferas de fluorescência codificada com captura de anticorpos ligados covalentemente a sua superfície. Estes anticorpos são imobilizados na áreas de superfície muito menores do que os exigidos pelos formatos tradicionais de ELISA. Isso permite que tais ensaios ser executado com muito menos volume de amostra, enquanto ao mesmo tempo reduzir específico vinculação e fornecendo multiplexado análise de vários analitos.
O ensaio descrito neste protocolo utiliza esta tecnologia para dosar até 13 alvos simultaneamente. Dados deste ensaio podem ser obtidos usando uma grande variedade de citômetros comumente disponíveis e ao contrário de outros ensaios disponíveis não requer o uso de instrumentação de ensaio específico dedicado. Com um catálogo de expansão dos painéis de analito validado, estes ensaios têm sido usados em pesquisa biomédica em curso vários projectos10,11,12,13.
Para demonstrar a facilidade e a utilidade do formato de ensaio, neste experimento, que usamos um painel de citocina Mouse T auxiliar para dosar 13 separar concentrações de citocinas sobrenadantes de cultura de tecidos obtidos a partir do mouse splenocytes cultivadas sob múltiplos estimulatórios condições. Além de cultura de tecidos sobrenadantes, este ensaio também pode ser realizado utilizando amostras de soro ou plasma.
Protocolo
todas as experiências em animais foram realizadas de acordo com as recomendações de NIH contidas o guia para o cuidado e o uso de animais de laboratório e foram aprovadas pelo IACUC no BioLegend.
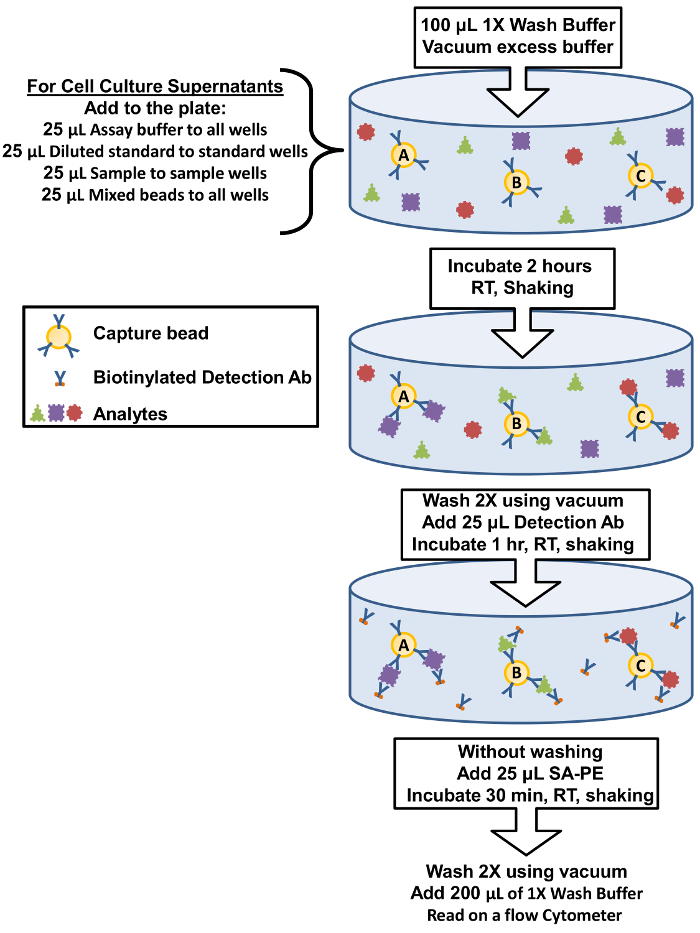
Figura 1: Resumo de procedimento de ensaio de placa do filtro. O protocolo para realizar o ensaio usando placas de filtro é representado como um diagrama representando componentes chave do ensaio e etapas de incubação. clique aqui para ver uma versão maior desta figura.
1. preparação da amostra biológica
Nota: O local escolhido anatômico e volume de coleta de sangue é deixada ao critério de cada investigador individual e não afetará o resultado do ensaio. No entanto, uma vez que eles são obtidos, as amostras devem ser manuseadas de acordo com as etapas listadas abaixo.
- De Preparação de amostras de soro
- coletar o volume desejado de sangue num tubo de colheita preferencial e permitir que coagula pelo menos 30 min.
- Centrifugar a amostra durante 10 minutos a 1.000 x g, à temperatura ambiente.
- Retire o soro e ensaio imediatamente ou alíquota em tubos de polipropileno microcentrifuga e armazenar as amostras em ≤ -20 ° C.
- Preparação de amostras de Plasma
- recolher o volume desejado de sangue usando ácido etilenodiaminotetracético (EDTA) revestido tubos de colheita de sangue.
- Centrifugar durante 10 minutos a 1.000 x g, à temperatura ambiente dentro de 30 min de coleção.
- Remover plasma e ensaio imediatamente ou alíquota para tubos de polipropileno microcentrifuga e armazenar as amostras em ≤ -20 ° C.
- Preparação do amostras sobrenadante de cultura de tecidos
- centrifugar a amostra durante 10 minutos a 1.500 x g a 4 ° C para remover células e restos.
- Recolher o sobrenadante e ensaio imediatamente ou alíquota para tubos de polipropileno microcentrifuga e armazenar no ≤ -20 ° C.
- Descongelamento de congelados amostras biológicas
- descongelar completamente qualquer amostras biológicas previamente congeladas no gelo e o vórtice brevemente antes do uso. Evitar mais de 2 ciclos de congelamento/descongelamento.
Nota: As amostras utilizadas neste protocolo foram obtidas pelo cultivo splenocytes de rato BALB/c (1 x 10 6 células em 37 ° C + 5% CO 2 sob várias condições: unstimulated, LPS (100 ng/mL), αCD3 (1 µ g/mL-revestida) + αCD28 (1 µ g/mL solúvel), PMA (20 ng/mL) + Ionomycin (500 ng/mL). Sobrenadantes de cultura foram coletadas após 48 h e processados conforme descrito na seção 1.3.
- descongelar completamente qualquer amostras biológicas previamente congeladas no gelo e o vórtice brevemente antes do uso. Evitar mais de 2 ciclos de congelamento/descongelamento.
2. Preparação do reagente
- Grânulos de Preparation of Pre-mixed Antibody-Immobilized
- Sonicate pré-misturados grânulos do frasco por 1 min em um banho de sonicador em temperatura ambiente e em seguida vortex para 30 antes de s de usar. Se nenhum banho sonicador está disponível, aumentar o tempo de vórtice para 1 min.
- Preparação de tampão de lavagem
- trazer a 20 x tampão de lavagem (20x PBS com 1% Tween-20) fornecido com o kit à temperatura ambiente e vórtice para trazer todos os sais em solução.
- Diluir 25 mL de tampão de lavagem com 475 mL de água desionizada de 20x. Parcela não utilizada armazenar entre 2 ° C e 8 ° C por até um mês.
- Preparação da matriz B (para uso com soro e Plasma amostras apenas)
- Adicionar 5,0 mL de tampão de ensaio (PBS com 1% de BSA) incluído no kit para o frasco contendo liofilizado Matrix B. permitir pelo menos 15 min para reconst completa itution, então o vórtice para misturar bem. Reconstituído sobra Matrix B pode ser armazenado em ≤-70 ° C por até um mês.
3. Preparação padrão
Nota: cada analito neste painel tem uma concentração padrão superior de 10.000 pg/mL.
- Adicionar 250 µ l de Buffer de ensaio para reconstituir o liofilizado Mouse Th citocina padrão Cocktail. Misture por brevemente num Vortex e permitir que o frasco para sentar-se à temperatura ambiente durante 10 min.
- Transferir o coquetel padrão para um tubo de polipropileno microcentrifuga rotulado " C7 ". Isso será usado como o padrão de topo.
- Tubos de polipropileno microcentrifuga rótulo 6 como C6, C5, C4, C2, C3 e C1.
- Adicionar 75 µ l de Buffer de ensaio para cada um destes tubos.
- Transferir 25 µ l do C7 padrão superior ao tubo de C6 e mistura bem vortexing. Este será o padrão C6.
- Continuar realizando serial diluições de 1:4 usando uma pipeta nova dica para cada tubo, adicionar 25 µ l da norma anterior para o µ 75 l de Buffer de ensaio no próximo menor tubo padrão seguido num Vortex para obter padrões C5, C4, C3 , C1 e C2. Usar o Buffer de ensaio como o padrão de 0 pg/mL (C0).
4. Diluição da amostra
Nota: experimentos piloto preliminares usando este ensaio com várias diluições podem ser necessários para determinar o fator de diluição mais apropriado para um determinado conjunto de amostras biológicas. Um fator de diluição adequada irá produzir cálculos da concentração da amostra que se encontram dentro dos limites da curva padrão. As etapas a seguir servem como diretrizes e poderão ter de ser determinado empiricamente dependendo do tipo de amostra.
- Diluir soro ou plasma amostras 2 dobras com Buffer de ensaio (EG. diluir 50 µ l de amostra com 50 µ l de Buffer de ensaio) em tubos de polipropileno microcentrifuga.
Nota: Se mais diluição da amostra é necessária, diluições devem ser feitas com a matriz B em vez de buffer de ensaio para garantir a precisão das medições. Adicionando as amostras de soro ou plasma sem diluição resultarão na precisão do ensaio baixa e podem obstruir a placa do filtro. Matriz B é composto por soro de rato em pool empobrecido de alvos de ensaio endógeno. É usado como um diluente de amostra de soro ou plasma para evitar efeitos de matriz, que são conhecidos para a sensibilidade analítica de afeto de imunoensaios. - Teste de pilha amostras de sobrenadante de cultura sem diluição.
Nota: Os níveis de analito podem variar grandemente de amostra para amostra. Se necessário, diluir as amostras sobrenadante usando uma fresca preparação de seu correspondente meio de cultura celular ou Buffer de ensaio.
5. Procedimento de ensaio
Nota: O ensaio pode ser executado em placas de filtro de polipropileno, tubos de micro FACS ou microplacas de fundo-V. O procedimento de ensaio de placa do filtro é recomendado devido à boa amostra para amostra consistência, ensaio robustez e facilidade de manuseio. Este procedimento requer uma unidade de filtração de vácuo para lavagem (fornecida pelo usuário final).
- Permitem que todos os reagentes aquecer a temperatura ambiente (20-25 ° C) antes do uso.
- Conjunto da placa do filtro na capa de um prato invertido em todos os momentos durante as etapas de instalação e incubação de ensaio, para que o fundo do prato não tocar superfícies como pode causar vazamento.
- Manter a placa na posição vertical durante o procedimento de ensaio inteiro, incluindo as etapas de lavagem, para evitar a perda de grânulos de.
- Manter a placa no escuro ou embrulhado com papel alumínio para todas as etapas de incubação.
- Executar todas as normas e amostras como duplicatas, dispostas no prato em ordem sequencial.
- Pre-molhar a placa filtro adicionando-se 100 µ l de tampão de lavagem 1x a cada poço e deixe descansar por 1 min à temperatura ambiente (se estiver usando o filtro de fundo microplacas).
- Volume de tampão remover utilizando um tubo de vácuo (5-10 s). Não exceda 10 " Hg de vácuo. Lavagem do excesso de borrão Tampão da parte inferior da placa, pressionando a placa sobre uma pilha de toalhas de papel limpo. Coloque a placa em cima da tampa da placa invertida.
Nota: As etapas 5.1-5.2 podem ser omitidas se realizar o ensaio usando uma V-microplaca ou micro FACS tubos. - Para amostras sobrenadante de cultura de células, adicione 25 µ l de Buffer de ensaio para todos os poços. Adicione 25 µ l de cada norma aos poços padrão. Adicionar 25 µ l de cada amostra os amostra poços.
- Para medição de amostras de soro ou plasma, adicione 25 µ l de matriz B aos poços padrão. Adicione 25 µ l de Buffer de ensaio para os poços da amostra. Adicione 25 µ l de cada norma aos poços padrão. Adicionar 25 µ l de cada amostra de plasma ou de soro diluído nos poços de amostra.
- Vortex misturado de grânulos para 30 µ l adicionar 25 s., de grânulos mistos para cada poço, agitando a garrafa de grânulo intermitentemente para evitar grânulo fixando-se. O volume final deve ser 75 µ l em cada poço após a adição dos grânulos.
- a placa com um aferidor de placa do selo. Embrulhe o prato inteiro, incluindo a tampa da placa invertida, com folha de alumínio. Coloque a placa de um agitador de placa, fixá-lo e agitar a aproximadamente 500 rpm por 2 h à temperatura ambiente. Para evitar fugas, não aplique pressão positiva para o aferidor de placa.
- Sem inversão, coloque a placa sobre o distribuidor de vácuo e aplicar vácuo como antes e acrescentar 200 µ l de tampão de lavagem 1x a cada poço.
- Remover o conteúdo dos poços de placa de ensaio por filtração em vácuo. Borre o tampão de lavagem em excesso da parte inferior da placa com um absorvente ou toalhas de papel. Repita essa etapa mais uma vez.
Nota: Se o ensaio é realizado usar um V-fundo microplacas ou micro FACS tubos pular etapas 5.12 e 5.13. Em vez disso, centrifugar a placa a 1.000 x g durante 5 min à temperatura ambiente, em seguida, remover o sobrenadante com uma pipeta multicanal. - Adicionar 25 µ l de anticorpos de deteção (consulte a tabela de materiais) para cada poço.
- a placa com um aferidor de placa fresca do selo. Embrulhe o prato inteiro, incluindo a tampa da placa invertida, com folha de alumínio.
- Colocar a placa num agitador de placa e agitar a aproximadamente 500 rpm por 1h à temperatura ambiente.
- Sem aspirar, adicione 25 µ l de reagente de SA-PE diretamente a cada poço. Sem diluição do reagente é necessária.
- a placa com um aferidor de placa fresca do selo. Embrulhe o prato inteiro, incluindo a tampa da placa invertida, com folha de alumínio.
- Colocar a placa num agitador de placa e agitar a aproximadamente 500 rpm durante 30 min à temperatura ambiente.
- Repita o passo acima 5.13.
- Adicionar 200 µ l de 1x tampão de lavagem a cada poço. Re-suspender as contas num agitador de placa de 1 min.
- Usando uma pipeta multicanal, transferir amostras da placa do filtro para tubos de FACS ler amostras em um citômetro de fluxo.
Nota: Volume de amostra pode ser aumentado de 200 µ l para 300 µ l, adicionando um extra 100 µ l de tampão de lavagem 1x a cada tubo para evitar a amostra seca em execução. Se amostras necessárias podem ser armazenadas em 4 ° C protegido da luz e analisados no dia seguinte. No entanto, armazenamento de amostra prolongada pode levar a sinal reduzido.
6. Set-up citômetro de fluxo
Nota: a fim de gerar dados fiáveis, o citômetro de fluxo deve ser configurado corretamente antes de aquisição de dados. Este processo irá variar para usuários individuais em alguns aspectos, dependendo da configuração do instrumento particular em que o ensaio é realizado. Um processo de instalação generalizada para um citômetro capaz de medir a PE e APC e equipado com ambos um laser de 488 e 633 nm é discutido abaixo.
- Iniciar o software de aquisição e citômetro de fluxo de acordo com o fabricante ' instruções é fornecidas com o instrumento.
- Criar uma trama de ponto com selo FSC (dispersão para a frente) no eixo x e SSC (dispersão lateral) para o eixo y. Definir o FSC e SSC para modo linear.
- Criar um segundo ponto enredo com PE no eixo x e APC para o eixo y. Este plano deve ser definido como um modo de exibição com base em log.
- Vortex do frasco de grânulos crus incluídos no kit de 30 s para re-suspender as contas. Estes grânulos contêm um corante APC interno e são compreendidos de duas populações de tamanho.
- Transferência de 400 µ l dos grânulos crus para um novo tubo de FACS.
- Definir a taxa de fluxo do citômetro de fluxo para baixo.
- Executar os grânulos crus, ajustando cuidadosamente o ganho e a tensão para o SSC e FSC, para que ambas as populações tamanho destes grânulos são visivelmente separados e fáceis de portão.
- Ajustar o limite FSC para excluir eventos indesejados (ou seja, bolhas de detritos ou ar).
- Enredo no FSC vs CCD, desenhar um portão que inclui todas as populações do grânulo.
Nota: Os grânulos crus contêm duas populações de tamanho dos grânulos, a menor " um grânulos " e o maior " grânulo B " regiões. - Exibir as populações fechado do grânulo do terreno FSC vs CCD sobre o segundo ponto enredo com PE no eixo x e APC para o eixo y.
- Ajustar a tensão de PGTO para o canal de fluorescência APC para que o sinal da APC para todas as populações de esferas tem uma intensidade de fluorescência mediana (IFM) que se situa entre 1 x 10, 1 e 5 x 10 3.
- Vortex o frasco da instalação PE grânulos para 30 s para re-suspender os grânulos.
- Contas de transferência de 400 µ l do PE para um novo tubo de FACS.
- Contas de substituir os grânulos crus tubo do citômetro de fluxo com o PE tubo.
- Ajustar a tensão do tubo (PMT) fotomultiplicador para a PE fluorescência canal configuração para que o IFM dos grânulos PE cai entre o intervalo de lote-específico encontrada indicados no rótulo do frasco de grânulos de PE.
Nota: Os grânulos de instalação PE contêm grânulos do tamanho de uma população (" um grânulos " somente).
7. Aquisição de dados
Nota: os procedimentos exatos associados com a aquisição de dados em um determinado instrumento podem variar e dependem o citômetro de ' s especificações de configuração e o software de interface utilizado. As instruções abaixo destinam-se, portanto, para destacar as etapas necessárias a adoptar no ensaio independentemente o citômetro empregado no ensaio de.
- Verifique se a taxa de citômetro de fluxo ainda está definida para baixo.
- Definir o número de eventos do grânulo, a aquisição de cerca de 300 por analito. Para um 13-plex painel isso equivale a adquirir 3.900 eventos combinados de ambas as populações de tamanho do grânulo (grânulos de A + B).
- Vortex cada amostra por 5 s antes da análise. Amostras
- leitura. Ao ler as amostras, definir o citômetro de fluxo para o modo de instalação, primeiro e esperar até que a população do grânulo é estabilizada antes de mudar para o modo de aquisição.
- Use nomes simples com numeração consecutiva para arquivos de dados para facilitar a análise de dados.
- Exportar somente os eventos fechados (A + B talão regiões) ao invés de eventos totais.
- Armazenar todos os arquivos do FCS na mesma pasta para cada ensaio. Se executando vários ensaios, criar uma pasta separada para cada ensaio.
Nota: arquivos do FCS gerados sobre o citômetro de fluxo devem ser analisados usando o software de análise de dados, que pode ser baixado gratuitamente 14.
- Instalar o software de análise de dados em um PC.
- Transferir todos os arquivos de ensaio FCS para o computador que contém o software de análise.
- Conecte o dongle de chave de licença (incluído no kit) em uma porta USB do computador.
- Lançar o software de análise de dados.
- Clique azul " adicionar arquivos " botão localizado na parte superior da tela.
- Navegue até a pasta que contém os arquivos de FCS do ensaio na janela pop-up que aparece.
- Clique e arraste todos os arquivos de ensaio FCS da janela pop up para a visualização de software. Devem aparecer em uma lista todos os arquivos.
- Clique o verde " próximo " botão no canto inferior direito do visor. Clique e segure para arrastar a pequena curva padrão azul botões (C7 a C0) para seus arquivos correspondentes do FCS da lista para definir a curva padrão.
- Clique o verde " próximo " botão no canto inferior direito da tela para abrir a associada janela pop-up.
- No lado esquerdo da janela associada, digite os nomes de ambos os A e regiões de grânulo B ensaio analito alvos e sua ID de associado do grânulo (encontradas no manual fornecido com o ensaio), em ordem crescente.
- Selecione a ferramenta associada da parte superior da janela pop up e usá-lo para desenhar 2 portões na trama do FSC vs CCD, um próximo as contas A e um segundo próximo os grânulos de B.
- Revisão do APC vs PE dispersão plota que aparecem abaixo a trama do FSC vs CCD que aparecem. Haverá 6 bandas de analito em grânulos A (terreno à esquerda) e 7 bandas de analito em grânulos B (direito terreno).
Nota: Portões podem ser redesenhados manualmente selecionando a ferramenta borracha no topo e clique para excluir um determinado Portal. A ferramenta associada pode ser selecionada e usada para aplicar manualmente um portão para a região de banda desejada. - Clique o verde " Okey " botão para fechar a associada janela pop-up e retornar à lista de arquivos FCS.
- Definir nenhum diluições que foram feitas em amostras biológicas por direito clicando em um determinado arquivo, selecionando " diluição dobre " no menu, e o valor correto de entrada.
- Clique o verde " executar " botão no canto inferior direito do visor para gerar as curvas padrão para o ensaio e calcular as concentrações das amostras biológicas desconhecidas.
Resultados
Este protocolo demonstra como uma plataforma baseada em grânulo imunoensaio pode ser usada para dosar simultaneamente perfis cytokine de amostras biológicas usando um citômetro de fluxo. As amostras biológicas usadas neste exemplo foram sobrenadantes de cultura de células de rato splenocytes que tinha sido previamente incubado sob várias condições de activação, embora o formato de ensaio também foi validado para uso com amostras de soro ou plasma.
Dados gerados a partir do ensaio são usados para construir curvas padrão para todos os analitos no painel multiplexado. O software de análise de dados classifica cada analito específico com base em um único talão tamanho e intensidade APC e quantifica-los usando um repórter de PE. Os intervalos dinâmicos, bem como a sensibilidade do ensaio é demonstrados quando plotados em escala log-log na Figura 2A. O software usa dados de ensaio e um algoritmo de ajuste de curva 5-parâmetro para calcular com precisão não só as concentrações dos analitos em usuário fornecido amostras biológicas mas também os limites de detecção em ambas as extremidades da alta e baixa de todas as curvas padrão (tabela 1 ). O formato descrito neste protocolo também fornece precisão ensaio altamente robusto. Na Figura 2B e 2C , os dados são apresentados mostrando a variabilidade intraensaio de cada analito. Duas concentrações de proteína padrão separado (alta e baixa) foram analisadas em um ensaio com 16 repetições para cada amostra. Figura 2 e 2D representam a variação inter-ensaio do alvo analitos de três ensaios independentes. Como com os experimentos de precisão intra-ensaio, altas e baixas concentrações padrão foram analisadas com 3 repetições em cada um dos experimentos independentes. Variabilidade mínima na concentração de proteínas do alvo calculada é claramente visível.
Para demonstrar a utilidade dos ensaios baseados em grânulo cytometric em interrogar perfis de expressão de citocinas, rato splenocytes foram incubados sob várias condições de activação. Além de um controle unstimulated, células também foram incubadas com LPS, anticorpos anti-CD3/anti-CD28, ou phorbol myristate 12 13-acetato e ionomycin. Sobrenadantes de cultura de células foram coletadas 48 horas mais tarde e analisada usando o painel de citocina Mouse T auxiliar. Os resultados da quantificação deste experimento são representados na Figura 3 e o efeito das condições de estimulação em concentrações de citocinas é claramente delineado.
Os resultados descritos acima são típicos, contanto que o experimentador tem laboratório de boa técnica e segue o protocolo de ensaio fornecido. Fontes de erro neste formato de ensaio podem surgir a partir de desvios em tempos de incubação, volumes de reagentes, lavagem, ou configurações de PGTO indevidas sobre o citômetro de fluxo usado para analisar as amostras. Na Figura 4A uma dispersão enredo de um ensaio bem sucedido mostra 2 populações distintas do grânulo que estão claramente definidas. Isto pode ser contrastado a Figura 4B, onde pobre aderência de lavagem e protocolo conduziram a agregados de grânulo que desfocagem as duas populações. Além disso, conforme atestam os detritos no quadrante inferior esquerdo, total citômetro eventos foram exportados para análise, ao invés do formato preferido de eventos fechados apenas. Adequada citômetro de configurar é fundamental para gerar dados confiáveis neste ensaio. Na Figura 4 adequado PGTO configurações permitem para a resolução de cada um dos 6 analitos no canal de classificação da APC. Configurações de PGTO indevidas resultará em semelhante ao apresentado na Figura 4 , onde o canal APC tem populações grânulo com sobreposição intensidades de classificação de dados. Isso invalidará o ensaio, uma vez que será impossível calcular concentrações de analito sem populações claramente definidas de grânulos de ensaio.
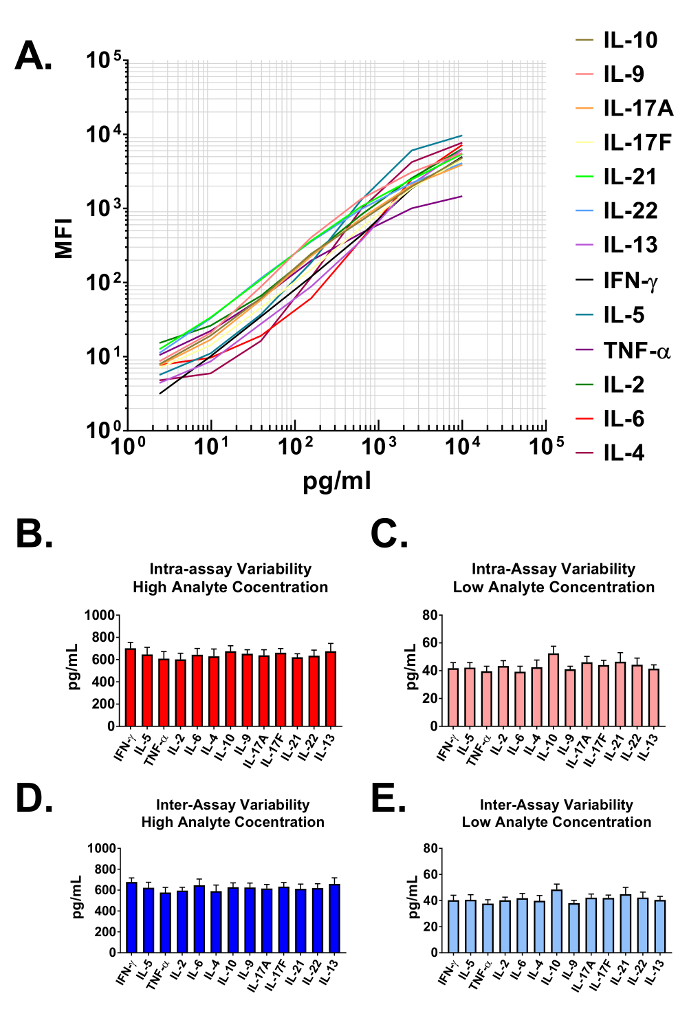
Figura 2: intervalos de curva padrão e precisão teste. (A) uma representante curva padrão gerada usando o painel de citocina Mouse T auxiliar. Uma curva padrão deve ser executada com cada ensaio. (B-C) Precisão intra-ensaio. Duas amostras com concentrações diferentes de proteínas do alvo (alta e baixa) foram analisadas em um ensaio com 16 repetições para cada amostra. Dados são representados como a média + desvio padrão. (D-E) Precisão inter-ensaio. Duas amostras com concentrações diferentes de proteínas do alvo (alta e baixa) foram analisadas em três ensaios independentes com 3 repetições para cada amostra. Dados são representados como a média + desvio padrão. Clique aqui para ver uma versão maior desta figura.
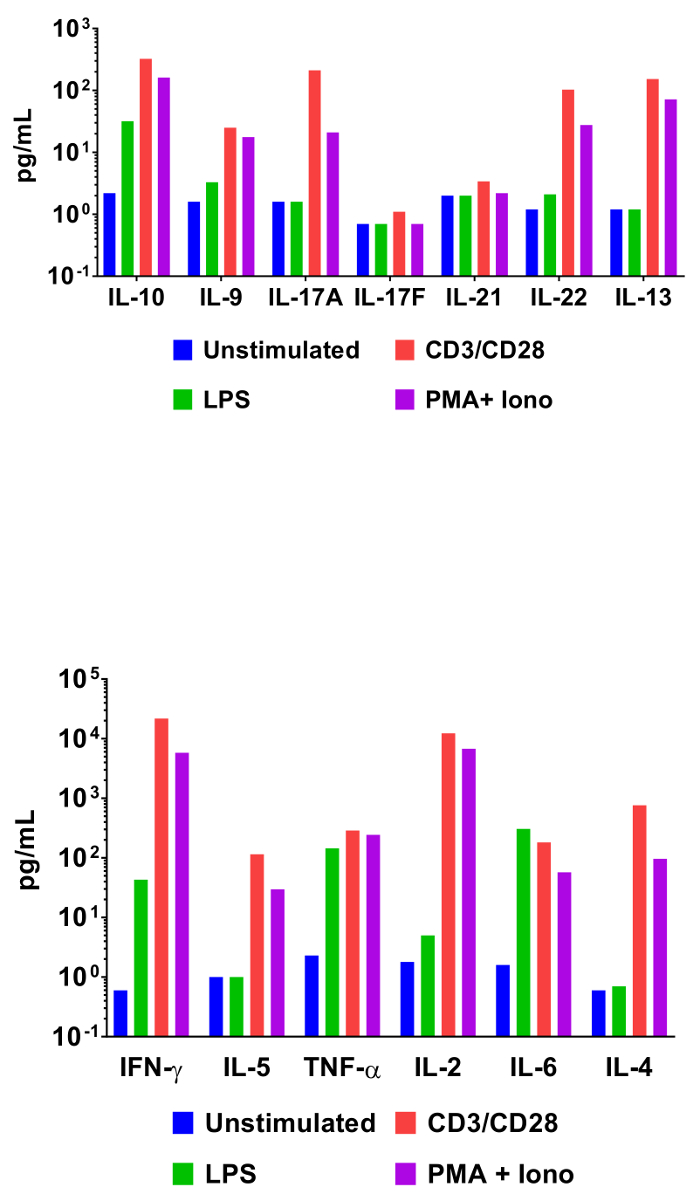
Figura 3: quantificação dos resultados representante. Mouse splenocytes (1 x 106 células) foram cultivadas a 37 ° C + 5% CO2 sob várias condições: unstimulated, LPS (100 ng/mL), αCD3 (1 µ g/mL-revestida) + αCD28 (1 µ g/mL solúvel), PMA (20 ng/mL) + Ionomycin (500 ng/mL). Sobrenadantes de cultura foram coletadas após 48 h, em seguida, quantificados usando o painel de citocina Mouse T auxiliar. Perfis de expressão diferencial de citocinas em resposta a condições de estimulação são claramente visíveis. Clique aqui para ver uma versão maior desta figura.

Figura 4: resultados de sucesso vs ensaios sem sucesso. (A) ensaios bem sucedidos terão populações distintas do grânulo para as populações de microesfera. (B) ensaios vencidos terá separação de população pobre, agregados do grânulo e muitos eventos coletados. (C) ensaios bem sucedidos têm claramente definidos intensidades no canal de fluorescência de classificação que são fáceis de portão e quantificar. (D) ensaios sem sucesso vão ter mal separados e intensidades de classificação que se sobrepõem várias populações de grânulo, tornando difícil a quantificação. Muitos destes erros podem ser evitados através da cuidadosa adesão ao protocolo de ensaio. Clique aqui para ver uma versão maior desta figura.
| Curva padrão | Sensibilidade (pg/mL) | ||||
| Analito | Fórmula de ajuste | CV | R2 | Min. | Max. |
| IFN-Γ | 5-P.log(4.43, 14.40, 0.54, 9.11, 0.01) | 1,77% | 0,99 | 2.1 | 18105.0 |
| IL-5 | 5-P.log(4.36, 12.68, 0.64, 5.73, 0.36) | 1,32% | 1 | 1.9 | 14514.0 |
| TNF-Α | 5-P.log(4.36, 11.63, 0.79, 5.45, 0.37) | 1,48% | 0,99 | 1.9 | 20109.0 |
| IL-2 | 5-P.log(4.46, 12.62, 0.78, 5.07, 0.34) | 1,34% | 1 | 1.9 | 25109.0 |
| IL-6 | 5-P.log(4.58, 11.66, 0.64, 5.77, 0.37) | ||||
Tabela 1: encaixe de curva-padrão e a sensibilidade do ensaio. O software de análise de dados foi usado para gerar curvas padrão para todos os analitos contidas no ensaio de multiplex. Esta análise totalmente automatizado aplica-se um robusta encaixe algoritmo para as normas de série de diluição do ensaio de curva 5-parâmetro e também foi usado para definir a sensibilidade do ensaio, usando os limites teóricos de detecção.
Discussão
O formato de ensaio descrito neste protocolo pode fornecer robusta quantificação dos perfis de mediador solúvel em amostras biológicas, desde que o experimentador tem laboratório de boa técnica e adere ao protocolo recomendado.
Há várias etapas que devem ser seguidas para garantir resultados confiáveis. Em primeiro lugar, as normas recombinantes devem reconstituir no buffer de ensaio o recomendado em tempo integral e após apenas diluído em tubos de polipropileno. Tubos de poliestireno podem promover a adesão das proteínas da parede dos tubos, que pode levar a sinais de baixos ao gerar a curva padrão. Em segundo lugar, adequada a tremer durante as etapas de incubação é crítico. Sem a agitação adequada, as características de ligação dos grânulos do ensaio podem ser severamente prejudicadas. Além disso, a lavagem adequada entre as etapas de incubação também é necessária. O experimentador deve assegurar que os reagentes em excesso são removidos dos poços, antes de iniciar o próximo passo no protocolo. Configurações de instrumentos para o citômetro de fluxo usado para interrogar os grânulos de ensaio devem ser também otimizadas. Em particular, configurações de PGTO devem ser ajustadas para assegurar a separação adequada do grânulo e amplos intervalos dinâmicos para as curvas padrão. Finalmente, pouco antes de ser analisado sobre o citômetro, grânulos devem ser vortexed para garantir a suspensão adequada e para evitar a formação de agregados que podem distorcer os resultados.
Este protocolo potencialmente pode ser modificado para analisar o tecido homogenates, bem como os tipos de amostra discutidos neste manuscrito, desde que o pesquisador está disposto otimizar seu protocolo de Lise antes de realizar ensaios de placa grande, completo. Claro, a técnica real irá variar dependendo do tipo de tecido; no entanto, em geral o protocolo deve usar um tampão de pH neutro contendo concentrações fisiológicas de sais iônicos, sem produtos químicos desnaturação e de preferência sem detergentes. Se o detergente deve ser usado, as concentrações de detergente não-iônico devem ser mantidas no mínimo (por exemplo, não mais que 1%). O buffer também deve conter inibidores de protease suficientes para prevenir a degradação proteolítica de proteínas do alvo. Independentemente do protocolo de Lise usado, os preparativos finais devem ser centrifugados para remover partículas antes da análise.
Sobre as limitações do ensaio, as concentrações de analito alvos em tipos de amostra biológica podem variar muito. De forma a quantificar corretamente as concentrações de analito, eles devem ser abrangidos os valores superior e inferior para a curva padrão. Extrapolação dos valores da curva não é necessariamente fiável e não recomendo. Investigadores, portanto, devem otimizar as diluições de amostras particulares em experimentos piloto antes da execução de um ensaio completo-placa. Além disso, a preparação cuidadosa das amostras biológicas para ser analisada é fundamental para o sucesso deste formato de ensaio. Amostras lipémicas, hemolizado, ou contêm restos de proteínas irão afetar interações antígeno anticorpo que definem o princípio básico deste imunoensaio e render resultados que são difíceis de interpretar.
Este ensaio é significativo no que diz respeito a métodos de quantificação existentes por várias razões. Quando executado corretamente, o formato de ensaio pode dosar até 13 analitos de uma amostra usando volumes muito menores do que seria necessário para analisar a amostra usando os tradicionais ensaios de ELISA. Este formato de ensaio também não requer instrumentação dedicada para ser executada. Esta é uma vantagem em comparação com outros imunoensaios baseados em grânulo comercialmente disponíveis como o ensaio pode ser executado usando qualquer número de citômetros comumente usados.
Inquérito científico sobre o papel desempenhado por citocinas e fatores secretados redes em saúde e doença está se expandindo. O formato de ensaio descrito neste manuscrito pode ser uma ferramenta valiosa para investigadores que pretendam compreender esses fenômenos multifacetados e complexos. Programas de investigação biomédica estão começando a explorar o papel das redes de citocina de inflamação de áreas tais como generalizadas não apenas6, mas também no contexto de Estados de doença específica, tais como aterosclerose, câncer e neuroinflammation 15,16,17. Sem dúvida, investigação continuará a crescer nestas áreas, como a busca de novas terapêuticas tratar essas condições crônicas se expande. A necessidade de quantificação precisa e confiável dos mediadores solúveis associados a estas doenças continuará a ser uma prioridade de investigação crítica.
Divulgações
Os autores são empregados pelo BioLegend, que fabrica os reagentes descritos neste manuscrito. Vigene Tech, Inc. desenvolveu o software de análise de dados de LEGENDplex que é usado para analisar os dados gerados a partir do ensaio descrito neste manuscrito.
Agradecimentos
Os autores gostaria de reconhecer as contribuições dos biomarcadores e imuno-ensaios de equipe de desenvolvimento de produto para o desenvolvimento do ensaio. Além disso, gostaríamos de agradecer Vigene Tech, Inc. para seus esforços de colaboração na criação de pacotes de software de análise de dados.
Materiais
| Name | Company | Catalog Number | Comments |
| Allegra 6R Centrifuge with MICROPLUS Carrier Adaptor | Beckman Coulter | 366816 | For LEGENDplex assays is run in microtubes, V-or U-bottom 96-well plate (optional) |
| LEGENDplex Mouse T helper Cytokine Panel | BioLegend | 740005 | Multiplex Immunoassay (13-plex) |
| Anti-mouse CD3ε antibody | BioLegend | 100314 | Clone 145-2C11, low endotoxin, azide free format |
| Anti-mouse CD28 antibody | BioLegend | 102112 | Clone 37.51, low endotoxin, azide free format |
| Vacuum Pump | EMD Millipore | WP6111560 | For LEGENDplex assays using filter plates (recommended) |
| Vacuum Manifold | EMD Millipore | MSVMHTS00 | For LEGENDplex assays using filter plates (recommended) |
| Sterile Disposable Reagent Reservoirs | Fisher Scientific | 07-200-130 | Or equivalent |
| Polypropylene MicroFACS Tubes | Fisher Scientific | 11-842-90 | For LEGENDplex assays is run in microtubes, V-or U-bottom 96-well plate (optional) |
| Pipette Kit | Fisher Scientific | 14-388-100 | Four pipette sizes (0.2-2µL, 2-20µL, 20-200µL, 100-1000µL) |
| Multi-Channel Pipette | Fisher Scientific | FA10011G | capable of dispensing 5 μL to 200 μL |
| Microplate Shaker | Fisher Scientific | 88880023 | Or equivalent |
| Microcentrifuge | Fisher Scientific | 75002410 | Or equivalent |
| FACS tubes | Fisher Scientific | NC9885747 | 12 x 75 mm round bottom |
| PMA (Phorbol 12-myristate 13-acetate) | Sigma-Aldrich | P8139 | |
| Lipopolysaccharide (LPS) | Sigma-Aldrich | L-8274 | Escherichia coli O26:B6 |
| Ionomycin | Sigma-Aldrich | I0634 | |
| Branson B200 Ultrasonic Cleaner | Sigma-Aldrich | Z305359 | Or equivalent |
| Microcentrifuge tubes | Sigma-Aldrich | Z666505 | 1.5 mL polypropylene tubes |
| Flow Cytometer | Various | Various | Cytometer equipped with single laser (488nm blue) or two lasers (488nm blue or 532nm green + 633nm Red) capable of reading emission wavelengths at 575nm and 660nm |
| 96-Well Polypropylene Plate | VWR | 82050-662 | For LEGENDplex assays is run in microtubes, V-or U-bottom 96-well plate (optional) |
Referências
- Stanley, A. C., Lacy, P. Pathways for cytokine secretion. Physiology (Bethesda). 25, 218-229 (2010).
- Nicola, N. A. Cytokine pleiotropy and redundancy: a view from the receptor. Stem Cells. 12, (1994).
- Miyajima, A., Hara, T., Kitamura, T. Common subunits of cytokine receptors and the functional redundancy of cytokines. Trends Biochem Sci. 17, 378-382 (1992).
- Costantini, S., Castello, G., Colonna, G. Human Cytokinome: a new challenge for systems biology. Bioinformation. 5, 166-167 (2010).
- Capone, F., et al. Serum Cytokinome Profile Evaluation: A Tool to Define New Diagnostic and Prognostic Markers of Cancer Using Multiplexed Bead-Based Immunoassays. Mediators Inflamm. , 3064643 (2016).
- Schett, G., Elewaut, D., McInnes, I. B., Dayer, J. M., Neurath, M. F. How cytokine networks fuel inflammation: Toward a cytokine-based disease taxonomy. Nat Med. 19, 822-824 (2013).
- Tse, E., Kwong, Y. L. T-cell lymphoma: Microenvironment-related biomarkers. Semin Cancer Biol. 34, 46-51 (2015).
- Reale, M., Greig, N. H., Kamal, M. A. Peripheral chemo-cytokine profiles in Alzheimer's and Parkinson's diseases. Mini Rev Med Chem. 9, 1229-1241 (2009).
- Vistnes, M., Christensen, G., Omland, T. Multiple cytokine biomarkers in heart failure. Expert Rev Mol Diagn. 10, 147-157 (2010).
- Gobel, K., et al. Blood coagulation factor XII drives adaptive immunity during neuroinflammation via CD87-mediated modulation of dendritic cells. Nat Commun. 7, 11626 (2016).
- Palm, A. K., Friedrich, H. C., Kleinau, S. Nodal marginal zone B cells in mice: a novel subset with dormant self-reactivity. Sci Rep. 6, 27687 (2016).
- Yu, Y., et al. The transcription factor Bcl11b is specifically expressed in group 2 innate lymphoid cells and is essential for their development. J Exp Med. 212, 865-874 (2015).
- Pelly, V. S., et al. IL-4-producing ILC2s are required for the differentiation of TH2 cells following Heligmosomoides polygyrus infection. Mucosal Immunol. 9, 1407-1417 (2016).
- . LEGENDplex Multiplex Assays Available from: https://www.biolegend.com/legendplex (2017)
- Autieri, M. Pro- and anti-inflammatory networks in atherosclerosis. ISRN Vascular Medicine. 2012, (2012).
- West, N. R., et al. Emerging cytokine networks in colorectal cancer. Nat Rev Immunol. 15, 615-629 (2015).
- Becher, B., Spath, S., Goverman, J. Cytokine networks in neuroinflammation. Nat Rev Immunol. 17, 49-59 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados