Method Article
Мультиплекс цитокина профилирование Splenocytes стимулировали мыши с использованием платформы на базе гранулярных шарик иммуноанализа
В этой статье
Резюме
Этот протокол описывает количественная оценка нескольких целей цитокина одновременно в supernatants культуры ткани, собранных от стимулировали мыши splenocytes bead многозальных платформы на основе иммуноферментного анализа и проточный цитометр.
Аннотация
На основе бисера иммуноанализа используют тот же основной принцип как сэндвич иммуноанализа. Захват бусы, которые могут быть продифференцированы по размеру и интенсивности флуоресценции внутренней аллофикоцианин (APC), являются конъюгированных антител специфических для конкретного исследуемое вещество. Далее выбранной группы захвата определенных бисера наборы инкубировали с биологической пробы, содержащей целевой аналитов специфичные для захвата антител. Добавляется биотинилированным обнаружения антител коктейль, который приводит к образованию захвата шарик-исследуемое вещество обнаружение антител бутерброды.
Наконец добавляется стрептавидина фикоэритрин (SA-PE), которая связывает биотинилированным обнаружения антител, обеспечивая интенсивностью флуоресцентного сигнала пропорционально количество связанных исследуемое вещество. PE флуоресцентного сигнала бусины аналита конкретных регионов количественно с помощью проточной цитометрии и концентрации конкретных аналитов определяются с помощью программного обеспечения для анализа данных и калибровочной кривой, созданный в assay.
В этом эксперименте мы используем мышь T вспомогательный цитокина панели одновременно определить концентрацию 13 целей отдельных цитокинов в supernatants культуры ткани, собранных от мыши splenocytes культивировали в различных условиях стимулирующее.
Введение
В их роли как растворимые сигнальных молекул цитокины посредником высоко скоординированных и многофакторных процессов, которые управляют хост иммунологических реакций. Они выражаются на всех стадиях воспалительного процесса, от начала к резолюции и регулируют сложного взаимодействия сети, которая включает в себя их собственные синтеза и что их клеточных рецепторов1. Эта сеть связи слоистых с сложности, которая выходит за рамки синергетические и антагонистические отношения, которые могут существовать между отдельными компонентами. Действительно многие цитокинов известны поделиться излишними или по крайней мере частично перекрывающихся функций2,3.
Интегрированные системы биологии подходы, которые одновременно определить несколько цитокина аналитов в настоящее время оказывают все более полное понимание уникальной cytokinomes, что оркестровать иммунных реакций, лежащих в основе несколько заболеваний государства4,5. Эти болезни государств варьируются от обобщенных воспаление рака, нейро дегенеративных условиях и сердечно-сосудистых заболеваний6,,78,9.
Такие цитокиновой сети могут быть допрошены эффективно с помощью LEGENDplex на основе бисера иммуноанализа. Эти анализы основаны на том же принципе как сэндвич твердофазный Assay иммуносорбента (ELISA) и использовать флуоресценции кодировке микросфер с захвата антитела ковалентно прилагается к их поверхности. Эти антитела иммобилизованных на площади поверхности гораздо меньше, чем те, которые требуются от традиционных форматов ELISA. Это позволяет такие анализы выполняться с гораздо меньше объема выборки, хотя в то же время снижение неспецифической привязки и обеспечивая мультиплексированных анализ нескольких аналитов.
Assay, указанных в настоящем Протоколе использует эту технологию для quantitate до 13 целей одновременно. Данные из этого анализа можно получить, используя широкий спектр общедоступных потока цитофлуориметрами и в отличие от других имеющихся анализов не требует использования выделенных пробирного конкретных приборов. С расширение каталог проверенных аналита панелей эти анализы были использованы в нескольких текущих биомедицинских исследовательских проектов10,11,12,13.
Чтобы продемонстрировать легкость и полезность анализа формата, в этом эксперименте мы используем панель цитокина вспомогательный мыши T чтобы quantitate 13 отдельных концентрации цитокинов от supernatants культуры ткани, полученные от мыши splenocytes культивированный под несколькими стимулирующие условия. В дополнение к supernatants культуры ткани этот assay также может выполняться с использованием образцов сыворотки или плазмы.
протокол
все эксперименты на животных были выполнены согласно NIH рекомендации, содержащиеся в руководстве для ухода и использования лабораторных животных и были одобрены IACUC в BioLegend.
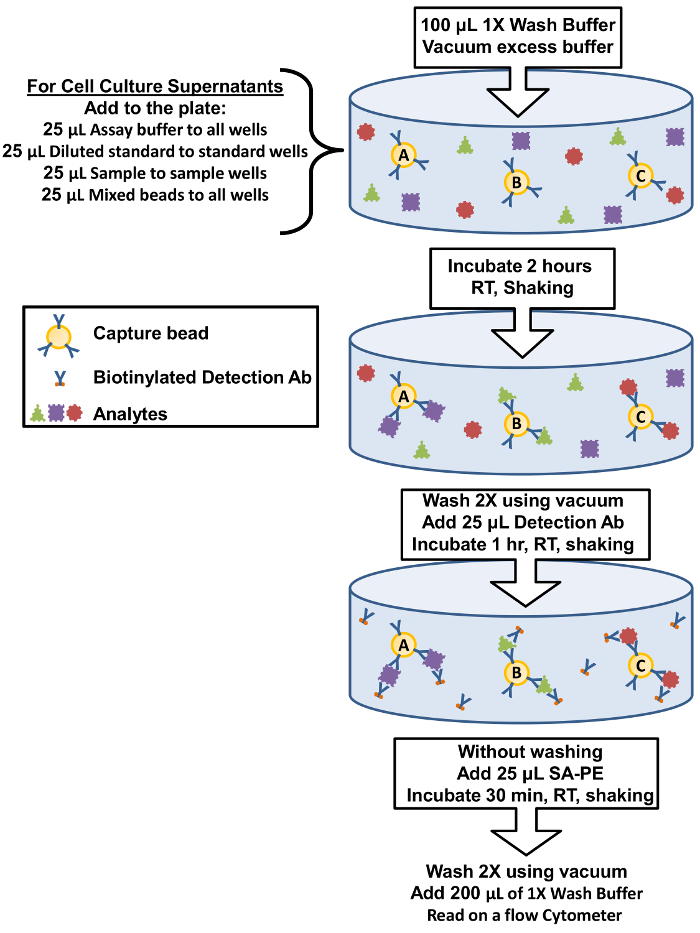
Рисунок 1: фильтр пластины Assay процедуры резюме. Протокол для выполнения анализа, с помощью фильтра плиты представлен в виде диаграммы анализа ключевых компонентов и инкубации шаги. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
1. Биологическая подготовка образца
Примечание: выбранный сайт анатомические и объем сбора крови остается на усмотрение каждого индивидуального следователь и не влияет на результаты анализа. Однако, как только они будут получены, образцы должны обрабатываться согласно шаги, приведенные ниже.
- Подготовка образцов сыворотки
- собирать желаемый объем крови в трубу Предпочтительная коллекция и позволить ей сгусток для по крайней мере 30 мин.
- Центрифугуйте образцы для 10 мин на 1000 x g при комнатной температуре.
- Удаления сыворотки и пробирного немедленно или Алиготе в трубы полипропиленовые microcentrifuge и хранить образцы на ≤ -20 ° с.
- Подготовка проб плазмы
- собрать требуемый объем крови, используя Этилендиаминтетрауксусная кислота (ЭДТА) покрытием пробирки.
- Центрифуги для 10 минут 1000 x g при комнатной температуре в течение 30 мин, коллекции.
- Удаления плазмы и пробирного немедленно или Алиготе в трубы полипропиленовые microcentrifuge и хранения образцов в ≤ -20 ° с.
- Подготовка супернатанта образцов культуры ткани
- центрифуга образца для 10 мин на 1500 x g при 4 ° C для удаления клеток и мусора.
- Собирать супернатант и пробирного немедленно или Алиготе в трубы полипропиленовые microcentrifuge и хранить в ≤ -20 ° с.
- Оттаивания замороженных биологических образцов
- полностью растаять любой ранее замороженных биологических образцов на льду и вихрь кратко перед использованием. Избежать более чем 2 циклов замораживания/оттаивания.
Примечание: Образцы, используемые в настоящем протоколе были получены путем культивирования splenocytes мыши BALB/c (1 х 10 6 клеток при 37 ° C + 5% CO 2 при различных условиях: кератоз, LPS (100 нг/мл), αCD3 (1 мкг/мл пластины покрытием) + αCD28 (1 мкг/мл растворимый), PMA (20 нг/мл) + Ionomycin (500 нг/мл). Supernatants культуры были собраны после 48 ч и обрабатываются как описано в разделе 1.3.
- полностью растаять любой ранее замороженных биологических образцов на льду и вихрь кратко перед использованием. Избежать более чем 2 циклов замораживания/оттаивания.
2. Подготовка реагента
- Sonicate Preparation of Pre-mixed Antibody-Immobilized бусины бусины и предварительно смешанные флакон 1 мин в sonicator ванне при комнатной температуре и затем вихрь 30 s до использования. Если не sonicator Ванна, увеличить время вихря до 1 мин
- Подготовка мыть буфера
- принести 20 x мыть буфера (20 x PBS с 1% Tween-20) поставляется с комплектом для комнатной температуры и вихревой довести все соли в раствор.
- Развести 25 мл 20 x мыть буфер с 475 мл деионизированной водой. Неиспользованная часть магазина от 2 ° C до 8 ° C на срок до одного месяца.
- Подготовка матрицы B (для использования с сыворотки и плазмы образцы только)
- Добавить 5,0 мл Assay Buffer (PBS с 1% BSA) входит в комплект к бутылке, содержащую лиофилизированные матрица B. разрешить по крайней мере 15 мин для полного reconst itution, затем Вортекс для хорошо перемешайте. Остатки восстановленные матрица B может храниться на ≤-70 ° C на срок до одного месяца.
3. Стандартный подготовки
Примечание: каждый аналита в этой панели есть топ стандартной концентрации 10 000 пг/мл.
- Добавить 250 мкл аналитического буфера для воссоздания лиофилизированные мыши й цитокина стандартных коктейль. Смешать, кратко vortexing и позволяют флакона сидеть при комнатной температуре на 10 мин
- Полипропиленовые microcentrifuge трубки помечены передать стандартные коктейль " C7 ". Это будет использоваться в качестве стандартной верхней.
- Трубы полипропиленовые microcentrifuge метка 6 как C6, C5, C4, C3, C2 и C1.
- Добавить 75 мкл аналитического буфера для каждого из этих трубок.
- Передачи 25 мкл Топ стандартные C7 C6 трубки и смесь хорошо, vortexing. Это будет стандартом C6.
- Продолжить выполнение последовательного разведения 1:4 с помощью новой накапайте подсказка для каждой трубы для добавления 25 мкл предыдущего стандарта 75 мкл аналитического буфера в следующий низкие стандартные трубки, следуют vortexing для получения стандартов C5, C4, C3 , C2 и C1. Используйте Assay Buffer стандартно 0 пг/мл (C0).
4. Образец разведения
Примечание: предварительные экспериментальных эксперименты, используя этот assay с несколькими разведениях может потребоваться для определения наиболее подходящей фактор разведения для конкретного набора биологических образцов. Фактор надлежащего разбавления будет производить расчеты концентрации для образца, которые лежат в пределах стандартной кривой. Следующие действия предназначены в качестве руководства и могут иметь определяется эмпирически в зависимости от типа образца.
- Развести сыворотки или плазмы образцы секционное с Assay Buffer (например. разбавить 50 мкл пример с 50 мкл аналитического буфера) в трубы полипропиленовые microcentrifuge.
Примечание: Если требуется дальнейшее разведение образца, разведения должно быть сделано с матрицы B вместо пробирного буфера для обеспечения точных измерений. Добавление образцов сыворотки или плазмы без разбавления приведет к низкой пробирного точность и может засорить фильтр пластины. Матрица B состоит из пула мыши сыворотки, обедненный эндогенного пробирного целей. Он используется в качестве образца сыворотки или плазмы разбавителя избежать матрица эффектов, которые известны влияют Аналитическая чувствительность иммуноанализа. - Тест ячейка супернатанта образцов культуры без разбавления.
Примечание: Уровень исследуемое вещество может варьироваться от образец. При необходимости разбавить супернатанта образцы с использованием свежих подготовки их соответствующих клеток культуры среднего или Assay Buffer.
5. Процедура анализа
Примечание: assay может быть выполнена в полипропиленового фильтра плиты, трубы микро СУИМ или V-дно планшет. Процедура анализа пластины фильтра рекомендуется из-за хороший пример для последовательности, пробирного надежность и удобство в использовании. Эта процедура требует блока вакуумной фильтрации для мытья (предоставляемые конечного).
- Разрешить все реагенты в теплой комнатной температуре (20-25 ° C) перед использованием.
- Набор фильтра плиты на Перевернутый покрытие во все времена во время анализа установки и инкубации шаги, так что в нижней части пластины не трогать любой поверхности, как это может вызвать утечку.
- Держать upright пластину во время всего пробирного процедуры, включая стиральные шаги, чтобы избежать потери бусины.
- Держите пластины в темной или завернутый с алюминиевой фольги для всех шагов инкубации.
- Запускать все стандарты и образцы как дубликаты, организовал на плите в последовательном порядке.
- Предварительно намочить пластину фильтр, добавив 100 мкл 1 x мыть буфер для каждой скважины и пусть это сидеть в течение 1 мин при комнатной температуре (если используется фильтр дно микроплита).
- Объем буфера удалить с помощью вакуумного коллектора (5-10 s). Не превышать 10 " Hg вакуума. Помарки избыток мыть Буфера от нижней части пластины, нажав пластину в стеке чистой бумажные полотенца. Место пластину на верхней крышке Перевернутый пластины.
Примечание: Шаги 5.1-5.2 может быть опущено, если выполнение анализа с помощью V-дно Гонав или микро труб СУИМ. - Для супернатанта образцы культуры клетки, добавить 25 мкл аналитического буфера для всех скважин. 25 мкл каждого стандарта, для стандартной скважины. Добавить 25 мкл каждого образца образца Уэллс.
- Для измерения образцов сыворотки или плазмы, добавить 25 мкл матрица B Стандартный скважин. Добавьте 25 мкл аналитического буфера выборки скважин. 25 мкл каждого стандарта, для стандартной скважины. 25 мкл каждого разреженных сыворотки или плазмы образца образца лунки.
- Вихрь смешанный Бусины для 30 s. Добавить 25 мкл смешанных бусы для каждой скважины, встряхивая бутылку шарик с перерывами, чтобы избежать шарик урегулирования. Окончательный объем должен быть 75 мкл в каждой скважине после добавления бисера.
- Уплотнение пластины с sealer пластины. Оберните всю тарелку, включая крышку Перевернутый пластины, с алюминиевой фольгой. Поместите пластины на пластину шейкер, зафиксируйте его и поколебать на приблизительно 500 об/мин – 2 ч при комнатной температуре. Для предотвращения утечки, действуют не под положительным давлением для sealer пластины.
- Без инвертирования, место пластину на вакуумный коллектор и применять вакуум как раньше и 200 мкл 1 x мыть буфер для каждой скважины.
- Удалить содержимое пробирного тарелка скважин, вакуумной фильтрации. Помарки избыток мыть буфер из нижней части пластины с Впитывающим вкладышем или бумажные полотенца. Повторите этот шаг еще раз.
Примечание: Если генотипирования с помощью V-дно Гонав или микро СУИМ трубки пропустить шаги 5.12 и 5.13. Вместо этого центрифуга пластину на 1000 x g 5 мин при комнатной температуре, а затем удалить супернатант с помощью многоканальных дозаторов. - Добавить 25 мкл обнаружения антител (см. таблицу материалов) к каждой скважине.
- Уплотнение пластины с свежий пластины герметик. Обернуть весь пластины, включая крышку Перевернутый пластины, с алюминиевой фольгой.
- Место пластины на пластину шейкер и погрозит приблизительно 500 об/мин за 1 ч при комнатной температуре.
- Без очистки, добавить 25 мкл Реагента SA-PE непосредственно в каждой скважине. Нет растворения реагента необходимо.
- Уплотнение пластины с свежий пластины герметик. Обернуть весь пластины, включая крышку Перевернутый пластины, с алюминиевой фольгой.
- Место пластины на пластину шейкер и погрозит приблизительно 500 об/мин за 30 мин при комнатной температуре.
- Повторите шаг выше 5.13.
- Добавить 200 мкл 1 x мыть буфер для каждой скважины. Вновь приостановить бусы на шейкере пластину за 1 мин
- С помощью многоканальные пипетки, передавать образцы от пластины фильтра СУИМ трубы для чтения образцы на проточный цитометр.
Примечание: Объем образца может быть увеличена с 200 мкл до 300 мкл, добавив дополнительные 100 мкл 1 x мыть буфер для каждой трубы, чтобы избежать образец работает сухой. Если необходимые образцы можно хранить при 4 ° C, защищенном от света и проанализированы следующий день. Однако, длительное образца хранения может привести к сокращению сигнал.
6. Потока цитометр Set-up
Примечание: с целью получения достоверных данных, проточный цитометр необходимо правильно настроить до сбора данных. Этот процесс будет отличаться для отдельных пользователей в некоторых отношениях в зависимости от конфигурации конкретного инструмента, выполненных на пробу. Ниже рассматривается процесс обобщенной установки для цитометр возможность измерить PE и APC и оборудованные с обоими 488 и 633 нм лазер.
- Запуск потока цитометр и приобретение программного обеспечения по заявлению производителя ' s инструкции с инструмента. Участок в
- создать точку с FSC (вперед разброс) на оси x и ККК (сторона разброс) для оси y. Установить линейный режим FSC и SSC.
- Создание второй участок точка с PE на оси x и APC для оси y. Этот участок следует установить в режим отображения на основе журнала.
- Vortex флакон сырья бисера в комплект для 30 s вновь приостановить бисер. Эти бусы содержат внутреннего окрашивания APC и состоят из двух размер популяций.
- Передачи 400 мкл сырье бусы для новой трубки СУИМ.
- Установить низкий расход потока цитометр.
- Запуска сырья бусы, тщательно регулируя усиление и напряжения для КФН и SSC так, что обе размер популяции этих бусин заметно разлученных и легко ворот.
- Настроить FSC порог, чтобы исключить нежелательные события (т.е. мусора или воздушных пузырьков).
- Участок в FSC против SSC, нарисуйте ворот, который включает в себя все население шарик.
Примечание: Сырье бусины содержат две популяции Размер бисера, меньшего " бисер " и больше " B шарик " регионы. - Отображение условного шарик населения от участка FSC против SSC на втором участке точка с PE на оси x и APC для оси y.
- Настроить ПЛТ напряжения для канала флуоресценции APC, так что APC сигнал для всех шарик населения имеет средний флуоресценции интенсивности (МРИ), которая лежит между 1 x 10 1 и 5 x 10 3.
- Vortex флакон установки PE Бусины для 30 s вновь приостановить бусины.
- Передачи 400 мкл PE Бусины для новой трубки СУИМ.
- Заменить сырье бусины пробки от проточный цитометр с PE бусины пробки.
- Настроить фотоэлектронный умножитель напряжения трубки (ПЛТ) для PE флуоресценции канала настройки так, что ФГИ PE бусины падает между много отдельных диапазон найдено перечислены на флаконе бусины PE.
Примечание: Бусины установки PE содержат Бусы Размер одной популяции (" бусы " только).
7. Сбора данных
Примечание: точные процедуры, связанные с приобретением данных по данному инструменту может варьироваться и зависит от цитометр ' s конфигурации спецификации и используемого программного обеспечения интерфейс. Поэтому приведенные ниже предназначены для выделить необходимые шаги в assay независимо от цитометр, занятых в assay.
- Установите скорость потока цитометр все еще низкий.
- Задать количество бисера событий быть приобретено около 300 на исследуемое вещество. Для 13-plex группа это приравнивается к приобретению 3900 события комбинированные из совокупностей Размер бисера (A + B бусины).
- Водоворот каждого образца для 5 s перед анализом. Образцы
- чтения. При чтении образцы, сначала установите проточный цитометр режим установки и ждать, пока шарик населения стабилизировалась перед переключением в режим приобретения.
- Использовать простые имена с подряд нумерация файлов данных для облегчения анализа данных.
- Экспорт только условным события (A + B шарик регионов) вместо всего событий.
- Хранить все ФТС файлы в той же папке для каждого анализа. Если запущено несколько анализов, создать отдельную папку для каждого пробирного.
Примечание: ФТС файлы, созданные на проточный цитометр должны быть проанализированы с использованием программного обеспечения анализа данных, которые можно скачать бесплатно 14.
- Установить программное обеспечение для анализа данных на ПК.
- Передачи всех пробирного FCS файлов на компьютер, содержащий программное обеспечение анализа.
- Вилка лицензионного ключа ключ (входит в комплект) к USB-порту компьютера,.
- Запустите программное обеспечение для анализа данных.
- Нажмите синюю " добавить файлы ", расположенную в верхней части экрана.
- Перейдите к папке, содержащей файлы FCS из assay в всплывающее окно, которое появляется.
- Нажмите и перетащите все пробирного ФТС файлы из всплывающее окно для отображения программного обеспечения. Все файлы должны теперь появляются в списке.
- Щелкните зеленый " Следующая " кнопку в правом нижнем углу экрана. Щелкните левой кнопкой мыши и удерживайте, чтобы перетащить небольшой синий калибровочной кривой их соответствующие файлы FCS кнопок (C7 до C0) из списка для определения стандартной кривой.
- Щелкните зеленый " Следующая " кнопку в нижнем правом углу дисплея, чтобы открыть стробирования шипучки вверх по окну.
- На левой стороне окна стробирования введите имена как A и B шарик регионов пробирного аналита целей и их связанные шарик ID (найдены в руководстве, поставляемом с assay) в порядке возрастания.
- Выберите стробирования инструмент из верхней части всплывающее окно и использовать его для рисования 2 ворота в заговоре FSC против SSC, один вокруг A шариков и второй вокруг шариков Б.
- Обзор APC против PE точечные которые появляются ниже участок FSC против SSC, которые появляются. Там будет 6 полос аналита в A бусины (левый график) и 7 полос аналита в B бусины (правый сюжет).
Примечание: Ворота могут быть повторно перетаскиваются, вручную, выбрав инструмент «Ластик» в верхней части и щелкнув Удалить данный ворот. Шлюзовые инструмент могут затем выбраны и использоваться вручную применить ворота в регионе нужный диапазон. - Щелкните зеленый " ОК " кнопку, чтобы закрыть стробирования всплывающее окно и вернуться к списку файлов FCS.
- Определить любые разведений, которые были сделаны для биологических образцов по праву щелкнув данный файл, выбрав " разбавления раз " от меню и ввода правильного значения.
- Щелкните зеленый " запуска " кнопку в правом нижнем углу дисплея, чтобы генерировать стандартные кривые для анализа и расчета концентраций неизвестных биологических образцов.
Результаты
Этот протокол демонстрирует, как на основе бисера иммуноанализа платформа может использоваться для одновременно quantitate профили цитокинов из биологических образцов с помощью проточный цитометр. Биологические образцы, используемые в этом примере были supernatants культуры клеток от splenocytes мыши, которые были ранее инкубировали при различных условиях активации, хотя формат пробирного также были утверждены для использования с образцами сыворотки или плазмы.
Данные, полученные от анализа используются для создания стандартных кривых для всех аналитов в мультиплексированном панели. Программное обеспечение для анализа данных классифицирует каждого конкретного исследуемое вещество, основанный на уникальный БУСИНА размером и интенсивностью APC и количественно их с помощью репортера PE. Динамические ряды, а также чувствительность assay демонстрируются когда наносятся на шкале log-log – на рисунке 2A. Программное обеспечение использует данные анализа и алгоритм установки 5-параметр кривой точно рассчитать не только концентрации аналитов в пользователя предоставляется биологических образцов, но и пределы обнаружения на обоих высокого и низкого конца всех стандартных кривых (Таблица 1 ). Формат, описанный в настоящем Протоколе также обеспечивает высокую прочность пробирного точность. В рисунке 2B и 2 C данные представлены с изображением внутри пробирного изменчивость каждого аналита. Два отдельных стандарта белка концентрации (высокая и низкая) были проанализированы в одном assay с 16 репликация для каждого образца. Рисунок 2 c и 2D представляют изменчивость между анализами целевой аналитов от трех независимых анализов. Как с интра пробирного точность экспериментов, высоких и низких стандартной концентрации были проанализированы с 3 реплицирует в каждом из независимых экспериментов. Отчетливо виден минимальный изменчивость в расчетные концентрации белков-мишеней.
Для того, чтобы продемонстрировать полезность на основе бисера гранулярных анализов в опрашивания профили выражение cytokine, splenocytes мыши инкубировали при различных условиях активация. Помимо элемента кератоз клетки инкубировали также с ПЛАСТИНОК, анти CD3/анти CD28 антитела, или phorbol 12-миристат 13-ацетат и ionomycin. Supernatants культуры клеток были собраны 48 h позже и Оксиметрический анализ с помощью панели мыши T вспомогательный цитокина. Количественная оценка результатов этого эксперимента представлены на рисунке 3 и эффект стимуляции условий на концентрации цитокинов четко разграничены.
Результаты описанных выше являются типичными, поскольку экспериментатор имеет надлежащей лабораторной техники и соответствует протокол предоставленный assay. Источники ошибок в этом формате пробирного могут возникнуть от отклонений в инкубации раз, реагент томов, Стиральная, или неправильной настройки ПМТ на проточный цитометр, используются для анализа образцы. В рисунке 4A разброс участок от успешного анализа показывает 2 различных шарик популяций, которые четко определены. Это может быть сравнено к Рисунок 4B, где плохое мытье и протокол присоединения привели к шарик агрегатов, которые стирают две популяции. Кроме того как свидетельствует мусора в нижнем левом квадранте, Общая цитометр события были экспортированы для анализа, а не предпочтительный формат только условным событий. Надлежащего цитометр Настройка имеет решающее значение для создания надежных данных в этот assay. В рисунке 4 c надлежащего ПЛТ параметры позволяют для разрешения каждого из 6 аналитов в канале классификации APC. Неправильное ПЛТ параметров приведет к данных аналогична представлены в Рисунок 4 d где БТР канал имеет шарик населения с перекрывающимися классификации света. Это лишит assay, поскольку он будет невозможно рассчитать концентрации аналита без четко определенной популяции пробирного бусины.
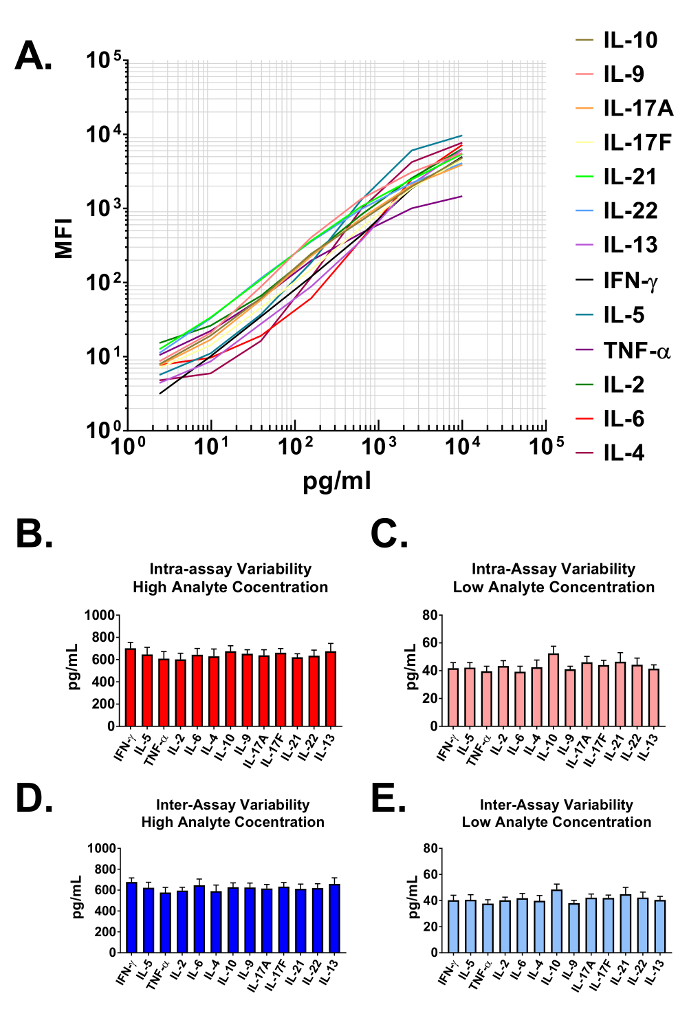
Рисунок 2: стандарт диапазонов кривой и точность Assay. (A) представитель калибровочной кривой с помощью панели мыши T вспомогательный цитокина. Калибровочной кривой должна выполняться с каждой assay. (B-C) Внутри пробирного точность. Две пробы с различной концентрации целевых белков (высокая и низкая) были проанализированы в одном assay с 16 репликация для каждого образца. Данные представлены в виде mean + стандартное отклонение. (D-E) Точность между анализами. Две пробы с различной концентрации целевых белков (высокая и низкая) были проанализированы в трех независимых анализов с 3 репликация для каждого образца. Данные представлены в виде mean + стандартное отклонение. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
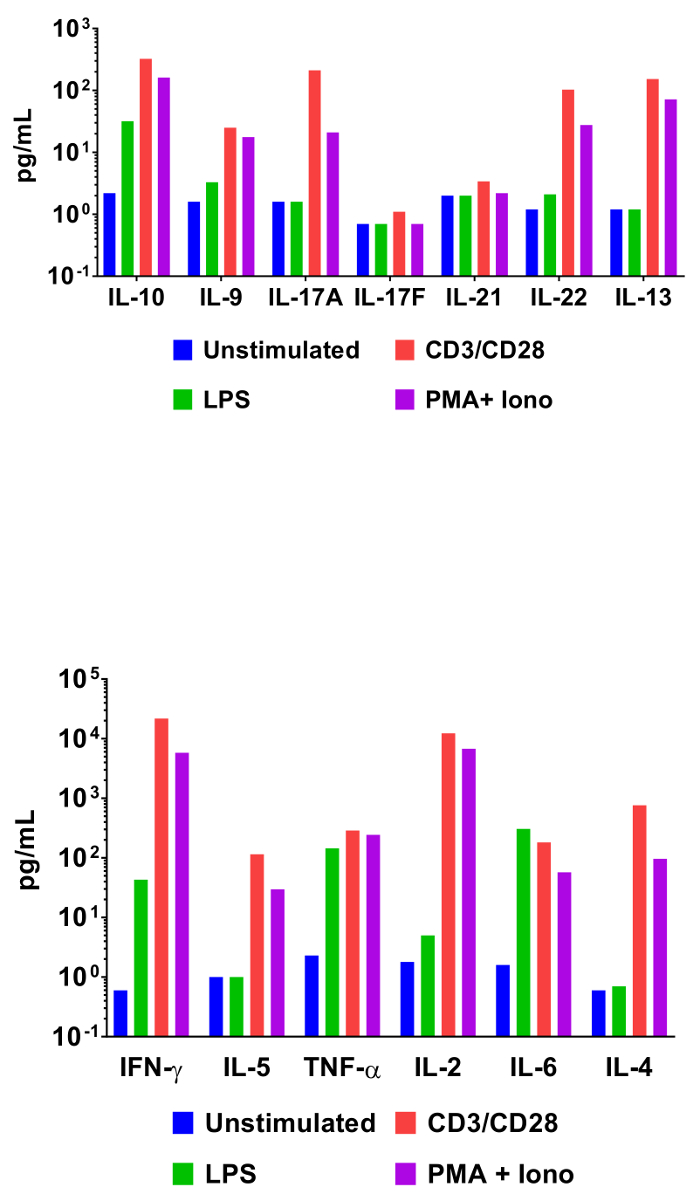
Рисунок 3: количественная оценка результатов представитель. Мышь splenocytes (1 х 106 клеток) были культивировали при 37 ° C + 5% CO2 при различных условиях: кератоз, LPS (100 нг/мл), αCD3 (1 мкг/мл пластины покрытием) + αCD28 (1 мкг/мл растворимый), PMA (20 нг/мл) + Ionomycin (500 нг/мл). Supernatants культуры были собраны после 48 ч, затем количественно с помощью панели мыши T вспомогательный цитокина. Дифференциальный цитокина выражение профили в ответ на стимуляцию условий, четко видны. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: результаты от успешных против неудачной Assays. (A) успешные анализы будут иметь собственный шарик население для населения микросфер. (B) неудачной анализов будет иметь разделения бедного населения, агрегаты шарик и слишком много собранных событий. (C) успешно анализов четко определили интенсивностей в канале флуоресценции классификации, которая легко ворот и количественной оценки. (D) неудачной анализов будут плохо расстались и интенсивности классификации, которые перекрывают несколько шарик населения, что затрудняет количественную оценку. Многие из этих ошибок можно избежать путем тщательного соблюдения протокол assay. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Калибровочной кривой | Чувствительность (ПГ/мл) | ||||
| Аналита | Fit формула | РЕЗЮМЕ | R2 | Мин. | Макс. |
| ИФН Γ | 5-P.log(4.43, 14.40, 0.54, 9.11, 0.01) | 1.77% | 0.99 | 2.1 | 18105.0 |
| IL-5 | 5-P.log(4.36, 12.68, 0.64, 5.73, 0.36) | 1.32% | 1 | 1.9 | 14514.0 |
| ФНО Α | 5-P.log(4.36, 11.63, 0.79, 5.45, 0.37) | 1.48% | 0.99 | 1.9 | 20109.0 |
| ИЛ-2 | 5-P.log(4.46, 12.62, 0.78, 5.07, 0.34) | 1,34% | 1 | 1.9 | 25109.0 |
| IL-6 | 5-P.log(4.58, 11.66, 0.64, 5.77, 0.37) | ||||
Таблица 1: стандартные кривой и чувствительность Assay. Программное обеспечение для анализа данных был использован для создания стандартных кривых для всех аналитов, содержащихся в мультиплекс assay. Это полностью автоматизированный анализ применяет надежные 5-параметр кривой алгоритм для разбавления серии стандартов от пробирного и был также использован для определения анализа чувствительности с использованием теоретических пределов обнаружения.
Обсуждение
Пробирного формат, описанный в настоящем Протоколе может обеспечить надежной количественной оценки растворимых посредника профилей в биологических образцах, предоставляемых экспериментатор имеет надлежащей лабораторной техники и придерживается рекомендуемый протокол.
Есть несколько ключевых шагов, которые необходимо соблюдать, с тем чтобы гарантировать надежные результаты. Во-первых рекомбинантных стандартов должно быть разрешено в буфере пробирного полный время рекомендовал, и после того, как только разводят в полипропиленовые трубы. Полистирольные трубы могут содействовать присоединению белков к стенке трубы, которые могут привести к низким сигналов при генерации калибровочной кривой. Во-вторых, надлежащего пожимая во время инкубации шаги имеет решающее значение. Без надлежащего агитации можно серьезно препятствуют характеристики привязки пробирного бусины. Кроме того требуется также надлежащее Стиральная между шагов инкубации. Экспериментатор необходимо убедиться, что избыток реагентов удаляются из скважин до начала следующий шаг в протоколе. Также должны быть оптимизированы параметры инструментов для проточный цитометр допроса пробирного бусины. В частности PMT параметры должны быть скорректированы для обеспечения надлежащего шарик разделения и широкий динамический диапазоны для стандартных кривых. Наконец просто до анализируются на цитометр, бусины должны быть vortexed для обеспечения надлежащего подвеска и во избежание формирования агрегатов, которые могут исказить результаты.
Этот протокол потенциально может быть изменен для анализа гомогенатах ткани, а также типы образца, обсуждается в этой рукописи, условии исследователь хочет оптимизировать их лизис протокол до выполнения анализов большой, полную тарелку. Фактический метод будет варьироваться в зависимости от типа ткани; Однако в общем протоколе следует использовать нейтральный pH буфер, содержащий физиологические концентрации ионных солей, не денатурируя химических веществ и желательно без моющих средств. Если необходимо использовать моющее средство, не ионных концентраций детергентов должны храниться как минимум (например не более 1%). Буфер должен также содержать достаточную ингибиторы протеазы для предотвращения протеолитических деградации белков-мишеней. Независимо от того, используемый протокол лизиса окончательной подготовки следует центрифугировали для удаления частиц до анализа.
Что касается анализа ограничения концентрации аналита целей в биологических образцов типов может сильно различаться. Для того, чтобы правильно измерить концентрации аналита, они должны находиться в верхней и нижней значения для стандартной кривой. Экстраполяция значений кривой надежен не обязательно и не рекомендуется. Поэтому следователи необходимо оптимизировать разбавления их конкретных образцов в пилотных экспериментов перед запуском пробирного полный пластины. Кроме того тщательная подготовка биологических образцов для быть assayed имеет первостепенное значение для успеха этого анализа формата. Образцы, которые являются lipemic, опаковые или содержат белок мусора будет влиять на взаимодействий антиген антитела, которые определяют основной принцип этой иммуноанализа и визуализации результатов, которые являются нечитаемое.
Этот assay имеет важное значение в отношении существующих методов количественной оценки по нескольким причинам. При правильной, пробирного формат может quantitate до 13 аналитов от образца, используя намного меньшие объемы чем необходимо будет анализировать образец, используя традиционные assays ELISA. Этот assay формат также не требует специального инструментария для того, чтобы быть выполнена. Это преимущество по сравнению с другими коммерчески доступных на основе бисера иммуноанализа как assay может выполняться с использованием любое количество часто используемых потока цитофлуориметрами.
Научные расследования роль играют секретируемые факторов и цитокина сетей в области здравоохранения и болезни расширяется. Пробирного формат, описанный в этой рукописи может быть ценным инструментом для исследователей, стремящихся понять этих многоплановых и сложных явлений. Активные биомедицинских исследовательских программ начинают изучать роль цитокинов сетей не только областей таких как обобщенные воспаление6, но и в контексте конкретных заболеваний государств, таких как атеросклероз, рак и neuroinflammation 15,16,17. Несомненно расследование будет продолжать расти в таких областях, как поиск Роман терапии для лечения этих хронических расширяет. Потребность в точной и надежной количественной оценки растворимых медиаторов, связанных с этими заболеваниями будет оставаться приоритетной критических исследований.
Раскрытие информации
Авторы являются сотрудниками BioLegend, которая производит реагентов, описанные в этой рукописи. Vigene Tech, Inc. разработали программное обеспечение анализа данных LEGENDplex, которая используется для анализа данных, созданный из анализа, описанный в этой рукописи.
Благодарности
Авторы хотели бы признать вклад биомаркеров и иммуно анализов команды разработчиков продукта на развитие assay. Кроме того мы хотели бы поблагодарить Vigene Tech, Inc. за их совместные усилия в разработке пакетов программного обеспечения анализа данных.
Материалы
| Name | Company | Catalog Number | Comments |
| Allegra 6R Centrifuge with MICROPLUS Carrier Adaptor | Beckman Coulter | 366816 | For LEGENDplex assays is run in microtubes, V-or U-bottom 96-well plate (optional) |
| LEGENDplex Mouse T helper Cytokine Panel | BioLegend | 740005 | Multiplex Immunoassay (13-plex) |
| Anti-mouse CD3ε antibody | BioLegend | 100314 | Clone 145-2C11, low endotoxin, azide free format |
| Anti-mouse CD28 antibody | BioLegend | 102112 | Clone 37.51, low endotoxin, azide free format |
| Vacuum Pump | EMD Millipore | WP6111560 | For LEGENDplex assays using filter plates (recommended) |
| Vacuum Manifold | EMD Millipore | MSVMHTS00 | For LEGENDplex assays using filter plates (recommended) |
| Sterile Disposable Reagent Reservoirs | Fisher Scientific | 07-200-130 | Or equivalent |
| Polypropylene MicroFACS Tubes | Fisher Scientific | 11-842-90 | For LEGENDplex assays is run in microtubes, V-or U-bottom 96-well plate (optional) |
| Pipette Kit | Fisher Scientific | 14-388-100 | Four pipette sizes (0.2-2µL, 2-20µL, 20-200µL, 100-1000µL) |
| Multi-Channel Pipette | Fisher Scientific | FA10011G | capable of dispensing 5 μL to 200 μL |
| Microplate Shaker | Fisher Scientific | 88880023 | Or equivalent |
| Microcentrifuge | Fisher Scientific | 75002410 | Or equivalent |
| FACS tubes | Fisher Scientific | NC9885747 | 12 x 75 mm round bottom |
| PMA (Phorbol 12-myristate 13-acetate) | Sigma-Aldrich | P8139 | |
| Lipopolysaccharide (LPS) | Sigma-Aldrich | L-8274 | Escherichia coli O26:B6 |
| Ionomycin | Sigma-Aldrich | I0634 | |
| Branson B200 Ultrasonic Cleaner | Sigma-Aldrich | Z305359 | Or equivalent |
| Microcentrifuge tubes | Sigma-Aldrich | Z666505 | 1.5 mL polypropylene tubes |
| Flow Cytometer | Various | Various | Cytometer equipped with single laser (488nm blue) or two lasers (488nm blue or 532nm green + 633nm Red) capable of reading emission wavelengths at 575nm and 660nm |
| 96-Well Polypropylene Plate | VWR | 82050-662 | For LEGENDplex assays is run in microtubes, V-or U-bottom 96-well plate (optional) |
Ссылки
- Stanley, A. C., Lacy, P. Pathways for cytokine secretion. Physiology (Bethesda). 25, 218-229 (2010).
- Nicola, N. A. Cytokine pleiotropy and redundancy: a view from the receptor. Stem Cells. 12, (1994).
- Miyajima, A., Hara, T., Kitamura, T. Common subunits of cytokine receptors and the functional redundancy of cytokines. Trends Biochem Sci. 17, 378-382 (1992).
- Costantini, S., Castello, G., Colonna, G. Human Cytokinome: a new challenge for systems biology. Bioinformation. 5, 166-167 (2010).
- Capone, F., et al. Serum Cytokinome Profile Evaluation: A Tool to Define New Diagnostic and Prognostic Markers of Cancer Using Multiplexed Bead-Based Immunoassays. Mediators Inflamm. , 3064643 (2016).
- Schett, G., Elewaut, D., McInnes, I. B., Dayer, J. M., Neurath, M. F. How cytokine networks fuel inflammation: Toward a cytokine-based disease taxonomy. Nat Med. 19, 822-824 (2013).
- Tse, E., Kwong, Y. L. T-cell lymphoma: Microenvironment-related biomarkers. Semin Cancer Biol. 34, 46-51 (2015).
- Reale, M., Greig, N. H., Kamal, M. A. Peripheral chemo-cytokine profiles in Alzheimer's and Parkinson's diseases. Mini Rev Med Chem. 9, 1229-1241 (2009).
- Vistnes, M., Christensen, G., Omland, T. Multiple cytokine biomarkers in heart failure. Expert Rev Mol Diagn. 10, 147-157 (2010).
- Gobel, K., et al. Blood coagulation factor XII drives adaptive immunity during neuroinflammation via CD87-mediated modulation of dendritic cells. Nat Commun. 7, 11626 (2016).
- Palm, A. K., Friedrich, H. C., Kleinau, S. Nodal marginal zone B cells in mice: a novel subset with dormant self-reactivity. Sci Rep. 6, 27687 (2016).
- Yu, Y., et al. The transcription factor Bcl11b is specifically expressed in group 2 innate lymphoid cells and is essential for their development. J Exp Med. 212, 865-874 (2015).
- Pelly, V. S., et al. IL-4-producing ILC2s are required for the differentiation of TH2 cells following Heligmosomoides polygyrus infection. Mucosal Immunol. 9, 1407-1417 (2016).
- . LEGENDplex Multiplex Assays Available from: https://www.biolegend.com/legendplex (2017)
- Autieri, M. Pro- and anti-inflammatory networks in atherosclerosis. ISRN Vascular Medicine. 2012, (2012).
- West, N. R., et al. Emerging cytokine networks in colorectal cancer. Nat Rev Immunol. 15, 615-629 (2015).
- Becher, B., Spath, S., Goverman, J. Cytokine networks in neuroinflammation. Nat Rev Immunol. 17, 49-59 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены