Method Article
Um material fantasma estável para imagens ópticas e acústicas
Neste Artigo
Resumo
Este protocolo descreve a fabricação de um material simulador estável e biologicamente relevante para aplicações de imagens biomédicas ópticas e acústicas, apresentando propriedades acústicas e ópticas ajustáveis independentemente.
Resumo
Estabelecer materiais simuladores biofotônicos que mimetizam tecidos e que forneçam estabilidade a longo prazo são imperativos para permitir a comparação de dispositivos de imagem biomédica entre fornecedores e instituições, apoiar o desenvolvimento de padrões reconhecidos internacionalmente e auxiliar a tradução clínica de novas tecnologias. Aqui, é apresentado um processo de fabricação que resulta em um material copolímero em óleo estável, de baixo custo e que imita tecidos para uso em esforços de padronização fotoacústica, óptica e ultrassônica.
O material base consiste em óleo mineral e um copolímero com números definidos do Chemical Abstract Service (CAS). O protocolo aqui apresentado produz um material representativo com velocidade do som c(f) = 1.481 ± 0,4 m·s-1 a 5 MHz (corresponde à velocidade do som da água a 20 °C), atenuação acústica α(f) = 6,1 ± 0,06 dB·cm-1 a 5 MHz, absorção óptica μ a(λ) = 0,05 ± 0,005 mm-1 a 800 nm, e espalhamento óptico μs'(λ) = 1 ± 0,1 mm-1 a 800 nm. O material permite sintonia independente das propriedades acústicas e ópticas, variando, respectivamente, a concentração do polímero ou espalhamento de luz (dióxido de titânio) e agentes absorventes (corante solúvel em óleo). A fabricação de diferentes desenhos de fantasmas é exibida e a homogeneidade dos objetos de teste resultantes é confirmada usando imagens fotoacústicas.
Devido ao seu processo de fabricação fácil e repetível e durabilidade, bem como suas propriedades biologicamente relevantes, a receita do material é altamente promissora em iniciativas multimodais de padronização acústico-óptica.
Introdução
Estabelecer a precisão e a acurácia de novos biomarcadores de imagem óptica por meio de validação técnica 1,2 é fundamental para garantir sua implementação bem-sucedida na prática clínica. Para tanto, os estudos de validação técnica empregam frequentemente simuladores físicos duráveis, que facilitam a avaliação de desempenho interinstrumentos e o controle de qualidade rotineiro. Para o uso generalizado de um material fantasma em pesquisa e tradução clínica, um protocolo de fabricação simples e altamente reprodutível é necessário. Um material simulador biofotônico ideal deve incluir as seguintes propriedades3: (1) propriedades ajustáveis independentemente dentro de intervalos biologicamente relevantes; (2) robustez mecânica; (3) estabilidade a longo prazo; (4) flexibilidade em geometria e arquitetura; (5) manuseio seguro; (6) ingredientes amplamente disponíveis que podem ser comprados de fornecedores científicos padrão; e (7) baixo custo. Atualmente, as aplicações biofotônicas carecem de um protocolo padronizado para um material simulador amplamente aceito que atenda aos requisitos descritos e também inclua propriedades acústicas ajustáveis para aplicações híbridas, como imagens fotoacústicas (PAI).
Materiais simuladores biologicamente relevantes e direcionados para aplicações ópticas e acústicas combinadas incluem hidrogéis 4,5, álcool polivinílico (PVA)6,7,8,9 e plastisol de cloreto de polivinila (PVCP)10,11,12,13,14,15,16 . No entanto, esses materiais são caracterizados por certas limitações que restringem sua aplicação como um material simulador estável. Os hidrogéis, por exemplo, são propensos à desidratação, danos mecânicos e crescimento bacteriano, limitando sua vida de prateleira17,18,19. A adição de produtos químicos pode aumentar a longevidade, mas conservantes comuns, como formaldeído20 ou cloreto de benzalcônio21, são perigosos e requerem medidas de precaução durante o manuseio. Além disso, alvos contendo corantes solúveis em água podem se difundir dentro do material base se não forem encapsulados. Os criogéis de PVA caracterizam-se por maior longevidade e robustez estrutural, mas seu processo de preparação envolve longos ciclos de congelamento-descongelamento22. Isso pode limitar a sintonia independente dos parâmetros acústicos e ópticos23 e, se ligeiramente variado, pode levar a inomogeneidades6, comprometendo a reprodutibilidade. Além disso, a difusão de corantes a partir de inclusões tem sido observada após 1 ano13. O PVCP possui um complexo processo de fabricação que inclui altas temperaturas de até 180-220 °C 13,14,24,25. O PVCP também sofre com a falta de uma cadeia de suprimentos com fornecedores científicos26 e pode conter plastificantes à base de ftalatos, que podem causar danos reprodutivos e de desenvolvimento27, tornando-os substâncias controladas em alguns países.
Composições de copolímero em óleo, como cera gel 28,29,30,31 ou blendas à base de elastômeros estirênicos termoplásticos 32,33,34,35,36, apresentam boa estabilidade longitudinal e propriedades acústicas e ópticas semelhantes às tecidos 31,35,36,37, tendo assim alto potencial como candidato fantasma durável em aplicações multimodais. Além disso, essa classe de material é custo-efetiva, não absorvedora de água, atóxica e biologicamente inerte35,38. A velocidade do som c(f) e o coeficiente de atenuação acústica α(f) podem ser ajustados em uma faixa biologicamente relevante (Tabela 1) pela variação da concentração do polímero 33,35,39, enquanto os coeficientes de absorção óptica μa(λ) e de espalhamento reduzidoμ s'(λ) podem ser primariamente variados pela adição de corantes solúveis em óleo ou dióxido de titânio (TiO2)39, respectivamente.
Aqui, um protocolo simples e fácil de seguir é apresentado para a criação de simuladores duráveis de copolímero em óleo, adequados para uso em calibração óptica, ultrassônica ou de dispositivos fotoacústicos. Todos os ingredientes têm números definidos do Chemical Abstract Service (CAS) e estão prontamente disponíveis em fornecedores científicos padrão. Potenciais dificuldades no processo de fabricação são destacadas e formas de superá-las são apresentadas. Enquanto o protocolo permite a fabricação de materiais com uma gama de propriedades acústicas e ópticas, o protocolo apresentado produz um material com uma velocidade de som de ~1.481 m·s-1, alinhando-se com a velocidade do som da água à temperatura ambiente (20 °C)40. Esse valor foi selecionado como padrão neutro para representar a ampla gama de propriedades teciduais existentes (Tabela 1), permitindo o estabelecimento de um ponto de referência consistente e confiável para comparação. Ao fornecer este protocolo detalhado, pretendemos ampliar a reprodutibilidade de absorção e fabricação deste promissor tipo de material simulador, facilitando assim estudos de validação biofotônica, acústica e fotoacústica e apoiando o controle de qualidade de rotina em aplicações de imagem pré-clínica e clínica.
Protocolo
Tabela 1: Visão geral das propriedades acústicas e ópticas encontradas nos tecidos moles. As propriedades ópticas cobrem um espectro que varia de 600 a 900 nm. Note-se que estes são apenas valores representativos destinados a fornecer orientação geral. Os valores precisos podem variar dependendo da condição experimental (por exemplo, temperatura) e frequência/comprimento de onda. A literatura fornece valores mais específicos. *Nenhuma referência específica encontrada. Clique aqui para baixar esta tabela.
O protocolo dado foi desenvolvido para fazer ~120 mL de material fantasma. As massas dos componentes podem ser dimensionadas para fazer diferentes volumes de material fantasma. Observe que, para volumes maiores (>500 mL), o equipamento proposto pode não ser capaz de aquecer suficientemente a mistura fantasma de forma homogênea. Para o efeito, o equipamento de aquecimento deve ser adaptado de forma adequada.
CUIDADO: Certifique-se sempre de que o equipamento de proteção individual (EPI) adequado seja usado durante todo o processo de fabricação. Isso pode incluir o uso de jalecos, óculos de segurança e luvas de segurança; Consulte e siga as diretrizes de segurança locais. O procedimento é adaptado de Hacker et al.39; um resumo das etapas é exibido na Figura 1.
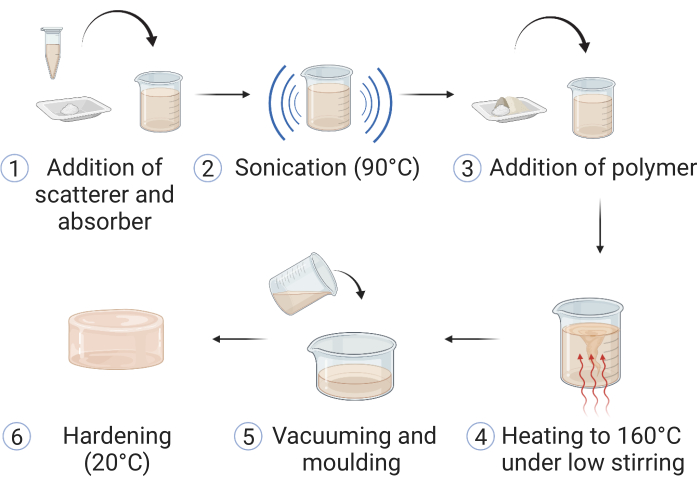
Figura 1: Fabricação do material copolímero em óleo. (1) Materiais para espalhamento óptico e absorção são adicionados ao óleo mineral e (2) sonicados, a 90 °C até dissolver. (3) Polímero(s) e estabilizante(s) são adicionados, e (4) a mistura é aquecida em banho de óleo a 160 °C sob agitação fraca. (5) Após a dissolução de todos os componentes, a amostra é vertida num molde simulador adequado e (6) deixada endurecer à temperatura ambiente. Esse dado é reproduzido de Hacker et al.39. Clique aqui para ver uma versão maior desta figura.
1. Preparação da mistura
- Preparar a solução-mãe de Nigrosin adicionando 0,4 g de Nigrosin a 40 ml de óleo mineral. Garanta uma mistura homogênea por sonicação e vórtice completo da amostra. Conservar a solução-mãe à temperatura ambiente.
NOTA: A solução-mãe deve ser sempre cuidadosamente misturada antes da reutilização. Se preferir um material fantasma sem espalhador óptico (TiO 2) ou absorvedor (corante), as etapas 1 e2 podem ser ignoradas. Prossiga com a etapa 3. - Sonicar 0,15 g de TiO 2 e 1 mL da solução-estoque do corante em 100 mL (83,8 g) de óleo mineral até que todos os componentes estejam completamente dissolvidos (~60 min) (Figura 1: passos 1 e2). Ajuste o sonicador para temperaturas elevadas (90 °C) se o equipamento permitir, pois isso facilita o processo de mistura. Prossiga com as etapas 3-5 durante o tempo de sonicação.
NOTA: Se um simulador com propriedades de absorção e espalhamento mais altas for preferido, o tempo de sonicação pode precisar ser estendido. - Pesar o poliestireno-bloco-poli(etileno-ran-butileno)-bloco-poliestireno (SEBS) e o polietileno de baixa densidade (PEBD) nas concentrações desejadas (por exemplo, SEBS = 25,14 g; PEBD = 6,70 g) (Figura 1: passo 3).
- Opcional: Um antioxidante pode ser adicionado para aumentar a estabilidade, mas não é obrigatório se as temperaturas de aquecimento não excederem 180°C.
NOTA: Caso problemas de solubilidade ou viscosidade sejam encontrados em um estágio posterior do processo de fabricação, é aconselhável excluir o PEBD. O PEBD é incorporado para aumentar a velocidade do som no material (Tabela 3); no entanto, não é obrigatório para a criação de um simulador estável. Ao omitir o PEBD, o processo de fabricação e moldagem pode ser simplificado, mas resultará em uma diminuição na velocidade subsequente do som do material final (Tabela 3).
- Opcional: Um antioxidante pode ser adicionado para aumentar a estabilidade, mas não é obrigatório se as temperaturas de aquecimento não excederem 180°C.
- Crie um banho de óleo usando vidraria e óleo de silicone adequados; Fixe-o cuidadosamente na placa de aquecimento. Certifique-se de que o termopar permaneça no banho de óleo de silicone e não toque nas bordas dos vidros durante todo o procedimento (Figura 2).
NOTA: Certifique-se de que o acessório termorregulador esteja cuidadosamente montado, conforme instruções do fabricante do equipamento. - Coloque uma barra de agitação magnética de comprimento adequado dentro do banho de óleo para garantir uma distribuição uniforme do calor.
- Ligue a placa de aquecimento, ajuste a temperatura de aquecimento para 160 °C e ajuste as rotações por minuto (rpm) do agitador para 50.
- Transfira o PEBD e o SEBS para o copo de vidro contendo o óleo mineral sonicado (com TiO2 e Nigrosina). Introduzir uma barra de agitação magnética de comprimento adequado no copo de vidro e transferi-la para o centro do banho de óleo para aquecimento dos componentes medidos. Certifique-se de que o nível de óleo no banho permaneça acima do nível de óleo mineral dentro do copo (Figura 1: passo 4).
2. Aquecimento da mistura
- Se, em qualquer fase, o polímero adicionado parecer flutuar sobre o óleo mineral, agite manualmente a solução de óleo mineral usando uma espátula metálica, de modo que qualquer polímero flutuante seja distribuído dentro do óleo mineral. Use luvas resistentes ao calor.
- Deixar a mistura a 160 °C até que todo o polímero esteja dissolvido e a solução apareça uniformemente misturada, com uma textura lisa e homogénea (~1,5 h).
3. Aspiração
NOTA: Para remoção de bolhas de ar, siga os seguintes passos, dependendo do equipamento disponível.
- Coloque o copo quente cuidadosamente na câmara de vácuo e aspirar as amostras por 2-3 minutos na configuração mais alta (vácuo mais baixo). Use uma espátula metálica para remover cuidadosamente as bolhas de ar que se acumulam na superfície. Se as bolhas de ar ainda estiverem presentes após esta etapa, reaqueça a mistura e repita a etapa de aspiração até que todas as bolhas de ar tenham sido removidas.
- Ligue o forno a vácuo e aqueça-o até 160 °C. Assim que atingir a temperatura desejada, transfira o copo com a solução para o forno a vácuo.
OBS: Sempre manuseie o copo com luvas de proteção térmica.- Ligue o vácuo para a configuração mais alta (menor vácuo) disponível. Se uma camada de espuma tiver produzido em cima da solução, desligue o vácuo e remova as bolhas da superfície usando uma espátula (repita este passo até que todas as bolhas de ar tenham sido removidas).
- Deixe o copo no forno a vácuo por 1 h na configuração mais alta de vácuo.
NOTA: Para manter o forno a vácuo limpo, limpe a superfície externa do copo de óleo de silicone com um papel toalha.
4. Despejar as amostras no molde
- Antes de despejar as amostras em moldes de amostra, remova quaisquer bolhas de ar restantes na superfície da mistura com uma espátula, se necessário.
- Despeje cuidadosamente a solução em um molde adequado, usando luvas resistentes ao calor ou usando equipamento de proteção adequado. Garanta o derramamento suave e constante de uma altura baixa para reduzir a chance de formação de bolhas de ar (Figura 1: passo 5). Para moldes com formas complexas, cubra o molde com uma fina camada de óleo (exceto óleo mineral [por exemplo, óleo de rícino ou silicone]) antes de derramar para facilitar a remoção da amostra curada.
NOTA: O pré-aquecimento dos moldes em um forno pode ajudar a obter maior homogeneidade da amostra. - Remova rapidamente quaisquer bolhas de ar do topo das amostras com uma espátula metálica uma vez derramada. Se várias bolhas de ar se acumularem no interior da mistura, repita o passo de vácuo, desde que o tipo e a forma do molde o permitam.
- Deixe a solução ajustar à temperatura ambiente. Embora amostras menores possam curar em menos de 2 h, deixe as amostras durante a noite para eliminar qualquer risco de cura incompleta. Conservar as amostras à temperatura ambiente (Figura 1: passo 6).
5. Aquisição de imagens
- Para aquisição da imagem, colocar o simulador no campo de visão do aparelho de imagem.
- Para sistemas de IAF ou ultrassom, realizar acoplamento acústico da superfície do simulador ao transdutor de ultrassom, por exemplo, com gel de ultrassom ou água.
NOTA: Se o protocolo foi seguido corretamente, nenhuma inomogeneidade deve perturbar o campo de visão. Os suportes simuladores personalizados podem ajudar no posicionamento repetível da amostra entre as medições. - Se a temperatura de aquisição diferir da temperatura de armazenamento do simulador, permita que a temperatura do simulador se estabilize com o ambiente.
- Adquira uma imagem.
6. Medidas de caracterização do material
OBS: O objetivo das medições de caracterização de materiais é a verificação das propriedades ópticas e acústicas do material. Ressalta-se que o protocolo de fabricação de simuladores tem mostrado altareprodutibilidade39, de modo que os protocolos gerais de mensuração que seguem são fornecidos apenas como orientação se mais estudos de verificação forem desejados. As etapas individuais das medições dependerão do equipamento de caracterização utilizado. Aqui, um sistema baseado no método de substituição de banda larga através da transmissão41 (disponível no National Physical Laboratory (NPL), Reino Unido) foi empregado para a caracterização acústica e um sistema interno de esfera de dupla integração (DIS) foi usado (baseado no 42) para a caracterização óptica. A configuração dos sistemas de caracterização é apresentada na Figura Suplementar 1. Detalhes adicionais sobre as configurações de medição (acústica43; óptica42,44) e procedimento de medição39 podem ser encontrados em outra publicação. O procedimento de medição deve ser adaptado de acordo com cada sistema de caracterização específico utilizado.
- Caracterização acústica
OBS: As medidas de caracterização acústica são baseadas em um sistema que emprega um transdutor de ultrassom de frequência central de 10 MHz (diâmetro do elemento ativo de 10 mm) para geração de pulso e um hidrofone de banda larga (hidrofone de membrana bilaminar de 30 mm de diâmetro do elemento ativo) para detecção de pulso (ambos colocados em um tanque de água cheio de água deionizada; dimensões de 112 cm x 38 cm x 30 cm3). O transdutor é acionado por um pulsador-receptor. As formas de onda são adquiridas usando um osciloscópio. Mais detalhes sobre a configuração e o procedimento de medição (incluindo os efeitos do tipo B específicos do sistema nas medições) podem ser encontrados em 43.- Preparar amostras adequadas para a configuração de medição (por exemplo, neste caso, amostras circulares com um diâmetro de 7-8 cm e espessura de 6-9 mm). Certifique-se de que as amostras são de composição homogênea e livres de quaisquer impurezas, bolhas de ar ou irregularidades de superfície.
- Medir a espessura da amostra de ensaio utilizando paquímetros vernier e registar a temperatura do reservatório de água utilizando um termómetro calibrado.
- Coloque a amostra no sistema. Certifique-se de que a amostra esteja corretamente alinhada com os componentes do sistema.
NOTA: Um porta-amostras controlado automaticamente com base num suporte gimbal43 pode ajudar no controlo preciso da rotação e inclinação da amostra. - Adquirir quatro pulsos acústicos para cada conjunto de medição: um pulso de referência através da água sem amostra presente no trajeto acústico; transmissão por amostragem; e reflexões acústicas recebidas no transmissor das superfícies frontal e traseira da amostra.
- Derivar as propriedades acústicas da amostra a partir das medições. Calcule a velocidade do som c(f ) (em m·s−1) usando a equação (1)43.
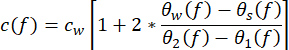 (1º)
(1º)
CW representa a velocidade dependente da temperatura do som da água, e θ1(f), θ2(f), θw(f) e θs(f) são os espectros de fase não envolvidos correspondentes dos pulsos de tensão front-reflected, back-reflected, through-water e through-sample, respectivamente. O coeficiente de atenuação dependente da frequência (αi(f)) do material pode ser obtido usando a técnica de substituição de duas amostras mostrada na equação (2)43.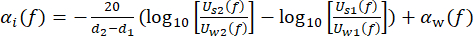 (2º)
(2º)
U w(f) e Us(f) são os respectivos espectros de magnitude de tensão do pulso through-water e through-sample, αw(f) é o coeficiente de atenuação do ultrassom (em dB·cm-1) de água pura na temperatura específica do tanque de água45, e d 1 e d 2 (d2 > d1) são duas espessuras de amostra.
OBS: Para o presente protocolo, avaliou-se a atenuação responsável pelas perdas interfaciais, considerando-se desprezível seu impacto. - Repetir a medição mais de três vezes em posições diferentes na amostra de ensaio. Calcular a média e o desvio padrão das medidas para derivar um valor final da amostra.
- Caracterização óptica
NOTA: Para os ensaios ópticos, foi utilizado um sistema de esfera de dupla integração (baseado em 42), empregando duas esferas integradoras (50 mm de diâmetro interno) que são conectadas a dois espectrômetros através de duas fibras ópticas. A esfera de reflectância é conectada a uma fonte de luz através de uma terceira fibra óptica.- Prepare amostras adequadas para a configuração de medição (por exemplo, neste caso, amostras retangulares com largura de 5,9 cm, altura de 1,8 cm e espessura variando entre 2 e 3 mm). Certifique-se de que as amostras são de composição homogênea e livres de quaisquer impurezas, bolhas de ar ou irregularidades de superfície.
- Ligue a fonte de luz e deixe-a estabilizar de acordo com as instruções do fabricante (por exemplo, 15 min).
- Determinar a espessura da amostra utilizando paquímetros vernier. Se aplicável, especifique a faixa de comprimento de onda e o tamanho do passo para a medição (por exemplo, 450-900 nm com um tamanho de passo de 1 nm).
- Registre as medições de referência para a esfera de transmissão e reflectância.
- Para a esfera de reflectância, primeiro faça uma medição de porta aberta registrando o valor de refletância R0 com a esfera de transmitância removida e a fonte de luz ligada. Em seguida, registre o valor de refletância R1 com um padrão de referência mantido na frente da esfera de refletância (fonte de luz ligada).
- Para a esfera de transmitância, primeiro faça uma medição de feixe bloqueado registrando o valor de transmitância T0 com as esferas de refletância e transmitância alinhadas e a fonte de luz desligada. Em seguida, faça uma medição de feixe incidente registrando o valor de transmitância T1 com as esferas de refletância e transmitância alinhadas e a fonte de luz ligada.
NOTA: Uma superfície limpa das esferas e um padrão de referência devem ser assegurados para as medições, pois a aderência de poeira ou outros contaminantes pode afetar o desempenho dos componentes46.
- Coloque a amostra entre as esferas. Meça os valores de reflectância Rs e transmitância Ts. Certifique-se de que a amostra não seja compactada, pois isso pode afetar a precisão da medição. Colocar uma esfera em um estágio motorizado pode ajudar a controlar com precisão a distância entre as esferas, adaptando-a à espessura da amostra medida.
- Calcular os valores de reflectância normalizadaM R e transmitância MT usando as equações (3) e (4)42.
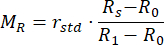 (3º)
(3º)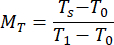 (4º)
(4º)
RStd representa a intensidade refletida a partir do padrão de reflectância de 99%. - Insira os valores medidos em um programa de duplicação de adição inversa (IAD) (código-fonte: http://omlc.org/software/iad/)44 para estimar as propriedades ópticas do material.
NOTA: Com base em relatos anteriores, o fator de anisotropia de espalhamento (g) pode ser tomado como g = 0,7, e o índice de refração como n = 1,4 30. - Repetir a medição pelo menos três vezes em posições diferentes ao longo da amostra de ensaio. Calcular a média e o desvio padrão das medidas para derivar um valor final da amostra.
Resultados
Seguindo esta receita, três desenhos de simuladores representativos foram criados com a finalidade de imagens fotoacústicas, direcionados para diferentes projetos de sistemas com diferentes geometrias de iluminação óptica e detecção acústica (Figura 3A). Se o procedimento de preparação do simulador for realizado com sucesso, o material do simulador parece liso e homogêneo, sem bolhas de ar aprisionadas ou impurezas, e nenhum artefato pode ser visto na imagem resultante (aqui visualizado usando imagens fotoacústicas; Figura 3B,C). O protocolo produz um material representativo com velocidade do som c(f) = 1481 ± 0,4 m·s-1 (correspondente à velocidade do som da água a 20 °C40), atenuação acústica α(f) = 6,1 ± 0,06 dB·cm-1 (ambos a 5 MHz), absorção óptica μa(λ) = 0,05 ± 0,005 mm-1 e espalhamento óptico μs'(λ) = 1 ± 0,1 mm-1 (ambos a 800 nm) (a incerteza representa o desvio padrão de n = 3 lotes produzidos independentemente por diferentes operadores; todas as medições foram realizadas à temperatura ambiente [20 °C]).
O coeficiente de espalhamento óptico pode ser ajustado pela variação de TiO 2, enquanto o coeficiente de absorção óptica pode ser ajustado pela adição de qualquer corante solúvel em óleo, aqui demonstrado com a Nigrosina (Tabela 2 e Figura 3D). Embora os valores da Tabela 2 estejam focados em tecidos de menor absorção e espalhamento, como músculo ou mama (Tabela 1), não encontramos dificuldades com a adição de absorvedores e espalhadores em concentrações mais elevadas. No entanto, a adição de espalhadores/absorvedores ópticos em concentrações mais elevadas pode exigir tempos de sonicação mais longos para alcançar uma mistura homogênea da solução.
A atenuação acústica e a velocidade do som podem ser sintonizadas pela variação da concentração do polímero (Tabela 3). Aqui, a afinação é até agora limitada a uma faixa de velocidade de som de ~1.450-1.516 m·s-1. Concentrações menores do polímero podem resultar em baixa estabilidade física da amostra, levando à deformação plástica ao longo do tempo34. Concentrações mais altas de polímeros resultam em fragilidade e textura irregular do material. A gama de propriedades acústicas pode ajudar a mimetizar tecidos como mama ou gordura (c = 1.450-1.480 m·s−1), mas pode ser insuficiente para tecidos como músculo ou rim (c > 1.520 m·s−1; Tabela 1).
Fontes de erro comuns na preparação de simuladores incluem remoção insuficiente de bolhas de ar e mistura não homogênea dos componentes de base (Figura 4). Isso pode ser minimizado por aspiração e derramamento cuidadoso, e agitação/vórtice, respectivamente.
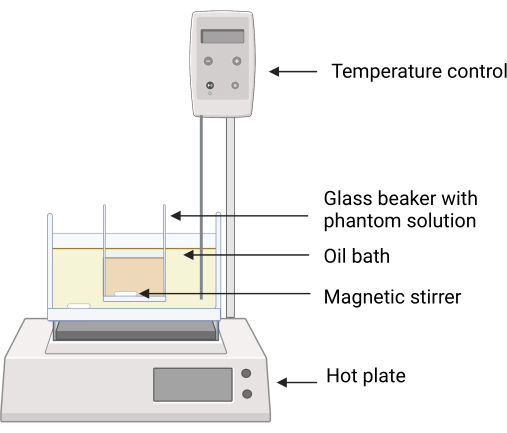
Figura 2: Arranjo experimental para a confecção do simulador. O copo de vidro contendo os ingredientes fantasmas é colocado no banho de óleo de silicone usando uma braçadeira para evitar o contato direto entre as superfícies do banho de óleo e o copo de vidro. O feedback da temperatura na placa quente garante um controle cuidadoso da temperatura. Os agitadores magnéticos permitem a mistura dos ingredientes do óleo de silicone e do fantasma. Clique aqui para ver uma versão maior desta figura.
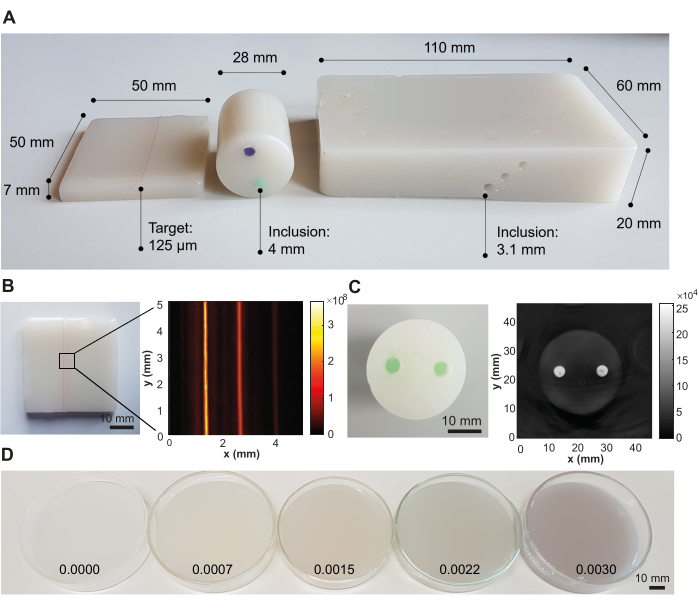
Figura 3: Resultados representativos do procedimento de fabricação do simulador. (A) Vários desenhos de simuladores mostrando versatilidade para aplicação em diferentes sistemas de imagem fotoacústica. Esquerda: pequeno simulador retangular com cordas embutidas em diferentes profundidades (0,5, 1,5 e 2,5 mm; distância entre alvos de 1,25 mm) projetado para testar sistemas de imagem de alta resolução; Meio: simulador cilíndrico com duas inclusões (distância de interinclusão de 12 mm) utilizando corante solúvel em óleo verde e violeta, projetado para testar sistemas de tomografia; Direita: Grande simulador retangular com canais embutidos em diferentes profundidades (6 mm, 10 mm e 14 mm; distância de interinclusão de 3,5 mm), projetado para testar um sistema portátil. (B) Exemplo de imagem fotoacústica do simulador retangular com cordas embutidas, adquirida a 532 nm com um sistema de imagem fotoacústica comercial. (C) Exemplo de imagem fotoacústica do simulador tomográfico cilíndrico, adquirida a 800 nm com um sistema de imagem fotoacústica comercial. (D) Simuladores com concentrações crescentes de absorção óptica por concentrações crescentes de Nigrosin (concentrações dadas em porcentagem em peso do volume total de óleo mineral na imagem). A Figura 3B,C é reproduzida de Hacker et al.39. Barras de escala = 10 mm. Clique aqui para ver uma versão maior desta figura.
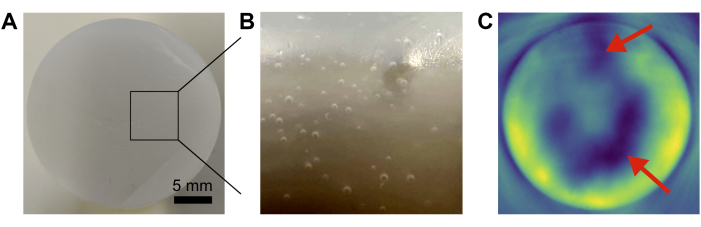
Figura 4: Falhas comuns do fantasma . (A,B) Fotografias mostrando bolhas de ar presas dentro da matriz de base. (C) A mistura insuficiente dos componentes de base leva a inhomogeneidades (setas vermelhas) na imagem fotoacústica resultante. Barra de escala = 5 mm (A). Clique aqui para ver uma versão maior desta figura.
Quadro 2: Visão geral tabular da sintonia dos valores de absorção óptica (μa) e espalhamento (μs'). Os valores percentuais são dados em percentagem ponderal do volume total da solução de base (óleo mineral, coluna 1) e do peso total do material simulador (coluna 2). As concentrações de Nigrosin representam a quantidade total de Nigrosin absoluta (não solução-mãe). Todas as amostras incluíram 5% de hidroxitolueno butilado como antioxidante (opcional). n = 3 medidas por amostra. Uma representação visual da tabela pode ser encontrada em Hacker et al.39. Abreviação: neg = desprezível. Clique aqui para baixar esta tabela.
Tabela 3: Visão geral tabular da afinação dos valores de atenuação acústica (α) e velocidade do som (c). Descrito pela lei de potência α0f n com α0 e n parâmetros obtidos a partir de um ajuste não linear de mínimos quadrados (n = 4 medidas por amostra). F representa a frequência em MHz. Os valores percentuais são dados como percentagem em peso do peso total da solução de base (óleo mineral). Todas as amostras incluíram 5% de hidroxitolueno butilado como antioxidante (opcional). Uma representação visual da tabela pode ser encontrada em Hacker et al.39. Clique aqui para baixar esta tabela.
Figura Complementar S1: Configuração dos sistemas de caracterização acústica e óptica utilizados para as verificações. Uma fotografia (A) e um esquema (B) do sistema de caracterização acústica para determinação do coeficiente de atenuação acústica e velocidade do som são exibidos. Os componentes individuais do sistema são indicados por anotações HP (HydroPhone), S (Amostra) e T (Transdutor) na foto e no esquema. Uma fotografia (C) e um esquema (D) do sistema de esferas de dupla integração para a avaliação do coeficiente de absorção óptica e do coeficiente de espalhamento reduzido são mostrados. Os componentes individuais do sistema são denotados pelas anotações S (Amostra), RS (Esfera de Reflectância), TS (Esfera de Transmissão), OF (Fibra Óptica) e MS (Estágio Motorizado) na foto e esquema. Esse dado é reproduzido de Hacker e col. 39. Clique aqui para baixar este arquivo.
Discussão
Aqui, é apresentado um protocolo que visa fornecer uma receita versátil para um material estável e biologicamente relevante que pode ser usado para criar simuladores para medições de calibração e padronização em aplicações multimodais de imagens biomédicas acústicas e ópticas. O material já demonstrou ser estável ao longo do tempo39, ter alta reprodutibilidade lote a lote, ser seguro de usar e consistir em ingredientes prontamente disponíveis e econômicos de fornecedores científicos padrão. As propriedades do material são ajustáveis independentemente através de regimes acústicos e ópticos relevantes. Além disso, é mecanicamente robusto e insolúvel em água, resistindo assim ao manuseio áspero, e é inerte aos agentes de acoplamento à base de água que são usados em pesquisas ultrassônicas/fotoacústicas. Destacou-se que diferentes desenhos de fantasmas podem ser criados com diferentes tipos de inclusões, compostos por um mesmo material ou por diferentes tipos de materiais. Dadas essas propriedades, o material preenche os critérios-chave acima mencionados para um simulador biofotônico ideal e apresenta vantagens fundamentais em comparação com outros materiais que imitam tecidos existentes3. Ao detalhar o processo exato de fabricação, esperamos minimizar as variações decorrentes do procedimento de fabricação, otimizando assim seu uso para calibrar, validar e rastrear o desempenho de sistemas de imagem.
Duas etapas fundamentais foram identificadas como críticas para o processo de fabricação. Primeiro, os ingredientes precisam ser completamente misturados e uniformemente aquecidos para a criação de um material homogêneo. O uso de um sonicador e agitador magnético para mistura e um banho de óleo para aquecimento garante a distribuição uniforme dos componentes do material dentro da matriz de base. É preciso tomar cuidado para que o banho de óleo não atinja temperaturas muito altas (>180 °C), pois isso resultará na oxidação dos componentes do material, levando à descoloração amarelada. A agitação manual pode suportar o processo de mistura e compensa o aquecimento insuficiente da interface material-ar. O tempo de sonicação e mistura pode precisar ser estendido quando uma concentração maior de TiO2 e/ou polímeros é usada para garantir uma composição homogênea do material. Em segundo lugar, as bolhas de ar precisam ser removidas para evitar a formação de heterogeneidades dentro da matriz de base. Embora isso possa ser conseguido com uma bomba de vácuo ou forno, o despejo cuidadoso de uma altura baixa também deve ser praticado para minimizar o aprisionamento de ar dentro do material.
Uma vantagem significativa do material são suas propriedades termoplásticas (derivadas do polímero SEBS), permitindo que ele seja reaquecido e remoldado sem impacto significativo em suas propriedades acústicas e ópticas39. No entanto, o reaquecimento precisa ser realizado de forma gradual e cuidadosa, pois o material pode facilmente queimar e oxidar se reaquecido muito rapidamente. O reaquecimento também se torna mais difícil quando concentrações mais elevadas de PEBD são utilizadas, uma vez que o PEBD não apresenta o mesmo comportamento termoplástico que o PEBS.
Várias limitações do protocolo permanecem. Devido à alta temperatura de fusão dos polímeros (150 °C), os moldes fantasmas precisam ser feitos de um material resistente ao calor, como vidro ou aço inoxidável. Além disso, o material é bastante viscoso no estado líquido se uma alta concentração de polímero for usada para ajustar as propriedades acústicas, dificultando o preenchimento de pequenos alvos de imagem. Finalmente, a afinação das propriedades acústicas é até agora limitada a uma faixa de velocidade do som de ~1450-1.516 m·s-1 que suporta imitar tecidos como mama ou gordura (c = 1.450-1.480 m·s−1), mas pode ser insuficiente para tecidos como músculo ou rim (c > 1.520 m·s−1). A alteração concomitante da atenuação acústica também deve ser levada em consideração.
Aqui, destacamos a aplicação do material como um simulador estável para aplicações em ultrassom e imagem óptica. No entanto, materiais de copolímero em óleo também têm se mostrado de valor em aplicações de elastografia35, e poderiam potencialmente permitir compatibilidade com outras modalidades de imagem, como a ressonância magnética. O aumento do realismo anatômico dos objetos simuladores pode ser obtido com o uso de moldes impressos em 3D, como demonstrado em estudos semelhantes 29,47,48,49. Os primeiros estudos também demonstraram a capacidade de impressão 3D do próprio material, ampliando ainda mais sua flexibilidade em termos de processamento e fabricação. Esses desenvolvimentos destacam o potencial futuro empolgante do material como um meio simulador estável e amplamente utilizado para aplicações de imagem multimodais.
Divulgações
Sarah Bohndiek já recebeu apoio de pesquisa da CYBERDYNE INC e iThera Medical GmbH, fornecedores de instrumentos de imagem fotoacústica. Os demais autores não têm conflitos de interesse relacionados ao presente manuscrito a divulgar.
Agradecimentos
A LH foi financiada pelo programa MedAccel da NPL financiado pelo Fundo de Desafio de Estratégia Industrial do Departamento de Negócios, Energia e Estratégia Industrial. A JMG recebeu financiamento da Deutsche Forschungsgemeinschaft (DFG, Fundação Alemã de Pesquisa) no âmbito do projeto GR 5824/1. JJ agradece o apoio financeiro do prêmio Academy of Medical Sciences Springboard (REF: SBF007\100007). A SEB reconhece o apoio da Cancer Research UK sob o número de concessão C9545/A29580. AMI, BZ e SR foram apoiados pelo Departamento de Negócios, Energia e Estratégia Industrial do Reino Unido por meio do financiamento do Sistema Nacional de Medição. A Figura 1 e a Figura 2 foram criadas com o BioRender.
Materiais
| Name | Company | Catalog Number | Comments |
| Low-density Polyethylene (LDPE) | Alfa Aesar | 43949.30 CAS: 9002-88-4 | 6.70 g 5.8% w/w |
| Mineral oil | Sigma Aldrich | 330779-1L CAS: 8042-47-5 | 83.80 g 72.5% w/w |
| Nigrosin | Sigma Aldrich | 211680-100G CAS: 11099-03-9 | 0.4 g |
| Polystyrene-block-poly(ethylene-ran-butylene)-block-polystyrene (SEBS) | Sigma Aldrich | 200557-250G CAS: 66070-58-4 | 25.14 g 21.7% w/w |
| Silicone oil for oil bath | Sigma Aldrich | 85409-1L CAS: 63148-62-9 ~1 L (depending on size of oil bath) | |
| Titanium(IV) oxide, anatase (TiO2) | Sigma Aldrich | 232033 CAS: 1317-70-0 | 0.15 g |
| Antioxidant (optional; e.g., butylated hydroxytoluene) | Sigma Aldrich | W218405-1KG-K CAS: 128-37-0 | may be added to prevent discolouration if higher fabrication temperatures are used |
| Oil-solule dyes for inclusions (optional) | e.g., Caligo safe wash relief inks, Cranfield Colours, Cwmbran, UK* | may be added depending on preferred absorption | |
| Bath Sonicator | Ultrawave Ltd, UK* | U500H Ultrasonic Cleaning Bath* | ideally with temperature control; recommended operating frequencies between 30-50 kHz) |
| Crystallising dish for silicone oil bath (up to +200 °C) | any suitable supplier | (ext. diameter ~140 mm for 250 mL glass beaker) | |
| Glass beaker (~250 mL); glass sample dishes/phantom mould | any suitable supplier | ||
| Hot plate with magnetic stirrer and thermoregulator (external probe thermocouple) with maximum temperature of > 200 °C | Thermo Fisher Scientific, UK* | Velp Scientifica AREC.X Digital Ceramic Hot Plate Stirrer* | |
| Laboratory scales / scientific balances accurate to 0.01 g | any suitable supplier | ||
| Metallic spatula | any suitable supplier | ||
| Vaccuum oven or vaccum chamber | Memmert, Germany (Vacuum oven)* Cole-Parmer Instrument Company, UK (Vaccum chamber)* | VO29 (Vacuum oven) DWK Life Sciences (Kimble) Glass Vacuum Desiccator with Collar (Vaccum chamber)* | |
| 1. Acoustic characterization system* | |||
| Hydrophone | GEC Marconi | 30 mm active element diameter bilaminar membrane hydrophone | |
| Oscilloscope | Tektronix UK, Bracknell, UK | DPO 7254 | |
| Pulser–receiver | Olympus NDT, Waltham, MA, USA | Olympus 5073PR | |
| Sample holder | Newport Spectra-Physics, Didcot, UK | Newport 605-4 Series Low-Distortion Axial Clamping Gimbal Optic Mount | may require additional adaptor for sample holding |
| Thermometer | G. H. Zeal, London, UK | UKAS-calibrated IP 39C spirit-in-glass thermometer | |
| Ultrasound transducer | Force Technology, Brondby, Denmark | Transducer of active element diameter 10 mm | |
| Vernier callipers | any suitable supplier | ||
| Water tank filled with deionized water | any suitable supplier | requires sufficent size (e.g., dimensions 112 × 38 × 30 cm3) | |
| 2.Optical characterization system* | |||
| Integrating sphere (two) | Avantes, Apeldoorn, the Netherlands | AvaSphere-50, 50 cm internal diameter | |
| Light source | Avantes, Apeldoorn, the Netherlands | Avalight-HAL-s-mini | |
| Motorized stage (optional) | Thorlabs, | Thorlabs MTS50 | |
| Optical fibres (three) | any suitable supplier | ||
| Reflectance standard | Labsphere, North Sutton, USA | 99%, white, 1.25" diameter, USRS-99-010, AS-01158-060 | |
| Spectrometer | Avantes, Apeldoorn, the Netherlands | Starline Avaspec-2048 | |
| Software | |||
| Data acqusition software (e.g., Labview) | National Instruments, Austin, TX, USA | ||
| Data analysis software (e.g., Matlab) | Mathworks, Natick, USA | ||
| Inverse adding doubling (IAD) program | Source code: http://omlc.org/software/iad/ | ||
| *Please note that similar equipment may also be used. |
Referências
- Waterhouse, D. Translation of optical imaging biomarkers: opportunities and challenges. Nature Biomedical Engineering. 3 (5), 339-353 (2019).
- O'Connor, J. P. B., et al. Imaging biomarker roadmap for cancer studies. Nature Reviews Clinical Oncology. 14 (3), 169-186 (2017).
- Hacker, L., et al. Criteria for the design of tissue-mimicking phantoms for the standardization of biophotonic instrumentation. Nature Biomedical Engineering. 6 (5), 541-558 (2022).
- Laufer, J., Zhang, E., Beard, P. Evaluation of absorbing chromophores used in tissue phantoms for quantitative photoacoustic spectroscopy and imaging. IEEE Journal of Selected Topics in Quantum Electronics. 16 (3), 600-607 (2010).
- Cook, J. R., Bouchard, R. R., Emelianov, S. Y. Tissue-mimicking phantoms for photoacoustic and ultrasonic imaging. Biomedical Optics Express. 2 (11), 3193-3206 (2011).
- Xia, W., et al. Poly(vinyl alcohol) gels as photoacoustic breast phantoms revisited. Journal of Biomedical Optics. 16 (7), 075002 (2011).
- Manohar, S., et al. Photoacoustic mammography laboratory prototype: imaging of breast tissue phantoms. J Biomed Opt. 9, 1172 (2004).
- Blumenröther, E., Melchert, O., Wollweber, M., Roth, B. Detection, numerical simulation and approximate inversion of optoacoustic signals generated in multi-layered PVA hydrogel based tissue phantoms. Photoacoustics. 4 (4), 125-132 (2016).
- Kharine, A., et al. Poly(vinyl alcohol) gels for use as tissue phantoms in photoacoustic mammography. Physics in Medicine and Biology. 48 (3), 357-370 (2003).
- Spirou, G. M., Oraevsky, A. A., Vitkin, I. A., Whelan, W. M. Optical and acoustic properties at 1064 nm of polyvinyl chloride-plastisol for use as a tissue phantom in biomedical optoacoustics. Physics in Medicine and Biology. 50 (14), N141-N153 (2005).
- Bohndiek, S. E., Bodapati, S., Van De Sompel, D., Kothapalli, S. -. R., Gambhir, S. S. Development and application of stable phantoms for the evaluation of photoacoustic imaging instruments. PLoS One. 8 (9), e75533 (2013).
- Fonseca, M., Zeqiri, B., Beard, P. C., Cox, B. T. Characterisation of a phantom for multiwavelength quantitative photoacoustic imaging. Physics in Medicine and Biology. 61 (13), 4950-4973 (2016).
- Vogt, W. C., Jia, C., Wear, K. A., Garra, B. S., Joshua Pfefer, T. Biologically relevant photoacoustic imaging phantoms with tunable optical and acoustic properties. Journal of Biomedical Optics. 21 (10), 101405 (2016).
- Dantuma, M., van Dommelen, R., Manohar, S. Semi-anthropomorphic photoacoustic breast phantom. Biomedical Optics Express. 10 (11), 5921-5939 (2019).
- Jeong, E., et al. Fabrication and characterization of PVCP human breast tissue-mimicking phantom for photoacoustic imaging. BioChip Journal. 11, 67-75 (2017).
- Jia, C., Vogt, W. C., Wear, K. A., Pfefer, T. J., Garra, B. S. Two-layer heterogeneous breast phantom for photoacoustic imaging. Journal of Biomedical Optics. 22 (10), 1-14 (2017).
- Madsen, E. L., Hobson, M. A., Shi, H., Varghese, T., Frank, G. R. Stability of heterogeneous elastography phantoms made from oil dispersions in aqueous gels. Ultrasound in Medicine & Biology. 32 (2), 261-270 (2006).
- Culjat, M. O., Goldenberg, D., Tewari, P., Singh, R. S. A review of tissue substitutes for ultrasound imaging. Ultrasound in Medicine & Biology. 36 (6), 861-873 (2010).
- Zell, K., Sperl, J. I., Vogel, M. W., Niessner, R., Haisch, C. Acoustical properties of selected tissue phantom materials for ultrasound imaging. Physics in Medicine and Biology. 52 (20), N475-N484 (2007).
- Lazebnik, M., Madsen, E. L., Frank, G. R., Hagness, S. C. Tissue-mimicking phantom materials for narrowband and ultrawideband microwave applications. Physics in Medicine and Biology. 50 (18), 4245-4258 (2005).
- Ramnarine, K. V., Anderson, T., Hoskins, P. R. Construction and geometric stability of physiological flow rate wall-less stenosis phantoms. Ultrasound in Medicine & Biology. 27 (2), 245-250 (2001).
- Pogue, B. W., Patterson, M. S. Review of tissue simulating phantoms for optical spectroscopy, imaging and dosimetry. Journal of Biomedical Optics. 11 (4), 041102 (2006).
- Lamouche, G., et al. Review of tissue simulating phantoms with controllable optical, mechanical and structural properties for use in optical coherence tomography. Biomedical Optics Express. 3 (6), 1381-1398 (2012).
- Bohndiek, S. E., Van de Sompel, D., Bodapati, S., Kothapalli, S. R., Gambhir, S. S. Stable phantoms for characterization of photoacoustic tomography (PAT) systems. Design and Performance Validation of Phantoms Used in Conjunction with Optical Measurement of Tissue V. 858308, 30-35 (2013).
- Fenollar, O., Sanchez-Nacher, L., Garcia-Sanoguera, D., López, J., Balart, R. The effect of the curing time and temperature on final properties of flexible PVC with an epoxidized fatty acid ester as natural-based plasticizer. Journal of Materials Science. 44, 3702-3711 (2009).
- Fonseca, M., Zeqiri, B., Beard, P., Cox, B. Characterisation of a PVCP-based tissue-mimicking phantom for quantitative photoacoustic imaging. European Conference on Biomedical Optics. , 953911 (2015).
- Heudorf, U., Mersch-Sundermann, V., Angerer, J. Phthalates: toxicology and exposure. International Journal of Hygiene and Environmental Health. 210 (5), 623-634 (2007).
- Maneas, E., et al. Gel wax-based tissue-mimicking phantoms for multispectral photoacoustic imaging. Biomed. Opt. Express. 9 (3), 1151-1163 (2018).
- Maneas, E., et al. Anatomically realistic ultrasound phantoms using gel wax with 3D printed molds. Physics in Medicine and Biology. 63 (1), 015033 (2018).
- Jones, C. J. M., Munro, P. R. T. Stability of gel wax based optical scattering phantoms. Biomedical Optics Express. 9 (8), 3495-3502 (2018).
- Ivory, A. M., Shah, A., Rajagopal, S., Zeqiri, B. Development and investigation of the acoustic properties of tissue-mimicking materials for photoacoustic imaging techniques. IEEE International Ultrasonics Symposium. IEEE. , 1489-1492 (2019).
- Grillo, F. W., Cabrelli, L. C., Sampaio, D. R. T., Carneiro, A. A. O., Pavan, T. Z. Glycerol in oil-based phantom with improved performance for photoacoustic imaging. 2017 IEEE International Ultrasonics Symposium. IEEE. , 1-4 (2017).
- Cabrelli, L. C., et al. Oil-based gel phantom for ultrasound and optical imaging. Biophotonics South America. SPIE. 9531, 40-46 (2015).
- Cabrelli, L. C., et al. Stable phantom materials for ultrasound and optical imaging. Physics in Medicine and Biology. 62 (2), 432-447 (2017).
- Oudry, J., Bastard, C., Miette, V., Willinger, R., Sandrin, L. Copolymer-in-oil phantom materials for elastography. Ultrasound in Medicine & Biology. 35 (7), 1185-1197 (2009).
- Suzuki, A., et al. Oil gel-based phantom for evaluating quantitative accuracy of speed of sound measured in ultrasound computed tomography. Ultrasound in Medicine & Biology. 45 (9), 2554-2567 (2019).
- Cabrelli, L. C., Grillo, F. W., Carneiro, A. A. O., Pavan, T. Z. Copolymer-in-oil tissue-mimicking material with tunable acoustic properties. 2016 IEEE International Ultrasonics Symposium. IEEE. , 1-4 (2016).
- Cabrelli, L. C., et al. Copolymer-in-oil phantoms for photoacoustic imaging. 2015 IEEE International Ultrasonics Symposium. IEEE. , 1-4 (2015).
- Hacker, L., et al. A copolymer-in-oil tissue-mimicking material with tuneable acoustic and optical characteristics for photoacoustic imaging phantoms. IEEE Transactions on Medical Imaging. 40 (12), 3593-3603 (2021).
- Greenspan, M., Tschiegg, C. E. Speed of sound in water by a direct method. Journal of Research of the National Bureau of Standards. 59 (4), 249-254 (1957).
- Zeqiri, B., Scholl, W., Robinson, S. P. Measurement and testing of the acoustic properties of materials: a review. Metrologia. 47 (2), S156-S171 (2010).
- Pickering, J. W., et al. Double-integrating-sphere system for measuring the optical properties of tissue. Applied Optics. 32 (4), 399-410 (1993).
- Rajagopal, S., Sadhoo, N., Zeqiri, B. Reference characterisation of sound speed and attenuation of the IEC agar-based tissue-mimicking material up to a frequency of 60 MHz. Ultrasound in Medicine & Biology. 41 (1), 317-333 (2015).
- Prahl, S. A. Everything I think you should know about Inverse Adding-Doubling. Oregon Medical Laser Center, St. Vincent Hospital. 1344, 1-74 (2011).
- Pinkerton, J. M. M. The absorption of ultrasonic waves in liquids and its relation to molecular constitution. Proceedings of the Physical Society. Section B. 62 (2), 129-141 (1949).
- Hu, D., Lu, R., Huang, Y., Ying, Y., Fu, X. Effects of optical variables in a single integrating sphere system on estimation of scattering properties of turbid media. Biosystems Engineering. 194, 82-98 (2020).
- Grillo, F. W., et al. Patient-specific neurosurgical phantom: assessment of visual quality, accuracy, and scaling effects. 3D Printing in Medicine. 4 (1), 3 (2018).
- Nikitichev, D. I., et al. Construction of 3-dimensional printed ultrasound phantoms with wall-less vessels. Journal of Ultrasound in Medicine. 35 (6), 1333-1339 (2016).
- West, S. J., et al. Development of an ultrasound phantom for spinal injections with 3-dimensional printing. Regional Anesthesia and Pain Medicine. 39 (5), 429-433 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados