Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
96 Ну планшет метода, основанного на формировании мониторинга и тестирования Противогрибковые Восприимчивость Candida Albicans Биопленки
В этой статье
Резюме
Мы опишем простой, быстрый и надежный метод для формирования Candida Albicans Биопленки использованием 96-луночных микротитровальных и его полезность в противогрибковые тестирования чувствительности клеток внутри биопленки.
Аннотация
Candida Albicans остается наиболее частой причиной грибковых инфекций у растущего населения зараженных пациентов и кандидоза в настоящее время третьей наиболее распространенной инфекцией в больницах США. Различные проявления кандидоза, связанные с формирование биопленок, как на ткани хозяина и / или медицинские приборы (например, катетеры). Формирование биопленок несет отрицательную клинических проявлений, как клетки в биопленки защищены от иммунного ответа и от действия противогрибковых средств. Мы разработали простой, быстрый и надежный в пробирке модель образования С. Albicans биопленки использованием 96-луночных микротитровальных пластин, которые также могут быть использованы для биопленки противогрибковые тестирования восприимчивости. Считывания данного анализа колориметрическим, основанная на сокращении XTT (тетразолия соли) метаболически активными грибковых клеток биопленки. Типичный эксперимент занимает около 24 ч для образования биопленки, с дополнительными 24 ч для тестирования чувствительности к противогрибковым. Из-за своей простоты и использование обычно доступных лабораторных материалов и оборудования, этот метод демократизирует биопленки исследований и представляет собой важный шаг на пути к стандартизации тестирования чувствительности к противогрибковым грибковых биопленки.
протокол
1. Подготовка C. Albicans
C. Albicans является 1/BSL1 Группа риска микроорганизма. Всегда помните, использовать хорошие асептические / стерильные методы для работы с этим микроорганизмом и следуйте институциональные процедуры по надлежащему уничтожению биологически опасных материалов.
- Подготовка ночной культуры С. Albicans в YPD (дрожжевой пептон декстроза) жидкой среде путем посева одной колонии C. Albicans в 25 мл YPD.
- Инкубируют культуры в орбитальном шейкере (около 180 оборотов в минуту) при температуре 30 ° С в течение ночи. Большинство С. Albicans штаммов будет расти, поскольку дрожжевые клетки в этих условиях.
- Центрифуга ночь культур (около 3000 оборотов в минуту, 5-10 минут), промыть клетки в два раза стерильной PBS, и ресуспендируют конечный осадок примерно в 20-25 мл RPMI 1640, буфер с 165 мМ morpholinepropanesulfonic кислотой до рН 7,0 и подогретого при 37 ° C (отныне эта среда называется просто "RPMI 1640").
- Граф клеток с использованием hemacytometer. После подсчета, готовят суспензию клеток на конечную плотность 1,0 х 10 6 клеток / мл в RPMI 1640.
Примечание: Поскольку клетки имеют тенденцию к агрегации, важно, чтобы вихрь энергично между стирок и перед пипетки.
2. Настройка 96-луночных планшет для формирования биопленки
- Использование многоканальной пипетки добавьте 100 мкл C. Albicans суспензии в выбранной скважины 96-луночных планшет (-ов). Не добавляйте клетки к скважинам в колонке 12, как они будут служить в качестве отрицательного контроля.
- Обложка весь планшет с оригинальной крышкой, печать с парафильмом, места внутри инкубатора и инкубировать в течение 24 ч при температуре 37 ° C. Длина инкубации могут быть адаптированы к конкретным экспериментальным дизайном. Например, можно исследовать кинетику образования биопленки в течение 24 - 48 часов путем посева несколько пластин и обработки каждой пластине в различные моменты времени (2, т. е. 4, 8, 12, 24 и 48 ч)
- После образования биопленки, используя многоканальную пипетку аспирата среду тщательно, чтобы не касаться и разрушают биопленки, которые сформировались в каждой из скважин.
- Использование многоканальных пластин пипетки мыть три раза в стерильном PBS (200 мкл на лунку). Кроме того, использование автоматизированных шайбу планшет. Между моет, и особенно после последнего мытья, процедить пластин в перевернутом положении по промокательной с бумажными полотенцами, чтобы удалить остатки PBS. На данный момент биопленки образуются на дне скважины должны быть четко видны даже невооруженным глазом, а также может быть визуализированы использованием инвертированного микроскопа (рис. 1). Биопленки теперь готовы быть обработаны для противогрибкового анализов тестирования восприимчивости.
(Если основной целью эксперимента является оценка степени формирование биопленок, плиты готовы быть обработаны с использованием колориметрического метода. Для этого XTT / менадиона реагента (см. шаг 3 ниже) могут быть добавлены и результирующий цвет читать с помощью читатель планшет).
3. Противогрибковые Тестирование Восприимчивость Биопленки
- С растворы или порошок, готовят рабочий раствор в RPMI 1640, каждого противогрибковые для тестирования. Типичные высокой концентрации 1024 мкг / мл для флуконазол, и 16 мкг / мл для обоих амфотерицина В и каспофунгина. Другие концентрации могут быть использованы для различных агентов.
- Использование многоканальной пипетки внести 200 мкл высокой рабочей концентрации противогрибковых в соответствующие лунки в колонке 1 каждый планшет содержащие грибковую биопленки.
- Добавить 100 мкл RPMI 1640 в каждую лунку в колонках 2 до 10.
- Добавить 100 мкл RPMI 1640 по скважин в колонке 11.
- Удалить 100 мкл противогрибковый препарат из скважин колонки 1 и добавить в соседних скважин в колонке 2 (уже содержащую 100 мкл среды).
- Смешайте содержимое также с помощью пипетки вверх и вниз для выполнения серийного разведения удвоение, и удалить советы.
- Повторить перемещение вправо, пока скважин колонки 10, после чего окончательный объем 100 мкл из скважин колонке 10 после смешивания отбрасывается. Таким образом, серия удвоение разведения вашего агента (-ов), имеющие отношение было создано, а с наиболее концентрированным в скважинах колонны с 1 по мере сосредоточена в скважинах колонку 10. Безраздельно биопленки в колонке 11 будет служить положительным контроля, а также пустые скважины в колонке 12 будет служить отрицательным контролем.
- Обложка пластин с крышками, печать с парафильмом и инкубировать в течение 24 -48 часов при температуре 37 ° C.
- После инкубационного периода вымыть пластины, как в шаге до 2,4 (3 х PBS).
- Использование многоканальной пипетки добавьте 100 мкл XTT / менадиона раствора в каждую лунку содержащие предварительно мыть биопленки, а также к негативным скважин управления для измерения фоновых XTT-колориметрическим уровнях.
- XTT готовят насыщенный раствор по 0,5 г / л лактата Рингера стерильные, PBS или физиологический раствор, который должен быть фильтр-стерилизовать использованием 0,22 мкм, размер пор фильтра. Решение XTT является светочувствительным, поэтому она должна быть покрыта алюминиевой фольгой, в процессе приготовления. После подготовлены и фильтр-стерилизовать, аликвоту в 10 мл рабочими объемами, и хранить при температуре -70 ° C. Защита труб от света с помощью алюминиевой фольги. Оттепель ровно столько труб, сколько необходимо для конкретного эксперимента непосредственно перед использованием.
- Менадиона готовят 10 мМ маточного раствора в 100% ацетон, аликвоты в меньших объемах (около 50 мкл) и хранить при температуре -70 ° C. Подготовка XTT / менадиона решение непосредственно перед использованием, путем добавления 1 мкл исходного раствора менадиона в пробирку, содержащую 10 мл талой XTT решение.
- Обложка пластин в алюминиевой фольги и инкубировать в темноте в течение 2 ч при 37 ° C.
- Раскройте пластин. Использование многоканальной пипетки удалить 80 мкл в результате цветной супернатант из каждой лунки и передачи в соответствующие лунки новой планшет.
- Прочитано пластины (-ы) в читателя планшет при 490 нм.
- Рассчитать сидячие минимальную подавляющую концентрацию SMIC50 и SMIC80, которые противогрибковые концентрации, при которых 50% или 80%-ное снижение колориметрических показаний обнаружены в сравнении с контролем биопленки образуются в отсутствие противогрибкового препарата (в данном случае значения для столбца 11 , не забудьте также вычесть значения от отрицательных контролей из скважин в колонке 12, содержащий XTT только). МРОТ результаты могут быть представлены в виде таблицы (например, несколько изолирует от нескольких противогрибковых препаратов) или, наоборот, результаты для каждого отдельного грибковых изолировать друг с противогрибковым могут быть представлены в виде графика, откладывая процент ингибирования по сравнению с противогрибковые концентрации.
Пример: После вычитания значения отрицательного контроля, средняя ОП биопленки контроля формируется в колонку 11 составляет 1,32. SMIC50 является самым низким противогрибковые концентрации приводит к> 50%-ное снижение колориметрических чтениях, в этом случае меньше, чем 1,32 х 50 / 100 = 0,66. Кроме того, SMIC80 является самым низким противогрибковые концентрации приводит к> 80%-ное снижение колориметрических чтениях, в этом случае меньше, чем 1,32 х 20 / 100 = 0,264.
4. Представитель Результаты
На рисунке 1 показана микрофотография C. Albicans биопленки образуются на дне колодца в 96 планшет сделан с использованием инвертированного микроскопа. На рисунке 2 показан XTT-колориметрическим чтениях (OD 490 значений) для каждого из 11 биопленки из C. Albicans штаммом дикого типа образуются в каждом из 8 различных строк одного и того же 96-луночных планшет. На рисунке 3 показана активность амфотерицина В при различных концентрациях против C. Albicans биопленки; стрелки указывают SMIC50 и SMIC80 ценностей.

Рисунок 1. () Панель показывает, микрофотография, сделанные с использованием камеры, прикрепленной к перевернутой микроскопа C. Albicans биопленки образуются на дне колодца после аспирации RPMI средних и последующих стирок с PBS. (B) микрофотография типичная C. Albicans биопленки визуализированы с помощью сканирующей электронной микроскопии. Бары 100 мкм и 10 мкм для панелей и В соответственно.
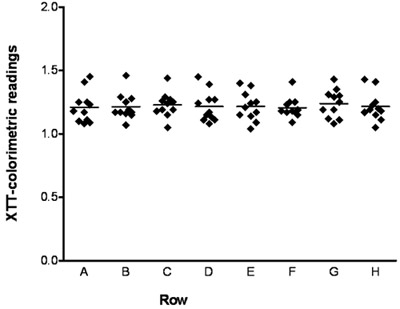
Рисунок 2. Формирование несколько эквивалентных C. Albicans биопленки в 96-луночных микротитровальных. колориметрический чтениях (OD 490 значений) из XTT сокращения анализов биопленок образована C. Albicans дикого типа в скважинах микротитровальных пластин. Значения для 11 независимых биопленки образуются в каждом из 8 различных строк одного и того же 96-луночных планшет. Результаты для разных строках сравнивались с помощью одностороннего дисперсионного анализа и с помощью тест Бартлетта для однородности дисперсий и многочисленные сравнения Бонферрони пост-тест. Статистически значимых различий были отмечены при сравнении всех пар строк друг к другу (P> 0,05).
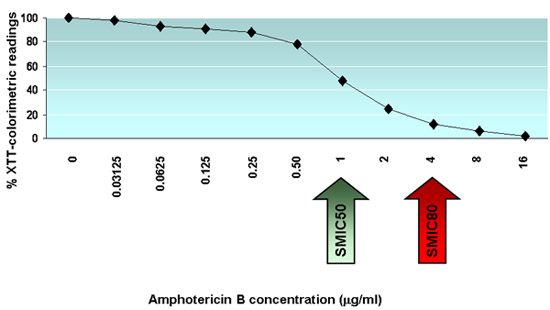
Рисунок 3. Типичные результаты тестирования чувствительности к противогрибковым против C. Albicans биопленки. график, иллюстрирующий типичные результаты эффективности различных концентраций амфотерицина B против биопленок из C. Albicans штаммом дикого типа. Значения выражаются как средний процент колориметрических показания для XTT сокращения тестов по сравнению с контрольной скважины. SMIC50 и SMIC80 значения указаны стрелками.
Обсуждение
Здесь мы опишем простой, быстрый, экономичный и очень воспроизводимые модели с 96 планшет для формирования биопленок Candida в сочетании с колориметрическим методом, что меры, метаболической активности клеток внутри биопленки использованием XTT. Это 96-модель планшет для биопленки перв...
Раскрытие информации
Благодарности
Биопленка связанных работать в лаборатории финансируется за счет грантов и пронумерованы R21DE017294 R21AI080930 из Национального института стоматологических и черепно-лицевых исследований и Национальным институтом аллергии и инфекционных заболеваний (в JLL-R.). Содержание несут их авторы и не обязательно отражает официальную точку зрения NIDCR, NIAID или НИЗ.
Материалы
| Name | Company | Catalog Number | Comments |
| Sabouraud-dextrose agar | BD Biosciences | 211584 | To prepare plates for fresh subcultures of fungal isolates |
| YPD: Yeast peptone dextrose | US Biological | Y2076 | Medium for propagation of overnight liquid cultures |
| RPMI-1640 without sodium bicarbonate supplemented with L-glutamine | Cellgro | 50-020-PB | Liquid medium for biofilm formation |
| Morpholinepropanesulfonic acid (MOPS) | Fisher Scientific | BP308 | To buffer RPMI 1640 |
| Phosphate buffered saline, PBS | Sigma-Aldrich | P4417 | Buffer for washes |
| XTT sodium salt | Sigma-Aldrich | X4251 | See above for preparation instructions |
| Ringer’s lactate | Hospira Inc. | NDC0409-7953-09 | For preparation of XTT solution |
| Menadione | Sigma-Aldrich | M5625 | Caution: hazardous by skin contact, inhalation or ingestion |
| Petri dishes | Fisher Scientific | 08-757-12 | |
| 15 ml conical centrifuge tubes | Corning | 430790 | |
| 50 ml conical centrifuge tubes | Corning | 430828 | |
| 96 well microtiter plates: Polystyrene, flat-bottomed, tissue culture treated | Corning | 3595 | |
| Multichannel pipette and tips | Eppendorf | ||
| Incubator | Any Supplier | ||
| Microtiter plate reader | Any Supplier |
Ссылки
- Bachmann, S. P. In vitro activity of caspofungin against Candida albicans biofilms. Antimicrob Agents Chemother. 46, 3591-3596 (2002).
- Hawser, S. P., Norris, H., Jessup, C. J., Ghannoum, M. A. Comparison of a 2,3-bis(2-methoxy-4-nitro-5-sulfophenyl)-5-[(phenylamino)carbonyl]-2H-t etrazolium hydroxide (XTT) colorimetric method with the standardized National Committee for Clinical Laboratory Standards method of testing clinical yeast isolates for susceptibility to antifungal agents. J Clin Microbiol. 36, 1450-1452 (1998).
- Kuhn, D. M., Balkis, M., Chandra, J., Mukherjee, P. K., Ghannoum, M. A. Uses and limitations of the XTT assay in studies of Candida growth and metabolism. J Clin Microbiol. 41, 506-508 (2003).
- Kuhn, D. M., George, T., Chandra, J., Mukherjee, P. K., Ghannoum, M. A. Antifungal susceptibility of Candida biofilms: Unique efficacy of amphotericin B lipid formulations and echinocandins. Antimicrob. Agents Chemother. 46, 1773-1780 (2002).
- Nobile, C. J., Mitchell, A. P. C. albicans transcription factor Bcr1p: a regulator of cell-surface genes and biofilm formation. Current Biol. 15, 1150-1155 (2005).
- Ramage, G., Saville, S. P., Thomas, D. P., Lopez-Ribot, J. L. Candida biofilms: an update. Eukaryot Cell. 4, 633-638 (2005).
- Ramage, G., Vande Walle, K., Wickes, B. L., p, B. L., Lopez-Ribot, J. L. Standardized method for in vitro antifungal susceptibility testing of Candida albicans biofilms. Antimicrob Agents Chemother. 45, 2475-2479 (2001).
- Bachmann, S. P. Antifungal combinations against Candida albicans biofilms in vitro. Antimicrob Agents Chemother. 47, 3657-3659 (2003).
- Ramage, G., VandeWalle, K., Bachmann, S. P., Wickes, B. L., Lopez-Ribot, J. L. In vitro pharmacodynamic properties of three antifungal agents against preformed Candida albicans biofilms determined by time-kill studies. Antimicrob Agents Chemother. 46, 3634-3636 (2002).
- Ramage, G., VandeWalle, K., Wickes, B. L., López-Ribot, J. L. Characteristics of biofilm formation by Candida albicans. Rev. Iberoam. Micol. 18, 163-170 (2001).
- Tellier, R., Krajden, M., Grigoriew, G. A., Campbell, I. Innovative endpoint determination system for antifungal susceptibility testing of yeasts. Antimicrob Agents Chemother. 36, 1619-1625 (1992).
- Nett, J., Andes, D. Candida albicans biofilm development, modeling a host-pathogen interaction. Curr Opin Microbiol. 9, 340-345 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены