Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
миРНК Скрининг для идентификации Убиквитин и Убиквитин-подобной системе регуляторов биологических путей в культивируемых клетках млекопитающих
В этой статье
Резюме
Здесь мы описываем методологию для выполнения целевой миРНК экрана "ubiquitome" для идентификации новых убиквитин и убиквитин-как регуляторов HIF1A опосредованного клеточного ответа на гипоксию. Это может быть адаптирована к любой биологической реакции, где надежной чтения из репортерной активности доступен.
Аннотация
Пост-трансляционной модификации белков с убиквитиновых и убиквитиновых-подобных молекул (UBLs) становится динамичной сети сотовой сигнализации, которая регулирует разнообразные биологические пути в том числе реагирования гипоксия, proteostasis, в ответ на повреждения ДНК и транскрипции. Чтобы лучше понять, как UBLs регулировать пути, имеющие отношение к человеческой болезни, мы составили человека миРНК "ubiquitome" библиотека, состоящая из 1186 миРНК дуплексных бассейнов, ориентированных на все известные и предсказал компоненты системы путей UBL. Эта библиотека может быть экранированы против ряда клеточных линий, выражающих журналистам разнообразных биологических путей, чтобы определить, какие компоненты УБЛ действуют как положительные или отрицательные регуляторов пути в вопросе. Здесь мы опишем протокол, использующий эту библиотеку, чтобы определить ubiquitome-регуляторы на HIF1A опосредованного клеточного ответа на гипоксию, используя транскрипции на основе люциферазы репортера. Начальная стадия развития анализавыполняется установить подходящие параметры отбора в клеточной линии, прежде чем выполнять экран в три этапа: первичная, вторичная и третичная скрининга / деконволюция. Использование целевых над целые библиотеки генома миРНК становится все более популярным, поскольку это дает преимущество отчетности только на членов пути, с которой следователи наиболее заинтересованы. Несмотря ограничений, присущих миРНК скрининга, в частности ложных срабатываний вызвано миРНК мимо ворот эффектов, выявление подлинных новых регуляторов путей в вопросе перевешивают эти недостатки, которые могут быть преодолены путем выполнения серию тщательно предпринятых контрольных опытов.
Введение
Модификация белков с убиквитиновых и убиквитиновых-подобных молекул (UBLs) представляет обширный биохимической системы, которая регулирует разнообразные биологические пути и ответные реакции на стресс. Ковалентное присоединение UBLs их белков-мишеней может иметь различные результаты, регулирующие стабильность, локализацию, функцию или интерактома подложки 1. Ферментативные шаги, лежащие в основе модификации UBL впервые были созданы для убиквитином, и в настоящее время служат в качестве парадигмы для модификации с большинством UBLs, в том числе сумо, NEDD8, ISG15 и FAT10. Для изменения происходят, карбоксилат группа diglycine мотив UBL сначала активируется активирующего фермента E1 для формирования высокой энергии тиол, что передается на активно-сайте цистеина в сопрягающего фермента Е2. Е2 затем взаимодействует с подложки с привязкой E3 лигазы посредничать передачу УБЛ на (обычно) целевой остаток лизина создания разветвленной цепью (изопептида) связи 2. Последовательных циклов модификации могут иметь место, чтобы построить изопептида цепи на подложку, которая для убиквитина может происходить через любой из семи лизина, или через его N-концевого метионина, чтобы создать линейные цепочки убиквитин. Эти изменения формируют дискретные топологии с различных целей, таких как создание новых мотивов взаимодействия и ориентации белки для деградации до удаления UBL специалистом протеаз. В случае убиквитина есть два E1 ферменты, 30-40 E2 сопрягающие ферменты, по крайней мере, 600 E3 лигазы и примерно 100 deubiquitylating ферменты (дублирует). В то время как пути менее экспансивным для других 10 или около того UBLs, общая сложность ubiquitome дает огромное разнообразие в биологической исход конкретного модификации UBL. Тем не менее, в то время как крупные успехи в UBL биологии были сделаны, точные сотовые роли большинства этих компонентов ubiquitome остаются неизвестными.
Использование короткого междунарerfering рибонуклеиновая кислота (миРНК) стала мощным инструментом в обратной генетики из-за способности миРНК непосредственно для клеточных мРНК для уничтожения, позволяя роль отдельных генов, которые будут рассмотрены в различных биологических контекстах 3. Целые экраны генома были использованы для идентификации и проверки новых регуляторов многих клеточных процессах, и создали множество полезных данных, доступную для широкой научной общественности. Тем не менее, в то время как целые экраны генома оказались крайне полезными, целевые экраны становятся все более популярными, поскольку они дешевле, быстрее, привлечь меньше по управлению данными и отчет только на членов генома, в котором следователь является наиболее заинтересованы. Поэтому, чтобы лучше понять, какие компоненты семейства клеточные процессы УБЛ участвуют в, мы составили человеческого библиотеку миРНК ориентации все известные и предсказал компоненты ubiquitome. Это включает в себя UBLs, E1 активирующие ферменты, E2 сопрягающихферменты, E3 лигазы, убиквитин-связывающий домен (UBD), содержащих белки и называет. Эта библиотека может быть использована для экрана против широкого спектра линий репортер клеток различных биологических проблем, что позволяет объективную идентификацию новых компонентов UBL, регулирующих эти пути.
Следующий протокол описывает, как выполнить строгий целевых миРНК ubiquitome экран для определения новых регуляторов в HIF1A-зависимых ответ на гипоксию. При нормальном давлении кислорода, HIF1A подлежит пролил гидроксилирования, что приводит к его признать и направлены на деградацию по Гиппеля Линдау (ВХЛ) E3 лигазы комплекса 4. Гипоксия ингибирует пролил гидроксилирование, ведущие к стабилизации HIF1A и его последующего связывания с чувствительными элементами гипоксии (HRES) для управления экспрессией генов. Здесь мы описываем экран использованием клеток остеосаркомы U20S, стабильно экспрессирующих светлячка люциферазы под контролем трех тандемных копий Hypoxia элемент, отвечающий (U20S-HRE клетки) 5. Этот протокол может быть адаптирован для любой биологической реакции, если надежным для чтения из репортерной активности достижимо и может быть соединен с соответствующими положительным и отрицательным контролем.
протокол
1. Анализ Стадия разработки
Примечание: до начала экран миРНК, этап развития анализа имеет решающее значение для изложены важные параметры для скрининга с линией репортера клеток. Важно, чтобы инвестировать значительные усилия на данном этапе, так как это будет лежать в основе будущего успеха экране.
- Чтобы охарактеризовать гипоксией реагирования U20S-HRE линии репортер клеток, растут 2 х 75 см 2 колб U20S-HRE клеток в 80-90% слияния в Dulbeccos модификации Дульбекко (DMEM) с добавлением 10% FBS.
- Аспирируйте носитель одной из колб клеток, дважды промывали 10 мл PBS и отделить клетки добавлением 2 мл 0,05% раствора трипсина-ЭДТА и инкубировали при 37 ° С в течение 5 мин. Ресуспендируют клеток в 8 мл DMEM 10% FBS и пипетки вверх и вниз для создания гомогенной суспензии клеток.
- Внесите 20 мкл суспензии в счетной ячейки камеры, в двух экземплярах, и вставить в камеру в автоматизированную клеток кулоновГюнтер. Нажмите кнопку "Показать изображение" на встречной клеток программного обеспечения и обеспечить клетки находятся в фокусе. Нажмите кнопку "Count" и запишите плотности клеток. Повторите эту процедуру для другой экземплярах и вычислить среднюю плотность клеток. Развести клетки с DMEM 10% FBS в концентрации 60000 клеток / мл.
- Использование многоканальной пипетки, добавьте 100 мкл (6000 клеток) разбавленных клеток в те же три колонки (например А5-H5, A6-H6 и А7-H7) из 5 стерильных белых стенами 96-а планшеты для анализа и передачи в увлажненный 37 ° C инкубаторе при 5% CO 2 в течение ночи. Примечание: эти плиты будут использоваться для определения гипоксии зависит от люциферазы выход для различном воздействии гипоксии: 0 ч, 2 ч, 6 ч, 10 ч и 24 ч..
- В конце следующего дня, обратите внимание на время и добавить 24 часами гипоксия пластину к набору гипоксия рабочей станции до 1% кислорода. На следующее утро, рассчитать время 10 час, 6 часов и 2 ч до 24 ч пластины должен быть удален фром рабочая станция гипоксия. В эти времена, добавьте 10 час, 6 часов и 2 часа пластины к рабочей станции гипоксии.
- Подготовка 30 мл 2 раза в сочетании буфера для лизиса люциферазы / анализа (50 мМ Трис рН 7,8 Фосфат; 16 мМ MgCl 2, 2 мМ ДТТ, 2% Triton-X-100, 30% глицерина, 1 мМ АТФ, 1% BSA; 0,25 мМ люциферина и 8 мкМ Na 4 P 2 O 7). Примечание: добавить компоненты в указанном порядке и позволяют БСА, по крайней мере 30 минут, чтобы растворить перед добавлением люциферина и Na 4 P 2 O 7.
- Удалите все тарелки с рабочей станции гипоксии в соответствующее время. Добавить 100 мкл 2х люциферазы лизис / буфере для анализа в соответствующие лунки планшета для анализа и накрыть прозрачной пленкой. Взболтать тарелки на планшетном шейкере в течение 10 мин при 500 оборотах в минуту тщательно лизиса клеток.
- Трансфер стек пластины к автоматизированной 96 а стойки пластины люминометра. В меню "Протоколы", выберите "абс 595" и выделить все WELлс следует рассматривать в экранном пластины карте в меню "хорошо выбор". Нажмите "Выполнить" для измерения люминесценции каждую лунку затем вычислить среднее чтение каждой пластины. Рассчитайте гипоксией зависит раза-увеличение репортера деятельности путем деления средней чтение каждого гипоксии пластины на среднее чтении нормоксии (0 ч гипоксия) контроль пластины. Примечание: важно соблюдать надежную гипоксии зависит от ответа люциферазы, чтобы быть пригодным для скрининга. Пять-десять кратное увеличение в репортера деятельности считается отличным.
- Создайте мастер управления пластину, содержащую четыре высокую контроль (HIF1A миРНК) репликантов (колодцы А1-D1), четыре низким управления (FIH1 миРНК) повторяет (скважины A12-D12), четыре буфера только контролировать повторов (скважины E1-H1) и четыре контроль миРНК нецелевых повторов (E12-H12), где все бассейны миРНК которые в концентрации 200 нМ. Примечание: высокого и низкого контроля устанавливаются, исходя из известного регуляторов тропа, которые увеличивают и ОВЦСоблегчить реакцию гипоксия соответственно. Кроме того, развитие анализа с использованием подмножества библиотеки могут быть использованы для определения подходящих управления.
- Использование многоканальной пипетки, передать 10 мкл каждого контрольного миРНК в стерильную белой стеной планшет для анализа. Подготовка трансфекции смесь 0,1 мкл реагента для трансфекции в 10 мкл сниженной сыворотки среде (1:100) на лунку, и передачи 10 мкл трансфекции смесь к каждому контроля скважины. Внесите вверх и вниз кратко перемешать, и оставить тарелку отдохнуть в течение 20-60 мин, чтобы позволить трансфекции образование комплекса.
- Подготовьте клеточной суспензии из 75000 клеток / мл со вторым колбу U20S-HRE клеток. Использование многоканальную пипетку, добавьте 80 мкл (6000 клеток) клеточной суспензии на каждой трансфекции смеси. Передача пластину в увлажненной 37 ° C инкубаторе с 5% CO 2 в течение 24 ч, а затем перенести на рабочую станцию гипоксии в течение еще 24 ч и выполнять люциферазы анализов, как описано в шагах 1,6-1.8.
- Вычислить Z-фактора для высоких и низких управления, используя формулу Z = 1 - [3 х (стандартное отклонение высокого контроля + стандартное отклонение низкой контроля) / (имею в виду высокого контроля - среднее низкой контроля)]. Примечание: стоимость между 0,5-1 указывает отличную анализа и следует стремиться.
2. Основной Экран
Примечание: как только эти основные условия от стадии развития анализа на месте, первичный экран может быть выполнен в трех экземплярах в формате 96 хорошо пластины по следующему протоколу.
- Grow 7 х 75 см 2 колб U20S-HRE клеток в 80-90% слияния в среде DMEM с добавлением 10% об / об эмбриональной телячьей сыворотки (FCS).
Примечание: следующие шаги 2.2-2.13 следует проводить на 1 день. - Инициировать копировщика 1 путем подготовки мастер управления пластину, содержащую 200 мкл каждого элемента управления, как описано в шаге 1.9 и оттаивания серию разбавления миРНК ubiquitome лibrary в течение как минимум 30 мин. Примечание: каждая лунка содержит пул 4 миРНК, собранных в 17 х 96-луночных планшетах с колоннами 1 и 12 оставлено пустым для элементов управления.
- В ламинарном боксе, метка (или штрих-кода) 17 стерильные белые стеной аналитические планшеты с крышками из чисел 1-17, соответствующие каждой пластины из библиотеки серии миРНК.
- Центрифуга мастер управления тарелку и миРНК ubiquitome библиотеки кратко (1 мин при 2000 мкг в) обеспечить все миРНК накапливаются на дне колодца.
- Используйте автоматическую дозатора жидкости для робота "штамп" 10 мкл каждого элемента управления от главного управляющего пластины на планшеты для анализа 17, используя тот же стек наконечника 96-а для каждой пластины.
- Использование свежий стек наконечника 96-луночного для каждого из библиотеки пластин 17, передачу 10 мкл каждого ubiquitome миРНК в соответствующий планшет для анализа с использованием автоматического дозатора жидкости.
- Подготовка 40 мл реагента для трансфекции для 17 аналитических планшетах с использованием соотношения ESзана на 1,10. Примечание: это включает в себя еще 20 мл к ответственности за "мертвого объема" в клеточной дозатора. "Мертвый объем» относится к объему жидкости непрерывно настоящего в сети труб в клеточной дозатора.
- С помощью автоматизированной клеток дозатор для передачи 10 мкл реагента для трансфекции в каждую лунку в планшеты для анализа 17. Вкратце трясти аналитические планшеты на шейкере (1 мин при 500 оборотах в минуту), чтобы позволить тщательное смешивание миРНК и реагента для трансфекции, а затем оставить все еще при комнатной температуре в течение 20-60 мин, чтобы позволить миРНК: трансфекции реагент образование комплекса.
- Вымойте два 75 см 2 колбы U20S-HRE клеток дважды 10 мл PBS и снять с 2 мл трипсина-EDTA при 37 ° С в течение 5 мин. Добавить 8 мл DMEM 10% FBS в каждую колбу и пипетку вверх и вниз несколько раз, чтобы создать гомогенной суспензии клеток. Комбинат клетки с обеих колб и передать в стерильную 50 мл пластиковую трубку.
- Рассчитать концентрацию клеток с помощью пипетки20 мкл клеток в двух экземплярах на подсчета клеток камеры и рассчитать среднюю концентрацию клеток из двух показаний счетчика автоматизированной клеток, как описано в шаге 1.3.
- Подготовка 155 мл клеточной суспензии путем разбавления DMEM 10% FBS в концентрации 75000 клеток на мл в стерильном пластиковый контейнер. Примечание: этот объем является достаточным для 17 пластин и включает в себя еще 25 мл для мертвого объема в клеточной дозатора.
- Добавить стерильный магнитной мешалки к клеточной суспензии и место на мешалкой, созданной внутри ламинаре ограничить клеток комков. Равновесие автоматизированную клеток дозатор с клеточной суспензии и установить его отказаться 80 мкл клеток на лунку (6000 клеток).
- Наведите каждого из 17 пластин, в свою очередь, на автоматизированной клеток дозатором и обойтись клетки. Запишите время и стека пластин в группах по 5 затем поместить стеки во влажном 37 ° C инкубаторе при 5% CO 2 в течение 24 часов. Примечание: конечной концентрациимиРНК бассейн будет 20 нМ в 100 мкл общего объема.
Примечание: следующие шаги 2.14-2.15 должны проводиться на 2-й день. - Инициировать второй копировщика в день 2, в соответствии с процедурой, описанной в 1-й день для репликации 1 (2.2-2.13).
- Через 24 часа трансфекции передачи плиты из реплик 1 в стерильной среде до рабочей станции гипоксии установлена на уровне 1% кислорода и оставить на 24 часов, чтобы вызвать репортеру HRE.
Примечание: следующие шаги 2.16-2.20 следует проводить в День 3. - Инициировать третий репликации в соответствии с процедурой, описанной в 1-й день для репликации 1 (2.2-2.13).
- Через 24 часа трансфекции передачи плиты из реплик 2 в стерильной среде до рабочей станции гипоксии установлена на уровне 1% кислорода и оставить на 24 часов, чтобы вызвать репортеру HRE.
- За два часа до 1 репликации пластины должны быть удалены с рабочей станции гипоксии, готовят 200 мл люциферазы 2x лизис / буфере для анализа, как описано в 1.6. Примечание: этот объем вcludes дополнительные 20 мл для обеспечения буфер водохранилище остается хорошо освещены.
- Удалить повторить 1 Планшеты от станции гипоксии после воздействия 24 часа в сутки гипоксии и с использованием автоматизированного дозатора жидкости, добавить 100 мкл 2x люциферазы лизис / буфере для анализа каждой планшет для анализа и накрыть прозрачной пленкой.
- Взболтать пластины по мобильному шейкере в течение 10 мин при 500 оборотах в минуту тщательно лизиса клеток. Передача каждую тарелку в свою очередь, к считывателю люминометра пластины и записывать люминесценции как описано на стадии 1.8.
Примечание: следующие шаги 2.21-2.22 следует проводить в День 4. - Через 24 часа трансфекции передачи плиты из реплик 3 в стерильной среде до рабочей станции гипоксии установлена на уровне 1% кислорода и оставить на 24 часов, чтобы вызвать репортеру HRE.
- Читайте реплику 2 тарелки, выполнив действия 2.18-2.20, используемых для репликации 1.
Примечание: следующий шаг 2.23 следует проводить на 5-й день. - Читайте дублирующие 3 тарелки, следуяшаг 2.18-2.20, используемый для репликации 1.
- Компиляция всех 3 повторов основного экрана, и вычислить коэффициент Z для каждой пластины по формуле, приведенной в 1.12. Примечание: если любой пластина имеет Z-фактор меньше чем 0,5, рассмотрим повторяя эту пластину для улучшения качества данных.
- Рассчитывают коэффициент дисперсии (CV) для высокого и низкого контроля, используя следующую формулу: 100 х стандартное отклонение управления / среднем контроля. Примечание: резюме должно быть как можно более низкой, то разумно ожидать 10-15% вариации. Если изменение значительно выше, рассмотрим повторяя пластину.
- Вычислить процентное активацию каждого миРНК на пластине с помощью следующей формулы: [(среднее высокого контроля - оценка миРНК) / (среднее высокой контролем - среднее низкой контроля)] х 100 Кроме того, вычислить нецелевых (NT. )-кратное каждого миРНК по формуле [Пример данные / среднее из NT]. Для обоих процент активации и NT раза, вычислить среднее значение трех репликТочные и скомпилировать значения.
- Используя исходные данные, рассчитать Спирмена Ранг коэффициент корреляции (НИВЦ), чтобы определить, насколько тесно три повторных пластины коррелируют по формуле:
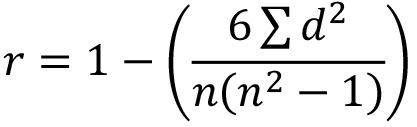
где г = НИВЦ; д = разница между двумя числами в каждой паре рядов и п = число пар данных. Примечание: хорошая корреляция между плит повторах даст значения, близкие к 1 Если репликат показывает низкую НИВЦ против других 2 пластин, дальнейшее расследование и попробуйте повторить эту тарелку.. - Решите, какие миРНК имеют достаточный интерес для вторичного скрининга (до 80). Применять определяемые пользователем вырезать офф (например, выбор все миРНК, показывающие менее 5% или более 95% процентов активации, или менее 0,5 NT-кратное или более 1,5 NT раза) или применить биоинформатики или рассуждения, основанного на знаниях, для поиска скоплений парад подпадающие под тем же UBL пути. Примечание:Как правило, комбинация этих подходов определяет, какие миРНК принимаются во вторичном скрининге.
3. Вторичный экран
Примечание: подтверждающего Дополнительный экран осуществляется на основе максимум 80 миРНК интерес с основного экрана. Это число может быть удобно проводить с каждой повторности с покрытием на одной 96-луночный планшет с полным контролем, как в первичном скрининге (см. 2.2). Это очень полезно, чтобы подтвердить, что регуляторы, выявленные на первичном экране воспроизводимо вызывает такую же фенотип, и это поможет в уточнении решения сортировки, на котором удары должны проводиться до окончательного экране третичный / деконволюции.
- Расти 1 х 75 см 2 колбу U20S-HRE клеток 80-90% слияния в DMEM с 10% FBS.
- Обратите внимание на номер машины и расположение основных хитов экрана, и планировать их новое расположение на вспомогательный экран вишня выбрал мастер пластину, оставляя колонок 1д. 12 бесплатно для элементов управления. Подготовка контрольного мастер пластины, как и в 1,9, но с общим объемом каждого элемента управления 50 мкл.
- Оттепель вторую серию разбавления ubiquitome библиотеки (отведенных для снятия сливок отдельных бассейнов миРНК) в течение как минимум 30 мин. Центрифуга кратко пластины (1 мин при 2000 мкг в) затем добавить 50 мкл вторичных миРНК на экране, чтобы их новых местах нахождения плиты на вишни взял мастер пластину.
- Провести вторичный экран, используя тот же базовый протокол, описанной дл основного экрана со следующими изменениями: (а) запустить все три повторов в тот же день в одном аналитическом планшете в репликации и (б) регулировать объемы реагентов соответственно.
4. Третичный / Деконволюция экрана
Примечание: третичные или деконволюции скрининг выполняется на максимум 20 киРНК из вторичного экрана. Этот шаг является изучение парализующим действием, используя каждый отдельный миРНК от первоначального мочитьсял из четырех. Обычно, по крайней мере, две отдельные миРНК дуплексы от каждого пула должны незаконного такой же фенотип иметь достаточную степень уверенности, что наблюдаемое фенотип не связано с миРНК мимо ворот эффектов. Для дальнейшего повышения доверия на данном этапе, дополнительные индивидуальные миРНК дуплексы, нацеленную на ген под вопросом могут быть разработаны и испытаны на их способности вызывать данный фенотип. Результаты этих экспериментов могут быть затем использованы для вычисления коэффициента H, где H = 0,6 или более (т.е. где по крайней мере 3 из 5 отдельных киРНК вызывают фенотип) считается приемлемым 6.
- Расти один 75 см 2 колбу U20S-HRE клеток 80-90% слияния в DMEM с 10% FBS.
- Создайте карту пластины для третичного экране, планируя расположение четырех отдельных миРНК дуплексов каждого хита на третичную экрана мастер пластины, оставляя столбцы 1 и 12 бесплатно для элементов управления. Подготовьте управления мастер пластины, как в 1,9, но в общей сложностиОбъем каждого элемента управления 50 мкл.
- Оттепель в деконволюция / индивидуальный миРНК тарелки и добавить 50 мкл отдельных миРНК (200 нм) в каждую лунку третичного экрана мастер пластины в соответствии с пластиной карте (4.2), чтобы позволить в течение трех х 10 мкл повторах и удобной 20 мкл свыше .
- Провести третичную экран, используя тот же базовый протокол, описанной дл основного экрана со следующими изменениями: (а) работают все три повторов в тот же день в одном аналитическом планшете за репликации и (б) регулируют объемы реагентов соответственно
Примечание: В идеале порог для отдельных дуплексы миРНК должен быть установлен на том же жесткости отсечения как для бассейна. Тем не менее, это может быть приемлемо, чтобы расслабить порог на 10-20% по отдельным киРНК, особенно там, где по меньшей мере один другой дуплекс находится в пределах заданного порога. Стоит имея в виду, что индивидуальный эффект киРНК может быть меньше, чембассейн, и, наоборот, в некоторых случаях отдельные миРНК может показать более сильное воздействие на клеточном фенотипа в изоляции, чем когда он существует в бассейне (даже тогда, когда концентрация учитывается).
Результаты
До скрининга, гипоксией отзывчивость U20S-HRE клеток устанавливается. U20S-HRE клетки экспрессируют репортер конструкцию, состоящую из люциферазы светляков плавленого вниз по течению от трех тандемных копий элемента ответа гипоксия, которая связана гетеродимера HIF1A/HIF1B при воздействии гипо?...
Обсуждение
Использование генома экранов миРНК в клетки млекопитающих оказалась чрезвычайно ценным в определении новых регуляторов различных биологических путей. Здесь мы описали использование целевой экране ubiquitome миРНК для выявления регуляторов HIF1A опосредованного клеточного ответа на гипок...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Эта работа была поддержана Wellcome Trust, GlaxoSmithKline (GSK) и шотландского Института клеточной сигнализации (теперь часть из фосфорилирования белков MRC и Ubiquitylation блока).
Материалы
| Name | Company | Catalog Number | Comments |
| Automated Liquid Dispenser | Fluid-X | XPP-721 | http://www.fluidx.eu/BIOTRACK/xpp-721-liquid-handling-system.html |
| White Walled Assay Plate | Greiner Bio One | 655083 | http://www.greinerbioone.com/en/row/articles/catalogue/article/37_11/13221/ |
| Clear Plate Film | Perkin Elmer | 1450-461 | http://www.perkinelmer.co.uk/Catalog/Product/ID/1450-461 |
| siRNA library | Thermo Scientific | On-Target Plus | http://www.thermoscientificbio.com/rnai-and-custom-rna-synthesis/sirna/on-targetplus-sirna/search-gene/ |
| Transfection reagent | Invitrogen | Lipofectamine RNAimax | http://www.invitrogen.com/site/us/en/home/Products-and-Services/Applications/Protein-Expression-and-Analysis/Transfection-Selection/lipofectamine-rnaimx.html |
| Reduced Serum Medium | Invitrogen | Optimem | http://products.invitrogen.com/ivgn/product/31985062?ICID=search-product |
| DMEM | Invitrogen | 41965-039 | http://products.invitrogen.com/ivgn/product/41965039# |
| FBS | Invitrogen | 16000-044 | https://products.invitrogen.com/ivgn/product/16000044?ICID=search-product# |
| Tryspin-EDTA | Invitrogen | 25300-054 | https://products.invitrogen.com/ivgn/product/25300054?ICID=search-product# |
Ссылки
- Hochstrasser, M. Origin and function of ubiquitin-like proteins. Nature. 458, 422-429 (2009).
- Schulman, B. A., Harper, J. W. Ubiquitin-like protein activation by E1 enzymes: the apex for downstream signalling pathways. Nat Rev Mol Cell Biol. 10, 319-331 (2009).
- Siomi, H., Siomi, M. C. On the road to reading the RNA-interference code. Nature. 457, 396-404 (2009).
- Kaelin, W. G., Ratcliffe, P. J. Oxygen sensing by metazoans: the central role of the HIF hydroxylase pathway. Mol Cell. 30, 393-402 (2008).
- Melvin, A., Mudie, S., Rocha, S. The chromatin remodeler ISWI regulates the cellular response to hypoxia: role of FIH. Mol Biol Cell. 22, 4171-4181 (2011).
- Bhinder, B., Djaballah, H. A simple method for analyzing actives in random RNAi screens: introducing the "H Score" for hit nomination & gene prioritization. Comb Chem High Throughput Screen. 15, 686-704 (2012).
- Bett, J. S., et al. The P-body component USP52/PAN2 is a novel regulator of HIF1A mRNA stability. Biochem J. 451, 185-194 (2013).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. J Biomol Screen. 4, 67-73 (1999).
- Birmingham, A., et al. Statistical methods for analysis of high-throughput RNA interference screens. Nat Methods. 6, 569-575 (2009).
- Stagg, H. R., et al. The TRC8 E3 ligase ubiquitinates MHC class I molecules before dislocation from the ER. J Cell Biol. 186, 685-692 (2009).
- Zhang, Y., et al. RNF146 is a poly(ADP-ribose)-directed E3 ligase that regulates axin degradation and Wnt signalling. Nat Cell Biol. 13, 623-629 (2011).
- Jackson, A. L., et al. Expression profiling reveals off-target gene regulation by RNAi. Nat Biotechnol. 21, 635-637 (2003).
- Birmingham, A., et al. 3' UTR seed matches, but not overall identity, are associated with RNAi off-targets. Nat Methods. 3, 199-204 (2006).
- . Whither RNAi. Nat Cell Biol. 5, 489-490 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены