Method Article
Стандарты для количественного анализа с использованием Metalloproteomic гельпроникающей ICP-MS
В этой статье
Резюме
Size exclusion chromatography hyphenated with inductively coupled plasma - mass spectrometry (ICP-MS) is a powerful tool to measure changes in the abundance of metalloproteins directly from biological samples. Here we describe a set of metalloprotein standards used to estimate molecular mass and the amount of metal associated with unknown proteins.
Аннотация
Metals are essential for protein function as cofactors to catalyze chemical reactions. Disruption of metal homeostasis is implicated in a number of diseases including Alzheimer's and Parkinson's disease, but the exact role these metals play is yet to be fully elucidated. Identification of metalloproteins encounters many challenges and difficulties. Here we report an approach that allows metalloproteins in complex samples to be quantified. This is achieved using size exclusion chromatography coupled with inductively coupled plasma - mass spectrometry (SEC-ICP-MS). Using six known metalloproteins, the size exclusion column can be calibrated and the respective trace elements (iron, copper, zinc, cobalt, iodine) can be used for quantification. SEC-ICP-MS traces of human brain and plasma are presented. The use of these metalloprotein standards provides the means to quantitatively compare metalloprotein abundances between biological samples. This technique is poised to help shed light on the role of metalloproteins in neurodegenerative disease as well as other diseases where imbalances in trace elements are implicated.
Введение
Основные металлы играют жизненно важную роль в нормальных биологических функций, в том числе вторичных мессенджеров путей, обмена веществ путей и функции органелл. 30% всех белков , как полагают, металлопротеиды 1 и 50% всех ферментов 2. Металлоферментах использовать эти металлы в качестве следовых кофакторов катализировать химические реакции, стабилизируют структуру белка, а также для регуляторных функций, таких как вторичных мессенджеров. Некоторые из наиболее изученных микроэлементов в отношении нейродегенерации являются медь, железо и цинк 3. Считается, что они должны быть вовлечены во многих путей заболевания, где с помощью dyshomeostasis может иметь неблагоприятные последствия. Например, статус металла супероксиддисмутазы (СОД) непосредственно влияет на продолжительность жизни и фенотипа трансгенных моделей мышей семейного типа бокового амиотрофического склероза (ALS) 4. При болезни Альцгеймера, metalloproteomics методы использовались, чтобы обнаружить снижение состояния металла трансферрина в рЛАЗМА 5. Эти исследования подчеркивают важную роль, которую могут играть металлопротеиды болезни.
Изучение металлопротеинов непосредственно из биологических тканей является полем развивается. Хотя некоторые металлоэнзимами были охарактеризованы, большинство по- прежнему остаются неохарактеризованных или неизвестно 6. Одной из основных проблем при измерении металлопротеинов является требование , чтобы сохранить естественное состояние белка 7. Классическая снизу вверх протеомические методы основаны на переваривание белков в пептидов. Этот процесс приводит к нарушению нековалентную взаимодействия металлов и их белков. Таким образом, никакой информации о состоянии металла белка не достигается.
Одним из способов преодоления этой проблемы является использование эксклюзионной хроматографии в паре с индуктивно связанной плазмой - масс - спектрометрии (8,9 SEC-ICP-MS). Это генерирует информацию о приблизительный размер белка, а также любые металлы, которые Assocзанного с ним 10. Кроме того, размер исключения нежный хроматографический метод, который может сохранить естественное состояние фермента или белок-белкового комплекса. Одно из преимуществ использования с индуктивно связанной плазмой - масс-спектрометрии (МС-ИСП) является количественный характер технологии. С помощью набора стандартов металлопротеиды можно обеспечить абсолютную количественную оценку металлопротеинов из биологических образцов 9,11. Это достигается за счет создания стандартной кривой, путем введения известных металлопротеиды в диапазоне концентраций металла.
Этот протокол показывает пример того, как это может быть достигнуто для различных стандартов металлопротеины. В этой статье мы стремимся создать стандартные кривые для металлов, которые в значительной степени исследованы в биологических областях, включая железо (Fe), меди (Cu), цинк (Zn), йод (I) и кобальта (Co).
протокол
1. Подготовка буферов и образцов
- Приготовления 500 мл буфера 200 мМ нитрата аммония рН 7,6 - 7,8 (рН с помощью гидроксида аммония (NH 4 OH)) с цезием (Cs) и антиномия (Sb) до конечной концентрации 10 частей на миллиард. Используйте цезий и антиномии в качестве внутренних стандартов для контроля за любого дрейфа в ответе ICP-MS. Буфер фильтра перед использованием через фильтр с размером пор 0,22 мкм.
- Подготовка образца в зависимости от типа образца: жидкость, ткани или клеточной культуре.
- Для образцов , которые требуют гомогенизации (например, ткани или клеток), убедитесь , что они не содержат моющие средства. Используйте Трис буферы для подготовки проб. В качестве альтернативы, использовать фосфатные буферы , но они могут негативно повлиять на metalloproteome с течением времени или замораживания циклов оттаивания 12.
- Однородный ткани или культуры клеток, образцов ручного гомогенизатора Даунса или обработке ультразвуком в течение 5 мин с использованием трис-солевой буферный раствор (50 мМ Трис, рН 8,0, 150 мМ хлорида натрия,(NaCl) + этилендиаминтетрауксусной кислоты (ЭДТА) бесплатно ингибиторы протеазы).
- Уточнить гомогенаты центрифугированием при 16000 мкг в течение 5 мин. Собирают полученного супернатанта. Хранить образцы при температуре 4 ° С.
Примечание: Все образцы должны быть центрифугируют перед загрузкой в высокоэффективной жидкостной хроматографии (ВЭЖХ) ампул для предотвращения частиц от блокирования колонки вытеснительной хроматографии (SEC).
- Нормализуют общее количество белка, наносили на колонку через образцы. Определение концентрации белка при 280 нм с использованием УФ - спектрофотометре микрообъема 13. Нагрузка от 20 до 150 мкг белка. Используйте типичные объемы впрыска в пределах от 2 - 80 мкл в зависимости от концентрации образца.
- Очистите образец руку микро объем УФ-спектрофотометре с дистиллированной водой до загрузки образца. Образец рука, где образцы белка загружены.
- Пустой прибор против 2-го мкле буфера выборок. Затем нагрузка 2 мкл каждого образца на руку налили и измеряют оптическую плотность при длине волны 280 нм.
- Определение концентрации. Для получения образцов сырого протеина, используют коэффициент экстинкции 1 Abs = 1 мг / мл. Для определения концентрации белка в образцах, используют Закон о Беэр-Ламберта, A = ε xlxc, где А обозначает оптическую плотность, ε коэффициент экстинкции, л длина пути в сантиметрах и с-концентрация.
2. Объемная Анализ металлопротеины стандартов с использованием индуктивно связанной плазмы - масс-спектрометрия
- Разминка и настраивать прибор с использованием протоколов изготовителя.
- После того, как прибор разогревается и настроен, выполнить объемную ICP-MS.
Примечание: Исходные растворы очищенных металлопротеинов как правило, должны быть разбавлены перед измерением. Концентрация металла стандарта может быть оценена из известного белка: металл stochiometries и оцененным белка Concentraции. Эта информация может быть использована для определения разбавления, которое будет уместно, чтобы попадать в диапазон стандартной кривой, полученной.- Развести стандарты металлопротеины, тиреоглобулина, ферритина, церулоплазмина, Cu / Zn СОД и витамин В 12, чтобы гарантировать , что они попадают в диапазон от 0 - 500 мкг / л, с использованием 1% -ной азотной кислоты. Для достижения стандартов в пределах этого диапазона, не используйте разведений, превышающими 1 в 20. Выполните серийные разведения в воде для разбавления запасов до этого в случае необходимости.
- Установить порядок инъекций. Во-первых, проанализировать семь уровней калибровки, концентрации в диапазоне от 0 - 500 мкг / л, а затем по стандартам металлопротеины. Семь уровней калибровки 0, 1, 5, 10, 50, 100 и 500 мкг / л.
- Выберите элементы, представляющие интерес. При этом, использование Fe, Cu, Zn, Co и я, так как они являются элементами, что белковые стандарты которые связаны с. Выберите элементы в способе приобретения, открыв вкладку селектора элемента и добавление остаетс NTS и их соответствующие изотопные масс, которые должны быть проанализированы.
- Провести анализ проб с прибором и программным обеспечением прибор автоматически создает калибровочные кривые для каждого из элементов анализируемого. Калибровочные кривые создаются с помощью программного обеспечения, откладывая имп / сек металла обнаруженного против количества металла, что стандарт предназначается, чтобы содержать в мкг / л. С помощью калибровочных кривых для определения концентрации металла в неизвестных образцах.
Примечание: С помощью калибровочной кривой, программное обеспечение определяет концентрацию металла в каждом из стандартов металлопротеины. - Из результатов анализа больших количеств, генерировать стандарты металлопротеины, которые включают три наиболее распространенных элементов след в тканях млекопитающих, используя смесь Cu, Zn супероксиддисмутазы (СОД), разведенного до 200 мкг / л меди и цинка и ферритина (FTN) в конечной концентрация 2,000 мкг / л железа.
Примечание: Этот раздел должен выполняться параллельно с предыдущим, так как они оба требуется около 1 - 1,5 ч, чтобы закончить.
- Продувка ВЭЖХ насосы с буфером созданной на шаге 1.1 и произвести чистку насосов в течение 5 мин при скорости потока 5 мл / мин.
- После того как система продувается, установите скорость потока 0,1 мл / мин и подключить колонки эксклюзионной (4,6 х 300 мм, 3 мкм, 150 Å).
Примечание: Мокрый соединение между трубой и колонной позволяет избежать пузырьки воздуха в ловушке во время соединения колонны. - Подключите противоположный конец колонки к УФ-детектора, установленного для измерения оптической плотности при 280 нм с использованием PEEK трубки.
- Постепенно увеличивают скорость потока колонки с шагом 0,05 - 0,1 мл / мин до тех пор, конечной скорости потока 0,4 мл / мин достигается. В то время как это происходит, проверьте соединения трубок в колонну для каких-либо утечек. Монитор давлениясистемы, чтобы убедиться, что он не превышает требований колонки путем наблюдения следов давления на хроматограмме в программном обеспечении.
- Оставьте колонку уравновешивают при требуемой скорости потока в течение 5 - 10 объемов колонки. После того, как она уравновешена, подключить инструменты для проведения анализа пробы происходит.
- Настройка метода ВЭЖХ до накачать буфера А через колонку при 0,4 мл / мин в течение 15 мин.
4. Настройка и запуск гельпроникающей - индуктивно связанной плазмой - Масс-спектрометрия
Примечание: Рабочие процедуры могут варьироваться в зависимости от инструментов и моделей. Обратитесь к техническому специалисту инструмент, чтобы узнать больше о том, как настроить ICP-MS используется.
- Поместите ICP - MS в режим ожидания перед изменением настройки аппаратного обеспечения.
- После того, как в режиме ожидания, отключить связь для автоматического пробоотборника и изменить образец введение в "другой".
Примечание: В зависимости от программного обеспечения и жесткогоИзделия конфигурации выбирающий "ВЭЖХ" в качестве источника ввода образца может быть использован. Обратитесь к техническому специалисту инструмент, чтобы узнать, если эта опция доступна.
- После того, как в режиме ожидания, отключить связь для автоматического пробоотборника и изменить образец введение в "другой".
- Используйте PEEK трубки (ID 0,13 мм) для подключения выхода потока из УФ-детектора непосредственно к распылителе на ИСП-МС.
- Мощность резервного копирования ICP - MS и дайте прибору прогреться в течение 10 - 20 мин.
- После того, как плазма воспламенится, подключить удаленный кабель от ICP - MS в задней части ВЭЖХ пробоотборником. Делайте это после того, как плазма зажигается; в противном случае система ВЭЖХ автоматически отключается после ПМС - MS не включен.
- Изменение метода ICP-MS для сбора данных для LC-ICP-MS.
- Alter метода приобретения из спектра для приобретения времени (TRA Resolve).
- Выберите элементы, которые будут проанализированы, Fe, Cu, Zn, Co, я, а также любые другие интересующие нас элементы, и установить время интеграции (как правило, от 0,05 - 0,3 сек). После того, как элементы долевымповторно выбран, отрегулируйте время захвата , чтобы соответствовать времени выполнения для хроматографии (например, 900 сек для хроматографии бега 15 мин).
- настраивать вручную ПМС - MS для чувствительности и столкновений клеток гелия (He) скорости потока газа с буфером хроматографии, протекающей с использованием Cs и Sb, включенных в буфер. Скорости потока Он, как правило, ~ 1 мл / мин меньше, чем те, которые используются для анализа больших количеств. После того, как счетчики ионов металлов стабилизировались и относительное стандартное отклонение значений (RSD) составляет менее 5%, система готова к использованию.
- Сделать пример запуска списков в обоих программ ICP-MS и ВЭЖХ. Список пример запуска содержит порядок, в котором каждый из образцов должен быть введен, а также имя, с помощью которого будут сохранены данные. Убедитесь, что общее число образцов в матче списка между двумя программами.
- Запустить партию проб для ИСП-МС перед HPLC, как инъекции образца методом ВЭЖХ активирует ПМС - MS, чтобы начать сборданные. Если это не будет сделано в правильном порядке, то это приведет к недостающих данных.
- Генерация точек калибровочной кривой, вводя различные объемы СОД и FTN смешанного стандарта от 200 мкг / л до 6000 мкг / л вводили в колонку для Cu и Zn и 2000 мкг / л до 60000 мкг / л для Fe. объем вводимого препарата в диапазоне от 1 до 30 мкл.
Примечание: Эти диапазоны концентрации охватывают концентрации Fe, Cu и Zn обычно наблюдается в сложных гомогенатах. Для образцов, которые содержат только очищенные белки максимальный диапазон кривой должен быть соответствующим образом скорректированы. Так как количество металла, связанного с белком, может потребовать меньшего или большего диапазона, так как там меньше загрязнение в образце от других факторов. - Анализ каждого из неизвестных образцов ткани, плазмы или клеточной культуре.
5. Анализ данных, манипулирование и визуализация
- Хранить данные в разделенных запятыми значения (CSV) формат файла и загрузить INto программ обработки по мере необходимости.
- В целях контроля за дрейфа инструмента, разделить отсчетов в секунду для каждого элемента по подсчетов в секунду либо Cs или Sb.
- Генерировать калибровочные кривые для каждого из элементов.
- Определение площади под пиком металла, который соответствует металлопротеины, что он связан с каждой из инъекций, выполняя пиковую интеграцию в предпочтительном программного обеспечения для анализа данных.
- Участок площади под пиком металла по отношению к общему количеству металла, который вводили в колонку в каждом цикле 200 - 6000 мкг / л для меди и цинка и 2000 - 60000 мкг / л для Fe. Провести анализ линейной регрессии в соответствии с протоколом программного обеспечения.
- Использование результатов Откос от линейного регрессионного анализа, как фактор для преобразования отсчетов в секунду в пг / сек. Разделите каждого из отсчетов в секунду точек данных через хроматограмме градиентом значения линии.
- Graph данные впг / сек против времени хроматограммы. Определить площадь пиков, представляющих интерес. Площадь под пиком представляет собой общее количество металла, что белок связывается с, в пг.
- Генерирование калибровку, основанную на молекулярной массе известных металлопротеинов и время, в котором они элюции. Используйте эту функцию, чтобы оценить размер пиков белка в сложных образцах.
Результаты
Использование стандартов металлопротеины позволяет для калибровки колонки вытеснительной. Рисунок 1A показывает профиль элюирования для стандартов тиреоглобулина, ферритина, церулоплазмина, Cu / Zn СОД и витамина B 12 на основе металла , что они связаны с (Fe, Со, Cu, Zn и I). на рисунке 1В показывает калибровочную кривую для колонки вытеснительной на основе молекулярной массы белковых стандартов и их времени элюирования, представленные в формате объема элюирования (Ve) , разделенное на объем пустот колонка (Vo). Белки, используемые для создания этой стандартной кривой конканавалином А, conalbumin, церулоплазмин, ферритин, СОД и тиреоглобулина.
На фиг.2А показана элюирование ферритина в диапазоне 2000 - 60000 мкг Fe впрыскивается на колонке и рис 2D является регрессионный анализ , проведенный с использованием пEAK площадь. На рисунках 2В и 2С являются профили элюции для Cu / Zn СОД для Cu и Zn и 2E и 2F являются регрессионный анализ генерируется с использованием площадей пиков. Результаты регрессионного анализа используются для преобразования исходных данных в число импульсов / с до пг / сек, так что количество металла, связанный с белком может быть определено количественно. Преобразование выполняется путем деления число импульсов / с наклоном линейной регрессии (например, 334,6 (число импульсов / с) х (сек / пг) из меди).
Как уже говорилось, эта техника может быть использована для идентификации металлопротеиды в сложных биологических образцах. Человеческий мозг и плазма были подвергнуты этой технике и рисунках 3 и 4, соответственно, показывают результаты , полученные. Человеческий мозг разделены SEC-ИСП-МС показано на фигурах 3А-3С, каждый из которых представляет различный металл интерес (Cu, Zn или Fe). На фиг.4А-4С показаны следы , полученные из плазмы человека , когда подвергается этой технике. Сложность и обилие образца окажет влияние на число пиков, которые видны. Как и следовало ожидать плазмы доминируют несколько металлопротеинов включая церулоплазмина и трансферрина.
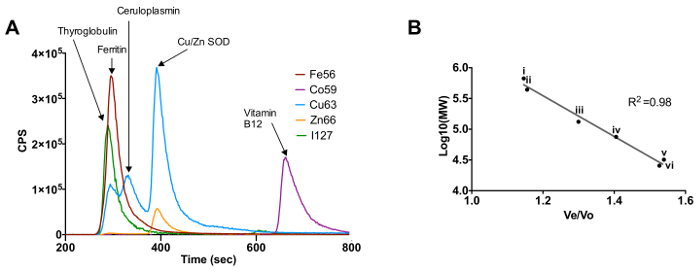
Рисунок 1. Калибровка вытеснительной хроматографии - индуктивно связанной плазмой - масс - спектрометрия с использованием известных профиль металлопротеиды (А) элюции стандартов металлопротеины на основе их соответствующих металлов.. (Б) Молекулярная масса калибровочной кривой для белковых стандартов тиреоглобулина (I), ферритин (II), церулоплазмина (III), conalbumin (IV), Cu / Zn СОД (V) и конканавалин А (VI)."Целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
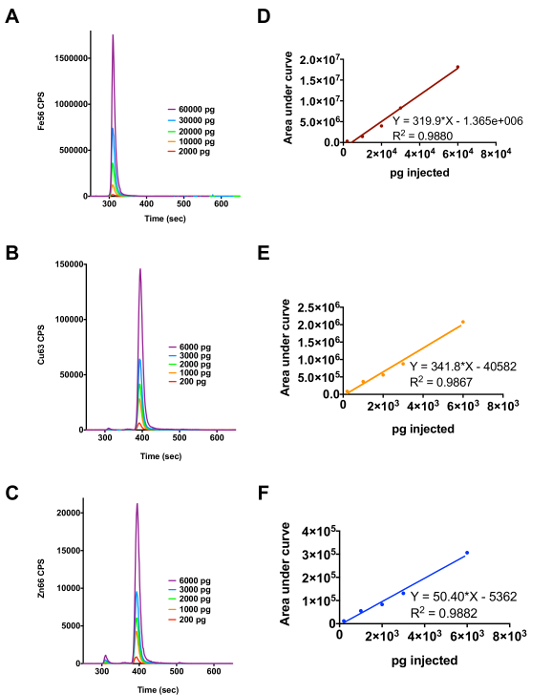
Рисунок 2. Использование ферритина и Cu / Zn СОД как металлопротеины стандартов для определения количества Cu, Fe или Zn , связанных с металлопротеиды в комплексной биологической пробе (A) Профиль элюции для ферритина в диапазоне впрыска 2000 -. 60 000 мкг / л железа. (В) и (С) Профиль элюции для Cu / Zn СОД в диапазоне инжекции 200 - 6000 мкг / л меди и цинка, соответственно. (D), (Е) и (F) показывают результаты регрессионного анализа для металлов железа, меди и цинка, соответственно. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
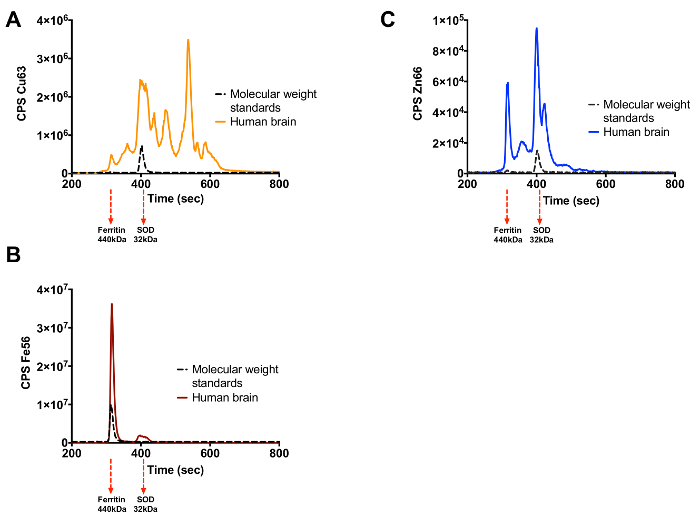
Рисунок 3. Cu, Fe и Zn Metalloproteome человеческого мозга. (A) Медь след (B) Железный след (C) Цинковый след. Элюции белковых стандартов для каждого металла показан черным следом с их молекулярной массой , указанной под графиком. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
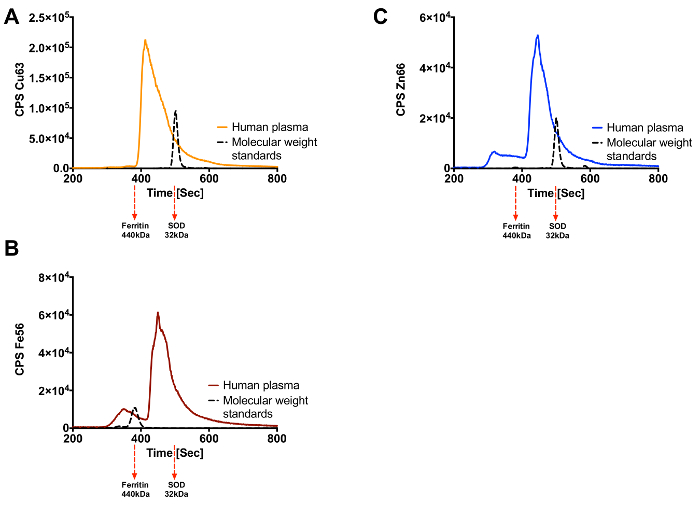
Рисунок 4. Cu, Fe и Zn Metalloproteome для человеческой плазме. (A) Медь след (B) Железный след (C) Цинковый след. Элюции белковых стандартов для каждого металла показана черным следом с их молекулярной массойпод показаны , графика. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Обеспечение нативного состояния белка означает особое внимание используемых буферов и хранения образца необходимы. Не могут быть использованы все методы хроматографии или методы подготовки образца. Важно, что буферы, используемые в пробоподготовки и хроматографии, лишены металлических энтеросорбенты и используют буферы, которые имитируют физиологические концентрации рН и соли. Другие условия , чтобы избежать включают нагревание образца или добавление белка денатурирующих (например, мочевина). Крайне важно, чтобы свести к минимуму количество циклов замораживания-оттаивания. Способность выбранного буфера для связывания двухвалентных металлов также имеет важное значение и является причиной того, что Трис или аммония нитрата буферы выбираются через буферы на основе фосфатов.
Низкое разрешение и пик емкость вытеснительной хроматографии по сравнению с другими формами хроматографии является основным ограничением этого метода. Тем не менее, нежная природа вытеснительной хроматогPHY важно поддерживать естественное состояние белка и, таким образом, сохранить относительно слабые металл-белковых связей. Требование , чтобы сохранить естественное состояние белков требует особого внимания к обработке образцов , включая ограничение числа циклов замораживания - оттаивания, избегая металлических энтеросорбенты (например, ЭДТА) или хаотропные соли и моющих средств.
Это низкое разрешение этой методики воздействий способность определить количество металла, связанного с конкретным белком, если он находится в сложном образце, что и пики видно будет содержать более одного белка. Таким образом, количество металла, определяется с использованием пиковой интеграции может быть показателем общего количества металла, связанного со всеми белками элюирование в этот момент времени, а не только один конкретный белок. Для того, чтобы преодолеть это ограничение интересующий белок должен был бы быть дополнительно очищен при нативных условиях. Это позволило бы квантификацииметалл, связанный с этим белком, чтобы сообщаться с более высокой степенью certainity. Еще одним потенциальным недостатком этой методики было бы потери белка из-за необратимое связывание с колонкой. Для того, чтобы определить, является ли это происходит эксперимент восстановления следует проводить в результате чего количество белка при элюировании из колонки анализируют, чтобы определить, совпадает ли этот объем впрыскиваемого. То же самое можно сделать путем измерения содержания металла элюции материала и исходный материал и навальным ICP-MS. Восстановление столбца может отличаться в зависимости от используемых условий, но было показано , что полное восстановление белков из колонки вытеснительной возможно 9. Таким образом, важно, чтобы проверить, действительно ли существует какой-либо потери в рабочих условиях используется.
Изменения в протоколе могут быть связаны со стандартами металлопротеины, которые используются, а также анализируемых элементов. Тип металлопротеины стандарт СШАе изд будет отличаться в зависимости от элементов, представляющих интерес. Для таких элементов, как Cu, Fe и Zn белков, СОД и ферритина используются. Любые другие металлопротеины, которые имеют известные stoichometries также могут быть использованы и несколько примеров было показано здесь.
Одним из основных осложнений, которые могут возникнуть в результате использования этого метода является нарастание кристаллов соли в факелом ICP-MS. Для того, чтобы предотвратить накопление кристаллов соли, факел промывают дистиллированной водой каждые 500 - 1000 мл буфера, который был пропущен через систему или когда определено путем визуального осмотра, что факел должны быть вымыты. Другая проблема, которая может возникнуть является более быстрое снижение чистоты образца и экстракции конусов. Их необходимо регулярно чистить следующие протоколы производителя.
Первоначальная подготовка образца является самым важным шагом в протоколе. Если есть какие-либо изменения в белке - металлический комплекс РСМДormation генерируется не будет действительным. Это одно из основных ограничений техники; Кроме того, использование низкого разрешения, колонка эксклюзионной дает ограниченное детальное представление об истинной сложности металлопротеинов в биологии.
Техника, описанная здесь, позволяет расширить знания metalloproteome организма. Bulk анализ дает только грубую индикацию изменения в количестве металла в образце. Помимо общих соображений, которые необходимо принимать во внимание, этот метод дает инструмент, который может быть использован для количественного определения количества металла, связанного с белками, а также определения металлопротеинов, которые отличаются путем сравнения полученных следов. Использование этого метода может быть использована, чтобы определить различия между болезненными состояниями. Выявленные металлопротеиды затем могут быть дополнительно исследованы, чтобы помочь определить роль, которую они играют в процессах болезни. Применение дефис ICP-MS имеет растущуюбудущее, чтобы определить роль лекарственных средств, имеющих гетероатом, такой как платина, йод или медь в качестве ИСП-МС может быть использован для идентификации белков, который связывает лекарственное средство.
Раскрытие информации
The authors have nothing to disclose
Благодарности
Мы хотели бы отметить поддержку со стороны викторианского правительства Операционной программы Инфраструктура поддержки, Австралийский исследовательский совет Linkage Проекты Схема (с Agilent Technologies), австралийского исследовательского центра Национального Совета по медицинским исследованиям, викторианская мозга банка, здравоохранения и кооперативной психического здоровья и Neuroproteomics объект.
Материалы
| Name | Company | Catalog Number | Comments |
| Agilent 1290 Infinity Binary Pump | Agilent | G4220A | |
| Agilent 1290 Infinity Autosampler | Agilent | G4226A | |
| Agilent 1200 Series Autosampler Thermostat | Agilent | G1330B | |
| Agilent 1290 Infinity Thermostatted Column Compartment | Agilent | G1316C | |
| Agilent 1290 Infinity Variable Wavelength Detector | Agilent | G1314E | |
| Agilent 7700 ICP-MS | Agilent | G3282A | |
| Ammonium hydroxide trace metal basis | Sigma | 338818 | |
| Ammonium nitrate | Sigma | 256064 | Make fresh 200mM solution on day of experiment |
| Antinomy | Choice analytical | 10002-3 | |
| Ceruloplasmin | Sigma | ||
| Cesium | Choice analytical | 100011-1 | |
| Complete, EDTA free protease inhibitors | Roche | 11873580001 | |
| Conalbumin | Sigma | C7786 | |
| Concanavalin A from Canavalia ensiformis (Jack bean) | Sigma | L7647 | |
| Cu, Zn Superoxide dismutase | Sigma | S9697 | |
| Ferritin | Sigma | F4503 | |
| ICP-MS multielemental calibration standards | AccuStandard | Made up to required concentrations in 1% nitric acid | |
| Microvolume UV spectrophotometer | Thermo Scientific | ||
| 65% Nitric acid | Millipore | 100441 | Diluted to 1% for use |
| Peek tubing | Agilent | 5042-6461 | |
| Size exclusion column BioSEC-3 PLC. column, 4.6 x 300 mm, 3 μm, 150 Å | Agilent | 5190-2508 | |
| Sodium Chloride | Chem Supply | SA046 | |
| Tris Hydrochloride | ICN Biomedicals inc. | 103130 | |
| Thyroglobulin | Sigma | T9145 | |
| Vitamin B12 | Sigma | V2876 |
Ссылки
- Holm, R. H., Kennepohl, P., Solomon, E. I. Structural and Functional Aspects of Metal Sites in Biology. Chem Rev. 96, 2239-2314 (1996).
- Andreini, C., Bertini, I., Cavallaro, G., Holliday, G., Thornton, J. Metal ions in biological catalysis: from enzyme databases to general principles. J Biol Inorg Chem. 13, 1205-1218 (2008).
- Roberts, B. R., Ryan, T. M., Bush, A. I., Masters, C. L., Duce, J. A. The role of metallobiology and amyloid-beta peptides in Alzheimer's disease. J Neurosci. 120 (Suppl 1), 149-166 (2012).
- Roberts, B. R., et al. Oral Treatment with CuII (atsm) Increases Mutant SOD1 In Vivo but Protects Motor Neurons and Improves the Phenotype of a Transgenic Mouse Model of Amyotrophic Lateral Sclerosis. J Neurosci. 34, 8021-8031 (2014).
- Hare, D. J., et al. Decreased plasma iron in Alzheimer's disease is due to transferrin desaturation. ACS CHEM NEUROSCI. , (2015).
- Cvetkovic, A., et al. Microbial metalloproteomes are largely uncharacterized. Nature. 466, 779-782 (2010).
- Barnett, J., Scanlan, D., Blindauer, C. Protein fractionation and detection for metalloproteomics: challenges and approaches. Anal Bioanal Chem. 402, 3311-3322 (2012).
- Fernandez Sanchez, L., Szpunar, J. Speciation analysis for iodine in milk by size-exclusion chromatography with inductively coupled plasma mass spectrometric detection(SEC-ICP MS). J. Anal. At. Spectrom. 14, 1697-1702 (1999).
- Manley, S., Byrns, S., Lyon, A., Brown, P., Gailer, J. Simultaneous Cu-, Fe-, and Zn-specific detection of metalloproteins contained in rabbit plasma by size-exclusion chromatography-inductively coupled plasma atomic emission spectroscopy. J Biol Inorg Chem. 14, 61-74 (2009).
- Richarz, A. N., Brätter, P. Speciation analysis of trace elements in the brains of individuals with Alzheimer's disease with special emphasis on metallothioneins. Anal Bioanal Chem. 372, 412-417 (2002).
- Hare, D. J., et al. Profiling the iron, copper and zinc content in primary neuron and astrocyte cultures by rapid online quantitative size exclusion chromatography-inductively coupled plasma-mass spectrometry. Metallomics. 5, 1656-1662 (2013).
- Balkhi, S. E., et al. Human Plasma Copper Proteins Speciation by Size Exclusion Chromatography Coupled to Inductively Coupled Plasma Mass Spectrometry. Solutions for Columns Calibration by Sulfur Detection. Anal Chem. 82, 6904-6910 (2010).
- Desjardins, P., Hansen, J. B., Allen, M. Microvolume Protein Concentration Determination using the NanoDrop 2000c Spectrophotometer. J Vis Exp. , e1610 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены