Method Article
Быстрое Нейрональная Дифференциация индуцированные плюрипотентные стволовые клетки для измерения сетевой активности на микро-электродных Массивы
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы модифицируем и реализовать ранее опубликованный протокол , описывающий быстрое, воспроизводимое и эффективное дифференцировку человеческих индуцированных плюрипотентных стволовых клеток (hiPSCs) в возбуждающих корковых нейронов 12. В частности, наша модификация позволяет контролировать плотности нейронов и использования клеток на микро-матриц электродов для измерения электрофизиологических свойств на сетевом уровне.
Аннотация
Нейроны, полученные из человеческих индуцированных плюрипотентных стволовых клеток (hiPSCs) обеспечивают новый перспективный инструмент для изучения неврологических расстройств. В последнее десятилетие были разработаны многие протоколы для дифференциации hiPSCs в нейроны. Тем не менее, эти протоколы часто медленно с высокой изменчивостью, низкой воспроизводимостью и низкой эффективностью. Кроме того, нейроны, полученные с помощью этих протоколов часто незрелые и не имеют надлежащей функциональной активности как на одноклеточных и сетевых уровней, если нейроны не культивируют в течение нескольких месяцев. Частично из-за этих ограничений, функциональные свойства hiPSC-производных нейронных сетей все еще недостаточно хорошо охарактеризованы. Здесь мы приспосабливаемся недавно опубликованный протокол , который описывает производство человеческих нейронов из hiPSCs форсированным экспрессии фактора транскрипции neurogenin-2 12. Этот протокол быстрый (дающим зрелых нейронов в течение 3-х недель) и эффективно, с эффективностью преобразования почти 100% transducе изд клетки (> 95% от DAPI-положительных клеток являются МАР2 положительными). Кроме того, протокол дает гомогенную популяцию возбуждающих нейронов, которые позволили бы исследование камерного типа конкретных вкладов в неврологических расстройств. Мы модифицировали исходный протокол, генерируя стабильно приемными клетками hiPSC, что дает нам явное управление общего количества нейронов. Эти клетки затем используются для генерации hiPSC полученных из нейронных сетей на микро-матриц электродов. Таким образом, спонтанное электрофизиологическое активность hiPSC-производных нейронных сетей может быть измерена и охарактеризована, сохраняя при этом interexperimental согласованность с точки зрения плотности клеток. Представленный протокол широко применим, особенно для механистических и фармакологических исследований на нейронных сетей человека.
Введение
Развитие человека индуцированных плюрипотентных стволовых клеток (hiPSCs) протоколов дифференцировки для формирования человека нейроны в пробирке дала мощный новый инструмент для изучения неврологических расстройств. До недавнего времени изучение этих нарушений не было сильно затруднено из-за отсутствия модельных систем с использованием человеческих нейронов. Хотя грызуны могут быть использованы для изучения неврологических расстройств, результаты таких исследований не могут быть легко переведены на человека 1. Принимая во внимание эти ограничения, hiPSC-производные нейроны являются перспективной альтернативой модель , которая может быть использована для выяснения молекулярных механизмов , лежащих в основе неврологических расстройств и для экстракорпорального скрининга лекарственных средств.
В последнее десятилетие, несколько протоколов для преобразования hiPSCs в нейроны были разработаны 2-8. Тем не менее, эти протоколы все еще ограничены во многих отношениях. Во- первых, протоколы зачастую отнимает много времени: генерирующие нейроны с адекватной созревания (т.е. synapформирование таковой) и функциональной активности требует месяцев процедур культивирования, что делает крупномасштабные исследования сложных 9. Кроме того, эффективность преобразования hiPSC к нейрону является низким. Протоколы часто приводят к гетерогенную популяцию нейронов, и, таким образом, не позволяют исследования конкретных подмножеств нейрональных клеток. Кроме того, протоколы не являются воспроизводимыми, что дает различные результаты для различных линий IPSC 10,11. И, наконец, этап созревания и функциональные свойства полученных нейронов также различны 10.
Для решения этих проблем, Чжан и др. (2013) 12 разработала протокол , который быстро и воспроизводимо генерирует человеческие нейроны от hiPSCs по гиперэкспрессией фактор транскрипции neurogenin-2. Как сообщают авторы, дифференциация происходит относительно быстро (всего 2 - 3 недели после индукции экспрессии neurogenin-2), протокол является воспроизводимым (нейронные свойства не зависят от хtarting hiPSC линия), а также преобразование hiPSC к нейрону высокоэффективен (почти 100%). Популяция нейронов, полученных с их протоколом однородна (напоминающая верхнего уровня корковых нейронов), что позволяет исследовать камерного типа конкретных вкладов в нейронных нарушений. Кроме того, их hiPSC-производные нейроны выставлялись зрелые свойства (например, способность формировать синапсы и надежную функциональную активность) после того, как только 20 д.
Характеризуя электрофизиологические свойства hiPSC-нейронов, полученных на сетевом уровне является важной предпосылкой, прежде чем технологии hiPSC могут быть использованы для изучения заболеваний человека. По этой причине, многие исследовательские группы недавно начали изучать стволовых клеток , полученных из нейронов на сетевом уровне с использованием микро-матрицы электродов (MEA) устройства (многоканальные системы, Reutlingen, Германия) 13-16. Электроды МПОС встроены в подложку, на которой можно культивировать нейрональные клетки.МЭС могут быть использованы для изучения электрофизиологических свойств нейронных сетей и развитие экстракорпоральное их активности. В настоящее время МЭС используются только в сочетании с дифференциацией протоколами, которые принимают несколько месяцев для получения зрелых сетей. Следовательно, объединение МЭС с быстрым протоколом дифференциации должно облегчить использование этой технологии в крупномасштабных исследованиях неврологических расстройств.
Здесь мы представляем модификацию Zhang и др. (2013) 12 протокола и адаптировать его для использования на МЭС. В частности, вместо того , чтобы полагаться на острый лентивирусов трансдукции, мы вместо того, чтобы создали hiPSC линии , стабильно экспрессирующие rtTA / Ngn2 перед тем индукции дифференцировки. Мы сделали это в первую очередь , чтобы иметь воспроизводимые контроль над плотностью нейрональных клеток, так как нейронная плотность клеток имеет решающее значение для формирования нейронной сети, а также для хорошего контакта между нейронами и электродами МЭС 17,18. Althougч Чжан и др. Протокол является очень эффективным в отношении конверсии трансдуцированных hiPSCs, он по своей природе переменной по отношению к конечному выходу нейронов из числа hiPSCs гальваническим первоначально (рис 2E в Zhang и др.) 12. При стабильной линии, мы исключаем много вопросов, вызывающих изменчивость, таких как лентивирусов токсичность и эффективность инфекции. Затем мы оптимизировали параметры , которые надежно производить hiPSC полученных из нейронных сетей на МЭС, получение сети созреванию (например, синхронные события с участием большинства каналов) на третьей неделе. Этот быстрый и надежный протокол должен позволить проводить прямые сравнения между нейронами , полученных из различных (т.е. специфическая для пациента) линий hiPSC, а также обеспечивают надежную последовательность для фармакологических исследований.
протокол
Все эксперименты на животных проводились в соответствии с утвержденными по уходу за животными и использование руководящих принципов Комитета Animal Care, Radboud University Medical Centre, Нидерланды, (RU-DEC-2011-021, номер протокола: 77073).
1. Глия Выделение клеток и культуры
Примечание: Протокол , представленные здесь, основаны на работе Маккарти и де Vellis 19, и очень похожий подробный протокол для астроцитов мыши доступно 20. Для формирования первичных культур кортикальных астроцитов из эмбриональных (Е18) мозга крыс, у беременной крысы должна быть принесена в жертву, эмбрионы должны быть собраны из матки, и мозги должны быть изолированы от эмбрионов. Для того, чтобы заполнить колбу T75, кору головного мозга от 2-х эмбриональных мозги должны быть объединены. В качестве альтернативы, имеющиеся в продаже очищенные и замороженные астроциты могут быть куплены.
- Готовят колбу T75 культуры
- Развести поли-D-лизином (PDL), встерильной, сверхчистой водой до конечной концентрации 10 мкг / мл. Добавляют 5 мл разведенной PDL в колбу Т75 культуры. Swish вокруг аккуратно смачивать всю поверхность роста. Поместить колбу в увлажненной 37 ° C инкубаторе в течение 3 ч.
- Аспирируйте PDL из колбы. Смыва колбы 3 раза с 5 мл стерильной воды для удаления несвязанного PDL. Аспирируйте воду полностью. Оставьте колбу, чтобы высохнуть в ламинарном потоке или использовать немедленно.
- Рассечение кортикальных
- Подготовьте 50 мл рассечение среды: L-15 среды Lebovitz с 2% (об / об) B-27 дополнения. Держите на льду.
- Обезболить крысы глубоко с изофлуран в индукционной камере (небольшие оргстекло коробка) до тех пор, пока не прекратится дыхание (~ 5 - 8 мин). Удалить крысу из индукции камеры и немедленно умерщвлены шейным смещением.
- Брызги Живот крысы с 70% этанола и вытереть излишки. Expose и удалить матку от плотины через кесарево sectiна использование пары ножниц 21.
- Вырезать отдельные эмбрионы из их амниотической мешочки с ножницами, переносят в стерильную чашку Петри, наполненную холодной рассечение среды, и держать на льду.
- Перенос эмбрионов снова к новым стерильным 6 см чашке Петри заполнены холодной рассечение среды. Экстракт мозги из эмбрионов с помощью стереомикроскопа. Для того, чтобы подвергать мозг, осторожно очистить от кожи и черепа с помощью щипцов. Аккуратно выкопать весь мозг и перенести на 35 мм чашки Петри со свежей холодной рассечение среды.
Примечание: Весь головной мозг рассеченные из эмбрионов можно хранить в секционном среде на льду в течение многих часов без потери жизнеспособности клеток. - Разделяют два полушария головного мозга каждого путем разрезания через среднюю линию с остроконечный пружинными ножницами или скальпелем. Тщательно сдирать мозговые оболочки с прямыми остроконечного пинцета.
Примечание: Очень важно , чтобы удалить мозговые оболочки полностью. Thэто предотвращает загрязнение фибробластов из астроцитов культуры. Фибробласты быстро делящиеся клетки и в конечном итоге вытесняют другие клетки. - Удалите среднемозговых / стриатуме и обонятельной луковицы с пружинными ножницами или скальпелем. Кроме того, убедитесь, чтобы удалить гиппокампе (C-образную структуру, которая perimedian и каудально по отношению к коре головного мозга) с пружинными ножницами или скальпелем. Сбор коры головного мозга полушарий в 15 мл центрифужную пробирку, заполненную 5 мл рассечение среды. Держите на льду.
- Диссоциация кортикальных
- Приготовьте 2 мл Ca2 + / Mg2 + -бесплатно Хэнкса сбалансированный солевой раствор (HBSS) с 0,25% трипсина (диссоциация среда). Приготовьте 50 мл высокого глюкозы Игла в модификации орла Средний (DMEM), 15% (об / об) фетальной бычьей сыворотки (FBS) и 1% (об / об) пенициллин / стрептомицин (культуральная среда) и фильтр стерилизовать.
- Пусть ткани оседают на дно трубки центрифуги. Осторожно, какпират, как большая часть рассечение среды, как это возможно сверху ткани. Промыть ткань 5 мл Ca 2+ / Mg 2+ -бесплатно HBSS (без трипсина) и позволяют ткани , чтобы осесть на дно пробирки.
- Тщательно аспирата HBSS. Добавить 2 мл среды диссоциации и вылить трубку осторожно, чтобы смешать фермент вокруг ткани. Выдержите в водяной бане C 37 ° в течение 5-10 мин. Флик трубку несколько раз во время инкубации для перемешивания ткани.
- Немедленно растирают ткани, используя 1000 мкл пипетки. Установите громкость пипетку до примерно 800 мкл. Аспирата куски и выскочить на стороне трубки, непосредственно над линией жидкости. Тем не менее, стараются свести к минимуму пузырьков или пенообразования. Повторяйте, пока ткань не будет в достаточной степени диссоциированы, около 15 - 20x. Добавить 8 мл культуральной среды для инактивации трипсина. Аккуратно перемешать с помощью переворачивания пробирки несколько раз.
- Суспензию пропускали через клеточную ячейки фильтра 70 мкм, размещенной на верхней части 50 мL центрифуге трубки. Промыть 15 мл пробирку с культуральной средой и фильтруют среды через клеточный фильтр для сбора среды в 50 мл пробирку с суспензией клеток. Промойте ячейки фильтра несколько раз с культуральной средой. После промывки, чтобы конечный объем должен составлять около 20 - 25 мл.
- Гранул клетки при 200g в течение 10 мин. Тщательно аспирата столько среды, насколько это возможно, не касаясь осадок клеток. Ресуспендируют клеток в 1 мл культуральной среды с помощью 1000 мкл пипетку. Добавить 11 мл предварительно нагретой культуральной среды и осторожно перемешать (чтобы предотвратить пузырьков) с помощью 10 мл пипетки.
- Ополосните PDL-T75 с покрытием колбы один раз 5 мл культуральной среды. Аспирируйте среды и передачи клеточной суспензии в колбу. Все клетки в суспензии высевают, и мы находим его вообще нет необходимости считать их, так как астроциты не может быть дифференцирована от других клеток в суспензии. Поместить колбу в увлажненной 37 ° C инкубаторе с атмосферой 5% СО 2 Fили два дня.
- Расширение и поддержание астроцитов
- Заменить всю среду в первый раз 2 сут после первоначального посева. Заменить всю среду после этого каждые 3 d. Всегда prewarm свежую среду до 37 ° С перед добавлением к клеткам.
ПРИМЕЧАНИЕ: астроциты требуется 7 - 10 D , чтобы достигнуть приблизительно 90% слитности (астроциты появляются как плотно упакованного монослоя мозаичные, с микроглии и олигодендроциты , лежа на верхней и перемешаны). - Когда астроциты достигнет приблизительно 90% слитности, встряхните колбу, чтобы удалить загрязняющие глиальные клетки:
- Выньте колбу из инкубатора и затяните крышку (фенольный) или закройте порт (с фильтром). Чтобы удалить микроглии, встряхните колбу на орбитальной платформе при 180 оборотах в минуту в течение 1 ч. Аспирируйте среды. Полоскание один раз с 5 мл подогретого культуральной среды, аспирация и заменить 12 мл культуральной среды.
- Удалятьолигодендроцитов, возвращают колбу на орбитальной платформе и встряхивают при 250 оборотах в минуту, 37 ° C в течение как минимум 7 часов, но предпочтительно O / N.
- Аспирируйте среды. Полоскание один раз с 5 мл подогретого культуральной среды, аспирация и заменить 12 мл культуральной среды. Вернуть колбу в инкубатор.
- Когда 100% сплошности, разделить астроцитов с использованием стандартных процедур в соотношении 1: 3 до 1: 2, с 0,05% трипсина-этилендиаминтетрауксусной кислоты (ЭДТА). Т75 колбу на 100% сплошности обычно дают около 4,0 × 10 6 клеток в общей сложности. В соответствии с этим графиком, культуры, как правило, могут быть разделены один раз в неделю.
Примечание: Когда астроциты достигают слитности, они могут быть собраны и использованы для hiPSC дифференцировки , как описано ниже на шаге протокола 3.4. Астроциты можно разделить по крайней мере, один раз без заметной потери жизнеспособности. Они могут сохраняться в течение до 2-х месяцев в культуре. Из опыта, первичный эмбриональный день 18 крысы астроциты прогрessively становятся неизлечимо дифференцированы и / или теряют жизнеспособность после повторного расщепления. Несмотря на то, что можно заморозить астроцитов для использования в будущем, мы предпочитаем, чтобы изолировать астроцитов из свежих эмбриональных мозга, когда это требуется.
- Заменить всю среду в первый раз 2 сут после первоначального посева. Заменить всю среду после этого каждые 3 d. Всегда prewarm свежую среду до 37 ° С перед добавлением к клеткам.
2. Генерация rtTA / Ngn2 -положительным hiPSCs
ПРИМЕЧАНИЕ: hiPSCs , используемые для наших экспериментов были получены в доме с помощью лентивирусов трансдукции фибробластов человека с перепрограммирование факторы CMYC, Sox2, OCT4 и Klf4.
Примечание: Для генерации rtTA / Ngn2 -позитивных hiPSCs, лентивирусов векторы используются для стабильной интеграции трансгенов в геном hiPSCs. Протокол для производства лентивирусов было опубликовано ранее 22. Детали лентивирусов векторов упаковки, которые используются для получения частиц Лентивирус rtTA и Ngn2 предоставляются в Таблица материалов / оборудования. Вектор переноса используется для лентивирусов rtTA является pLVX-EF1α- (Tet-On-Advanced) -IRES-G418 (R); т.е. этот вектор кодирует Tet-On Advanced трансактиватора под контролем конститутивного промотора EF1α и придает устойчивость к G418 антибиотика. Вектор переноса используется для лентивирусов Ngn2 является pLVX- (TRE-thight) - (МЫШЬ) Ngn2-ПГК-Пуромицин (R); то есть этот вектор кодирует ген мышиного neurogenin-2 под контролем Tet-регулируемого промотора и гена устойчивости к пуромицин под контролем конститутивного промотора PGK. Следовательно, при использовании этих двух векторов для переноса, hiPSC линия может быть создана для которой экспрессия мышиного neurogenin-2 может быть индуцирована путем дополнения среды с доксициклином. Для трансдукции hiPSCs, используется супернатант с лентивирусов частиц (упоминается как 'лентивирусов суспензией' в оставшейся части текста), то есть именноХаут концентрирования частиц с помощью ультрацентрифугирования.
- Пластина hiPSCs (1 день)
Примечание: Объемы, которые упоминаются в данном протоколе предполагается , что hiPSCs культивируют в 6 - луночный планшет с и что клетки одной скважины собирают. Кроме того, предполагается, что клетки высевают затем в 12 лунки 12-луночного планшета.- Приготовьте 10 мл холодного DMEM / F12 с добавлением 1% (об / об) базальной мембраны Матрица (ВММ), чтобы получить разбавленный BMM. Добавьте 800 мкл разведенного БММ на лунку 12-луночного планшета. Выдержите в течение не менее 1 ч в увлажненной 37 ° C инкубаторе с атмосферой 5% CO 2. Перед использованием, инкубируйте в течение 1 ч при комнатной температуре.
- Теплый 15 мл Эфирное 8 (Е8) среда с добавлением 1% (об / об) пенициллин / стрептомицин, 9 мл DMEM / F12 и 1 мл раствора открепления клеток (CDS) до комнатной температуры. Дополнение среды E8 с Rho-ассоциированной протеинкиназы (ROCK) ингибитор.
- Аспирируйте затрачиваемое среде hiPSCsd прибавляют 1 мл CDS к hiPSCs. Выдержите 3 - 5 мин в увлажненной 37 ° C инкубаторе с атмосферой 5% CO 2. Проверка под микроскопом ли клетки отсоединение друг от друга.
- Добавьте 2 мл DMEM / F12 в скважине, осторожно приостановить клеток с 1000 мкл пипеткой и переноса клеток в пробирку 15 мл. Добавить 7 мл DMEM / F12 к клеточной суспензии. Спин клетки при 200 мкг в течение 5 мин.
- Аспирируйте супернатант и добавьте 2 мл приготовленного среды E8. Получение клеточной суспензии, в которой hiPSCs разобщены (не образуют скопления клеток), положив кончик 1000 мкл пипеткой против стороны 15 мл трубки и ресуспендирования клеток осторожно. Проверка под микроскопом ли диссоциированы клетки.
- Определить количество клеток (клеток / мл) с использованием гемоцитометра камеры.
ПРИМЕЧАНИЕ: 6 - луночный планшет хорошо на 80 - 90% сплошности, как правило , дают 3,0 - 4,0 × 10 6 клеток в общей сложности. - придыхательныйразбавленный BMM из лунки 12-луночного планшета. Развести клетки для получения суспензии клеток в 3,0 х 10 4 клеток / мл. Пластина 1 мл суспензии клеток на лунку 12-луночного планшета. Поместите 12 - луночный планшет O / N в увлажненной 37 ° C инкубаторе с атмосферой 5% CO 2.
- Трансдукции клетки плюрипотентных с rtTA и Ngn2 лентивирусов (день 2)
- Теплое среда 12 мл Е8 с 1% (об / об) пенициллин / стрептомицин до комнатной температуры. Дополнение среды E8 с ингибитором ROCK и полибрен до конечной концентрации 8 мкг / мл в среде E8.
- Оттепель аликвоты с лентивирусов подвеской. Добавить полибрен до конечной концентрации 8 мкг / мл до лентивирусов подвески. Аспирируйте истощенной средой и добавляют 1 мл приготовленного среды Е8 в каждую лунку.
- Выполните трансдукции с различными количествами rtTA - и Ngn2 -lentivirus суспензий. Например, transduсе в hiPSCs путем добавления 100 мкл как -lentivirus rtTA и Ngn2 -lentivirus суспензии в одну лунку 12 - луночного планшета. Для других скважин, используют 200 мкл, 300 мкл, 400 мкл и 500 мкл лентивирус приостановку вместо 100 мкл. В hiPSCs двух лунок 12-луночного планшета не должно быть трансдуцированная; они будут служить в качестве контроля в процессе отбора.
Примечание: В предпочтительно каскадов , выполнены в двух экземплярах, так что эффективность трансдукции может быть оценено более точно после начала отбора (см шаг протокола 2.2.4). Количество лентивирусов суспензии, которая необходима, чтобы эффективно преобразовывать большинство hiPSCs зависит от титра лентивирусов подвески и линии hiPSC, который используется. В данном исследовании мы обычно используем 100 - 500 мкл лентивирусов суспензии для трансдукции hiPSCs. - Поместите 12-луночный планшет в увлажненной 37 ° C инкубаторе с атмосферой 5% CO2 в течение 6 часов. До конца 6-часового периода инкубации, теплый 12 мл Е8 среду с 1% (об / об) пенициллина / стрептомицина и 12 мл Дульбекко фосфатно-солевом буфере (DPBS) до комнатной температуры. Дополнение среды E8 с ингибитором ROCK.
- Аспирируйте истощенной средой E8. Промыть каждую лунку с 1 мл ДЗФР. Добавить 1 мл приготовленного среды Е8 в каждую лунку. Поместите 12 - луночный планшет O / N в увлажненной 37 ° C инкубаторе с атмосферой 5% CO 2.
- Обновление среды E8 (день 3)
- Теплое среда 12 мл Е8 с 1% (об / об) пенициллин / стрептомицин до комнатной температуры. Аспирируйте затрачиваемое среды из лунки 12-луночного планшета и добавьте 1 мл приготовленной среды Е8 в каждую лунку. Поместите 12 - луночный планшет O / N в увлажненной 37 ° C инкубаторе с атмосферой 5% CO 2.
- Выполните выбор с пуромицин и G418 (4 -й день - 8)
Примечание: В зависимости от скорости деления клеток тазобедренного суставаЛиния КН и эффективность лентивирусов трансдукции, клетки могут достигать 70 - 80% сплошности в течение периода выбора, в какой момент культуры должны быть разделены. Поскольку сроки расщепления нельзя предсказать заранее, это не будет упомянуто в протоколе. Тем не менее, вместо того, чтобы освежить среду E8, дополненную с указанными концентрациями пуромицин и G418, можно разделить hiPSC культуру как нормальный hiPSC культуры (в том числе и покрытие клеток на витронектина пластинок, покрытых). Единственным исключением является то, что среда E8 должна быть дополнена с указанными концентрациями антибиотиков, чтобы продолжить выбор.- Теплое среда 12 мл Е8 с 1% (об / об) пенициллин / стрептомицин до комнатной температуры. Добавить пуромицин и G418 для выбора; различные количества антибиотиков добавляют в течение периода отбора (таблица 1).
- Оценить эффективность трансдукции путем оценки процента G418- и пуромицинрезистентные клетки. Для того, чтобы оценить процент резистентных клеток, оценить процент мертвых клеток (неустойчивый клетки) для различных условий (культуры трансдуцированных с различными количествами лентивирусов суспензии) и для nontransduced клеток (клетки, которые служат в качестве контроля выбора). Вычислить процент резистентных клеток, как [100% - (процент мертвых клеток)].
Примечание: Если с каскадов , различными количествами лентивирусов подвески были выполнены в двух экземплярах, эффективность трансдукции может быть оценена более точно. Состояние с не-трансдуцированных клеток служит в качестве контроля выбора; Проценты мертвых клеток для культур трансдуцированных с различными количествами лентивирусов подвески должна быть ниже. Оценочный процент резистентных клеток используется, чтобы выбрать hiPSCs, которые могут положительно для обеих трансгенов. В общем, мы выбираем hiPSCs из условия трансдукции были> 90% ячейкиs пережить период выбора 5 d. - Аспирируйте затрачиваемое среде hiPSCs и добавьте 1 мл приготовленной среды Е8 в лунки. Поместите 12 - луночный планшет O / N в увлажненной 37 ° C инкубаторе с атмосферой 5% CO 2.
| Конечная концентрация G418 | Конечная концентрация пуромицин | |
| 4-й день | 250 мкг / мл | 2 мкг / мл |
| 5-й день | 250 мкг / мл | 2 мкг / мл |
| 6-й день | 250 мкг / мл | 1 мкг / мл |
| 7-й день | 250 мкг / мл | 1 мкг / мл |
| 8-й день | 250 мкг / мл | 1 мкг / мл |
Таблица 1: Концентрация антибиотиков в течение периода выбора. Концентрации пуромицин и G418 в течение 5 дней периода отбора.
- Остановите выбор и начать регулярное культивирование (9 -й день и позже)
- После 5 дней периода выбора, культивирования rtTA / Ngn2 -положительные hiPSCs как нормальные hiPSCs, за исключением того, что среда Е8 из клеток , дополненной G418 до конечной концентрации 50 мкг / мл и с пуромицин до конечной концентрации 0,5 мкг / мл.
Примечание: Клетки теперь могут быть заморожены ( в соответствии со стандартными протоколами для криоконсервации клеток) , чтобы служить в качестве резервного. Это важный шаг для воспроизводимости протокола дифференцировки, поскольку она позволяет использовать той же партии rtTA / Ngn2 -позитивных hiPSCs для многих будущих экспериментов дифференциации.
- После 5 дней периода выбора, культивирования rtTA / Ngn2 -положительные hiPSCs как нормальные hiPSCs, за исключением того, что среда Е8 из клеток , дополненной G418 до конечной концентрации 50 мкг / мл и с пуромицин до конечной концентрации 0,5 мкг / мл.
3. Дифференциация rtTA / Ngn2 -позитивных hiPSCs нейронам на 6-луночныеМЭС и покровные стекла
Примечание: В этом протоколе, детали предусмотрены для дифференциации rtTA / Ngn2 -положительным hiPSCs на двух различных подложках, т.е. 6-луночные МЭС (устройства , состоящие из 6 независимых скважин с 9 записи и 1 эталонных встроенных микроэлектродов на лунку) и покровные стекла в лунки 24-луночного планшета. Протоколы, однако, может быть легко адаптирована для больших подложек (например, для лунки 12 - ти или 6-луночные планшеты), путем расширения указанных значений в зависимости от площади поверхности.
- Подготовка МЭС или покровные стекла (день 0 и день 1)
- За день до начала дифференцировки, стерилизовать МЭС в соответствии с рекомендациями производителя.
- Развести адгезии белка поли-L-орнитин (ПЛО) в стерильной сверхчистой воде до конечной концентрации 50 мкг / мл. Coat активная площадь электрода 6-луночных МЭС путем размещения 100 мклпадение разбавленного ПЛО в каждую лунку. Поместите покровных в лунки 24-луночного планшета с использованием стерильного пинцета. Добавьте 800 мкл разбавленного ПЛО в каждую лунку. Предотвращение покровные от плавающих, вставив их вниз с 1000 мкл кончика пипетки.
- Инкубируйте 6-а МЭС и 24-луночный планшет O / N в увлажненной 37 ° C инкубаторе с атмосферой 5% CO 2. На следующий день, аспирация разбавленный ПЛО. Мытье стеклянных поверхностей 6-луночных МЭС и покровные два раза стерильной сверхчистой водой.
- Развести ламинин в холодной DMEM / F12 до конечной концентрации 20 мкг / мл (для 6-луночных МЭС) и 10 мкг / мл (для покровные стекла). Сразу же пальто активная область электрода из 6-луночных МЭС путем размещения капли 100 мкл в каждую лунку. Точно так же, добавьте 400 мкл разведенного ламинина в каждую лунку 24-луночного планшета для покрытия покровные. Предотвращение покровные от плавающих, вставив их вниз с 1000 мкл кончика пипетки.
- Инкубируйте МЭС 6-луночные и 24 - луночный планшет в увлажненной 37 ° C инкубаторе с атмосферой 5% СО 2 в течение не менее 2 ч.
- Пластина hiPSCs (1 день)
Примечание: Объемы, которые упоминаются в пунктах 3.2.1 - 3.2.4 предположим , что -положительные hiPSCs rtTA / Ngn2 культивируют в 6-луночный планшет , и что клетки одной скважины собирают. Объемы, которые требуются для обшивки клеток на 6-луночных МЭС и / или покровные зависит от количества 6-луночных МЭС и / или количество покровные, которые используются в эксперименте; цифры, указанные в пунктах 3.2.6 - 3.2.8 позволяют масштабирование к различным размерам эксперимента.- Теплые DMEM / F12, CDS и E8 среду с 1% (об / об) пенициллина / стрептомицина к R / T. Добавить доксициклин до конечной концентрации 4 мкг / мл и ингибитора ROCK к среде E8.
- Аспирируйте затрачиваемое среде -позитивных hiPSCs rtTA / Ngn2 и добавьте 1 мL CDS к hiPSCs. Выдержите 3 - 5 мин в увлажненной 37 ° C инкубаторе с атмосферой 5% CO 2. Проверка под микроскопом ли клетки отсоединение друг от друга.
- Добавьте 2 мл DMEM / F12 в скважине, осторожно приостановить клеток с 1000 мкл пипеткой и переноса клеток в пробирку 15 мл. Добавить 7 мл DMEM / F12 к клеточной суспензии. Спин клетки при 200 мкг в течение 5 мин.
- Аспирируйте супернатант и добавьте 2 мл приготовленного среды E8. Диссоциировать hiPSCs, помещая кончик 1000 мкл пипеткой против стороны 15 мл трубки и ресуспендирования клеток осторожно. Проверка под микроскопом ли диссоциированы клетки.
- Определить количество клеток (клеток / мл) с использованием гемоцитометра камеры.
ПРИМЕЧАНИЕ: 6-луночный планшет хорошо на 80 - 90% сплошности, как правило , дают 3,0 - 4,0 × 10 6 клеток в общей сложности. - Аспирируйте разбавленный ламинин. Для 6-луночный МЭС, разбавленные клетки, чтобы получить CELL подвеска 7,5 х 10 5 клеток / мл. Пластина клетки путем добавления капли 100 мкл клеточной суспензии на активной площади электродов в каждую лунку 6-луночных МЭС. Для покровные, разбавленные клетки для получения суспензии клеток в 4,0 х 10 4 клеток / мл. Пластина клетки путем добавления 500 мкл суспензии клеток в лунки 24-луночного планшета.
ПРИМЕЧАНИЕ: конечная плотность клеток на МЭС выше , чем на покровные (рис 1А и В). Мы обнаружили, что эта высокая плотность клеток требуется для правильной записи сетевой активности. В протоколе, числа при условии, что оказались оптимальными для анализов. - Поместите 6-луночные МЭС и 24 - луночный планшет в увлажненной 37 ° C инкубаторе с атмосферой 5% CO 2 в течение 2 ч (МЭС) или O / N (24 - луночного планшета).
- Через 2 ч, осторожно добавляют 500 мкл приготовленного среды Е8 в каждую лунку 6-луночных МЭС. Поместите 6-WELL МЭС O / N в увлажненной 37 ° C инкубаторе с атмосферой 5% CO 2.
- Изменение среды (день 2)
- На следующий день приготовить DMEM / F12 с добавлением 1% (об / об) N-2 дополнение, 1% (об / об) заменимых аминокислот и 1% (об / об) пенициллина / стрептомицина. Добавить человеческий рекомбинантный нейротрофин-3 (NT-3) до конечной концентрации 10 нг / мл, человеческого рекомбинантного мозга нейротрофического фактора (BDNF) до конечной концентрации 10 нг / мл, и доксициклин до конечной концентрации 4 мкг / мл. Подогреть среды до 37 ° С.
- Добавить ламинин до конечной концентрации 0,2 мкг / мл в среде. Фильтр среды, полученной. Аспирируйте затрачиваемое среды из лунок 6-луночных МЭС и 24-луночного планшета и заменить его на подготовленную среду. Инкубируйте 6-а МЭС и 24-луночный планшет O / N в увлажненной 37 ° C инкубаторе с атмосферой 5% CO 2.
- Добавить астроциты крысы (день 3)
Примечание: объемы, которые упоминаются в данном протоколе предполагается , что астроциты крысы культивируют в колбах культуры Т75. Очень важно, что астроциты крысы, которые добавляются к культурам хорошего качества. Мы используем два критерия, чтобы проверить, астроциты крысы хорошего качества. Во-первых, культура астроцитов крысы должны быть в состоянии расти сливающиеся в течение десяти дней после изоляции от крыс эмбриональные мозги. Во- вторых, после того, как расщепление астроцитов культуры крысы, астроциты крысы должны быть в состоянии сформировать сливающийся монослой, мозаичную (рис 1C). Если крыса астроцитов культура не отвечает этим двум критериям, мы рекомендуем не использовать эту культуру для дифференциации экспериментов.- Теплое 0,05% трипсин-ЭДТА до комнатной температуры. Нагреть ДЗФР и DMEM / F12 с добавлением 1% (об / об) пенициллин / стрептомицин до 37 ° С.
- Аспирируйте затрачиваемое среду крысы астроцитов культуры. Вымойте культуру путем добавления 5 мл DPBS и прополощите его вокруг мягко.
- Aspirсъел DPBS и добавляют 5 мл 0,05% трипсин-ЭДТА. Размахивайте трипсин-ЭДТА вокруг мягко. Инкубируйте в увлажненной 37 ° C инкубаторе с атмосферой 5% СО 2 в течение 5 - 10 мин.
- Проверка под микроскопом ли отрываются клетки. Отделить последние клетки, попав в колбу несколько раз.
- Добавляют 5 мл DMEM / F12 в колбу. Растирают клетки осторожно в колбе с пипеткой 10 мл. Собирают суспензию клеток в пробирку 15 мл. Спин трубку при 200g в течение 8 мин.
- Аспирируйте супернатант и клетки вновь суспендируют в 1 мл DMEM / F12. Определить количество клеток (клеток / мл) с использованием гемоцитометра камеры.
- Добавить 7,5 × 10 4 астроциты на лунку 6-луночных МЭС. Добавить 2,0 × 10 4 астроциты на лунку 24-луночного планшета. Инкубируйте МЭС и 24-луночный планшет O / N в увлажненной 37 ° C инкубаторе с атмосферой 5% CO 2.
- Изменение среды (4 -й день)
- Подготовка Neurobasal среды с добавлением 2% (об / об) В-27 добавка, 1% (об / об) L-аланил-L-глутамина и 1% (об / об) пенициллина / стрептомицина. Добавить NT-3 в конечной концентрации 10 нг / мл, BDNF в конечной концентрации 10 нг / мл, и доксициклин до конечной концентрации 4 мкг / мл. Кроме того, добавить цитозина бета-D-арабинофуранозида до концентрации 2 мкМ.
Примечание: цитозин β-D-арабинофуранозида добавляют к среде для ингибирования пролиферации астроцитов и убить оставшихся hiPSCs, не дифференцироваться в нейроны. - Фильтр среды и нагреться до 37 ° С. Аспирируйте затрачиваемое среды из лунок 6-луночных МЭС и 24-луночного планшета и заменить его на подготовленную среду. Поддерживать 6-луночный МЭС и 24-луночный планшет в увлажненной 37 ° C инкубаторе с атмосферой 5% CO 2.
- Подготовка Neurobasal среды с добавлением 2% (об / об) В-27 добавка, 1% (об / об) L-аланил-L-глутамина и 1% (об / об) пенициллина / стрептомицина. Добавить NT-3 в конечной концентрации 10 нг / мл, BDNF в конечной концентрации 10 нг / мл, и доксициклин до конечной концентрации 4 мкг / мл. Кроме того, добавить цитозина бета-D-арабинофуранозида до концентрации 2 мкМ.
- Обновите среду (день 6 - 28)
Примечание: Начиная с 6 -й день, обновить половинусреды каждые два дня. С 10-й день и далее, среда дополнена FBS, чтобы поддержать жизнеспособность астроцитов.- Подготовка Neurobasal среды с добавлением 2% (об / об) В-27 добавка, 1% (об / об) L-аланил-L-глутамина и 1% (об / об) пенициллина / стрептомицина. Добавить NT-3 в конечной концентрации 10 нг / мл, BDNF в конечной концентрации 10 нг / мл, и доксициклин до конечной концентрации 4 мкг / мл. С 10-й день и далее, также дополняют среду с 2,5% (об / об) FBS. Фильтр полученную среду и нагреваться до 37 ° С.
- Удалите половину использованной среды из лунок 6-луночных МЭС и 24-луночного планшета, используя 1000 мкл пипетки и заменить его на подготовленную среду. Поддерживать 6-луночный МЭС и 24-луночный планшет в увлажненной 37 ° C инкубаторе с атмосферой 5% CO 2.
4. Установите нейрофизиологических Профиль hiPSC-производных Нейроны
Примечание: От двух до трех недель после инводство дифференцировки hiPSC-производные нейроны могут быть использованы для различных последующих анализов. В данном разделе приведены примеры некоторых последующих анализов приведены, которые могут быть выполнены, чтобы установить нейрофизиологических профиль hiPSC полученных из нейронов.
- Охарактеризовать нейронную сетевую активность с помощью МЭС
- Запись 20 мин электрофизиологической активности hiPSC полученных из нейронов, культивируемых на МЭС. Во время записи, поддерживая температуру при 37 ° С, и предотвращать испарение и рН изменения среды с помощью раздувания постоянный, медленный поток увлажненного газа (5% СО 2, 20% O 2, 75% N 2) на MEA ,
- После 1200X амплификации (MEA 1060, MCS), дискретизации сигнала на частоте 10 кГц с использованием карты сбора данных MCS. Анализ данных (спайка и взрыв обнаружения) , используя пользовательский пакет программного обеспечения 23.
- Охарактеризовать электрофизиологические активность одноклеточного
- Перенесите покровных стеклах, содержащих hiPSC полученных из нейрональных культур в затопленную записи камеры фиксированной ступени в вертикальном микроскопом. Запись 20 мин спонтанного потенциала действия, вызванных постсинаптических токов (sEPSC) 24. Обнаружение синаптическую события с помощью Нейрологическая программы.
- Охарактеризовать нейронную морфологию и синапсины выражение
- Фикс и окрашивают hiPSC-производные нейроны для MAP2, синапсины-1/2, и PSD-95 22, 24, 25. Количественно число синапсины-1/2 и PSD-95 Puncta с использованием программного обеспечения для анализа изображений.
Результаты
Здесь мы успешно изменили протокол , в котором hiPSCs дифференцируются непосредственно в корковых нейронах сверхэкспресирующим фактор neurogenin-2 12 транскрипции и мы адаптировали его для использования МЭС. Такой подход является быстрым и эффективным позволяет нам получать функциональные нейроны и сетевую активность уже в течение третьей недели после индукции дифференциации.
В ходе протокола дифференцировки клетки морфологически начали напоминать нейроны: образовывались небольшие процессы и нейроны стали подключать друг к другу (фиг.1А). Мы установили нейрофизиологическую профиль нейронов, полученных из hiPSC линии здорового управления, путем измерения их нейронную морфологию и синаптические свойства в процессе развития. hiPSC-производные нейроны окрашивали на МАР2 и синапсины-1/2, в разные дни после началадифференцирования (фиг.2А). Выведенные нейроны показывают зрелые нейрональные морфологию уже через 3 недели после индукции дифференцировки. Число синапсины-1/2 Puncta (мера для числа синапсов) количественно оценивали на основе синапсины-1/2 иммуноцитохимию окрашиванием. Число синапсины-1/2 Puncta увеличилось с течением времени, что свидетельствует о том , что уровень нейронального связности также возрастает (Фигура 2В). Число синапсины-1/2 Puncta 23 дней после индукции дифференциации была одинаковой в двух независимых линий IPS (рис 2С). На 23 ДИВ наиболее synapsin1 / 2 Puncta были сопоставлены с PSD-95 Puncta, что указывает на функциональные синапсы (рис 2D).
В соответствии с результатами , описанными Zhang и др., Мы получили население возбуждающих верхнего уровня корковых нейронов, что подтверждается пан-нейронный и подтип-специфической корковой м arkers, такие как BRN2 и SATB2 (слой II / III). Мы не наблюдали нейронов , которые были положительными для глубокого слоя нейронов CTIP2 (слой V) или FOXP2 (слой VI) (рис 2Е и F)
Для того, чтобы охарактеризовать электрофизиологические активность hiPSC полученных из нейронов, мы использовали ток целой клетки и напряжения записи хомута, то есть внутренние свойства и возбуждающий вход на эти нейроны были измерены в процессе разработки. Нейроны были способны генерировать потенциалы действия уже через одну неделю после дифференциации и процент клеток наблюдаются пики увеличивалось с течением времени (рис 2G и H). Кроме того, нейроны получили возбуждающей синаптической вход уже через неделю после индукции дифференциации: как частота и амплитуда возбуждающей синаптической вход увеличился в процессе разработки (Рисунок 2I - K).
нт "ВОК: Keep-together.within-страницу =" 1 "> Для того, чтобы лучше понять , как одноклеточные деятельность сочетает в виде функций сетевого уровня, необходимо изучить , как нейроны работают согласованно в условиях in vitro нейронных сетей культивировали на МЭС. представляют собой ценный экспериментальную модель для изучения нейронные динамики. Мы записали 20 мин электрофизиологических сетевой активности нейронов , полученных из hiPSC линии здорового управления культивируемых на 6-луночных МЭС (рис 2М). через несколько недель после индукции дифференцировки нейронов производным от здорового управления hiPSCs формируется функционально активных нейронных сетей, показывая спонтанные события (0,62 ± 0,05 шип / с; Рисунок 2а). на данном этапе развития (т.е. 16 d после начала дифференцировки) нет синхронных событий с участием всех каналов . МЭС обнаружены (рис 2О) уровень сетевой активности увеличился в процессе разработки: в течение четвертой недели после т он индуцирование дифференцировки, нейронные сети , показали высокий уровень спонтанной активности (2,5 ± 0,1 спайка / с; Рисунок 2 н) во всех лунках устройства. В сети также выставляются синхронной сети очередей (4,1 ± 0,1 пачки импульсов / мин, рис 2O) с большой продолжительностью (2,100 ± 500 мс).
Рисунок 1: hiPSC Дифференцировка в нейронах. A. Три временные точки hiPSCs дифференцировки в нейроны на покровные. B. Покрытие из hiPSCs на МЭС. С. астроциты при 100% сплошности в колбе T75 (обратите внимание , что клетки образуют мозаичную монослой). Шкала баров: 150 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
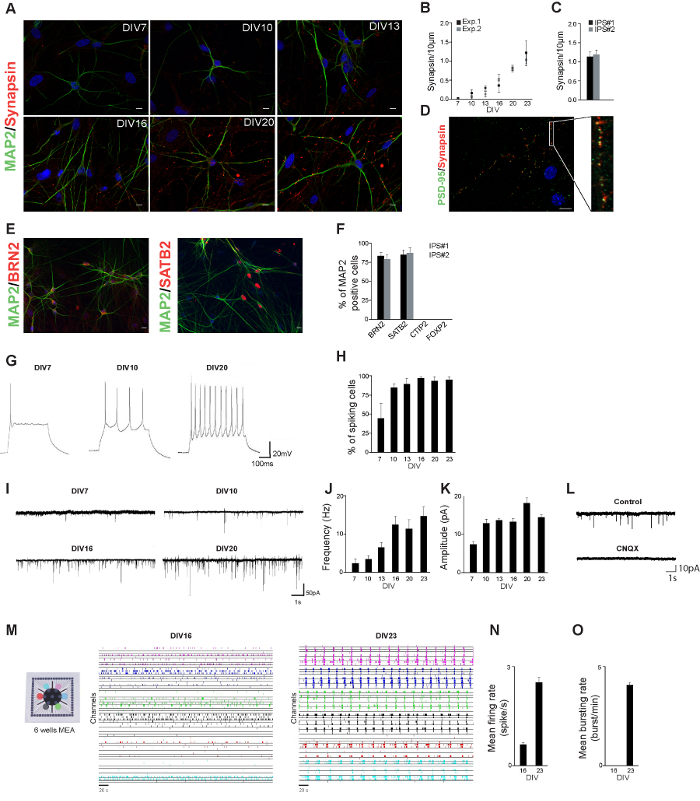
Рисунок 2. hiPSC полученные нейронах характеристики. А. hiPSC-производные нейроны окрашивали на МАР2 (зеленый) и синапсины-1/2 (красный) в разные дни после начала дифференцировки. Шкала бар: 10 мкм. Б. Количественное синапсины Puncta в двух независимых экспериментах. В каждом экспериментах были проанализированы по крайней мере, 10 клеток. C. Количественная синапсины Puncta в DIV23 в нейронах , полученных из двух независимых линий IPS. D. hiPSC-производные нейроны окрашивали для PSD-95 (зеленый) и синапсины-1/2 (красный) 23 дня после начала дифференциации. Синапсины Puncta соседствуют с PSD-95 Puncta. E. hiPSC-производные нейроны окрашивали для MAP2 (зеленый) и BRN2 (красный) или SATB2 (красный) 23 г после начала дифференцировки. F. Процент map2 положительных клеток,были положительными для указанных маркеров. G. Типичные токовые клещи записи , показывающие , что потенциалы действия могут быть получены уже в 7 суток после начала дифференцировки. H. Процент клеток в разные дни после индукции дифференциации , которые показывают один или несколько потенциалов действия. I. Характерные следы возбуждающих постсинаптических токов (EPSCs) , полученных hiPSC-нейронов , полученных в разные дни после дифференцировки. J. Частота возбуждающих постсинаптических токов в процессе разработки. К. Амплитуда возбуждающих постсинаптических токов в процессе разработки. L. Представитель следы записей EPSC без (контроля) и с CNQX (CNQX). М. Нейроны полученный из одной линии hiPSC культивировали на MEA 6-луночного и сетевую активность показана на hiPSC-производных нейронных сетей 16 и 23 дней , после индукции дифференцировки. Активности, регистрируемой изкаждый (скорость 10 кГц дискретизации) хорошо обозначена с другим цветом (5 мин от 20 мин записи показаны). Н. скорострельность 16 и 23 г после индукции дифференцировки. О. Скорость Разрывные 16 и 23 г после индукции дифференцировки. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
С учетом результатов, качество получаемых hiPSC полученных нейронов может быть оценена путем нейрофизиологической профиля клеток. То есть, в три-четыре недели после начала дифференцировки, морфологии,-1 синапсины / 2 экспрессии и электрофизиологических нейронов могут быть оценены. В этот момент времени, то hiPSC-производные нейроны, как ожидается, показывают нейронный морфологию, быть МАР2, синапсины / PSD-95 положительными при выполнении иммуноцитохимия, и exhibiт спонтанной электрофизиологических активности (как на одноклеточных и сетевом уровне).
Обсуждение
Здесь мы внедрили эффективный протокол hiPSC-дифференциацию опубликованной Чжан и др. (2013) 12 для измерения сетевой активности hiPSC-производных нейронных сетей на МЭС. Мы адаптировали оригинальный протокол путем создания rtTA / Ngn2 -положительным hiPSC линию до индукции дифференцировки нейронов. Этот дополнительный шаг позволяет контролировать нейронную плотность клеток на СМЭ. Контроль за плотности нейронов была важной предпосылкой для адаптации протокола к МЭС и для обеспечения согласованности. Для измерения активности нейронных сетей с использованием МЭС, нейроны должны образовывать плотные сети непосредственно поверх МЭС электродов 17,18. Это неизбежно требует жесткого контроля над плотностью металлизации нейронов. RtTA / Ngn2 -положительным hiPSC линия позволяет контролировать плотность нейронов , так как эта тактика не зависит от острых лентивирусов hiPSCs из каскадов , до дифференциации;поэтому rtTA / Ngn2 -положительным hiPSC линия практически исключает любое изменение конечного выхода из - за, например, лентивирусов токсичности и переменной эффективности инфекции.
Другим важным шагом экспериментальной процедуры является количество астроцитов крыс, которые культивируют совместно с дифференцирующих hiPSCs. Астроциты активно содействовать уточнению развития нейронных цепей, контролируя образование синапсов, техническое обслуживание и устранение, все из которых являются важными процессами для функционирования нервных клеток. Протокол, представленные в этой статье, является весьма астроцитов-зависимой: полностью зрелой и формируют функциональные синапсы, нейроны требуют поддержки со стороны астроцитов. Мы испытали, что число астроцитов должно быть примерно равно числу hiPSC полученных из нейронов поддерживать созревание нейронов и образование нейронных сетей, обладающих спонтанной активностью. Так как наши урожаи протокола астроцитов первичных Кю клетоквания с ограниченным сроком службы, выделение астроцитов крыс должно проводиться на регулярной основе.
Наша адаптация протокола , опубликованного Zhang и др. (2013) 12 для использования с MEA технологии, вероятно , значительно улучшить нашу способность изучать сетевую активность hiPSC-производных сетей. Ранее протоколы , используемые для изучения hiPSC полученных из нейронных сетей с МЭС полагались на затратных по времени процедур дифференциации 13-16. Протокол от Zhang и др. (2013) обеспечивает быструю альтернативу, и наша модификация устраняет источник изменчивости, что делает его в настоящее время более целесообразно использовать hiPSC-производные нейроны в сочетании с MEA технологии, особенно в высокой пропускной способности и фармакологических исследований. Кроме того, так как этот метод опубликован Zhang и др. (2013) 12 дает однородное население верхнего уровня корковых нейронов, наш адаптированный протокол делает возможным целенаправленные исследования в сети Activity этого конкретного нейронального подмножества.
Тем не менее, этот подход также имеет ряд ограничений. Во- первых, гомогенность культур также можно считать недостатком, так как культуры, менее вероятно, напоминают в естественных условиях сетей, где различные классы нейронов (например , ингибирующих и возбуждающих нейронов) образуют гетерогенную сеть. Для дальнейшего повышения использования hiPSC полученных из нейронов с MEA технологии, это будет иметь важное значение для разработки быстрых (трансгенов) на основе протоколов дифференцировки для других популяций нейронов клеток. Если протоколы становятся доступными, сети в пробирке будет более тесно имитировать сети в естественных условиях. Во- вторых, в настоящее время астроцитов крысы должны быть добавлены к hiPSC полученных из нейронов для поддержки роста, и , следовательно, в результате чего нейронной сети не является человеческой нейронной сети в буквальном смысле. Надежные протоколы для дифференциации hiPSCs в астроциты могут в будущем золеве этой проблемы 26. В- третьих, двумерные нейронных сетей, как описано здесь, являются ограниченная модель для изучения сложных трехмерных в естественных нейронных сетей. К счастью, протоколы , описывающие трехмерные культуры крысы первичных нейронов в сочетании с MEA технологии уже доступны 27,28. Проспективно, сочетание быстрых протоколов дифференциации для получения hiPSC полученных из нейронов и астроцитов с трехмерными методами культивирования и технологии MEA должны обеспечить новое понимание биологических механизмов, лежащих в основе неврологических расстройств.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The authors thank Jessica Classen for performing the whole-cell patch-clamp experiments. The hiPSCs used in our experiments were kindly provided by Huiqing Zhou and Willem van den Akker from the Radboud University Nijmegen. The transfer vectors used in this protocol were kindly provided by Oliver Brüstle, Philipp Koch and Julia Ladewig from the University of Bonn Medical Centre.
Материалы
| Name | Company | Catalog Number | Comments |
| Lebovitz's L-15 medium | Gibco | 11415-064 | |
| B-27 supplement | Gibco | 0080085SA | |
| Poly-D-Lysine (PDL) | Sigma-Aldrich | P6407 | |
| Ca2+/Mg2+-free HBSS | Gibco | 14175-095 | |
| 0.05% Trypsin-EDTA | Gibco | 25300-054 | |
| 2.5% Trypsin | Gibco | 15090-046 | |
| High-glucose DMEM | Gibco | 11965-092 | |
| FBS (Fetal Bovine Serum) | Sigma-Aldrich | F2442-500ML | |
| Penicillin/Streptomycin | Sigma-Aldrich | P4333 | |
| 70 µm cell strainer | BD Falcon | 352350 | |
| DPBS | Gibco | 14190-094 | |
| psPAX2 lentiviral packaging vector | Addgene | Plasmid #12260 | |
| pMD2.G lentiviral packaging vector | Addgene | Plasmid #12259 | |
| Basement membrane matrix | Gibco | A1413201 | |
| DMEM/F12 | Gibco | 11320-074 | |
| Cell detachment solution | Sigma-Aldrich | A6964 | |
| E8 medium | Gibco | A1517001 | |
| ROCK inhibitor | Gibco | A2644501 | Alternatively, ROCK inhibitors like thiazovivin can be used. |
| Polybrene | Sigma-Aldrich | H9268-5G | |
| G418 | Sigma-Aldrich | G8168-10ML | |
| Puromycin | Sigma-Aldrich | P9620-10ML | |
| Vitronectin | Gibco | A14700 | |
| 6-well MEAs | Multi Channel Systems | 60-6wellMEA200/30iR-Ti-tcr | |
| Glass coverslips | VWR | 631-0899 | |
| Poly-L-Ornithine (PLO) | Sigma-Aldrich | P3655-10MG | |
| Laminin | Sigma-Aldrich | L2020-1MG | |
| Doxycyclin | Sigma-Aldrich | D9891-5G | |
| N-2 supplement | Gibco | 17502-048 | |
| Non-essential amino acids | Sigma-Aldrich | M7145 | |
| NT-3, human recombinant | Promokine | C66425 | |
| BDNF, human recombinant | Promokine | C66212 | |
| Trypsin-EDTA | Gibco | 25300-054 | |
| L-alanyl-L-glutamine | Gibco | 35050-038 | |
| Neurobasal medium | Gibco | 21103-049 | |
| Cytosine β-D-arabinofuranoside | Sigma-Aldrich | C1768-100MG | |
| Straight fine-tipped forceps | Fine Science Tools | 11251 | |
| Fine-tipped spring scissors | Fine Science Tools | 91500-09 |
Ссылки
- Ahfeldt, T., Litterman, N. K., Rubin, L. Studying human disease using human neurons. Brain Res. , (2016).
- Zhang, S. C., Wernig, M., Duncan, I. D., Brustle, O., Thomson, J. A. In vitro differentiation of transplantable neural precursors from human embryonic stem cells. Nat Biotechnol. 19 (12), 1129-1133 (2001).
- Perrier, A. L., et al. Derivation of midbrain dopamine neurons from human embryonic stem cells. Proc Natl Acad Sci USA. 101 (34), 12543-12548 (2004).
- Wu, H., et al. Integrative genomic and functional analyses reveal neuronal subtype differentiation bias in human embryonic stem cell lines. Proc Natl Acad Sci USA. 104 (34), 13821-13826 (2007).
- Chambers, S. M., Fasano, C. A., Papapetrou, E. P., Tomishima, M., Sadelain, M., Studer, L. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Shi, Y., Kirwan, P., Livesey, F. J. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks. Nat Protoc. 7, 1836-1846 (2012).
- Espuny-Camacho, I., et al. Pyramidal neurons derived from human pluripotent stem cells integrate efficiently into mouse brain circuits in vivo. Neuron. 77 (3), 440-456 (2013).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Johnson, M. A., Weick, J. P., Pearce, R. A., Zhang, S. C. Functional neural development from human embryonic stem cells: accelerated synaptic activity via astrocyte coculture. J Neurosci. 27 (12), 3069-3077 (2007).
- Hu, B. Y., et al. Neural differentiation of human induced pluripotent stem cells follows developmental principles but with variable potency. Proc Natl Acad Sci USA. 107 (9), 4335-4340 (2010).
- Kim, H., et al. miR-371-3 expression predicts neural differentiation propensity in human pluripotent stem cells. Cell Stem Cell. 8 (6), 695-706 (2011).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Odawara, A., Saitoh, Y., Alhebshi, A. H., Gotoh, M., Suzuki, I. Long-term electrophysiological activity and pharmacological response of a human induced pluripotent stem cell-derived neuron and astrocyte co-culture. Biochem Biophys Res Commun. 443 (4), 1176-1181 (2014).
- Odawara, A., Katoh, H., Matsuda, N., Suzuki, I. Physiological maturation and drug responses of human induced pluripotent stem cell-derived cortical neuronal networks in long-term culture. Sci Rep. 6, 26181 (2016).
- Amin, H., Maccione, A., Marinaro, F., Zordan, S., Nieus, T., Berdondini, L. Electrical Responses and Spontaneous Activity of Human iPS-Derived Neuronal Networks Characterized for 3-month Culture with 4096-Electrode Arrays. Front Neurosci. 10, (2016).
- Heikkila, T. J., et al. Human embryonic stem cell-derived neuronal cells form spontaneously active neuronal networks in vitro. Exp Neurol. 218 (1), 109-116 (2009).
- Massobrio, P., Massobrio, G., Martinoia, S. Multi-program approach for simulating recorded extracellular signals generated by neurons coupled to microelectrode arrays. Neurocomputing. 70, 2467-2476 (2007).
- Wang, L., Riss, M., Buitrago, J. O., Claverol-Tinturé, E. Biophysics of microchannel-enabled neuron-electrode interfaces. J Neural Eng. 9 (2), (2012).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85, 890-902 (1980).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes. J. Vis. Exp. (71), e50079 (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J Vis Exp. (63), e3965 (2012).
- Ba, W., et al. ARHGAP12 functions as a developmental brake on excitatory synapse function. Cell Rep. 14 (6), 1355-1368 (2016).
- Bologna, L. L., et al. Investigating neuronal activity by SPYCODE multi-channel data analyzer. Neural Netw. 23 (6), 685-697 (2010).
- Ba, W., et al. TRIO loss of function is associated with mild intellectual disability and affects dendritic branching and synapse function. Hum Mol Genet. 25 (5), 892-902 (2016).
- Benevento, M., et al. Histone methylation by the Kleefstra syndrome protein EHMT1 mediates homeostatic synaptic scaling. Neuron. 91 (2), 341-355 (2016).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. -. J., Zhang, S. -. C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nature biotechnology. 29 (6), 528-534 (2011).
- Frega, M., Tedesco, M., Massobrio, P., Pesce, M., Martinoia, S. Network dynamics of 3D engineered neuronal cultures: a new experimental model for in-vitro electrophysiology. Sci Rep. 4, 5489 (2014).
- Tedesco, M., Frega, M., Martinoia, S., Pesce, M., Massobrio, P. Interfacing 3D engineered neuronal cultures to micro-electrode arrays: an innovative in vitro experimental model. J Vis Exp. (104), e53080 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены