Method Article
Протокол для множественного нокаута гена в мышиных органоидах малого кишечника Использование CRISPR-конкатэмера
В этой статье
Резюме
В этом протоколе описаны этапы клонирования нескольких однонаправленных РНК в один направляющий вектор-конкатенатор РНК, который особенно полезен при создании нокаутов с несколькими генами с использованием технологии CRISPR / Cas9. Появление двойных нокаутов в органоидах кишечника показано как возможное применение этого метода.
Аннотация
Технология CRISPR / Cas9 значительно улучшила осуществимость и скорость исследований потери функции, которые необходимы для понимания функции генов. У более высоких эукариот паралогичные гены могут маскировать потенциальный фенотип, компенсируя потерю гена, тем самым ограничивая информацию, которая может быть получена из генетических исследований, основанных на выпадениях одного гена. Мы разработали новый метод быстрого клонирования направляющих конъюгатов РНК (gRNA), чтобы создать многоцелевые нокауты после одного раунда трансфекции в небольших органных клетках мыши. Наша стратегия позволяет конкатмеризовать до четырех отдельных gRNAs в один вектор, выполняя одну реакцию Shuffling Golden Gate с отожженными олигонами gRNA и предварительно разработанным ретровирусным вектором. Это позволяет либо одновременный нокаут до четырех разных генов, либо повысить эффективность нокаута после нацеливания одного гена несколькими гРНК. В этом протоколе мы подробно показываемКак эффективно клонировать несколько гРНК в ретровирусный вектор CRISPR-concatemer и как добиться высокоэффективной электропорации в кишечных органоидах. В качестве примера мы показываем, что одновременный нокаут двух пар генов, кодирующих отрицательные регуляторы сигнального пути Wnt (Axin1 / 2 и Rnf43 / Znrf3), делает кишечные органоиды устойчивыми к отмене ключевых факторов роста.
Введение
Обратный генетический подход является широко используемым методом исследования функции гена. В частности, исследования потери функции, в которых разрушение гена вызывает фенотипические изменения, играют ключевую роль в построении нашего понимания биологических процессов. Метод CRISPR / Cas9 представляет собой последнее усовершенствование в технологии технологии генома и революционизировал существующую практику генетики в клетках и организмах. Cas9 представляет собой эндонуклеазу с РНК-направленностью, которая связывается с определенной последовательностью ДНК, комплементарной гРНК, и генерирует двухнитевый разрыв (DSB). Этот DSB рекрутирует устройство для восстановления ДНК, которое в отсутствие шаблона ДНК для гомологичной рекомбинации будет повторно лигировать вырезанную ДНК-цепь с помощью ошибочного гомологичного концевого соединения, что, таким образом, может привести к вставкам или делециям нуклеотидов (нуклеотидов) Вызывая мутации в рамке 1 .
Большая легкость и универсальность CRISPR / Cas9 apprOach сделала его очень привлекательным инструментом для экранов с ножом для генома, направленных на распутывание неизвестных функций гена 2 , 3 . Тем не менее, подходы с одним нокаутом генов имеют ограниченное применение, если существуют множественные паралоги с избыточными функциями. Таким образом, удаление одного гена может быть недостаточным для определения функции этого гена при возможной компенсации паралогами, что приводит к незначительному или отсутствующему фенотипическому изменению 4 . Поэтому важно параллельно выбивать параллели, поставляя несколько векторов gRNA, нацеленных на различные паралоговые гены, чтобы преодолеть влияние генетической компенсации.
Чтобы расширить использование CRISPR / Cas9 для нокаута паралогого гена, в последнее время мы разработали быстрый способ однократного клонирования для клонирования до четырех предварительно отожженных gRNAs в один ретровирусный вектор 5 . Основа, называемая CRISPR-concatemer, основанаНа ретровирусной плазмиде MSCV, содержащей повторяющиеся кассеты экспрессии gRNA. Каждая кассета содержит два перевернутых участка распознавания рестрикционного фермента типа IIS Bbs I, который может быть необратимо заменен отожженным олигоном gRNA с соответствующими свесами с использованием реакции перетасовки золотых ворот в одной пробирке 6 . Этот метод клонирования состоит из повторяющихся циклов пищеварения и лигирования, которые позволяют одновременную сборку нескольких фрагментов ДНК путем использования различных последовательностей навесов, генерируемых Bbs I. Уникальность этого фермента заключается, например, в возможности выполнять асимметричные срезы за пределами его распознавания последовательность; Поэтому каждая кассета может иметь различную последовательность с индивидуальными выступами, фланкирующими сайт Bbs I, и таким образом, каждая gRNA может быть клонирована в определенном положении и ориентации вектора конкатематора.
В качестве доказательства принципа мы продемонстрировали использование этой стратегии вМышечных органоидов кишечника, одновременно разрушая две пары паралогичных отрицательных регуляторов пути Wnt одним кругом электропорации 5 .
В течение последних нескольких лет многие другие группы разработали аналогичные стратегии, основанные на множественных векторах экспрессии gRNA, построенных с использованием перетасовки 7 « Золотых ворот», для достижения нокаута нескольких генов в различных модельных системах, таких как клеточные линии 8 , 9 , рыбок данио 10 и Escherichia coli 11 . В своих протоколах gRNAs сначала клонируются в отдельные промежуточные векторы и затем собираются вместе в один конечный продукт. Напротив, основным преимуществом нашей стратегии CRISPR-concatemer является удобство единственного шага по BBS I, клонирование. Как и другие конкатэмеры gRNA, наш метод позволяет либо одновременный нокаут до четырехРазличные гены или повышенную эффективность нокаута CRISPR после нацеливания одного или двух генов с множественными гРНК ( рис. 1 ).
В этом протоколе мы подробно описываем каждый шаг в генерации векторов CRISPR-конкатэмера, от проектирования gRNA до реакции «Золотые ворота» и подтверждения успешного клонирования. Мы также предоставляем высокоэффективный протокол для трансфекции CRISPR-конкатемеров в мышиные малые кишечные органоиды путем электропорации и последующих экспериментов по выводу фактора роста.
протокол
1. gRNA Дизайн для CRISPR-конкатеманера Vector
Примечание. Цель этого раздела - объяснить, как выбрать оптимальную стратегию таргетинга и как проектировать gRNAs, содержащие конкретные выступы для вектора CRISPR-concatemer.
- Конструируйте gRNAs против генов, представляющих интерес, с использованием выбранного в дизайне инструмента CRRPR. См. Таблицу материалов для примера.
ПРИМЕЧАНИЕ. Когда вы нацеливаете пару паралогичных генов, хотя можно разработать одну гРНК на ген, рекомендуется создать две гРНК на ген, чтобы увеличить шансы на достижение двойного нокаута ( рисунок 1 ). - Убедитесь, что gRNAs не содержат сайт распознавания Bbs I, используя инструмент сопоставления ограничений (см. Таблицу материалов для примера).
- Добавьте конкретные олигонуклеотиды CRISPR-concatemer к каждому олиго, как показано в таблице 1 .
Таблица 1: Сверты для каждой кассеты вектора CRISPR-конкатэмера.
2. Клонирование гРНК в вектор CRISPR-конкатэмера
- Фосфорилирование и отжиг олигонов
ПРИМЕЧАНИЕ. Этот шаг иллюстрирует, как tO верхние и нижние нити для каждого олигонуклеата gRNA и как фосфорилировать их концы в одной реакции.- Подготовьте реакционную смесь для фосфорилирующих олигонов и отжигая верхнюю и нижнюю нити на льду в соответствии с инструкциями ниже.
ПРИМЕЧАНИЕ. Все олигоны могут объединяться в одну реакцию; Например, в случае вектора 4 gRNA-concatemer, объединяют вместе 8 олигонов. - Для 3-х конкатэмеров используйте верхнюю нить gRNA 3,0 мкл (1,0 мкл от каждой гРНК, 10 мкМ, 1 мкл / гРНК), 3,0 мкл гренкой нити gRNA (1,0 мкл от каждой gRNA, 10 мкМ, 1 мкл / гРНК), 2,0 мкл T4 ДНК-лигазный буфер (10x), 1,0 мкл T4 PNK и добавление H 2 O до общего объема 20,0 мкл.
- Хорошо перемешать путем пипетирования и запустить его в термоциклере, используя следующие настройки: 37 ° C в течение 30 минут, 95 ° C в течение 5 минут, спуск до 25 ° C при 0,3 ° C / мин, при температуре 4 ° C.
- Подготовьте реакционную смесь для фосфорилирующих олигонов и отжигая верхнюю и нижнюю нити на льду в соответствии с инструкциями ниже.
- Bbs I перетасовка реакции
ПРИМЕЧАНИЕ. В этом разделе предварительно отожженные олигоны gRNA вводят в соответствующее положение вектора конкатенатора за один шаг чередующимися циклами переваривания и лигирования.- Разбавьте реакционную смесь 1: 100 в воде, свободной от ДНКазы / РНКазы, для получения 3 и 4 гРНК-конкатемберных векторов.
ПРИМЕЧАНИЕ. При клонировании 2 gRNA-concatemers этот шаг не требуется. - Соберите реакцию перетасовки Bbs I на льду в соответствии с инструкциями ниже. Включите отрицательный элемент управления, который содержит только вектор.
- Использовать 100 нг-вектор CRISPR-конкатэмера, 10,0 мкл олиго-смеси, 1,0 мкл BSA-содержащего рестрикционного ферментного буфера (10х), 1,0 мкл DTT (10 мМ), 1,0 мкл АТФ (10 мМ), 1,0 мкл Bbs I, 1,0 мкл T7-лигазы , И H 2 O до общего объема 20,0 мкл.
- Хорошо перемешайте пипетированием и запустите его в термоциклере, используя следующие настройки: выполните 50 циклов для клонирования 3 и 4 gRNA-конкатэмеров и 25 циклов для 2 гРНК-конкатэмеров, как при 37 ° С в течение 5 мин, 21 ° С в течение 5 мин, выдерживают при 37 ° С в течение 15 мин, а затем 4 ° С навсегда.
- Разбавьте реакционную смесь 1: 100 в воде, свободной от ДНКазы / РНКазы, для получения 3 и 4 гРНК-конкатемберных векторов.
- Обработка экзонуклеазой
ПРИМЕЧАНИЕ. Этот шаг рекомендуется, так как он повышает эффективность клонирования путем удаления любых следов линеаризованной ДНК.- Обработайте реакцию переливания Bbs I с помощью экзонуклеазы ДНК (см. Таблицу материалов ) следующим образом.
- Возьмите 11,0 мкл лигирующей смеси с предыдущей стадии (2.2.3), добавьте 1,5 мкл экзонуклеазного буфера (10х), 1,5 мкл АТФ (10 мМ), 1,0 мкл ДНК-экзонуклеазы и доведите общий объем до 15,0 мкл водой. Инкубируйте при 37 ° С в течение 30 мин, затем 70 ° С в течение 30 мин.
ПРИМЕЧАНИЕ. Этот шаг удаляет любую остаточную линеаризованную ДНК в смеси и, таким образом, повышает эффективность клонирования. - Используйте 2 мкл реакционной смеси для превращения в химическое соединениеПалатки бактерий E. coli при тепловом шоке 12 .
ПРИМЕЧАНИЕ. Альтернативно, реакцию можно хранить в течение одной недели при -20 ° C.
- Коррекция рестрикции
ПРИМЕЧАНИЕ. Целью этого шага является оценка путем рестрикционного расщепления успеха процедуры клонирования.- Чтобы подтвердить наличие вставок gRNA в векторе CRISPR-concatemer, подберите 4-8 бактериальных колоний с инокулирующей петлей, вырастите каждый клон в 4 мл среды LB в течение ночи при 37 ° C в орбитальном шейкере. Экстрагируют ДНК, используя набор плазмиды miniprep в соответствии с инструкциями производителя (см. Таблицу материалов ).
- Дайджест ~ 200 нг ДНК с 10 U EcoR I + 5 U Bgl II в 10 мкл реакции путем инкубации его при 37 ° C в течение 3 часов в бактериальном инкубаторе. Включите отдельную реакционную смесь с соответствующим исходным вектором в качестве положительного контроля для сравнения размеров.
ПРИМЕЧАНИЕ.S подтвердят, присутствуют ли все конкатемеры, так как эти два рестрикционных фермента будут поглощать целые конкатемеры. Это ожидаемые размеры для каждого конкатематера: 2 gRNA-конкатематор (800 bp), 3 gRNA-конкатематор (1,2 т.п.н.) и 4 gRNA-конкатематор (1,6 т.п.н.). - Проводите реакции расщепления на 1% агарозном геле при 90 В в течение приблизительно 20 мин.
- Визуализируйте гель с помощью ультрафиолетового трансиллюминатора. Определите клоны с правильным размером вставки, гарантируя, что их шаблон полосы соответствует одному из исходного вектора и что каждый фрагмент имеет ожидаемый размер с использованием лестницы ДНК.
- Дайте отобранные клоны 5 U Bbs I при 37 ° C в течение 3 часов в бактериальном инкубаторе. Включите отдельную реакционную смесь с соответствующим исходным вектором в качестве контроля.
ПРИМЕЧАНИЕ. Этот дополнительный шаг пищеварения заключается в том, чтобы подтвердить, что гРНК были клонированы в правильное положение, и, следовательно, все сайты распознавания Bbs I были потеряны. - Выполнить реакции пищеварения на1% агарозного геля при 90 В в течение приблизительно 20 мин. Считайте правильными только те векторы, которые не разрезаны Bbs I, поскольку они содержат только gRNAs.
- Векторная последовательность
ПРИМЕЧАНИЕ. Целью этого этапа является подтверждение наличия последовательностей gRNA в тех векторах, которые были определены как правильные с помощью анализа рестрикционного расщепления.- Подтвердите положительные векторы конкатэмера по секвенированию Сэнгера 13, используя следующие праймеры:
Вперед: TCAAGCCCTTTGTACACCCTAAG (для проверки первой кассеты gRNA)
Linker1_Forward: GACTACAAGGACGACGATGACAA (для проверки второй кассеты gRNA)
Linker2_Reverse: GGCGTAGTCGGGCACGTCGTAGGGGT (для проверки второй кассеты gRNA)
Linker2_Forward: ACCCCTACGACGTGCCCGACTACGCC (для проверки третьей кассеты gRNA)
Linker3_Reverse: TCCTCCTCTGAGATCAGCTTCTGCAT (для проверки третьей кассеты gRNA)
Реверс: AGGTGGCGCGAAGGGGCCACCAAAG (для проверки последней gRNAкассета) - Проверьте наличие всех gRNA, выполнив поиск их последовательностей в чтениях последовательности.
- Подтвердите положительные векторы конкатэмера по секвенированию Сэнгера 13, используя следующие праймеры:
3. Трансфекция кишечных органоидов электропорацией
ПРИМЕЧАНИЕ. Обратите внимание, что эта процедура основана на протоколе, опубликованном Fujii et al . В 2015 году, с адаптацией к мышиным культурам тонких кишечных органоидов 14 .
- Предварительно электропорации
ПРИМЕЧАНИЕ. В этом разделе описывается, как подготовить мышиные органоиды кишечника до электропорации путем удаления всех антибиотиков и кондиционированных сред из их культуральной среды. Это предотвратит возможные токсические эффекты во время электропорации.- В день 0 процедуры трансфекции разделяют органоиды в соотношении 1: 2.
ПРИМЕЧАНИЕ. Культуры кишечных органоидов можно получить, выполняя изоляцию склепа в соответствии с ранее установленными протоколами 15 . Пожалуйста, обратитесь к Таблица 2 для всех медиа-композиций.- При расщеплении органоидов для электропорации высевают минимум 6 лунок 48-луночного планшета на трансфекцию.
- Выделите органоиды с каплями матрицы 20 мкл-основания и произведите их в среде WENR + Nic (Wnt + EGF + Noggin + R-spondin + Nicotinamide) при 37 ° C, 5% CO 2 во влажном инкубаторе (как описано выше 15 ) ,
- На второй день замените WENR + Nic 250 мкл EN (EGF + Noggin) + CHIR99021 (ингибитор гликогенсинтазы киназы-3) + Y-27632 (ингибитор ROCK) без антибиотиков (см. Таблицу 2 ).
ПРИМЕЧАНИЕ. На всех стадиях количество среды, добавляемой в каждую лунку 48-луночного планшета, составляет 250 мкл. - На третий день замените органоидную среду на EN + CHIR99021 + Y-27632 + 1,25% об. / Об. Диметилсульфоксид (ДМСО) без антибиотиков.
- В день 0 процедуры трансфекции разделяют органоиды в соотношении 1: 2.
- Подготовка клеток
ЗАМЕТКА:Здесь мы опишем, как фрагментировать органоиды в мелкие клеточные кластеры путем механической и химической диссоциации. Эти шаги имеют решающее значение для успеха процедуры.- На 4-й день разрушите купола матрицы подвалов с помощью наконечника пипетки 1 мл и перенесите органоиды в пробирку объемом 1,5 мл. Содержимое пула четырех лунок 48-луночного планшета в трубку.
- Механически разрушать органоиды на мелкие фрагменты пипетированием вверх и вниз пипеткой P200 примерно 200 раз. Центрифуга при комнатной температуре, 5 мин при 600 × g.
- Удалите среду и повторно суспендируйте гранулу в 1 мл рекомбинантной протеазы класса клеточной культуры (см. Таблицу материалов). Инкубируйте при 37 ° C в течение максимум 5 минут, а затем проверьте 50 мкл капли образца под инвертированным светом микроскопом с 4-мя объективами.
ПРИМЕЧАНИЕ. Кластеры 10-15 клеток желательны, так как это увеличивает выживаемость клеток после электропорации. - Перенесите клеточную суспензию в 15-сантиметровую трубку с низким связыванием и остановитеДиссоциации путем добавления 9 мл основной среды без антибиотиков (см. Таблицу 2 ). Центрифугируют при комнатной температуре, 5 мин при 600 × g, затем отбрасывают супернатант и ресуспендируют гранулу в 1 мл восстановленной сывороточной среды (см. Таблицу материалов ).
- Подсчитайте количество клеток с камерой Бюркера и используйте минимум 1 × 10 5 клеток на реакцию электропорации. Добавьте 9 мл восстановленной сывороточной среды в 15 мл пробирку и центрифугу при комнатной температуре, 3 мин при 400 × g.
- Электропорация
ПРИМЕЧАНИЕ. В следующих разделах приводятся инструкции о том, как выполнять электропорацию и после этого делать органоиды.- Удалите весь супернатант и повторно суспендируйте гранулу в растворе электропорации (см. Таблицу материалов ). Добавить общее количество ДНК размером 10 мкг в клеточную суспензию и добавить раствор для электропорации до конечного объема 100 мкл и сохранить ячейку-DNСмесь на льду. Используйте векторы CRISPR-concatamer в комбинации с плазмидой экспрессии Cas9 ( например, Addgene # 41815) в соотношении 1: 1.
ПРИМЕЧАНИЕ. Общий объем добавляемой ДНК должен быть меньше или равен 10% от общего объема реакции. - Включите отдельную трансфекционную смесь, содержащую плазмиду GFP, для оценки эффективности трансфекции ( например, pCMV-GFP, Addgene # 11153 или любую общую GFP-экспрессирующую плазмиду).
- Добавьте смесь клеток-ДНК в кювету электропорации и поместите ее в камеру электропоратора. Измерьте импеданс, нажав соответствующую кнопку на электропораторе и убедитесь, что он составляет 0,030-0,055 Ом. Выполните электропорацию в соответствии с настройками, показанными в таблице 3 .
ПРИМЕЧАНИЕ. Если значение импеданса выходит за пределы допустимого диапазона, отрегулируйте объем раствора в кювете. - Добавить 400 мкл буфера для электропорации + Y-27632 в кювету и затем перенести все на 1,5-миллилитровую трубку. ИнкубаторыПри комнатной температуре в течение 30 мин, чтобы позволить клеткам восстанавливаться, а затем откручивать их при комнатной температуре в течение 3 мин при 400 × g.
- Удаляют супернатант и ресуспендируют гранулу в 20 мкл / лунку матрицы основания. Высевают приблизительно 1 × 10 4 × 1 × 10 5 клеток на лунку в 48-луночном планшете и добавьте среду EN + CHIR99021 + Y-27632 + 1,25% об. / Об. ДМСО. Инкубируйте при 37 ° C.
- На 5-й день измените среду на EN + CHIR99021 + Y-27632 и проверьте эффективность трансфекции, наблюдая за выражением GFP ( рисунок 2 ). Держите органоиды при 37 ° C и обновите среду EN + CHIR99021 + Y-27632 через 2 дня.
- На 9-й день измените среду на WENR + Nic + Y-27632 и инкубируйте при 37 ° C.
ПРИМЕЧАНИЕ. Y-27632 можно удалить через 7-10 дней (в день 16-19).
- Удалите весь супернатант и повторно суспендируйте гранулу в растворе электропорации (см. Таблицу материалов ). Добавить общее количество ДНК размером 10 мкг в клеточную суспензию и добавить раствор для электропорации до конечного объема 100 мкл и сохранить ячейку-DNСмесь на льду. Используйте векторы CRISPR-concatamer в комбинации с плазмидой экспрессии Cas9 ( например, Addgene # 41815) в соотношении 1: 1.
| Пульсирующий импульс | Импульс передачи | |
| напряжение | 175V | 20V |
| Длительность импульса | 5 мс | 50msec |
| Интервал импульсов | 50msec | 50msec |
| Количество импульсов | 2 | 5 |
| Скорость распада | 10% | 40% |
| полярность | + | +/- |
Таблица 3: Настройки электропорации.
4. Снятие фактора роста
Примечание. Здесь проиллюстрировано, как проводить эксперимент по удалению фактора роста при выбивании отрицательных регуляторов пути Wnt в органоидах кишечника.
- 10-14 дней послеR электропорацию, разделить органоиды в соотношении 1: 3 на 48-луночном планшете после вышеупомянутых этапов (3.2.1 - 3.2.2).
- Ресуспендируют гранулу органоида в 20 мкл мембраны из подвальной мембраны и дайте ей затвердеть при 37 ° С в течение 10 мин. Затем наложите 250 мкл среды, лишенной от фактора роста ( например, EN), чтобы проверить, достигнут ли нокаут целевых генов 5 .
- Разделите органоиды в условиях отсутствия факторов роста в течение минимум 2 - 3 проходов, чтобы увидеть разницу в выживаемости между контрольными органоидами дикого типа дикого типа (WT) и мутантными органоидами 5 , 15 .
ПРИМЕЧАНИЕ: Органоиды дикого типа не должны выживать в среде, лишенном фактора роста, в течение двух проходов, тогда как мутантные линии должны быть способны расти.
Результаты
Чтобы подтвердить наличие правильного количества вставок gRNA в векторе конкатенатора , рестрикционное расщепление выполняется ферментами ( EcoR I + Bgl II), фланкирующими все gRNA-экспрессирующие кассеты (каждый размер кассеты составляет ~ 400 п.о., рис. 1 ). Например, при генерации вектора 4 gRNA-concatemer ожидаемый размер нижней полосы в агарозном геле составляет приблизительно 1,6 Kbp; Любая полоса ниже этого указывает на то, что не все 4-граммовые кассеты вставляются в вектор ( рис. 2А ). Кроме того, всегда рекомендуется проверить, что все сайты распознавания Bbs I потеряны, и фермент не разрезает вектор ( рисунок 2B ).
Как только конструкции будут подтверждены, они могут быть доставлены в мышиные органоиды кишечника путем электропорации для достижения оптимальныхЛ уровня эффективности трансфекции (до 70%), как показано GFP-контролем ( рис. 3 ).
Наконец, чтобы функционально проверить эффективность этой стратегии, кишечные органоиды, трансфецированные векторами Cas9 и concatemer против Axin1 / 2 и Rnf43 / Znrf3, культивировали в EN (вывод R-spondin) и EN + IWP2 (удаление R-spondin и Wnt, IWP2 : Ингибитор возбуждения, 2,5 мкМ) в течение минимум 3 проходов ( рисунок 4 ). В то время как нетрансфицированные органоиды WT умерли в обоих условиях, Axo1 / 2 нокаутированные органоиды выживали как из-за последующей активации Wnt-пути; Кроме того, мутантные органоиды Rnf43 / Znrf3 выживают в отсутствие R-спондина, но не могут выжить в присутствии IWP2, что приводит к истощению Wnt, который активирует путь. Взятые вместе, эти наблюдения показывают, что нокаут этих пар паралоги возможен путем генерации tОн ожидал фенотипа органоида. Подробная информация об этих результатах опубликована в биологии развития 5 .
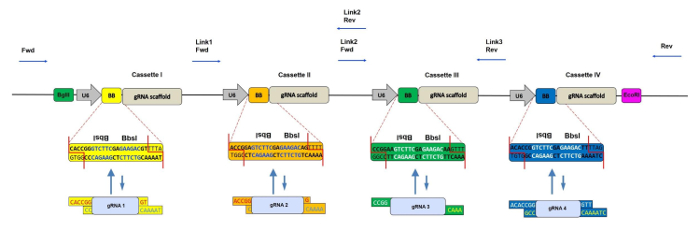
Рисунок 1: Схематическое представление CRISPR-конкатэмера с 4 кассетами. Схема вектора 4 gRNA-concatemer с каждой кассетой 400 bp, содержащей промотор U6, два перевернутых повторяющихся Bbs I-сайта (также обозначенных как BB) и gRNA-эшафоты в этом порядке. Во время реакции перетасовки сайты Bbs I заменяются фрагментами рРНК с соответствующими свесами и, следовательно, теряются. Связывающие участки секвенирующих праймеров для проверки правильности введения олигонов gRNA показаны синими стрелками. Fwd = прямой праймер, Rev = обратный праймер, Link 1/2/3 = области компоновки 1/2/3. Пожалуйста сЛизать здесь, чтобы просмотреть большую версию этого рисунка.

Рисунок 2: Репрезентативные схемы вываривания векторов конкатемеров. ( A ) Двойное переваривание 3 и 4 векторов gRNA- конкатэмера с EcoR I и Bgl II. Правильная картина пищеварения отмечена зеленым тиком, тогда как векторы с 1 или 2 гРНК-вставками отмечены красным крестом. Дорожка 1 показывает переваривание родительского вектора 4 гРНК-конкатэмера, используемого в качестве положительного контроля (обозначается «+»); Аналогично, дорожка 5 показывает переваривание родительского вектора 3 гРНК-конкатэмера, обозначенного буквой «+». ( B ) Пищеварение с Bbs I, показывающее правильный размер непереваренных векторов конкатэмера (обозначенных зелеными клещами). Переваривание gRNA-содержащего вектора конкатэмера , которое потеряло сайты Bbs I, используется в качестве положительного контроля иD помечен знаком «+». Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
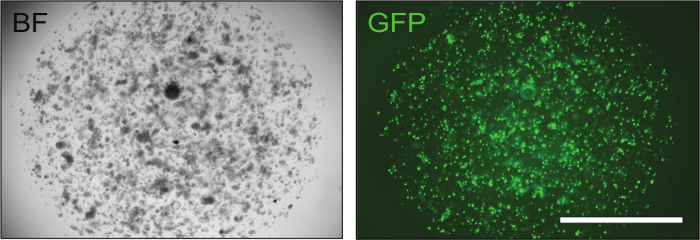
Рисунок 3: Типичное изображение успешно электропористых кишечных органоидов. Трансфекция плазмиды GFP играет важную роль в оценке эффективности трансфекции. Примерно через 24 часа после электропорации органоиды, содержащие небольшое количество клеток, уже видны, и, если процедура электропорации прошла успешно, до 70% из них отображает зеленую флуоресценцию. BF = яркое поле, GFP = зеленый флуоресцентный белок. Шкала шкалы = 2000 мкм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
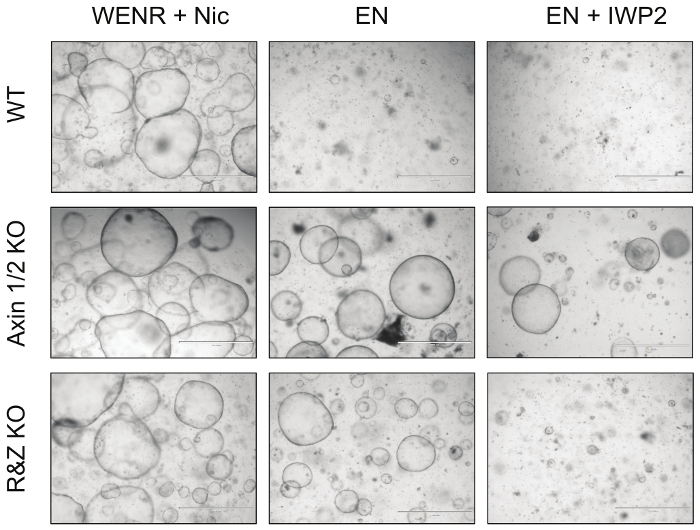
Рисунок 4: Репрезентативные изображения мутантных кишечных органоидов. Нокаут отрицательных регуляторов Wnt-пути Axin1 и Rnf43 вместе со своими паралогами приводит к тому, что кишечные органоиды устойчивы к лихорадочным факторам роста. В частности, Axin1 / 2 нокаутирующие органоиды (Axin1 / 2 KO) могут расти в отсутствие как R-спондинов (EN: EGF + Noggin), так и Wnt (EN + IWP2: EN + ингибитор пирсипина), тогда как Rnf43 / Znrf3-мутантные органоиды (R & Z KO) может выживать только в отсутствие R-spondin (EN). Напротив, органоиды WT могут выживать только в контрольной культуре, WENR + Nic (Wnt + EGF + Noggin + R-spondin + Nicotinamide). Шкала шкалы = 1000 мкм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Базальная среда | Комментарии | |
| Хранить при 4 ° C в течение 4 недель | ||
| Культуральная среда для клеток | 500 мл | См. Таблицу материалов |
| L-глутамин 100x | 5 мл | |
| Буферный агент 1 M | 5 мл | См. Таблицу материалов |
| Пенициллин стрептомицин 100х | 5 мл | |
| WENR + Nic (Wnt + EGF + Noggin + R-спондин + никотинамид) | ||
| Хранить при температуре 4 ° C в течение 2 недель | ||
| Базальная среда | До 50 мл | |
| Нейронная клетка без сыворотки (50x) | 1 мл | См. Таблицу materials |
| Нейронная клетка без сыворотки (100x) | 500 мкл | См. Таблицу материалов |
| Н-ацетилцистеин (500 мМ) | 125 мкл | |
| EGF мыши (100 мкг / мл) | 25 мкл | |
| Мышь Noggin (100 мкг / мл) | 50 мкл | |
| Кондиционированная среда R-Spondin | 5 мл | |
| Кондиционированная среда Wnt3a | 25 мл | |
| Никотинамид (1 М) | 250 мкл | |
| EN + CHIR + Y-27632 (EGF + Noggin + CHIR + Y-27632) | ||
| Хранить при температуре 4 ° C в течение 2 недель | ||
| Базальная среда без пенициллина Стрептомицин | До 20 мл | |
| Нейронная клетка без сыворотки (50x) | 400 мкл | См. Таблицу материалов |
| Нейронная клетка без сыворотки (100x) | 200 мкл | См. Таблицу материалов |
| Н-ацетилцистеин (500 мМ) | 50 мкл | |
| EGF мыши (100 мкг / мл) | 10 мкл | |
| Мышь Noggin (100 мкг / мл) | 20 мкл | |
| Y-27632 (10 мкМ) | 20 мкл | |
| CHIR99021 (8 мкМ) | 10 мкл | |
| EN (EGF + Noggin) | ||
| Хранить при 4 ° C в течение 4 недель | ||
| Базальная среда | До 50 мл | |
| Нейронная клетка без сыворотки (50x) | 1 мл | См. Таблицу материалов |
| Нейронная клетка без сыворотки (100x) | 500 мкл | См. Таблицу материалов |
| Н-ацетилцистеин (500 мМ) | 125 мкл | |
| EGF мыши (100 мкг / мл) | 25 мкл | |
| Мышь Noggin (100 мкг / мл) | 50 мкл |
Таблица 2: Состав органоидов.
Обсуждение
В этом протоколе мы подробно изложим все шаги, необходимые для создания CRISPR-конкатэмеров и применения CRISPR-конкатемеров в органоидах кишечника мыши, чтобы одновременно выбить несколько генов. Как отмечалось ранее, эта стратегия имеет ряд преимуществ, таких как ее скорость, высокая эффективность и экономичность.
Чтобы успешно выполнить всю процедуру, необходимо рассмотреть несколько важных аспектов. Во-первых, важно, чтобы все олигоны gRNA были надлежащим образом отожжены и фосфорилированы, поскольку они представляют собой исходный материал для реакции клонирования Bbs I, который сам по себе является очень эффективным. Во-вторых, когда электропорация органоидов, чем больше клеток используется для каждого состояния, тем выше максимальная эффективность трансфекции. Кроме того, важно также, что после диссоциации клеток мелкие клеточные кластеры преобладают над отдельными клетками.
Тем не менее, можно встретить технические проблемыЛемы при попытке либо клонирования, либо трансфекции в первый раз; В случае проблем при клонировании гРНК рекомендуется дважды проверить последовательность олигонуклеазы gRNA и, если правильно, выбрать дополнительные колонии бактерий для скрининга с рестрикционным расщеплением. Если эффективность трансфекции и жизнеспособность клеток являются низкими после электропорации, тогда желательно повторить протокол, используя большее количество клеток для каждого состояния и уменьшая время диссоциации клеток до 3 мин.
Хотя генерация CRISPR-конкатемеров относительно дешева и легка, использование крупномасштабных генетических экранов в органоидах не является, поскольку масштаб ограничен расходами, связанными с органоидной культурой и ее трудоемким характером. В этом случае стоит упомянуть, что метод CRISPR-concatemer также совместим с клеточными линиями, такими как HEK293 и эмбриональные стволовые клетки мыши.
Независимо от сотовой системы, другой потенциальный недостаток этогоTrategy можно встретить при одновременном выбивании трех или четырех разных генов. Например, каждая gRNA будет иметь различную эффективность таргетинга и изменения попадания всех генов в одно и то же время могут быть относительно низкими; По этой причине целесообразно использовать систему конкатэмеров для направления более одной гРНК против одного и того же гена.
На протяжении многих лет были предложены альтернативные стратегии, аналогично основанные на перетасовке «Золотых ворот» для генерации мультиплексных векторов gRNA 7 , 8 . Однако в нашем методе можно сразу собрать несколько gRNAs в один ретровирусный вектор за один раунд клонирования, что делает его пригодным для генерации библиотек gRNA для нацеливания на паралоги.
Наш CRISPR-конкатэмер построен в ретровирусной векторной магистрали MSCV. Таким образом, gRNA-конкатемпер-содержащий ретровирус может быть использован для генерации стабильных клеточных линий, которые перегружаютRess gRNAs. В сочетании с Cas9-индуцируемой системой можно использовать индуцируемые паралогические нокауты с использованием нашей системы.
Вкратце, здесь мы опишем, как клонировать до четырех разных gRNAs в один и тот же вектор за один шаг и как применять эту стратегию к органоидной культуре с высокой эффективностью трансфекции. Кроме того, мы предлагаем полезные предложения, чтобы максимизировать шансы на успех на протяжении всей процедуры.
Раскрытие информации
Авторам нечего раскрывать. Заявители не объявили конфликта интересов.
Благодарности
Мы благодарим Кристофера Хиндли за критическое чтение рукописи. AM поддерживается Wntsapp (Marie Curie ITN), AA-R. Поддерживается Советом медицинских исследований (MRC) и BK.K. И RM поддерживаются стипендией сэра Генри Дейла из Wellcome Trust и Королевского общества [101241 / Z / 13 / Z] и получают поддержку через основной грант от Wellcome Trust и MRC до Wellcome Trust - MRC Cambridge Stem Cell Institute ,
Материалы
| Name | Company | Catalog Number | Comments |
| Optimized CRISPR Design Tool | Feng Zhang group | CRISPR gRNA design tool; http://crispr.mit.edu/ | |
| Webcutter 2.0 | restriction mapping tool; http://rna.lundberg.gu.se/cutter2/ | ||
| T4 PNK (Polynucleotide Kinase) | New England Biolabs | M0201L | |
| T4 DNA ligase buffer | New England Biolabs | M0202S | |
| T7 DNA Ligase | New England Biolabs | M0318L | |
| DTT (dithiothreitol) | Promega | P1171 | |
| ATP (adenosine triphosphate) | New England Biolabs | P0756S | |
| FastDigest BbsI (BpiI) | Thermo Fisher | FD1014 | |
| Tango buffer (BSA-containing restriction enzyme buffer) | Thermo Fisher | BY5 | |
| BglII | New England Biolabs | R0144 | |
| EcoRI | New England Biolabs | R0101 | |
| Plasmid-safe exonuclease | Cambio | E3101K | |
| Thermal cycler | Applied biosystems | 4359659 | |
| 10G competent E. coli bacteria | Cambridge Bioscience | 60108-1 | |
| Plasmid mini kit | Qiagen | 12125 | |
| Table top microcentrifuge | Eppendorf | UY-02580-01 | |
| Inoculating loops | Microspec | PLS5 | |
| Bacteria incubator | Sanyo | MIR-262 | |
| Luria-Bertani broth (LB) | Sigma-Aldrich | L3522 | |
| Agarose | Sigma-Aldrich | A4718 | |
| Agarose gel electrophoresis apparatus | Bioneer | A-7020 | |
| Advanced DMEM/F12(cell culture medium) | Invitrogen | 12634-034 | |
| Glutamax (L-Glutamine) 100x | Invitrogen | 35050-068 | |
| HEPES 1 M (buffering agent) | Invitrogen | 15630-056 | |
| Penicillin-streptomycin 100x | Invitrogen | 15140-122 | |
| B27 supplement (Neuronal cell serum-free supplement) 50x | Invitrogen | 17504-044 | |
| N2 supplement (Neuronal cell serum-free supplement) 100x | Invitrogen | 17502-048 | |
| n-Acetylcysteine 500 mM | Sigma-Aldrich | A9165-5G | |
| Mouse EGF 500 µg/mL | Invitrogen Biosource | PMG8043 | |
| Mouse Noggin 100 µg/mL | Peprotech | 250-38 | |
| Nicotinamide 1 M | Sigma | N0636 | |
| R-Spondin conditioned medium | n.a. | n.a. | Produced in house from HEK293 cells, for details see Sato and Clevers 2013 |
| Wnt conditioned medium | n.a. | n.a. | Produced in house from HEK293 cells, for details see Sato and Clevers 2013 |
| Y-27632 10 µM | Sigma-Aldrich | Y0503-1MG | |
| Standard BD Matrigel matrix | BD Biosciences | 356231 | |
| 48-well Plate | Greiner Bio One | 677980 | |
| CHIR99021 | Sigma-Aldrich | A3734-1MG | |
| IWP-2 | Cell Guidance Systems | SM39-10 | |
| TrypLE (recombinant protease) | Invitrogen | 12605-010 | |
| Opti-MEM (reduced serum medium ) | Life technologies | 51985-034 | |
| Electroporation Cuvettes 2mm gap | NepaGene | EC-002S | |
| Low binding 15 mL tubes | Sigma-Aldrich | CLS430791 | |
| Bürker’s chamber | Sigma-Aldrich | BR719520-1EA | |
| NEPA21 Super Electroporator | NepaGene | contact supplier | |
| Protein LoBind tubes low binding | Thermo Fisher | 10708704 | |
| BTXpress electroporation buffer | Harvard Apparatus | 45-0805 | |
| DMSO (Dimethyl sulfoxide) | AppliChem | A3672 |
Ссылки
- Mali, P., et al. RNA-Guided Human Genome Engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Koike-Yusa, H., Li, Y., Tan, E. -. P., Velasco-Herrera, M. D. C., Yusa, K. Genome-wide recessive genetic screening in mammalian cells with a lentiviral CRISPR-guide RNA library. Nat Biotech. 32 (3), 267-273 (2014).
- Bassett, A. R., Kong, L., Liu, J. L. A Genome-Wide CRISPR Library for High-Throughput Genetic Screening in Drosophila Cells. J Genet Genomics. 42 (6), 301-309 (2015).
- Diss, G., Ascencio, D., DeLuna, A., Landry, C. R. Molecular mechanisms of paralogous compensation and the robustness of cellular networks. J Exp Zool B Mol Dev Evol. 322 (7), 488-499 (2014).
- Andersson-Rolf, A., Merenda, A., Mustata, R. C., Li, T., Dietmann, S., Koo, B. -. K. Simultaneous paralogue knockout using a CRISPR-concatemer in mouse small intestinal organoids. Dev Biol. 420 (2), 1-7 (2016).
- Ran, F. A., Hsu, P. P. D., Wright, J., Agarwala, V., Scott, D., Zhang, F. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Engler, C., Gruetzner, R., Kandzia, R., Marillonnet, S. Golden gate shuffling: A one-pot DNA shuffling method based on type IIs restriction enzymes. PLoS ONE. 4 (5), (2009).
- Sakuma, T., Nishikawa, A., Kume, S., Chayama, K., Yamamoto, T. Multiplex genome engineering in human cells using all-in-one CRISPR/Cas9 vector system. Sci Rep. 4 (5), 5400 (2014).
- Kabadi, A. M., Ousterout, D. G., Hilton, I. B., Gersbach, C. A. Multiplex CRISPR/Cas9-based genome engineering from a single lentiviral vector. Nucleic Acids Res. 42 (19), 1-11 (2014).
- Yin, L., et al. Multiplex Conditional Mutagenesis Using Transgenic Expression of Cas9 and sgRNAs. Genetics. 200 (2), 431-441 (2015).
- Cress, B. F., Toparlak, O. D., et al. CRISPathBrick: Modular Combinatorial Assembly of Type II-A CRISPR Arrays for dCas9-Mediated Multiplex Transcriptional Repression in E. coli. ACS Synth Biol. 4 (9), 987-1000 (2015).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253 (2007).
- Zimmermann, J., Voss, H., Schwager, C., Stegemann, J., Ansorge, W. Automated Sanger dideoxy sequencing reaction protocol. FEBS Letters. 233 (2), 432-436 (1988).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nat. Protoc. 10 (10), 1474-1485 (2015).
- Andersson-Rolf, A., Fink, J., Mustata, R. C., Koo, B. -. K. A video protocol of retroviral infection in primary intestinal organoid culture. J Vis Exp. (90), e51765 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены