Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Одновременное исследование вербовки Моноцит субпопуляций под поток в пробирке
В этой статье
Резюме
Здесь мы представляем Интегрированный протокол, который измеряет Моноцит субпопуляция людьми под потока в пробирке путем использования конкретных поверхностных маркеров и конфокальный флуоресцентной микроскопии. Этот протокол может использоваться для изучения последовательного набора мер, а также относительно профиль другие подтипы лейкоцитов, используя другие конкретные поверхностных маркеров.
Аннотация
Набор моноцитов в крови для целевых периферических тканях имеет решающее значение для воспалительного процесса во время повреждения тканей, развитие опухоли и аутоиммунных заболеваний. Этому способствует через процесс захвата от свободного потока на поверхность Люминал активированного эндотелиальных клеток, следуют их адгезии и трансэндотелиальной миграции (переселение) в базовом пораженной ткани. Однако механизмы, которые поддерживают преференциальных и контекстно зависимые вербовки Моноцит субпопуляций понимаются еще не полностью. Таким образом мы разработали метод, который позволяет набора различных Моноцит субпопуляций одновременно визуализировать и измеряется в поток. Этот метод, основанный на покадровой конфокальная томография, позволяет недвусмысленное различие между приверженцами и переселенных моноцитов. Здесь мы описываем, как этот метод может использоваться одновременно изучить набор Каскад pro ангиогенных и не ангиогенных моноцитов в пробирке. Кроме того этот метод может быть продлен изучить различные этапы найма до трех Моноцит населения.
Введение
Моноциты являются фагоцитирующих компонентом врожденного иммунитета, которая необходима для борьбы с патогенами, очистка поврежденных тканей, ангиогенез и патофизиологии многих заболеваний, включая рак1,2,3 . Моноциты являются клетки костного мозга, полученных состоит из гетерогенных субпопуляций, которые циркулируют в крови, но могут быть набраны на месте воспаления в периферических тканях через конкретные молекулярные механизмы. Набор каскадов моноцитов, а лейкоцитов в целом подразумевает различные шаги, включая захват, прокатки, ползать, арест, трансэндотелиальной миграции (переселение) и миграции через стенку сосуда (базальной мембраны и росписи 4клетки). Эти шаги включают главным образом воспаления индуцированной молекул на поверхности эндотелиальных Люминал селектинов, гликопротеин лигандов, chemokines, молекулы адгезии межклеточных и соединительной и их рецепторов на лейкоциты например селектина лигандами и интегринов. Торговли людьми пути через либо развязок эндотелиальных клеток (параклеточный) или через эндотелиальные клетки тела (transcellular) может использоваться лейкоциты пересечь эндотелиальный барьер5. Хотя исторически были задокументированы моноцитов к высыпками через маршрут transcellular, потенциальные расхождения в их миграционных пути были предложены моноциты больше не считаются популяции однородных клеток. В настоящее время становится ясно, что разнообразие Моноцит могут быть определены каждым из их различий и общности, в отношении их отличительные кровоподтек каскады3,6. Таким образом чтобы однозначно различать Моноцит субпопуляций, крайне важно для визуализации и фенотип поведение каждого из этих различных субпопуляций в ходе набора процесса.
Моноциты от человека, свинки, крысы и мыши были подразделены фенотипического субпопуляции с некоторыми объясняется социальными функциями и конкретных миграционных поведения7,8,9. Например в организме человека, моноциты можно подразделить три подгруппы, основанный на их поверхности выражение CD14, coreceptor для бактериальных липополисахарида и CD16, Fc-гамма-рецептор III. Человека Моноцит субпопуляций включают в себя классические CD14 окрашенных CD16 ++-, промежуточные CD14 окрашенных CD16 +++ и неклассические CD14тускломCD16+ клетки6,9. Классическая CD14 окрашенных CD16 ++– моноцитов были показаны в основном воспалительных тогда как бассейн CD16+ моноцитов коллективно были найдены представить TIE2 выражения и proangiogenic функции10. Последовательно, стимуляции эндотелиальных клеток с воспалительных цитокинов, таких как некроза опухолей человека фактор (ФНО) α или интерлейкина (IL-1) бета (обычные воспаление) достаточно, чтобы вызвать полный набор классических CD14 окрашенных CD16 ++ – моноцитов. Тем не менее, одновременных действий Сосудистый эндотелиальный фактор роста (VEGF) и TNFα (ангиогенных факторов driven воспаление) требуются спровоцировать трансмиграции CD16+ proangiogenic бассейн моноциты3. Исторически традиционная система Transwell при статических условиях, Камера потока параллельной пластине и µ слайд потока камеры были использованы для количественного анализа набора одного лейкоцита населения на время в пробирке11 ,12,13. Хотя эти протоколы были подтверждены, более надежный метод, который позволяет одновременный анализ нескольких Моноцит субпопуляций будет считаться более глубокий. Такие методологии должны учитывать различные частоты каждого соответствующего населения и несколько взаимодействий и также предусматривают набор каскадов, которые определяют каждый Моноцит механистического понимания сходства и особенностей подмножество.
Здесь мы представляем метод, основанный на промежуток времени изображений набора Моноцит под поток, который позволяет мигрирующих каскады Моноцит различных субпопуляций одновременно быть изучены с помощью конфокальной микроскопии. Этот метод объединяет некоторых критических функций, которые имитируют эндотелиальных клеток воспаления, а также гемодинамики циркулирующих моноцитов в пост капиллярного венулы, основное место лейкоцита вербовки в естественных условиях. Предложенный метод использует эндотелиальных клеток человека пупочную вену (HUVEC), которые генерируются с помощью устоявшихся Протокол изоляции от человека пуповины. Этот клинический ресурс имеет преимущество легко доступны как побочный продукт биологического, также одновременно обеспечивая разумной доходности эндотелиальных клеток, которые могут быть изолированы от пупочную вену. Мы также использовали флуоресцентных красителей и иммунофлюоресценции для различения различных клеточных компонентов и confocal микроскопии однозначно определить Моноцит позиционирования (люминал против abluminal) с течением времени. Протокол, представленные здесь был разработан одновременно измерить уровни трансмиграции Моноцит субпопуляций. Кроме того следует отметить, что эта методология может быть расширен для изучения других субпопуляций лейкоцитов и процессы набора персонала путем использования различных биомаркеров и маркировки.
протокол
С осознанного согласия добровольцев доноров и в соответствии со швейцарской комитетов по этике клинических исследований были использованы материалы человека.
1. изоляция и замораживание человека пупочной вены эндотелиальных клеток (HUVEC)
- Добавьте 5 мл раствора покрытие в колбе T75 (0,1 мг/мл коллаген G и 0,2% желатина в солевой PBS фосфатного буфера при рН 7,4) для 30 минут при 37 ° C до начала HUVEC изоляции.
- Очистить шнур с PBS, протрите его стерильные компрессы и поместите его в стерильных 20 см Петри. Отрежьте концы шнура с стерильными ножницами.
- Определите один большой вен и два малых артерий. Аккуратно вставьте канюлю с трехходовой кран, прикрепленных к нему в Вену конечностях на концах кабеля.
- Затяните шнур и канюли связи прочно с длиной провода.
- Perfuse шнур дважды с 20 мл RPMI носитель, содержащий 100 ед/мл пенициллин, стрептомицин 100 ед/мл и 250 нг/мл амфотерицин B мыть шнур вен. Этот процесс делает внешний вид шнур белее и яснее. Пустые Вены перед добавлением коллагеназы, собирая RPMI с помощью шприца на одном конце.
- Perfuse вен с 12 мл 1 мг/мл коллагеназы типа I (0,22 мкм фильтрация).
- Закрыть кран на шнур заканчивается и инкубировать шнур при 37 ° C 12 мин.
- Нежно массируйте за шнур для отсоединения эндотелиальных клеток от просвета вены.
- Возьмите 30 мл RPMI, содержащие 10% плода телячьей сыворотки с 50 мл шприц и подключить его к одному концу пуповины.
- Подключите пустой 50 мл шприц в другой конец пуповины
- Откройте кран и perfuse вен с одного конца, хотя взаимно сбор с другого конца.
Примечание: Собранные суспензии содержит эндотелиальных клеток. - Центрифуга этот суспензию клеток на 200 x g за 5 мин.
- Отменить супернатант и Ресуспензируйте клетки лепешка с 10 мл полного среднего M199 (M199 добавки, содержащие 20% FCS, рост эндотелиальных клеток 15 мкг/мл, 100 мкг/мл гепарина натрия, 0,5 мкм гидрокортизон, 10 мкг/мл L-Аскорбиновая кислота, 100 ед/мл пенициллин, 100 ед/мл Стрептомицина и 250 нг/мл амфотерицин B).
- Удалить раствор для нанесения покрытия из T75 колбу и один раз промыть PBS.
- Семя клетки собраны из шага 1,13 в колбу T75 и поместите его в инкубаторе при 37 ° C с 5% CO2.
- Следующий день, промойте колба 3 раза с полного среднего M199 удалить остаточные красных кровяных клеток, а затем изменить носитель каждые 2 дня до слияния.
- При впадении в 80 – 90% промойте HUVEC монослоя раз с 5 мл PBS и отсоединение клетки с 5 мл 0,05% трипсина в 1 мм ЭДТА при 37 ° C за 5 минут добавить 4 мл M199 и 1 мл FCS прекратить действие трипсина. Промойте Фляга для отсоединения всех HUVEC.
- Собирайте Алиготе 50 мкл использоваться для окрашивания VE-Кадгерины, PECAM-1 и gp38, и анализировать подачей cytometry проверить чистоту HUVEC.
- Сбор на оставшуюся часть HUVEC от шага 1.18 в 15 мл трубки и центрифуги на 200 x g 5 мин при комнатной температуре.
- Отменить супернатант из шага 1.19, Ресуспензируйте Пелле клеток в замораживания раствора (FCS, содержащие 10% ДМСО) на плотности тарелок 5 x 105 клеток/мл в cryotubes и заморозить при температуре-80 ° C или в жидком азоте до использования.
-
Чтобы проверить HUVEC чистоты:
- Добавьте 1 мкл антител против человека VE-Кадгерины FITC, 1 мкл антител против человека PECAM1-PE и 1 мкл антител против человека Podoplanin-APC Алиготе 50 мкл HUVEC, собранных на этапе 1.18.
- Инкубации при комнатной температуре в течение 10 мин.
- Добавить 100 мкл PBS и центрифуги 400 x g 30 s.
- Отменить супернатант и Ресуспензируйте в 100 мкл PBS. Данные теперь могут быть приобретены потока цитометрии методами.
Примечание: HUVEC позитивные для VE-Кадгерины и PECAM-1 и негативные для Podoplanin.
2. HUVEC размораживания
Примечание: Использование HUVEC на низкий проход для экспериментов (максимум 5 ходов).
- Герб T75 флакон с 1 мл раствора покрытие при 37 ° C за 30 мин.
- Быстро разморозить HUVEC при 37 ° C на 2 мин и Ресуспензируйте клетки в 10 мл полной M199.
- Центрифуга клетки на 200 x g при комнатной температуре в течение 5 мин и удалить супернатант.
- Ресуспензируйте Пелле клеток в 10 мл полной M199.
- Передача суспензию клеток в предварительно покрытых колбу. Место колбу в инкубаторе при 37 ° C с 5% CO2. Измените ячейки питательной среды каждые 2 дня.
3. HUVEC культура в камере 0.4 мкг слайд
- Пять дней до начала эксперимента потока, предварительно покройте палат 0.4 мкг слайд с 30 мкл PBS, содержащие 0,1 мг/мл коллаген G, 0,2% желатина при 37 ° C за 30 мин.
- Вымойте камер с 100 мкл PBS.
- Отсоедините клетки от 80 – 90% вырожденная HUVEC T75 колбы.
- Промойте HUVEC 5 мл PBS и отсоединить их с 5 мл 0,05% трипсина при 37 ° C за 5 мин.
- Потолочные и собирать суспензию клеток в полной M199 и подсчитать количество ячеек по наиболее удобным способом. Центрифуга на 200 x g 5 мин при комнатной температуре.
- Ресуспензируйте Пелле клеток на 106 клеток/мл и распространять 30 мкл (30000 клеток) на камеру.
- Инкубируйте клетки в инкубаторе при 37 ° C с 5% CO2 на 1 ч.
- 150 мкл полного M199 для каждой камеры и культура клетки на 5 дней в инкубаторе при 37 ° C и 5% CO2. Измените носитель каждые 2 дня.
4. HUVEC пятная для Assay Моноцит набора под поток
- Подготовить маркировки среднего M199 и 1 мкм CMFDA (5-chloromethylfluorescein диацетата) и тепло при 37 ° C за 5 мин до клеток маркировки.
- Вымойте HUVEC дважды с M199 среднего нагревается при 37 ° C.
- Замените 30 мкл утепленные маркировки среды, содержащие 1 мкм CMFDA среды и поместите в инкубатор при 37 ° C и 5% CO2 за 10 мин.
- Мыть раз с полным M199 и инкубировать клетки с полным M199 в инкубаторе при 37 ° C и 5% CO2 на 30 мин.
Примечание: Важно удалить все следы сыворотки перед добавлением раствора маркировки, в противном случае она может изменить HUVEC пятнать. - Заменить в среду с полным M199 содержащие либо человека TNFα (500 ед/мл) или смесь человека TNFα (500 ед/мл) с человеческой VEGFA (1 мкг/мл) за 6 ч в инкубаторе при 37 ° C и 5% CO2.
5. изоляция человека Пан моноцитов и пятнать субпопуляций
- Используйте Баффи слой концентрированного человеческой крови, или 20 мл свежевыделенных человеческой крови, собранные в день эксперимента в ЭДТА vacutainer трубы.
- Разбавить кровь в PBS-1 мм ЭДТА (1:1) и аккуратно Пипетка 20 мл разбавленной крови поверх 20 мл градиента плотности средств массовой информации. Центрифуга на 400 x г за 30 мин при комнатной температуре с медленным ускорение и без тормозов.
- Собирать мононуклеарных клеток периферической крови (КСДОР)-уровень тромбоцитов (между СМИ градиента плотности и плазмы слои) в новый Тюбик 50 мл, содержащие 40 мл PBS - 1 мм ЭДТА. Топ 50 мл с ЭДТА PBS - 1 мм.
- Центрифуга на 200 x g при комнатной температуре на 5 мин отбросить супернатант.
- Ресуспензируйте клетки лепешка с 10 мл окрашивание буфера (PBS - 1 мм ЭДТА содержащих 0,5% альбумина bovine сыворотки BSA).
- Центрифуга на 200 x g при комнатной температуре на 5 мин отбросить супернатант.
- Повторите шаги 5.5 и 5.6.
- Ресуспензируйте клетки лепешка с 10 мл окрашивания буфера. Возьмите Алиготе 10 мкл для подсчета клеток.
- Проверьте КСДОР населения и подсчитать ячейки быстро с проточный цитометр.
Примечание: Характеристика лимфоцитов и моноцитов населения может наблюдаться (рис. 1A). От 50 мл свежей крови человека ожидать о 50-100 х 106 КСДОР. -
Для найма CD14 + против CD14-КСДОР под поток:
- Помыть лепешка три раза с буфера потока (M199 содержащих 0,5% BSA) и Ресуспензируйте мононуклеарных клеток в буфере потока на 6 x 106 клеток / мл.
- Сделайте аликвоты 200 мкл калибровочных. Инкубируйте при 37 ° C до 20 мин до assay.
- Мкл 5 анти CD14-PE и Hoechst 33342 в конечной концентрации 2 мкм для каждого Алиготе. Смешать и инкубировать при 37 ° C за 10 мин.
- Центрифуга Алиготе на 400 x g 30 s.
- Отменить супернатант и Ресуспензируйте лепешка с 200 мкл буфера потока.
-
Для найма Моноцит субпопуляций в поток:
- Изолируйте моноциты с комплектом Пан Моноцит изоляции согласно инструкциям производителя.
Примечание: Следующий протокол изоляции предназначен для 50 x 106 клеток. Он может масштабироваться вверх или вниз, пока он находится в пределах рекомендациям изготовителя. - Центрифуга КСДОР подвеска на 200 x g при комнатной температуре в течение 5 мин.
- Отменить супернатант и Ресуспензируйте лепешка с 400 мкл окрашивания буфера.
- Добавьте 50 мкл Реагента Fc рецептор блокировки и 50 мкл антител Пан Моноцит коктейль.
- Инкубации при комнатной температуре в течение 10 мин.
- Окрашивание буфера и 100 мкл магнитной бусины конъюгированных антител анти биотина 400 мкл. Инкубации при комнатной температуре в течение 15 мин.
- Добавить 2 мл окрашивание буфера и использовать столбец MACS LS, в сочетании с магнитом.
- Разместите LS столбца на магните и добавьте 1 mL окрашивания буфера. Отказаться от потока через.
- Передайте КСДОР подвеска в столбце и собирать четкий поток хотя содержащие Пан моноцитов в новой трубки 15 мл.
- Добавьте окрашивание буфера к началу до 5 мл.
- Возьмите Алиготе и проверить качество изоляции Моноцит с проточный цитометр.
- Определите количество Моноцит Пан.
Примечание: Только Моноцит население может наблюдаться (рис. 1B). - Центрифуга оставшуюся часть моноциты из шага 5.11.11 при 200 x g за 5 мин.
- Выбросите супернатант.
- Ресуспензируйте Пелле клеток в 5 мл буфера потока (M199 содержащих 0,5% BSA).
- Повторите 5.11.13 для 5.11.14 дважды для устранения следов ЭДТА.
- Изолируйте моноциты с комплектом Пан Моноцит изоляции согласно инструкциям производителя.
- Сделать Моноцит приостановления потока буфера (M199 с 0,5% BSA) в 6 х 106 клеток/мл.
- Сделайте аликвоты 200 мкл моноцитов для каждого набора assay.
- Держите Алиготе при 37 ° C в инкубаторе до 20 мин перед инъекцией.
- Добавьте 5 мкл антител анти CD16-PE и Hoechst 33342 (окончательный 2 мкм) для каждого Алиготе.
- Смешать и инкубировать при 37 ° C за 10 мин.
- Центрифуга Алиготе на 400 x g 30 s.
- Отменить супернатант и Ресуспензируйте лепешка с 250 мкл буфера потока.
- Мкл 30 взвеси Моноцит в одной палате слайд, чтобы служить для настройки параметров получения конфокального микроскопа.
- Держите аликвоты Моноцит подвеска из шага 5.18 при 37 ° C.
Примечание: Эта подвеска готова быть введен в системе потока.
6. Подготовка оптимизированных системы
- Убедитесь, что ячейка инкубатора для изображений на 37 ° C.
Примечание: Схема потока системы показан на рисунке 2. - Соберите трубки часть I: вставьте люэровский коннектор папа один конец кусок силиконовые трубки (8 см длиной и 3 мм толщиной) и подключите другой конец к набору инъекции Luer в линии. Подключите второй Luer к кусок силиконовые трубки (40 см и 3 мм толщиной) на одном конце.
Примечание: При необходимости 3-ходовой кран, подключенных к шприц 5 мл может быть вставлен между инъекции Luer в линии и силиконовые трубки для возможного воздушного пузыря удаления. - Соберите трубки часть II: подключение 20 мл шприц один конец длиной силиконовые трубки (длиной 1 м и толщиной 3 мм). Вставьте люэровский коннектор папа в другой конец трубки.
- Подключите часть I и часть II труб, вставив разъем мужчины Luer для женского Luer замок автосцепки (рисунок 2A).
- Положите свободный конец трубки силиконовые в водохранилище, содержащий буфер потока (M199 + 0,5% BSA) нагревают при 37 ° C.
- Потяните поршень шприца 20 мл для заполнения трубки с потока буфера.
- Поместите шприц на насос и закрепите его.
- Установите насос в отказаться режим (в отличие от на настаиваться) и укажите скорость потока.
- Определите скорость потока согласно IBIDI слайд, используемый с помощью следующей формулы:
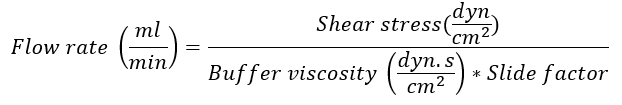
Примечание: Слайд фактор зависит от IBIDI слайд, используемый для эксперимента. Для µ слайд я0,4 люэровского, используемые в этом примере, слайд фактор – 131,6. Для конкретных слайд факторов смотрите веб-сайт компании14. Вязкость буфера потока является 0,0072 dyn.s/cm2. Касательное напряжение на пост капиллярного венулы составляет около 0,5 дин/см2. -
Подключите слайд (рис. 2B):
- Зажим силиконовые трубки вокруг женского Luer Lock муфта и отсоедините два самца Luer разъем от стяжку.
- Подключите их к водоемам слайд, содержащий стимулировали HUVEC и заполнить с среднего. Избегайте воздушных пузырей во время этого шага.
- Снимите зажимы и убедитесь, что подключение не протекает.
- Поместите слайд под микроскопом для покадровой воображения и запуска насоса.
7. промежуток времени визуализации Моноцит вербовки под потока конфокальная микроскопия
- Использовать цель 40 x (см. Таблицу материалы) для изображений.
- Активировать 405 нм (синий Моноцит ядер), 488 нм (зеленый эндотелиальных клеток) и 561 Нм (красный CD16 + подмножество) лазеры.
- Использование камеры, содержащий моноциты установить параметры приобретения.
Примечание: Чтобы обнаружить-переселено и переселенных моноцитов, обскуры и интенсивности лазера 405 нм устанавливаются высокие. Таким образом моноциты переселено слегка видны в плане базальной. Однако только переселенных моноциты представляют безупречный район вокруг ядра, соответствующее новое пространство под эндотелиальных клеток. - Место камеры, чтобы быть приобретены под микроскопом.
- Выберите 3 поля представлений в радиусе 1 см для многопозиционных конфокальная томография.
- Определение базальной и апикального стороны эндотелиальных клеток
- Установка z стека в диапазоне 10-12 мкм (шаг 0,5 мкм). Запуск промежуток времени приобретения каждые 1 мин.
- После 3 минут изображений придать 200 мкл суспензии Моноцит (6 x 106 клеток/мл) через порт впрыска Luer в линии.
Примечание: Быстро моноцитов появляются в апикальной фокальной плоскости, присоединиться и начать трансмиграции (транзит из апикального базальной план). - Изображение для по крайней мере 30 минут. После завершения, остановить изображений и остановить поток. Зажим трубы, чтобы отсоединить их от слайда.
- Исправьте слайд с параформальдегида 4% на 4 ° C на 10 мин.
- Вымойте слайд с PBS и сохранять слайд на 4 ° C для дальнейшего анализа, если это необходимо.
8. анализ данных с ImageJ
- Подсчитать количество всего адэрентных моноцитов в каждом поле. Определите количество клеток в мм2.
- Граф переселенных моноцитов, которые присутствуют в плане базальной под эндотелиальных клеток и выявленных наличием черной дыры (в зелёном канале) вокруг ядра.
- Разделите количество переселенных лейкоцитов на общее количество адэрентных лейкоцитов. Трансмиграции курс представлен в процентном отношении адэрентных моноцитов.
- Для иллюстрации верхушечный и базальной стороны могут отображаться одновременно чтобы проиллюстрировать событий, происходящих в каждой из этих эндотелиальной отсеков.
Результаты
Определение состояния активации HUVEC индуцированных TNFα
Био активности воспалительных цитокинов TNFα может зависимости пакета и пресыщения цикла замораживания оттаивания. Важно проверить состояние активации HUVEC TNFα лечения. Это может быт...
Обсуждение
Здесь мы приводим метод подробно исследование как Моноцит субпопуляций высыпками через воспаление эндотелия монослоя. Обсудили метод используется confocal микроскопии вместо фазово контрастной микроскопии, который также используется для изучения набора Моноцит под поток3
Раскрытие информации
Авторы имеют без финансовых интересов.
Благодарности
Мы благодарим д-р Пол Брэдфилд за рукопись чтения и обратными связями. A. S. получил финансовую поддержку от сэра Жюль Торн благотворительных заморских доверять обл.,
Материалы
| Name | Company | Catalog Number | Comments |
| Tissue Culture Flasks 75 cm2 | TPP | 90076 | Routine culture of isolated HUVEC |
| µ-Slide VI 0.4 | IBIDI | 80606 | |
| Centrifuge Tubes 15 mL | TPP | 191015 | |
| Centrifuge Tubes 50 mL | TPP | 191050 | |
| Collagen G | Biochrom | L 7213 | For coating of cell culture flasks |
| Gelatin | Sigma-Aldrich | 1393 | For coating of cell culture flasks |
| Dulbecco’s Phosphate Buffered Saline (without MgCl2 and CaCl2) | Sigma-Aldrich | D8537 | |
| Dulbecco’s Phosphate Buffered Saline (with MgCl2 and CaCl2) | Sigma-Aldrich | D8662 | |
| RPMI-1640 Medium | Sigma-Aldrich | R8758 | |
| 3-Way Stopcocks | BIO-RAD | 7328103 | |
| penicillin 10,000 μ/mL streptomycine 10,000 μg/mL fungizone 25 μ/mL | AMIMED | 4-02F00-H | |
| Collagenase type 1 | Worthington | LS004216 | |
| Medium 199 1x avec Earle's salts, L-Glutamine, 25 mM Hepes | GIBCO | 22340020 | |
| Bovine Albumin Fraction V | ThermoFisher | 15260037 | |
| Endothelial Cell Growth Supplement, 150 mg | Millipore | 02-102 | |
| Heparin Sodium | Sigma-Aldrich | H3149RT | |
| Hydrocortisone | Sigma-Aldrich | H6909 | |
| L-Ascorbic acid | Sigma-Aldrich | A 4544 | |
| EDTA disodium salt dihydrate C10H14N2Na2O8 · 2H2O | APPLICHEM | A2937.0500 | |
| CD144 (VE-Cadherin), human recombinant clone: REA199, FITC | Miltenyi Biotech | 130-100-713 | AB_2655150 |
| CD31-PE antibody, human recombinant clone: REA730, PE | Miltenyi Biotech | 130-110-807 | AB_2657280 |
| Anti-Podoplanin-APC, human recombinantclone: REA446, APC | Miltenyi Biotech | 130-107-016 | AB_2653263 |
| BD Accuri C6 Plus | BD Bioscience | ||
| µ-Slide I Luer | IBIDI | 80176 | |
| CMFDA (5-chloromethylfluorescein diacetate) | ThermoFisher | C2925 | |
| Recombinant human TNFα | Peprotech | 300-01A | |
| Recombinant human VEGFA | Peprotech | 100-20 | |
| NE-1000 Programmable Syringe Pump | KF Technology | NE-1000 | |
| Ficoll Paque Plus | GE Healthcare | 17-1440-02 | |
| Anti-human CD14-PE, human recombinant clone: REA599, PE | Miltenyi Biotech | 130-110-519 | AB_2655051 |
| Pan Monocyte Isolation Kit, human | Miltenyi Biotech | 130-096-537 | |
| Anti-human CD16-PE, human recombinant clone: REA423, PE | Miltenyi Biotech | 130-106-762 | AB_2655403 |
| LS columns | Miltenyi Biotech | 130-042-401 | |
| QuadroMACS Separator | Miltenyi Biotech | 130-090-976 | |
| Hoechst 33342, Trihydrochloride, Trihydrate | ThermoFisher | H1399 | |
| Silicone tubing | IBIDI | 10841 | |
| Elbow Luer Connector | IBIDI | 10802 | |
| Female Luer Lock Coupler | IBIDI | 10823 | |
| Luer Lock Connector Female | IBIDI | 10825 | |
| In-line Luer Injection Port | IBIDI | 10820 | |
| Ar1 confocal microscope | Nikon | ||
| 40x objective | Nikon | 40x 0.6 CFI ELWD S Plane Fluor WD:3.6-2.8mm correction 0-2mm | |
| ImageJ Software | NIH |
Ссылки
- Auffray, C., Sieweke, M. H., Geissmann, F. Blood Monocytes: Development, Heterogeneity, and Relationship with Dendritic Cells. Annual Review of Immunology. 27 (1), 669-692 (2009).
- De Palma, M., Venneri, M. A., Roca, C., Naldini, L. Targeting exogenous genes to tumor angiogenesis by transplantation of genetically modified hematopoietic stem cells. Nature Medicine. 9 (6), 789-795 (2003).
- Sidibe, A., et al. Angiogenic factor-driven inflammation promotes extravasation of human proangiogenic monocytes to tumours. Nature Communications. 9 (1), 355 (2018).
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nature Review Immunology. 7 (9), 678-689 (2007).
- Nourshargh, S., Alon, R. Leukocyte Migration into Inflamed Tissues. Immunity. 41 (5), 694-707 (2014).
- Cros, J., et al. Human CD14dim monocytes patrol and sense nucleic acids and viruses via TLR7 and TLR8 receptors. Immunity. 33 (3), 375-386 (2010).
- Geissmann, F., Jung, S., Littman, D. R. Blood monocytes consist of two principal subsets with distinct migratory properties. Immunity. 19 (1), 71-82 (2003).
- Chamorro, S., et al. In vitro differentiation of porcine blood CD163− and CD163+ monocytes into functional dendritic cells. Immunobiology. 209 (1-2), 57-65 (2004).
- Passlick, B., Flieger, D., Ziegler-Heitbrock, H. Identification and characterization of a novel monocyte subpopulation in human peripheral blood. Blood. 74 (7), (1989).
- Venneri, M. A., et al. Identification of proangiogenic TIE2-expressing monocytes (TEMs) in human peripheral blood and cancer. Blood. 109 (12), 5276-5285 (2007).
- Bradfield, P. F., et al. JAM-C regulates unidirectional monocyte transendothelial migration in inflammation. Blood. 110 (7), 2545-2555 (2007).
- Schenkel, A. R., Mamdouh, Z., Muller, W. A. Locomotion of monocytes on endothelium is a critical step during extravasation. Nature Immunology. 5 (4), 393-400 (2004).
- Luu, N. T., Rainger, G. E., Nash, G. B. Kinetics of the different steps during neutrophil migration through cultured endothelial monolayers treated with tumour necrosis factor-alpha. Journal Vascular Research. 36 (6), 477-485 (1999).
- ibidi GmbH. . Shear Stress and Shear Rates for ibidi µ-Slides - Based on Numerical Calculations. , (2014).
- Yang, L., Froio, R. M., Sciuto, T. E., Dvorak, A. M., Alon, R., Luscinskas, F. W. ICAM-1 regulates neutrophil adhesion and transcellular migration of TNF-alpha-activated vascular endothelium under flow. Blood. 106 (2), 584-592 (2005).
- Yang, C. -. R., Hsieh, S. -. L., Ho, F. -. M., Lin, W. -. W. Decoy receptor 3 increases monocyte adhesion to endothelial cells via NF-kappa B-dependent up-regulation of intercellular adhesion molecule-1, VCAM-1, and IL-8 expression. Journal of Immunology. 174 (3), 1647-1656 (2005).
- Wong, D., Dorovini-Zis, K. Expression of vascular cell adhesion molecule-1 (VCAM-1) by human brain microvessel endothelial cells in primary culture. Microvascular Research. 49 (3), 325-339 (1995).
- Bradfield, P. F., Nourshargh, S., Aurrand-Lions, M., Imhof, B. A. JAM family and related proteins in leukocyte migration (Vestweber series). Arteriosclerosis Thrombosis and Vascular Biology. 27 (10), 2104-2112 (2007).
- Bradfield, P. F., et al. Divergent JAM-C Expression Accelerates Monocyte-Derived Cell Exit from Atherosclerotic Plaques. PLoS One. 11 (7), e0159679 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены