Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Масштабируемое выделение и очистка внеклеточных везикул от кишечной палочки и других бактерий
В этой статье
Резюме
Бактерии выделяют внеклеточные везикулы (EV) нанометрового размера, несущие биологические молекулы. Исследования ЭЛЕКТРОМОБИЛей сосредоточены на понимании их биогенеза, роли во взаимодействиях микроб-микроб и микроб-хозяин и болезни, а также их потенциальных терапевтических применений. Представлен рабочий процесс для масштабируемой изоляции электромобилей от различных бактерий для облегчения стандартизации исследований электромобилей.
Аннотация
Различные виды бактерий выделяют ~ 20-300 нм внеклеточные везикулы (EV), состоящие из липидов, белков, нуклеиновых кислот, гликанов и других молекул, полученных из родительских клеток. EV функционируют как внутри- и межвидовые коммуникационные векторы, а также способствуют взаимодействию между бактериями и организмами-хозяевами в контексте инфекции и колонизации. Учитывая множество функций, приписываемых ev в здоровье и болезнях, растет интерес к выделению EV для исследований in vitro и in vivo . Было выдвинуто предположение, что разделение электромобилей на основе физических свойств, а именно размера, облегчит выделение везикул из различных бактериальных культур.
Рабочий процесс изоляции состоит из центрифугирования, фильтрации, ультрафильтрации и хроматографии с исключением размера (SEC) для выделения EV из бактериальных культур. Для повышения масштабируемости была включена стадия тангенциальной фильтрации потока (TFF), управляемая насосом, что позволило отделить материал от литров стартовой клеточной культуры. Escherichia coli использовалась в качестве модельной системы, экспрессирующей EV-ассоциированную нанолюциферазу и не-EV-ассоциированную mCherry в качестве репортерных белков. Нанолюцифераза была нацелена на EV путем слияния ее N-конца с цитолизином A. Ранние фракции хроматографии, содержащие 20-100 нм EV с ассоциированным цитолизином А - наноЛюк, отличались от более поздних фракций, содержащих свободные белки. Наличие EV-ассоциированной нанолюциферазы было подтверждено иммунозолотой маркировкой и просвечивающей электронной микроскопией. Этот рабочий процесс изоляции ЭЛЕКТРОМОБИЛей применим к другим человеческим кишечно-ассоциированным грамотрицательным и грамположительным видам бактерий. В заключение, сочетание центрифугирования, фильтрации, ультрафильтрации / TFF и SEC обеспечивает масштабируемую изоляцию электромобилей от различных видов бактерий. Использование стандартизированного рабочего процесса изоляции облегчит сравнительные исследования микробных ЭЛЕКТРОМОБИЛей между видами.
Введение
Внеклеточные везикулы (EV) представляют собой нанометровые липосомоподобные структуры, состоящие из липидов, белков, гликанов и нуклеиновых кислот, секретируемых как прокариотическими, так и эукариотическими клетками1. Начиная с ранних исследований, визуализирующих высвобождение EV из грамотрицательных бактерий2, количество биологических функций, приписываемых бактериальным EV (20-300 нм в диаметре), постоянно растет в последние десятилетия. Их функции включают перенос устойчивости к антибиотикам3, образование биопленки4, ощущение кворума5 и доставку токсинов6. Растет также интерес к использованию бактериальных EV в качестве терапевтических средств, особенно в вакцинологии7 и терапии рака8.
Несмотря на растущий интерес к исследованиям электромобилей, все еще существуют технические проблемы, связанные с методами изоляции. В частности, существует потребность в методах изоляции, которые являются воспроизводимыми, масштабируемыми и совместимыми с различными организмами, производящими электромобили. Чтобы создать единый набор принципов для планирования и отчетности по изоляции ЭЛЕКТРОМОБИЛей и методам исследования, Международное общество внеклеточных везикул публикует и обновляет позиционный документMISEV 9. Кроме того, консорциум EV-TRACK предоставляет открытую платформу для представления подробных методологий изоляции электромобилей, используемых в опубликованных рукописях для повышения прозрачности10.
В этом протоколе предыдущие методологии, используемые для выделения EV из культуры клеток млекопитающих, были адаптированы11,12, чтобы обеспечить выделение EV из бактериальной клеточной культуры. Мы стремились использовать методы, которые позволяют изолировать EV от различных микробов, которые могут быть масштабируемыми, и сбалансировать чистоту и выход EV (как обсуждалось в позиционном документеMISEV 9). После удаления бактериальных клеток и мусора центрифугированием и фильтрацией питательную среду концентрируют либо ультрафильтрацией центробежного устройства (для объема до ~100 мл), либо насосным ТФФ (для больших объемов). Затем электромобили изолируются SEC с помощью столбцов, оптимизированных для очистки небольших электромобилей.
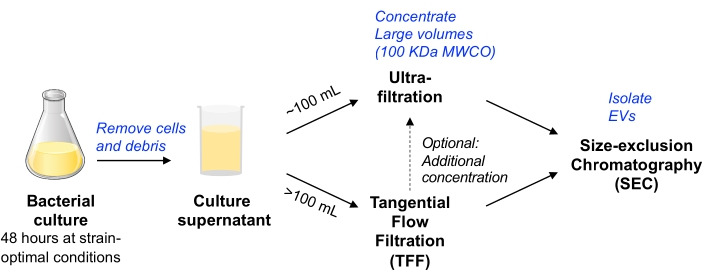
Рисунок 1: Обзор схемы рабочего процесса изоляции бактериальных электромобилей. Сокращения: EV = внеклеточный везикул; TFF = тангенциальная фильтрация потока; SEC = размерная эксклюзионная хроматография; MWCO = отсечка молекулярной массы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Мышино-комменсальный штамм Escherichia coli (т.е. E. coli MP113) использовали в качестве модельного организма и модифицировали для экспрессии EV-ассоциированной нанолюциферазы путем слияния с цитолизином А, как сообщалось ранее14. Методы, используемые здесь, могут обрабатывать, по крайней мере, до нескольких литров бактериальных культур и эффективно отделять EV-ассоциированные от не-EV-ассоциированных белков. Наконец, этот метод также может быть использован для других грамположительных и грамотрицательных видов бактерий. Все соответствующие данные представленных экспериментов были представлены в базу знаний EV-TRACK (EV-TRACK ID: EV210211)10.
Access restricted. Please log in or start a trial to view this content.
протокол
ПРИМЕЧАНИЕ: Обеспечить, чтобы вся работа, связанная с бактериями и рекомбинантной ДНК, соответствовала передовой практике сдерживания биобезопасности, соответствующей уровню опасности биобезопасности каждого штамма. Работа должна проводиться в соответствии с местными, национальными и международными правилами биобезопасности.
1. Бактериальные штаммы и условия культивирования
ПРИМЕЧАНИЕ: Бактериальными штаммами, используемыми в этом исследовании, были Escherichia coli MP1 13, Akkermansia mucinophila, Bacteroides thetaiotaomicron, Bifidobacterium breve и Bifidobacterium dentium.
- Для кишечной палочки используйте стерильную петлю для инокуляции отдельных колоний в 250-1000 мл бульона Лурия-Бертани (LB) и аэробно инкубируют в встряхивающем инкубаторе при 300 об/мин и 37 °C в течение 48 ч перед обработкой культуры. Для рекомбинантного штамма E. coli MP1, содержащего p114-mCherry-Clyluc (дополнительный метод и дополнительный рисунок S1), добавляют хлорамфеникол к агару LB и бульону в конечной концентрации 17 мкг/мл.
- Для A. mucinophila, B. thetaiotaomicron, B. breve и B. dentium, полоса на агаровых пластинах инфузии сердца (BHI) и анаэробная инкубация внутри виниловой анаэробной камеры. Инокулируют одиночные колонии в 100 мл предварительно восстановленного бульона BHI и инкубируют в течение 48 ч анаэробно.
2. Изоляция электромобилей
- Осветление бактериальной питательной среды центрифугированием и фильтрацией
- Перенесите бактериальные клеточные культуры, инокулированные на стадии 1, для очистки бутылок полипропиленовой центрифуги объемом 250 мл или 500 мл путем заливки. Центрифугируйте бутылки в роторе с фиксированным углом наклона большой емкости при 4 °C и 5000 × g в течение 15 мин. Переложите супернатант в чистые бутылки центрифуги путем тщательного разлива и снова центрифугируйте при 10 000 × г в течение 15 мин.
ПРИМЕЧАНИЕ: Повторное использование бутылок после соответствующей биобезопасности очистки и дезактивации.- Если после второй центрифугации присутствуют большие гранулы бактериальных клеток, повторите центрифугирование в чистой бутылке для дальнейшего удаления клеток.
- Перенесите супернатант на фильтрующее устройство с вакуумным приводом полиэфирсульфона 0,22 мкм соответствующего размера путем заливки. Фильтр путем подключения фильтрующего устройства к вакуумной стенке. Если скорость фильтрации значительно падает, просто переместите любой нефильтрованный материал на новое устройство. Храните отфильтрованную среду при температуре 4 °C в течение ночи и при желании продолжайте протокол на следующий день.
ПРИМЕЧАНИЕ: Вышеуказанные центрифугирования обычно позволяют обрабатывать ~2x указанного объема клеточной культуры через каждое устройство. Например, одно фильтрующее устройство объемом 500 мл может фильтровать ~1000 мл предварительно центрифугированной культуры. Эти устройства обычно не используются повторно. Использование шприцевых фильтров на этом этапе не рекомендуется без оптимизации, так как при тестируемых моделях были отмечены значительные потери. Это потенциальная остановка. - Проверьте полное удаление жизнеспособных клеток в этот момент, распределив аликвоту фильтрованного супернатанта на подходящие агаровые пластины и обеспечьте отсутствие каких-либо колоний после инкубации в оптимальных условиях для бактериального штамма. При обнаружении бактерий дополнительно оптимизируйте описанную выше процедуру, выполнив дополнительные центрифугирования и/или фильтрации.
- Перенесите бактериальные клеточные культуры, инокулированные на стадии 1, для очистки бутылок полипропиленовой центрифуги объемом 250 мл или 500 мл путем заливки. Центрифугируйте бутылки в роторе с фиксированным углом наклона большой емкости при 4 °C и 5000 × g в течение 15 мин. Переложите супернатант в чистые бутылки центрифуги путем тщательного разлива и снова центрифугируйте при 10 000 × г в течение 15 мин.
- Концентрация фильтруемой среды
- Если работа с объемами значительно >100 мл, переходите к шагу 2.2.2. При работе с объемами ~100 мл загрузить 90 мл фильтрованной питательной среды в резервуар соответствующей емкости 100 кДа центробежного ультрафильтрационного устройства молекулярно-массовой отсечки (МВКО) с использованием серологических пипеток. Всегда балансируйте с помощью соответствующего ультрафильтрационного устройства и центрифуги в качающемся роторе ковша при 4 °C и 2000 × г с интервалом 15-30 минут, пока объем среды в верхнем резервуаре не будет сконцентрирован до <0,5 мл.
- Залейте резервуар любой оставшейся фильтрованной питательной средой. При «пополнении» удалите сквозной поток в нижней части устройства и перебалансируйте все устройства.
ПРИМЕЧАНИЕ: Было отмечено, что максимальный объем фильтрованной питательной среды, который может быть сконцентрирован с помощью этих устройств, <2 раза превышает рекомендуемый объем. - Если вязкость концентрированной среды в резервуаре заметно увеличена (темный, вязкий материал), разбавляют фосфат-буферным физиологическим раствором (PBS) и повторно концентрируют центрифугированием для разбавления любых белков, не относящихся к EV, меньших, чем MWCO 100 кДа.
ПРИМЕЧАНИЕ: Это потенциальная остановка. - Переведите концентрированную среду в трубку с низким содержанием белка, храните при 4 °C в течение ночи и продолжайте протокол на следующий день, если это необходимо.
- Залейте резервуар любой оставшейся фильтрованной питательной средой. При «пополнении» удалите сквозной поток в нижней части устройства и перебалансируйте все устройства.
- Если вы работаете с объемами значительно >100 мл, выберите устройство TFF соответствующего размера (MWCO 100 кДа) для размещения обрабатываемого объема.
ПРИМЕЧАНИЕ: В продаже имеются фильтрационные устройства для переработки от 100 мл до >1000 мл. Локальная доступность, стоимость и совместимость с насосом и трубками / соединениями будут определять, какие конкретные модели будут наиболее полезны. До 2 л питательной среды обрабатывали устройством, указанным в Таблице материалов , перед необходимостью очистки фильтра (см. шаг 2.3 ниже для протокола очистки).- Соберите контур фильтрации с трубкой No16 с низким связыванием/низким выщелачиванием, 1/8-дюймовым шлангом-барбусом для адаптеров Luer, устройством TFF и перистальтическим насосом, как указано на дополнительном рисунке S2.
ПРИМЕЧАНИЕ: Выполняйте TFF в шкафу биобезопасности, чтобы свести к минимуму риск загрязнения препарата EV бактериями окружающей среды. - При комнатной температуре начинают циркулировать отфильтрованную кондиционированную среду со скоростью приблизительно 200 мл/мин (минимум 100 мл/мин). Определить соответствующие обороты, соответствующие желаемому расходу, путем перекачки 200 мл PBS в градуированный сосуд. При циркуляции фильтрованной, кондиционированной среды собирают молекулы <100 кДа, пересекающие ультрафильтрационную мембрану, в виде отходов в отдельный сосуд.
ПРИМЕЧАНИЕ: Приведенный ниже пример предполагает начальный объем в 2 л культуры. - Продолжают циркулировать кондиционированную среду до тех пор, пока ее объем не уменьшится до ~100-200 мл. Перемещайтесь на небольшие суда по мере необходимости. Разбавить в 2 раза ПБС, и продолжить циркуляцию с насосом, концентрируясь до 75-100 мл. Разбавляют в 2 раза ПБС и продолжают циркулировать до конечного объема 25 мл. Разбавить в 2 раза ПБС и продолжать циркулировать до <10 мл.
- Поднимите питательную трубку из резервуара для проб и продолжайте откачку, чтобы продуть фильтр и восстановить максимальное количество пробы.
ПРИМЕЧАНИЕ: Это потенциальная остановка. - Переложите концентрированный образец в коническую трубку и при желании храните на ночь при температуре 4 °C. В качестве альтернативы можно продолжить работу с протоколом.
- Переместите концентрированный образец на центробежное ультрафильтрационное устройство MWCO емкостью 15 мл 100 кДа. Центрифуга в качающемся роторе ковша при 4 °C и 2000 × г с интервалом 15-30 мин до тех пор, пока объем среды в верхнем резервуаре не будет сконцентрирован до <2 мл.
ПРИМЕЧАНИЕ: Это потенциальная остановка. - Переведите концентрированную среду в трубку с низким содержанием белка и храните при 4 °C в течение ночи, продолжая протокол на следующий день, если это необходимо.
- Соберите контур фильтрации с трубкой No16 с низким связыванием/низким выщелачиванием, 1/8-дюймовым шлангом-барбусом для адаптеров Luer, устройством TFF и перистальтическим насосом, как указано на дополнительном рисунке S2.
- Если работа с объемами значительно >100 мл, переходите к шагу 2.2.2. При работе с объемами ~100 мл загрузить 90 мл фильтрованной питательной среды в резервуар соответствующей емкости 100 кДа центробежного ультрафильтрационного устройства молекулярно-массовой отсечки (МВКО) с использованием серологических пипеток. Всегда балансируйте с помощью соответствующего ультрафильтрационного устройства и центрифуги в качающемся роторе ковша при 4 °C и 2000 × г с интервалом 15-30 минут, пока объем среды в верхнем резервуаре не будет сконцентрирован до <0,5 мл.
- Очистка устройства TFF (опционально)
ПРИМЕЧАНИЕ: Скорость фильтрации уменьшается по мере того, как устройство TFF начинает «засоряться» во время процесса (загрязнение). При необходимости фильтрующее устройство может быть очищено для облегчения фильтрации дополнительных образцов в том же цикле очистки. Хотя теоретически это возможно, очищенный фильтр TFF не использовался для другого цикла очистки, чтобы избежать перекрестного загрязнения.- Для очистки снимите все трубки и колпачки с устройства TFF и слейте остатки жидкости.
- Используйте перистальтический насос и трубки для затопления как внутреннего, так и внешнего отсеков устройства TFF (т.е. через параллельные и перпендикулярные порты в модели, указанной в Таблице материалов) ~100 мл дистиллированной воды. Снимите все трубки/колпачки и осушите устройство TFF.
- Закройте наружные (перпендикулярные, фильтратные) порты и циркулируйте 250 мл 20% этанола в дистиллированной воде при >200 мл/мин в течение 10 мин через внутренний отсек. Осушите, залить дистиллированной водой и снова слейте, как указано выше.
- Циркулируют 250 мл свежего раствора NaOH 0,5 Н в течение 30 мин через внутренний отсек и снова сливают.
- Повторно подключите все трубки и колпачки к входному, выходному и фильтратному портам, как показано на дополнительном рисунке S2, и снова циркулируйте раствор NaOH 0,5 Н до тех пор, пока объем naOH > 1 мл/см2 поверхности фильтра не проникнет через мембрану фильтра и не будет собран в виде фильтрата/отходов.
- Промойте устройство TFF дистиллированной водой, как указано выше. Немедленно используйте устройство TFF или затопите устройство ~ 100 мл 20% этанола и храните на ночь при 4 °C.
ПРИМЕЧАНИЕ: При хранении в этаноле обязательно сливайте, ополаскивайте водой, сливайте и циркулируйте 250 мл PBS через устройство до тех пор, пока объем поверхности фильтра >1мл / см2 проникнет через фильтрующую мембрану и не будет собран в виде фильтрата / отходов для удаления остаточного этанола перед обработкой образца.
- Исключение размеров хроматография (SEC)
ПРИМЕЧАНИЕ: SEC используется для повышения чистоты EV и удаления невезикулярного белка.- Используйте небольшую колонну SEC (объем слоя 10 мл) для изоляции электромобилей от <100 мл исходного материала и большую колонну (объем слоя 47 мл) для изоляции электромобилей от >100 мл исходного материала.
ПРИМЕЧАНИЕ: В приведенном ниже примере будут перечислены тома для большего столбца, а тома для меньшего столбца в скобках. - Доведите колонку SEC и PBS до комнатной температуры в течение нескольких часов. Стабилизируйте колонну SEC в вертикальном положении с помощью стандартного лабораторного стенда и держателя. В качестве альтернативы используют коммерческие хроматографические колонковые стенды.
- Перед подключением к колонне SEC гидратируйте резервуар для образцов, позволяя 5 мл PBS течь через фрит и в контейнер для отходов. Открутите впускную крышку колонны SEC, добавьте 2 мл PBS в резервуар для проб и осторожно подключите резервуар к колонне, поскольку PBS капает через фрит (не применимо для небольших колонн SEC).
ПРИМЕЧАНИЕ: Этот предыдущий шаг предотвращает попадание пузырьков воздуха в верхнюю часть столбца SEC. Если воздух захвачен, извлеките резервуар, постучите по колонне, чтобы вытащить пузырь воздуха, и повторите процедуру подключения. Для меньшего столбца просто снимите верхнюю часть столбца SEC и прикрепите бункер для образцов. - Добавьте 47 мл (10 мл) PBS в резервуар для проб и снимите крышку с нижней части колонны SEC. Позвольте всему загруженному буферу выборки проходить через столбец для уравновешивания. Отбросьте сквозной поток.
- Загрузите максимум 2 мл (0,5 мл) образца в резервуар для проб, отбросьте сквозной поток и позвольте образцу полностью войти в колонну.
- Немедленно добавьте PBS в резервуар для проб или бункер в объеме 14,25 мл минус объем пробы (3 мл минус объем образца для небольшой колонки). Позвольте раствору пройти через столбец и отбросьте это количество, равное объему пустоты столбца.
ПРИМЕЧАНИЕ: Для типичного образца объемом 2 мл количество PBS, добавляемого в резервуар для проб или бункер, составит 12,25 мл. - Расположите микротрубку с низким связыванием объемом 2 мл непосредственно под колонкой SEC. Немедленно добавьте 2 мл (0,5 мл) PBS в резервуар для проб и дайте ему войти в колонну. Обозначьте эти первые 2 мл (0,5 мл) сквозного потока как фракцию 1. Продолжайте добавлять 2 мл (0,5 мл) за один раз в резервуар для отбора проб для сбора каждой последующей фракции.
ПРИМЕЧАНИЕ: Большинство бактериальных EV элюируются в первых 5 фракциях. В ходе оптимизации были собраны первые 12 фракций. - Хранить фракции при 4 °C для кратковременного хранения (дни) или -80 °C для длительного хранения.
- Очистка и хранение многоразовых колонн SEC
ПРИМЕЧАНИЕ: Столбцы SEC, описанные в этом протоколе, могут быть повторно использованы до 5 раз в соответствии с производителем. Если расход колонн SEC снижается после использования <5, производитель рекомендует центрифугировать концентрифугированные образцы при 10 000 х г в течение 10 мин для очистки любых агрегатов перед SEC. Затем загрузите супернатант этой центрифугации в колонну SEC для изоляции ЭЛЕКТРОМОБИЛЯ.- Чтобы очистить и сохранить столбец SEC после каждого использования, добавьте 2 мл (0,5 мл) 0,5 М NaOH и позвольте ему полностью войти в столбец. Пропустите 100 мл (20 мл) 20% этанола через колонку и храните его при 4 °C до следующего использования. Перед следующим использованием уравновешивайте этанол до комнатной температуры, как указано выше, и обменивайте его с буфером PBS, пропуская еще 150 мл (30 мл) PBS через колонну.
- Чтобы очистить и немедленно повторно использовать столбец SEC после каждого использования, добавьте 2 мл (0,5 мл) 0,5 М NaOH и позвольте ему полностью войти в столбец. Запустите приблизительно 150 мл (30 мл) буфера PBS, чтобы смыть NaOH. Когда рН элюата равен PBS (~7), может быть загружен новый образец.
- Используйте небольшую колонну SEC (объем слоя 10 мл) для изоляции электромобилей от <100 мл исходного материала и большую колонну (объем слоя 47 мл) для изоляции электромобилей от >100 мл исходного материала.
3. Контроль качества подготовки EV
- Тестирование на стерильность
ПРИМЕЧАНИЕ: Поскольку эти электромобили поступают из бактериальных культур, крайне важно обеспечить стерильность перед последующим использованием.- Получают 100 мкл (20 мкл) фракций, которые будут использоваться в анализах, и инокулируют 3 мл среды, используемой для выращивания исходных бактерий. Культивирование в соответствующих оптимальных условиях не менее 3 дней и наблюдение за мутностью. В качестве альтернативы, нанесите образцы фракций на агаровые пластины, содержащие среду, используемую для выращивания продуцирующих бактерий, и ищите образование колоний.
ПРИМЕЧАНИЕ: При обнаружении бактериального загрязнения не рекомендуется использовать препарат EV для экспериментов. Вместо этого повторите изоляцию, позаботившись о том, чтобы свести к минимуму риск бактериального загрязнения, (а) выполняя достаточную центрифугирование/фильтрацию кондиционированной бактериальной клеточной культуральной среды, (б) используя чистые бутылки, трубки, фильтры и хроматографические колонки и (в) используя соответствующие асептические методы.
- Получают 100 мкл (20 мкл) фракций, которые будут использоваться в анализах, и инокулируют 3 мл среды, используемой для выращивания исходных бактерий. Культивирование в соответствующих оптимальных условиях не менее 3 дней и наблюдение за мутностью. В качестве альтернативы, нанесите образцы фракций на агаровые пластины, содержащие среду, используемую для выращивания продуцирующих бактерий, и ищите образование колоний.
- Количественная оценка белка
ПРИМЕЧАНИЕ: Был использован высокочувствительный набор для количественного определения белка на основе флуоресценции (см. Таблицу материалов). Комплект работает с соответствующим запатентованным флуориметром на длинах волн возбуждения/излучения 485/590 нм.- Доведите все реагенты, стандарты и образцы до комнатной температуры.
- Приготовьте главную смесь белкового реагента и буфера, добавив 1 мкл реагента к 199 мкл буфера для каждого образца и стандарта, подлежащего анализу. Используя тонкостенные ПЦР-трубки объемом 0,5 мл, добавьте 10 мкл стандартной + 190 мкл мастер-смеси в каждую стандартную трубку.
ПРИМЕЧАНИЕ: Чтобы быть в пределах диапазона анализа, количество каждой фракции, добавляемой в каждую пробу, зависит от ожидаемого выхода белка при очистке. Как правило, использовали 5 мкл каждой фракции + 195 мкл мастер-микса. Конечный объем образца + мастер-микс должен быть 200 мкл. - Вращайте пробирные трубки и инкубируйте в течение не менее 15 мин при комнатной температуре в темноте.
- Измерьте стандарты на соответствующем запатентованном флуориметре (см. Таблицу материалов), выбрав опцию Анализ белка с помощью кнопок со стрелками и нажав кнопку GO для подтверждения. Следуйте инструкциям на экране, вставляя каждую стандартную трубку и нажимая КНОПКУ GO.
- Вставьте экспериментальную пробу; нажмите GO для чтения; и обратите внимание на отображаемый результат, который представляет собой фактическую концентрацию белка в смеси буфера для анализа/образца. Чтобы получить концентрацию белка в образце, с помощью клавиш со стрелками выберите параметр Рассчитать концентрацию образца , нажмите кнопку GO и с помощью клавиш со стрелками выберите объем образца , добавленный в буфер анализа для данного образца. Нажмите GO и запишите концентрацию белка в образце. Повторите этот шаг для каждого анализируемого образца.
- Подсчет частиц и распределение по размерам
ПРИМЕЧАНИЕ: Микрофлюидика резистивного импульсного зондирования (MRPS) использовалась для количественной оценки концентрации EV и распределения по размерам.- Разбавьте образцы в PBS, дополненные 1% Tween-20, который был отфильтрован через шприцевой фильтр 0,02 мкм до концентрации белка приблизительно 0,1 мкг/мл.
ПРИМЕЧАНИЕ: Цель разбавления заключается в достижении ожидаемой концентрации частиц в диапазоне 1010 частиц/мл в EV-содержащих фракциях. Оптимальное разбавление, возможно, потребуется определить эмпирически. Ожидается, что для более поздних фракций (помимо фракции 6) ожидается несколько электромобилей. Таким образом, концентрация частиц, вероятно, составит <1010 частиц/мл, несмотря на анализ при низких разрежениях. - Загрузите 3 мкл каждого образца в одноразовый картридж микрофлюидики с помощью микропипетки, вставьте картридж в инструмент MRPS и нажмите металлическую кнопку с синим ободом с подсветкой.
- Нажмите кнопку Go! на программном обеспечении для сбора и дождитесь анализа образца прибором. Получите от 1000 до 10 000 событий частиц, чтобы свести к минимуму техническую статистическую погрешность анализа. На этом этапе нажмите кнопку Остановить и завершить выполнение , чтобы завершить получение образца.
ПРИМЕЧАНИЕ: Вместе с необработанными файлами данных прибор выводит сводную электронную таблицу с перечислением концентрации частиц в образце. Исправьте это значение в соответствии с произведенным разбавлением пробы. - Используя аналитическое программное обеспечение, загрузите необработанные данные и сгенерируйте настраиваемые графики распределения размеров.
- Разбавьте образцы в PBS, дополненные 1% Tween-20, который был отфильтрован через шприцевой фильтр 0,02 мкм до концентрации белка приблизительно 0,1 мкг/мл.
4. Хранение электромобилей
- Aliquot отдельные или объединенные фракции до 25-50% от размера отдельной фракции (в зависимости от размера используемой колонки) в низкобелковых связывающих трубках и хранят при -80 °C, чтобы избежать циклов замораживания-оттаивания.
ПРИМЕЧАНИЕ: Различные приложения могут потребовать меньших или больших аликвот в зависимости от ожидаемого количества, используемого в каждом эксперименте. Это необходимо будет определить эмпирически. Фракции, не содержащие EV, могут быть отброшены, если это не применимо к целям исследования.
5. Просвечивающая электронная микроскопия
- Отрицательное окрашивание
- Добавьте 5 мкл образца EV в медную сетку 400 с углеродным покрытием и инкубируйте при комнатной температуре в течение 10 мин. Бок образца промыть 5 каплями буфера Триса 5 мМ (рН 7,1), а затем 5 каплями дистиллированной воды.
- Окрашивают образец стороной 5 каплями 2% уранилацетата. Смочите любое дополнительное количество пятен фильтровальной бумагой и дайте сетке полностью высохнуть в течение нескольких часов или за ночь. Визуализируйте образцы с помощью электронного микроскопа, работающего на 80 кВ.
- Маркировка иммунозолотогола
- Нанесите 10 мкл суспензии EV на сетку формвар/углерод 400 и инкубируйте при комнатной температуре в течение 1 ч. Промыть сетку в PBS три раза, а затем нанести 4% параформальдегид в течение 10 минут, чтобы зафиксировать образец. Вымойте сетки пять раз с помощью PBS.
- Заблокируйте сетку тремя промывками PBS, содержащими 0,1% бычьего сывороточного альбумина (BSA). Затем применяют 10 мкл первичного антитела в течение 40 мин при комнатной температуре (здесь 1 мкг/мл антитела nluc). Трижды промыть PBS, содержащим 0,1% BSA.
- Добавьте в сетку 10 мкл вторичного антитела, меченого золотом, и инкубируйте в течение 40 мин при комнатной температуре. Трижды вымойте сетки с помощью PBS.
ПРИМЕЧАНИЕ: Здесь после разбавления 1:10 в блокирующем буфере использовалось козье антимышье антитело, конъюгированное с наночастицами золота 10 нм. Если маркировка золота скрывает визуализацию EV, вместо этого можно использовать вторичные антитела с меньшими наночастицами золота (например, 5 нм). - Постфиксируйте сетку 10 мкл 2,5% глутарового альдегида в течение 10 мин при комнатной температуре. Мойте три раза в PBS. Выполняют отрицательное окрашивание 2% уранилацетатом (10 мкл) в течение 15 мин. Встраивают образцы в 10 мкл 0,5% уранилацетата и 0,13% раствор метилцеллюлозы в течение 10 мин.
- Дайте сеткам образцов высохнуть в течение ночи при комнатной температуре перед визуализацией на электронном микроскопе.
- На программном обеспечении для сбора микроскопа определите экспозицию эмпирически, чтобы получить оптимальное качество изображения (например, 0,80851 с в этой конкретной установке) и отрегулируйте его, введя это значение в поле параметров времени экспозиции . Выберите параметр 80 кВ и нажмите кнопку Начать сбор , чтобы записать изображение.
Access restricted. Please log in or start a trial to view this content.
Результаты
Чтобы оценить, какие фракции хроматографии SEC были обогащены для электромобилей, колонку SEC загрузили 2 мл питательной среды E. coli MP1, которая была сконцентрирована в 1000 раз TFF, и были собраны последовательные фракции. Используя MRPS, было обнаружено, что фракции 1-6 содержат наибольшее к?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В протоколе выше описан способ, который является масштабируемым и надежно изолирует EV от различных грамотрицательных/положительных и аэробных/анаэробных бактерий. Он имеет несколько потенциальных остановочных точек на протяжении всей процедуры, хотя лучше избегать использования бо?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликта интересов, о которых можно было бы заявить.
Благодарности
Исследование, описанное выше, было поддержано учебным грантом NIH TL1 TR002549-03. Мы благодарим докторов Джона К. Тилтона и Закари Тройера (Case Western Reserve University) за облегчение доступа к прибору для анализа размера частиц; Лью Браун (Spectradyne) за техническую помощь в анализе данных о распределении частиц по размерам; д-р Дэвид Патнэм из Корнелльского университета за предоставление плазмиды pClyA-GFP14; и д-р Марк Гулиан из Университета Пенсильвании за предоставление нам E. coli MP113.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.5 mL flat cap, thin-walled PCR tubes | Thermo Scientific | 3430 | it is important to use thin-walled PCR tubes to obtain accurate readings with Qubit |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron microscopy sciences | 15700 | |
| 250 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1495 | |
| 500 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1493 | |
| 65 mm Polypropylene Round-Bottom/Conical Bottle Adapter | Beckman Coulter | 392077 | Allows Vivacell to fit in rotor |
| Akkermansia mucinophila | ATCC | BAA-835 | |
| Amicon-15 (100 kDa MWCO) | MilliporeSigma | UFC910024 | |
| Avanti J-20 XPI centrifuge | Beckman Coulter | No longer sold by Beckman. Avanti J-26XP is closest contemporary model. | |
| Bacteroides thetaiotaomicron VPI 5482 | ATCC | 29148 | |
| Bifidobacterium breve | NCIMB | B8807 | |
| Bifidobacterium dentium | ATCC | 27678 | |
| Brain Heart infusion (BHI) broth | Himedia | M2101 | After autoclaving, Both BHI broth and agar were introduced into the anaerobic chamber, supplemented with Menadione (1 µg/L), hematin (1.2 µg/L), and L-Cysteine Hydrochloride (0.05%). They were then incubated for at least 24 h under anaerobic conditions before inoculation with the anaerobic bacterial strains. |
| C-300 microfluidics cartridge | Spectradyne | ||
| Chloramphenicol | MP Biomedicals | ICN19032105 | |
| Electron microscope | FEI company | Tecnai G2 SpiritBT | |
| Escherichia coli HST08 (Steller competent cells) | Takara | 636763 | |
| Escherichia coli MP1 | Dr. Mark Goulian (gift) | commensal bacteria derived from mouse gut | |
| Fiberlite 500 mL to 250 mL adapter | ThermoFisher | 010-0151-05 | used with Fiberlite rotor to enable 250 mL bottles to be used for smaller size of starting bacterial culture |
| Fiberlite fixed-angle centrifuge rotor | ThermoFisher | F12-6x500-LEX | fits 6 x 500 mL bottles |
| Formvar Carbon Film 400 Mesh, Copper | Electron microscopy sciences | FCF-400-CU | |
| Glutaraldehyde (EM-grade, 10% aqeous solution) | Electron microscopy sciences | 16100 | |
| Hematin | ChemCruz | 207729B | Stock solution was made in 0.2 M L-histidine solution as 1.2 mg/mL |
| Infinite M Nano+ Microplate reader | Tecan | This equibment was used to measure the mCherry fluorescence | |
| In-Fusion HD Cloning Plus | Takara | 638909 | For cloning of the PCR fragements into the PCR-lineraized vectors |
| JS-5.3 AllSpin Swinging-Bucket Rotor | Beckman Coulter | 368690 | |
| Lauria Bertani (LB) broth, Miller | Difco | 244620 | |
| L-Cysteine Hydrochloride | J.T. Baker | 2071-05 | It should be weighed and added directly to the autoclaved BHI media inside the anaerobic chamber |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer - special | HV-30800-08 | connection adapters for filtration tubing circuit |
| Masterflex Fitting, Polypropylene, Straight, Male Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer - special | HV-30800-24 | connection adapters for filtration tubing circuit |
| Masterflex L/S Analog Variable-Speed Console Drive, 20 to 600 rpm | Masterflex | HV-07555-00 | |
| Masterflex L/S Easy-Load Head for Precision Tubing, 4-Roller, PARA Housing, SS Rotor | Masterflex | EW-07514-10 | |
| Masterflex L/S Precision Pump Tubing, PharmaPure, L/S 16; 25 ft | Cole Palmer | EW-06435-16 | low-binding/low-leaching tubing |
| Menadione (Vitamin K3) | MP | 102259 | Stock solution was made in ethanol as 1 mg/mL |
| MIDIKROS 41.5CM 100K MPES 0.5MM FLL X FLL 1/PK | Repligen | D04-E100-05-N | TFF device we have used to filter up to 2 L of E. coli culture supernatant |
| Nano-Glo Luciferase Assay System | Promega | N1110 | This assay kit was used to measure the luminescence of the nluc reporter protein |
| NanoLuc (Nluc) Luciferase Antibody, clone 965808 | R&D Systems | MAB10026 | |
| nCS1 microfluidics resistive pulse sensing instrument | Spectradyne | ||
| nCS1 Viewer | Spectradyne | Analysis software for particle size distribution | |
| OneTaq 2x Master Mix with Standard Buffer | NEB | M0482 | DNA polymerase master mix used to perform the routine PCR reactions for colony checking |
| Protein LoBind, 2.0 mL, PCR clean tubes | Eppendorf | 30108450 | |
| Q5 High-Fidelity 2x Master Mix | NEB | M0492 | DNA polymerase master mix used to perform the PCR reactions needed for cloning |
| qEV original, 35 nm | Izon | maximal loading volume of 0.5 mL | |
| qEV rack | Izon | for use with the qEV-original SEC columns | |
| qEV-2, 35 nm | Izon | maximal loading volume of 2 mL | |
| Qubit fluorometer | ThermoFisher | Item no longer available. Closest available product is Qubit 4.0 Fluorometer (cat. No. Q33238) | |
| Qubit protein assay kit | ThermoFisher | Q33211 | Store kit at room temperature. Standards are stored at 4 °C. |
| Sorvall Lynx 4000 centrifuge | ThermoFisher | 75006580 | |
| SpectraMax i3x Microplate reader | Molecular Devices | This equipment was used to measure the nanoluciferase bioluminescence | |
| Stericup Quick-release-GP Sterile Vacuum Filtration system (150, 250, or 500 mL) | MilliporeSigma | S2GPU01RE S2GPU02RE S2GPU05RE | One or multiple filters can be used to accommodate working volumes. In our experience, you can filter twice the volume listed on the product size. |
| Uranyl acetate | Electron microscopy sciences | 22400 | |
| Vinyl anaerobic chamber | Coy Lab | ||
| Vivacell 100, 100,000 MWCO PES | Sartorius | VC1042 | |
| Whatman Anotop 10 Plus syringe filters (0.02 micron) | MilliporeSigma | WHA68093002 | to filter MRPS diluent |
Ссылки
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066(2015).
- Chatterjee, S. N., Das, J. Electron microscopic observations on the excretion of cell-wall material by Vibrio cholerae. Journal of General Microbiology. 49 (1), 1-11 (1967).
- Ciofu, O., Beveridge, T. J., Kadurugamuwa, J., Walther-Rasmussen, J., Hoiby, N. Chromosomal beta-lactamase is packaged into membrane vesicles and secreted from Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 45 (1), 9-13 (2000).
- Yonezawa, H., et al. Outer membrane vesicles of Helicobacter pylori TK1402 are involved in biofilm formation. BMC Microbiology. 9, 197(2009).
- Mashburn, L. M., Whiteley, M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote. Nature. 437 (7057), 422-425 (2005).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Petousis-Harris, H., et al. Effectiveness of a group B outer membrane vesicle meningococcal vaccine against gonorrhoea in New Zealand: a retrospective case-control study. Lancet. 390 (10102), 1603-1610 (2017).
- Kim, O. Y., et al. Bacterial outer membrane vesicles suppress tumor by interferon-gamma-mediated antitumor response. Nature Communications. 8 (1), 626(2017).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Consortium, E. -T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Watson, D. C., et al. Efficient production and enhanced tumor delivery of engineered extracellular vesicles. Biomaterials. 105, 195-205 (2016).
- Watson, D. C., et al. Scalable, cGMP-compatible purification of extracellular vesicles carrying bioactive human heterodimeric IL-15/lactadherin complexes. Journal of Extracellular Vesicles. 7 (1), 1442088(2018).
- Lasaro, M., et al. Escherichia coli isolate for studying colonization of the mouse intestine and its application to two-component signaling knockouts. Journal of Bacteriology. 196 (9), 1723-1732 (2014).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. Journal of Molecular Biology. 380 (1), 51-66 (2008).
- Beveridge, T. J. Structures of gram-negative cell walls and their derived membrane vesicles. Journal of Bacteriology. 181 (16), 4725-4733 (1999).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12, 628801(2021).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены