Method Article
Эффективное пероральное введение РНК-интерференции (РНКи) взрослым комарам Anopheles gambiae
В этой статье
Резюме
Пероральное введение дцРНК, продуцируемой бактериями, метод доставки РНК-интерференции (РНКи), который обычно используется в Caenorhabditis elegans, было успешно применено здесь к взрослым комарам. Наш метод позволяет проводить надежные исследования обратной генетики и векторные исследования, блокирующие передачу, без использования инъекций.
Аннотация
РНК-интерференция была широко используемым инструментом для обратного генетического анализа в течение двух десятилетий. У взрослых комаров введение двухцепочечной РНК (дцРНК) осуществлялось в основном путем инъекций, что требует значительного времени и не подходит для полевых применений. Чтобы преодолеть эти ограничения, здесь мы представляем более эффективный метод надежной активации РНКi путем пероральной доставки дцРНК взрослому Anopheles gambiae. Длинные дцРНК были получены в штамме Escherichia coli HT115 (DE3), а концентрированная суспензия термоубитых дцРНК-содержащих бактерий в 10% сахарозе была предложена на ватных шариках ad-libitum взрослым комарам . Ватные шарики заменялись каждые 2 дня на время лечения. Использование этого метода для нацеливания на двойной секс (ген, участвующий в дифференцировке пола) или головку вилки (которая кодирует фактор транскрипции слюнной железы) привело к снижению экспрессии гена-мишени и / или сигнала иммунофлуоресценции белка, измеренного количественной ПЦР в реальном времени (qRT-PCR) или флуоресцентной конфокальной микроскопии, соответственно. Также наблюдались дефекты морфологии слюнных желез. Этот очень гибкий, удобный для пользователя, недорогой, эффективный по времени метод доставки дцРНК может быть широко применим к генам-мишеням, важным для физиологии насекомых-переносчиков и за ее пределами.
Введение
Многие болезни передаются комарами, что делает изучение физиологии и генетики комаров важным делом. Использование РНКи в этих организмах было заметным в последние 20 лет и позволило функционально охарактеризовать многие гены комаров 1,2,3,4,5. Наиболее часто используемым методом доставки дцРНК была микроинъекция, которая имеет недостатки, заключающиеся в том, что она может повредить комаров и требует значительного времени и усилий. Были опробованы методы пероральной доставки для РНКи, но в основном в личиночной стадии комаров 6,7,8,9. Пероральная доставка дцРНК у взрослых комаров не была полностью изучена и может быть полезным инструментом для изучения векторной биологии и борьбы с переносчиками.
Малярия передается комарами Anopheles, когда инфицированная самка комара берет кровавую пищу от неинфицированного хозяина и вводит слюну, содержащую малярийных паразитов10. Чтобы в конечном итоге передаваться в слюне комара, паразит должен преодолеть многие препятствия, включая уклонение от иммунной системы комара, пересечение барьера средней кишки и вторжение в слюнные железы11. Архитектура слюнной железы комара (SG) является ключом к инвазии паразитов, и эта архитектура контролируется как ключевыми факторами транскрипции, выраженными слюнной железой, так и детерминантами полового диморфизма. Несколько высококонсервативных факторов транскрипции необходимы для клеточной спецификации и гомеостатического поддержания слюнных желез, а также для производства и секреции слюнных белков, которые функционируют при питании кровью 12,13,14. Головка вилки (Fkh) является фактором транскрипции крылатой спирали, который функционирует как основной регулятор структуры и функции SG насекомых (на основе исследований на плодовых мухах и шелкопрядной моли)15,16,17,18,19,20. В Drosophila SGs Fkh функционирует с Sage, SG-специфическим основным фактором транскрипции спирали-петли-спирали (bHLH), чтобы способствовать выживанию SG и выработке слюны19. Важным, положительным корегулятором выработки слюны у дрозофилы является CrebA, хорошо изученный лейциновый фактор транскрипции молнии, который повышает экспрессию генов секреторного пути 21,22,23. Существует также сильная степень морфологической дифференцировки в женских слюнных железах, которая, вероятно, играет ключевую роль не только в кровоснабжении, но и в способности паразитов вторгаться в эту ткань24.
Многие из генов, участвующих в определении выживаемости, структуры, физиологии и полового диморфизма слюнных желез, имеют сложные профили пространственно-временной экспрессии 25,26,27, и традиционные методы доставки дцРНК для индуцирования РНК Не всегда эффективны для нацеливания на эти виды генов в той или иной ткани. Тем не менее, пероральная доставка дцРНК в личиночной стадии комаров Aedes aegypti и An. gambiae была успешно использована для подавления специфической для женщин формы гена dsx 9,28. Предыдущие исследования с использованием дцРНК в слюнных железах комаров показали, что, хотя требовалось большое количество дцРНК, эффект глушения был относительно длительным (не менее 13 дней)29. Здесь была проверена способность термоубитого штамма E. coli HT115 (DE3), экспрессирующего последовательно-специфическую дцРНК для dsx, fkh или CrebA, индуцировать глушение РНКи этих генов у взрослых самок комаров. Пероральное введение нокдауна гена, индуцированного дцРНК, у An. gambiae, с явным снижением уровней мРНК и с фенотипами, соответствующими потере функции этих генов. Таким образом, этот подход, вероятно, будет работать, чтобы сбить функцию различных генов слюнных желез.
протокол
1. Клонирование дцРНК в вектор экспрессии E. coli
- Выберите последовательность генов-мишеней для вставки в соответствующий вектор для экспрессии дцРНК. Извлеките значения выражений из Vectorbase.org с помощью следующего метода.
- Поиск интересующего гена (например, таблица 1) в поле поиска на главной странице.
- На странице полученного гена перейдите к 8. Раздел транскриптомики .
- Ищите перечисленные соответствующие эксперименты по экспрессии генов RNA-seq и микрочипов.
- Транскрибируйте интересующие значения в программное обеспечение для работы с электронными таблицами и создайте таблицу данных.
- Выберите коммерчески доступную плазмиду с по крайней мере одним промотором T7 для использования. Если выбранная плазмида имеет только один промотор Т7 (как это делает большинство коммерческих плазмид), включите второй промотор Т7 в обратный праймер, который будет использоваться для амплификации дцДНК для интересующего гена.
ПРИМЕЧАНИЕ: Последовательность дцРНК для генов-мишеней может быть выбрана с помощью веб-приложения E-RNAi для проектирования реагентовRNAi 30. Либо длинная дцРНК (приблизительно 400 bp), либо короткая дцРНК (шРНК) могут быть разработаны на основе конкретных последовательностей генов. Эти последовательности должны быть усилены и секвенированы для подтверждения личности перед клонированием. Выбранные области генов, плазмиды и промоторы, используемые в этом исследовании, перечислены в дополнительном файле 1. - Выполните клонирование в соответствии с простой одноэтапной процедурой, описанной ранее 9,31. Для этого очищают продукт ПЦР и связывают с линеаризованной плазмидной ДНК. Используют продукт лигирования для теплового шокового превращения компетентных клеток E. coli 32. Выделите преобразованные ячейки с помощью сине-белого экрана. Подтвердите ориентацию вкладыша с помощью Т7-праймерной ПЦР и подтвердите последовательность с помощью праймеров М13.
ПРИМЕЧАНИЕ: Белые/синие скрининги могут быть использованы, когда плазмида, выбранная для трансформации, несет ген lacZ, который кодирует β-галактозидазу. Белые колонии должны содержать желаемую вставку внутри lacZ и могут быть выбраны для дальнейшего подтверждения наличия и ориентации целевой последовательности33. - Очистите плазмиду от первого превращения и используйте ее для преобразования компетентной E. coli HT115 (DE3), как описано ранее34. После подтверждения того, что плазмида со вставкой присутствует в компетентной кишечной палочке HT115 (DE3), делают глицериновые запасы бактерий для одноразового применения.
ПРИМЕЧАНИЕ: Соответствующая неродственная контрольная дцРНК должна быть приобретена или подготовлена к использованию в каждом эксперименте. В этом случае используется последовательность для неродственного гена aintegumenta (муравья) от Arabidopsis thaliana .
2. Получение термоубильных бактерий, экспрессирующих дцРНК
- Вырастите культуру из одной бактериальной колонии штамма E. coli HT115 (DE3), содержащей дцРНК-экспрессирующую плазмиду в 50 мл бульона Лурия (LB), содержащего 100 мкг/мл ампициллина и 12,5 мкг/мл тетрациклина, на платформе шейкера (180 об/мин) при 37 °C в течение 12 ч.
- Разбавьте бактериальную культуру (1:1000) в 2x дрожжевую триптоновую (2x YT) среду, содержащую 100 мкг/мл ампициллина и 12,5 мкг/мл тетрациклина.
- Индуцируют продукцию дцРНК путем добавления 40 мкМ (конечная концентрация) изопропила β-D-1-тиогалактопиранозида (IPTG).
- Когда клетки достигнут O.D.600 = 0,4 , примерно через 2 ч индукции при 37 °C с перемешиванием при 180 об/мин, готовят концентрированную суспензию термоубильных бактерий, как описано Taracena et al 9. Гранулируйте клетки центрифугированием (4000 х г, 4 °C, 10 мин) и промывайте клетки в одном объеме фосфатно-натриевого буфера (PBS).
- Снова вращайте в тех же условиях, повторно приостанавливайте в PBS до 1/100 от исходного объема и размещайте при 70 °C в течение 1 ч.
- Сделайте 400 мкл аликвот термоубитных бактерий и храните эти аликвоты при -20 °C до дальнейшего использования (не храните более недели). Эта суспензия термоубильных бактерий содержит специфическую дцРНК для экспериментов RNAi. Проводят эту процедуру как для гена-мишени дцРНК-бактерий, так и для неродственного дцРНК-контроля, который будет использоваться в каждом эксперименте.
3. Кормление комаров термоубийственными бактериями, экспрессирующими дцРНК
- Разморозить одну аликвоту дцРНК (суспензия бактерий HT115 (DE3)) и смешать с 1,6 мл 12% раствора сахара, содержащего 0,2% метилпарабена.
- Замочите небольшой ватный тампон в этом растворе и поместите пропитанный ватный тампон в клетку, содержащую 5-дневных комаров. Убедитесь, что комары питаются этим раствором, одновременно подбирая как сахар, так и дцРНК-содержащие бактерии.
- Менять ватный тампон, смоченный в растворе дцРНК-сахара, через день в течение 8 дней подряд.
- Держите клетки от комаров в постоянных условиях, т.е. 27 °C и 80% относительной влажности при фотопериоде 12 ч:12 ч света: темный фотоцикл, разделенный 30-минутным рассветом и 30-минутным периодом сумерек.
4. Анализ уровней экспрессии генов-мишеней
- Холодный обезболивает комаров, помещая контейнер на лед на минуту или до тех пор, пока комары не перестанут двигаться. Как только комары будут обезболены, поместите их на холодную поверхность, чтобы изолировать самок для рассечения.
- Распылите 70% этанола на комаров и поместите их на стеклянную поверхность с PBS. С помощью пары щипцов закрепите голову комара устойчиво и очень медленно потяните грудную клетку, позволяя слюнным железам высвобождаться в PBS.
- Держите слюнные железы в ледяном PBS до тех пор, пока 10 особей не будут рассечены. Пул десять SGs для экстракции РНК с использованием метода гуанидиниум тиоцианат-фенол-хлороформ. Суспендировать гранулу РНК в 30 мкл воды, не содержащей РНКазы.
- Используйте 1 мкл аликвоты РНК, извлеченной из SG на предыдущем этапе, чтобы считывать абсорбцию при 260 и 280 нм и рассчитывать концентрацию РНК в каждом образце путем умножения на коэффициент разбавления. Соотношение 260/280 ~ 2,0 указывает на хорошее качество РНК.
- Используйте 1 мкг очищенной РНК для синтеза комплементарной ДНК (кДНК) с использованием коммерческого набора обратной транскрипции.
- Сделайте разбавление кДНК 1:10 для получения реакции ОТ-ПЦР в соответствии с рекомендациями производителя. Для каждого образца подготовьте реакцию на ген-мишень и параллельно настройте реакцию с геном ведения хозяйства (HK). Установите каждую реакцию гена в техническое утроение, чтобы исключить влияние случайной вариации из метода.
ПРИМЕЧАНИЕ: Здесь рибосомный ген An. gambiae S7 (GeneBank: L20837.1) и актин (VectorBase: AGAP000651) были использованы в качестве генов HK. - Используйте все грунтовки в конечной концентрации 300 нМ, следуя показаниям производителя SYBR-green. Амплификация со стандартными условиями ПЦР: 95 °C в течение 10 мин, затем 40 циклов по 15 с при 95 °C и 60 с при 60 °C.
ПРИМЕЧАНИЕ: Для количественной оценки экспрессии генов используется метод дельта-дельта-Ct (ΔΔCt). Дельта Ct (ΔCt) - это разница между Ct гена-мишени и Ct гена домашнего хозяйства. ΔΔCt — разница между ΔCt экспериментальной группы и ΔCt контрольной группы35.
5. Фенотипическая оценка: успешное кровоснабжение
- Для оценки способности к кровоснабжению устанавливают группы из 15 самок комаров, обработанных мишенью и контрольной дцРНК на небольших клетках (диаметром 12 см) и голодают их в течение 4 ч.
- Используя циркуляционную водяную баню, установленную на 37 ° C, стеклянные кормушки для комаров (диаметр 24 мм) и парапленочную мембрану, предлагают дефибринированную овечью кровь комарам.
ПРИМЕЧАНИЕ: Кровь может быть получена у коммерческого поставщика, который асептически извлекает ее из здоровых животных-доноров американского происхождения и вручную дефибринирует без антикоагулянтов или добавок. - Путем непосредственного наблюдения подсчитайте и запишите количество попыток зондирования, чтобы успешно получить кровяную муку от первых пяти самок, чтобы стать полностью набухшими в каждой группе.
ПРИМЕЧАНИЕ: Чтобы избежать значительных метаболических изменений у комаров, которые могли бы помешать энергетическим ресурсам, влияющим на поведение в поисках крови, голодание было сведено к минимуму (4 ч). В результате не каждый комар будет жадно искать кровяную муку, и мы ограничили количество набухших самок до пяти (треть от общего числа в каждой группе), чтобы уменьшить влияние временных переменных, таких как воздействие человеческого запаха, изменение температуры между камерами и поверхностями кормления и т. Д.
6. Фенотипическая оценка: морфология слюнных желез и понижающая регуляция соответствующих белков
- Выделяют свежую ткань в 1x фосфатно-буферном физиологическом растворе (PBS), как описано на этапе 4.2, и фиксируют в ледяном ацетоне в течение 90 с. Промыть несколько раз в 1x PBS после удаления ацетона. Инкубировать с первичными антителами в течение ночи при 4 °C с антисывороткой (см. Таблицу материалов), разведенной в 1x PBS.
ПРИМЕЧАНИЕ: См. Таблицу материалов для идентификации первичных антител, используемых для белков слюны (антитромбоцитарный белок Anopheles , AAPP; Mucin 2, MUC2), факторы транскрипции SG (Fork Head, fkh; Шалфей, шалфей; Циклический ответ АМФ-элемент-связывающий белок А, CrebA) и маркер секреторных везикул (Rab11). Эти антитела используются в качестве показаний для формы и функции SG. Однако любое антитело, подходящее для иммунофлуоресценции, должно подходить для этого протокола. - Вымойте в 1x PBS несколько раз. Добавляют вторичные антитела (флуоресцентные), разведенные в 1x PBS, и инкубируют в темноте при комнатной температуре в течение 2 ч. Добавьте любое встречное пятно [например, 4',6-диамидино-2-фенилиндол (DAPI; ДНК), агглютинин зародышей пшеницы (WGA; для хитина), фаллоидин (для F-актина) и/или Красный Нил (для липидов)] за 30 мин до окончания инкубации за 2 ч.
- Мойте три раза в 1x PBS. Затем установите ткани в 100% глицерине на стандартный слайд микроскопа с крышкой толщиной 1 мм и храните при -20 °C до получения изображения с помощью флуоресцентного конфокального микроскопа.
ПРИМЕЧАНИЕ: Для получения количественных данных настройки изображения должны быть постоянными. Здесь были включены только проекционные изображения максимальной интенсивности через весь 3D-объем ткани, и вся количественная оценка изображения была нормализована между процедурами (в рамках эксперимента) на основе сигнала DAPI в остатках ткани, не относящихся к SG (жировое тело, кутикула или голова), также присутствующих на слайде.
Результаты
Для начала данные экспрессии микрочипов из VectorBase были использованы для сканирования потенциальных мишеней на стадиях развития36,37 для определения статуса экспрессии всех генов, имеющих отношение к текущему исследованию (таблица 1). Как и ожидалось, все выбранные нами гены-мишени показали экспрессию во взрослых SG. Уровни аппликации и шалфея были особенно высокими (таблица 1). Также следует отметить высокие уровни экспрессии f-Agdsx у взрослых женщин SG9.
Конкретные сегменты из каждого гена оценивали для использования в качестве дцРНК с использованием веб-приложения E-RNAi для проектирования реагентов RNAi30. ~ 400 областей bp, содержащих последовательности, уникальные для каждого гена-мишени, затем клонировали (рисунок 1A), трансформировали в соответствующие бактериальные штаммы и использовали для приготовления суспензий термоубильных бактерий, которые были индуцированы для производства дцРНК. Взрослых комаров кормили в течение 8 дней пропитанными сахарозой ватными шариками, содержащими бактериальные суспензии дцРНК для f-Agdsx, fkh или муравья (несвязанный отрицательный контроль).
Для анализа кормления РНКи самок комаров сначала было определено, индуцирует ли f-Agdsx или fkh дцРНК-питание глушение генов. Снижение на 98,8% (±2,1) уровней транскриптов fkh наблюдалось в группе, получавшей fkh-dsRNA (рисунок 1B), что указывает на то, что дцРНК очень эффективно уменьшала обилие транскриптов fkh в SGs. Удивительно, но уровни fkh мРНК были снижены на 82,0% (±18,9) у комаров, обработанных dsRNA для f-Agdsx, у которых было 89,86% (±4,48) снижения f-Agdsx , предполагая, что fkh может быть мишенью F-Dsx в слюнной железе. Одновременно со значительным снижением уровня экспрессии fkh комары fkh-knockdown продемонстрировали значительное увеличение числа попыток зондирования, необходимых для кровоснабжения. Эти комары демонстрировали, в среднем, в пять раз больше попыток кормления, чем контрольная группа или f-Agdsx dsRNA, которых кормили комаров, чтобы они были полностью нагружены кровью (рисунок 1C). Это привело к вопросу о том, вызывает ли лечение fkh нокдаун РНКи изменения в локализации и/ или распределении ключевых транскрипционных регуляторов (SG TFs Sage и CrebA) (Рисунок 2), секретируемых белков (AAPP и муцин) (Рисунок 3) и секреторных механизмов [Nile Red (липиды) и Rab11 (секреторные везикулы)] (Рисунок 4). Важно отметить, что существенные различия в интенсивности окрашивания наблюдались в разных областях доли, долях и отдельных СГ.
Как и прогнозировалось, уровни окрашивания шалфея и CrebA были заметно снижены во всех долях SG после fkh RNAi (рисунок 2B) по сравнению с RNAi контроля муравьев (рисунок 2A). Уменьшение как самых высоких максимальных значений интенсивности (красные пунктирные линии и цифровые метки), так и наименьших максимальных значений интенсивности (синие пунктирные линии и цифровые метки) в профилях линейного сканирования позволило уменьшить области как высокого, так и низкого сигнала в ткани (рисунки 2A, B). Эти данные свидетельствуют о том, что An. gambiae fkh RNAi эффективен и что fkh регулирует производство и/или стабильность SG TFs Sage и CrebA в An. gambiae, аналогично их генетическому родству в Drosophila SGs 19,38,39.
При рассмотрении высокообильных слюнокомпонентных белков уровни антитромбоцитарного белка Anopheles (AAPP)40,41 были снижены во всех трех долях SG после fkh RNAi по сравнению с контрольным лечением RNAi (рисунок 3A, B; зеленый). С другой стороны, никаких изменений в уровнях муцина не наблюдалось (рисунок 3A,B; фиолетовый). Эти данные свидетельствуют о том, что Fkh по-разному способствует экспрессии различных генов белка слюны.
Наконец, наблюдались два маркера секреции (фиг.4A,B): Rab11 (везикулы, связанные с апикальными рециркулирующими эндосомами)42 и Nile Red (липиды). Снижение флуоресценции Rab11 наблюдалось в дистальных боковых (DL) долях после лечения fkh RNAi (рисунок 4A v против 4B v; зеленый). Однако также наблюдалось увеличение сигнала Rab11 в медиальной (M) и проксимальной боковой (PL) долях (рисунок 4A vii, ix против 4B vii, ix; зеленый). Не наблюдалось заметной разницы в сигнале Nile Red (рис. 4A,B; фиолетовый) после fkh RNAi по сравнению с контрольной обработкой РНКи. Эти данные свидетельствуют о том, что сокращение fkh может изменять некоторое секреторное действие механизма сложным образом, который отличается между долями SG.
| Набор данных: | Гольцев | Нейра Овьедо | Нейра Овьедо | Пекарь | Пекарь | Пекарь | Пекарь | ||
| символ гена | функция | Идентификатор АГАП | эмбрион (25 ч.) | Личинки L3 | Л3 СГ | взрослая сука тело (3 дня) | взрослый кобель тело (3 дня) | взрослая сука SG (3 дня) | взрослый кобель SG (3 дня) |
| ААПП | белок слюны | АГАП009974 | 3.92 | 4.38 | 4.33 | 3.81 | 2.46 | 11.92 | 2.69 |
| КребА | txn фактор | АГАП001464 | 6.28 | 5.22 | 5.92 | 2.99 | 2.96 | 3.27 | 3.13 |
| " | txn фактор | АГАП011038 | 4.50 | 4.46 | 5.23 | 2.96 | 2.86 | 3.05 | 2.88 |
| dsx | txn фактор | АГАП004050 | 4.91 | 5.39 | 5.55 | 3.72 | 4.00 | 4.57 | 4.01 |
| фхх | txn фактор | АГАП001671 | 5.18 | 4.67 | 5.25 | 2.99 | 3.09 | 3.21 | 3.05 |
| МУЦ2 | белок слюны | АГАП012020 | 4.59 | 5.53 | 5.63 | 2.96 | 3.07 | 3.08 | 3.26 |
| Раб11 | торговля везикулами | АГАП004559 | 10.21 | 7.47 | 8.60 | 4.90 | 3.79 | 3.38 | 2.96 |
| мудрец | txn фактор | АГАП013335 | 5.32 | 5.96 | 8.89 | 3.40 | 3.33 | 7.37 | 7.23 |
Таблица 1: Средние профили выражения микрочипов log2 для An. Гамбия гены, представляющие интерес. Показаны имена генов, функциональная категория, идентификаторы Vectorbase (AGAP) и данные о среднем выражении микрочипов log2, собранные из Vectorbase. Эти данные указывают на то, что интересующие нас гены (участвующие в клеточной биологии и секреции слюнных желез (SG)) экспрессируются и обогащаются личиночной стадией 3 (L3) и взрослыми SGs по сравнению с целыми особями.
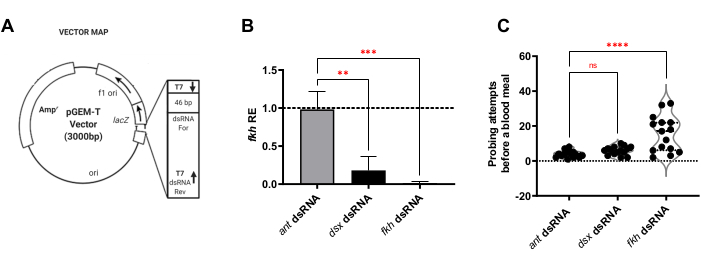
Рисунок 1: f-Agdsx и fkh нокдаун у взрослых An. gambiae снижает уровень fkh мРНК в SGs и влияет на способность женщины к кровоснабжению. (A) Репрезентативное изображение конструкции плазмиды, используемой для производства дцРНК в данной методологии. Вторая последовательность промотора Т7 добавляется к плазмиде путем включения ее в 3'-дюймовый праймер, используемый для усиления вставки, подлежащей клонированию в плазмиду pGEMT. Затем плазмида превращается в бактерии E. coli HT115 (DE3) и питательный раствор делают из суспензии индуцированных термоубильных бактерий в 10% сахарной воде. (B) Животные, которых кормили раствором для кормления дцРНК для f-Agdsx или fkh, показали значительно более низкие уровни транскриптов fkh (односторонние ANOVA с несколькими сравнениями; n = 15). Однако только группа, получавшая fkh dsRNA (C), показала значительную разницу в количестве попыток укуса, необходимых для получения пищи из крови. Комарам в этой группе требовалось, в среднем, в пять раз больше попыток зондирования для получения успешной кровяной муки, чем требовалось контрольной группе или группам, питаемым dsx-dsRNA (односторонние ANOVA с несколькими сравнениями; n = 15). Полосы ошибок указывают на стандартную погрешность среднего значения (SEM). Каждый эксперимент проводился в трех отдельных биологических репликах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
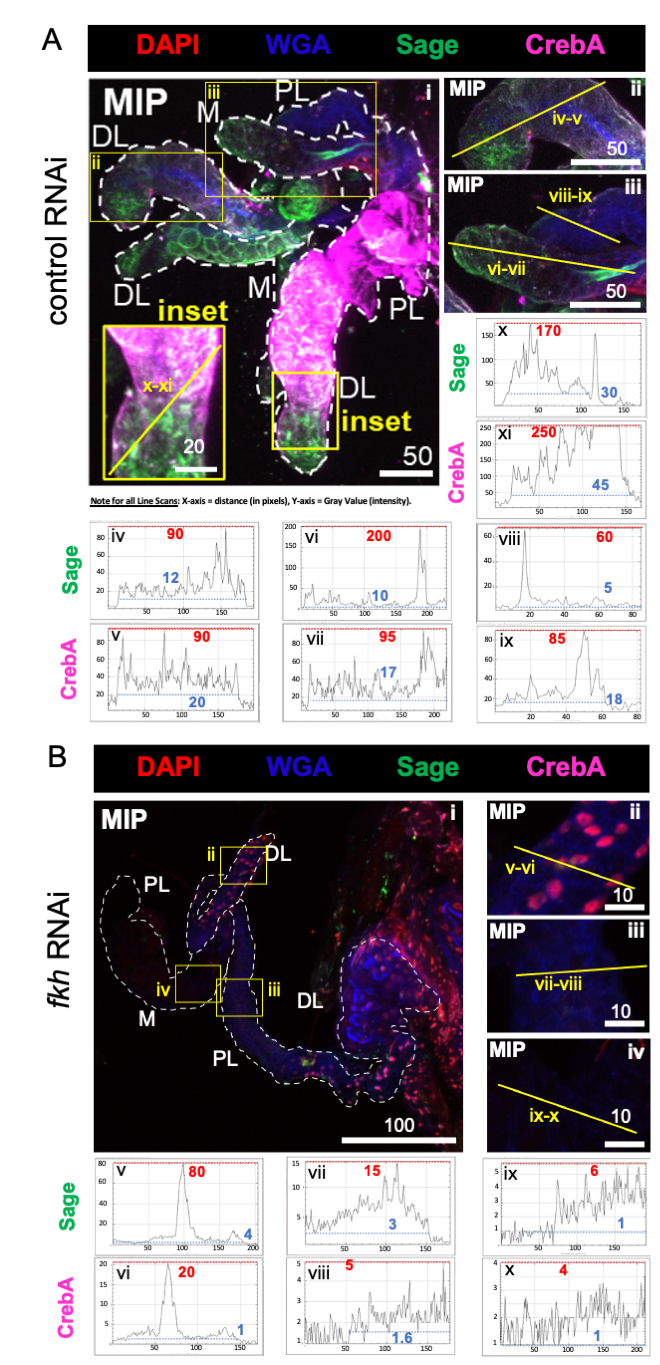
Рисунок 2: fkh нокдаун у взрослых слюнных желез An. gambiae снижает уровень фактора транскрипции SG. Показаны репрезентативные изображения с 13-го дня взрослой самки An. gambiae SGs после 8 дней (дней 5-13) перорального воздействия либо (A) неродственного контроля дцРНК (муравья), либо (B) дцРНК, нацеленной на головку вилки SG TF (fkh, AGAP001671) в 10% сахарозе, окрашенной красителями DAPI (ДНК; красный), меченым агглютинином зародышей пшеницы (WGA, хитин / O-GlcNAcylation; синий), антисыворотки против SG TFs Sage (зеленый) и CrebA (фиолетовый). Показанные длины шкалы равны микронам. SG (i) очерчены белыми тире. Желтые линии в увеличенных изображениях долей (областей, заключенных в желтые поля и помеченных «вставкой») указывают, где проводилось сканирование интенсивности сигнала. Зеленые и фиолетовые интенсивности каналов, соответствующие сканированию линий для каждой увеличенной доли, отображаются (всегда слева направо в SG) на графиках под изображениями; Ось X = расстояние (в пикселях) и ось Y = единица серого (интенсивность пикселей). Динамический диапазон интенсивности пикселей ограничен красными (максимальными) и синими (минимум) пунктирными линиями, и соответствующие значения отображаются на каждом графике. MIP = максимальная интенсивность 3D проекции через всю глубину SG. DL: дистальная боковая доля; М: медиальная доля; ПЛ: проксимальная латеральная доля; СД: слюнный проток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
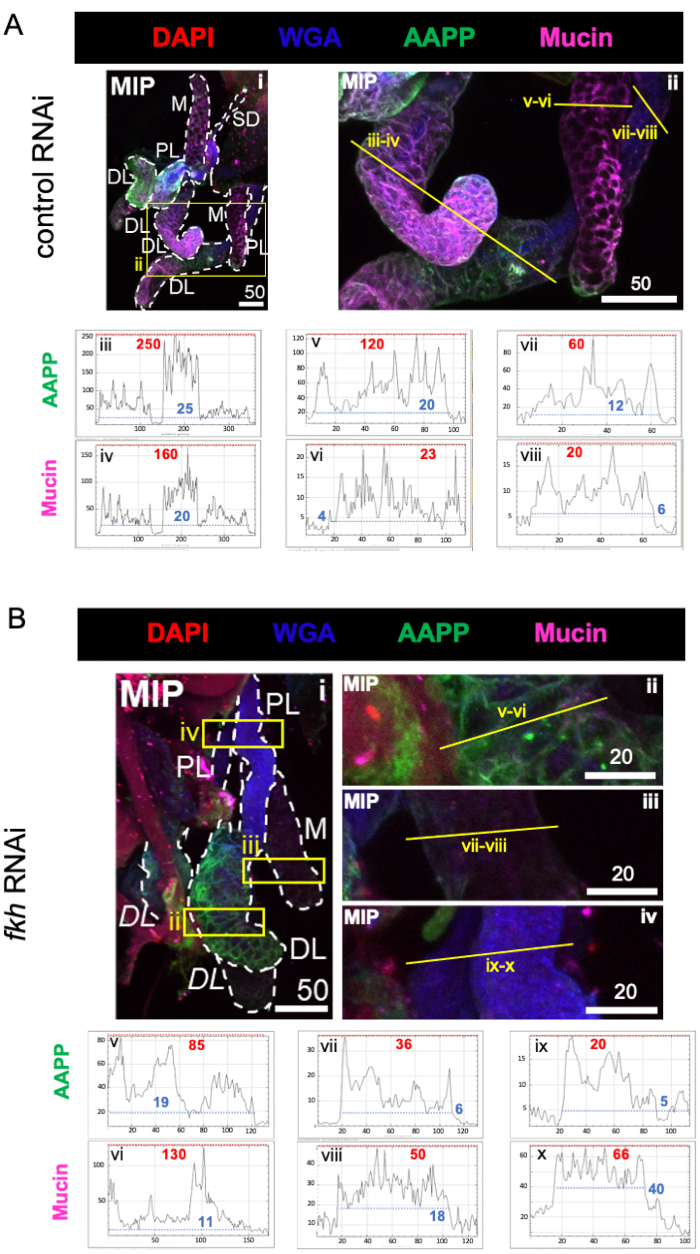
Рисунок 3: fkh нокдаун во взрослых слюнных железах An. gambiae снижает уровень секретируемого SG белка. Показаны репрезентативные изображения с 13-го дня взрослой женщины An. gambiae SGs после 8 дней (дней 5-13) перорального воздействия либо (A) неродственного контроля дцРНК (муравей), либо (B) дцРНК , нацеленной на головку вилки SG TF (fkh, AGAP001671) в 10% сахарозе, окрашенной красителями DAPI (ДНК; красный), меченым агглютинином зародышей пшеницы (WGA, хитин / O-GlcNAcylation; синий), и белки слюны AAPP (зеленый) и Mucin (MUC2, фиолетовый). Показанные длины шкалы равны микронам. SG (i) очерчены белыми тире. Желтые линии на увеличенных изображениях долей (областей, заключенных в желтые поля) указывают, где проводилось линейное сканирование интенсивности сигнала. Интенсивность зеленого и фиолетового каналов, соответствующая сканированию линий для каждой доли, отображается (всегда слева направо в SG) на графиках под изображениями; Ось X = расстояние (в пикселях) и ось Y = единица серого (интенсивность пикселей). Динамический диапазон интенсивности пикселей разделен красными (максимальными) и синими (минимальными) пунктирными линиями, и соответствующие значения отображаются на каждом графике. MIP = максимальная интенсивность 3D проекции через всю глубину SG. DL: дистальная боковая доля; М: медиальная доля; ПЛ: проксимальная латеральная доля; СД: слюнный проток. Курсивом метки "DL" (Bi) обозначают две видимые области одной и той же доли DL. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
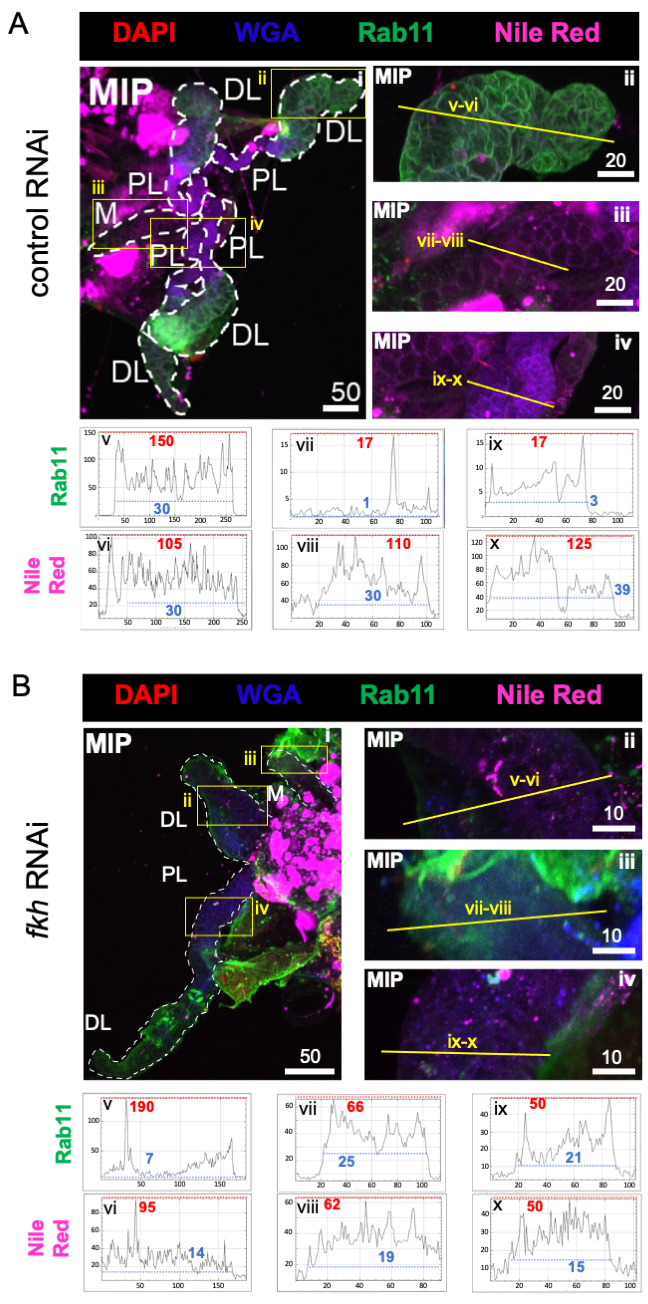
Рисунок 4: fkh нокдаун у взрослых слюнных желез An. gambiae снижает маркеры секреции SG. Показаны репрезентативные изображения с 13-го дня взрослой женщины An. gambiae SGs после 8 дней (дней 5-13) перорального воздействия либо (A) неродственного контроля дцРНК (муравья), либо (B) дцРНК, нацеленной на головку вилки SG TF (fkh, AGAP001671) в 10% сахарозе, окрашенной красителями DAPI (ДНК; красный), меченым агглютинином зародышей пшеницы (WGA, хитин / O-GlcNAcylation; синий), Nile Red (липиды; фиолетовый) и антисыворотки против рециркулирующего эндосомного везикулярного маркера Rab11 (зеленый). Показанные длины шкалы равны микронам. SG (i) очерчены белыми тире. Желтые линии на увеличенных изображениях долей (областей, заключенных в желтые поля) указывают, где проводилось линейное сканирование интенсивности сигнала. Зеленые и фиолетовые интенсивности каналов, соответствующие сканированию линий для каждой доли, отображаются (всегда слева направо в SG) на графиках под изображениями; Ось X = расстояние (в пикселях) и ось Y = единица серого (интенсивность пикселей). Динамический диапазон интенсивности пикселей разделен красными (максимальными) и синими (минимальными) пунктирными линиями, и соответствующие значения отображаются на каждом графике. MIP = максимальная интенсивность 3D проекции через всю глубину SG. DL: дистальная боковая доля; М: медиальная доля; ПЛ: проксимальная латеральная доля; СД: слюнный проток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Способность эффективно доставлять дцРНК комарам An. gambiae путем перорального кормления имеет широкие последствия для исследований векторной биологии как в лаборатории, так и в полевых условиях. Микроинъекция уже давно принята в качестве предпочтительного способа доставки химических веществ, антител, РНКi и стратегий генетической модификации у комаров43,44. Последствий существенных физических манипуляций, повреждения клеток и стресса можно избежать с помощью пероральной доставки, которая также может быть потенциально пригодна для крупномасштабных или полевых применений. Предыдущая работа предполагала, что РНКи действует повсеместно в пределах отдельного взрослого комара29, допуская эффекты во всех тканях, включая слюнные железы. Кормя комаров большим количеством дцРНК-экспрессирующей E. coli, которые перевариваются асинхронно в течение длительного периода времени, можно потенциально достичь последовательного и равномерного воздействия РНКИ на всех особей в клетке. Этот метод позволяет кормить большое количество комаров и анализировать потенциальную изменчивость полученных фенотипов в зависимости от гена-мишени. Однако одним из важных соображений является возможность гетерогенного распределения бактерий и, следовательно, дцРНК в хлопковом волокне. 400 мкл бактерий, используемых ежедневно для кормления комаров сахаром, будут содержать примерно ≤4,6 мкг дцРНК, как описано и рассчитано ранее9, но количество дцРНК, проглоченного каждым комаром, не было индивидуально определено. Если построение конструкций дцРНК становится рутиной, этот простой протокол лечения позволяет быстро усвоить этот метод любому исследователю комаров. Априори затраты времени во время лечения (30 мин в день) тривиальны по сравнению со временем, затрачиваемым на изучение и применение микроинъекции к аналогичным размерам выборки.
Питание дцРНК обычно используется для обратных генетических исследований в модельном организме Caenorhabditis elegans45. Такой высокий уровень использования подчеркивает ценность подхода к устной доставке. Построение общегеномной библиотеки An. gambiae в трансформированной кишечной палочке, аналогичной той, которая существует у C. elegans46,47, позволило бы проводить быстрый обратный генетический скрининг у комаров в увеличенном масштабе. Однако важно отметить, что эффективность метода в значительной степени зависит от эндогенных уровней транскрипта и от того, ограничивается ли экспрессия тканью-мишенью, а экспрессируется более широко 4,8,44. Кроме того, есть доказательства того, что некоторые инсектициды могут вызывать поведенческое избегание у комаров48, а кормление бактериями, которые потенциально вызывают у них неблагоприятные эффекты, может вызвать аналогичные модели избегания. В контролируемых условиях лаборатории, где у комаров не было альтернативного источника пищи, у них не было выбора, чтобы избежать сахарной воды с кишечной палочкой, и потребность в питательном источнике, вероятно, перевесила бы инстинкт избегать бактерий. Однако это следует учитывать, если стратегия предназначена для использования в менее контролируемых условиях.
Может быть возможно нацеливаться на несколько генов одновременно (используя одну конструкцию, несколько конструкций или смесь трансформированных бактериальных изолятов), но для оценки эффективности необходимы дальнейшие исследования. Другим важным соображением на этот момент является оценка возможных нецелевых или синергетических эффектов при использовании одной или нескольких целей. Создание соответствующих контрольных генов и групп является важной частью экспериментального проекта. Кроме того, заманчиво предположить, что этот подход может быть использован для нацеливания на другие патогены или вирусы49. Предыдущая работа по индукции РНКи у комаров проводилась в условиях, когда реагент вводился непосредственно, поэтому E. coli отсутствовала . E. coli может обеспечивать защитный отсек, позволяющий медленнее высвобождать дцРНК с течением времени, гарантируя, что воздействие будет более или менее непрерывным в течение гораздо более длительного периода29.
Наконец, эти результаты показывают, что эффекты этого метода можно настроить путем корректировки временных рамок (продолжительности и начального дня) воздействия и количества используемой кишечной палочки . Эта особенность позволила изучить функции эссенциальных генов (dsx и fkh) путем определения оптимальных условий нокдауна методом проб и ошибок. Это значительно повышает вероятность того, что гены-мишени, представляющие интерес, могут быть исследованы с использованием этой техники.
Таким образом, было обнаружено, что пероральная доставка РНКи взрослым комарам может быть простой, универсальной и мощным подходом к изучению функции генов комаров и созданию новых и податливых инструментов для борьбы с переносчиками болезней, переносимых комарами.
Раскрытие информации
Авторы сообщают, что у них нет конфликта интересов для раскрытия.
Благодарности
Авторы хотели бы поблагодарить сотрудников и ученых в Отделе энтомологии и Отдела паразитарных заболеваний и малярии в CDC, а также Брайана Тригга и Мишель Чиу за помощь в подготовке бактерий в JHU и / или полезные обсуждения этой работы. Мы благодарим JHMRI Insectary и менеджера Криса Кизито за доступ к комарам An. gambiae и их выращивание . Мы благодарим Wei Huang (JHSPH) за помощь в получении плазмид PJet GFP и pPB47 GFP для использования в этом исследовании. Финансирование этой работы было предоставлено: NIH R21AI153588 (для DJA), постдокторской стипендией Научно-исследовательского института малярии Джона Хопкинса (для MW); и грантом Фонда Good Ventures и Открытого благотворительного проекта Фонду CDC под названием «Поддержка криоконсервации и подавления развития женщин у комаров» для содействия исследованиям малярии, Open Philanthropy Project, 2017. Мы высоко ценим помощь со стороны сотрудников JHU Microscope Facility и соответствующую грантовую поддержку NIH для используемого микроскопа (NIH Grant #: S10OD016374). Выводы и заключения в этой рукописи принадлежат авторам и не обязательно отражают точку зрения CDC. Использование торговых наименований предназначено только для идентификации и не подразумевает одобрения со стороны Центров по контролю и профилактике заболеваний, Службы общественного здравоохранения или Министерства здравоохранения и социальных служб США.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 Kb Plus DNA Ladder | Thermo Fisher Scientific | 10787018 | |
| 2x Yeast Extract Tryptone (2xYT) Medium | BD Difco | DF0440-17 | |
| AAPP | n/a | n/a | Antisera. 1:50 dilution (rabbit); gift from Fabrizio Lombardo |
| AccuStart II PCR Supermix | Quantabio | 95137-100 | |
| Agarose | Millipore Sigma | A9539 | |
| Ampicillin | Millipore Sigma | A5354 | |
| Anopheles gambiae G3 | BioDefense and Emerging Infections (BEI) Malaria Research and Reference Reagent Resource Center (MR4) | MRA-112 | |
| BugDorm | BioQuip | 1452 | |
| Centrifuge 5810R | Eppendorf | P022628181 | |
| CrebA | DSHB | CrebA Rbt-PC | Antisera. 1:50 dilution (rabbit); generated by the Andrew Lab |
| Damiens diet | BioServ | ||
| DAPI | Life Technologies | n/a | 4′,6-diamidino-2-phenylindole; 1:200 dilution. |
| Defibrinated sheep blood | HemoStat | DSB050 | |
| Escherichia coli HT115 (DE3) | |||
| Ethidium bromide | Millipore Sigma | E7637 | |
| High-Capacity cDNA Reverse Transcription Kit | Thermo Fisher Scientific | 4368814 | |
| Isopropyl β-D-1-thiogalactopyranoside | Millipore Sigma | I5502 | |
| JM109 Competent cells | Promega | L2005 | |
| Luria Broth Media | Thermo Fisher Scientific | 10855001 | |
| Mucin 2 | Proteintech | Muc2; 27 675-1-AP | Antisera. 1:100 dilution (mouse). |
| Nanodrop 2000 | Thermo Fisher Scientific | ||
| Nile Red | Sigma | n/a | Lipid dye; 1:50 dilution. |
| Owl EasyCast B2 Mini Gel Horizontal Electrophoresis | Thermo Fisher Scientific | Model B2 | |
| pGEMT easy | Promega | A3600 | |
| Power SYBR-green PCR master MIX | Applied Biosystems | 4367659 | |
| PureLink PCR purification kit | Thermo Fisher Scientific | K31001 | |
| QuantaStudio 6 | Applied Biosystems | ||
| QuantStudio6 Real Time PCR System | Applied Biosystems | ||
| Rab11 | n/a | n/a | Antisera. 1:100 dilution (rabbit); generated by the Andrew Lab |
| Rh-WGA | Vector Labs | n/a | Rhodamine-conjugated wheat germ agglutinin (chitin, O-GlcNAcylation dye); 1:40 dilution |
| Sage | n/a | n/a | Antisera. 1:50 dilution (rat); generated by the Andrew Lab |
| T4 DNA ligase | Promega | M1801 | |
| Tetracycline | Millipore Sigma | 87128 | |
| Trizol | Thermo Fisher Scientific | 15596018 | |
| Zeiss LSM700 fluorescence confocal microscope | Zeiss | ||
| ANTIBODIES | |||
| Chicken anti-Rat IgG (H+L), Alexa Fluor 647 | Thermo Fisher Scientific | A21472 | |
| Goat anti-Mouse IgG (H+L), Alexa Fluor 647 | Thermo Fisher Scientific | A28181 | |
| IgG (H+L) Goat anti-Rabbit, Alexa Fluor 488 | Thermo Fisher Scientific | A27034 | |
| Rabbit anti-Goat IgG (H+L), Alexa Fluor 488 | Thermo Fisher Scientific | A27012 | |
| PRIMERS | |||
| ACT-2f: TACAACTCGATCATGAAGTGCGA | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
| ACT-3r: CCCGGGTACATGGTGGTACCGC CGGA | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
| FKH_RNAi_F: GCCGACTTATGCTTAGCCCA | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
| FKH_RNAi_R: TAGCCGTCAATTCCTCCTGC | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
| newDSX-f: AGAGGGCGGGGAAATTCTAGT | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
| newDSX-r: GGGCTTGTGGCAGTACGAATA | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
| S7qf1: AGAACCAGCAGACCACCATC | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
| S7qr1: GCTGCAAACTTCGGCTATTC | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
Ссылки
- Hoa, N. T., Keene, K. M., Olson, K. E., Zheng, L. Characterization of RNA interference in an Anopheles gambiae cell line. Insect Biochemistry and Molecular Biology. 33, 949-957 (2003).
- Caplen, N., Zheng, Z., Falgout, B., Morgan, R. Inhibition of viral gene expression and replication in mosquito cells by dsRNA-triggered RNA interference | Elsevier enhanced reader. Molecular Therapy. 6, 243-251 (2002).
- Brown, A. E., Catteruccia, F. Toward silencing the burden of malaria: progress and prospects for RNAi-based approaches. BioTechniques. , 38-44 (2006).
- Airs, P. M., Bartholomay, L. C. RNA interference for mosquito and mosquito-borne disease control. Insects. 8, (2017).
- Blandin, S., et al. Reverse genetics in the mosquito Anopheles gambiae: targeted disruption of the Defensin gene. EMBO Reports. 3 (9), 852-856 (2002).
- Garver, L., Dimopoulos, G. Protocol for RNAi assays in adult mosquitoes (A. gambiae). Journal of Visualized Experiments: JoVE. (5), e230 (2007).
- Whyard, S., et al. Silencing the buzz: a new approach to population suppression of mosquitoes by feeding larvae double-stranded RNAs. Parasites & Vectors. 8, 96 (2015).
- Wiltshire, R. M., Duman-Scheel, M. Advances in oral RNAi for disease vector mosquito research and control. Current Opinion in Insect Science. 40, 18-23 (2020).
- Taracena, M. L., Hunt, C. M., Benedict, M. Q., Pennington, P. M., Dotson, E. M. Downregulation of female doublesex expression by oral-mediated RNA interference reduces number and fitness of Anopheles gambiae adult females. Parasites & Vectors. 12, 170 (2019).
- Grassi, B. Studi di uno zoologo sulla malaria. Real Accademia dei Lincei. 3, 229 (1901).
- Smith, R. C., Jacobs-lorena, M. Plasmodium - Mosquito interactions: A tale of roadblocks and detours. Advances in Insect Physiology. 39, (2010).
- Das, S., et al. Transcriptomic and functional analysis of the Anopheles gambiae salivary gland in relation to blood feeding. BMC Genomics. 11, 1-14 (2010).
- Francischetti, I. M. B., Valenzuela, J. G., Pham, V. M., Garfield, M. K., Ribeiro, J. M. C. Toward a catalog for the transcripts and proteins (sialome) from the salivary gland of the malaria vector Anopheles gambiae. Journal of Experimental Biology. 205, 2429-2451 (2002).
- Henderson, K. D., Isaac, D. D., Andrew, D. J. Cell fate specification in thedrosophila salivary gland: The integration of homeotic gene function with the DPP signaling cascade. Developmental Biology. 205, 10-21 (1999).
- Mach, V., Ohno, K., Kokubo, H., Suzuki, Y. The Drosophila fork head factor directly controls larval salivary gland-specific expression of the glue protein gene Sgs3. Nucleic Acids Research. 24 (12), 2387-2394 (1996).
- Weiserova, M., et al. Mini-Mu transposition of bacterial genes on the transmissible plasmid. Folia Microbiologica. 32 (5), 368-375 (1987).
- Abrams, E. W., Mihoulides, W. K., Andrew, D. J. Fork head and Sage maintain a uniform and patent salivary gland lumen through regulation of two downstream target genes, PH4αSG1 and PH4αSG2. Development. 133, 3517-3527 (2006).
- Myat, M. M., Isaac, P. P., Andrew, D. J. Early genes required for salivary gland fate determination and morphogenesis in Drosophila melanogaster. Advances in Dental Research. 14, 89-98 (2000).
- Fox, R. M., Vaishnavi, A., Maruyama, R., Andrew, D. J. Organ-specific gene expression: the bHLH protein Sage provides tissue specificity to Drosophila FoxA. Development of Cell Biology. 140, 2160-2171 (2013).
- Maruyama, R., Grevengoed, E., Stempniewicz, P., Andrew, D. J. Genome-wide analysis reveals a major role in cell fate maintenance and an unexpected role in endoreduplication for the Drosophila FoxA gene fork head. PLOS ONE. 6, 20901 (2011).
- Johnson, D. M., et al. CrebA increases secretory capacity through direct transcriptional regulation of the secretory machinery, a subset of secretory cargo, and other key regulators. Traffic. 21, 560-577 (2020).
- Fox, R. M., Hanlon, C. D., Andrew, D. J. The CrebA/Creb3-like transcription factors are major and direct regulators of secretory capacity. Journal of Cell Biology. 191, 479-492 (2010).
- Abrams, E. W., Andrew, D. J. CrebA regulates secretory activity in the Drosophila salivary gland and epidermis. Development. 132, 2743-2758 (2005).
- Wells, M. B., Andrew, D. J. Anopheles salivary gland architecture shapes plasmodium sporozoite availability for transmission. mBio. 10 (4), 01238 (2019).
- Pei-Wen, L., Xiao-Cong, L., Jin-Bao, G., Yan, L., Xiao-Guang, C. Molecular cloning, characterization and expression analysis of sex determiantion gene doublesex from Anopheles gambiae (Diptera: Culicidae). Acta Entomologica Sinica. 58 (2), 122-131 (2015).
- Scali, C., Catteruccia, F., Li, Q., Crisanti, A. Identification of sex-specific transcripts of the Anopheles gambiae doublesex gene. The Journal of Experimental Biology. 208, 3701-3709 (2005).
- Price, D. C., Egizi, A., Fonseca, D. M. Characterization of the doublesex gene within the Culex pipiens complex suggests regulatory plasticity at the base of the mosquito sex determination cascade. BMC Evolutionary Biology. 15, 1-13 (2015).
- Mysore, K., et al. siRNA-mediated silencing of doublesex during female development of the dengue vector mosquito Aedes aegypti. PLoS Neglected Tropical Diseases. 9, 1-21 (2015).
- Boisson, B., et al. Gene silencing in mosquito salivary glands by RNAi. FEBS Letters. 580, 1988-1992 (2006).
- Horn, T., Boutros, M. E-RNAi: a web application for the multi-species design of RNAi reagents-2010 update. Nucleic Acids Research. 38, 332-339 (2010).
- Taracena, M. L., et al. Genetically modifying the insect gut microbiota to control chagas disease vectors through systemic RNAi. PLoS Neglected Tropical Diseases. 9, (2015).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular Cloning: A Laboratory Manual. , (1989).
- Ullmann, A., Jacob, F., Monod, J. Characterization by in vitro complementation of a peptide corresponding to an operator-proximal segment of the β-galactosidase structural gene of Escherichia coli. Journal of Molecular Biology. 24, 339-343 (1967).
- Timmons, L. Bacteria-mediated RNAi-General outline. Carnegie Institution of Washington. , (2000).
- Pfaffl, M. W. Relative quantification. Real-time PCR. , 63-82 (2004).
- Neira-Oviedo, M., et al. The RNA-Seq approach to studying the expression of mosquito mitochondrial genes. Insect Molecular Biology. 20, 141-152 (2011).
- Baker, D. A., et al. A comprehensive gene expression atlas of sex- and tissue-specificity in the malaria vector, Anopheles gambiae. BMC Genomics. 12, (2011).
- Loganathan, R., Hoon, J., Wells, M. B., Andrew, D. J. Secrets of secretion - How studies of the Drosophila salivary gland have informed our understanding of the cellular networks underlying secretory organ form and function. Cellular Networks in Development. , 143 (2021).
- Chung, S., Hanlon, C. D., Andrew, D. J. Building and specializing epithelial tubular organs: The Drosophila salivary gland as a model system for revealing how epithelial organs are specified, form and specialize. Wiley Interdisciplinary Reviews: Developmental Biology. 3, 281-300 (2014).
- Yoshida, S., et al. Inhibition of collagen-induced platelet aggregation by anopheline antiplatelet protein, a saliva protein from a malaria vector mosquito. Blood. 111, 2007-2014 (2008).
- Wells, M. B., Villamor, J., Andrew, D. J. Salivary gland maturation and duct formation in the African malaria mosquito Anopheles gambiae. Scientific Reports. 7 (1), 601 (2017).
- Takahashi, S., et al. Rab11 regulates exocytosis of recycling vesicles at the plasma membrane. Journal of Cell Science. 125, 4049-4057 (2012).
- Catteruccia, F., Levashina, E. A. RNAi in the malaria vector, Anopheles gambiae. Methods in Molecular Biology. 555, 63-75 (2009).
- Balakrishna Pillai, A., et al. RNA interference in mosquito: understanding immune responses, double-stranded RNA delivery systems and potential applications in vector control. Insect Molecular Biology. 26, 127-139 (2017).
- Fire, A., et al. Potent and specific genetic interference by double-stranded RNA in caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30, 313-321 (2003).
- Kamath, R. S., et al. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421, 231-237 (2003).
- Carrasco, D., et al. Behavioural adaptations of mosquito vectors to insecticide control. Current Opinion in Insect Science. 34, 48-54 (2019).
- Magalhaes, T., et al. Induction of RNA interference to block Zika virus replication and transmission in the mosquito Aedes aegypti. Insect Biochemistry and Molecular Biology. , 111 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены