Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Нейтронная спектроскопия высокого разрешения для исследования пикосекундно-наносекундной динамики белков и гидратационной воды
В этой статье
Резюме
Спектроскопия обратного рассеяния нейтронов обеспечивает неразрушающий и свободный от меток доступ к ps-ns динамике белков и их гидратационной воде. Рабочий процесс представлен двумя исследованиями амилоидных белков: динамики лизоцима во время агрегации с временным разрешением и динамики гидратационной воды тау при образовании волокон.
Аннотация
Рассеяние нейтронов дает возможность исследовать динамику в образцах для широкого диапазона энергий неразрушающим способом и без маркировки, кроме дейтерия. В частности, спектроскопия обратного рассеяния нейтронов регистрирует сигналы рассеяния при нескольких углах рассеяния одновременно и хорошо подходит для изучения динамики биологических систем на шкале времени ps-ns. ИспользуяD2O- и, возможно, дейтерированные буферные компоненты, метод позволяет контролировать как диффузию центра масс, так и движения основной цепи и боковой цепи (внутреннюю динамику) белков в жидком состоянии.
Кроме того, динамика гидратационной воды может быть изучена с использованием порошков пердейтерированных белков, гидратированных с H2O. В этой статье представлен рабочий процесс, используемый на приборе IN16B в Институте Лауэ-Ланжевена (ILL) для исследования динамики белковой и гидратационной воды. Объясняется приготовление образцов раствора и образцов гидратированного протеинового порошка с использованием парообмена. Описана процедура анализа данных как белковой, так и гидратационной динамики воды для различных типов наборов данных (квазиупругие спектры или сканирование с фиксированным окном), которые могут быть получены на спектрометре обратного рассеяния нейтронов.
Метод проиллюстрирован двумя исследованиями с участием амилоидных белков. Показано, что агрегация лизоцима в сферические агрегаты размером с мкм, обозначенные частицами, происходит в одностадийном процессе в пространственно-временном диапазоне, исследованном на IN16B, в то время как внутренняя динамика остается неизменной. Далее изучали динамику гидратации воды тау на гидратированных порошках пердейтерированного белка. Показано, что поступательные движения воды активируются при образовании амилоидных волокон. Наконец, обсуждаются критические шаги в протоколе относительно того, как рассеяние нейтронов позиционируется по отношению к изучению динамики по отношению к другим экспериментальным биофизическим методам.
Введение
Нейтрон представляет собой массивную частицу без заряда, которая на протяжении многих лет успешно использовалась для зондирования образцов в различных областях от фундаментальной физики до биологии1. Для биологических применений широко используются малоугловое рассеяние нейтронов, неупругое рассеяние нейтронов, а также нейтронная кристаллография и рефлектометрия 2,3,4. Неупругое рассеяние нейтронов обеспечивает усредненное по ансамблю измерение динамики, не требующее специфической маркировки как таковой, и качество сигнала, которое не зависит от размера или белка5. Измерение может быть выполнено с использованием очень сложной среды для исследуемого белка, которая имитирует внутриклеточную среду, такую как дейтерированный бактериальный лизат или даже in vivo 3,6,7. Для изучения динамики могут быть использованы различные экспериментальные установки, а именно: i) доступ к динамике суб-ps-ps, дающий время пролета, ii) доступ к динамике ps-ns, дающий обратное рассеяние, и iii) спин-эхо-дающий доступ к динамике от нс до сотен нс. Обратное рассеяние нейтронов использует закон Брэгга 2d sinθ = nλ, где d — расстояние между плоскостями в кристалле, θ — угол рассеяния, n — порядок рассеяния и λ — длина волны. Использование кристаллов для обратного рассеяния по направлению к детекторам позволяет достичь высокого разрешения по энергии, обычно ~ 0,8 мкВ. Для измерения энергообмена используется либо доплеровский привод, несущий кристалл в обратном рассеянии, для определения и настройки входящей длины волны нейтрона 8,9,10 (рис. 1), либо времяпролетная установка может быть использована за счет уменьшения энергетического разрешения 11.
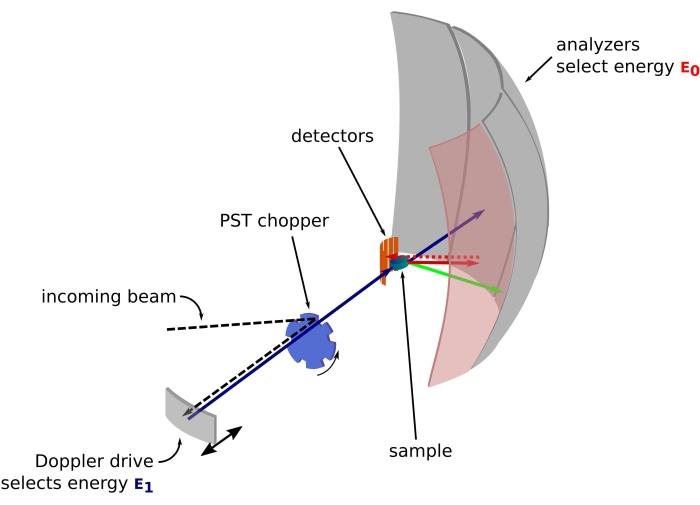
Рисунок 1: Эскиз спектрометра обратного рассеяния нейтронов с доплеровским приводом. Входящий луч попадает на прерыватель42 преобразования фазового пространства (PST), который увеличивает поток в положении образца. Затем он обратно рассеивается по направлению к образцу доплеровским приводом, который выбирает энергию E1 (голубая стрелка). Затем нейтроны рассеиваются образцом (с различными энергиями, представленными цветом стрелок), и анализаторы, изготовленные из кристаллов Si 111, будут рассеивать только нейтроны с определенной энергией E0 (здесь красные стрелки). Следовательно, передача импульса q получается из обнаруженного положения нейтрона на матрице детекторов, а передача энергии получается из разности E1 - E0. Время пролета, ожидаемое для нейтронного импульса, создаваемого PST, используется для отбрасывания сигнала от нейтронов, рассеянных непосредственно к детекторным трубкам. Аббревиатура: PST = преобразование фазового пространства. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Для спектроскопии обратного рассеяния основной вклад в сигнал от образцов, богатых протонами водорода, таких как белки, приходится на некогерентное рассеяние, для которого интенсивность рассеяния Sinc(q, ω) показана уравнением (1)12
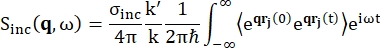 (1)
(1)
Где σinc — некогерентное поперечное сечение рассматриваемого элемента, k' — норма рассеянного волнового вектора, k — норма входящего волнового вектора, q (= k - k') — передача импульса, r j(t) — вектор положения атома j в момент времени t, а ω — частота, соответствующая переносу энергии между входящим нейтроном и системой. Угловые скобки обозначают среднее значение ансамбля. Следовательно, некогерентное рассеяние исследует усредненную по ансамблю самокорреляцию положений атомов во времени и дает самодинамику, усредненную по всем атомам в системе и различным временным началам (среднее значение ансамбля). Функция рассеяния является преобразованием Фурье во времени промежуточной функции рассеяния I(q, t), которое можно рассматривать как преобразование Фурье в пространстве корреляционной функции Ван Хова, показанное уравнением (2):
 (2)
(2)
Где ρ(r,t) — плотность вероятности нахождения атома в положении r и времени t 13.
Для фиковского диффузионного процесса функция самодиффузии возникает (см. Eq (3)) после двойного преобразования Фурье в функции рассеяния, состоящей из лоренциана ширины линии, заданной γ = Dq2.
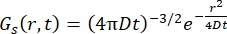 (3)
(3)
Были разработаны и признаны полезными более сложные модели, такие как модель скачкообразной диффузии Сингви и Шёландера для внутренней динамики белкаps-ns 14 или модель вращения Sears для гидратационной воды15,16,17.
На приборе обратного рассеяния нейтронов (NBS) IN16B 8,9 в ILL, Гренобль, Франция (дополнительный рисунок S1), установка, обычно используемая с белками, состоит из кристаллов Si 111 для анализаторов с доплеровским приводом для настройки входящей длины волны (дополнительный рисунок S2A), тем самым предоставляя доступ к диапазону передачи импульса ~ 0,2 Å-1 < q < ~ 2 Å-1 и диапазону передачи энергии -30 мкэВ < 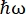 < 30 мкэВ, что соответствует временным шкалам в диапазоне от нескольких пс до нескольких нс и расстояний в несколько Å. Кроме того, IN16B предлагает возможность выполнять упругое и неупругое сканирование с фиксированным окном (E/IFWS)10, которое включает сбор данных при фиксированной передаче энергии. Поскольку поток ограничен при работе с нейтронами, E/IFWS позволяет максимизировать поток для одной передачи энергии, тем самым сокращая время сбора данных, необходимое для получения удовлетворительного отношения сигнал/шум. Более поздним вариантом является режим11 спектрометра обратного рассеяния и времяпролетного спектрометра (BATS), который позволяет измерять широкий диапазон переносов энергии (например, -150 мкВ < <
< 30 мкэВ, что соответствует временным шкалам в диапазоне от нескольких пс до нескольких нс и расстояний в несколько Å. Кроме того, IN16B предлагает возможность выполнять упругое и неупругое сканирование с фиксированным окном (E/IFWS)10, которое включает сбор данных при фиксированной передаче энергии. Поскольку поток ограничен при работе с нейтронами, E/IFWS позволяет максимизировать поток для одной передачи энергии, тем самым сокращая время сбора данных, необходимое для получения удовлетворительного отношения сигнал/шум. Более поздним вариантом является режим11 спектрометра обратного рассеяния и времяпролетного спектрометра (BATS), который позволяет измерять широкий диапазон переносов энергии (например, -150 мкВ < < 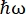 150 мкВ) с более высоким потоком, чем с доплеровским приводом, но за счет более низкого энергетического разрешения (дополнительный рисунок S2B).
150 мкВ) с более высоким потоком, чем с доплеровским приводом, но за счет более низкого энергетического разрешения (дополнительный рисунок S2B).
Важным свойством рассеяния нейтронов является то, что некогерентное поперечное сечение σвключительно имеет в 40 раз более высокое значение для водорода, чем для дейтерия, и пренебрежимо мало для других элементов, обычно встречающихся в биологических образцах. Следовательно, динамика белков в жидкой среде может быть изучена с использованием дейтерированного буфера, а состояние порошка позволяет изучать либо внутреннюю динамику белка с гидрогенизированным протеиновым порошком, гидратированным сD2O, либо исследование гидратационной воды для пердейтерированного протеинового порошка, гидратированного с H2O. В жидком состоянии обратное рассеяние нейтронов обычно позволяет одновременно получить доступ к самодиффузии белков в центре масс (диффузия фиковского типа) и их внутренней динамике. Последние представляют собой движения основной цепи и боковой цепи, обычно описываемые так называемой скачкообразной диффузионной моделью или другими 3,18. В гидрогенизированных протеиновых порошках диффузия белка отсутствует и необходимо моделировать только внутреннюю динамику. Для гидратационной воды вклад поступательных и вращательных движений молекул воды представляет различную зависимость от передачи импульса q, что позволяет различать их в процессе анализа данных17.
Эта работа иллюстрирует метод обратного рассеяния нейтронов с изучением белков, которые, как было установлено, способны разворачиваться, агрегироваться в каноническую форму, состоящую из стопок β-нитей - так называемого перекрестного β паттерна19,20 - и образовывать удлиненные волокна. Это так называемая амилоидная агрегация, которая широко изучается из-за ее центральной роли в нейродегенеративных расстройствах, таких как болезни Альцгеймера или Паркинсона21,22. Изучение амилоидных белков также мотивировано функциональной ролью, которую они могут играть 23,24, или их высоким потенциалом для разработки новых биоматериалов25. Физико-химические детерминанты агрегации амилоида остаются неясными, и нет общей теории агрегации амилоида, несмотря на огромный прогресс за последниегоды 21,26.
Агрегация амилоида подразумевает изменения структуры и стабильности белка с течением времени, изучение которых, естественно, подразумевает динамику, связанную со стабильностью конформации белка, функцией белка и энергетическим ландшафтомбелка 27. Динамика напрямую связана со стабильностью определенного состояния через энтропийный вклад для самых быстрых движений28, и функция белка может поддерживаться движениями в различных временных масштабах от суб-пс для светочувствительных белков29 до мс для доменных движений, что может быть облегчено пикосекундно-наносекундной динамикой30.
Будут представлены два примера использования спектроскопии обратного рассеяния нейтронов для изучения амилоидных белков: один в жидком состоянии для изучения динамики белка и один в гидратированном порошковом состоянии для изучения динамики гидратационной воды. Первый пример касается агрегации лизоцима в сферы размером мкм (называемые частицами), за которой следуют в режимереального времени 5, а второй - сравнение динамики воды в нативном и агрегированном состояниях человеческого белка тау-31.
Лизоцим является ферментом, участвующим в иммунной защите и состоит из 129 аминокислотных остатков. Лизоцим может образовывать твердые частицы в дейтерированном буфере при pD 10,5 и температуре 90 °C. С помощью рассеяния нейтронов мы показали, что временная эволюция коэффициента диффузии лизоцима в центре масс следует за одной экспоненциальной кинетикой флуоресценции тиофлавина Т (флуоресцентный зонд, используемый для мониторинга образования амилоидных перекрестных β паттернов32), что указывает на то, что образование сверхструктур частиц и перекрестных β происходит за один шаг с одинаковой скоростью. Более того, внутренняя динамика оставалась постоянной на протяжении всего процесса агрегации, что можно объяснить либо быстрым конформационным изменением, которое невозможно наблюдать на приборах NBS, либо отсутствием существенного изменения внутренней энергии белка при агрегации.
Человеческий белок тау представляет собой внутренне неупорядоченный белок (IDP), состоящий из 441 аминокислоты для так называемой изоформы 2N4R, которая, в частности, участвует в болезни Альцгеймера33. Используя обратное рассеяние нейтронов на порошках пердейтерированного белка тау, мы показали, что динамика гидратационной воды увеличивается в состоянии волокна с более высокой популяцией молекул воды, претерпевающих поступательные движения. Результат свидетельствует о том, что увеличение энтропии гидратации воды может привести к фибрилляции амилоида тау.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Подготовьте дейтерированный буфер для белков в жидком состоянии
- Растворите все компоненты буфера в чистом виде D2O.
- Если pH-электрод был откалиброван в H2O, отрегулируйте pD по формуле pD = pH + 0,4 с помощью NaOD или DCl34.
ПРИМЕЧАНИЕ: Использование D 2 O вместо H2O может повлиять на растворимость белка, и, возможно, потребуется адаптировать буферные условия (например, путем небольшого изменения концентрации соли).
2. Приготовьте H2O-гидратированные порошки пердейтерированного белка.
- Подготовьте держатель образца.
- Тщательно очистите плоский алюминиевый держатель образца с уплотнением из индиевой проволоки и винтами водой и этанолом и дайте ему высохнуть.
ПРИМЕЧАНИЕ: Плоский держатель образца используется таким образом, чтобы порошок мог быть равномерно распределен по поверхности. Количество порошка должно быть достаточным, чтобы его можно было удерживать между стенками и не падать при вертикальном размещении держателя образца. - Взвесьте различные части держателя образца - дно, крышку и индиевую проволоку - отдельно на прецизионных весах.
- Поместите уплотнение из индиевой проволоки диаметром 1 мм в канавку нижней части держателя образца, оставив небольшое перекрытие в месте соединения двух концов (рис. 2A).
- Поместите соответствующее количество лиофилизированного белка (обычно ~ 100 мг белка) так, чтобы он заполнил внутреннюю поверхность нижней части держателя образца.
- Тщательно очистите плоский алюминиевый держатель образца с уплотнением из индиевой проволоки и винтами водой и этанолом и дайте ему высохнуть.
- Увлажните протеиновый порошок.
- Поместите держатель образца в эксикатор с чашкой Петри, содержащей порошок P2O5 , на 24 часа, чтобы полностью высушить протеиновый порошок35 (рис. 2B). Взвесьте сухую нижнюю часть держателя образца, содержащую индиевую печать и сухой порошок, чтобы получитьm сухой.
ВНИМАНИЕ: порошок P2O5 очень агрессивен. - Извлеките P 2 O5 из эксикатора и поставьте чашку Петри с D2O внутри. Регулярно контролируйте массу порошка, чтобы проверить уровень гидратации h = m hyd / m dry, где mhyd и mdry - это масса гидратированного порошка и сухого порошка соответственно.
ПРИМЕЧАНИЕ: Для высокогидрофобных белков, таких как инсулин, может потребоваться повысить температуру внутри эксикатора, чтобы получить более высокое давление пара и достичь желаемого уровня гидратации h. - Повторите шаги 2.2.1 и 2.2.2 не менее трех раз, чтобы правильно преобразовать все обменные атомы водорода в дейтроны.
ПРИМЕЧАНИЕ: В качестве альтернативы для лучшего обмена H/D можно использовать циклы сублимационной сушки и растворения в чистом D2O при условии, что он не влияет на белок. - Гидратируйте порошок до уровня чуть выше желаемого, оставьте нижнюю часть держателя образца с индиевой проволокой и гидратированным порошком на прецизионных весах и подождите, пока масса медленно уменьшится до желаемого значения, чтобы получить целевой h (обычно 0,2-0,4, если глобулярный белок среднего размера должен быть покрыт одним полным гидратационным слоем).
- Быстро наденьте крышку на нижнюю часть и сначала закройте держатель образца четырьмя винтами, чтобы остановить парообмен (дополнительный рисунок S3A).
- Установите и затяните все оставшиеся винты до тех пор, пока между нижней частью и крышкой не останется зазора (дополнительный рисунок S3B).
- Взвесьте герметичный держатель образца, чтобы проверить возможные потери гидратации из-за утечек после нейтронного эксперимента.
- Поместите держатель образца в эксикатор с чашкой Петри, содержащей порошок P2O5 , на 24 часа, чтобы полностью высушить протеиновый порошок35 (рис. 2B). Взвесьте сухую нижнюю часть держателя образца, содержащую индиевую печать и сухой порошок, чтобы получитьm сухой.
3. Провести эксперимент по некогерентному рассеянию нейтронов
- Обсудите и перепроверьте конфигурацию прибора, необходимого для эксперимента, с локальным контактом за несколько недель до назначенного времени луча.
- Подготовьте образец жидкого состояния.
- Растворите белок в дейтерированном буфере.
- Определите подходящий объем жидкости, который будет помещен в держатель для образца, используя воду (убедитесь, что при закрытом держателе для образца нет перелива; Рисунок 2В).
ПРИМЕЧАНИЕ: Следующие этапы (3.3 и 3.4) описывают эксперимент, проведенный на спектрометре NBS IN16B на ILL 8,9 с использованием криопечи в качестве среды для образцов. Система управления прибором будет меняться от одного прибора к другому, но принципы работы останутся прежними.
- Вставьте образец.
- Тщательно высушите стержень для образца (рис. 2D) и удалите предыдущий образец, если таковой имеется, убедившись, что доза ионизирующего излучения ниже 100 мкЗв/ч, прежде чем приступать к работе с любым материалом (в ILL).
- Поместите образец, проверьте правильность центрирования относительно центра луча (дополнительный рисунок S4) и вставьте палочку для образца в криопечь (рис. 2D). Включите вакуумный насос до температуры менее 10-3 бар и промойте воздух внутри криопечи, повторив следующие три раза: заполните криопечь газообразным гелием до достижения атмосферного давления и снова удалите газ с помощью вакуумного насоса.
ПРИМЕЧАНИЕ: В случае плоского держателя образца держатель образца должен быть ориентирован под углом 45° относительно входящего луча. Полезный диапазон передачи импульса может быть уменьшен из-за поглощения и рассеяния ячейкой. Сильный поглотитель нейтронов, такой как кадмий, может быть использован для маскировки определенных частей держателя образца (например, винтов, толстых деталей). - Введите немного газообразного гелия в криопечь так, чтобы давление составляло ~ 0,05 бар.
- Сбор данных (например, при использовании NOMAD на IN16B в ILL предполагается, что пользователь предпочитает температуру 200 К перед получением спектра квазиупругих нейтронов (QENS), затем E/IFWS во время изменения температуры до 310 K при 0,5 K в минуту и, наконец, QENS при 310 K).
- С помощью NOMAD на вкладке «Выполнение» перетащите контроллер FurnaceCryostat на стартовую площадку. Установите температуру 200 К. Используйте быстрый режим и тайм-аут в 30 минут, чтобы температура успела стабилизироваться. Нажмите на значок вращающихся стрелок, чтобы запустить его в фоновом режиме, чтобы данные можно было получить во время снижения температуры.
- Перетащите контроллер IN16DopplerSettings , установите профиль скорости на Точная скорость , установленная Max ΔE, значение 0,00 мкВ и 128 каналов , чтобы получить конфигурацию EFWS.
- Перетащите контроллер подсчета , заполните поле «Субтитры » именем, позволяющим легко идентифицировать данные, и установите 60 повторений 30-секундных сканирований (дополнительный рисунок S5A).
- Перетащите контроллер IN16DopplerSettings , установите профиль скорости на синусоиду , установленную скоростью , со значением 4.5 м/с и 2,048 каналами , чтобы получить конфигурацию QENS.
- Перетащите контроллер Count с 4 повторениями по 30 минут сканирования (дополнительный рисунок S5B).
- Для изменения температуры перетащите контроллер FurnaceCryostat , установите температуру на 310 К, установите для параметра Рампа значение SetPoint с Δ = 0,05 К и 6 с. Используйте тайм-аут 220 минут (дополнительный рисунок S6A).
- Используйте цикл for с 65 повторениями. Внутрь вставьте контроллер IN16DopplerSettings , как показано на шаге 3.4.2, а затем отсчет 30 с. Затем вставьте IN16DopplerSettings, как описано ранее, но с использованием смещения энергии 1.5 мкВ и 1,024 канала с последующим однократным отсчетом в 3 минуты (дополнительный рисунок S6B).
- Чтобы получить последний QENS с разрешением 310 K, перетащите контроллеры IN16DopplerSettings и Count , настроенные так, как описано в шагах 3.4.4 и 3.4.5 соответственно.
- Нажмите кнопку «Пуск » (прямоугольный треугольник в нижней части окна), чтобы запустить сценарий.
ПРИМЕЧАНИЕ: Каждый эксперимент потребует сбора калибровочных данных; то есть пустая ячейка для вычитания или поправок на поглощение, только буфер при различных температурах, используемых для моделирования фона, и измерение ванадия (или, что то же самое, образца при температуре 10 К или ниже) для получения функции разрешения прибора.
4. Анализ данных - QENS
- Импортируйте набор данных с помощью метода 'IN16B_QENS.process()' в программном обеспечении Python nPDyn v3.x36
>>>> из nPDyn.dataParsers import IN16B_QENS
>>> выборка = IN16B_QENS(
... <путь к файлам данных>
... [detGroup=<целочисленный файл или файл группировки детекторов в XML
... формат>]
... ). process()
>>> выборка = sample.get_q_range(0,3, 1,8) - Выполните коррекцию данных (необязательно) с помощью следующих команд (см. документацию nPDyn для получения дополнительной информации, рис. 3):
#it предполагается, что данные для пустой ячейки, ванадия и буфера
# были импортированы уже в набор данных под названием 'empty_cell', 'vanadium',
# и 'buffer', соответственно.
# для вычитания пустых ячеек с коэффициентом масштабирования
# (ошибки распространяются автоматически)
>>> выборка = выборка - 0,95 * empty_cell
# для коррекции с использованием коэффициента Паалмана-Пинга
# (взаимоисключающий с приведенным выше примером)
>>> образец = sample.absorptionCorrection(empty_cell)
# для нормализации
>>> образец = sample.normalize(ванадий)
# для биннинга вдоль наблюдаемой оси
# наблюдаемым является время агрегации здесь
>>> образец = образец.bin(3, ось=0) - Подгонка калибровочных данных. Набор данных - образцы, пустая ячейка, дейтерированный буфер (при необходимости) и ванадий - могут быть установлены с помощью встроенных моделей или пользовательской модели (см. документацию nPDyn):
>>> из импорта nPDyn.models.builtins (
... модельPVoigt,
... модельВода,
... modelCalibratedD2O,
... )
# Встроенные модели используют столбцовый вектор импульса
# Передача значений Q
>>> q = ванадий.q[:, Нет]
# ванадий установлен с использованием псевдо-профиля Фойгта
>>> vanadium.fit(modelPVoigt(q)) - Используйте встроенную модель для гидратации воды под названием «modelWater». Эта модель читается так, как показано на Eq (4)17
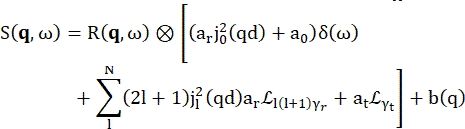 (4)
(4)
Где0,r иt являются скалярами, учитывающими относительный вклад упругого сигнала, вращательных движений и поступательных движений соответственно; j1(qd) — сферическая функция Бесселяl-го порядка, где q — передача импульса; d расстояние O-H в молекуле воды; δ(ω) — дельта Дирака, которая здесь умножается на EISF; N — высший порядок используемой сферической функции Бесселя (обычно ~5);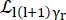 и являются вращательными и
и являются вращательными и 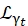 поступательными движениями Лоренца соответственно; b(q) — плоский фоновый термин. Сферические функции Бесселя дают относительный вклад каждого состояния углового момента молекул воды, а число N определяется на основе q-диапазона передачи импульса. В случае типичного NBS-спектрометра термины до N = 4 почти полностью объясняют сигнал (дополнительный рисунок S7).
поступательными движениями Лоренца соответственно; b(q) — плоский фоновый термин. Сферические функции Бесселя дают относительный вклад каждого состояния углового момента молекул воды, а число N определяется на основе q-диапазона передачи импульса. В случае типичного NBS-спектрометра термины до N = 4 почти полностью объясняют сигнал (дополнительный рисунок S7).
# Здесь уравнение 2 используется для гидратации воды
# свертка с функцией разрешения и добавлением
# Фон D2O выполняется автоматически с помощью кнопки
# предоставленные аргументы
>>> sample.fit(modelWater(q),
... res=ванадий,
... bkgd=буфер,
... volume_fraction_bkgd=0,95
... )
ПРИМЕЧАНИЕ: Вклад вращательных и поступательных движений должен быть запутанным, чтобы быть совершенно строгим. Успех аддитивной модели следует объяснить наличием различных популяций воды на поверхности белка и ограниченным энергетическим диапазоном. - Для построения графика данных используйте следующее (рис. 4):
>>> из графика импорта nPDyn.plot
>>> сюжет (образец)
5. Анализ данных - температурный скачок, эластичное сканирование с фиксированным окном (EFWS)
- Используйте процедуру, аналогичную разделу 4, для нормализации данных о переходе температуры по сигналу при самой низкой температуре (обычно 10 К):
>>> из nPDyn.dataParsers import IN16B_FWS
>>> выборка = IN16B_FWS(
... <путь к файлам данных>,
... detGroup=[detGroup=<файл группировки целых чисел или детекторов в формате XML>]
... ). process()
# нормализация с 5 первыми точками на наблюдаемом
# оси, которые соответствуют температуре
>>> пример /= образец[:5].mean(0)
# Используемый здесь диапазон добротности передачи импульса меньше
# так как используемая модель действительна только для низкого q
>>> выборка = sample.get_q_range(0,2, 0,8) - Для начала используйте простую гауссову модель, ширина которой определяется так называемым средним квадратичным смещением (MSD). Постройте и подгоните модель с помощью следующих команд:
>>> Импорт numpy как NP
>>> из импорта nPDyn.models Параметры, Модель, Компонент
# a - коэффициент масштабирования
>>> params = Параметры(
... a={'value': 1, 'bounds': (0, np.inf)},
... msd={'value': 1, 'bounds': (0, np.inf)}
... )
>>> model = Model(params)
>>> model.addComponent(Component(
... 'гауссовский',
... лямбда x, a, msd: a * np.exp(-x ** 2 * msd / 6)
... ))
>>> sample.fit(model, x=sample.q[:, None])
>>> сюжет (образец)
ПРИМЕЧАНИЕ: Гауссовское приближение всегда справедливо для q2MSD << 1, но для относительного сравнения между образцами можно использовать более широкий диапазон передачи импульса. Более сложные модели, выходящие за рамки гауссовского приближения, были разработаны37,38,39.
6. Анализ данных - эластичное и неэластичное сканирование с фиксированным окном (E/IFWS)
- Как и на шаге 4, импортируйте набор данных, но с помощью класса 'IN16B_FWS':
>>> из nPDyn.dataParsers import IN16B_FWS
>>> выборка = IN16B_FWS(
... <путь к файлам данных>
... [detGroup=<целочисленный файл или файл группировки детекторов в формате XML>]
... ). process()
>>> выборка = sample.get_q_range(0,3, 1,8) - Подгонка калибровочных данных и данных образца.
- Проанализируйте данные E/IFWS с помощью обобщенного MSD40 или рассматривая их как грубые спектры QENS (имея только несколько точек данных на оси энергии). Когда E/IFWS рассматривается как грубая QENS, модели, используемые для QENS, используются для одновременной подгонки всего набора данных E/IFWS (глобальное соответствие передач энергии и передач импульса).
ПРИМЕЧАНИЕ: Последнее решение, использующее модели для QENS на данных E / IFWS, используется здесь, где накладывается зависимость передачи импульса от диффузии центра масс и внутренней динамики белка. - Моделирование динамики белков в жидкостях с использованием следующего эквалайзера (5) ('modelProteinJumpDiff' в nPDyn):
 (5)
(5)
Где R(q,ω) — функция разрешения; β скаляр, независимый для каждой передачи импульса q; a0 - коэффициент упругой некогерентной структуры (EISF);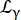 лоренцев, учитывающий диффузию центра масс с шириной, заданной уравнением (6);
лоренцев, учитывающий диффузию центра масс с шириной, заданной уравнением (6); 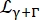 — лоренциан, включающий диффузию центра масс и вклад в соответствии с моделью скачкообразной диффузии14 , учитывающей внутреннюю динамику (Eq (7);
— лоренциан, включающий диффузию центра масс и вклад в соответствии с моделью скачкообразной диффузии14 , учитывающей внутреннюю динамику (Eq (7);  являющийся подогнанным сигналом от D2O, перемасштабированным его объемной долей в образце.
являющийся подогнанным сигналом от D2O, перемасштабированным его объемной долей в образце.
γ = Dsq2 (6)
Ds — коэффициент самодиффузии.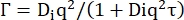 (7)
(7)
Di — кажущийся коэффициент диффузии для внутренней динамики, а τ — время релаксации для диффузионных движений.
>>> из импорта nPDyn.models.builtins (
... модельPVoigt,
... modelProteinJumpDiff,
... modelCalibratedD2O,
... )
# Встроенные модели используют столбцовый вектор импульса
# Передача значений Q
>>> q = ванадий.q[:, Нет]
# ванадий установлен с использованием псевдо-профиля Фойгта
>>> vanadium.fit(modelPVoigt(q))
# для чистого D2O, модели с калиброванной шириной линии
# для разных температур включен в nPDyn
>>> buffer.fit(modelCalibratedD2O(q, temp=363))
# Здесь уравнение 3 используется для жидких образцов
# свертка с функцией разрешения и добавлением
# Фон D2O выполняется автоматически с предоставленными аргументами #
>>> sample.fit(modelProteinJumpDiff(q),
... res=ванадий,
... bkgd=буфер,
... volume_fraction_bkgd=0,95
... )
- Проанализируйте данные E/IFWS с помощью обобщенного MSD40 или рассматривая их как грубые спектры QENS (имея только несколько точек данных на оси энергии). Когда E/IFWS рассматривается как грубая QENS, модели, используемые для QENS, используются для одновременной подгонки всего набора данных E/IFWS (глобальное соответствие передач энергии и передач импульса).
- Постройте график подогнанных данных, используя:
>>> из графика импорта nPDyn.plot
>>> сюжет (образец)
Access restricted. Please log in or start a trial to view this content.
Результаты
Агрегацию лизоцима в твердые частицы проводили при 90 ° C с концентрацией белка 50 мг / мл в дейтерированном буфере (0,1 М NaCl при pD 10,5). Образование твердых частиц вызывается повышением температуры до 90 °C и происходит в течение 6 часов (дополнительный рисунок S8). Сбор данных проводилс...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Нейтронная спектроскопия является единственным методом, позволяющим зондировать усредненную по ансамблю ps-ns динамику образцов белка независимо от размера белка или сложности раствора при использовании дейтерации6. В частности, исследуя самодиффузию белковых сборок в ра...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликтов интересов, которые необходимо раскрывать.
Благодарности
Авторы выражают благодарность Микаэле Зампони из Центра нейтронной науки им. Юлиха в центре им. Хайнца Майера-Лейбница, Гархинг, Германия, за часть экспериментов по рассеянию нейтронов, проведенных на приборе SPHERES. Эта работа опиралась на деятельность консорциума Лаборатории дейтерации (DLAB), финансируемого Европейским союзом по контрактам HPRI-2001-50065 и RII3-CT-2003-505925, а также на деятельность, финансируемую Исследовательским советом по инженерным и физическим наукам Соединенного Королевства (EPSRC) в рамках Института Лауэ Ланжевена EMBL DLAB в рамках грантов GR/R99393/01 и EP/C015452/1. Признана поддержка со стороны Европейской комиссии в рамках 7-й Рамочной программы в рамках Ключевого действия: укрепление европейского исследовательского пространства, исследовательских инфраструктур [Контракт 226507 (NMI3)]. Кевин Пуно и Кристиан Бек благодарят Федеральное министерство образования и научных исследований (BMBF, грант No 05K19VTB) за финансирование их постдокторских стипендий.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Aluminum sample holder | Not commercially available. Either the local contact on the instrument can provide them or they can be manufactured based on a technical drawing that can be provided by the local contact. | ||
| Deuterium chloride, 35 wt. % in D2O, ≥99 atom % D | Sigma-Aldrich | 543047 | |
| Deuterium oxide (D, 99.9%) | Eurisotop | DLM-4DR-PK | |
| Dow Corning high-vacuum silicone grease | Sigma-Aldrich | Z273554-1EA | |
| Ethanol 96%, EMSURE Reag. Ph Eur | Sigma-Aldrich | 1.5901 | |
| Glass dessicator | VWR | 75871-660 | |
| Glass dessicator plate, 140 mm | VWR | 89038-068 | |
| Indium wire, 1.0 mm (0.04 in) dia, Puratronic, 99.999% | Alfa Aesar | 00470.G1 | |
| Lysozyme from chicken egg white dialyzed, lyophilized, powder, ~100,000 U/mg | Sigma-Aldrich | 62970 | |
| nPDyn | v3.x | see github.com/kpounot/nPDyn, model functions fot fitting also included in the software | |
| OHAUS AX324 Adventurer balance, internal calibration | Dutscher | 92641 | |
| Phosphorus pentoxide, ReagentPlus, 99% | Sigma-Aldrich | 214701 | |
| Pipette ErgoOne 0.5-10 μL | Starlab | S7100-0510 | |
| Pipette ErgoOne 100-1,000 μL | Starlab | S7100-1000 | |
| Pipette ErgoOne 20-200 μL | Starlab | S7100-2200 | |
| Pipette tip TipOne 1,000 μL | Starlab | S1111-6001 | |
| Pipette tip TipOne 10 μL | Starlab | S1111-3200 | |
| Pipette tip TipOne 200 μL | Starlab | S1111-0206 | |
| Sodium deuteroxide solution, 40 wt. % in D2O, 99.5 atom % D | Sigma-Aldrich | 372072 |
Ссылки
- Jacrot, B. Des neutrons pour la science: Histoire de l'Institut Laue-Langevin. Des neutrons pour la science. EDP Sciences. , (2021).
- Mahieu, E., Gabel, F. Biological small-angle neutron scattering: recent results and development. Acta Crystallographica Section D. 74 (8), 715-726 (2018).
- Grimaldo, M., Roosen-Runge, F., Zhang, F., Schreiber, F., Seydel, T. Dynamics of proteins in solution. Quarterly Reviews of Biophysics. 52, 7(2019).
- Martel, A., et al. Membrane permeation versus amyloidogenicity: A multitechnique study of islet amyloid polypeptide interaction with model membranes. Journal of the American Chemical Society. 139 (1), 137-148 (2017).
- Pounot, K., et al. Tracking internal and global diffusive dynamics during protein aggregation by high-resolution neutron spectroscopy. The Journal of Physical Chemistry Letters. 11 (15), 6299-6304 (2020).
- Grimaldo, M., et al. Protein short-time diffusion in a naturally crowded environment. The Journal of Physical Chemistry Letters. 10 (8), 1709-1715 (2019).
- Jasnin, M., Stadler, A., Tehei, M., Zaccai, G. Specific cellular water dynamics observed in vivo by neutron scattering and NMR. Physical Chemistry Chemical Physics. 12 (35), 10154-10160 (2010).
- Frick, B. The neutron backscattering spectrometer IN16 at ILL-high energy resolution with high intensity and excellent signal-to-noise ratio. Neutron News. 13 (2), 15-22 (2002).
- Frick, B., Mamontov, E., van Eijck, L., Seydel, T. Recent backscattering instrument developments at the ILL and SNS. Zeitschrift für Physikalische Chemie. 224 (1-2), 33-60 (2010).
- Frick, B., Combet, J., van Eijck, L. New possibilities with inelastic fixed window scans and linear motor Doppler drives on high resolution neutron backscattering spectrometers. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 669, 7-13 (2012).
- Appel, M., Frick, B., Magerl, A. A flexible high speed pulse chopper system for an inverted neutron time-of-flight option on backscattering spectrometers. Scientific Reports. 8 (1), 13580(2018).
- Squires, G. L. Introduction to the theory of thermal neutron scattering. , Dover Publications. Mineola N.Y. (1996).
- Bee, M. Quasielastic neutron scattering. , Available from: http://inis.iaea.org/Search/search.aspx?orig_q=RN:20038756 (1988).
- Singwi, K. S., Sjölander, A. Diffusive motions in water and cold neutron scattering. Physical Review. 119 (3), 863-871 (1960).
- Sears, V. F. Theory of cold neutron scattering by homonuclear diatomic liquids: i. free rotation. Canadian Journal of Physics. 44 (6), 1279-1297 (1966).
- Sears, V. F. Theory of cold neutron scattering by homonuclear liquid: ii. hindered rotation. Canadian Journal of Physics. 44 (6), 1299-1311 (1966).
- Schirò, G., et al. Translational diffusion of hydration water correlates with functional motions in folded and intrinsically disordered proteins. Nature Communications. 6, 6490(2015).
- Grimaldo, M., et al. Hierarchical molecular dynamics of bovine serum albumin in concentrated aqueous solution below and above thermal denaturation. Physical Chemistry Chemical Physics. 17 (6), 4645-4655 (2015).
- Eanes, E. D., Glenner, G. G. X-ray diffraction studies on amyloid filaments. Journal of Histochemistry & Cytochemistry. 16 (11), 673-677 (1968).
- Bonar, L., Cohen, A. S., Skinner, M. M. Characterization of the Amyloid Fibril as a Cross-β Protein. Proceedings of the Society for Experimental Biology and Medicine. 131 (4), 1373-1375 (1969).
- Chiti, F., Dobson, C. M. Protein Misfolding, Amyloid Formation, and Human Disease: A Summary of Progress Over the Last Decade. Annual Review of Biochemistry. 86 (1), 27-68 (2017).
- Knowles, T. P. J., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nature Reviews Molecular Cell Biology. 15 (6), 384-396 (2014).
- Maji, S. K., et al. Functional amyloids as natural storage of peptide hormones in pituitary secretory granules. Science. 325 (5938), 328-332 (2009).
- Li, J., et al. The RIP1/RIP3 necrosome forms a functional amyloid signaling complex required for programmed necrosis. Cell. 150 (2), 339-350 (2012).
- Knowles, T. P. J., Mezzenga, R. Amyloid fibrils as building blocks for natural and artificial functional materials. Advanced Materials. 28 (31), 6546-6561 (2016).
- Stephens, A. D., Kaminski Schierle, G. S. The role of water in amyloid aggregation kinetics. Current Opinion in Structural Biology. 58, 115-123 (2019).
- Adamcik, J., Mezzenga, R. Amyloid polymorphism in the protein folding and aggregation energy landscape. Angewandte Chemie International Edition. 57 (28), 8370-8382 (2018).
- Liu, Z., et al. Entropic contribution to enhanced thermal stability in the thermostable P450 CYP119. Proceedings of the National Academy of Sciences of the United States of America. 115 (43), 10049-10058 (2018).
- Coquelle, N., et al. Chromophore twisting in the excited state of a photoswitchable fluorescent protein captured by time-resolved serial femtosecond crystallography. Nature Chemistry. 10 (1), 31-37 (2018).
- Henzler-Wildman, K. A., et al. A hierarchy of timescales in protein dynamics is linked to enzyme catalysis. Nature. 450 (7171), 913-916 (2007).
- Fichou, Y., et al. Hydration water mobility is enhanced around tau amyloid fibers. Proceedings of the National Academy of Sciences of the United States of America. 112 (20), 6365-6370 (2015).
- Burns, J., Pennock, C. A., Stoward, P. J. The specificity of the staining of amyloid deposits with thioflavine T. The Journal of Pathology and Bacteriology. 94 (2), 337-344 (1967).
- Iqbal, K., Liu, F., Gong, C. -X., Grundke-Iqbal, I. Tau in Alzheimer disease and related tauopathies. Current Alzheimer Research. 7 (8), 656-664 (2010).
- Krȩżel, A., Bal, W. A formula for correlating pKa values determined in D2O and H2O. Journal of Inorganic Biochemistry. 98 (1), 161-166 (2004).
- Dolman, M., Halling, P. J., Moore, B. D., Waldron, S. How dry are anhydrous enzymes? Measurement of residual and buried 18O-labeled water molecules using mass spectrometry. Biopolymers. 41 (3), 313-321 (1997).
- Pounot, K. kpounotnPDyn: v3.0.0. Zenodo. , (2021).
- Yi, Z., Miao, Y., Baudry, J., Jain, N., Smith, J. C. Derivation of mean-square displacements for protein dynamics from elastic incoherent neutron scattering. Journal of Physical Chemistry B. 116 (16), 5028-5036 (2012).
- Peters, J., Kneller, G. R. Motional heterogeneity in human acetylcholinesterase revealed by a non-Gaussian model for elastic incoherent neutron scattering. The Journal of Chemical Physics. 139 (16), 165102(2013).
- Zeller, D., Telling, M. T. F., Zamponi, M., García Sakai, V., Peters, J. Analysis of elastic incoherent neutron scattering data beyond the Gaussian approximation. The Journal of Chemical Physics. 149 (23), 234908(2018).
- Roosen-Runge, F., Seydel, T. A generalized mean-squared displacement from inelastic fixed window scans of incoherent neutron scattering as a model-free indicator of anomalous diffusion confinement. EPJ Web of Conferences. 83, 02015(2015).
- Ortega, A., Amorós, D., García de la Torre, J. Prediction of hydrodynamic and other solution properties of rigid proteins from atomic- and residue-level models. Biophysical Journal. 101 (4), 892-898 (2011).
- Hennig, M., Frick, B., Seydel, T. IUCr Optimum velocity of a phase-space transformer for cold-neutron backscattering spectroscopy. Journal of Applied Crystallography. 44 (3), 467-472 (2011).
- Paalman, H. H., Pings, C. J. Numerical evaluation of X-ray absorption factors for cylindrical samples and annular sample cells. Journal of Applied Physics. 33 (8), 2635-2639 (1962).
- Ow, S. -Y., Dunstan, D. E. The effect of concentration, temperature and stirring on hen egg white lysozyme amyloid formation. Soft Matter. 9 (40), 9692-9701 (2013).
- Tominaga, T., Sahara, M., Kawakita, Y., Nakagawa, H., Yamada, T. Evaluation of sample cell materials for aqueous solutions used in quasi-elastic neutron scattering measurements. Journal of Applied Crystallography. 54 (6), 1631-1640 (2021).
- Beck, C., et al. Following protein dynamics in real time during crystallization. Crystal Growth & Design. 19 (12), 7036-7045 (2019).
- Smith, A. A., Testori, E., Cadalbert, R., Meier, B. H., Ernst, M. Characterization of fibril dynamics on three timescales by solid-state NMR. Journal of Biomolecular NMR. 65 (3-4), 171-191 (2016).
- Wang, T., Jo, H., DeGrado, W. F., Hong, M. Water distribution, dynamics, and interactions with Alzheimer's β-amyloid fibrils investigated by solid-state NMR. Journal of the American Chemical Society. 139 (17), 6242-6252 (2017).
- Rezaei-Ghaleh, N., Giller, K., Becker, S., Zweckstetter, M. Effect of zinc dinding on β-amyloid structure and dynamics: Implications for Aβ aggregation. Biophysical Journal. 101 (5), 1202-1211 (2011).
- Vugmeyster, L., et al. Fast motions of key methyl groups in amyloid-β fibrils. Biophysical Journal. 111 (10), 2135-2148 (2016).
- Yang, X., Wang, B., Hoop, C. L., Williams, J. K., Baum, J. NMR unveils an N-terminal interaction interface on acetylated-α-synuclein monomers for recruitment to fibrils. Proceedings of the National Academy of Sciences of the United States of America. 118 (18), (2021).
- Tuttle, M. D., et al. Solid-state NMR structure of a pathogenic fibril of full-length human α-synuclein. Nature Structural & Molecular Biology. 23 (5), 409-415 (2016).
- Karamanos, T. K., Kalverda, A. P., Thompson, G. S., Radford, S. E. Mechanisms of amyloid formation revealed by solution NMR. Progress in Nuclear Magnetic Resonance Spectroscopy. 88-89, 86-104 (2015).
- Lai, Y. -C., Kuo, Y. -H., Chiang, Y. -W. Identifying protein conformational dynamics using spin-label ESR. Chemistry - An Asian Journal. 14 (22), 3981-3991 (2019).
- Franck, J. M., Han, S. Overhauser dynamic nuclear polarization for the study of hydration dynamics, explained. Methods in Enzymology. 615, 131-175 (2019).
- Pavlova, A., et al. Protein structural and surface water rearrangement constitute major events in the earliest aggregation stages of tau. Proceedings of the National Academy of Sciences of the United States of America. 113 (2), 127-136 (2016).
- Lin, Y., et al. Liquid-liquid phase separation of tau driven by hydrophobic interaction facilitates fibrillization of tau. bioRxiv. , (2020).
- Decatur, S. M. Elucidation of residue-level structure and dynamics of polypeptides via isotope-edited infrared spectroscopy. Accounts of Chemical Research. 39 (3), 169-175 (2006).
- Chatani, E., Tsuchisaka, Y., Masuda, Y., Water Tsenkova, R. molecular system dynamics associated with amyloidogenic nucleation as revealed by real time near infrared spectroscopy and aquaphotomics. PLoS One. 9 (7), 101997(2014).
- Goret, G., Aoun, B., Pellegrini, E. MDANSE: An interactive analysis environment for molecular dynamics simulations. Journal of Chemical Information and Modeling. 57 (1), 1-5 (2017).
- Fujiwara, S., et al. Internal dynamics of a protein that forms the amyloid fibrils observed by neutron scattering. Journal of the Physical Society of Japan. 82, Suppl A (2013).
- Schiró, G., et al. Neutron scattering reveals enhanced protein dynamics in concanavalin a amyloid fibrils. Journal of Physical Chemistry Letters. 3 (8), 992-996 (2012).
- Pounot, K., et al. Zinc determines dynamical properties and aggregation kinetics of human insulin. Biophysical Journal. 120 (5), 886-898 (2021).
- Fujiwara, S., et al. Dynamic properties of human α-synuclein related to propensity to amyloid fibril formation. Journal of Molecular Biology. 431 (17), 3229-3245 (2019).
- Sanz, A., et al. High-pressure cell for simultaneous dielectric and neutron spectroscopy. Review of Scientific Instruments. 89 (2), 023904(2018).
- Adams, M. A., et al. Simultaneous neutron scattering and Raman scattering. Applied Spectroscopy. 63 (7), 727-732 (2009).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены