Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Анализ формы линии динамических спектров ЯМР для характеристики перегруппировок координационных сфер в комплексе полигидрида хирального рения
В этой статье
Резюме
Анализ формы линии спектров ЯМР, собранных в диапазоне температур, служит руководством для перегруппировки атомов внутренней координационной сферы в хиральном восьмикоординатном полигидридном комплексе рения(V), ReH5(PPh3)2(сек-бутиламин). Анализ формы линии также используется для определения параметров активации ΔH‡, ΔS‡и ΔG‡ для этих перестроек атомов.
Аннотация
Спектроскопия ядерного магнитного резонанса (ЯМР) динамического решения является типичным методом характеристики динамических перегруппировок атомов в пределах координационной сферы для полигидридных комплексов переходных металлов. Подгонка формы линии динамических спектров ЯМР может привести к оценке параметров активации процессов динамической перестройки. Комбинация динамической 31P-{1H} ЯМР-спектроскопии связанных с металлом атомов фосфора с динамической ЯМР-спектроскопией 1H-{31P} гидридных лигандов может идентифицировать перегруппировки гидридных лигандов, которые происходят в сочетании с перегруппировкой атомов фосфора. Для молекул, которые демонстрируют такую связанную пару перестроек, динамическая ЯМР-спектроскопия может быть использована для проверки теоретических моделей перегруппировок лигандов. Динамическая 1H-{31P} ЯМР-спектроскопия и подгонка формы линии также могут идентифицировать наличие обменного процесса, который перемещает определенный гидридный лиганд за пределы внутренней координационной сферы металла через протонный обмен с молекулой растворителя, такой как адвентивная вода. Представлено получение нового соединения ReH5(PPh3)2(сек-бутиламина), которое иллюстрирует множественные процессы динамической перестройки, наряду с подгонкой формы линии динамических ЯМР-спектров комплекса. Результаты подгонки формы линии могут быть проанализированы с помощью уравнения Айринга для оценки параметров активации для идентифицированных динамических процессов.
Введение
ЯМР-спектроскопия обычно используется для характеристики динамических процессов, которые происходят внутри или между молекулами. Для многих простых внутримолекулярных перестроек оценка ΔG‡ так же проста, как измерение разности частот, Δν, между двумя резонансами на пределе медленного обмена и определение температуры слияния для этих же резонансов (рисунок 1)1. Отношения,
ΔG‡ = 4,575 x 10-3 ккал/моль x Tc [9,972 + log (Tc/Δν)]
где Tc — температура коалесценции для пары резонансов, представляющих собой форму медленного обмена динамического образца, может быть использована для решения для свободной энергии активации для такой динамической перестройки. Более сложные динамические системы требуют подгонки формы линии динамических спектров ЯМР или другого метода ЯМР, такого как двумерная спектроскопия обмена (2D-EXSY) или двумерная спектроскопия эффекта Вращающегося кадра Оверхаузера (2D-ROESY) для оценки параметров активации.
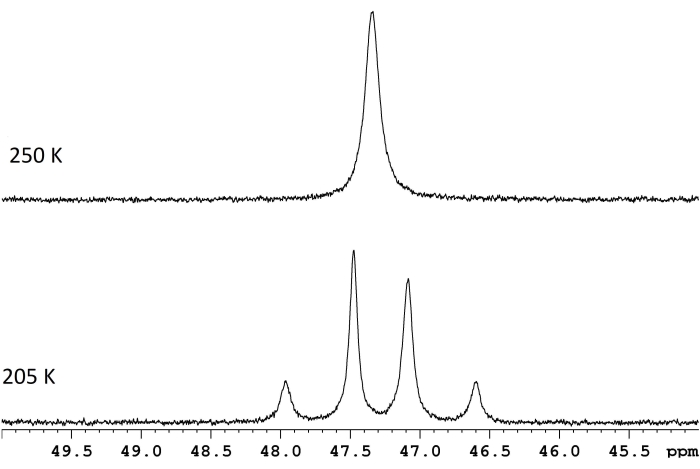
Рисунок 1: Спектры ЯМР для раствора d 8-толуола ReH5(PPh3)2 (сек-бутиламина) при двух температурах. Разность частот между двумя дублетами медленного обмена (нижняя трассировка, 117,8 Гц) и температурой слияния 250 К (верхняя трасса) соответствует энергетическому барьеру (ΔG‡) 11,8 ккал/моль. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Подгонка формы линии динамических спектров ЯМР является распространенным методом, который уже давно используется для оценки параметров активации, описывающих динамические перестановки для веществ с энергией активации приблизительно от 5 до 25 ккал/моль 2,3,4,5. Определение энергетических барьеров для протонного обмена между молекулами воды и аминов6, энергетического барьера для вращения вокруг связи C-N в диметилформамиде7 или общего размера органических фрагментов8 являются лишь несколькими примерами многих свойств, которые были оценены путем подгонки формы линии динамических спектров ЯМР. В данной рукописи демонстрируется использование подгонки формы линии для характеристики межмолекулярных и внутримолекулярных динамических процессов, происходящих для комплекса ReH5(PPh3)2(сек-бутиламина). Целями этого и аналогичных экспериментов по подгонке линий ЯМР являются: 1) характеристика всех наблюдаемых внутримолекулярных динамических процессов обмена атомами ЯМР, если они присутствуют, 2) идентификация и характеристика наблюдаемых ЯМР внутримолекулярных динамических процессов обмена атомов, если они присутствуют, 3) идентификация коррелированных внутримолекулярных атомных обменов, которые происходят в этом примере как для атомов водорода, так и для фосфора, и 4) для примера, представленного здесь, сравнить две опубликованные модели динамических процессов, происходящих в комплексе ReH5(PPh3)2(сек-бутиламина).
Восьмикоординатные полигидридные системы рения(V) представляют собой сложные динамические системы, в которых лиганды участвуют в множественных динамических процессах, а атомы фосфора могут участвовать в одном динамическом процессе, который является вторым аспектом процесса обмена гидридных лигандов 9,10,11,12,13,14,15,16,17,18 ,19,20,21,22,23,24,25,26,
27,28,29. Восьмикоординатные, псевдододекаэдрические, рений(V) полигидридные комплексы принимают молекулярную геометрию (рис. 2), которую можно описать как пару ортогональных трапеций лигандов17,26. Вершины на длинных краях трапеций обычно маркируются как B-сайты и в полигидридных комплексах рения обычно являются участками, занятыми нейтральными двухэлектронными донорскими лигандами, такими как третичные фосфины или аминные лиганды. Вершины на коротких краях трапеций обычно обозначаются как участки А и обычно заняты анионными, двухэлектронными донорными гидридными лигандами. Спектры ЯМР при комнатной температуре полигидридных комплексов рения(V), как правило, обманчиво просты из-за нескольких динамических процессов, которые происходят в растворах с комнатной температурой.
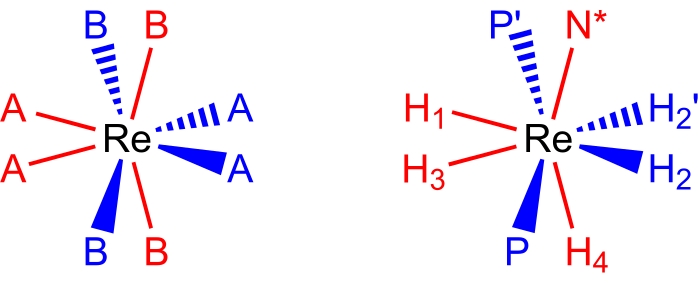
Рисунок 2: Додекаэдрический координационный набор (слева) и комплекс ReH5(PPh3)2 (сек-бутиламин) с той же точки зрения (справа). Участки красного цвета представляют координационные участки, которые образуют вертикальную трапецию, а сайты синего цвета представляют координационные участки, которые образуют горизонтальную трапецию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Комплексы формы ReH5(PPh3)2(амин) являются наиболее тщательно изученным классом полигидридных комплексов рения по отношению к динамическим процессам 9,10,12,13,16,30,31. Для комплексов ReH5(PPh3)2(аминов) были идентифицированы три динамических процесса (фиг.3):1) протонный обмен между единственным гидридным лигандом сайта В и протоном из молекулы воды (случайный или преднамеренный)9,13, 2) турникетный обмен пары гидридных лигандов сайта А с соседним гидридным лигандомсайта В 9, 11,13,30,31 и 3) стерическая инверсия (или псевдоротация), которая проявляется в виде попарного обмена лигандов гидрида сайта А и попарного перемещения атомов сайта В к противоположной стороне центра рения (как показано на рисунке 4)4,5,6,8,26,27 . Движение атомов сайта В на противоположную сторону рения наблюдается динамической ЯМР-спектроскопией как: 1) процесс, делающий неэквивалентные 3 и 5 протонов N = пиридиновым эквивалентом при комнатной температуре 10,30,31,2) процесс, заставляющий изомеры E и Z N = несимметрично замещенные ароматические аминные лиганды подвергаться быстрому обмену при комнатной температуре 9, 10,13,30,31 или 3) процесс, вызывающий быстрый обмен стерическими перспективами диастереотопической пары атомов фосфора относительно хирального центра, расположенного на аминном лиганде 9,30,31. Ранее не сообщавшийся хиральный комплекс ReH5(PPh3)2(сек-бутиламин) дает возможность в целом описать методы, которые могут быть использованы для идентификации и характеристики динамических перегруппировок полигидридных комплексов рения.
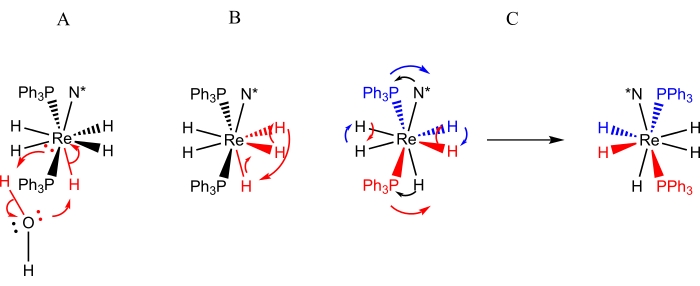
Рисунок 3: Представления динамических процессов, наблюдаемых с помощью ЯМР-спектроскопии для растворов ReH5(PPh3)2(сек-бутиламина). Представление А изображает обмен одного протона случайной воды на уникальный гидридный лиганд B-сайта. На представлении В изображен турникетный обмен трех соседних гидридных лигандов, два из которых находятся на участке А, а третий является уникальным гидридным лигандом участка В. Представление C изображает как парный обмен лигандов гидрида А, так и стерическую инверсию атомов фосфора по отношению к хиральному аминному лиганду (N*). Следует отметить, что попарный обмен гидридных лигандов сайта А не требует смещения гидридных лигандов сайта А на противоположную сторону центра рения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Для химических систем, таких как полигидридные комплексы рения, которые демонстрируют сложный набор динамических процессов, подгонка формы линии динамических спектров ЯМР является наиболее используемым методом ЯМР для характеристики процессов 9,11,13,16,21,29. Двумерные EXSY 9,32 или 2D-ROESY11 являются альтернативными динамическими методами ЯМР, которые также могут быть использованы для количественной характеристики динамических процессов. Двумерные спектры EXSY обычно измеряются в области медленной обменной температуры; двумерные спектры ROESY обычно измеряются в области быстрой обменной температуры. Оба двумерных метода могут потребовать значительного времени в спектрометре для сбора данных, поскольку каждый из методов получает гораздо больший набор данных при заданной температуре, чем одномерные наборы данных, необходимые для анализа подгонки формы линии. Простые динамические процессы, которые хорошо изучены, такие как динамический обмен двумя метильными группами диметилформамида, могут быть легко охарактеризованы любым из трех методов ЯМР. Более сложные системы, такие как ReH5(PPh3)2 (сек-бутиламин), в которых отдельные гидридные лиганды участвуют в множественных динамических процессах, или системы, которые не обязательно хорошо изучены, такие как новый полигидридный комплекс переходного металла, который может или не может обмениваться протонами между гидридным лигандом и адвентитивной водой, легче количественно характеризуются методом ЯМР подгонки формы линии, чем двумерными методами ЯМР. В отличие от двумерных методов ЯМР, метод подгонки формы линии обеспечивает легко интерпретируемую визуализацию соответствия между тестируемой моделью и экспериментальными данными, а также визуальные доказательства обмена, который перемещает гидридный лиганд за пределы внутренней координационной сферы рения. Основываясь на пиковых высотах и пиковых формах в спектрах медленного обмена, даже сложная динамическая система, такая как ReH5 (PPh3) 2 (сек-бутиламин), может привести к легко проверяемому первоначальному набору моделей обмена. Кроме того, когда было сообщено о нескольких теоретических моделях для молекулярного преобразования, соответствие формы линии динамических спектров ЯМР может позволить визуально сравнить каждую модель с наблюдаемыми спектрами.
Помимо трех методов ЯМР, упомянутых выше, эксперименты изотопного замещения ЯМР с участием D2O или HD были использованы для качественной демонстрации межмолекулярного обмена атомов для сложных полигидридных систем рения, но не использовались для количественных характеристик 9,33,34,35. Теоретические расчеты представляют дополнительный метод характеристики динамических процессов сложных динамических систем 30,31,36. Теоретические расчеты имеют преимущество перед подгонкой формы линии в том, что они могут быть использованы для дифференциации возможностей, которые не могут быть различимы при анализе подгонки формы линии. Например, теоретические расчеты были использованы для описания обмена, который включает три смежных гидридных лиганда на определенных комплексах рения(V) в качестве турникетного обмена всех трех гидридных лигандов, а не чередующуюся пару попарных обменов с каждым попарным обменом, включая уникальный гидридный лиганд и один из двух химически эквивалентных гидридных лигандов30, 31. Результаты теоретических расчетов обычно сравнивают с экспериментально наблюдаемыми количественными характеристиками одного из трех методов ЯМР, упомянутых выше, в качестве проверки достоверности рассчитанных результатов.
Подгонка формы линии динамических спектров ЯМР использует преимущества изменения внешнего вида спектров ЯМР, которое происходит, когда ЯМР-активные ядра перемещаются между различными химическими средами во время измерения ЯМР. Спектры ЯМР с медленным обменом (спектры с независимыми лоренциановыми резонансами для каждого набора обменивающихся ядер) возникают при температурах, где разность частот между резонансами для ядер, которые обмениваются, велика по сравнению со скоростью обмена ядер37. Спектры ЯМР с быстрым обменом (спектры с одним лоренцевым резонансом для обмена ядрами) возникают при температурах, где скорость обмена ядер намного больше, чем разность частот между медленными обменными резонансами37. Промежуточные обменные курсы возникают для температур между областью медленной обменной температуры и областью быстрой обменной температуры37. Если известны фундаментальные параметры частоты Лармора, химического сдвига обменивающихся ядер, констант связи (если таковые имеются) для обменивающихся ядер и относительных популяций каждого типа ядра, константы скорости для предполагаемых обменов между ядрами могут быть определены путем сравнения смоделированных спектров с наблюдаемыми спектрами при нескольких промежуточных температурах. Хорошие приспособления для моделирования при нескольких температурах приводят к получению постоянных данных о температуре и скорости, которые могут быть использованы с уравнением Айринга для оценки параметров активации для предполагаемого обмена (обменов). Результаты метода оказались точными и воспроизводимыми.
протокол
1. Пробоподготовка
- Приготовление ReH7(PPh3)235
- Смешайте 0,15 г боргидрида натрия и 0,41 г ReOCl3(PPh3)2 в колбе с круглым дном объемом 100 мл емкостью 100 мл, оснащенной резиновой перегородкой и газовым портом, или в колбе Kjeldahl объемом 100 мл (с газовым портом бокового рычага), оснащенной резиновой перегородкой (дополнительный рисунок 1).
- Добавьте отжимной стержень в реакционный сосуд.
- В вытяжном вытяжке используйте кусок резиновой напорной трубки для соединения газового отверстия реакционного сосуда с одним из запорных кранов двойного стеклянного коллектора для вакуума и газообразного азота. Подключите стеклянный вакуумный коллектор к вакуумному насосу с резиновой напорной трубкой и подключите стеклянный азотный коллектор к баллону с регулируемым газообразным азотом.
- Подключите выходной газ из азотного газового коллектора к запорному крану, который можно использовать для направления вентилируемого газа через столб минерального масла размером 2 см или столб ртути размером 2 см.
- Откройте кран на азотном баллоне и отрегулируйте давление на протекающий газ до 34 фунтов на квадратный дюйм. Выпустите поток газообразного азота через ртутный пузырь.
- Откачивайте газ внутрь реакционного сосуда, регулируя запорный кран на стеклянном коллекторе для подключения сосуда к вакуумному коллектору. Наполните реакционный сосуд газообразным азотом, изменив стеклянный запорный кран коллектора таким образом, чтобы он соединял газовый коллектор с реакционным сосудом.
- Повторите шаги 1.1.5 и 1.1.6 еще два раза, чтобы полностью заменить воздух в реакционном сосуде газообразным азотом. Охладите колбу и ее содержимое в ледяной ванне.
- Добавьте 8 мл дезоксигенированной воды и 8 мл дезоксигенированного тетрагидрофурана к твердым веществам в реакционном сосуде через шприц. Переключите газоотводящий запорный кран так, чтобы газ выходил через барботер минерального масла. Слегка перемешайте суспензию в ледяной ванне в течение 15 мин. Извлеките реакционный сосуд из ледяной ванны после первых 15 минут перемешивания.
- Дайте смеси продолжать помешивать еще 45 минут. Обратите внимание на цвет реакционной смеси как индикатор того, когда реакция завершилась. Цвет реакционной смеси от коричневого до оранжевого цвета (дополнительный рисунок 1) указывает на то, что реакция достигла своей конечной точки.
- После получения оранжево-коричневого цвета для реакционной смеси фильтруйте смесь через 30 мл средней спеченной стеклянной воронки. Промыть восстановленное твердое вещество три раза каждый с порциями воды, метанола и этилового эфира по 15 мл. Высушите твердое вещество под вакуумом, чтобы удалить любой адсорбированный растворитель.
ПРИМЕЧАНИЕ: Реакция обычно производит от 0,20 г до 0,25 г продукта.
- Получение ReH5(PPh3)2(сек-бутиламина)
- Взвесьте 0,070 г ReH7(PPh3)2 и переложите его в 50 мл одногорловую колбу с круглым дном, содержащую отжимной стержень. Установите колбу на конденсатор, оснащенный газовым отверстием. Дезоксигенировать реакционный сосуд с помощью насосного и заправочного метода из этапов 1.1.3-1.1.7.
- Добавьте объем 8 мл дезоксигенированного тетрагидрофурана в реакционный сосуд через шприц, растрескивая соединение между колбой с круглым дном и конденсатором. Добавьте объем 0,2 мл сек-бутиламина аналогичным образом. Переключите газоотводящий запорный кран так, чтобы газ выходил на барботер минерального масла.
- Нагревание реакционной смеси до рефлюкса при 65 °C с нагревательной мантией, подключенной к переменному трансформатору переменного тока, установленной на 40 по шкале от 0 до 140 в течение 40 мин. Охладите реакционную смесь до температуры, которая обеспечивает удобное обращение с колбой.
- Перелейте реакционную смесь в 25 мл метанола в колбе Эрленмейера объемом 125 мл. Энергично перемешайте смесь в течение 5 мин. Добавьте 5 мл воды, чтобы вызвать образование флокулянтного желтого осадка.
- Соберите желтый осадок вакуумной фильтрацией в спеченной стеклянной воронке. Вымойте твердое вещество 15 мл метанола. Высушите твердое вещество под вакуумом. После этого процесса типичный выход продукта составляет 0,035 г.
2. Получение и анализ спектров ЯМР
- Измерение динамических спектров ЯМР
- Готовят образец ЯМР с приблизительно 8 мг комплекса ReH5(PPh3)2(сек-бутиламина) примерно в 0,8 мл d8-толуола. Вставьте образец в инструмент.
- Перейдите на вкладку Файл и выберите Создать из вариантов, которые появятся, чтобы открыть диалоговое окно, используемое для построения эксперимента ЯМР.
- Создайте эксперимент 1H, выполнив следующие действия.
- Назначьте имя папки для нового эксперимента, заполнив поле Ввода Имя уникальным именем файла. Назначьте номер эксперимента, например 1 для эксперимента 1H, в поле EXPNO .
- Присвойте эксперименту номер процесса 1 в поле PROCNO . Назначьте папку каталогу с помощью раскрывающегося списка DIR. Определите растворитель, который будет фиксировать инструмент, из раскрывающегося списка Варианты растворителя .
- Выберите каталог, содержащий параметры эксперимента 1H, из раскрывающегося списка каталогов в Experiment Dirs. Выберите эксперимент «Протон » из вариантов в раскрывающемся списке «Эксперимент» и (необязательно) добавьте заголовок для данных в поле Заполнитель «Заголовок ».
- Введите команду Eda в командной строке и настройте параметры в соответствии с описаниями эксперимента, приведенными во втором абзаце раздела «Обсуждение» ниже.
- Перейдите на вкладку Окно, выберите Новое окно из списка и повторите шаги 2.1.3.1-2.1.3.8, чтобы подготовить эксперимент 1H-{31P}, используя значение EXPNO 2, чтобы отличить эксперимент от эксперимента 1H, построенного ранее.
- Перейдите на вкладку Окно, выберите Новое окно из списка и повторите шаги 2.1.3.1-2.1.3.8, чтобы подготовить эксперимент 31P-{1H}, используя значение EXPNO 3, чтобы отличить эксперимент от экспериментов 1H и 1H-{31P}, построенных ранее (см. Дополнительную таблицу 1 для получения подробной информации о параметрах).
- Введите команду Lock в командной строке и выберите из списка вариант d 8-toluene. Нажмите кнопку ОК, чтобы принять решение о выборе растворителя. Введите команду Atma в командной строке, если это необходимо, из-за переменного ядра зонда X-диапазона, чтобы минимизировать отраженную энергию на частотах Лармора в течение 1H и 31P на приборе.
- Введите команду Ro в командной строке, введите в поле значение 20 и нажмите кнопку Начать поворот . Введите команду Shim в командной строке. Выберите подходящую процедуру автошима, например Topshim , из списка процедур прокладки и нажмите кнопку Пуск .
- Введите команду Rga в командной строке. Выберите параметр Автоматическая настройка приемника и нажмите кнопку ОК. В свою очередь, измерьте три спектра образца при комнатной температуре, используя 64 сканирования для каждого спектра с помощью команды Go в командной строке.
- Преобразуйте данные из эксперимента в спектр с помощью команды Efp , введенной в командной строке.
- Отрегулируйте фазирование спектра с помощью следующих команд.
- Перейдите на вкладку Фаза , а затем нажмите на вкладку Настроить фазу . Наведите курсор на кнопку 0 на панели инструментов фазирования и удерживайте левую кнопку мыши вниз, чтобы кнопка 0 стала зеленой.
- Удерживая левую кнопку мыши, переведите мышь вперед или назад, пока базовая линия не станет плоской по всему спектру, и все резонансы не будут отображаться в виде поглощений (пики поднимаются выше базовой линии).
- Если базовую линию нельзя сделать плоской только с помощью кнопки 0, отрегулируйте кнопку 1, как описано в шагах 2.1.10.1 и 2.1.10.2, а также кнопку 0, пока базовая линия не станет плоской для всего спектрального окна.
- Сохраните настройку фазы вместе с данными, нажав кнопку Сохранить и вернуть на панели инструментов фазирования.
- Отрегулируйте количество сканирований для каждого измерения по мере необходимости, основываясь на соотношении сигнал/шум в спектре, имея в виду, что сигнал-шум обычно уменьшается при более низких температурах из-за разъединения сигналов в отдельные резонансы (рисунок 4).
- Подготовьте спектрометр для контроля температуры в соответствии с инструкциями поставщика. Введите скорость потока 200 л/ч для охлаждающего газа и целевую температуру 290 К для зонда. Дайте спектрометру стабилизироваться при заданной температуре в течение 2 мин. Увеличьте расход охлаждающего газа, если это необходимо, до 210 или 220 л/ч для стабилизации температуры.
- Очистите образец при 290 К, как на шаге 2.1.7. Измените имя файла для каждого из ранее измеренных спектров, добавив температуру в конец имени файла (шаги 2.1.2 и 2.1.3.1) и получите набор из трех спектров при 290 К.
- Увеличьте расход охлаждающего газа на ≥ 30 л/ч, по мере необходимости для стабилизации при следующей температуре, и уменьшите целевую температуру на 10 К. Позвольте спектрометру стабилизироваться при следующей температуре в течение 2 мин, а затем проведите образец, как показано на этапе 2.1.7. Измерьте множество из трех спектров.
- Повторите шаги 2.1.13 и 2.1.14 по мере необходимости для получения спектров до минимальной желаемой температуры.
ПРИМЕЧАНИЕ: Температуры 200 К обычно достаточно для полного набора данных, пригодных для определения параметров активации динамических процессов образца. - Нагрейте образец обратно до комнатной температуры с шагом 10 К. Стабилизируйте температуру в течение 2 мин при каждой температуре, прежде чем снова нагревать образец, чтобы предотвратить повреждение стеклянного вкладыша зонда.
- Анализ формы линии измеряемых спектров
- В программе NMR нажмите на панель команд в левом верхнем углу окна и выберите Открыть в раскрывающемся меню. Выберите Открыть данные ЯМР, хранящиеся в стандартном формате. Нажмите кнопку ОК , чтобы открыть окно проводника для программы.
- Перейдите в папку для анализа данных по форме линии. Выберите номер файла, соответствующий анализируемому спектру, и нажмите кнопку Дисплей . Спектр (если он был предварительно обработан) или кривая свободного индукционного распада (FID) отображается в программном обеспечении ЯМР.
- При необходимости обработайте FID, введя в командной строке команду Efp (экспоненциальное умножение, преобразование Фурье и фазовая коррекция). Отрегулируйте фазу спектра (Шаг 2.1.10).
- Отрегулируйте базовую линию спектра; если он не плоский по всему спектру, то выровняйте его с линией 0-интенсивности, как показано ниже.
- Перейдите на вкладку Процесс и перейдите на вкладку Базовые показатели . Наведите курсор на кнопку A . Нажмите левую кнопку мыши и переведите мышь вперед или назад, чтобы выровнять красную линию регулировки с левым (нижним) концом спектра.
- Если базовая линия по-прежнему не совпадает с красной линией корректировки, повторите процесс с оставшимися буквенными кнопками, пока красная линия корректировки не упадет до базовой линии спектра. Используйте кнопку сохранения и возврата , чтобы сохранить корректировку, когда красная скорректированная базовая линия соответствует фактической базовой линии.
- Выберите вкладку Анализ в программном обеспечении ЯМР. В параметрах анализа выберите вариант «Линейные фигуры », а затем выбор «Динамические модели ЯМР подгонки ».
- Теперь спектр отображается в окне модуля подгонки формы линии. Используйте панели инструментов над спектром, чтобы настроить способ отображения спектра. Окно слева от спектра обрабатывает подгонку формы линии спектра.
- Отрегулируйте отображение спектра с помощью инструмента «Плавное масштабирование» таким образом, чтобы часть спектра, которая должна быть установлена, отображалась в окне спектра. Используйте кнопку Shift Spectrum Left и Right на панели инструментов, чтобы центрировать часть спектра в окне отображения.
- Откройте окно химического сдвига для подгонки формы линии, выбрав вкладку «Спектр» в окне «Подгонка формы линии».
- Нажмите на кнопку Изменить диапазон . Введите верхний и нижний химические сдвиги для подгонки формы линии и нажмите кнопку OK , чтобы принять эти ограничения.
- Запустите модель для подгонки формы линии, щелкнув вкладку Система вращения в окне подгонки фигуры линии. Нажмите кнопку Добавить , чтобы создать модель системы вращения.
- Снимите флажок LB (для расширения линии) и введите значение для расширения линии вручную с помощью мыши и кнопки LB на панели инструментов подгонки фигуры линии.
- Добавьте первое ядро в модель, щелкнув вкладку Nucleus , а затем нажав кнопку Добавить . Для Nucleus 1 появится набор значений по умолчанию. Отрегулируйте химический сдвиг для Nucleus 1, введя значение химического сдвига в поле Nu(iso) или с помощью инструмента химического сдвига на панели инструментов подгонки формы линии.
ПРИМЕЧАНИЕ: Если поле выбора оставить в отмеченной форме, химический сдвиг этого ядра будет варьироваться для достижения наилучшего соответствия. Неконтролируемые переменные не будут изменяться в процессе линейной установки. - Используйте поле Псевдоспин для ядра 1, чтобы ввести число эквивалентных ядер для ядра 1 с каждым спином 1/2 ядра, эквивалентным 0,5 при подсчете. Введите сумму спинов в поле Псевдоспин , чтобы учесть все эквивалентные ядра.
- Используйте поле In Molecule для размещения моделей, для участия которых в динамическом процессе требуется более одной молекулы. Назначайте резонансы, возникающие из разных молекул, к отдельным молекулам, используя обозначения, такие как 1, 2 и т. Д. Для разных молекул. Для резонансов, возникающих из одной молекулы, присвойте 1 для всех значений In Molecule .
- Добавьте второе и все последующие ядра в модель, перейдя на вкладку Ядро , а затем нажав на кнопку Добавить . Включите спин-спиновую связь между ядрами, либо введя связь в соответствующее поле JN (где N — ядро, с которым связано добавляемое ядро, N = 1, 2, ...), либо отрегулировав кнопку скалярной связи на панели инструментов подгонки формы линии.
- Начните процесс описания обмена атомами, нажав на вкладку Реакция . Установите флажок , если константа курса для обмена должна быть изменена в соответствии с формой линии. Введите количество обмениваемых ядер (число относительно их идентифицирующих вкладок, таких как Nucleus 1 и Nucleus 2) в поле Exchanges для первого обмена в модели.
- Опишите биржи, подлежащие тестированию, в полях под полем Обмены . Определите обмен между вкладками Nucleus в полях ниже. Обмен двумя ядрами будет введен как Ядро 1 к Ядру 2 и Ядро 2 к Ядру 1. Убедитесь, что обмены цикличны в том смысле, что если ядро перемещается из ядра 1, другое ядро должно быть перемещено в ядро 1.
- Используйте кнопку Скорость обмена на панели инструментов подгонки фигуры линии, чтобы изменить начальное значение k, чтобы итеративно настроить значение k, даже если для константы курса установлен флажок.
- Добавьте больше обменов в модель, нажав на вкладку Реакция , а затем нажав кнопку Добавить . При необходимости добавьте биржи в модель. Используйте инструменты на панели инструментов подгонки формы линии, чтобы настроить начальные переменные, включая интенсивность спектра, в соответствии с соответствием спектру.
- Начните итеративное подгонку формы линии, нажав кнопку «Начать подгонку спектра» на панели инструментов подгонки фигуры линии. Продолжайте итеративную подгонку до тех пор, пока не будет обнаружено никаких изменений в наилучшем перекрытии между спектром и моделью или пока не будет достигнуто 1000 итераций. Если подгонка останавливается на 1000 итерациях, продолжите дальнейшие итерации с помощью кнопки Start the Spectrum Fit . Спектр модели отображается с фактическим спектром для сравнения.
- Запишите наиболее подходящие значения из соответствующих вкладок. Сохраните наиболее подходящий спектр, щелкнув вкладку «Спектр» в окне подгонки формы линии, а затем нажав кнопку «Сохранить ».
ПРИМЕЧАНИЕ: Наиболее подходящий спектр будет сохранен в той же папке, которая использовалась для сбора данных. Наиболее подходящий спектр будет отличаться от исходных данных сохранением с другим номером обработки, который вводится при сохранении. - Сохраните модель, используемую для подгонки формы линии, щелкнув вкладку Main , а затем нажав кнопку Сохранить. Введите имя модели.
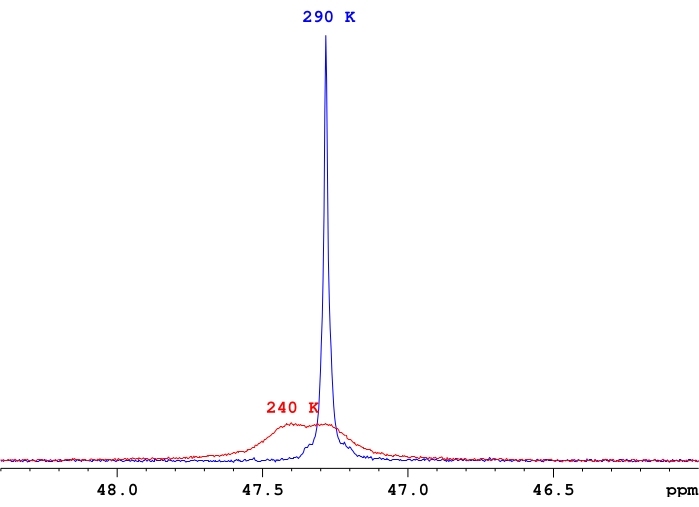
Рисунок 4: Сравнение интенсивности сигнала 31P-{1H} для одного образца ReH5(PPh3)2 (сек-бутиламина) вd8-толуоле. Репрезентативная демонстрация разницы в интенсивности сигнала между быстрым обменным одиночным фосфорным резонансом и парой фосфорных резонансов вблизи температуры слияния для этих резонансов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Определение параметров активации с участка Айринга 1
- Введите данные из подгонки формы линии для одного смоделированного динамического процесса в электронную таблицу с независимой переменной, введенной как 1/T, и зависимой переменной, введенной как ln(k/T).
- Вставьте точечную диаграмму данных в электронную таблицу. Добавьте линию тренда через данные. Используйте наклон и перехват линии тренда для решения для ΔH‡ и ΔS‡. Наклон трендовой линии -ΔH‡/R, а перехват трендовой линии – ΔS‡/R + 23,76.
- Решить для ΔG‡ при заданной температуре, используя соотношение
ΔG‡(T) = ΔH‡ - TΔS‡.
ПРИМЕЧАНИЕ: Для простого обмена двумя ядрами с резонансами, которые объединяются, проверка значений ΔH‡ и ΔS‡ может быть выполнена путем сравнения ΔG‡ , рассчитанного при температуре коалесценции, со значением ΔG‡ , которое возникает из медленной разности частот обмена между резонансами и температурой слияния.
Результаты
Характеристики обоих полигидридных продуктов рения, описанные в этой рукописи, лучше всего выполняются с помощью ЯМР-спектроскопии 1H-{31P} и 31P-{1H}. В растворе 6-бензола при комнатной температуре гидридный лигандный резонанс ReH7(PPh3)2 проявляется в ви...
Обсуждение
В приготовлении ReH7(PPh3)2 есть четыре элемента, которые могут повлиять на количество и чистоту производимого материала. Во-первых, использование ледяной ванны в течение первых 15 мин реакции важно для удаления тепла из реакции, которая происходит между боргидридом натрия...
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Авторы благодарят кафедру химии и физики и Программу грантов на творчество и исследования (Naik, Moehring) в Университете Монмута за финансовую поддержку этой работы.
Материалы
| Name | Company | Catalog Number | Comments |
| Bruker Avance II 400 MHz NMR spectrometer | Bruker Biospin | The instrument includes a two channel probe (1H and X) with the X channel tunable from 162 MHz to 10 Mhz. The instrument is also VT capable with a dewar and heat exchanger for VT work. | |
| d8-toluene | MilliporeSigma | 434388 | |
| Powerstat variable transformer | Powerstat | ||
| sec-butyl amine | MilliporeSigma | B89000 | |
| Sodium borohydride | MilliporeSigma | 452882 | |
| Tetrahydrofuran | MilliporeSigma | 186562 | |
| Thermowell C3AM 100 mL | Thermowell | ||
| Topspin 3.0 or 4.1.4 with dNMR | Bruker Biospin | Data was acquired with Topspin version 3.0 and data handling was performed on a second computer that was running Topspin version 4.1.4.. | |
| Trichlorooxobis(triphenylphosphine) rhenium(V) | MilliporeSigma | 370193 | |
| Vacuubrand PC3000 vacuum pump with a CVC 3000 controller | Vacuubrand |
Ссылки
- Zimmer, K. D., Shoemaker, R., Ruminski, R. R. Synthesis and characterization of a fluxional Re(I) carbonyl complex fac-[Re(CO)3(dpop')Cl] with the nominally tri-dentate ligand dipyrido(2,3-α:3',2'-j)phenazine (dpop). Inorganica Chimica Acta. 359 (5), 1478-1484 (2006).
- McGlinchey, M. J. Symmetry breaking in NMR spectroscopy: the elucidation of hidden molecular rearrangement processes. Symmetry. 6 (3), 622-654 (2014).
- Casarini, D., Luazzi, L., Mazzanti, A. Recent advances in stereodynamics and conformational analysis by dynamic NMR and theoretical calculations. European Journal of Organic Chemistry. 2010 (11), 2035 (2010).
- Palmer, A. G., Williams, J., McDermott, A. Nuclear magnetic resonance studies of biopolymer dynamics. Journal of Physical Chemistry. 100 (31), 13293-13310 (1996).
- Kern, D., Kern, G., Scherer, G., Fischer, G., Drakenberg, T. Kinetic analysis of cyclophilin-catalyzed prolyl cis/trans isomerization by dynamic NMR spectroscopy. Biochemistry. 34 (41), 13594-13602 (1995).
- Menger, F. M., Lynn, J. L. Fast proton transfer at a micelle surface. Journal of the American Chemical Society. 97 (4), 948-949 (1975).
- Pines, A., Rabinovitz, M. A nuclear magnetic resonance total line-shape treatment of internal rotation in dimethylformamide. Tetrahedron Letters. 9 (31), 3529-3532 (1968).
- Mancinelli, M., Bencivenni, G., Pecorari, D., Mazzanti, A. Stereochemistry and recent applications of axially chiral organic molecules. European Journal of Organic Chemistry. 2020 (27), 4070-4086 (2020).
- Streisel, D. J., et al. Fluxionality, substitution, and hydrogen exchange at eight-coordinate rhenium(V) polyhydride centers. Inorganica Chimica Acta. 496 (1), 119028 (2019).
- Jimenez, Y., Strepka, A. M., Borgohain, M. D., Hinojosa, P. A., Moehring, G. A. Ortho-metalation, rotational isomerization, and hydride-hydride coupling at rhenium(V) polyhydride complexes stabilized by aromatic amine ligands. Inorganica Chimica Acta. 362 (9), 3259-3266 (2009).
- Lee, J. C., Yao, W., Crabtree, R. H., Ruegger, H. Fluxionality in [ReH5(PPh3)2(pyridine)]. Inorganic Chemistry. 35 (3), 695-699 (1996).
- Patel, B. P., Kavallieratos, K., Crabtree, R. H. Effects of dihydrogen bonding on fluxionality in ReH5(PPh3)2L. Journal of Organometallic Chemistry. 528 (1), 205-207 (1997).
- Geetha, B., et al. Chiral amine ligands at rhenium(V) pentahydride complexes allow for characterization of an energetically accessible and reversible steric inversion of diastereotopic phosphorus atoms. Inorganica Chimica Acta. 531 (1), 120741 (2022).
- Paulo, A., Ascenso, J., Domingos, A., Galvao, A., Santos, I. Rhenium-(III) and -(V) hydride complexes with modified poly(pyrazolyl)borates. Journal of the Chemical Society, Dalton Transactions. 1999 (8), 1293-1300 (1999).
- Bianchini, C., et al. Synthesis and characterization of rhenium polyhydrides stabilized by the tripodal ligand MeC(CH2PPh2)3. Journal of Organometallic Chemistry. 451 (1), 97-106 (1993).
- Scorzelli, A. G., Macalush, B. E., Naik, D. V., Moehring, G. A. Comparative study of fluxional processes at two different classes of eight-coordinate rhenium(V) polyhydride complexes. Inorganica Chimica Acta. 516 (1), 120120 (2021).
- Luo, X. -. L., Crabtree, R. H. Synthesis and spectroscopic characterization of rhenium complexes ReH5(triphos)] and [ReH6(triphos)]+ [triphos = PPh(CH2CH2PPh2)2]. Journal of the Chemical Society. 1991 (5), 587-590 (1991).
- Kim, Y., Deng, H., Gallucci, J. C., Wojcicki, A. Rhenium polyhydride complexes containing PhP(CH2CH2CH2PCy2)2 (Cyttp): protonation, insertion, and ligand substitution reactions of ReH5(Cyttp) and structural characterization of ReH5(Cyttp) and [ReH4(η2-H2)(Cyttp)]SbF6. Inorganic Chemistry. 35 (24), 7166-7173 (1996).
- Bolano, S., et al. Synthesis, characterization, protonation studies and X-ray crystal structure of ReH5(PPh3)2(PTA) (PTA = 1,3,5-triaza-7-phosphaadamantane). Journal of Organometallic Chemistry. 691 (4), 629-637 (2006).
- Ginsberg, A. P., Abrahams, S. C., Jamieson, P. B. Nonrigid stereochemistry in eight-coordinate pentahydridorhenium complexes. Journal of the American Chemical Society. 95 (14), 4751-4752 (1973).
- Bolano, S., Bravo, J., Garcia-Fontan, S. Mono- and dinuclear rhenium polyhydride complexes bearing the chelating ligand 1,2-bis(dicyclohexylphosphinanyloxy)ethane. European Journal of Inorganic Chemistry. 2004 (24), 4812-4819 (2004).
- Leeaphon, M., Rohl, K., Thomas, R. J., Fanwick, P. E., Walton, R. A. Reactions of the polyhydride complex ReH7(PPh3)2 with quinoline, 2-hydroxyquinoline, and 2-mercaptoquinoline. The preparation and characterization of hydrido complexes of rhenium(V) and chloro complexes of rhenium(III). Inorganic Chemistry. 32 (24), 5562-5568 (1993).
- Mejia, E., Togni, A. Rhenium complexes containing the chiral tridentate ferrocenyl ligand pigiphos. Organometallics. 30 (17), 4765-4770 (2011).
- Moehring, G. A., Walton, R. A. Reactions of heptahydrobis(triphenylphosphine)rhenium with bidentate aromatic heterocycles. Inorganic Chemistry. 26 (17), 2910-2912 (1987).
- Kosanovich, A. J., Reibenspies, J. H., Ozerov, A. V. Complexes of high-valent rhenium supported by the PCP pincer. Organometallics. 35 (4), 513-519 (2016).
- Emge, T. J., Koetzle, T. F., Bruno, J. W., Caulton, K. G. Pentahydridorhenium: crystal and molecular structure of ReH5(PMePh2)3. Inorganic Chemistry. 23 (24), 4012-4017 (1984).
- Costello, M. T., Fanwick, P. E., Green, M. A., Walton, R. A. Reactions of Heptahydridobis(triphenylphosphine)rhenium with 1-(diphenylphosphino)-2-(diphenylarsino)ethane (arphos) and 1,2-bis(diphenylarsino)ethane (dpae). Structural characterization of ReH5(PPh3)2(arphos-As) and ReH5(PPh3)2(dpae-As). Inorganic Chemistry. 30 (4), 861-864 (1991).
- Alvarez, D., Lundquist, E. G., Ziller, J. W., Evans, W. J., Caulton, K. G. Synthesis, structure and applications of transition-metal polyhydride anions. Journal of the American Chemical Society. 111 (22), 8392-8398 (1989).
- Albinati, A., et al. Synthesis, characterization, and interconversion of the rhenium polyhydrides ReH3(η4-NP3)] and [ReH4(η4-NP3)]+ {NP3 = tris[2-(diphenylphosphanyl)ethyl]amine}. European Journal of Inorganic Chemistry. 2002 (6), 1530-1539 (2002).
- Bosque, R., et al. Site preference energetics, fluxionality, and intramolecular M−H···H−N hydrogen bonding in a dodecahedral transition metal polyhydride. Inorganic Chemistry. 36 (24), 5505-5511 (1997).
- Tao, Y., Sou, W., Luo, G. -. G., Kraka, E. Describing polytopal rearrangement processes of octacoordinate structures. I. renewed insights into fluxionality of the rhenium polyhydride complex ReH5(PPh3)2(Pyridine). Inorganic Chemistry. 60 (4), 2492-2502 (2021).
- Beringhelli, T., D'Alfonso, G., Minoja, A. P. Rhenium-platinum mixed metal clusters. Characterization in solution and dynamic behavior of the isomers of [Re3Pt(µ-H3)(CO)14]. An example of a labile metal fragment that undergoes intermolecular exchange. Organometallics. 13 (2), 663-668 (1994).
- Grieco, G., Blacque, O. Solution and solid-state structure of the first NHC-substituted rhenium heptahydrides. European Journal of Inorganic Chemistry. 2019 (34), 3810-3819 (2019).
- Wazio, J. A., Jimenez, V., Soparawalla, S., John, S., Moehring, G. A. Hydrogen exchange of rhenium(VII) heptahydridobis(triphenylphosphine) with water, aniline, methanol, and itself. Inorganica Chimica Acta. 362 (1), 159-165 (2009).
- Chatt, J., Coffey, R. S. Hydrido-complexes of rhenium-containing tertiary phosphines. Journal of the Chemical Society, A. 1969, 1963-1972 (1969).
- Tao, Y., Wang, X., Zou, W., Luo, G. -. G., Kraka, E. Unusual intramolecular motion of ReH92- in K2ReH9 crystal: circle dance and three-arm turnstile mechanisms revealed by computational study. Inorganic Chemistry. 61 (2), 1041-1050 (2022).
- Berger, X., Braun, S. . 200 and More NMR Experiments a Practical Course. , (2004).
- He, G., Chen, J., Sung, H. H. -. Y., Williams, I. D., Jia, G. Substituent effect on reactions of ReH5(PMe2Ph)3 with propargyl alcohols. Inorganica Chimica Acta. 518 (1), 120239 (2021).
- Donnelly, L. J., Parsons, S., Morrison, C. A., Thomas, S. P., Love, J. B. Synthesis and structures of anionic rhenium polyhydride complexes of boron-hydride ligands and their application in catalysis. Chemical Science. 11 (9), 9994-9999 (2020).
- Donnelly, L. J., et al. C-H borylation catalysis of heteroaromatics by a rhenium boryl polyhydride. ACS Catalysis. 11 (12), 7394-7400 (2021).
- Jin, H., et al. CO-enabled rhenium hydride catalyst for directed C(sp2)-H bond alkylation with olefins. Organic Chemistry Frontiers. 2 (4), 378-382 (2015).
- Takaya, H., Ito, M., Murahashi, S. -. I. Rhenium-catalyzed addition of carbonyl compounds to the carbon−nitrogen triple bonds of nitriles: α-C−H activation of carbonyl compounds. Journal of the American Chemical Society. 131 (31), 10824-10825 (2009).
- Carr, S. W., Fowles, E. H., Fontaine, X. L. R., Shaw, B. L. Multihydride complexes of rhenium, osmium or iridium containing monodentate ditertiary phosphine ligands: selective hydrogen-deuterium exchanges of the rhenium multihydrides. Journal of the Chemical Society, Dalton Transactions. 1990 (2), 573-579 (1990).
- Jin, H., et al. Rhenium-catalyzed acceptorless dehydrogenative coupling via dual activation of alcohols and carbonyl compounds. ACS Catalysis. 3 (10), 2195-2198 (2013).
- Loza, M. L., de Gala, S., Crabtree, R. H. Steric crowding in a rhenium polyhydride induced by a chelating disilyl ligand: synthesis, characterization, and reactivity of ReH5(disil)(PPh3)2 (disil = 1,2-Bis(dimethylsilyl)benzene and 1,2-Bis(dimethylsilyl)ethane). Inorganic Chemistry. 33 (22), 5073-5078 (1994).
- Lin, Y., Zhu, X., Xiang, M. Transition metal polyhydrides-catalyzed addition of activated nitriles to aldehydes and ketones via Knoevenagel condensation. Journal of Organometallic Chemistry. 448 (1-2), 215-218 (1993).
- Abdukader, A., Jin, H., Cheng, Y., Zhu, C. Rhenium-catalyzed amination of alcohols by hydrogen transfer process. Tetrahedron Letters. 55 (30), 4172-4174 (2014).
- Lin, Y., Zhou, Y. Selective transfer hydrogenation catalyzed by transition metal polyhydrides. Fenzi Cuihua. 5 (2), 119-124 (1991).
- Green, M. A., Huffman, J. C., Caulton, K. G., Rybak, W. K., Ziolkowski, J. J. Ligand scavenging and catalytic utilization of the phototransient ReH5(PMe2Ph)2. Journal of Organometallic Chemistry. 218 (2), 39-43 (1981).
- Komiya, S., Chigira, T., Suzuki, T., Hirano, M. Polymerization of alkyl methacrylate catalyzed by hydridorhenium complexes. Chemistry Letters. 4 (4), 347-348 (1999).
- Michos, D., Luo, X. L., Faller, J. W., Crabtree, R. H. Tungsten(VI) hexahydride complexes supported by chelating triphosphine ligands: protonation to give η2-dihydrogen complexes and catalytic dehydrogenation of cyclooctane to cyclooctene. Inorganic Chemistry. 32 (8), 1370-1375 (1993).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены