Method Article
Анализ образования белковых комплексов при микромолярных концентрациях путем сопряжения микрофлюидики с массовой фотометрией
В этой статье
Резюме
Этот протокол сочетает в себе массовую фотометрию с новой системой микрофлюидики для исследования низкоаффинных белок-белковых взаимодействий. Этот подход основан на быстром разбавлении высококонцентрированных комплексов в растворе, что позволяет проводить низкоаффинные измерения и расширяет область применения массовой фотометрии.
Аннотация
Масс-фотометрия — это универсальная технология измерения массы, которая позволяет изучать биомолекулярные взаимодействия и образование комплексов в растворе без меток. Масс-фотометрия обычно подходит для анализа образцов в диапазоне концентраций 100–100 нМ. Однако во многих биологических системах необходимо измерять более концентрированные образцы для изучения низкоаффинных или переходных взаимодействий. Здесь мы демонстрируем метод, который эффективно расширяет диапазон концентраций образцов, которые могут быть проанализированы с помощью массовой фотометрии, от наномоляров до десятков микромоляров.
В этом протоколе массовая фотометрия сочетается с новой системой микрофлюидики для исследования образования белковых комплексов в растворе в микромолярном диапазоне концентраций. С помощью системы микрофлюидики пользователи могут поддерживать в образце желаемую более высокую концентрацию с последующим разбавлением до наномолярного диапазона - за несколько миллисекунд до измерения фотометрии массы. Из-за скорости разбавления данные получают до того, как сместится равновесие образца (т.е. произойдет диссоциация комплекса).
Метод применяется для измерения взаимодействий между антителом иммуноглобулина G (IgG) и неонатальным Fc-рецептором, демонстрируя образование комплексов высокого порядка, которые не поддаются количественному определению с помощью статических измерений фотометрии массы.
В заключение следует отметить, что сочетание массовой фотометрии и микрофлюидики позволяет характеризовать образцы в диапазоне микромолярных концентраций и хорошо измеряет биомолекулярные взаимодействия с более слабым сродством. Эти возможности могут быть применены в различных контекстах, включая разработку и проектирование биотерапевтических средств, что позволяет тщательно охарактеризовать различные белок-белковые взаимодействия.
Введение
Белок-белковые взаимодействия подчеркивают большинство клеточных функций, от иммунной регуляции до репликации и трансляции ДНК. В результате в науках о жизни существует фундаментальная потребность в исследовании широкого спектра взаимодействий между различными гетерогенными комплексами, которые обычно образуются. Однако их обнаружение, характеристика и количественная оценка часто являются сложной задачей, особенно для низкоаффинных взаимодействий1.
Иммунопреципитационные анализы часто используются для обнаружения высокоаффинных взаимодействий, но для низкоаффинных и транзиторных взаимодействий обнаружение в значительной степени неосуществимо2. Также можно использовать флуоресцентные методы, но они требуют потенциально разрушительного добавления флуоресцентных меток2. Cryo-EM может обеспечить структурный снимок и ансамблевое считывание белковых комплексов, сформированных с высоким пространственным разрешением, но также обычно требует работы в концентрациях, которые слишком малы для визуализации низкоаффинных взаимодействий. Cryo-EM также создает проблемы, связанные со стоимостью, доступностью, пробоподготовкой и временем анализа3.
Кроме того, поверхностный плазмонный резонанс (SPR) стал популярным способом количественной оценки белок-белковых взаимодействий, хотя он требует иммобилизации белка, которая может повлиять на равновесие связывания и привести к переменной скорости включения, тем самым снижая точность измерений 4,5. Он также включает в себя несколько этапов анализа перед сбором и анализом данных6.
Масс-фотометрия — это метод одной молекулы, который используется для анализа белок-белковых взаимодействий 5,6,7. Он работает, измеряя массу отдельных молекул или комплексов на основе света, который они рассеивают, когда приземляются на поверхность стеклянного покровного стекла8. Измерения массовой фотометрии были использованы для количественной оценки аффинности связывания из относительного количества партнеров по связываниюи комплексов, которые они образуют. Тем не менее, как и в других методах с использованием одной молекулы, концентрация измеряемого образца обычно должна быть менее 100 нМ. Если концентрация выше, молекулы, падающие на поверхность стекла, будут перекрываться в пространстве, что приведет к низкому качеству данных7. Следовательно, более слабые взаимодействия (KD ~ микромоляры), которые диссоциируют при этих более низких концентрациях, не могут быть надежно измерены, поскольку невозможно наблюдать необходимую смесь несвязанных и связанных веществ5.
Здесь мы опишем подход, который преодолевает это ограничение, основанный на новом устройстве для массовой фотометрии с сопряженной микрофлюидикой. В частности, система микрофлюидики используется в сочетании с масс-фотометром для эффективного расширения диапазона взаимодействий, которые могут быть количественно определены с помощью массовой фотометрии. Было показано, что микрофлюидика предлагает ряд возможностей для исследования белок-белковых взаимодействий, включая быстрое разведение для обнаружения слабых взаимодействий 1,9. Описанная здесь система работает путем быстрого разбавления образца до 10000 раз на микрофлюидном чипе и немедленного пропускания его через область наблюдения чипа, что позволяет начать измерение массовой фотометрии в течение 50 мс с момента, когда молекулы начали процесс разбавления10. Разбавление происходит, когда образец и буфер объединяются в смесителе с обратным клапаном Тесла на чипе, при этом относительные скорости потока двух растворов определяют величину происходящего разбавления (см. шаг протокола 8). Расход регулируется с помощью программного обеспечения для микрофлюидного управления. Изменение скорости потока может изменить относительную популяцию вида, поскольку это может повлиять на количество событий посадки на поверхность стекла, которое измеряется массовым фотометром.
Скорость процесса достаточно высока, чтобы измерение было завершено до того, как целостность взаимодействия будет нарушена (подробнее см. также Обсуждение). Это можно понять, кратко взглянув на теорию реакций первого порядка, где 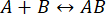 . Константа прямой (ассоциативной) скорости равна kf, константа обратной скорости (диссоциация) равна kb, а константа диссоциации равновесия (KD) определяется как
. Константа прямой (ассоциативной) скорости равна kf, константа обратной скорости (диссоциация) равна kb, а константа диссоциации равновесия (KD) определяется как
KD= kb/ kf
Для связывания с белками kfобычно ограничена диффузией11 реагентов и, таким образом, ограничена диапазоном 10 6-10 7 M-1·s-1. Поскольку диапазон ограничен, низкоаффинная (KD~микромолярная) реакция будет иметь kb≈ 1 с-1. То есть, kb = kf · KD= (106 M-1·s-1) (10-6 M) = 1 с-1, с периодом полураспада комплекса около 0,7 с11,12.
В качестве примера можно привести связывание моноклонального антитела IgG трастузумаба с растворимым доменом неонатального Fc-рецептора IgG (FcRn), которые известны как взаимодействующие партнеры13. Ранее опубликованные данные, полученные только с помощью обычной массовой фотометрии (т.е. с ручным разбавлением образцов), показали, что белки образуют несколько видов. Были хорошо видны мономера FcRn, димеры FcRn и несвязанный IgG, в то время как комплексы IgG-FcRn (в соотношении 1:1 и 1:2) также были обнаружены (при pH 5,0), но только с очень низкойконцентрацией5. Это наблюдение вызывает вопрос о том, можно ли более четко обнаружить образование комплекса IgG-FcRn, если измерять его в более высокой концентрации. Действительно, сочетание массовой фотометрии с описанным здесь подходом к быстрому разбавлению дало более убедительные доказательства образования комплексов за счет увеличения их измеренных частиц.
Описанный здесь протокол массовой фотометрии и микрофлюидики позволяет охарактеризовать образование комплексов с KD вплоть до микромолярного диапазона. Эмпирическое определение KD потребует дальнейшего повышения точности датчика расхода, стабильности насоса, вариаций от стружки к стружке и места измерения внутри окна наблюдения, поскольку все эти факторы будут влиять на время с момента разбавления пробы до измерения.
Тот же подход может быть применен для исследования связывания между любыми растворимыми белками, при условии, что они имеют различные молекулярные массы (разделенные по меньшей мере 25 кДа), которые попадают в диапазон, подходящий для анализа с помощью масс-фотометра (от 30 кДа до 6 МДа). Полученные знания могут быть полезны для исследований в различных контекстах — от получения механистического понимания клеточных функций до разработки новых биотерапевтических препаратов.
протокол
1. Подготовка инструментов и запуск программного обеспечения
- Включите масс-фотометр и оставьте его включенным не менее чем на 1 час перед началом любых измерений.
ПРИМЕЧАНИЕ: Это связано с тем, что прибор должен достигать постоянной температуры. Если не оставить фотометр массы включенным в течение 1 часа, это может привести к смещению массы и, следовательно, к неточным результатам. - Включите антивибрационный стол, включив питание и нажав кнопку изоляции (под масс-фотометром). Вибрации ограничивают производительность прибора массовой фотометрии, поэтому антивибрационный стол важен для обеспечения максимальной чувствительности прибора. Включите блок микрофлюидики.
- Запустите программное обеспечение для сбора данных и программное обеспечение для управления микрогидродинамикой. Включите воздушный компрессор.
2. Подготовка белковых образцов, буферных и чистящих растворов
- Добавьте 200 мл буфера PBS (pH 7,4) в чистую бутылку объемом 200 мл и 200 мл буфера PBS (pH 5,0) во вторую бутылку объемом 200 мл.
ПРИМЕЧАНИЕ: На следующих этапах бутылки объемом 200 мл необходимо будет подключить к датчику расхода «L». Используйте буфер pH 7,4 PBS для калибровочного измерения и буфер pH 5,0 PBS для измерения образца. - В центрифужной пробирке объемом 0,5 мл смешайте IgG (2 мкМ) и FcRn (20 мкМ) в соотношении 1:10 для получения общего объема 60 мкл.
- Исходные растворы для FcRn и IgG составляют 91,9 мкМ и 13,5 мкМ соответственно. Реакцию готовят путем смешивания 9 мкл бульона IgG + 13 мкл бульона FcRn + 38 мкл PBS (рН 5,0, комнатная температура [RT]) в центрифужной пробирке общим объемом 60 мкл. Конечные концентрации двух реагентов составляли 2 мкМ для IgG и 20 мкМ для FcRn. Держите все запасы белка на льду на протяжении всего процесса.
- В другую центрифужную пробирку объемом 0,5 мл дозируйте 20 мкл калибра β-амилазы в концентрации 20 мкМ.
- Например, для получения используемого здесь калибра β-амилазы следует выполнить процедуру, описанную в пунктах 2.3.1.1-2.3.1.2.
- Ресуспендировать 20 мг порошка β-амилазы во флаконе в 3,57 мл PBS (5% глицерина), что соответствует 5,6 мг/мл и молярной концентрации 100 мкМ (молекулярная масса 56 кДа).
- Для разбавления до 20 мкМ смешайте 200 мкл 100 мкМ с 800 мкл PBS (рН 7,4, RT) в центрифужной пробирке объемом 1 мл.
- Например, для получения используемого здесь калибра β-амилазы следует выполнить процедуру, описанную в пунктах 2.3.1.1-2.3.1.2.
- Инкубируйте образцы в RT не менее 30 минут.
ПРИМЕЧАНИЕ: Начните подготовку образца и калибровочных разведений после включения масс-фотометра. Для этого эксперимента образцы инкубировали в течение 120 минут. - В трех центрифужных пробирках по 50 мл аликвота: 50 мл PBS (pH 7,4) - моющий раствор 1 (CS1), 50 мл 0,5 М NaOH - моющий раствор 2 (CS2) и 50 мл 100% IPA - моющий раствор 3 (CS3).
3. Экспериментальная установка
- Чтобы загрузить образец и калибр, поместите пробирку для центрифуги калибра в положение 4, а пробирку для центрифуги для образцов в положение 5 блока для микрофлюидики (рис. 1).
- Чтобы загрузить чистящие растворы, поместите CS1, CS2 и CS3 в положения 1, 2 и 3 блока микрофлюидики (рисунок 1).
ПРИМЕЧАНИЕ: Образец, калибр и чистящие растворы подключены к мультипереключателю (m-switch). m-переключатель подключается к датчику расхода «S». - Прикрутите крышку, которая соединяется с буферной линией, к буферному флакону объемом 200 мл (pH 7,4).
ПРИМЕЧАНИЕ: Буферная линия подключена к запорному клапану, который подключен к датчику расхода «L». Запорный клапан предотвращает любые эффекты сифонирования, которые могут возникнуть при остановке потока буфера. Сифонирование может привести к загрязнению буфера разбавленной остаточной жидкостью, возвращающейся в буферный резервуар. - Поместите микрофлюидный чип на подготовительную пластину.
Вставьте другой конец трубки датчика расхода «S» в «Входное отверстие для образца» первого канала микрофлюидного чипа (рис. 1). Линия образца готова. - Вставьте другой конец трубки датчика расхода «L» в «Буферное входо» первого канала микрофлюидики (рис. 1). Буферная линия завершена.
- Чтобы собрать отток, протолкните трубку к «Выходу» первого канала в микрофлюидном чипе; расположите другой конец так, чтобы он стекал в контейнерную колбу или стакан (рис. 1).
4. Грунтовка линии образца и буфера буфером
- Откройте ручной запорный клапан на буферной линии.
- В программном обеспечении для управления микрогидродинамикой установите расход буферной линии на 1000 μл/мин и убедитесь, что давление в буферной линии не превышает 110 мбар (рис. 2). Поток автоматически начнется в буферной строке (рисунок 1).
ПРИМЕЧАНИЕ: Если давление в буферной линии превышает 110 мбар, это может быть связано с тем, что воздух проходит через датчик расхода. Если давление не возвращается к норме в течение нескольких секунд, может возникнуть засорение (обычно из-за защемления трубок в соединениях). В этом случае остановите поток и проверьте соединения в буферной линии, начиная с запорного клапана. - В программном обеспечении для управления микрогидродинамикой выберите положение 1 переключателя m (соответствующего буферу PBS), затем установите расход линии отбора проб на 8 мкл/мин и убедитесь, что давление в линии отбора проб не превышает 350 мбар. Поток автоматически начнется в линии выбора образца (рис. 1).
- С помощью наконечника дозатора (или другого мягкого пластикового компонента) слегка надавите сверху рядом с пузырьками, застрявшими в чипе, чтобы удалить пузырьки воздуха и убедиться, что они удалены через выпускное отверстие.
ПРИМЕЧАНИЕ: Убедитесь, что вы удалили все пузырьки в секциях «микшер» и «зона наблюдения» (Рисунок 1) используемого канала. Будьте осторожны, не давите слишком сильно, так как это может повредить чип.
5. Установка микрофлюидного чипа на масс-фотометр и нахождение фокуса
- Нанесите каплю иммерсионного масла для микроскопа на объектив масс-фотометра.
- Поместите микрофлюидный чип на держатель масс-фотометра «Входное отверстие для образца» вверх и прикрепите его к зажимам предметного стекла (рис. 1). Убедитесь, что все соединения трубок остаются прикрепленными.
- Используя программное обеспечение для сбора данных, переместите сцену, чтобы убедиться, что «Зона наблюдения» канала 1 выровнена с целью (рис. 1).
- Закройте крышку масс-фотометра и нажмите опцию Droplet-Dilution Find Focus в программном обеспечении для сбора данных.
- Проверьте белое кольцо фокусировки в левом нижнем углу программного обеспечения для сбора данных (рис. 3). Зазоры в кольце указывают на наличие пузырька воздуха в иммерсионном масле; Уберите это, увеличив скорость сцены до максимума и аккуратно переместив столик в сторону.
- После завершения фокусировки подождите 2-3 минуты, прежде чем делать первую запись. Затем нажмите кнопку Запись , чтобы записать измерение в течение 1 минуты, и убедитесь (наблюдая за измерением), что на нем нет примесей.
ПРИМЕЧАНИЕ: Примеси могут находиться на поверхности стекла или в буфере. Значение резкости в программном обеспечении для сбора данных должно быть выше 4,5%.
6. Калибровка фотометрии массы
- В программном обеспечении для управления микрогидродинамикой переключите переключатель m в положение 4 (соответствующее калибру) и убедитесь, что скорость потока в линии отбора проб установлена на уровне 8 мкл/мин, а давление в линии отбора проб не превышает 350 мбар (рис. 2).
- Калибр начнет поток через чип. Подождите примерно 1,5-2,5 минуты (или до тех пор, пока калибр не будет постоянно виден в программном обеспечении для сбора данных). Время может варьироваться в зависимости от длины трубки линии отбора проб.
- После того, как калибр будет виден последовательно (т.е. количество событий достаточно для точного измерения массовой фотометрии), в программном обеспечении управления микрофлюидикой уменьшите расход до 0,5 мкл/мин - целевого уровня разбавления для этого эксперимента.
ПРИМЕЧАНИЕ: Начало с более высокой скорости потока просто сокращает время, необходимое калибру для достижения чипа. - Убедитесь, что на поверхность измерения не попадает «слишком мало» или «слишком много» молекул (рисунок 4).
- Если плотность посадочных событий не является «идеальной» (рис. 4), измените расход в программном обеспечении управления микрогидродинамикой. Если плотность событий слишком низкая, увеличивайте скорость потока пробы до тех пор, пока не будут наблюдаться хорошо разделенные события посадки (но не более 8 мкл/мин). Если он слишком высок, уменьшите расход образца (но не опускайтесь ниже 0,1 мкл/мин).
- Если объем калибра в пробирке для образца низкий, измените положение переключателя M на линию pH 7,4 PBS (положение 1), чтобы избежать нагнетания воздуха.
- Нажмите кнопку Запись и выполните измерение за 60 секунд. Сохраните файл в выбранной папке.
ПРИМЕЧАНИЕ: Программное обеспечение для сбора данных создает файлы с расширением .mp.
7. Очистка линии отбора проб и остановка потока
- В программном обеспечении для управления микрогидродинамикой переключитесь в положение 2 переключателя m и измените давление образца на 800 мбар (рис. 2). Промывайте систему CS2 (NaOH) в течение 4 минут.
- Переключитесь в положение 3 m-переключателя и промойте систему CS3 (IPA) в течение 4 минут.
- Переключитесь в положение 1 переключателя m и промывайте систему CS1 (PBS) в течение 4 минут.
- В программном обеспечении для управления микрогидродинамикой остановите весь поток, установив давление в линии отбора проб и буферной линии на 0, и перекройте буферный клапан.
- Отсоедините чипс от предметного столика и поместите его обратно на подготовительную пластину. Отсоедините все трубки и поместите конец трубки для образцов в бутылку для отходов. Очистите объектив изопропанолом и салфетками.
8. Измерение образца массовой фотометрии
- Отвинтите крышку, соединенную с буферным флаконом объемом 200 мл (pH 7,4), и прикрутите его к буферному флакону объемом 200 мл (pH 5,0).
- Повторите шаги 3.4-5.6, но используйте второй канал чипа вместо первого.
- В программном обеспечении для управления микрогидродинамикой переключите переключатель m в положение 5 (соответствующее образцу), установите расход в пробоотборной линии на 8 μл/мин и убедитесь, что давление в пробоотборной линии не превышает 350 мбар (рис. 2).
- Повторите шаги 6.2-6.4 для измерения образца.
- Чтобы рассчитать используемые скорости потока, убедитесь, что кратная разница в расходе соответствует желаемому коэффициенту разбавления пробы. Например, для достижения разбавления в 2000 раз здесь расход отличается в 2000 раз; расход буфера составляет 1000 μл/мин, а расход пробы - 0,5 μл/мин. В конце эксперимента всегда оставляйте линии чистыми, следуя протоколу очистки.
9. Анализ данных
- После завершения сбора данных запустите программное обеспечение для анализа данных (рисунок 5).
- Нажмите на значок плюса (+) в левом верхнем углу и выберите файл калибра .mp. Программа начнет анализировать загруженный файл. В зависимости от размера и количества измерений это может занять несколько минут
- Не анализируйте файлы .mp в программном обеспечении для анализа данных при сборе данных с помощью программного обеспечения для сбора данных, так как это может снизить качество получаемых данных.
- Нажмите кнопку Создать калибровку массы (внизу справа). Откроется диалоговое окно, в котором будет показана таблица, заполненная значениями контрастности аппроксимированных пиков.
- Измените значения на известные значения массы для подогнанных пиков (для β-амилазы это 56 кДа, 112 кДа и 224 кДа) и нажмите Сохранить. Только что созданный файл калибровки (расширение .mc) появится на панели Mass Calibration (в левом нижнем углу программного обеспечения для анализа данных) (рис. 6).
- Щелкните значок плюса (+) в левом верхнем углу и выберите файл с образцом .mp.
- Чтобы создать массовую гистограмму, как показано на рисунке 5, перейдите на вкладку Analysis , выберите режим Histogram и опцию Mass plot. При необходимости отрегулируйте ширину ячейки, пределы массы и другие параметры.
- При необходимости настройте график на вкладке «Фигуры » перед экспортом рисунков и/или сохранением всей рабочей области в виде файла .dmp.
Результаты
Масс-фотометрия была использована для измерения взаимодействия между моноклональным антителом IgG трастузумабом и растворимым доменом неонатального Fc-рецептора IgG (FcRn). Смесь двух белков в соотношении 1:10 (при концентрации 2 мкМ для IgG и 20 мкМ для FcRn) разбавляли вручную до 10 нМ и 20 нМ в PBS соответственно.
Этап разбавления необходим, потому что массовая фотометрия, метод измерения массы одной молекулы, может анализировать образцы только в диапазоне 100 пМ-100 нМ. Попытка измерить пробы с концентрациями, выходящими за пределы этого диапазона, может поставить под угрозу точность результатов (рис. 4). Этот эксперимент не включен в настоящий Протокол, так как он был описан ранее 5,6.
В гистограммах массы, полученных в эксперименте по массовой фотометрии, сила сигнала рассеяния (или «контраста») для каждого события посадки отображается на оси x и преобразуется в молекулярную массу на этапе калибровки масс-контраста. Между тем, ось y указывает на количество молекул, подсчитанных с заданной массой (или контрастом). Таким образом, пик указывает на наличие популяции молекул в диапазоне молекулярных масс, показанных на оси x. Количество событий (количеств), составляющих пик, отражает размер этой популяции.
Измерение масс-фотометрии с ручным разбавлением привело к получению гистограммы массы, где два самых больших пика, исходя из ожидаемой молекулярной массы белков, соответствовали несвязанным мономерам FcRn (~50 кДа) и мономерам антител IgG (~150 кДа) (рис. 7). Как и в ранее опубликованных данных массовой фотометрии5, несвязанные виды были заметными, в то время как пики в диапазонах масс, которые соответствовали бы комплексам, были гораздо менее заметны.
Эксперимент повторяли с использованием системы быстрой микрофлюидики для разбавления смеси до необходимой концентрации непосредственно перед измерением массовой фотометрии. Этот подход позволил обнаружить дополнительные низкоаффинные комплексы, которые могли диссоциировать на этапе ручного разведения. Для достижения того же коэффициента разбавления 2000x, который использовался во время эксперимента по ручному разбавлению, смесь образцов 1:10 (при концентрации 2 мкМ для IgG и 20 мкМ для FcRn) подавалась на микрофлюидный чип со скоростью 0,5 мкл/мин вместе с буфером PBS (pH 5,0) со скоростью потока 1 мл/мин. Чтобы убедиться, что белки не деградировали во время измерения, IgG (2 мкМ) и FcRn (20 мкМ) измеряли под потоком с помощью микрофлюидной системы после 120 мин инкубации образцов. Индивидуальные контрольные измерения показали отсутствие деградации белка (дополнительный рисунок 1)
Для образца, подвергшегося быстрому разбавлению, снова можно было наблюдать пики, соответствующие мономерам FcRn (53 кДа), димерам FcRn (97 кДа) и мономерам IgG (148 кДа). Кроме того, два дополнительных пика четко наблюдались на 196 кДа и 251 кДа, что соответствует комплексам IgG-FcRn со стехиометрией 1:1 и 1:2 (рис. 7). Ожидаемые массы для этих двух комплексов составляли 200 кДа и 250 кДа соответственно. Вариабельность измерения массы находится в пределах погрешности измерения для фотометра массы, используемого в этом исследовании, составляет ±5%14 (2% для комплекса 1:1 и 0,4% для комплекса 1:2).
Присутствие этих комплексов только в быстро разбавленном образце согласуется с идеей о том, что они имеют тенденцию диссоциировать при более низких концентрациях, со скоростью, которая является быстрой по сравнению с процессом ручного разбавления, но медленной по сравнению с процессом быстрого разбавления, достигаемого с помощью микрофлюидной системы15.
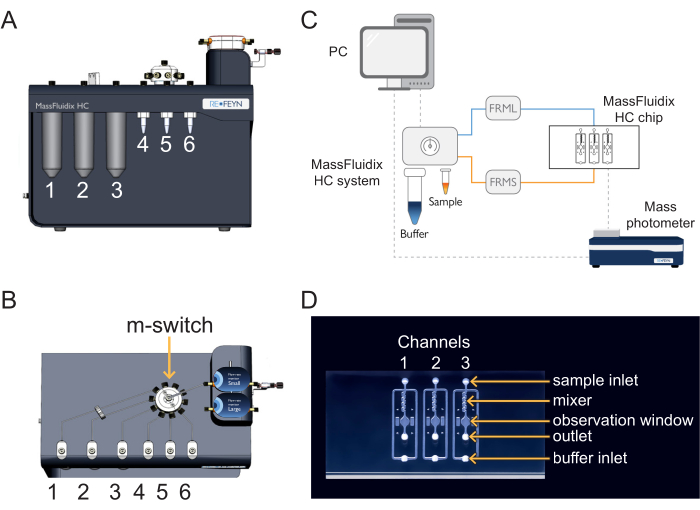
Рисунок 1: Сочетание микрофлюидики с масс-фотометрией. (A,B) Блок микрофлюидики, используемый в этом протоколе, как видно спереди (A) и (B) сверху. Чистящие растворы помещаются в положения 1-3, а образцы и калибранты - в положения 4-6. Все решения подключаются к m-switch, который подключается к датчику «Малый» расхода. (C) Обзор всей системы. Компьютер (вверху слева) подключен к блоку микрофлюидики (показан рядом с буфером и пробирками для образцов) и масс-фотометру (внизу справа), где расположен микрофлюидный чип. Монитор малого расхода (FRMS) контролирует расход через линию отбора проб, а монитор большого расхода (FRML) контролирует расход буфера. Трубки пробы и буферной линии соединяются с каналом на микрофлюидном чипе, размещенном внутри масс-фотометра. (D) Каждый чип имеет три канала. FRMS подключается к входу образца, а FRML — к входу буфера. Зона смесителя — это место, где происходит быстрое разбавление пробы, а зона наблюдения — это место, где проводятся измерения массовой фотометрии. Выход контролируется дополнительным датчиком расхода, чтобы убедиться в отсутствии утечек в чипе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
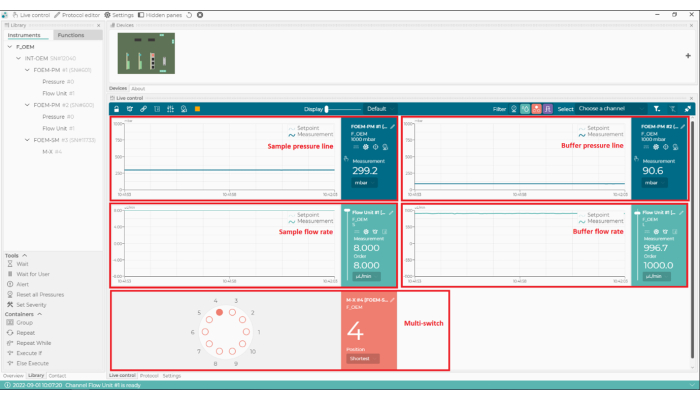
Рисунок 2: Программное обеспечение для управления микрогидродинамикой. С помощью этого программного обеспечения можно устанавливать и контролировать расход, линии давления микрогидродинамической системы и положение мультипереключателя (m-переключателя). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
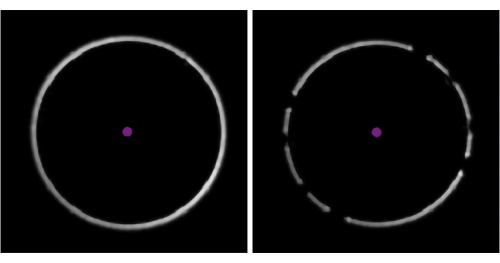
Рисунок 3: Определение наличия пузырьков в масле. На примерах из программного обеспечения для сбора данных видно чистое, неповрежденное кольцо фокусировки (слева) и «сломанное» кольцо, указывающее на наличие пузырьков воздуха в иммерсионном масле (справа). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Репрезентативные примеры концентраций образцов, в которых количество событий посадки молекул слишком мало, идеально или слишком много. Молекулы, падающие на поверхность области наблюдения в микрофлюидном чипе, будут выглядеть как темные пятна на ратиометрическом изображении массовой фотометрии. В идеале желаемая концентрация должна обеспечивать идеальную плотность посадочных событий во время сбора данных (посередине). Если плотность событий посадки слишком низкая (вверху, 'Слишком мало'), точный статистический анализ данных массовой фотометрии не может быть завершен. Если оно слишком высокое (нижнее, «слишком много»), молекулы посадки будут перекрываться пространственно, что приведет к низкому качеству данных. Эти изображения были получены с помощью программного обеспечения для сбора данных с использованием массового фотометра. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
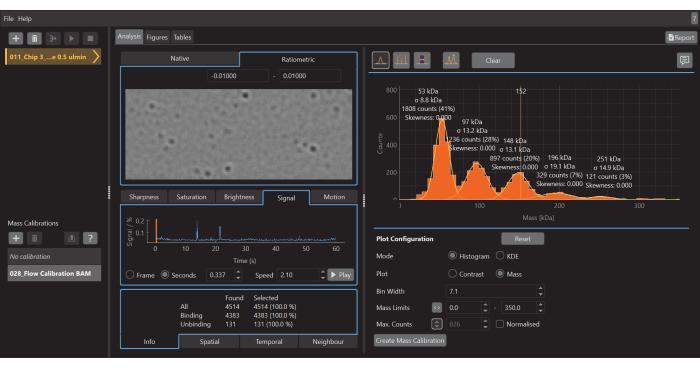
Рисунок 5: Снимок экрана программного обеспечения для анализа данных для массовой фотометрии. Здесь можно загрузить файлы .mp, экспортированные из программного обеспечения для сбора данных, для анализа данных. Цифры могут быть сгенерированы на основе обработанных данных. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
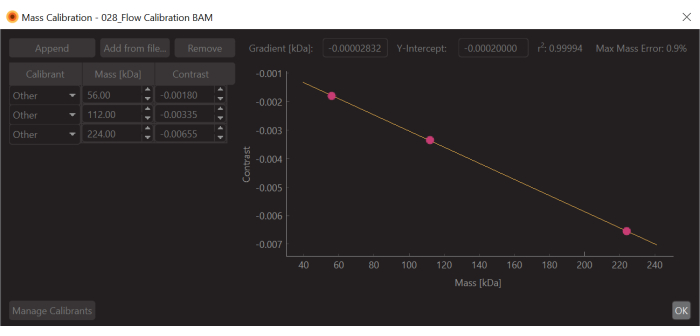
Рисунок 6: Снимок экрана калибровки массы-контраста для этого эксперимента. В качестве калибра использовалась β-амилаза, которая, как известно, образует три вида: мономер (56 кДа), димер (112 кДа) и тетрамер (224 кДа). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
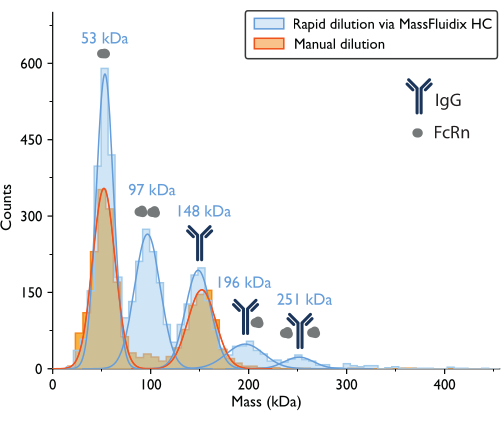
Рисунок 7: Масс-гистограммы выявляют образование комплекса только после быстрого разбавления образца. Для измерений образцов, содержащих IgG и FcRn, показаны масс-гистограммы и соответствующие наиболее подходящие гауссовы распределения после ручного разбавления (оранжевый) или быстрого разбавления с помощью системы microfluidicsHC (синий). Метки массы указывают, что средние значения кривых Гаусса соответствуют гистограммам массы, измеренным после быстрого разбавления. После ручного разведения наблюдались пики, соответствующие мономерам FcRn (52 кДа, измеренным при ручном разбавлении) и мономерам IgG (152 кДа). После быстрого разведения, помимо мономеров FcRn и IgG, также отчетливо наблюдались пики, соответствующие димерам FcRn и комплексам IgG-FcRn со стехиометрией 1:1 и 1:2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительные данные Рисунок 1: Массовые фотометрические измерения контрольных образцов после быстрого разведения не показывают деградации белка. (A) Масс-гистограмма и наилучшее соответствие гауссова распределения для выборки, содержащей только FcRn. Начальная концентрация образца до быстрого разбавления составляла 20 мкМ, а скорость потока была установлена на уровне 0,5 мкл/мин. Можно было наблюдать пики массы, соответствующие мономерам FcRn (53 кДа) и димерам FcRn (97 кДа). (B) Масс-гистограмма и наилучшее распределение Гаусса для образца только IgG (герцептина). Начальная концентрация образца до быстрого разбавления составляла 2 μМ, а скорость потока была установлена на уровне 1 μл/мин. Можно было наблюдать один пик массы, соответствующий мономеру IgG (155 кДа). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Протокол, описанный здесь, обеспечивает метод обнаружения и количественного определения низкоаффинных белок-белковых взаимодействий. В нем используется масс-фотометр, соединенный с системой микрофлюидики быстрого разбавления. Масс-фотометрия — это биоаналитический инструмент без меток, который может надежно измерять молекулярную массу в растворе для биомолекул16 в диапазоне от 30 кДа до 6 МДа. Поскольку массовая фотометрия — это метод одномолекулярной фотометрии, который анализирует образцы один за другим, она, как правило, ограничена образцами в диапазоне концентраций 100–100 нМ. Выше этого диапазона молекулы, падающие на поверхность стекла, будут перекрываться пространственно, что приведет к низкому качеству данных; ниже этого диапазона получается слишком мало данных для проведения надежного анализа7. Важным следствием этого является то, что он может ограничить исследование белковых взаимодействий теми, которые образуют смесь связанных и несвязанных веществ в пределах этого диапазона.
Здесь мы подробно описали пошаговый протокол использования системы микрофлюидики быстрого разбавления для эффективного расширения диапазона концентраций образцов, поддающихся массовой фотометрии. Разбавляя образец на микрофлюидном чипе и затем пропуская его через окно наблюдения детектора в течение 50 мс, система захватывает комплексы, присутствующие в неразбавленном образце, до того, как равновесие взаимодействия сместится. Образец непрерывно подается в детектор во время индивидуальных измерений. В этих условиях 95% комплекса останется нетронутым при измерении образца, даже при низкоаффинных взаимодействиях - с KD порядка микромоляров и скоростью диссоциации до 1 с-1.
Это можно рассчитать следующим образом: для реакции 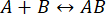 с прямой скоростью kfи обратной скоростью kb,
с прямой скоростью kfи обратной скоростью kb,
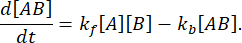
В равновесии концентрации всех трех видов (A, B и комплекса AB) остаются постоянными, so 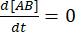 и
и 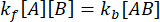 . При консервативном предположении, что возмущение (в данном случае разбавление) может привести к диссоциации комплекса, но прямая (ассоциативная) реакция не протекает, член kf [A] [B] можно рассматривать как пренебрежимо малый, и можно сделать следующее упрощение:
. При консервативном предположении, что возмущение (в данном случае разбавление) может привести к диссоциации комплекса, но прямая (ассоциативная) реакция не протекает, член kf [A] [B] можно рассматривать как пренебрежимо малый, и можно сделать следующее упрощение:
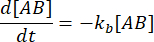
Интегрирование дает следующее выражение для концентрации комплекса в момент времени после возмущения равновесия:
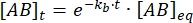
Доля комплекса, которая остается связанной в момент времени t после возмущения равновесия, выглядит следующим образом:
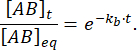
При = 50 мс для реакции с kb≈ 1 с-1 граница фракции равна 0,95, или 95%11,12.
Масс-фотометрия была использована здесь и ранее5 для исследования связывания трастузумаба моноклонального антитела IgG с растворимым доменом FcRn. Сообщалось, что два партнера по связыванию связываются с наномолярным сродством при кислом pH17. Масс-фотометрия использовалась для качественной оценки обилия комплексов, образовавшихся при рН 5,0 связывающих партнеров, и образцы быстро разбавлялись с помощью дополнительной микрофлюидной системы. Процедура была оптимизирована для конкретного белок-белкового взаимодействия на основе ранее сообщенных результатов5. Та же процедура может быть использована для изучения других взаимодействий, при условии, что пользователи имеют предварительные знания или оптимизируют условия эксперимента для рассматриваемой системы, такие как буферы, которые следует использовать, начальная концентрация белка, ожидаемая стехиометрия и количество инкубации, необходимое для достижения равновесия взаимодействия.
Когда смесь IgG-FcRn разбавляли вручную, было трудно обнаружить присутствие комплексов IgG-FcRn, хотя известно, что эти белки взаимодействуют5. В этой статье показано, что подход быстрого разведения приводит к заметному увеличению количества этих комплексов. В том же образце, когда использовали быстрое разведение, отчетливо наблюдались комплексы FcRn-IgG 1:1 и комплексы FcRn-IgG 2:1. Эти различия в образовании комплекса демонстрируют важность изучения систем биомолекулярных взаимодействий в широком диапазоне концентраций.
Кроме того, эти результаты также демонстрируют, что легко использовать микрофлюидику с анализом отдельных молекул для выявления слабых взаимодействий, заполняя значительный пробел в методе. Сочетание микрофлюидики с быстрым разбавлением с массовой фотометрией дает привлекательные преимущества благодаря преимуществам массовой фотометрии как аналитического метода. То есть массовая фотометрия не требует меток, предполагает минимальную подготовку образца, а измерения проводятся в растворе. Для этого протокола еще одним ключевым преимуществом массовой фотометрии является ее способность различать и количественно определять все образовавшиеся частицы (при условии, что они имеют отчетливую массу >30 кДа). Это отличается, например, от SPR, который может измерять скорость связывания и разъединения, но не может легко предоставить стехиометрическую информацию8.
Для этого протокола, а также для экспериментов по массовой фотометрии в целом, полезно несколько соображений. Во-первых, конечная концентрация белка должна быть в пределах того, что может измерить массовая фотометрия (100 пМ-100 нМ). Начальная инкубационная концентрация также должна находиться в диапазоне микрофлюидной системы (до 90 мкМ) и, теоретически, должна быть выше фактического KD взаимодействия10. Рекомендуемой отправной точкой является соотношение концентрации 1:1 между взаимодействующими веществами при концентрации μM. Затем соотношение может быть изменено до 1:2, 1:5 или, как в случае этого взаимодействия, 1:10. Если нет предварительной информации о белковых взаимодействиях, пользователь должен оптимизировать эксперимент, начиная с высокой концентрации (рекомендуемая 20 мкМ) для каждого партнера, чтобы определить, находится ли сродство компонентов в пределах диапазона концентраций, поддерживаемого представленным способом (т.е. образуются комплексы). Оптимизация может также включать выбор других буферных условий для стимулирования взаимодействий или титрования одного из компонентов взаимодействия для определения правильного соотношения смешивания. После их определения можно оптимизировать концентрации и потоки, чтобы обеспечить оптимальные условия для исследования и метода, например, уменьшить концентрации для обеспечения лучшего пикового разрешения.
Во-вторых, для успешного повторения этого эксперимента примеси должны быть сведены к минимуму. Общие источники примесей, которые, как известно, отрицательно влияют на измерения массовой фотометрии, включают другие белки или клеточный мусор, который остается после очистки, нефильтрованные буферы, мицеллообразующие детергенты (если они присутствуют в слишком высокой концентрации) и буферы, содержащие высокие концентрации соли, глицерина или других компонентов. Как обсуждалось в Протоколе выше, пузырьки в микрофлюидной системе должны быть удалены. Пузырьки могут образовываться в системе трубок или в тех случаях, когда образцы имеют высокое поверхностное натяжение и склонны к образованию пены. В иммерсионном масле также могут образовываться пузырьки, которые можно обнаружить по кольцу фокусировки (рисунок 3). Если пузырьки не могут быть удалены с помощью шагов, описанных в протоколе, другим решением является дегазация образца с помощью эксикатора и вакуумного насоса, оставляя образец под пониженным давлением в течение нескольких минут. Вортексинг или встряхивание высококонцентрированных белковых растворов не рекомендуется, так как эти действия могут способствовать образованию пузырьков.
Хотя здесь демонстрируется измерение одного конкретного белок-белкового взаимодействия, тот же протокол может быть применен к другим системам белок-белковых взаимодействий без существенных модификаций. Дальнейшим будущим направлением этого протокола будет использование измерений для расчета значений KD для идентифицированных комплексов, как это было описано в другом месте в контексте массовой фотометрии 5,7. В то время как в предыдущих исследованиях использовались данные экспериментов с ручным разбавлением и более сильными взаимодействиями, принцип анализа может быть легко применен в этом контексте - при условии внедрения дальнейших усовершенствований в микрофлюидное устройство (например, повышение точности датчика расхода и стабильности насоса).
Помимо белок-белковых взаимодействий, вероятно, существует более широкое применение комбинированной массовой фотометрии и микрофлюидики с быстрым разбавлением. Массовая фотометрия может быть использована для оценки чистоты, агрегации и однородности образца18,19; изучение олигомеризации белка20, сборки макромолекул21 или полимеризации22; и в других областях. Масс-фотометрический анализ также выходит за рамки белков; Он был использован для исследования взаимодействий между нуклеиновыми кислотами и белками23, вирусными частицами24 и наночастицами25. Таким образом, этот протокол описывает важное применение комбинированной системы массовой фотометрической микрофлюидики - он позволяет напрямую измерять слабые белок-белковые взаимодействия на уровне отдельных молекул и комплексов. Ценность настоящего приложения высока, поскольку оно открывает возможность прямой характеристики взаимодействий, которые, как правило, трудно изучать, с актуальностью в критических терапевтических областях. Этот комбинированный подход также может служить основой для более широкого спектра исследований образцов с концентрациями до десятков микромоляров.
Раскрытие информации
Миндерт Клаасен и Зорница Кофинова являются сотрудниками компании Refeyn Ltd, которая производит масс-фотометр и систему микрофлюидики, используемую в этой статье. Уэстон Струве является акционером и консультантом Refeyn Ltd.
Благодарности
W.S. поддерживается стипендией UKRI Future Leaders Fellowship [MR/V02213X/1]. Текст и графика рукописи были подготовлены при поддержке членов группы научных коммуникаций Refeyn (Панайота Паганопулу, Неус Торрес Тамарит и Катрин Лихтен). Мы также признательны за ценные отзывы от Камиллы Хетез, Софии Феррейры и Маттиаса Лангхорста.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-Propanol (Isopropanol) | VWR International LLC | 20880.320 | |
| Data acquisition software | Refeyn | AcquireMP (v2022 R1) | |
| Data analysis software | Refeyn | DiscoverMP (v2022 R1) | |
| FCRN, His-Tag | Sigma | SRP0624 | |
| Herceptin (IgG) | Cambridge Bioscience | HY-P9907-1mg | |
| Mass photometer | Refeyn | TwoMP | |
| Microfluidics box | Refeyn | MassFluidix HC system | |
| Microfluidics chip | Refeyn | MassFluidix HC chip | |
| Microfluidics control software | Fluigent | OxyGEN | |
| Phosphate Buffered Saline (PBS), 1x Ultra Pure | VWR International LLC | K812 | |
| Sodium Hydroxide (NaOH) | Sigma | S2770 | |
| β-Amylase, from sweet potato | Sigma | A8781 |
Ссылки
- Arter, W. E., Levin, A., Krainer, G., Knowles, T. P. J. Microfluidic approaches for the analysis of protein-protein interactions in solution. Biophysical Reviews. 12 (2), 575-585 (2020).
- Hellenkamp, B., Thurn, J., Stadlmeier, M., Hugel, T. Kinetics of transient protein complexes determined via diffusion-independent microfluidic mixing and fluorescence stoichiometry. The Journal of Physical Chemistry. B. 122 (49), 11554-11560 (2018).
- Li, Z. Editorial: Methods in structural biology: Cryo-electron microscopy. Frontiers in Molecular Biosciences. 9, 1041386 (2022).
- Herling, T. W., et al. A microfluidic platform for real-time detection and quantification of protein-ligand interactions. Biophysical Journal. 110 (9), 1957-1966 (2016).
- Soltermann, F., et al. Quantifying protein-protein interactions by molecular counting with mass photometry. Angewandte Chemie International Edition. 59 (27), 10774-10779 (2020).
- Wu, D., Piszczek, G. Rapid determination of antibody-antigen affinity by mass photometry. Journal of Visualized Experiments: JoVE. 168, 61784 (2021).
- Wu, D., Piszczek, G. Measuring the affinity of protein-protein interactions on a single-molecule level by mass photometry. Analytical Biochemistry. 592, 113575 (2020).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Zijlstra, N., et al. Rapid microfluidic dilution for single-molecule spectroscopy of low-affinity biomolecular complexes. Angewandte Chemie International Edition. 56 (25), 7126-7129 (2017).
- MassFluidix® HC system for rapid dilution via microfluidics. Available from: https://www.refeyn.com/massfluidix-hc-system (2023)
- Pollard, T. D. A guide to simple and informative binding assays. Molecular Biology of the Cell. 21 (23), 4061-4067 (2010).
- Jarmoskaite, I., AlSadhan, I., Vaidyanathan, P. P., Herschlag, D. How to measure and evaluate binding affinities. eLife. 9, e57264 (2020).
- Monnet, C., et al. Selection of IgG variants with increased FcRn binding using random and directed mutagenesis: Impact on effector functions. Frontiers in Immunology. 6, 39 (2015).
- . Refeyn TwoMP: Transforming biomolecular characterisation Available from: https://www.refeyn.com/twomp-mass-photometer (2022)
- Lai, S. -. H., Tamara, S., Heck, A. J. R. Single-particle mass analysis of intact ribosomes by mass photometry and Orbitrap-based charge detection mass spectrometry. iScience. 24 (11), 103211 (2021).
- Wu, D., Piszczek, G. Standard protocol for mass photometry experiments. European Biophysics Journal. 50 (3-4), 403-409 (2021).
- Vaughn, D. E., Bjorkman, P. J. Structural basis of pH-dependent antibody binding by the neonatal Fc receptor. Structure. 6 (1), 63-73 (1998).
- Niebling, S., et al. Biophysical screening pipeline for Cryo-EM grid preparation of membrane proteins. Frontiers in Molecular Biosciences. 9, 882288 (2022).
- Paul, S. S., Lyons, A., Kirchner, R., Woodside, M. T. Quantifying oligomer populations in real time during protein aggregation using single-molecule mass photometry. ACS Nano. 16 (10), 16462-16470 (2022).
- Schulz, L., et al. Evolution of increased complexity and specificity at the dawn of form I Rubiscos. Science. 378 (6616), 155-160 (2022).
- Malay, A. D., et al. An ultra-stable gold-coordinated protein cage displaying reversible assembly. Nature. 569 (7756), 438-442 (2019).
- Hundt, N., Cole, D., Hantke, M. F., Miller, J. J., Struwe, W. B., Kukura, P. Direct observation of the molecular mechanism underlying protein polymerization. Science Advances. 8 (35), eabm7935 (2022).
- Acharya, A., et al. Distinct RPA domains promote recruitment and the helicase-nuclease activities of Dna2. Nature Communications. 12, 6521 (2021).
- Ebberink, E. H. T. M., Ruisinger, A., Nuebel, M., Thomann, M., Heck, A. J. R. Assessing production variability in empty and filled adeno-associated viruses by single molecule mass analyses. Molecular Therapy - Methods & Clinical Development. 27, 491-501 (2022).
- Melo, L., et al. Size distributions of gold nanoparticles in solution measured by single-particle mass photometry. The Journal of Physical Chemistry B. 125 (45), 12466-12475 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены