このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウス気管から基底細胞および粘膜下腺管細胞の単離
要約
ここでは、マウスの気管から基礎および粘膜下腺管細胞を単離するための我々のプロトコルを示しています。また、作成するために背マウス脂肪パッドに幹細胞を注入する方法を実証モデル。
要約
大気道が1と我々は息毒素や感染性病原体による損傷することが影響を受けやすい環境と直接接触しており、。大気道が故に、私たちの体を守るための効率的な修復機構を必要とします。この修復プロセスは、気道内の幹細胞から発生し、気道から、これらの幹細胞を単離する修復および再生のメカニズムを理解する上で重要である。これは、気道疾患2につながることができます異常な修理を理解するためにも重要である。この方法の目的は、マウス気管粘膜下腺管から新規幹細胞集団を単離するために、粘膜下腺の3修復および再生のメカニズムを識別するために、in vitroおよび in vivoモデル系において 、これらの細胞を配置することです。この生産は、大規模な気道3からダクトおよび基底幹細胞を分離し、アッセイするために使用できる方法を示していますこれは、私たちを許可します嚢胞性線維症、喘息および慢性閉塞性肺疾患などの気道の疾患を研究する。現在、粘膜下腺管細胞を単離するためのメソッドはありませんし、粘膜下腺の再生を研究するin vivoモデルでは存在しています。
プロトコル
手順の概要
1。気管切開
2。気管を洗浄し、それを切断
3。単一細胞懸濁液に酵素消化し、処理
4。 FACS用染色およびソート
5。 in vivoおよびin vitroモデルのために選別された細胞を処理する
1。気管切開
- ペントバルビタールの0.1 mg/0.2 ccの腹腔内注射でマウスを安楽死させる。
- 腹壁を開いてカットし、腹部大動脈を露出し、それを解剖する側に腸を移動します。
- 心臓や肺を露出するために両側の横隔膜と前胸壁を切断することによって胸を開きます。気管を露出するために脂肪と唾液腺を除去首にカットアップを続けます。
- 胸腺を外し、下と後ろにその接続オフ肺を切った。 SEPARそれらの間に鉗子を挿入することで、食道から気管を食べその後、喉頭との接続上、その上部の大部分で気管を切った。その後、鉗子で気管を保持し、その添付ファイルからそれを解剖し、心臓と肺の専用ブロックでそれを除去するために下向き継続。左右の主気管支のほとんどが含まれるように門の近くに心臓や肺を切り取った。
- 氷の上に培地を収集含む小さなシャーレに気管を置きます。
2。気管を洗浄し、それをカッティング
- 解剖顕微鏡の下で、それに接続された他のすべての組織から気管をきれいにする非常に細かい点鉗子(第5号)及びVannasテュービンゲンはさみ(FST 15003から08 finescience.com)を使用します。これは含まれています:リンパ節、反回神経、脂肪、甲状腺、残りの肺血管を。気管の上部には、SMGの最大の束を損なうことなく、大きな喉頭軟骨を除去するために、特別な注意を必要とそれは輪状軟骨と第一気管軟骨輪(C1)は4の間に提出されています。
- 上部とC4とC5の間下部に気管を切断してから、気管の管腔を介して両方の部分を切り開いた。
3。単一細胞懸濁液に酵素消化および処理(SCS)
- 5前述のように、30分間室温(RT)でエッペンドルフチューブ内16 Uディスパーゼ1ml中に気管の下部をインキュベートする。その後、室温でさらに20分間DMEM中で0.5 mg / mlのDNase Iを追加します。
- 滅菌シャーレに新鮮収集培地に消化気管を外し、解剖顕微鏡で表面上皮を取り除くことにしました。 50mlコニカルチューブに取り除か上皮を含む培地を転送するためにピペットを使用しています。
- 4℃、1,000×gで取り除か上皮をスピンダウン上清を除去し、目を揺らしながら0.1%トリプシン/ EDTAとインキュベートを追加37の電子管℃で30分間インキュベーター(200 rpm)を振ること。インキュベーション後、1,000μlの先端を使用して、塊を分割し、単一の細胞懸濁液を形成するためにピペッティングします。
- 0.15%プロナーゼの1ミリリットルを含む円錐管の上部気管を置きます。その後、4時間、4℃でインキュベートする。
- チューブボルテックスした後、新鮮な培地に集気管を置き、表面上皮(SE)の完全な剥離があることを解剖顕微鏡下で確認してください。
- SMGコンパートメントを開くために細かいハサミで気管をミンチした後、低速振盪しながら室温でプロナーゼで1時間以上インキュベートします。
- 気管組織をスピンダウンし、プロナーゼを削除するには、上記のように振とうしながら30分間トリプシン/ EDTAとインキュベートし、37℃で0.1%を加算します。
- 10mlのシリンジを使用して20G、23Gと26Gの針を通過消化細胞塊と腺の残りのチャンク。前に、それぞれの針のサイズで継代を数回繰り返し辞任。今では、ほとんどの細胞は、SCSにする必要があります。
- その後、ストレーナを洗浄し、細胞をスピンダウンし、40μMストレーナーを通して懸濁液をろ過する。それから媒体の適切な音量で再構成する細胞は、細胞をカウントし、染色し、FACSソーティングにすぐに進みます。私たちは、これが生存率に影響を及ぼし、深刻な効率性を形成する球を減少させることがわかったので、4℃で、または数時間氷上で細胞を放置しないでください。
4。 FACS用染色およびソート
- その後、室温で15分間、一次抗体、ヤギおよびラットTrop2 ITGA6を持つ細胞の残りの部分を染色する染色されていないし、単一ステンド補償チューブを準備するために十分な細胞を取る。その後、PBSで洗ったり、培地を回収し、上清を除去し、非常に慎重に、細胞ペレットを破る。
- 室温で10分間、暗所でインキュベート適切な二次抗体を用いて染色、洗浄、上清を除去した後、ペレットを破る。
- FACSにあなたの電圧と補償、破片出門、非常に小さな細胞、細胞ダブレットと死細胞を調整した後、ARIA、。 SMG細胞の20〜50%がTROP2 +6になりますしながら、SEからのほとんどの細胞はTROP2正でなければならない。
- あなたのソートTrop2用ゲート+ ITGA6 SMG(管細胞)からSEから+細胞(基底細胞)とTrop2 +の細胞(+ /-ITGA6陽性細胞)を設定
5。ために選別された細胞の処理: 体外培養および in vivo モデルにおける
5月9日の文化を形成してin vitroでの球で 5.1
- 5万選別された細胞までを含む完全培地10,11100μlと"マトリゲル減少成長因子"の100μlを混ぜます( 表1を参照)は、次にトランス24ウェルの上室にこの混合物を入れた。その後、37℃、下部チャンバーに完全培地400μlを入れ、インキュベート℃に隔日下部チャンバー内の媒体を変更し、マトリゲルの余分100μlを加える毎週またはそれは薄くなった場合、以前の。
in vivoモデル 5.2
- 50μlあたり5,000-10,000細胞の濃度でマトリゲルと1:1で混合完全培地中で再構成するソート細胞ペレットを。
- 受信者C57/BL6マウスを麻酔。鎮痛剤としてsubcutaenouslyカルプロフェン(5 mg / kg)を投与する。背中の上部にある中央の長手方向の皮膚切開を行い、次にその背中を殺菌し、剃る。切開は脂肪パッド注射部位だけでなく、注射後ブレブ形成を識別するのに十分な大きさでなければなりません。アクセスと可視化を最大化するために両側胸壁の皮膚と背中の間に袋を広げてはさみの鈍側を使用します。
- 肩甲骨が動いて確認するまで、後方マウスの前肢を押すことにより、肩甲骨の内側縁を識別します。 300μlのBDのインスリン注射器に細胞懸濁液50μlを取り、ちょうど肩甲骨へ内側へと横方向の脂肪パッドにそれを注入する椎骨。あなたはあまりにも深いそうでなければブレブを見ることができるはずです。クリップやステッチ皮膚切開後、反対側に同じことを繰り返します。マウスを確認し、48時間1日1回(5 mg / kgを、サウスカロライナ州)カルプロフェンを与える。
- 3週間後、pentobarbatol(0.1 mg/0.2 CC、IP)にマウスを安楽死させる、上記のように皮膚を開き、周りに形成され、拡張された可能性のある組織構造の欠落を避けるために安全マージンの両側から全体の脂肪パッドを解剖。パラフィン12にPFAとembedで固定してください。細心の注意は、トリミングや構造をバイパスしたり、見落とさないブロックを切削中に採用すべきである。ベストプラクティスは、一旦、4μmのスライスをカットスライドガラスの上に置き、ブロックかどうかのこの部分の任意の "上皮構造"があるかどうか確認するために、顕微鏡下でそれを調べる40μmをトリミングすることである。見たものが何もない場合は、もう一度トリミングし、この手順を繰り返します。
6。代表的な結果
STRI図1Aに示すように、光学顕微鏡で見える裸に気管になり、マウスの気管pping。 図1Bは、上皮がブドウの組織と似た房から解放された粘膜下腺ストリッピング後の気管の明視野ビューを示しています。
プロナーゼはITGA6エピトープを削除し、TROP2ダクト細胞がITGA6に分離できない理由はここにある+と - 集団。しかし、ITGA6エピトープを保持ディスパーゼは、非常に短いインキュベーション時間であってもすべての表面上皮および管細胞を消化するため、3基底細胞からダクトを分離するために使用することはできません。単一の細胞懸濁液のフローサイトメトリーは、 図2Aに示されている前方散乱と側の散布図が表示されるはずです。残りの部分から管細胞の良好な分離気管細胞は、蛍光活性化細胞sortiためのフローサイトメトリーでTrop2抗体で見られるかどうか図2Bに示すように、NG(FACS)。球は、文化の中で、約1週間後にマトリゲルに表示され、 図3に示すように、外観に密集している必要があります。このプロセスの効率は1-2%であり、単一セルの順序がまだマトリゲル中に存在する可能性が高いと自己再生能力を持っていない粘膜下腺管から細胞を表すということです。 図4に示されている粘膜下腺様構造の形成におけるマウスの脂肪パッドの結果にダクト幹細胞の注入。これらはあっても、H&E染色せずにブロックで見られている。これらは球状であり、中央の内腔を有する。多くのクロスセクションでは、これらの上皮構造を逃さないようにするために、脂肪パッドを介して行う必要があります。
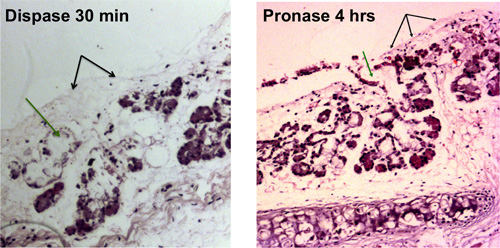
図1:気管上皮の酵素消化。表面上皮細胞の除去はBLACと共に示されているk個の矢印、粘膜下腺管の細胞の除去は、緑色の矢印で示されています。光学顕微鏡で見える裸にされた気管はディスパーゼ消化の30分後に、プロナーゼ消化の4時間後に表示されます。

図2A。私。上皮表面が剥離した後、マウスの気管から代表的な前方散乱および側方散乱プロットを示す単一の細胞懸濁液のフローサイトメトリー。 II。マウスの気管から管細胞におけるTROP2表現するための代表的なFACSプロット。
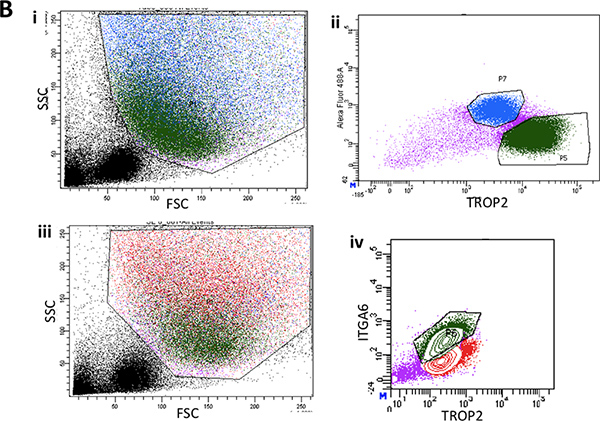
図2B。私。代表的な前方散乱および側方散乱プロットを示したマウス気管の下部3分の2の剥奪表層上皮からの単一細胞懸濁液のフローサイトメトリー。 II。 suコマンドでITGA6式の典型的なFACSプロット上皮をrface。 ⅲ。緑の中の基底細胞集団のゲーティングを示す背面表面上皮から前方および側方散乱のもう一つの代表的なFACSプロット。 IV。典型的なITGA6とTROP2が緑色に細胞集団を表現する。
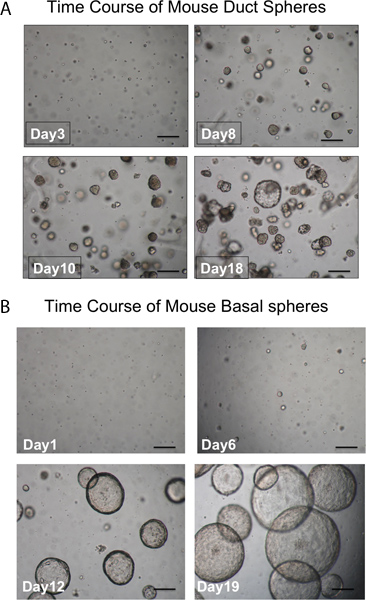
図3の球の開発のタイムコース。 A.ダクト球。球は培養液中で約1週間後にマトリゲルに表示する必要があると、ほとんどすべての外観が密集している。球体を形成していない単一細胞も見られている。 (スケールバー= 50μm)である。 B.基礎球は外観が大きく、管腔である。球体を形成していない単一細胞も見られている。 (スケールバー= 50μm)である。
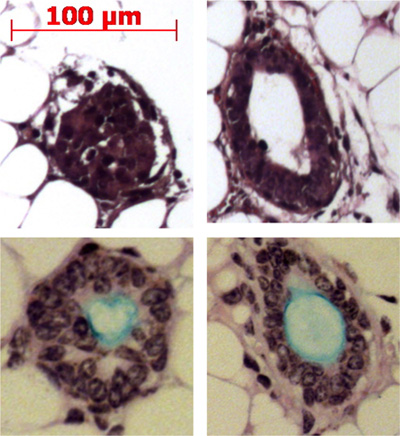
図4:粘膜下腺様構造の形成におけるマウスの脂肪パッドの結果にダクト幹細胞の注入。代表的な構造脂肪パッドに示されており、一部はアルシアンブルー過ヨウ素酸シッフ染色とムチン(ライトブルー)の製造示されています。
ディスカッション
気道からダクトおよび基底細胞を単離するために、この手法は、気道の修復及び再生及び気道疾患の我々の理解を向上させるために重要である。ここで説明する手法は、いくつかの重要なステップがあります。第一は、最適化された酵素消化期間です。第二は、細胞の毛刈りを防止するだけでなく、細胞塊を分割するために徐々に高くゲージ針で継シリアルを介して単一細胞懸濁液を作成す?...
開示事項
特別な利害関係は宣言されません。
謝辞
我々は、ブロード幹細胞研究センターのFACSを認識し、特に細胞選別を持つ彼らの助けのためにジェシカ·スコールズとフェリシアCodreaに感謝したいと思います。仕事がCIRM RN2-00904-1、K08 HL074229、米国胸部学会/ COPD財団ATS-06から065、懸念財団、UCLAのジョンソン総合がんセンター胸部腫瘍学プログラム/肺がんの胞子、カリフォルニア大学がんによって資金を供給された研究調整委員会とグウィンハーゼンチェリーメモリアル研究所(BG)。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | |
| 媒体10を完了して下さい : DMEM-F-12、50/50、1X) | メディアテック | 15から090-CV | |
| HEPES(15mMの) | インビトロジェン | 15630 | |
| 炭酸水素ナトリウム(3.6ミリメートルまたは0.03%) | インビトロジェン | 25080 | |
| L-グルタミン(4mMの) | メディアテック | 25から005-Clを | |
| ペニシリン(100 U / ml)を | メディアテック | 30から001-CI | |
| ストレプトマイシン(100μgの/ M) | メディアテック | 30から001-CI | |
| アムホテリシンB(0.25μg/ ml)を | ロンザ | 17-836R | |
| でsulin(10μg/ ml)を | シグマ | I6634 | |
| トランスフェリン(5μg/ ml)を | シグマ | T1147 | |
| コレラ毒素(0.1μg/ ml)を | シグマ | C8052 | |
| 上皮成長因子(25 ng / ml)を | BD | 354001 | |
| ウシ下垂体抽出物(30μg/ ml)を | インビトロジェン | 13028-014 | |
| ウシ胎児血清(5%) | フィッシャー | SH3008803HI | |
| レチノイン酸(0.05μM) | シグマ | R2625 | |
| マトリゲル減少した成長因子 | BD | 354230 |
表1は、。メディアコンポーネントを完了します。
| 試薬の名称 | 会社 | カタログ番号 | 注釈 |
| プロナーゼ | ロッシュ | 10165921001 | 0.15パーセントで使用: 4 AT-O / N°C消化合計気管細胞を(ALI培養用)を単離する -4時間消化4℃隔離するためにSMG |
| ディスパーゼ | BD Biosciences社 | 354235 | 室温で30分:16号機で使用 |
| DNase Iを | シグマ | DN25 | 0.5 mg / mlで使用される: 室温で20〜30分間 |
表2。気管の酵素消化のために使用される酵素。
参考文献
- Bartlett, J. A., Fischer, A. J., McCray, P. B. Innate immune functions of the airway epithelium. Contrib. Microbiol. 15, 147-163 (2008).
- Finkbeiner, W. E. Physiology and pathology of tracheobronchial glands. Respir. Physiol. 118, 77-83 (1999).
- Hegab, A. E. A Novel Stem/Progenitor Cell Population from Murine Tracheal Submucosal Gland Ducts with Multipotent Regenerative Potential. Stem Cells. , (2011).
- Jeffery, P. K. Morphologic features of airway surface epithelial cells and glands. Am. Rev. Respir. Dis. 128, S14-S20 (1983).
- Rock, J. R. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proc. Natl. Acad. Sci. U.S.A. 106, 12771-12775 (2009).
- Goldstein, A. S. Trop2 identifies a subpopulation of murine and human prostate basal cells with stem cell characteristics. Proc. Natl. Acad. Sci. U.S.A. 105, 20882-20887 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- McQualter, J. L., Yuen, K., Williams, B., Bertoncello, I. Evidence of an epithelial stem/progenitor cell hierarchy in the adult mouse lung. Proc. Natl. Acad. Sci. U.S.A. 107, 1414-1419 (2010).
- Inayama, Y. In vitro and in vivo growth and differentiation of clones of tracheal basal cells. Am. J. Pathol. 134, 539-549 (1989).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. Am. J. Physiol. Lung. Cell. Mol. Physiol. 283, L1315-L1321 (2002).
- Wu, X., Peters-Hall, J. R., Bose, S., Pena, M. T., Rose, M. C. Human Bronchial Epithelial Cells Differentiate to 3D Glandular Acini on Basement Membrane Matrix. Am. J. Respir. Cell Mol. Biol. , (2010).
- Ooi, A. T. Presence of a putative tumor-initiating progenitor cell population predicts poor prognosis in smokers with non-small cell lung cancer. Cancer Res. 70, 6639-6648 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved