Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Amiloid prekürsör protein intrasellüler Domain saflaştırılması ve toplama
Bu Makalede
Özet
APP hücre içi etki alanı (AICD) büyük ölçekli arıtma için bir yöntem tarif edilmektedir. Ayrıca teşvik etmek için yöntemler tarifedilmiştir In vitro AICD agregasyonu ve görselleştirme. Açıklanan yöntemler / biyokimyasal yapı AICD karakterizasyonu ve agregasyonu üzerinde moleküler şaperonlar etkileri için yararlıdır.
Özet
Amiloid prekürsör protein (APP) Alzheimer hastalığı (AH) patogenezi ile ilişkili bir tip I transmembran proteindir. APP büyük ekstrasellüler domain ve APP hücre içi etki alanı (AICD) olarak adlandırılan kısa bir sitosolik etki ile karakterize edilir. Salgı yolu ile olgunlaşma sırasında, APP α, β, ve γ-secretases 1 olarak adlandırılan proteaz tarafından bölünebilir. Ve γ-β secretases ile APP ardışık proteolitik bölünme bir küçük peptid proteolitik olarak adlandırıldı, Aβ, amiloidojenik ve senil plaklar çekirdek bileşenin üretimine yol açar. AICD sekretaz işlendikten sonra da membran kurtarılmasının ve Fe65 ve Tip60 olan etkileşimleri sayesinde, birden fazla hedef genlerin 2,3 transkripsiyon regülasyonu katılmaya çekirdeğine doğru olabilir. AICD içeren protein-protein etkileşimleri ticareti, işlenmesi, ve sanal-APP ve C-termin hücresel fonksiyonları etkileyebilirark parçaları. Biz son zamanlarda AICD AD-karıştığı moleküler şaperon ubiquilin-1 4 tarafından inhibe edilir vitro agrega ve bu süreç olduğunu göstermiştir. Fe65 7 bağlı olduğunda bu bulgularla tutarlı olarak, AICD hidrofobik etki ortaya çıkarmıştır ve kendinden vitro 5,6 olarak bozulup, ancak kararlı ikincil yapı alır. Biz ubiquilin-1 in vitro ve 4 sağlam hücreleri agregasyonu engelleyen AICD uygunsuz arası ve molekül içi etkileşimleri engeller önerdi. Çalışmaların çoğu AD patogenezinde APP rolü üzerinde odaklanırken, bu süreçte AICD rolü net değildir. AICD ekspresyonu sinyal yollarının 9 modüle etmek için, apoptoz 8 indüklemek için, ve 10 sinyal kalsiyum düzenleme gösterilmiştir. Bir transgenik fare modelinde AICD ve Fe65 Over ifade patolojisi 11 gibi Alzheimer indükler ve son zamanlarda AICD sutyen tespit edildiUygun antijen geri kazanım teknikleri 12 kullanırken batı blot tarafından özütündeki. AICD yapısal, biyokimyasal ve biyofiziksel çalışmaları kolaylaştırmak için, biz çok saf AICD protein Birleştirilerek büyük miktarlarda üretmek için bir prosedür geliştirmiştir. Daha ileri atomik kuvvet mikroskopi ile analiz AICD ve in vitro termal agregasyonu indüklenmesi için bir yöntem açıklanmaktadır. Açıklanan yöntemler, biyokimyasal biyo-fiziksel, ve yapısal AICD karakterizasyonu ve AICD agregasyonu üzerinde moleküler şaperonlar etkileri için yararlıdır.
Protokol
1. Rekombinant APP intrasellüler Domain (AICD) İfadesi
- Dönüşümü E. coli vektörü pGEX-4T-1 (GE Healthcare) klonlanmış insan AICD (artıkları APP 649-695, nöronal izoform numaralandırma) ile BL21 süzün. Bu vektör (GST), glutation-S-transferaz, bir füzyon proteininin C-terminal parçası olarak AICD ifade edecektir. Bu vektör de GST kısmının çıkarılmasını kolaylaştırmak için bir trombin bölünme sekansı kodlar. PGEX-4T-1'e AICD klonlama Detaylar önceki yayında 4 bulunabilir.
- Tek bir koloniden, ampisilin (100 ug / ml) LB et suyu, 10 ml inoküle, ve güçlü sallama ile 37 ° C de bir gece boyunca inkübe edilir.
- Ertesi sabah, gece boyunca kültür 5 ml bir bir litrelik bir şişeye 400 ml LB / ampisilin inoküle.
- Kuvvetli 600 nm'de optik yoğunluk kadar sallama 0,6-0,4 ulaşmıştır ile 37 ° C'de inkübe edin. Bu normalde 2 ile 2,5 saat sürer.
- Isopropil-beta-D-thiogalactopyranoside (IPTG) 0.4 mM ekleyerek GST-AICD ifadesini indükler. Kuvvetli 5 saat için sallama ile 37 ° C'de inkübe edin.
- 4 'de 15 dakika için 6000 x g'de santrifüjleyin hücreleri ° C. Hücre peleti İşlemin bu noktasında birkaç ay boyunca -80 ° C'de muhafaza edilebilir.
2. GST-AICD saflaştırılması
- Aşağıdaki gibi 50 ml lizis tamponu hazırlamak: 1 mM ditiotreitol, 1 mM etilendiamintetraasetik asit (EDTA),% 0.1 Triton-X100, 1 mM phenylmethylsulfonyl florid (PMSF), Tam proteaz inhibitör kokteyli (Roche Applied Science) ile fosfat tamponlu tuz. Buz üzerinde soğutun.
- Bakteriyel pelet (önceden dondurulmuş ise) çözülmebuz.
Bu noktada, tüm adımlar ° C proteoliz sınırlamak için 4 gerçekleştirilir önemlidir. Bütün borular, tamponlar ve diğer reaktifler önceden soğutulmuş olmalıdır. Bir Fransız basını ya lizis emülgatör kullanıyorsanız, bunlar da önceden soğutulmuş olmalıdır.
- İyice lizis tamponu, 20 ml bakteri pelet tekrar süspansiyon. Buz üzerinde 10 ml pipet ile vorteks ile tritürasyon bir kombinasyonu pelet tam olarak yeniden süspanse sağlayacaktır.
- 4 ° C'de 30.000 psi önceden soğutulmuş bir emülgatör ile yeniden süspanse bakteri hücrelerinde (örn., Avestin EmulsiFlex-C3) ya da Fransız basınçlı hücre, Min. Emülgatör, bir ikinci zaman içinde lizat geçirir. Önceden soğutulmuş bir 50 ml tüp içine lizat toplayın.
Bu iki aracın ana avantajı numune ısıtma minimize olmasıdır. Sonication arasında yaygın olarak kullanılan tekniktir sonikasyon probunun ucunda belirgin ısı üretir veRekombinant proteinlerin birleştirilmesi ile sonuçlanabilir.
- 30 dakika için 15,000 x g'de santrifüjleyin lizat. Ayırın ve bir önceden soğutulmuş bir 50 ml tüp içine supernatant tutun.
- Glutation-agaroz (Sigma-Aldrich),% 50 sulu, 500 ul ekle. 4 ° C'de 30 dakika süreyle döndürme 50 mM Tris 7.8,% 0.1 Triton-X100, 0.5 mM ditiyotreitol, 10 mM glutatyon: Örnek dönerken, taze tampon elüsyon yapmak.
Oda sıcaklığında gerçekleştirilir protokolünün tek adım elüsyon adımdır. Bu nedenle, işlem tampon maddesi oda sıcaklığında muhafaza edilir. Seyreltme Tampon maddesi taze hazırlanmış olmalıdır.
- Kaba (90-130 um) filtreler (Evergreen Scientific). Fosfat 3 ml sütun 5 kez yıkayın ile atılabilir bir 5 "polistiren kromatografi kolonu içine lizat ve bulamaç dökün tamponlu salin.
- Sütunun alt kapağı ve oda sıcaklığında elüsyon tampon 500 ul ilave edin. Bir üst kapağıkolon ve oda sıcaklığında 5 dakika için döner. Soğutulmuş bir 1,5 ml mikrofuge'de tüpüne eluat toplayın. Elüsyon iki kez daha (1.5 ml toplam eluat) tekrarlayın.
- Fosfat 4 litre 10.000 molekül ağırlığı kesme diyaliz membran (örneğin, Thermo Scientific Slide-A-Lyzer diyaliz kasetleri) içindeki elüsyon Dialyze 4 ° C'de bir gece tamponlu salin Fosfat ek bir 4 litre karşı Dialyze 4'te tamponlu salin ° C 1 saat ertesi gün için.
- Diyaliz kaset proteini çıkarın ve GST-AICD verimi belirlemek için bir protein kantifikasyon tahlil gerçekleştirin. Kültür, 400 ml 'den, tipik bir temizleme 10-20 mg / ml' lik konsantrasyonlarda protein saflaştırılmış> 20 mg verimleri ile sonuçlanır. -80 200 ul alikot ve dondurucuya kısım protein ° C.
3. Trombin GST-AICD bölünmesi ve AICD saflaştırılması
- Çözülme 200 Saflaştırılmış GST-AICD ul ve 1 U / ul trombositopeni 20 ul ekleyinLütfen 37 gece inkübe ° C
Trombin kalite ve saflık üreticileri arasında önemli ölçüde değişir, ve kirlenme önemli bir kaynağı olabilir. Biz GE Healthcare (reaktiflerin tabloya bakınız) trombin kullanın. Gece boyunca inkübasyondan sonra, füzyon proteininin>% 95 (Şekil 1B) parçalanabilen gerekmektedir.
- Trombin ile gece boyunca bölünme sonra, serbest AICD bir kısmını toplama yapılan ve çözelti bulanık görünebilir olması muhtemeldir. 4. 30 dakika için 20,000 x g'de santrifüj ile birleştirilmiş malzeme temizleme ° C. Önceden soğutulmuş bir mikrofüj tüpü içine süpernatantı.
- Sırasıyla, GST ve trombin çıkarmak için en az% 50 glutation-agaroz bulamacı ve 50 ul% 50 p-aminobenzamidine-agaroz bulamaç 50 ul ekle. Oda sıcaklığında 5 dakika boyunca rotasyonu ile inkübe edin.
- Sediman agaroz boncuk kısaca santrifüjleyin ve taze bir tüp içine süpernatant kaldırmak. T Özüglutatyon-agaroz ile GST dört kez daha. P-aminobenzamidine-agaroz ile tek bir ekstraksiyon trombin 20 U kaldırmak için yeterlidir.
- Saflaştırılmış AICD 5 ul üzerinde bir protein denemesi miktarının gerçekleştirin. Bir 400 ml kültürden tipik verimler 0,2-0,5 mg / ml 'lik bir konsantrasyonda 50-100 ug vardır. Yüksek verim GST-AICD geniş hacimli yarma ile mümkündür.
Saflaştırılmış AICD biyokimyasal / biyofiziksel karakterizasyonu için taze olarak hazırlanması gerekir. Kullanılmayan malzeme atılmalıdır. Bu numune ve liyofilize tampon 6 daha küçük bir hacim içinde resuspending ile AICD konsantre etmek de mümkündür. AICD tespit blot (gibi bir filtre tuzak veya dot blot assay sonra), membran antijeni alma Pimplikar ve Suryanarayana 12 tarafından açıklandığı gibi yapılmalıdır gerektiriyorsa.
4. Atomik Kuvvet Mikroskobu için AICD Toplama (AFM)
- Seyreltik taze p AICD hazırlananhosphate 0.1 mg / 15 ul'lik bir son hacim içinde ml 'lik bir konsantrasyona tamponlu salin. Bu noktada, çeşitli bileşikler ve / veya proteinler AICD agregasyonunu inhibe olup olmadığını belirlemek için ilave edilebilir. Örneğin, ubiquilin-1 eşit molar konsantrasyonlarda bu tahlil 4 AICD birleştirilmesi önlemek olduğunu göstermiştir.
Aynı zamanda, tuzak filtre deneyleri ve ışık saçılımı 4 gibi biyokimyasal deneyler için daha büyük bir toplam reaksiyon hacmi mümkündür. Biz başarı 1 uM gibi düşük konsantrasyonda seyreltilir AICD ile 400 ul kadar büyük reaksiyon karışımlarını filtre tuzak deneyleri gerçekleştirerek yaşamıştır.
- 48 saat boyunca bir Eppendorf Thermomixer 800 rpm'de çalkalanarak 43 ° C'de örnekleri inkübe edilmesiyle termal toplama øndükle. Bu sıcaklık modeli şaperon substrat sitrat sentaz 4,13 arasında termal toplama incelemek şaperon deneyleri dayalı seçildi.
Termal birleştirme moleküller agrega oluşumu ile sonuçlanan bir yerel olmayan yapı (zengin genellikle beta tabakası olan) bir yerli bir proteinin yapısal geçiş ikna etmek için yaygın olarak kullanılan bir yöntemdir. Termal agregasyon da uygun olmayan moleküller arası etkileşimleri (ve bu nedenle termal birleştirme geciktirmek veya önlemek) oluşturan ikinci hidrofilik bölümlere kalkan moleküler şaperonların, fonksiyonu incelemek için kullanılır.
- Taze yarılan mika üzerine deiyonize su ve spot 2 ul 20 kat Numuneyi seyreltin. Gecede bir desikatöre örnek kurulayın. Bu deneysel görüntüleme için en uygun seyreltme belirlemek için gerekli olacaktır ve bu nedenle 10 arasında değişen çeşitli seyreltiler - 100-kat için bir tedbirdir.
- Modunda 14 dokunarak AFM işletim kullanarak toplu AICD gözünüzde canlandırın. Kullanılan konsol 2 nm nominal ucu yarıçapı ile altın kaplı mikro keskin nitrür kolları (MSNL, Bruker) vardır. Tipik dokunarak amplitüdleri during görüntüleme konsol (30-50 kHz) rezonans frekansında 10-20 nm.
Biz farklı protein agrega görüntü kalitesi ve kontrast uygulanan kuvvet ve deney süresine bağlı olduğu bulundu. Ucu tarafından numune pertürbasyon en aza indirmek için, biz% 95 üzerinde bir ayar noktasına oranı tutmak ve 5-10 dakika her numunenin tarama sınırlayarak nispeten düşük uygulanan kuvvet yapılmaktadır. Görüntü işleme WSxM yazılımı (Nanotec) ile yapıldı. Standart görüntü işleme düzlemi çıkarma ve düzleştirme oluşuyordu. Bizim laboratuarları kullanan bir "ev-built" ticari bir tarama prob mikroskobu kontrol sistemi (Nanotec) da koordine AFM 15.
5. Temsilcisi Sonuçlar
İfade ve GST-AICD nispi zenginleştirme Şekil 1A 'de gösterilmiştir. Ayrılmasından sonra, füzyon proteinin, çözünür kesir halinde mevcut olduğu ve bu nedenle inclusi özütlemeceset üzerinde gerekli değildir. Glutatyon agaroz sütundan akıtılan malzemenin>% 95 saf. Şekil 1 'de gösterildiği hazırlanması sırasında, kolon yıkandı, protein konsantrasyonu 14.5 mg / ml idi, ve verimi 22 mg (400 ml' lik bir başlangıç kültürü) idi. Trombin 20 U gecede bu preparatın 200 ul Dilinim füzyon proteini (Şekil 1B) hemen hemen% 100 bölünme sonuçlandı. ("Cleaved" şeritli, Şekil 1B) Coomassie mavisi ile boyanarak bulunmamalıdır olarak kullanılan trombin miktarı yeterince düşük. Trombin ve GST çıkarılması ancak 0.35 mg / ml 'lik bir konsantrasyonda AICD 70 ug bu hazırlık içinde bir verim ile>% 90 saf olan, malzeme kaybı ile sonuçlandı. Şekil 1C AICD birleştirilmesi için akış şemasını göstermektedir ve sonraki analizler. AFM tarafından görüntülenmiştir AICD agregalar genellikle spheroid / amorf, ve boyut aralığı 50 ila 100 nm (Şekil 1D, F). Toplulaştırılmışmalzeme şaperon ubiquilin-1 eşmolar bir miktarda birleştirme reaksiyonu (Şekil 1E) 4 ilave edildiği zaman algılanamaz.
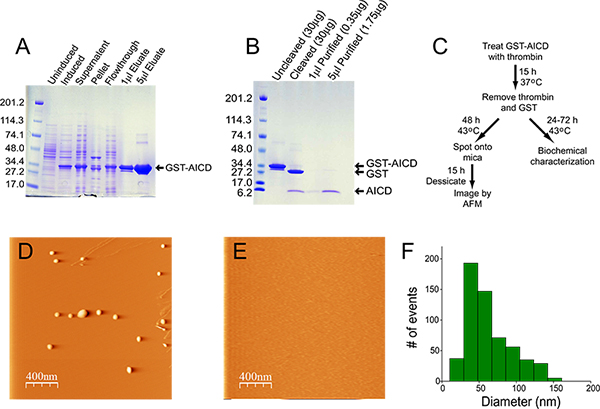
Şekil 1. Arıtma ve AICD toplulaştırılması. Örneklerinin A) Coomassie mavisi boyaması arıtma sürecinin her aşamasında toplanan. Uninduced ve isteyerek örnekleri için, toplam bakteri 20 ul jel üzerinde çalışıldı. Süpernatant fraksiyonu için, 5 ul lizat (20 ml toplam hacmi) jel üzerinde çalıştırıldı. Topak kesir için, pelet lizis tamponu, 20 ml içinde tekrar süspanse edilir, ve bu madde 5 ul 4 az 30 dakika süreyle bir su banyosuna sonikatör içinde sonike edilmiştir ° C'de önceden jel üzerine yüklemeden. Flowthrough için 5 ul jel üzerinde çalışıldı. Jel üzerine yüklenen arındırıldı ve miktarları gösterilmiştir. Uncleaved ve bölünmüş GST-AICD (2 ul) ve 1 ve 5 ve m B) Coomassie mavi lekeli jeliu; l saflaştırılmış AICD. AICD arıtma, toplama ve analiz C) Akış Şeması. D, E) Örnek AFM görüntü termal olarak moleküler şaperon ubiquilin-1 yokluğunda (D) varlığında ve (E) AICD derlenmiştir. AICD agrega boyutu dağılımı F) Histogram.
Tartışmalar
Bu protokolü biz, yapısal biyofiziksel ve biyokimyasal analizler için son derece saf AICD elde etmek için bir prosedürü var. Bu işlem karmaşık kromatografi ekipman gerektiren ve bu nedenle birçok laboratuar erişilebilir değil. Diğer gruplar / biyokimyasal yapısal analizler için GST-AICD 17-19 dahil AICD 5-7,16 saflaştırılmış var. Önceki protokol dezavantajları zayıf AICD 16, çözünürlük, ideal bir saflık 17 den daha az, ve boyut dışlama 16
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar cDNA APP Dr Hui Zheng (Baylor College of Medicine) teşekkür etmek istiyorum. Bu çalışma NIH hibe R21AG031948 (DB, JMB), F30AG030878 (ESS), R01DK073394 (AFO), Biyomedikal Araştırma John Sealy Memorial Endowment Fund (AFO), ve Jean C. ve William D. Willis Nöroloji Araştırma Vakfı tarafından finanse edildi (ESS). JMB Translasyonel Araştırmacı Programı, bir bilgin ve Texas Medical Branch Claude E. Pepper Eski Amerikalıların Bağımsızlık Merkezi Of Üniversitesi üyesi (NIH Grants sırasıyla UL1RR029876 ve P30-AG-024832, tarafından desteklenen) 'dir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| pGEX-4T-1 | GE Healthcare | 28-9545-49 | |
| Trombin | GE Healthcare | 27-0846-01 | |
| Ampisilin | Fisher Scientific | BP1760 | |
| Bradford protein tayini reaktifi | Bio-Rad | 500-0002 | |
| Coomassie mavisi | Bio-Rad | 161-0786 | |
| IPTG (izopropil-beta-D thiogalactopyranoside) | Sigma-Aldrich | I6758 | |
| Glutatyon-agaroz | Sigma-Aldrich | G4510 | |
| p-aminobenzamidine-agaroz | Sigma-Aldrich | A7155 | |
| Komple proteaz inhibitörü kokteyl | Roche | 11836170001 | |
| Slide-A-Lyzer diyaliz kasetleri | Thermo Scientific | 66380 | |
| Kromatografi kolonları | Evergreen Bilimsel | 208-3367-050 | |
| Emülgatör | Avestin, Inc | EmulsiFlex-C3 | Tavsiye |
| Eppendorf Thermomixer | Eppendorf | 022670107 | |
| Mika Diskler | Ted Pella | 50-12 | |
| AFM konsollar | Bruker | MSNL-10 | |
| WSxM yazılım | Nanotec | N / A | Free indir |
Referanslar
- De Strooper, B., Vassar, R., Golde, T. The secretases: enzymes with therapeutic potential in Alzheimer disease. Nature reviews. Neurology. 6, 99-107 (2010).
- Chang, K. A., Suh, Y. H. Possible roles of amyloid intracellular domain of amyloid precursor protein. BMB reports. 43, 656-663 (2010).
- McLoughlin, D. M., Miller, C. C. The FE65 proteins and Alzheimer's disease. J. Neurosci. Res. 86, 744-754 (2008).
- Stieren, E. S. Ubiquilin-1 is a molecular chaperone for the amyloid precursor protein. J. Biol. Chem. 286, 35689-35698 (2011).
- Ramelot, T. A., Nicholson, L. K. Phosphorylation-induced structural changes in the amyloid precursor protein cytoplasmic tail detected by NMR. J. Mol. Biol. 307, 871-884 (2001).
- Ramelot, T. A., Gentile, L. N. Transient structure of the amyloid precursor protein cytoplasmic tail indicates preordering of structure for binding to cytosolic factors. Biochem. 39, 2714-2725 (2000).
- Radzimanowski, J. Structure of the intracellular domain of the amyloid precursor protein in complex with Fe65-PTB2. EMBO Rep. 9, 1134-1140 (2008).
- Ohkawara, T., Nagase, H., Koh, C. S., Nakayama, K. The amyloid precursor protein intracellular domain alters gene expression and induces neuron-specific apoptosis. Gene. 475, 1-9 (2011).
- von Rotz, R. C. The APP intracellular domain forms nuclear multiprotein complexes and regulates the transcription of its own precursor. J. Cell Sci. 117, 4435-4448 (2004).
- Hamid, R. Amyloid precursor protein intracellular domain modulates cellular calcium homeostasis and ATP content. J. Neurochem. 102, 1264-1275 (2007).
- Ghosal, K., Stathopoulos, A., Pimplikar, S. W. APP intracellular domain impairs adult neurogenesis in transgenic mice by inducing neuroinflammation. PLoS ONE. 5, e11866 (2010).
- Pimplikar, S. W., Suryanarayana, A. Detection of APP intracellular domain in brain tissue. Met. Molecul. Biol. 670, 85-91 (2011).
- Buchner, J., Grallert, H., Jakob, U. Analysis of chaperone function using citrate synthase as nonnative substrate protein. Met. Enzymol. 290, 323-338 (1998).
- Hansma, H. G. Recent advances in atomic force microscopy of DNA. Scanning. 15, 296-299 (1993).
- Valbuena, A. Quasi-simultaneous imaging/pulling analysis of single polyprotein molecules by atomic force microscopy. Rev. Sci. Instrum. 78, 113707 (2007).
- Radzimanowski, J., Beyreuther, K., Sinning, I., Wild, K. Overproduction, purification, crystallization and preliminary X-ray analysis of human Fe65-PTB2 in complex with the amyloid precursor protein intracellular domain. Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 64, 409-412 (2008).
- Chen, T. Y., Liu, P. H., Ruan, C. T., Chiu, L., Kung, F. L. The intracellular domain of amyloid precursor protein interacts with flotillin-1, a lipid raft protein. Biochem. Biophys. Res. Commun. 342, 266-272 (2006).
- Kim, M. Y. Regulation of Notch1 signaling by the APP intracellular domain facilitates degradation of the Notch1 intracellular domain and RBP-Jk. J. Cell Sci. 124, 1831-1843 (2011).
- Lazarov, O. Axonal transport, amyloid precursor protein, kinesin-1, and the processing apparatus: revisited. J. Neurosci. 25, 2386-2395 (2005).
- Kakuda, N. Equimolar production of amyloid beta-protein and amyloid precursor protein intracellular domain from beta-carboxyl-terminal fragment by gamma-secretase. J Biol. Chem. 281, 14776-14786 (2006).
- Gosal, W. S., Myers, S. L., Radford, S. E., Thomson, N. H. Amyloid under the atomic force microscope. Protein Pept. Lett. 13, 261-270 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır