Method Article
Una guía para la moderna cuantitativa fluorescente Western Blot con las estrategias de solución de problemas
En este artículo
Resumen
The advancement of western blotting using fluorescence has allowed detection of subtle changes in protein expression enabling quantitative analyses. Here we describe a robust methodology for detection of a range of proteins across a variety of species and tissue types. A strategy to overcome common technical problems is also provided.
Resumen
Los finales de los años 1970 vio el primer uso informado públicamente de la transferencia de western, una técnica para evaluar la presencia y abundancia relativa de las proteínas específicas dentro de muestras biológicas complejas. Desde entonces, la metodología de transferencia de western se ha convertido en un componente común de los biólogos moleculares el repertorio experimental. Una búsqueda superficial de PubMed utilizando el término "western blot" sugiere que más de doscientos veinte mil manuscritos publicados han hecho uso de esta técnica para el año 2014. Es importante destacar que, en los últimos diez años se ha producido avances técnicos de imagen, junto con el desarrollo marcadores fluorescentes de sensibles que han mejorado la sensibilidad y arrojado aún mayores rangos de detección lineal. El resultado es una fluorescencia ahora verdaderamente cuantificable basado Western Blot (QFWB) que permite a los biólogos para llevar a cabo el análisis de expresión comparativo con mayor sensibilidad y precisión que nunca antes. Muchos Western Blot "optimizado"Existen metodologías y se utilizan en diferentes laboratorios. Estos a menudo resultan difíciles de implementar debido a la exigencia de modificaciones procesales sutiles pero indocumentados. Este protocolo proporciona una descripción completa de un método QFWB establecido y robusto, completo con las estrategias de solución de problemas.
Introducción
Western Blot (WB) es una técnica analítica desarrollado originalmente en la década de 1970 para determinar la presencia o ausencia de una proteína de interés en una muestra biológica compleja, tal como un homogeneizado de tejido 1. Comúnmente conocido como la inmunotransferencia de proteínas, debido a la interacción anticuerpo-antígeno clave, la metodología consiste en 5 pasos distintos: 1) la separación electroforética de las proteínas por su punto isoeléctrico; 2) la transferencia a un nitrocelulosa o difluoruro de polivinilideno (PVDF) membrana; 3) marcar usando un anticuerpo primario específico para la proteína de interés; 4) la incubación con un anticuerpo secundario dirigido contra el anticuerpo primario; y 5) la visualización.
Visualización metodología ha evolucionado con el tiempo para mejorar la seguridad y la sensibilidad. Algunos de los primeros WB se llevaron a cabo utilizando etiquetas de radio etiquetadas que luego progresaron a los métodos quimioluminiscentes más ampliamente utilizado (ECL) colorimétrico y luego. RadioactiviTy se marcó directamente en sondas para antígenos específicos mientras que las metodologías colorimétricas y ECL utilizan una técnica indirecta etiquetado con una enzima tal como reportero alcalina fosfatasa o estreptavidina peroxidasa de rábano picante (HRP) 2. La intensidad de etiquetado del producto cromógeno o luminiscente se mide utilizando densitometría por lo que la intensidad de la señal, fuerte o débil, más o menos indica la presencia de la proteína de interés en la muestra. ECL es la metodología más sensible y, por tanto, favorecido 2, pero los 3 métodos se desarrollaron inicialmente en la película de rayos X con técnicas de imagen digital más sofisticados posteriormente establecidas 3. El avance de la imagen digital de WB no sólo permite a un investigador para determinar la presencia o ausencia de su proteína de interés, pero también permitió una inferencia con el nivel de expresión de una proteína seleccionada cuando se compara con otras muestras y por lo tanto puede ser denominado "semi-cuantitativa & #8221 ;. Recientemente, una tecnología de transferencia de western verdaderamente cuantitativo y más sensibles ha sido desarrollado por el cual el nivel de fluorescencia medido está directamente relacionada con la cantidad y la expresión de una sola proteína dentro de una muestra: cuantitativa fluorescente Western Blot (QFWB).
Al comparar con el etiquetado QFWB ECL, el uso de un anticuerpo secundario fluorescente genera un perfil de detección lineal 4. Esto está en contraste con las técnicas ECL donde la linealidad de la señal generalmente se produce con cargas bajas de proteínas por debajo de 5 mg y la saturación de señal directamente relacionados con la expresión de la proteína, es decir, con genes de limpieza ubicuamente expresadas 5,6. Esta disparidad es muy probablemente causado por un mayor número de sitios de unión disponibles para un sustrato ECL avidina para unirse a un secundario biotinilado, que resulta en una mayor probabilidad de potencial de saturación de la señal. Esta es una de las principales razones de inmunotransferencia ECL base que se conoce como only "semi-cuantitativa" 7. El punto de saturación de la señal es de importancia crítica en la medición de las diferencias sutiles en los niveles de expresión y puede dar lugar a mediciones inexactas. En los últimos años el advenimiento de técnicas proteómicas generalizadas detallando cada vez mayor sensibilidad y la identificación de las diferencias sutiles de expresión ha dado lugar a una confianza cada vez mayor en la transferencia Western cuantitativa verdaderamente para los experimentos de validación de 8,9. La aplicación de la metodología sensible, robusto y verdaderamente cuantitativo es por lo tanto crucial.
Muchas metodologías Western Blot "optimizados" han sido utilizados por los laboratorios independientes, que con frecuencia resultan difíciles de establecer o reproducir debido a los ajustes metodológicos sutiles que pueden no estar reflejados en los protocolos documentados formales. Se trata de un protocolo establecido y robusto para QFWB y, además, ofrece valiosas estrategias para solucionar problemas comunes that puedan surgir durante la ejecución.
Este protocolo se optimizó originalmente para su uso con homogenados de cerebro murino, pero desde entonces ha sido utilizado con eficacia en una amplia gama de muestras de tejidos y especies 4,9,10. Variaciones del protocolo potenciales necesarios para la solución de problemas específicos se incluyen.
Protocolo
Este protocolo ha sido optimizado utilizando tampones producidos comercialmente, geles y pilas de transferencia con el fin de reducir la variabilidad y mejorar la consistencia. Consulte la Lista de materiales para obtener una lista completa de consumibles necesarios.
Protocolo WB fluorescente usando I-Blot transferencia rápida y sistema de imagen Odyssey LI-COR
1. Preparación de la muestra
- Selección de búfer / preparación
- Seleccionar un tampón de extracción apropiado para homogeneización de la muestra y asegurar que el tampón es compatible con todas las técnicas de aguas abajo para ser empleados. Preparar un tampón de extracción: tampón RIPA (25 mM Tris-HCl (pH 7,6), NaCl 150 mM, 1% NP-40, desoxicolato de sodio al 1%, 0,1% SDS) que contiene 5% de cóctel inhibidor de la proteasa antes de probar el aislamiento.
NOTA: Hay muchos tipos diferentes de tampones de extracción disponibles y se seleccionan dependiendo de la localización de la proteína de interés dentro de la célula. Estos incluyen, pero no estánlimitado a tampón RIPA (célula entera, mitocondrial y componentes nucleares), NP-40 tampón de lisis (células enteras o unido a membrana) y Tris-Triton (citoplásmica esquelético unido). Sin embargo, algunos detergentes químicos dentro de los tampones de extracción pueden ayudar a solubilizar o incluso desactivar una proteína, pero pueden interferir con la determinación de la proteína cuando se usa un ensayo de determinación de la proteína específica, es decir, ácido bicinconínico (BCA) de ensayo. Revise las instrucciones del fabricante con respecto a la compatibilidad química con el ensayo.
- Seleccionar un tampón de extracción apropiado para homogeneización de la muestra y asegurar que el tampón es compatible con todas las técnicas de aguas abajo para ser empleados. Preparar un tampón de extracción: tampón RIPA (25 mM Tris-HCl (pH 7,6), NaCl 150 mM, 1% NP-40, desoxicolato de sodio al 1%, 0,1% SDS) que contiene 5% de cóctel inhibidor de la proteasa antes de probar el aislamiento.
- La extracción de proteínas / solubilización
- Macerar manualmente la muestra de tejido con tijeras y / o bisturí seguido de homogeneización utilizando un Dounce o de un homogeneizador eléctrico de mano con una punta de polipropileno en el tampón de extracción preparados a aproximadamente 1:10 w v (volumen de peso de tejido / tampón) / hasta un homogeneizado suave / coherente se produce.
NOTA: Para los más pequeños, precioso / difícil obtener muestras, extracciones de detergente basado can todavía ser eficaz hasta 1: 5. - Publique homogeneización, las muestras de centrifugación a 20.000 xg durante 20 min a 4 ° C. Eliminar el sobrenadante que contiene las proteínas solubilizadas y almacenar a -80 ° C hasta que sea necesario. Conservar los sedimentos insolubles para permitir la extracción de más más estrictas si es necesario más adelante. Continúe con el paso de proteínas determinación 1.3.
- Macerar manualmente la muestra de tejido con tijeras y / o bisturí seguido de homogeneización utilizando un Dounce o de un homogeneizador eléctrico de mano con una punta de polipropileno en el tampón de extracción preparados a aproximadamente 1:10 w v (volumen de peso de tejido / tampón) / hasta un homogeneizado suave / coherente se produce.
- La determinación de proteínas
- Determinar la concentración de proteína en cada muestra extraída mediante el uso de ya sea un BCA, Bradford o ensayo similar. Cuando el cálculo de la curva estándar, asegurar que el coeficiente de la relación de determinación, valor R cuadrado, es mayor que o igual a 0.99 que refleja la determinación más precisa de la abundancia de proteínas dentro de las muestras 15.
NOTA: Todas las muestras que se comparan por QFWB deben analizarse en contra de la misma curva estándar.
- Determinar la concentración de proteína en cada muestra extraída mediante el uso de ya sea un BCA, Bradford o ensayo similar. Cuando el cálculo de la curva estándar, asegurar que el coeficiente de la relación de determinación, valor R cuadrado, es mayor que o igual a 0.99 que refleja la determinación más precisa de la abundancia de proteínas dentro de las muestras 15.
- Preparación de la muestra
- Planificar y registrar el orden de carga de escaleras y muestras de 2 g idénticosels: 1 para la transferencia de gel y el gel de 2 como control de carga. Cargue el control y muestras de "tratados" de manera secuencial para evitar cualquier sesgo que pueda surgir con la transferencia de pobres o inequívoca.
- Calcular el volumen proteína requerida para cada muestra. Una carga de proteínas estándar para detectar proteínas en aislamientos neuronales es de 15 mg. Hacer cada muestra hasta un volumen de 10 l con dH 2 O. Añadir 5 l de tampón de carga, vórtice y se calienta a 98 ° C durante 2 min.
- Incluir una muestra de control positivo tal como una proteína recombinante para ayudar con la identificación de la banda correcta de interés. Sin embargo preparar la muestra de control positivo correctamente siguiendo las instrucciones del fabricante para evitar la selección de las bandas equivocadas. Véase la Figura 1.
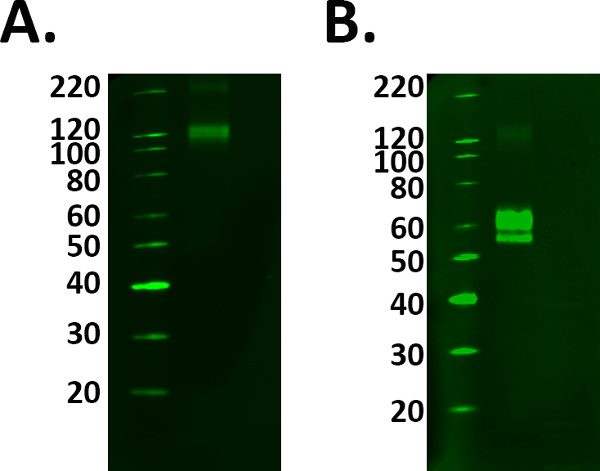
Figura 1. PSelección de control ositive. La adición de controles positivos para un experimento confirma el etiquetado detectado es real. Sin embargo, se debe tener cuidado para asegurar que su control está funcionando correctamente antes de utilizar muestras experimentales. A) proteína de fusión TREM 2 se cargó a las instrucciones del fabricante de 1 g / ml, sin embargo, el etiquetado observado en 110 conflictos kDa con la hoja de datos predijo molecular peso de 60-70 kDa. B) Después de la adición y la incubación con el agente reductor, el etiquetado proteína de fusión se detectó en el peso molecular predicho. Sin embargo, esto significaba una mayor carga de proteína se requiere como el proceso de reducción disminuyó la señal de la proteína.
2. electroforética separación de las proteínas
- Preparación de 4-12% de gel de Bis / Tris (1,0 mm)
NOTA: geles de gradiente se utilizan para producir una mayor separación de proteínas a través de una gama amplia de peso molecular.- Seleccionar y preparar MESo tampón MOPS (1 L por tanque) diluyendo con dH 2 O. Tampón MES produce una mejor resolución de las proteínas dentro de 3,5 a 160 kDa mientras MOP se prefiere funcionamiento de amortiguación para detectar las proteínas de mayor peso molecular por encima de 200 kDa sin embargo tendrá resolución más pobre de proteínas de bajo peso molecular por debajo de 15 kDa.
- Retire el peine y tira de cinta que cubre el pie del gel. Lave suavemente los pozos con tampón utilizando una pipeta de 1 ml. Llenar los pocillos con tampón y aseguran no hay burbujas permanecen en el gel.
- Preparación de gel y la carga
- Inserte los geles en el tanque y llene el compartimiento de gel entre otras con tampón para asegurar que todos los sellos están trabajando de manera efectiva.
- Añadir 3 l de estándar de peso molecular en el primer pocillo en gel 1 y 2. gel de carga 10 l de cada muestra en los pocillos subsiguientes.
NOTA: Con la excepción de las escaleras de mano, gel de 1 y 2 de gel deben ser idénticos. Es imperativo ésimoen el estándar de peso molecular pre-manchado utilizado para gel 2 es azul y visible cuando se utiliza una mancha de proteína total con el fin de ser visible en el canal 700 de reproductor de imágenes Odyssey. - Una vez que se cargan ambos geles, llene el tanque con el tampón de desarrollo restante y asegurar la tapa.
- La electroforesis
- "Run" el gel a 80 V durante 4 min para asegurar la muestra entra en la matriz de gel de poliacrilamida de una manera uniforme. A partir de entonces aumentar la tensión y la hora a 180 V durante 50 min, respectivamente, o hasta que el colorante de la muestra se puede ver en el pie del gel.
NOTA: Superior tensiones se pueden aplicar para lograr tiempos de ejecución más cortos. Sin embargo, esto puede resultar en geles "sonrientes", donde las muestras medias de los geles se ejecutan más rápido que las muestras de los carriles exteriores causadas por un aumento de la temperatura de 14.
- "Run" el gel a 80 V durante 4 min para asegurar la muestra entra en la matriz de gel de poliacrilamida de una manera uniforme. A partir de entonces aumentar la tensión y la hora a 180 V durante 50 min, respectivamente, o hasta que el colorante de la muestra se puede ver en el pie del gel.
3. manchas de proteína total de la Gel Loading control
- Gel Release 2 desde el cassette utilizandoun cuchillo gel. Retire los pozos y los pies de la gel. Marque el gel para ayudar a la orientación.
- Decantar aproximadamente 30 ml de la tinción de proteínas en una placa de Petri cuadrada (tamaño aproximado 12 x 12 cm). Coloque gel 2 en la mancha de proteína, lo que garantiza la solución cubre todo el gel, a continuación, agitar el gel para un mínimo de 1 hora a temperatura ambiente para teñir.
- Decantar la mancha y lave las proteínas 3x gel en agua destilada antes de la visualización. Continúe con el paso 6.3 para visualizar.
Proteína 4. I-Blot Semi Seco Transferencia rápida
NOTA: Todos los reactivos necesarios para la transferencia de proteínas utilizando la máquina I-Blot son productos comerciales diseñados específicamente para la metodología I-Blot y se pueden encontrar en la Lista de materiales.
- Prepare la pila de transferencia "de abajo". Quite la cubierta de papel de aluminio y pre-húmedo con tampón directo desde el depósito de gel. Papel de filtro Pre-húmedo con agua destilada.
- Repita el paso 3.1 y lugar de gel de 1 ala pila preparado "fondo" de transferencia.
- Coloque el papel de filtro pre-húmedo sobre el gel. Enrolle el papel de filtro y el gel para asegurar que no quedan atrapadas burbujas entre las capas.
- Retire la tapa de lámina de la pila de transferencia superior y poner la pila de la parte superior en la parte superior del papel de filtro y la pila inferior. Enrolle la pila de transferencia de "sándwich" para eliminar cualquier burbuja de aire.
- Inserte la esponja del kit de pila de transferencia sobre la tapa de la máquina I-Blot. Coloque el sándwich pila de transferencia sobre el espacio dedicado en la máquina I-Blot luego cierre la tapa firmemente. Inicie el I-Blot y transferir el 8,5 min en el programa 3.
- Si hay una señal de proteína baja o alta desiguales: bajo proporciones de proteínas de peso molecular, probar los tiempos de transferencia del fabricante al utilizar un método de transferencia semi seco "rápida". Ejecutar un protocolo simple de optimización utilizando repeticiones de muestra de carga idénticas para determinar la combinación ideal de tensión / tiempo de transferencia como se ve en la figura 2 .
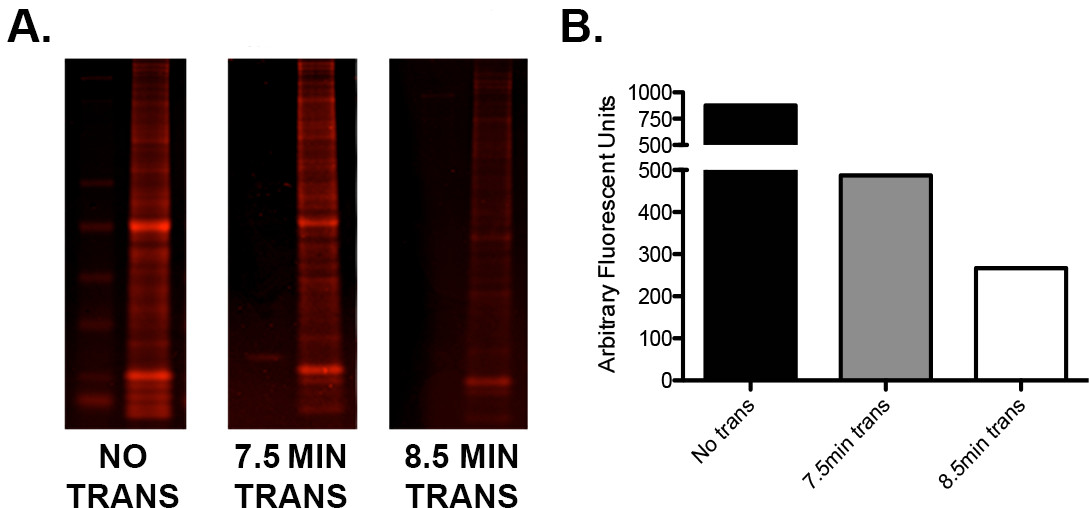
Figura 2. Optimización de la transferencia usando la I-Blot. A) Un único gel cargado con escalera y 15 g de homogeneizado de cerebro murino entero en tres repeticiones en tándem se cortó en tres secciones. Una sección no fue transferido, uno fue transferido por 7,5 min (según las instrucciones del fabricante) y una para 8,5 min. Las secciones de gel fueron teñidas con tinción de proteínas azul instantánea, escaneado en un formador de imágenes de infrarrojos en el canal 680 y cuantificado. B) Representación gráfica de los valores de cuantificación que demuestran la diferencia en el contenido de proteína residual de cada gel después de 0, 7,5, y 8,5 min de la transferencia. Tenga en cuenta que un minuto adicional de tiempo de transferencia resultó en la transferencia de la proteína adicional de aproximadamente 45%.e.com/files/ftp_upload/52099/52099fig2large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta cifra.
5. Detección de anticuerpos de proteínas
- Preparación de membrana y el bloqueo de
- Retire la pila de la máquina de transferencia de la I-Blot. Quite la capa superior y el papel de filtro exponiendo el gel en la pila de transferencia inferior.
- Cortar alrededor del gel con un bisturí y asegúrese de que un corte triangular para fines de orientación se representa en la membrana. Tras el recorte de la membrana, la proteína mancha el gel para comprobar la eficacia de la transferencia y / o descartar.
- Rápidamente mover la membrana en un tubo limpio 50 ml (o receptáculo equivalente) que contiene 5 ml de PBS 1x y coloque sobre un rodillo mecánico (o plataforma orbital) para la agitación constante.
NOTA: Es muy importante que la membrana no se permite que se seque. Durante la transferencia semi-seca la membrana se calienta. Espere 2 minutos antes de abrir la pila de transferencia ya que esto permitirá it se enfríe y el tiempo de secado lento durante deconstrucción pila. El uso de un rodillo y tubo para la agitación durante lavados e incubaciones permite la reducción significativa en los volúmenes de las soluciones requeridas. - Lavar la membrana 3 x 5 min en 1x PBS. Desechar el PBS 1X y bloquear la membrana con tampón de bloqueo sin diluir durante un mínimo de 30 min a temperatura ambiente.
- Preparación de anticuerpos primaria.
- Preparar el anticuerpo primario de acuerdo con las instrucciones del fabricante en 5 ml de tampón de bloqueo con 0,1% de Tween 20. Incubar la membrana con el anticuerpo primario preparado durante la noche a 4 ° C con agitación constante.
NOTA: El tampón de bloqueo se utilizan generalmente sin diluir, pero puede ser diluido hasta 1: 4 con PBS si el anticuerpo primario tiene alta especificidad suficiente. - Deseche el anticuerpo primario y se lava la membrana 6 veces durante 5 minutos cada uno con PBS 1x.
- Preparar el anticuerpo primario de acuerdo con las instrucciones del fabricante en 5 ml de tampón de bloqueo con 0,1% de Tween 20. Incubar la membrana con el anticuerpo primario preparado durante la noche a 4 ° C con agitación constante.
- La selección y preparación de anticuerpos secundaria
- Para SecoNdary sólo etiquetar evaluación con fines de control, omita los pasos 5.2.1 y 5.2.2 arriba y vaya al paso 5.3 para determinar los patrones de bandas secundarias específicas de la muestra. Véase la Figura 3.
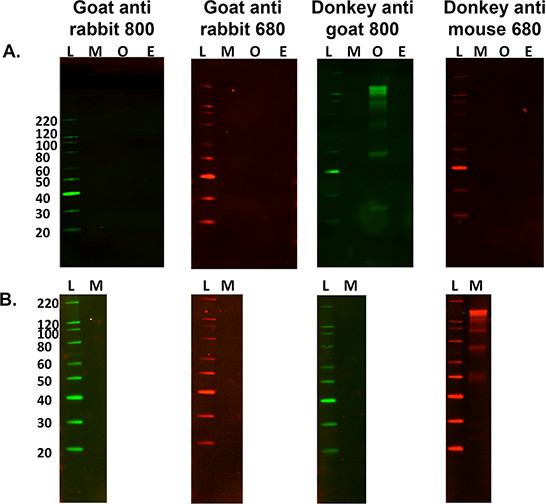
Figura 3. Optimización de los anticuerpos secundarios. A) Una comparación de varias especies de etiquetado sólo secundaria inespecífica contra 15 g de murino (M), ovino (O) y Equinos (E) homogeneizados de tejido nervioso con una variedad de fluorescente etiquetados anticuerpos secundarios . L es la escalera de peso molecular. Homogeneizado de tejido ovina era la única muestra reacción cruzada con el etiquetado secundaria cuando se utiliza anti-cabra de burro 800 de anticuerpo. B) También es importante determinar si se produce etiquetado no específica cuando se utiliza una muestra de tejido diferente, es decir, el músculo gastrocnemio murino (15 _6; carga g). Esta cruz muestra reacciona con el burro anti-anticuerpo secundario del ratón 680, sin embargo esto no ocurrió cuando se utiliza homogeneizado de cerebro de ratón.
- Prepare el fluorescente etiquetado anticuerpo secundario 680 o 800 (rojo o canal verde) siguiente fabricante concentraciones recomendadas en tampón de bloqueo con 0,1% de Tween 20. Incubar la membrana en la oscuridad con el anticuerpo secundario preparada durante 90 min a temperatura ambiente con agitación constante.
- Deseche el anticuerpo secundario y se lava la membrana 6 veces durante 5 min por lavado con PBS 1x. Continúe con el paso 6 - visualización.
- Si no funciona como se esperaba la visualización de los marcadores, las escaleras del examen con una gama de anticuerpos secundarios, como un paso adicional adecuado. No todos los anticuerpos secundarios permiten la visualización de todas las bandas marcadoras en todas las escalas disponibles comercialmente.
- Si las bandas esperadas no son visibles, utilice un host secundaria alternativa, es decir, donkconejo anti ey frente de cabra anti conejo representa una modificación protocolo adecuado. Véase la Figura 4. Especies huésped utilizadas para criar a un anticuerpo secundario en ocasiones pueden causar un problema con la visualización debido a la falta de especificidad de los anticuerpos primarios específicos.
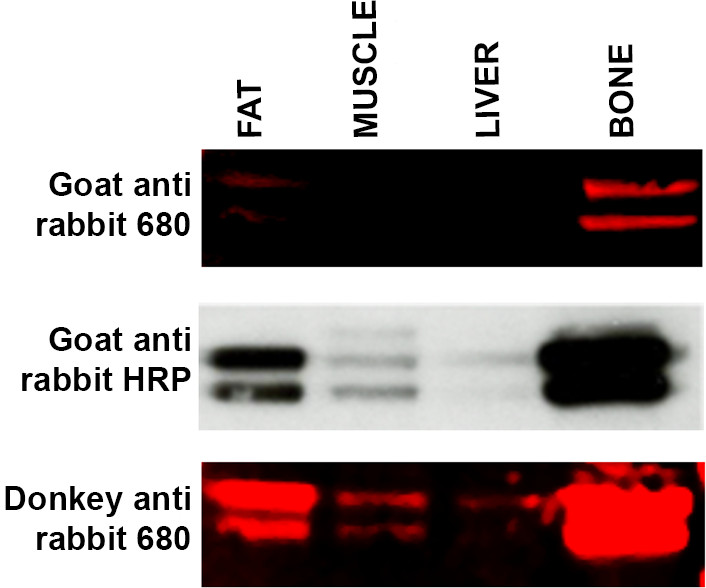
Figura 4. Solución de problemas especificidad anticuerpo secundario de transferencia Western de una serie de muestras de tejido (15 g de proteína por carril) -. Grasa, el músculo, el hígado y el hueso - incubaron con el anticuerpo primario ERK y se incubaron con tres anticuerpos secundarios diferentes. Panel superior: WB marcado con LI-COR de cabra anti-conejo anticuerpo secundario 680 produce etiquetado débil de grasa y hueso y no se detectó señal en las muestras de hígado y músculo. El panel medio: Membrana (desde el panel superior) fue despojado y reprobed usando la metodología de ECL y de cabra anti-conejo unido a HRP secundario. Las bandas son ahora visibles en las muestras de músculo y el hígado y el etiquetado aparece más intenso en las muestras de grasa y hueso. Panel inferior: Membrana (de panel superior y medio) fue desnudado y se volvió a sondear utilizando LI-COR burro anti-conejo anticuerpo secundario 680 que ha demostrado una mayor afinidad para el anticuerpo primario ERK. Etiquetado para el músculo y el hígado es ahora visible con el aumento de intensidad de la señal a partir de muestras tanto de grasa y hueso. Por favor, haga clic aquí para ver una versión más grande de esta cifra.
6. Visualización
NOTA: Todas las imágenes se adquieren mediante el generador de imágenes LI-COR Odyssey Classic y Imagen del software de análisis de Pro (versión 3.1.4).
- Encienda e inicie sesión en el ordenador y reproductor de imágenes. Abra el software de imagen y crear un nuevo archivo. Véase la Figura 5.
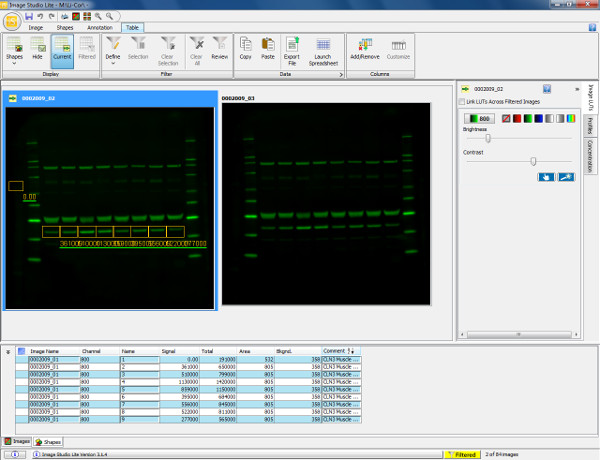
Figura 5. La visualización y la cuantificación de la transferencia de western. Analiza de una transferencia Western que muestra el músculo gastrocnemio de ratón (30 g de carga) se sondearon con anticuerpo Anexina V primaria (36 kDa) y de cabra anti-conejo 800 anticuerpo secundario. La membrana se escanea y se visualiza en el canal 800. Para cuantificar la proteína (anexina V), una caja rectangular se dibuja alrededor de la banda de interés de la muestra 1. Esto entonces es copiado y pegado en los carriles restantes de la muestra para garantizar una medición de la misma zona. Antecedentes se contabiliza automáticamente para alrededor de la forma dibujada, pero esto puede ser alterado para asegurar la medición de fondo se define con precisión. La siguiente tabla muestra las mediciones cuantificadas de cada figura dibujada incluyendo señal total obtenida, el fondo y la señal con antecedentes resta. Esta información puede ser exportada en unprograma de hoja de cálculo para calcular ratios de expresión (según lo determinado por la intensidad de fluorescencia relativa) y permite que los análisis estadísticos posteriores a realizar. Por favor, haga clic aquí para ver una versión más grande de esta cifra.
- Abra la tapa de la cámara termográfica. Vierta una pequeña cantidad de 1x PBS en el cristal en la esquina inferior izquierda y luego colocar la membrana en la parte superior de la PBS. Asegúrese de que la membrana es cuadrado con el eje sobre el generador de imágenes y una separación de 1 cm que queda entre la membrana y el eje de cuadrícula.
- Rollo de la membrana para asegurar que no queden atrapadas burbujas entre el vidrio y la membrana.
- Cuente el número de plazas de la membrana ocupa en el eje xe y. Cierre la tapa de la cámara termográfica. Introduce el número de plazas de la membrana ocupa en el software de su ordenador.
- Seleccione el canal adecuado para escanear la membrana que dependerá de la etiqueta fluorescentedel anticuerpo secundario, es decir, 700 de canal o canal 800 cuando un anticuerpo etiquetado fluorescente 680 o 800 se ha utilizado respectivamente. Cuando doble etiquetado se lleva a cabo, escanear en ambos canales.
NOTA: Optimizar el etiquetado de proteínas único antes de llevar a cabo el etiquetado dual. - Seleccione la intensidad para escanear la membrana, si una proteína de alta abundancia utilizar un escaneo de baja intensidad. Alternativamente, si el anticuerpo primario tiene poca afinidad por la proteína de interés, seleccione una exploración de mayor intensidad, es decir, el nivel 5. Presione START para comenzar la exploración. Continúe con el paso 6.4.
- La visualización de la gel de control de carga (Figura 6).
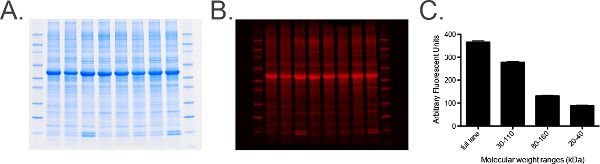
Figura 6. La proteína total etiquetado y análisis. A) Fotografía de un gel de proteína total marcado que contiene 20 g de homogenado equina ganglios cervicales por carril. B) Gel de Panel Aescaneada en el gráfico de las mediciones cuantificadas 680 canales. C) de la proteína total del gel teñido obtuvieron usando el software de imágenes. Una serie de medidas determinadas por marcadores de peso molecular, es decir, 30 a 110 kDa, se toman para proporcionar un histograma de las mediciones para garantizar error estándar (SEM) es bajo (de las muestras agrupadas) que indica que los niveles de proteína total en cada muestra son uniformes a través del gel. Haga clic aquí para ver una versión más grande de esta cifra.- Siga los pasos 6.1 y 6.2.
- Vierta agua destilada en el cristal en la esquina inferior de la cámara termográfica donde comienza el eje de cuadrícula.
- Colocar el gel en la parte superior del agua y la maniobra por lo que los carriles son perpendiculares a cualquiera de los ejes X o Y de la cuadrícula. Deja un espacio de 1 cm entre el eje Y y X de la rejilla y el gel y contar el número de cuadrados ocupa el gel en el eje de cuadrícula. Cercala tapa de la impresora de imágenes.
- Introduce el número de plazas que el gel ocupa en el software de su ordenador.
- Seleccione el canal 700 para escanear el gel de proteína total manchado.
NOTA: Azul emite fluorescencia en el canal 700. - Ajuste la intensidad a 5 y pulse Iniciar.
- La cuantificación de la imagen escaneada
- Ajuste los botones de brillo y contraste para producir la mejor calidad de imagen. Si parece que hay mucho ruido de fondo, vuelva a explorar la membrana a una intensidad menor y utilizar la configuración de escaneo de alta calidad.
NOTA: Los ajustes no se alterarán los datos fluorescentes adquiridas al escanear. - Gire las imágenes 90 °, 180 ° y 270 ° con el fin de ver en la orientación deseada con ninguna alteración a los datos adquiridos. Sin embargo, al hacer pequeños ajustes de la orientación en el "giro libre", a cargo de más de 3 °, los datos adquiridos en valores pixelación pueden distorsionarse y por lo tanto afectar a los resultados de cuantificación.
- Seleccione una forma en el menú formas - utilizar un rectángulo en la mayoría de los casos - y dibujar alrededor de la banda de interés (BM) o todo el carril (gel de proteína total) en la muestra carril 1.
- Copia y pega la forma a través de la muestra carril 2 banda de interés o de todo el carril. Repita al otro lado de cada banda individual de interés para cada muestra y cada carril para geles de proteína total.
- Compruebe que la medición de fondo no incorpora una señal en el carril de al lado. El fondo se puede deducir de forma automática por el software y abarcan todo el borde alrededor de la forma dibujada o puede ser especificado para ser superior / inferior o izquierda y derecha de la forma. Alternativamente, designar un cuadro de fondo definido por el usuario.
- Visualice la señal para la tabla formas para cada forma dibujada en unidades fluorescentes arbitrarias. El fondo será deducido automáticamente de la señal.
- Exporta la imagen como un archivo TIF a ver en diferentes programas. No exportar la imagen y manipular using no imagen de software profesional, ya que esto va a alterar los datos originales adquiridos por el generador de imágenes generando datos falsos.
- Repita los pasos 6.4.3-6.4.7 la hora de cuantificar el etiquetado doble o realizar múltiples mediciones en geles de control de carga para generar y recopilar datos de error estándar.
- Ajuste los botones de brillo y contraste para producir la mejor calidad de imagen. Si parece que hay mucho ruido de fondo, vuelva a explorar la membrana a una intensidad menor y utilizar la configuración de escaneo de alta calidad.
7. Publicar Visualización
- Mantener las membranas en 1 x PBS o secar para el almacenamiento a largo plazo para el futuro re-sondeo y extracción de las membranas para otras proteínas de interés.
- Decapado y volver a sondear las membranas. Véase la Figura 7.
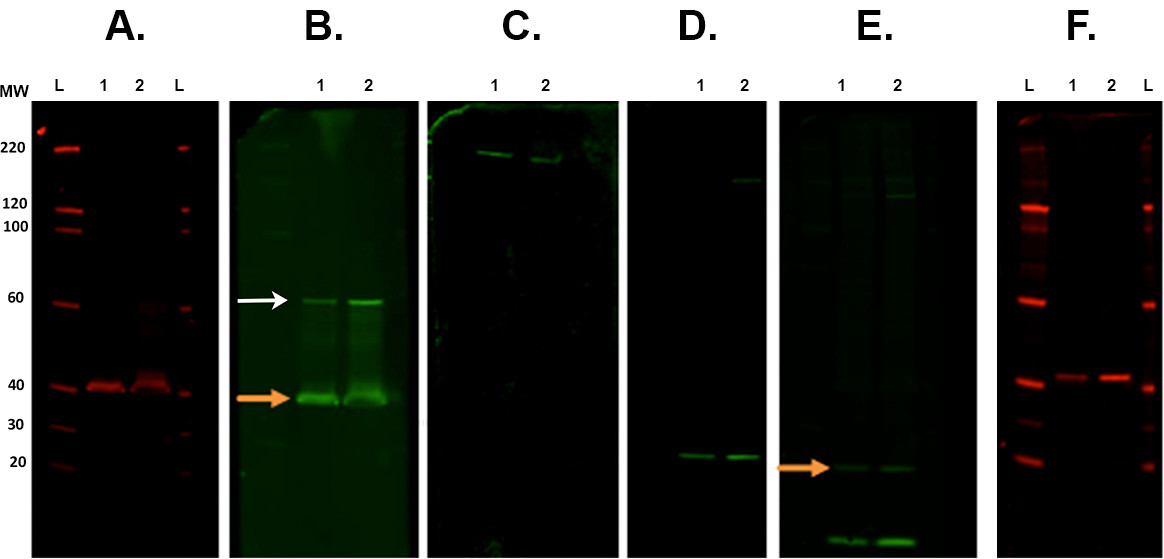
Figura 7. Membrana de separación y Reprobing. Ejemplos representativos de las membranas siguientes varios pasos de desbroce escaneados con un sistema de imágenes por infrarrojos. Una. La primera se llevó a cabo la inmunodetección con el anticuerpo primario CSP (conejo) y escaneado en 700 canales. B. Primera extracción y reprobing con ROCK2 (conejo) con 800 canales. Naranja flecha indica restante CSP anticuerpo primario presente después de la tira y re-sonda. Esto no afecta a la medición de ROCK2 como la banda está presente en un peso molecular más alto (flecha blanca). C. Segunda extracción y reprobed con β-espectrina anticuerpo (cabra) y se visualizaron en el canal 800. D. Tercer pelar y reprobing con anticuerpo α-sinucleína (conejo). E. Cuarta pelar y reprobing con anticuerpo ubiquitina (ratón) con 800 canales. Todavía hay señal restante de la última de anticuerpos (α-sinucleína. Flecha naranja). F. Quinto pelar y reprobing con anticuerpo CALB2 (conejo) fotografiado en 700 canales. Secundaria anticuerpos utilizados fueron: cabra 800cw anti-ratón, de cabra anti-conejo 680rd, de cabra anti-conejo 800cw, burro 800cw anti-cabra (ver Lista de Materiales). Etiquetas Carril: L - escalera, 1/260; - la muestra 1/2. Haga clic aquí para ver una versión más grande de esta cifra.- Place membrana (s) en un plato de Petri cuadrada que contiene aproximadamente 30 ml de tampón de extracción Revitablot y se incubó entre 5-20 min a temperatura ambiente con agitación constante.
- Lavar la membrana (s) 3 veces en PBS y luego vuelva a escanear en la impresora de imágenes para asegurar la eliminación completa de la fluorescencia se ha producido - este paso debe repetirse después de cada tira.
- Incubar la membrana (s) por períodos más largos si la fluorescencia permanece. Vuelva a explorar la membrana después de cada tira para confirmar que no hay señal secundaria restante.
NOTA: Membrana (s) sólo debe ser despojados y reprobed un máximo de 3 veces con el fin de garantizar que la integridad de la membrana no se ha visto comprometida resultando en alto fondo indeseable señal de relación.
Resultados
Como la sensibilidad QFWB y el rango lineal de detección es mayor que la detección convencional ECL, hay una serie de medidas de control que son cruciales para asegurar la recepción de datos precisa, ayudando de ese modo la interpretación efectiva. En primer lugar, la inclusión de muestras de control positivas como se muestra en la Figura 1. En segundo lugar, la optimización de la transferencia para garantizar una circulación equivalente de proteínas de alto y bajo peso molecular desde el gel a la membrana según lo exhibido en la figura 2. En tercer lugar, la optimización de anticuerpos, especialmente secundaria anticuerpos cuya optimización a menudo se pasa por alto, pero que pueden producir no específica bandas capaces de interferir con la interpretación correcta de la proteína (s) de interés. Véase la Figura 3. En cuarto lugar, también puede ser el caso cuando una proteína que aparece indetectable pero se espera que esté presente, esto también puede ser un problema de anticuerpo secundario que se puede corregir utilizando simplemente un rais secundariased en una serie de especies diferentes. Véase la Figura 4. En quinto lugar, el etiquetado de proteína total y el análisis es un método mucho más robusto y cuantificable en comparación con el uso de la proteína simple tradicional (s) que se expresa de forma ubicua para los estándares de referencia internos 3. Muchas de estas proteínas individuales se han encontrado para ser expresadas diferencialmente en modelos de enfermedades neurodegenerativas, así como entre las diferentes muestras de tejido y la uniformidad de expresión puede modificar dentro del mismo tejido 3. Por lo tanto, la producción de un gel de control de carga confirmará la uniformidad de la carga de la muestra cuando se combina con un análisis de proteína total mediante la comparación y la cuantificación de la carga de proteína en cada carril en varios rangos de pesos moleculares medidos contra cada muestra para indicar el error estándar como se demuestra en la Figura 6 . Es importante destacar que todas estas técnicas y controles de solución de problemas sólo son tan eficaces como la sensibilidad y la coherencia del análisis terramientas aplicadas por el operador (Figura 5). Finalmente esta técnica se presta a la extracción y re-sondeo de las membranas con más flexibilidad que ECL debido a factores incluyendo, pero no limitado a aumento de la sensibilidad, la reducción de fondo, la detección de doble color y estabilidad de la membrana en condiciones de almacenamiento a largo plazo. Véase la Figura 7.
Discusión
La debida consideración y la planificación es esencial antes de cualquier experimento y en última instancia pueden determinar el éxito de la técnica utilizada. Los avances en la detección de proteínas utilizando WB puede presentar una gran cantidad de posibles obstáculos cuando se trata de elegir los anticuerpos, métodos de transferencia y visualización adecuadas para su uso. Afortunadamente, el uso de una lista de verificación cuidadosa y medidas de control apropiadas QFWB puede ser utilizado de forma rutinaria para determinar la presencia de proteínas y las diferencias de expresión cada vez más sutiles entre las muestras. Este protocolo ofrece una guía completa sobre el Western Blot cuantitativa fluorescente, así como algunas estrategias de solución de problemas para evitar y / o resolver algunos de los muchos errores comunes asociados a ella.
Los pasos críticos usadas para mantener la sensibilidad y obtener verdaderamente mediciones cuantificables y comparables incluyen: 1) robusta extracción de proteína a partir de muestras de tejido; 2) preparación de la muestra; 3) loadin proteína exactag determinó por análisis de proteína total; 4) la transferencia óptima de proteínas utilizando I-Blot; 5) la preparación de anticuerpos primarios y secundarios en tampón de bloqueo que contiene 0,1% de Tween 20, y 6) correcta visualización y análisis utilizando un generador de imágenes de infrarrojos y el software asociado.
Detección fluorescente infrarrojo es verdaderamente cuantitativo y proporciona una mayor sensibilidad en comparación con las técnicas más tradicionales de detección ECL 3,11. Este sistema de detección es de múltiples facetas, y como tal no se limita a QFWB. Este sistema es capaz de obtención de imágenes de etiquetado inmunohistoquímico en baja potencia que permite la visualización y cuantificación de las secciones de tejido 12 enteros. Esta es un área de potencial de desarrollo futuro en términos de resolución, que podría ver imágenes rojo lejano que rivaliza con la captura de inmunofluorescencia convencional con microscopios convencionales en términos de evaluación cuantitativa.
Sin embargo, con una mayor sensibilidad a los cambios sutiles en protein expresión es fundamental para garantizar la variabilidad se reduce al mínimo y las medidas de control son muy estrictos con los protocolos robustos. Esto comienza con la extracción de proteínas rigurosa de la muestra de tejido seguido por la producción de geles de proteínas totales se tiñeron para proporcionar la seguridad de que la carga de muestra es uniforme, la optimización de anticuerpos primarios y secundarios para determinar si la detección es real y prueba de las directrices del fabricante con respecto a la transferencia veces para obtener la proteína de transferencia eficiente.
Sin embargo, incluso cuando se optimizan las condiciones para WB, es posible que aún los problemas asociados con el funcionamiento de los westerns que pueden no haber sido plenamente exploradas aquí. Estos incluyen, pero no se limitan a factores que incluyen la solubilización de proteínas y la elección de tampón de extracción. Algunos tampones pueden interferir con ensayos de concentración de proteína, y algunos tejidos son particularmente difíciles de solubilizar, lo que requiere técnicas más robustas tales como el uso de macera automatizadoting envases sellados, tales como tubos de M junto con un disociador Macs. Además, las medidas de control sencillas para el almacenamiento de material extraído no extraídos y a -80 ° C pueden ser la diferencia entre la obtención de etiquetado óptimo inmediatamente después de la extracción y que tiene resultados pobres semanas más tarde.
Métodos QFWB modernos han demostrado ser más sensibles para captar las diferencias sutiles en la expresión de proteínas y están permitiendo que más versátil de doble etiquetado simultáneo de 3, en comparación con las técnicas más antiguas como la ECL. Es de vital importancia que los protocolos de Western Blot son robustos y fácilmente repetible para la cuantificación precisa y el análisis estadístico. Este protocolo es sensible y lo suficientemente robusto como para ser utilizado de forma rutinaria para la detección de proteínas a través de una variedad de diferentes muestras de tejidos y especies 3 y permite la cuantificación de las proteínas de baja y alta abundancia dentro de la misma QFWB por lo tanto reduciendo el uso de consumibles así como el tiempo por experimento 1. 1 Además, el aumento de la sensibilidad de esta técnica permite la validación de cada vez más popular - estudios ómicas 9,14 embargo exactitud es crucial y la inclusión de medidas de control apropiadas deben ser respetados evitando de este modo la adquisición de datos erróneos.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Nos gustaría dar las gracias lo siguiente para apoyo financiero: BBSRC Instituto de Financiación de Programas Estratégicos - CF & TMW; Financiación BBSRC Oriente Bio DTP - LG; El Darwin Fideicomiso de Edimburgo - MLH. También nos gustaría dar las gracias a Dr. Barry McColl permiso para incluir la optimización TREM2 en este manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| RIPA Buffer | Fisher Scientific UK Ltd | 10230544 | |
| M Tubes | Miltenyi Biotec Inc. | 130-093-236 | |
| iBlot Transfer Stack, PVDF Regular | Life Technologies, UK | IB401001 | |
| MagicMark XP Western Protein Standard (20-220 kDa) | Life Technologies, UK | LC5602 | Use in gel 1 for Western blotting |
| SeeBlue Pre-stained protein standard | Life Technologies, UK | LC5625 | Use in gel 2 Total protein stained gel |
| NuPAge LDS Sample buffer 4x | Life Technologies, UK | NP0007 | |
| NuPAGE MES SDS Running Buffer (for Bis-Tris Gels only) (20x) | Life Technologies, UK | NP0002 | |
| NuPAGE Novex 4-12% Bis-Tris Gel 1.0 mm, 12 well | Life Technologies, UK | NP0322BOX | |
| Phosphate buffered saline tablet | Sigma-Aldrich, UK | P4417-100TAB | |
| Micro BCA, Protein Assay Kit | Fisher Scientific UK Ltd | 10249133 | |
| Odyssey blocking buffer | Li-Cor Biosciences | P/N 927-40000 | |
| IRDye 680RD Goat anti-Rabbit IgG (H+L), 0.5 mg | Li-Cor Biosciences | 926-68071 | |
| IRDye 680RD Donkey anti-Mouse IgG (H+L), 0.5 mg | Li-Cor Biosciences | 926-68072 | |
| IRDye 800CW Goat anti-Rabbit IgG (H + L), 0.5 mg | Li-Cor Biosciences | 926-32211 | |
| IRDye 800CW Donkey anti-Goat IgG (H + L), 0.5 mg | Li-Cor Biosciences | 926-32214 | |
| ODYSSEY CL Infra-red imager | Li-Cor Biosciences | Call for quotation | |
| iBlot 7-Minute Blotting System | Life technologies, UK | This model is no longer in production | |
| InstantBlue Protein stain | Expedeon, UK | ISB1L | |
| Revitablot western blot stripping buffer | Rockland Immunochemicals Inc. | MB-085-0050 |
Referencias
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Biotechnology. 1992 (24), 145-149 (1979).
- Walker, J. M. . Protein Protocols on CD-ROM. , (1998).
- Gallagher, S., Winston, S. E., Fuller, S. A., Hurrell, J. G. Immunoblotting and immunodetection. Curr Protoc Mol Biol. Chapter. 10, 10 (2008).
- Eaton, S. L., et al. Total protein analysis as a reliable loading control for quantitative fluorescent Western blotting. PLoS One. 8 (8), 72457 (2013).
- Suzuki, O., Koura, M., Noguchi, Y., Uchio-Yamada, K., Matsuda, J. Use of sample mixtures for standard curve creation in quantitative Western blots. Exp. Anim. 60, 193-196 (2011).
- Colella, A. D., et al. Comparison of Stain-Free gels with traditional immunoblot loading control methodology. Anal Biochem. 430 (2), 108-110 (2012).
- Zellner, M., et al. Fluorescence-based Western blotting for quantitation of protein biomarkers in clinical samples. Electrophoresis. 29, 3621-3627 (2008).
- Kielar, C., et al. Molecular correlates of axonal and synaptic pathology in mouse models of Batten disease. Hum Mol Genet. 18, 4066-4080 (2009).
- Mutsaers, C. A., Lamont, D. J., Hunter, G., Wishart, T. M., Gillingwater, T. H. Label-free proteomics identifies Calreticulin and GRP75/Mortalin as peripherally accessible protein biomarkers for spinal muscular atrophy. Genome Med. 5 (10), 95 (2013).
- Wishart, T. M., et al. Dysregulation of ubiquitin homeostasis and β-catenin signaling promote spinal muscular atrophy. J Clin Invest. 124 (4), 1821-1834 .
- Mathews, S. T., Plaisance, E. P., Kim, T. Imaging systems for westerns: chemiluminescence vs. infrared detection. Methods Mol Biol. 536, 499-513 (2009).
- Hawes, J. J., Brunzell, D. H., Wynick, D., Zachariou, V., Picciotto, M. R. GalR1, but not GalR2 or GalR3, levels are regulated by galanin signalling in the locus coeruleus through a cyclic AMP-dependent mechanism. J Neurochem. 93 (5), 1168-1176 (2006).
- Bond, D., Primrose, D. A., Foley, E. Quantitative evaluation of signaling events in Drosophila S2 cells. Biol Proceed Online. 10 (1), 20-28 (2008).
- Wishart, T. M., et al. Differential proteomics analysis of synaptic proteins identifies potential cellular targets and protein mediators of synaptic neuroprotection conferred by the slow Wallerian degeneration (Wlds) gene. Mol Cell Proteomics. 6, 1318-1330 (2007).
- Silva, J. M., McMahon, M. The fastest western in town: a contemporary twist on the classic western blot analysis. J. Vis. Exp. (84), 51149 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados