需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
从外周血人类同种异体抗原特异性T细胞的生成
摘要
This article describes a method for the generation and propagation of human T cell clones that specifically respond to a defined alloantigen. This protocol can be adapted for cloning human T cells specific for a variety of peptide-MHC ligands.
摘要
The study of human T lymphocyte biology often involves examination of responses to activating ligands. T cells recognize and respond to processed peptide antigens presented by MHC (human ortholog HLA) molecules through the T cell receptor (TCR) in a highly sensitive and specific manner. While the primary function of T cells is to mediate protective immune responses to foreign antigens presented by self-MHC, T cells respond robustly to antigenic differences in allogeneic tissues. T cell responses to alloantigens can be described as either direct or indirect alloreactivity. In alloreactivity, the T cell responds through highly specific recognition of both the presented peptide and the MHC molecule. The robust oligoclonal response of T cells to allogeneic stimulation reflects the large number of potentially stimulatory alloantigens present in allogeneic tissues. While the breadth of alloreactive T cell responses is an important factor in initiating and mediating the pathology associated with biologically-relevant alloreactive responses such as graft versus host disease and allograft rejection, it can preclude analysis of T cell responses to allogeneic ligands. To this end, this protocol describes a method for generating alloreactive T cells from naive human peripheral blood leukocytes (PBL) that respond to known peptide-MHC (pMHC) alloantigens. The protocol applies pMHC multimer labeling, magnetic bead enrichment and flow cytometry to single cell in vitro culture methods for the generation of alloantigen-specific T cell clones. This enables studies of the biochemistry and function of T cells responding to allogeneic stimulation.
引言
T淋巴细胞是适应性免疫系统的关键部件。 T细胞是负责不仅直接通过各种效应机制介导保护性免疫反应的病原体,还积极地维持免疫自身耐受性和指导其他细胞的应答,在免疫系统中。这些功能是通过一些综合信号,包括T细胞受体(TCR)的连接,细胞因子和趋化因子和代谢产物1定向。这些信号的,T细胞受体是特别重要的,因为它提供了特有的特异性,它定义在适应性免疫的T细胞的作用。 TCR的相互作用,在一个高度特异和敏感的态度提出了MHC(人类同源基因HLA)分子(的pMHC复合物),以提供启动T细胞的效应功能的信号线性肽抗原。 TCR互动与配体的pMHC的生化指标不仅提供了特异性对于T细胞的活化,同时也有在随后的T细胞的功能2质的影响。因此,研究T细胞功能往往需要研究克隆T细胞定义的抗原特异性的反应。
人T细胞区室,含有约10 12αβT细胞,包含大约7月10日至八月10日明显αβTCRs3-4。这种多元的曲目为识别肽繁多,从潜在的病原体,将必要的保护性免疫T细胞应答的机会。据估计,T细胞响应一个给定的外源抗原通过自MHC呈现的频率为10 -4的数量级上- 10-7在没有给该抗原5前的免疫应答。幼稚T细胞的剧目是由胸腺选择形状,确保认识自我MHC呈递的抗原肽和极限反应能力ivity对自身抗原肽,最大限度地提高调解的保护性免疫2的潜在效用。然而,违反了此设计的反应性,相对较大的频率,10 -3 - 10 -4,T细胞从免疫幼稚个体对刺激作出反应与同种异体细胞,识别两者的外来MHC分子,以及内源性肽它们呈现6。的同种异基因的pMHC配体的识别是结构上类似于识别通过自MHC呈现外源抗原的; TCR的使得与两个同种异体MHC分子以及所呈现的肽7临界生物化学相互作用。 T细胞以从的pMHC的多样性同种异体刺激的结果的响应的健壮本质络合物本同种异体细胞8的表面上。据估计,每MHC呈现约2×10 4个不同的内源性肽抗原9。这家B响应于同种异体刺激readth是临床相关的病理,如同种异体移植物排斥或移植物抗宿主病(GVHD)的显著方面,从T细胞的同种异体反应性所致。
研究的人T细胞的同种异体反应性的反应时检查下列刺激同种异体细胞幼稚T细胞的多克隆反应传统上依赖。反复刺激具有相同的同种异基因的细胞系结合的有限稀释分析能够产生单克隆T细胞定义的识别同种异体的HLA 10的。然而,这种方法是有问题的用于检查响应个体同种异体的pMHC配位体,如内源性的pMHC的大量不同的曲目络合物存在对于给定的同种异基因的HLA刺激T细胞的广泛的剧目。这种散装人口刺激和有限稀释方法需要大量克隆的筛选以分离的T细胞与所需reactiVITY针对单一的pMHC配体。此外,T细胞响应的个体同种异体的pMHC配体的频率相对低的幼稚T细胞群,其中介绍的障碍有效地产生人T细胞克隆响应于一个给定的抗原之一。
鉴定与多克隆群的抗原特异性T细胞的分离已经通过荧光团标记的pMHC多聚体11上的显影启用。该方法利用装入重组的可溶性生物素化的MHC分子,其通过结合到链霉亲和标记的荧光团标记的特异性肽抗原。的pMHC的多聚化增加了亲和力,补偿TCR的固有的低(微米)可溶性的pMHC配体的亲和力。标记的细胞可被识别和分离通过流式细胞术。但是,这种方法仍然由幼稚T细胞群中的抗原特异性T细胞,这是典型的低频率限制震级小于准确识别和量化大多数流式细胞仪的限制令。为了解决此限制,对的pMHC四聚体标记和随后的磁珠富集为四聚体标记的细胞的方法,已经开发了12。这种方法已经证明可靠检测,计数和低频抗原特异性T细胞的分离。
这个协议描述了一种有效的协议对人T细胞克隆的特异性个体同种异体的pMHC配体响应的产生。该协议适用的pMHC(HLA)的多聚体标记和富集对同种异体抗原-特异性的人T细胞的流式细胞术细胞分选和一个可靠的方法在体外培养的人T细胞的分离,使生产的从单个分选的细胞的T细胞克隆(概述图1)。
研究方案
注:此协议需要使用外周血样本的志愿者。所有的研究以人类为对象进行审查和批准由人类研究伦理审查委员会,以确保符合赫尔辛基宣言(2013年)和健康保险流通与责任法案1996。
1.隔离从全血中T细胞
- 开始之前,温密度梯度介质至室温。等分4毫升密度梯度介质的成2-4无菌的15毫升锥形离心管(1管将用于各10ml的稀释血液总体积)。
- 获得10-20毫升血液中1-2肝素钠喷涂(绿顶)静脉血液采集管。收集人体标本经过培训的人员的监督下,根据机构审查委员会批准的协议。
- 擦拭用70%乙醇在管的外侧。小心地取下音响的顶部LLED收集管,倒出血液进入无菌50ml离心管中。
- 加10毫升无菌磷酸盐缓冲盐水(PBS),以每血液收集管。收集PBS,加入到滗全血,轻轻混匀。
- 加入25μl的人类T细胞富集鸡尾酒/2毫升总量。在室温下孵育20分钟。
- 用10毫升吸管,层高达10毫升1:1的稀释血液轻轻放在密度梯度介质的顶部。注意不要打乱密度梯度介质的表面上。
- 离心分层的血液,并在1200×g离心20分钟,密度梯度介质在20℃。
- 从离心机中取出试管,小心地不扰乱密度梯度介质和白细胞的密度梯度介质和稀释的血浆之间的界面处的层之间的界面。使用5ml的吸量管,小心收集的白细胞层并转移到新的无菌的50ml锥形桶Ë。
- 加入PBS带来的PBL收集到50毫升容量,轻轻混匀。
- 离心600×g离心5分钟,在20℃。倒出。
- 重悬沉淀的细胞在10ml无菌的流式细胞分选缓冲液(含1%BSA无菌过滤的PBS)中。样品10微升细胞悬浮液,稀释的1点10分(加至90微升)台盼蓝计数使用血球细胞(预期产量1 - 4×10 6个细胞的全血/管)。
- 除去1毫升等分试样,转移至5ml管,并保持在冰上的T细胞不通过四聚体标记的分析。置于冰上细胞悬液。
同种异体抗原 - 特异性T细胞的2磁性富集
- 在无菌排序缓冲区100的稀释:同种抗原的pMHC四〜1。
- 离心细胞悬浮液(9毫升从步骤1.11),在600×g离心5分钟,在20℃。倒出。
- 加入50微升稀释的同种抗原的pMHC四聚体,以沉淀细胞(多达10 7个细胞)。轻柔吹打混匀。转移到灭菌的5毫升管。孵育30分钟,在室温下进行。
- 加2 ml排序缓冲区。离心600×g离心5分钟,在20℃。倒出。
- 将细胞再悬浮于100μl的排序缓冲器。加10微升生物素选择鸡尾酒,孵育15分钟,在室温下进行。
- 添加5μl的磁性纳米粒子的孵育在室温下10分钟。
- 添加2.5毫升排序缓冲区和吸液轻轻混匀。去除100微升的等分试样,转移至5ml管,并保持在冰上预富集细胞的分析。
- 放置5毫升管含有细胞悬浮液中的细胞分离磁体。帽应该是松散的管之上。孵育5分钟,在室温下进行。
- 轻轻取下管帽。握住管体一起,倒出管内容到一个新的5毫升管。不要敲击或摇晃试管内容除去最后一滴液体。
- 从磁体取出管。加入2毫升冷排序缓冲区,并通过吸液轻轻混匀。样品10微升细胞悬浮液,稀释1:2(加至10微升)台盼蓝使用血细胞计数器计数细胞。
3,准备T细胞的单细胞流式细胞仪细胞分选的
- 加冷排序缓冲区细胞的所有管道(未标记的四聚体,四聚体标记的未充实,四聚体标记的富集),使音量至3ml。
- 离心600×g离心5分钟,在4℃,澄清缓冲来恢复细胞。
- 重悬在25微升冷排序缓冲区沉淀的细胞。加入5微升人Fc块。在冰上孵育20分钟。
- 准备抗体流式细胞分选。混合15微升样缓冲液,加入15μl抗CD5,加入15μl抗CD14,和15微升抗CD19。
- 加入20μl抗体混合物对细胞的每管中。在冰上孵育20分钟。
- 加入2毫升冷排序缓冲器的每个管。
- 离心600×g离心5分钟,在4℃,澄清缓冲来恢复细胞。
- 重悬的细胞以1 -2×10 6个细胞/在排序缓冲器ml的浓度。
- 等份加入100μl的人T细胞培养基(Iscove氏DMEM培养基补充了2mM谷氨酰胺,10mM的HEPES,50μg/ ml的庆大霉素,50μM2-巯基乙醇,10%热灭活人AB血清和2.5纳克/ ml重组人IL-2)到96孔圆底细胞培养板的各孔中。保持在冰上。
由单细胞流式细胞分选4.隔离四聚体标记的T细胞
- 建立流式细胞仪门控参数来识别同种抗原的pMHC四聚体标记的T细胞( 图2.A)。使用预富集四聚体标记的部分,建立门控战略来消除双峰,门上的淋巴细胞,排除CD19表达B细胞和CD14表达单核细胞,并确定T细胞CD5表达。不使用标有四聚体作为荧光减一控制采样,建立门识别四聚体结合T细胞(与CD5 + CD14 0% - CD19 -从没有被标记的四聚体的细胞样本应属于这扇大门内) 。
注意:门控策略是不充分严格将导致非T细胞或T细胞中未抗原特异性的隔离,而过于严格的选通策略会降低T细胞中分离的数量。 - 编程板参数为单细胞类。直接分拣机放置1 CD5 + CD14 - CD19 -四聚体+细胞在每口井。指示板设置为包含1阴性对照孔(无细胞分类入井)和1个阳性对照孔(100 CD5 + CD14 - CD19 -四-细胞)每行中( 图2.B )。
- 使用所建立的流式细胞仪设门和板的设置,分离单个的四聚体结合的T细胞直接注入96孔板中使用流式细胞仪的细胞分选器。
5,文化和扩大同种异体抗原特异性T细胞克隆
- 细胞分选,离心板在600×g离心5分钟,在20℃。完成后地方培养板上,在37℃下在6%CO 2的培养箱中培养。
- 涡流刺激抗CD3 /抗CD28微珠30秒重悬珠子。
- 计算所需的收集T细胞的刺激活化珠的体积(0.5微升活化微珠/孔)。转移刺激珠计算量灭菌的5毫升管。加入1 ml的人T细胞培养基中并涡旋。
- 将管微珠悬浮体。帽应该是松散的管之上。孵育在室温下搅拌2分钟。
- 轻轻取出盖从管。握住管体一起,澄清管内容到一个新的5毫升管。不要敲击或摇晃试管内容。
- 从磁体取出管。添加人T细胞培养基(100μl的培养基中/ 0.5微升微珠的最初添加的)。
- 等份加入100μl活化珠悬浮液至96孔板的各孔中。在6%CO 2的培养箱中孵育培养板在37℃下。
- 监测细胞经显微镜检查每天的增长。培养第7天( 图3.A) -小簇增殖细胞可在显微镜后5中观察到。
注:T细胞培养物,在这一点上的可视化是很困难的,并且不存在可观察到的细胞团在此阶段可能并不指示缺乏生长的T细胞。 - 在后细胞分离14天,进料培养物通过仔细去除100微升的媒体离培养的顶部,并替换为100μ;升新鲜的人T细胞培养基中。继续在6%CO 2的培养箱中孵育培养板在37℃下。
- 监测细胞通过显微镜检查和培养液的颜色的评估日生长。介质更改后第3天 - 微观2大细胞群体应该是可见的。宏观上,细胞沉淀应成为在14日内介质的变化可见。
- 28天以下的细胞分离,通过镜检确定增长的克隆。转移生长阳性的96孔板中培养至含有200μl的人T细胞培养基中的48孔组织培养板的各个孔中的200μl的体积。
- 加入100μl含12.5微升刺激抗CD3 /抗CD28微珠(其制备如5.2节中所述 - 5.6)。在6%CO 2的培养箱中孵育培养板在37℃下。
- 监察显微镜前培养中生长的日常胺化和培养基的颜色的评估。当T细胞培养物达到> 2×10 6 / ml的(通常在3-5天后再次刺激后,可通过该介质,开始的当天推定回转草黄色),转移至培养在24孔组织培养板的孔中并加入500μl人类T细胞中。
- 在10-14天随访再刺激,收集200微升T细胞培养用流量来评估术的pMHC四聚体结合分析(使用在第3和4.1中描述的标签和门控策略)同种抗原特异性。
6.长期再刺激培养的T细胞克隆和
- 不断地重新刺激和扩大克隆性T细胞培养物具有所需的特异性可以是每14天。收集的T细胞培养物至无菌5毫升管中在14天之后的最后的抗CD3 / CD28微珠刺激。合并相同的T细胞克隆的多口井在单一管中,最多为2.5毫升的体积。
- 添加培养基以使终体积至2.5毫升,通过移液轻轻混匀。
- 放置5毫升管含有T细胞培养到细胞分离磁铁,以从培养物中除去旧的微珠。帽应该是松散的管之上。孵育5分钟,在室温下进行。
- 轻轻取下管帽。保持所述管和磁铁一起,滗出细胞悬浮液到一个新的5毫升管。不要敲击或摇晃管内容物去除最后一滴液体。
- 添加培养基以使终体积到4ml。样品10微升进行计数使用血球细胞。
- 恢复T细胞通过离心,在600×g离心5分钟,在室温下进行。
- 弃去上清液。重悬的T细胞在10 6个细胞/ ml的人T细胞培养基中。转移1ml等分至24孔组织培养板的各孔中。
- 再刺激T细胞,加入含有12.5微升刺激抗CD3 / 100μl的媒体NTI-CD28微珠( - 5.6在5.2节所述)。在6%CO 2的培养箱中在37℃下。
结果
这个协议描述了克隆人T细胞培养物的产生与通过磁珠富集和单细胞的流式细胞术分选策略定义的同种异体抗原特异性。 图1提供了该方法的概要。
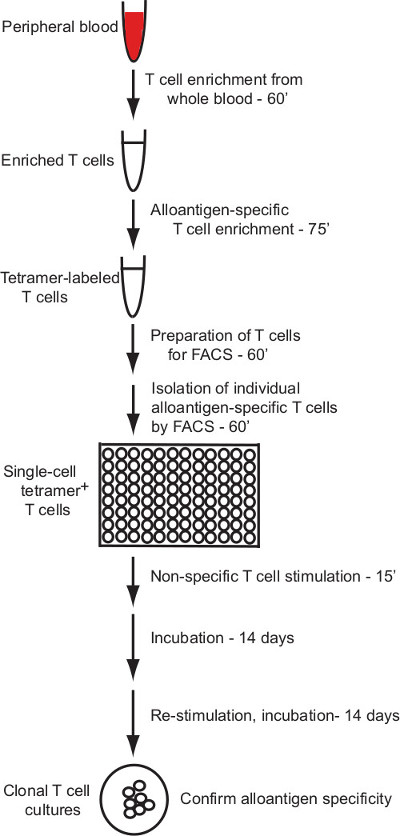
图1:协议概述这里描述的协议提供了用于产生从外周血同种异体抗原-特异性的人T细胞克隆的可靠方法。单T...
讨论
T cell alloreactivity is a long-studied and clinically-relevant phenomenon. The robust proliferative and effector responses of T cells to allogeneic stimulation has enabled extensive analyses of human T cell responses in vitro through relatively straightforward mixed lymphocyte reactions of peripheral blood T cells against inactivated allogeneic cells. However, these primary alloreactive T cell responses are oligoclonal, comprised of a large number of individual T cells responding to specific alloantigens. This ...
披露声明
The authors declare no competing financial interests.
致谢
The author would like to thank the NIH Tetramer Core Facility for tetramer production. The author would also like to thank E.D. O’Connor and K.E. Marquez at the UCSD Human Embryonic Stem Cell Core Facility flow cytometry laboratory for assistance in cell sorting. This work was funded by National Institutes of Health grant K08AI085039 (G.P.M.).
材料
| Name | Company | Catalog Number | Comments |
| Sodium heparin venous blood collection tube 16 x 100 mm | Becton, Dickenson and Company | 366480 | |
| Lymphoprep | Stemcell Technologies | 7801 | |
| Rosette Sep Human T Cell Enrichment Kit | Stemcell Technologies | 15061 | |
| Dulbecco's PBS, 1x without Ca or Mg | Corning | 21-031-CV | |
| Bovine serum albumin | Sigma-Aldrich | A7906 | |
| EDTA | Sigma-Aldrich | E6635 | |
| Fluorophore-labeled pMHC tetramer | NIH Tetramer Facility | NA | |
| EasySep Biotin Selection Kit | Stemcell Technologies | 18553 | |
| EasySep Selection magnet | Stemcell Technologies | 18000 | |
| TruStain FcX Human Fc blocking solution | Biolegend | 422301 | |
| Anti-CD5 PE-Cy7 (clone UCHT2) | Biolegend | 300621 | |
| Anti-CD14 FITC (clone HCD14) | Biolegend | 325603 | |
| Anti-CD19 FITC (clone HIB19) | Biolegend | 302205 | |
| Iscove's DMEM, without b-ME or L-glutamine | Corning | 15-016-CV | |
| HEPES | Corning | 25-060-CI | |
| b-Mercaptoethanol | Life Technologies | 21985-023 | |
| Glutamax | Life Technologies | 35050061 | |
| Gentamicin sulfate (50 mg/ml) | Omega Scientific | GT-50 | |
| Human AB serum, male donor | Omega Scientific | HS-30 | |
| Recombinant human IL-2 | Peprotech | AF 200-02 | |
| Dynabeads Human T-Activator CD3/CD28 | Life Technologies | 11131D | |
| Media | |||
| Cell sorting buffer | |||
| PBS, pH 7.4 | 1 L | ||
| BSA | 10 g | ||
| EDTA (0.5 M) | 2 ml | ||
| Human T Cell Culture Medium | |||
| Iscove's DMEM | 351.6 ml | ||
| Heat-inactivated human AB serum | 40 ml | ||
| HEPES (1 M) | 4 ml | ||
| Glutamax (100x) | 4 ml | ||
| Gentamicin (50 mg/ml) | 0.4 ml | ||
| b-mercaptoethanol (14.3 M) | 1.4 ml | ||
| Recombinant human IL-2 (1 mg/ml) | 1 ml |
参考文献
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S. T cell activation. Annu. Rev. Immunol. 27 (1), 591-619 (2009).
- Morris, G. P., Allen, P. M. How the TCR balances sensitivity and specificity for the recognition of self and pathogens. Nat. Immunol. 13 (2), 121-128 (2012).
- Arstilla, T. P., et al. A direct estimation of the human αβ T cell receptor diversity. Science. 286 (5441), 958-961 (1999).
- Robbins, H. S., et al. Comprehensive assessment of T-cell receptor β-chain diversity in αβ T cells. Blood. 114 (19), 4099-4107 (2009).
- Alanio, C., Lemaitre, F., Law, H. K. W., Hasan, M., Albert, M. L. Enumeration of human antigen-specific naive CD8+ T cells reveals conserved precursor frequencies. Blood. 115 (18), 3718-3725 (2010).
- Suchin, E. J., et al. Quantifying the frequency of alloreactive T cells in vivo: new answers to an old question. J. Immunol. 166 (2), 973-981 (2001).
- Felix, N. J., Allen, P. M. Specificity of T-cell alloreactivity. Nat. Rev. Immunol. 7 (12), 942-953 (2007).
- Morris, G. P., Ni, P. P., Allen, P. M. Alloreactivity is limited by the endogenous peptide repertoire. Proc. Natl. Acad. Sci. USA. 108 (9), 3695-3700 (2011).
- Suri, A., et al. In APCs, the autologous peptides selected by the diabetogenic I-Ag7 molecule are unique and determined by the amino acid changes in the P9 pocket. J. Immunol. 168 (3), 1235-1243 (2002).
- Yssl, H., Spits, H. Generation and maintenance of cloned human T cell lines. Curr. Protoc. Immunol. 7, (2002).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Moon, J. J., et al. Naive CD4+ T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity. 27 (2), 203-213 (2007).
- Chicz, R. M., et al. Specificity and promiscuity among naturally processed peptides bound to HLA-DR alleles. J. Exp. Med. 178 (1), 27-47 (1993).
- Ni, P. P., Allen, P. M., Morris, G. P. The ability to rearrange dual TCRs enhances positive selection, leading to increased allo- and autoreactive T cell repertoires. J. Immunol. In press, (2014).
- Morris, G. P., Uy, G. L., Donermeyer, D., DiPersio, J. F., Allen, P. M. Dual receptor T cells mediate pathologic alloreactivity in patients with acute graft-versus-host disease. Sci. Transl. Med. 5 (188), (2013).
- Altman, J. D., Reay, P. A., Davis, M. M. Formation of functional peptide complexes of class II major histocompatibility complex proteins from subunits produced in Escherichia coli. Proc. Natl. Acad. Sci. USA. 90 (21), 10330-10334 (1993).
- Sabatino, J. J., Huang, J., Zhu, C., Evavold, B. D. High prevalence of low affinity peptide-MHC II tetramer-negative effectors during polyclonal CD4+ T cell responses. J. Exp. Med. 208 (1), 81-90 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。