Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Periferik Kan İnsan alloantijen-özgü T hücrelerinin üretilmesi
Bu Makalede
Özet
This article describes a method for the generation and propagation of human T cell clones that specifically respond to a defined alloantigen. This protocol can be adapted for cloning human T cells specific for a variety of peptide-MHC ligands.
Özet
The study of human T lymphocyte biology often involves examination of responses to activating ligands. T cells recognize and respond to processed peptide antigens presented by MHC (human ortholog HLA) molecules through the T cell receptor (TCR) in a highly sensitive and specific manner. While the primary function of T cells is to mediate protective immune responses to foreign antigens presented by self-MHC, T cells respond robustly to antigenic differences in allogeneic tissues. T cell responses to alloantigens can be described as either direct or indirect alloreactivity. In alloreactivity, the T cell responds through highly specific recognition of both the presented peptide and the MHC molecule. The robust oligoclonal response of T cells to allogeneic stimulation reflects the large number of potentially stimulatory alloantigens present in allogeneic tissues. While the breadth of alloreactive T cell responses is an important factor in initiating and mediating the pathology associated with biologically-relevant alloreactive responses such as graft versus host disease and allograft rejection, it can preclude analysis of T cell responses to allogeneic ligands. To this end, this protocol describes a method for generating alloreactive T cells from naive human peripheral blood leukocytes (PBL) that respond to known peptide-MHC (pMHC) alloantigens. The protocol applies pMHC multimer labeling, magnetic bead enrichment and flow cytometry to single cell in vitro culture methods for the generation of alloantigen-specific T cell clones. This enables studies of the biochemistry and function of T cells responding to allogeneic stimulation.
Giriş
T lenfositleri adaptif bağışıklık sisteminin önemli bileşenleridir. T hücreleri, sadece doğrudan değil, efektör çeşitli mekanizmalar aracılığıyla patojenlere karşı koruyucu bir immün yanıtlara aracılık değil, aynı zamanda aktif kendini immünolojik toleransı muhafaza edilmesi ve bağışıklık sisteminin diğer hücrelerinin tepkileri yönlendirilmesi için sorumludur. Bu işlevler, bir T hücresi reseptörü (TCR) bağlanması, sitokinler ve kemokinlerin ve metabolitleri dahil olmak üzere 1, entegre sinyalleri, bir dizi içine yönlendirilir. Adaptif bağışıklık T hücre rolü tanımlayan karakteristik spesifisite sağlamaktadır Bu sinyaller arasında, TCR, özel bir önem taşır. TCR, T hücre efektör işlevi başlatmak sinyallerini temin etmek üzere bir çok özel ve hassas bir şekilde MHC (insan ortologu HLA) molekülleri (pMHC kompleksleri) tarafından sunulan lineer peptid antijen ile etkileşime girer. PMHC ligandlar ile TCR etkileşimleri biyokimyasal parametreleri T özgüllük sadece sağlarHücre aktivasyonu, aynı zamanda daha sonra T-hücresi işlevinin 2 niteliksel etkisi vardır. Bu nedenle, eğitim T hücre fonksiyon, genellikle tanımlanmış antijenik özgünlüğe sahip klonal T hücrelerinin tepkileri incelenmesi gerekir.
10 8 farklı αβTCRs 3-4 - yaklaşık 10 ila 12 αβ hücresi içeren insan T hücresi bölmesi, tahminen 10 7 içerir. Bu farklı repertuar koruyucu bağışıklık için bir T hücre yanıtını gerektirecek potansiyel patojenlerin peptidlerin geniş bir dizi tanınması için bir fırsat sunuyor. Bu antijene 5 önce bağışıklık yanıtının yokluğunda 10 -7 - kendi kendine MHC tarafından sunulan belirli bir yabancı antijene yanıt olarak T hücrelerinin frekansı 10 -4 mertebesinde olduğu tahmin edilmektedir. Naif T hücre repertuar peptid antijenleri ve sınır tepki gösteren öz-MHC tanıma yeteneğini sağlamak için timus seçimi ile şekillenmektedirkendinden peptit antijenlerine karşı ivity koruyucu bağışıklığı 2 aracılık potansiyel kullanımını maksimize edilmesidir. Bu ihlali reaktifliği, göreceli olarak büyük bir frekans, 10 -3 tasarlanmış Bununla birlikte, - İmmünolojik olarak naif bulunan bireylerden alınan T hücrelerinin, 10 -4, yabancı MHC moleküllerini hem de onlar mevcut endojen peptidler hem de göz önünde bulundurarak, farklı genetik yapıdaki hücreler ile uyarılmaya yanıt 6. Allojenik pMHC ligandların tanınması, bireysel MHC tarafından sunulan yabancı antigenlerin tanınmasına yapısal olarak benzer olduğu; TCR, allojenik MHC molekülü hem de sunulan peptit 7 her iki kritik biyokimyasal etkileşimleri yapar. PMHC çeşitliliğine allojeneik stimülasyonu sonucunda T hücrelerinin yanıtı sağlam yapısı farklı genetik yapıdaki hücreler, 8 yüzeyi üzerinde mevcut olan kompleksler. Bu, her bir MHC yaklaşık 2 x 10 4 farklı endojen peptit antijenlerini 9 sunulur olduğu tahmin edilmektedir. Bu bAllojenik stimülasyona yanıt readth T hücre alo-tepkiselliği sonuçlanan, host hastalığı (GVHD) alograft reddi veya doku yaması gibi klinik olarak ilgili patolojisi arasında önemli bir yönüdür.
Insan T hücresi alloreaktif yanıtlarının Çalışma, geleneksel olarak allojenik hücreleri ile stimüle edilmesini müteakkip bir hassas T hücreleri poliklonal tepkilerin test üzerine yaslanmaktadır. Sınırlayıcı seyreltme ile birlikte aynı allojeneik hücre hattı ile tekrarlı uyarım allojenik HLA 10 tanımlanan tanınması klonal T hücrelerinin üretme yeteneğine sahiptir analiz eder. Endojen pMHC en büyük ve farklı bir repertuar HLA T-hücrelerinin geniş bir repertuar uyaran belirli bir alogeneik kapsamayabilir kompleksleri Ancak, bu yaklaşım tek tek allojenik pMHC ligandlarına yanıtları incelenmesi için sorunludur. Bu toplu popülasyon uyarılması ve sınırlayıcı seyreltme yaklaşım arzu edilen Reacti T hücreleri izole etmek için klonların çok sayıda tarama gerektirecektirTek pMHC bağına karşı vite. Buna ek olarak, tek bir allojenik pMHC liganda yanıt T hücrelerinin frekansı, belirli bir antijene tepki veren, insan T hücresi klonlarının verimli üretimi için bir engel sunulur naif T hücresi popülasyonları arasında nispeten düşüktür.
Tanımlama ve poliklonal popülasyonlarından antijen-spesifik T hücrelerinin elde edilmesi fluoroforla işaretlenmiş pMHC multimerlerinin 11 geliştirilmesi ile sağlanmıştır. Bu yaklaşım, bir streptavidin-işaretli flüorofor bağlanarak etiketli rekombinant çözünür biyotinile MHC molekülleri, yüklenen özel peptit antijenlerini kullanmaktadır. PMHC bir multimerizasyon çözünür pMHC ligandlar için TCR'nin bünyesinde düşük bir düzeyde (uM) bir afinite telafi avidite artırır. Etiketlenmiş hücreler tanımlanır ve akış sitometrisi ile izole edilebilir. Bununla birlikte, bu yaklaşım, halen tipik olarak naif T hücresi popülasyonları arasında, antijen-spesifik T hücrelerin, en düşük frekans ile sınırlıdırEn akış sitometrelerinde doğru tanımlama ve tayin sınırından daha az büyüklükte siparişleri. Bu sınırlama gidermek için, tetramer-etiketli hücreler için pMHC tetramer etiketleme ve daha sonra manyetik boncuk zenginleştirmek için bir yöntem, 12 geliştirilmiştir. Bu yöntem, güvenli bir tespit numaralandırma ve düşük frekanslı antijen-spesifik T hücrelerinin elde edilmesi göstermiştir.
Bu protokol, spesifik olarak bireysel allojenik pMHC-ligantlarına tepki veren, insan T hücresi klonlarının oluşturulması için etkili bir protokolü tarif eder. Bu protokol, tek kriteri hücrelerinden T hücresi klonlarının üretimini (etkinleştirmeniz sıralama hücre bağlanımını akış sitometrisiyle ve insan T hücrelerinin in vitro kültürü için güçlü bir yöntemle Alloantijen özgü insan T hücrelerinin izolasyonu için multimer, etiketleme ve zenginleştirme pMHC (HLA) 'nin uygulandığı Şekil 1'de genel bakış).
Protokol
NOT: Bu protokol, insan gönüllülerden periferal kan örneklerinin kullanılmasını gerektirir. Insan denekler ile tüm araştırma gözden ve Helsinki Bildirgesi (2013) ve Sağlık Sigortası Taşınabilirliği ve 1996 Sorumluluk Yasası ile uyumu sağlamak üzere bir İnsan Araştırmaları Kurumsal Değerlendirme Kurulu tarafından onaylanmış olması gerekir.
Tüm kan T-hücrelerinin 1. izolasyonu
- Başlamadan önce, oda sıcaklığına kadar yoğunluk gradyan orta ısıtın. Kısım 2-4 steril 15 ml konik santrifüj tüplerine yoğunluk gradyan ortamının 4 ml (1 tüp her biri, 10 ml seyreltilmiş kan hacmi için kullanılacaktır).
- 1-2 sodyum heparin sprey kan 10-20 ml kaplı (yeşil-üst) venöz kan alma tüpleri edinin. Eğitimli bireylerin gözetiminde insan numuneleri toplamak ve Kurumsal Değerlendirme Kuruluna göre protokolünü onayladı.
- % 70 etanol ile, tüplerin dış silin. Dikkatle fi üstleri kaldırmaktoplama tüpleri doldurulmayan, steril bir 50 ml santrifüj tüpüne kan süzün.
- Her bir kan toplama tüpüne 10 ml steril fosfat tamponlu tuz (PBS) ekleyin. , PBS toplamak decanted tam kan eklemek ve hafifçe karıştırın.
- 25 ul insan T hücresi zenginleştirme Kokteyl / 2 mL toplam hacim. 20 dakika oda sıcaklığında inkübe edin.
- Yavaşça yoğunluk gradyan ortamının üstte 1 seyreltilmiş kan: 10 ml'lik bir pipet kullanılarak, 1, 10 ml kadar katman. Yoğunluk gradyan ortamın yüzeyini bozmak için dikkatli olun.
- 20 o C'de santrifüj katmanlı kan ve yoğunluk gradyan orta 20 dakika boyunca 1200 x g'de
- Yoğunluk gradyan orta ve yoğunluk gradyan orta ve seyreltilmiş plazma arasındaki ara yüzde lökosit tabakası arasındaki ara yüzü bozmayacak dikkat ederek, santrifüj tüpleri çıkarın. 5 ml'lik bir pipet kullanarak dikkatli bir şekilde lökosit faz toplanır ve yeni bir steril 50 ml konik küvet transferör.
- 50 ml toplanan PBL hacmini getirmek ve hafifçe karıştırmak için PBS ekleyin.
- 20 ° C'de 5 dakika boyunca 600 x g'de santrifüj Durusu.
- Süspanse tamponu (steril filtre edilmiş PBS% 1 BSA ihtiva eden) ayırma sitometrisi 10 ml'lik steril bir akış hücreleri topak. Örnek hücre süspansiyonu, 10 ul, 1:10 seyreltilmiş bir hemositometre kullanılarak hücre sayısı tripan mavisi (90 ul ekle) (beklenen verim 1-4 x 10 6 hücre tam kan / tüp).
- 5 ml'lik bir tüpe transfer 1 ml lik bir çıkarın ve tetramer etiketli olmayan T hücrelerinin analizi için buz üzerinde tutulur. Buz üzerinde hücre süspansiyonu tutun.
Alloantijen-spesifik T hücrelerinin 2. Manyetik zenginleştirilmesi
- 1 Alloantijen pMHC tetramerini sulandırmak: 100 steril sıralama tamponunda.
- Santrifüj Hücre süspansiyonu, 20 ° C'de 5 dakika boyunca 600 x g'de (adım 1.11 9 mi) Durusu.
- Peletlendi için pMHC tetramer Alloantijen seyreltilmiş 50 ul ekleyinHücreler (10 7 hücreleri kadar). Nazik pipetleme karıştırın. Steril bir 5 ml tüp aktarın. Oda sıcaklığında 30 dakika boyunca inkübe edin.
- Sıralama tampon 2 ml ekleyin. 20 ° C'de 5 dakika boyunca 600 x g'de santrifüj Durusu.
- 100 ul sıralama tamponunda süspanse hücreler. 10 ul Biotin seçimi kokteyl ilave edilir ve oda sıcaklığında 15 dakika inkübe edilir.
- 5 ul manyetik nanopartikülleri ilave edilir ve oda sıcaklığında 10 dakika inkübe edilir.
- 2.5 ml sıralama tampon ve pipetleme hafifçe karıştırın ekleyin. 5 ml tüp aktarmak, 100 ul kısım çıkarın ve ön zenginleştirme hücrelerin analizi için buz üzerinde tutmak.
- Hücre ayrılma mıknatıs hücre süspansiyonu ihtiva eden 5 ml'lik tüp yerleştirin. Bu kapak, tüpün üstüne gevşek olması gerekmektedir. Oda sıcaklığında 5 dakika boyunca inkübe edin.
- Yavaşça tüpten kapağı çıkarın. Birlikte tüp ve mıknatıs tutma, taze 5 ml tüp içine tüp içeriğini süzün. Dokunun veya tüp içeriğini sallamayınsıvının son damla çıkarın.
- Mıknatıstan tüpü çıkarın. 2 ml soğuk sıralama tampon ekleyin ve pipetle hafifçe karıştırın. 2, bir hemositometre kullanılarak hücrelerin sayısı tripan mavisi (10 ul ekle): Örnek hücre süspansiyonu, 10 ul, 1 seyreltin.
Tek hücreli Sitometrisi hücre sıralama için T hücrelerinin 3. hazırlanması
- Hücrelerin tüm tüplere soğuk sıralama tampon ekleme (tetramer etiketlenmemiş, tetramer etiketli zenginleştirilmiş un, tetramer ve etiketli zenginleştirilmiş) 3 ml hacim getirmek.
- 4 o C'de 5 dakika boyunca 600 xg'de Santrifüj ve decant tampon hücreleri kurtarmak için.
- 25 ul soğuk tür tampon pelet hücreleri tekrar süspansiyon. 5 ul insan Fc blok ekleyin. 20 dakika boyunca buz üzerinde inkübe edin.
- Akış sitometri sıralama için antikorlar hazırlayın. 15 ul sıralama tampon, 15 ul anti-CD5, 15 ul anti-CD14, ve 15 ul anti-CD19 karıştırın.
- Hücrelerin her biri tüp antikor karışımı 20 ul ekle. 20 dakika boyunca buz üzerinde inkübe edin.
- Her tüpe soğuk çeşit tampon 2 ml ekleyin.
- 4 o C'de 5 dakika boyunca 600 xg'de Santrifüj ve decant tampon hücreleri kurtarmak için.
- Sıralama tampon maddesi içinde 1 -2 x 10 6 hücre / ml'lik bir konsantrasyonda tekrar süspansiyon hücreleri.
- Insan T hücre kültür ortamının kısım 100 ul (Iscove DMEM, 2 mM Glutamax, 10 mM HEPES, 50 ug / ml gentamisin, 50 uM 2-merkaptoetanol,% 10 ısı ile inaktive edilmiş insan AB serumu, ve 2.5 ng / ml rekombinant insan ile desteklenmiş IL-2), 96 oyuklu tabanı yuvarlak hücre kültürü plakasının her oyuğuna. Buz üzerinde tutun.
Tek hücreli Sitometrisi Sorting tarafından Tetramer-etiketli T hücrelerinin 4. İzolasyonu
- Alloantijen pMHC tetrameri etiketli T hücreleri (Şekil 2.a) tanımlamak için yolluk parametrelerin akım sitometri kurmak. B hücreleri ve CD14 ifade CD19 hariç, lenfositlerin ikilileri, kapıyı ortadan kaldırmak için stratejiler yolluk kurmak için ön zenginleştirme tetrameri etiketli kısmını kullanınmonositler ifade ve CD5 ifadesi ile, T hücreleri tanımlar. (Tetramer etiketli olmayan örnekten hücreler bu kapıdan giren ve - - CD19, CD5 + CD14 0%) ile tetramer bağlanması T hücrelerin belirlenmesine yolluk kurmak için bir floresan gibi tetrameri eksi bir kumanda ile işaretli olmayan örnek kullanın .
Not: aşırı kısıtlayıcı yolluk stratejileri izole edilen T hücrelerinin sayısını azaltırken, antijene özel niteliği olmayan, T hücreleri veya T hücrelerinin izolasyonu ile sonuçlanır yeterince sıkı değildir stratejileri yolluk. - Tek hücre sıralama için plaka parametreleri programlamak. CD19 - - Her kuyuda tetramerini + hücreyi 1 CD5 + CD14 yerleştirmek için sıralayıcı yönlendirin. Her satırda (Şekil 2.S iyi (hücreler - CD19 - - tetrameri 100 CD5 + CD14) de 1 negatif kontrol (hücreleri kuyunun içine sıralanır) ve 1 pozitif kontrol içerecek şekilde ayarlanan plakayı yönlendirin ).
- Ayırıcı stratejisi ve plaka kurulumu sitometrisi düzenlenen akım kullanarak, doğrudan bir akış sitometrik hücre ayırıcıyla 96 oyuklu bir plakaya bireysel tetramer bağlanması T hücreleri izole etmek.
5. Kültür ve alloantijen-özgü T hücresi klonlarının Genişleme
- 20 ° C'de, hücre sınıflandırılması; 5 dakika boyunca 600 x g'de santrifüj plaka tamamlanmasından sonra, % 6 CO 2 inkübatör 37 o C yerleştirin kültür plakası.
- 30 saniye vorteksleyin uyarıcı, anti-CD3 / anti-CD28 mikro boncuklar boncuklar tekrar süspansiyon.
- Toplanan T hücrelerinin uyarılması için gerekli olan aktivatör boncuk hacmi (aktivatörünün mikro-/ oyuk 0.5 ul) hesaplayın. Steril bir 5 ml tüp uyarıcısı boncuk hesaplanan hacim aktarın. 1 ml insan T hücre kültür ortamı ve vorteks ekleyin.
- Mıknatıs microbead süspansiyonu ile tüp yerleştirin. Bu kapak, tüpün üstüne gevşek olması gerekmektedir. Oda sıcaklığında 2 dakika süreyle inkübe edin.
- Yavaşça çıkarıntüpten kabı. Taze 5 ml tüp içine, birlikte decant tüp içeriği tüp ve mıknatıs tutma. Dokunun veya tüp içeriğini sallamayın.
- Mıknatıstan tüpü çıkarın. Insan T hücre kültür ortamı ilave edin (mikrotaneciklerin, 100 ul ortam / 0.5 ul, başlangıçta ilave edildi).
- Kısım 96 oyuklu plakanın her oyuğuna aktivatör boncuk süspansiyonu 100 ul. % 6 CO 2 inkübatör 37 o C kültür plaka inkübe.
- Mikroskobik inceleme ile günlük hücre büyümesini izleyin. 7 günlük bir kültürden (Şekil 3a) - çoğalan hücrelerin küçük kümeler 5 sonra mikroskopla gözlenebilir.
Not: bu noktada T hücresi kültürlerinin Görselleştirme zor olabilir, ve bu aşamada gözlemlenebilir hücre kümelerinin olmaması artan bir T hücresi eksikliği olmayabilir. - Hücre izolasyonu 14 gün sonra, dikkatli bir şekilde kültür üst kapalı ve ortam 100 ul çıkararak besleme kültürleri 100 μ ile değiştirinL, taze insan T hücre kültürü ortamı. % 6 CO 2 inkübatör 37 o C kültür plaka kuluçkaya devam edin.
- Mikroskopik inceleme ve kültür ortamının rengi değerlendirilmesi günlük hücre büyümesini izlemek. 3 gün orta değişiklikten sonra - Büyük hücre kümeleri mikroskobik 2 görünür olmalıdır. Makroskobik olarak, hücre topakları ortam değişikliği takiben 14 gün boyunca görünür hale gelmelidir.
- Hücre izolasyonunu takiben 28 gün, mikroskobik inceleme ile büyüyen klonları tanımlamak. 200 ul insan T hücre kültür ortamı içeren 48-çukurlu bir doku kültür plakasının her bir gözeneğine büyüme pozitif 96 oyuklu plaka kültürlerin 200 ul hacim aktarın.
- Uyarıcı, anti-CD3 / anti-CD28 mikro boncuklar 12.5 ul içeren 100 ul ekle (- 5.6 bölümlerde 5.2 'de tarif edildiği gibi hazırlanmıştır). % 6 CO 2 inkübatör 37 o C kültür plaka inkübe.
- Mikroskobik eski tarafından günlük kültür büyümesini izlemekaminasyon ve kültür ortamının rengi değerlendirilmesi. T hücresi kültürü> 2x10 6 / ml'ye ulaştığı zaman (tipik olarak 3-5 gün tekrar uyarma işleminden sonra, ortam başladığı gün ile tahmin edilebilir saman-sarı renk), 24 oyuklu doku kültürü plakası, bir oyuğuna transfer kültürü ve 500 ul, insan T hücre ortamı ilave edin.
- 10-14 gün pMHC tetramerinin analizi bağlama (bölüm 3 ve 4.1 açıklanan etiketleme ve yolluk stratejisini kullanarak) flow sitometri ile Alloantijen özelliğinin değerlendirilmesi T hücre kültürünün 200 ul toplamak, yeniden uyarma izleyin.
6. Uzun süreli yeniden uyarma ve Kültür T hücresi klonlarının
- Sürekli her 14 günde bir olabilir, arzu edilen özellikteki klonal T hücresi kültürlerini yeniden canlandırmak ve genişletmek. Son anti-CD3 / CD28 mikroboncuk uyarımını takiben 14. günde, steril bir 5 ml'lik bir tüp içine T hücresi kültürlerini toplayın. 2,5 ml'lik bir hacme, tek tüp içinde, aynı T hücresi klonunun birden fazla kuyu birleştirin.
- 2.5 ml nihai hacme getirmek ve pipetleme hafifçe karıştırmak için orta ekleyin.
- Kültürden eski, mikro çıkarmak için bir hücre ayırma mıknatıs T hücresi kültürü içeren 5 ml'lik tüp yerleştirin. Bu kapak, tüpün üstüne gevşek olması gerekmektedir. Oda sıcaklığında 5 dakika boyunca inkübe edin.
- Yavaşça tüpten kapağı çıkarın. Birlikte tüp ve mıknatıs tutma, taze 5 ml'lik bir tüp içine hücre süspansiyonu süzün. Dokunun ya da sıvının son damla kaldırmak için tüp içeriği sallamayın.
- 4 ml nihai hacmi getirmek için orta ekleyin. Örnek 10 ul Hemasitometre kullanarak hücreleri saymak için.
- Oda sıcaklığında 5 dakika boyunca 600 x g'de santrifüj ile T hücrelerinin yeniden elde etmek.
- Durusu süpernatant. 10 6 hücre / ml insan T hücre kültürü ortamında yeniden süspanse T hücreleri. Aktarım 1, 24 oyuklu doku kültür plakasının her bir oyuğuna ml'lik eş payları.
- Uyarıcı, anti-CD3 / a 12.5 ul ihtiva eden 100 ul ortam eklenerek T hücrelerini uyarmak YenidenYüzgeç CD28 microbeads (- 5.6 gibi bölümlere 5.2 açıklanmıştır). % 6 CO 2 inkübatör 37 o C'de inkübe edilir.
Sonuçlar
Strateji sıralama Akış sitometrisi, bir manyetik tanecik zenginleştirme ve tek hücreli akışı aracılığı ile özgüllük Alloantijen tanımlanmış olan bu protokol, klonal insan T hücre kültürlerinin üretimini tarif eder. 1, sürecin bir özeti verilmektedir Şekil.
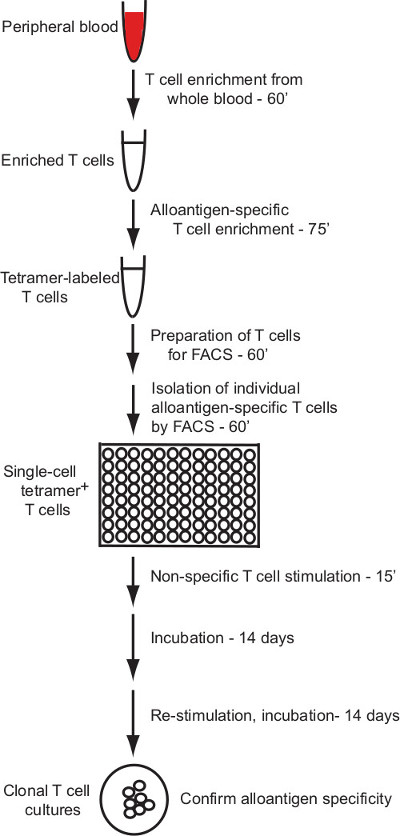
Şekil 1: Protokol genel protokolü, burada a...
Tartışmalar
T cell alloreactivity is a long-studied and clinically-relevant phenomenon. The robust proliferative and effector responses of T cells to allogeneic stimulation has enabled extensive analyses of human T cell responses in vitro through relatively straightforward mixed lymphocyte reactions of peripheral blood T cells against inactivated allogeneic cells. However, these primary alloreactive T cell responses are oligoclonal, comprised of a large number of individual T cells responding to specific alloantigens. This ...
Açıklamalar
The authors declare no competing financial interests.
Teşekkürler
The author would like to thank the NIH Tetramer Core Facility for tetramer production. The author would also like to thank E.D. O’Connor and K.E. Marquez at the UCSD Human Embryonic Stem Cell Core Facility flow cytometry laboratory for assistance in cell sorting. This work was funded by National Institutes of Health grant K08AI085039 (G.P.M.).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Sodium heparin venous blood collection tube 16 x 100 mm | Becton, Dickenson and Company | 366480 | |
| Lymphoprep | Stemcell Technologies | 7801 | |
| Rosette Sep Human T Cell Enrichment Kit | Stemcell Technologies | 15061 | |
| Dulbecco's PBS, 1x without Ca or Mg | Corning | 21-031-CV | |
| Bovine serum albumin | Sigma-Aldrich | A7906 | |
| EDTA | Sigma-Aldrich | E6635 | |
| Fluorophore-labeled pMHC tetramer | NIH Tetramer Facility | NA | |
| EasySep Biotin Selection Kit | Stemcell Technologies | 18553 | |
| EasySep Selection magnet | Stemcell Technologies | 18000 | |
| TruStain FcX Human Fc blocking solution | Biolegend | 422301 | |
| Anti-CD5 PE-Cy7 (clone UCHT2) | Biolegend | 300621 | |
| Anti-CD14 FITC (clone HCD14) | Biolegend | 325603 | |
| Anti-CD19 FITC (clone HIB19) | Biolegend | 302205 | |
| Iscove's DMEM, without b-ME or L-glutamine | Corning | 15-016-CV | |
| HEPES | Corning | 25-060-CI | |
| b-Mercaptoethanol | Life Technologies | 21985-023 | |
| Glutamax | Life Technologies | 35050061 | |
| Gentamicin sulfate (50 mg/ml) | Omega Scientific | GT-50 | |
| Human AB serum, male donor | Omega Scientific | HS-30 | |
| Recombinant human IL-2 | Peprotech | AF 200-02 | |
| Dynabeads Human T-Activator CD3/CD28 | Life Technologies | 11131D | |
| Media | |||
| Cell sorting buffer | |||
| PBS, pH 7.4 | 1 L | ||
| BSA | 10 g | ||
| EDTA (0.5 M) | 2 ml | ||
| Human T Cell Culture Medium | |||
| Iscove's DMEM | 351.6 ml | ||
| Heat-inactivated human AB serum | 40 ml | ||
| HEPES (1 M) | 4 ml | ||
| Glutamax (100x) | 4 ml | ||
| Gentamicin (50 mg/ml) | 0.4 ml | ||
| b-mercaptoethanol (14.3 M) | 1.4 ml | ||
| Recombinant human IL-2 (1 mg/ml) | 1 ml |
Referanslar
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S. T cell activation. Annu. Rev. Immunol. 27 (1), 591-619 (2009).
- Morris, G. P., Allen, P. M. How the TCR balances sensitivity and specificity for the recognition of self and pathogens. Nat. Immunol. 13 (2), 121-128 (2012).
- Arstilla, T. P., et al. A direct estimation of the human αβ T cell receptor diversity. Science. 286 (5441), 958-961 (1999).
- Robbins, H. S., et al. Comprehensive assessment of T-cell receptor β-chain diversity in αβ T cells. Blood. 114 (19), 4099-4107 (2009).
- Alanio, C., Lemaitre, F., Law, H. K. W., Hasan, M., Albert, M. L. Enumeration of human antigen-specific naive CD8+ T cells reveals conserved precursor frequencies. Blood. 115 (18), 3718-3725 (2010).
- Suchin, E. J., et al. Quantifying the frequency of alloreactive T cells in vivo: new answers to an old question. J. Immunol. 166 (2), 973-981 (2001).
- Felix, N. J., Allen, P. M. Specificity of T-cell alloreactivity. Nat. Rev. Immunol. 7 (12), 942-953 (2007).
- Morris, G. P., Ni, P. P., Allen, P. M. Alloreactivity is limited by the endogenous peptide repertoire. Proc. Natl. Acad. Sci. USA. 108 (9), 3695-3700 (2011).
- Suri, A., et al. In APCs, the autologous peptides selected by the diabetogenic I-Ag7 molecule are unique and determined by the amino acid changes in the P9 pocket. J. Immunol. 168 (3), 1235-1243 (2002).
- Yssl, H., Spits, H. Generation and maintenance of cloned human T cell lines. Curr. Protoc. Immunol. 7, (2002).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Moon, J. J., et al. Naive CD4+ T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity. 27 (2), 203-213 (2007).
- Chicz, R. M., et al. Specificity and promiscuity among naturally processed peptides bound to HLA-DR alleles. J. Exp. Med. 178 (1), 27-47 (1993).
- Ni, P. P., Allen, P. M., Morris, G. P. The ability to rearrange dual TCRs enhances positive selection, leading to increased allo- and autoreactive T cell repertoires. J. Immunol. In press, (2014).
- Morris, G. P., Uy, G. L., Donermeyer, D., DiPersio, J. F., Allen, P. M. Dual receptor T cells mediate pathologic alloreactivity in patients with acute graft-versus-host disease. Sci. Transl. Med. 5 (188), (2013).
- Altman, J. D., Reay, P. A., Davis, M. M. Formation of functional peptide complexes of class II major histocompatibility complex proteins from subunits produced in Escherichia coli. Proc. Natl. Acad. Sci. USA. 90 (21), 10330-10334 (1993).
- Sabatino, J. J., Huang, J., Zhu, C., Evavold, B. D. High prevalence of low affinity peptide-MHC II tetramer-negative effectors during polyclonal CD4+ T cell responses. J. Exp. Med. 208 (1), 81-90 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır