É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Geração de Células T humanas alo-específicos a partir de Sangue Periférico
Neste Artigo
Resumo
This article describes a method for the generation and propagation of human T cell clones that specifically respond to a defined alloantigen. This protocol can be adapted for cloning human T cells specific for a variety of peptide-MHC ligands.
Resumo
The study of human T lymphocyte biology often involves examination of responses to activating ligands. T cells recognize and respond to processed peptide antigens presented by MHC (human ortholog HLA) molecules through the T cell receptor (TCR) in a highly sensitive and specific manner. While the primary function of T cells is to mediate protective immune responses to foreign antigens presented by self-MHC, T cells respond robustly to antigenic differences in allogeneic tissues. T cell responses to alloantigens can be described as either direct or indirect alloreactivity. In alloreactivity, the T cell responds through highly specific recognition of both the presented peptide and the MHC molecule. The robust oligoclonal response of T cells to allogeneic stimulation reflects the large number of potentially stimulatory alloantigens present in allogeneic tissues. While the breadth of alloreactive T cell responses is an important factor in initiating and mediating the pathology associated with biologically-relevant alloreactive responses such as graft versus host disease and allograft rejection, it can preclude analysis of T cell responses to allogeneic ligands. To this end, this protocol describes a method for generating alloreactive T cells from naive human peripheral blood leukocytes (PBL) that respond to known peptide-MHC (pMHC) alloantigens. The protocol applies pMHC multimer labeling, magnetic bead enrichment and flow cytometry to single cell in vitro culture methods for the generation of alloantigen-specific T cell clones. This enables studies of the biochemistry and function of T cells responding to allogeneic stimulation.
Introdução
Os linfócitos T são componentes críticos do sistema imunitário adaptativo. As células T são responsáveis não só para mediar directamente respostas imunitárias protectoras para agentes patogénicos através de uma variedade de mecanismos efectores, mas também manter activamente auto-tolerância imunológica e dirigir as respostas de outras células do sistema imunológico. Estas funções são dirigidos através de um número de sinais integrados, incluindo o receptor de células T (TCR) de ligação, citocinas e quimiocinas, e metabolitos 1. Destes sinais, o TCR é de particular importância, uma vez que proporciona a especificidade característica que define o papel de células T na imunidade adaptativa. Um TCR interage com antigénios peptídicos lineares apresentados pelo MHC (HLA ortólogo humano) moléculas (complexos pMHC) de um modo altamente específico e sensível para fornecer os sinais que dão início a função efectora de células T. Os parâmetros bioquímicos das interacções TCR com ligandos pMHC proporcionam não só a especificidade para o tativação celular, mas também tem um impacto qualitativo sobre a função das células T posterior 2. Assim, estudar a função das células T exige frequentemente a examinar as respostas de células T com especificidade antigénica clonais definido.
O compartimento da célula T humana, contendo cerca de 10 12 células T αβ, contém uma estimativa de 10 julho-10 agosto αβTCRs distintas 3-4. Este repertório diversificado oferece oportunidade para o reconhecimento da vasta gama de peptídeos de potenciais patógenos que exigiria uma resposta das células T para a imunidade protetora. Estima-se que a frequência de células T de responder a um determinado antigénio estranho apresentado por auto-MHC é da ordem de 10 -4 - -7 10 na ausência de resposta imune antes que o antigénio 5. O repertório de células T naive é moldada por selecção tímica para assegurar a capacidade de reconhecer auto-MHC que apresenta antigénios peptídicos e limite reagemivity contra antigénios auto-péptido, a maximização da utilidade potencial para mediar a imunidade protectora 2. No entanto, em violação da presente concebido reactividade, uma relativamente grande frequência, 10 -3 - -4 10, de células T a partir de indivíduos imunologicamente naive respondem à estimulação com células alogénicas, que reconhece ambas as moléculas MHC estranhos, bem como os peptídeos endógenos que apresentem 6. O reconhecimento de ligandos pMHC alogénicos é estruturalmente semelhante ao do reconhecimento de antigénios estranhos apresentados pelas auto-MHC; o TCR faz interacções bioquímicas críticas, tanto com a molécula de MHC alogénico, bem como o péptido apresentado 7. A natureza robusta da resposta das células T para estimulação resulta alogénicas a partir da diversidade de complexos pMHC presente na superfície de células alogénicas 8. Estima-se que cada MHC apresenta cerca de 2 x 10 4 diferentes antigénios peptídicos endógena 9. Este breadth de resposta à estimulação alogénica é um aspecto importante da patologia clinicamente relevantes, tais como a rejeição de aloenxertos ou a doença do enxerto versus hospedeiro (GVHD), que resulta a partir de células T alloreactivity.
Estudo de células T respostas alorreativas humanos tradicionalmente invocado examinar as respostas policlonais de células T naive após a estimulação com células alogênicas. Estimulação repetida com a mesma linha de célula alogénica combinado com análises de diluição limitante é capaz de gerar células T clonais com reconhecimento definido alogénica de HLA de 10. No entanto, esta abordagem é problemática para examinar respostas aos ligandos alogénicos pMHC individuais, como o repertório grande e diverso de complexos pMHC endógeno presente para um dado alogénica de HLA estimula um amplo repertório de células T. Esta estimulação população a granel e de diluição limitante abordagem exigiria o rastreio de grandes números de clones para isolar as células T com a desejada Reactividade contra um único ligando pMHC. Além disso, a frequência de células T que respondem a uma célula alogénica ligando pMHC individuais é relativamente baixo entre as populações de células T ingénuas, o que apresenta uma barreira eficiente para a geração de clones de células T humanas que respondem a um dado antigénio.
Identificação e isolamento de células T específicas de antigénios a partir de populações policlonais têm sido activado pelo desenvolvimento de marcado com fluoróforo pMHC multímeros 11. Esta abordagem utiliza antigénios peptídicos específicos carregados em moléculas de MHC recombinantes solúveis, biotinilados que são marcados por ligação a um fluoroforo marcado com estreptavidina. Multimerização de pMHC aumenta a avidez, compensando a afinidade intrínseca baixa (M) de TCR para ligantes pMHC solúveis. As células marcadas podem ser identificadas e isoladas por citometria de fluxo. No entanto, esta abordagem é ainda limitada pela baixa frequência de células T específicas do antigénio entre as populações de células T naive, que são tipicamenteordens de grandeza menor do que o limite de identificação e quantificação precisas sobre a maioria das citómetros de fluxo. Para resolver esta limitação, um método de rotulagem pMHC tetrâmero e subsequente enriquecimento esfera magnética para células marcadas com tetrâmero foi desenvolvida 12. Este método tem demonstrado uma detecção fiável, enumeração e isolamento de células específicas para o antigénio T de baixa frequência.
Este protocolo descreve um protocolo eficaz para a geração de clones de células T humanas que respondem especificamente a ligandos alogénicos pMHC individuais. O protocolo aplica pMHC (HLA) de rotulagem e enriquecimento multímero para o isolamento de células T humanas específicas do aloantigénio com citometria de fluxo de células de triagem e um método robusto para a cultura in vitro de células T humanas, para permitir a produção de clones de células T a partir de células separadas individuais ( Resumo na Figura 1).
Protocolo
NOTA: Este protocolo requer a utilização de amostras de sangue periférico de voluntários humanos. Todas as pesquisas com seres humanos deve ser revisado e aprovado por um Estudos Humanos Institutional Review Board para assegurar a conformidade com a Declaração de Helsinque (2013) e do Seguro de Saúde Portabilidade e Responsabilidade Act de 1996.
1. Isolamento das células T a partir de Sangue Total
- Antes da partida, aquecer o meio de gradiente de densidade até à temperatura ambiente. Aliquota de 4 ml de meio de gradiente de densidade de 2-4 em tubos estéreis de 15 ml de centrífuga cónicos (1 tubo serão utilizados para cada 10 ml de volume total de sangue diluído).
- Obter 10-20 ml de sangue em heparina spray de 2/1 de sódio revestido (verde-top) tubos de coleta de sangue venoso. Coletar amostras humanas sob a supervisão de pessoas treinadas e de acordo com um Conselho de Revisão Institucional protocolo aprovado.
- Limpe a parte externa dos tubos com álcool a 70%. Remova cuidadosamente os tops da fiencheram tubos de coleta e decantar o sangue para um tubo de centrífuga de 50 ml estéril.
- Adicionar 10 ml estéril tampão fosfato salino (PBS) a cada tubo de coleta de sangue. Recolher o PBS, adicionar ao sangue total decantado, e misture delicadamente.
- Adicionar 25 ul t Human Enrichment celular Cocktail / 2 ml de volume total. Incubar à temperatura ambiente durante 20 min.
- Utilizando uma pipeta de 10 mL, a camada de até 10 ml de 1: 1 sangue diluído suavemente no topo do meio de gradiente de densidade. Ter cuidado para não perturbar a superfície do meio de gradiente de densidade.
- Centrifugar o sangue em camadas e meio de gradiente de densidade a 1200 xg durante 20 min a 20 o C.
- Retire os tubos da centrifugadora, tendo cuidado para não perturbar a interface entre o meio de gradiente de densidade e a camada de leucócitos na interface entre o meio de gradiente de densidade e o plasma diluído. Usando uma pipeta de 5 ml, cuidadosamente a camada de leucócitos recolher e transferir para um novo 50 ml estéril banheira cónicae.
- Adicionar PBS para perfazer o volume do PBL recolhidos para 50 mL e misturar suavemente.
- Centrifugar a 600 xg durante 5 min a 20 o C. Decantar.
- Ressuspender as células sedimentadas em 10 ml de citometria de fluxo estéril triagem tampão (esterilizada por filtração PBS contendo 1% de BSA). Amostra 10 ml de suspensão celular, diluir 1:10 (adicionar a 90 mL) azul de tripan para contar células usando um hemocitômetro (rendimento esperado 1-4 x 10 6 células / tubo de sangue total).
- Retirar alíquota de 1 ml, transferir para tubo de 5 ml, e manter em gelo para análise de células T não rotulados por tetrâmero. Mantenha suspensão de células no gelo.
2. Enriquecimento magnética de células T alo-específicos
- Diluir aloantigénio pMHC tetrâmero a 1: 100 em tampão de tipo estéril.
- Centrifugar a suspensão de células (9 ml do passo 1.11) a 600 xg durante 5 min a 20 o C. Decantar.
- Adicionar 50 ul de aloantigénio diluída pMHC tetrâmero para sedimentadasAs células (até 10 7 células). Misture por pipetagem suave. Transferir para um tubo esterilizado de 5 ml. Incubar durante 30 minutos à temperatura ambiente.
- Adicione 2 ml tipo buffer. Centrifugar a 600 xg durante 5 min a 20 o C. Decantar.
- Ressuspender as células em 100 ul tampão tipo. Adicionar 10 ul de coquetel Biotina Selecção e incubar durante 15 min à temperatura ambiente.
- Adicionar 5 uL Magnética Nanopartículas e incubar durante 10 min à temperatura ambiente.
- Adicionar 2,5 ml espécie de tampão e misture delicadamente por pipetagem. Remover alíquota de 100 ul, transferir para tubo de 5 ml, e manter em gelo para análise de células de pré-enriquecimento.
- Colocar o tubo contendo 5 ml da suspensão de células no íman de separação de células. A tampa deve ser solta em cima do tubo. Incubar durante 5 min à temperatura ambiente.
- Com cuidado, retire a tampa do tubo. Segurando o tubo e um ímã em conjunto, decantar o conteúdo do tubo para um novo tubo de 5 ml. Não bata nem sacuda o conteúdo do tubo pararemover as últimas gotas de líquido.
- Retirar o tubo do ímã. Adicionar 2 ml de tampão tipo frio e misture delicadamente por pipetagem. Amostra de 10 uL da suspensão de células, diluída 1: 2 (para adicionar 10 ul) de azul de tripano a contagem de células utilizando um hemocitómetro.
3. Preparação de células T para uma única célula Citometria de Fluxo Seleção celular
- Adicionar tampão tipo frio em todos os tubos de células (tetrâmero marcado, não-enriquecido, e enriquecido com rótulo tetrâmero marcado com tetrâmero) para trazer volume para 3 ml.
- Centrifugar a 600 xg durante 5 min a 4 ° C e tampão de decantar para recuperar as células.
- Ressuspender as células peletizadas em 25 mL de tampão tipo frio. Adicionar 5 uL de bloco Fc humana. Incubar em gelo durante 20 min.
- Preparar anticorpos para triagem de citometria de fluxo. Misture 15 ul de tampão tipo, 15 ul anti-CD5, 15 ul anti-CD14, e 15 ul anti-CD19.
- Adicionar 20 ul de mistura de anticorpo a cada tubo de células. Incubar em gelo durante 20 min.
- Adicionar 2 ml de tampão de tipo frio a cada tubo.
- Centrifugar a 600 xg durante 5 min a 4 ° C e tampão de decantar para recuperar as células.
- Ressuspender as células a uma concentração de 1 x 10 -2 6 células / ml em tampão tipo.
- Alíquotas de 100 ul de t meio de cultura de células humanas (DMEM Iscove suplementado com Glutamax 2 mM, HEPES 10 mM, 50 ug / ml de gentamicina, 50 uM de 2-mercaptoetanol, 10% de soro AB humano inactivado pelo calor, e 2,5 ng ml humana / recombinante IL-2) para cada poço de uma placa redonda de 96 poços de cultura de células de fundo. Manter em gelo.
4. Isolamento de células marcadas com tetrâmero T por uma única célula Citometria de Fluxo Seleção
- Estabelecer citometria de fluxo para identificar os parâmetros de propagação aloantigénio-pMHC tetrâmero células T marcados (Figura 2.a). Use a fração tetramer pré-enriquecimento marcado para estabelecer gating estratégias para eliminar dobletos, portão em linfócitos, excluir CD19 expressando as células B e CD14expressando monócitos, e identificar as células T por expressão CD5. Utilizar a amostra não marcada como um tetrâmero com fluorescência menos um controlo para estabelecer o gating para identificação de células T de ligação ao tetrâmero (com 0% de CD5 + CD14 - CD19 - células a partir da amostra não marcada pelo tetrâmero deve cair dentro deste portão) .
NOTA: Gating estratégias que não são adequadamente rigorosas irá resultar no isolamento de células não-T ou células T que não são antigénio específico, enquanto as estratégias gating excessivamente restritivas vai reduzir o número de células T isoladas. - Programar os parâmetros da placa para o tipo de célula única. Direcionar o classificador para colocar um CD5 + CD14 - CD19 - tetrâmero + célula em cada poço. Direcione a placa criada para conter um controle negativo (ausência de células classificadas para o bem) e um controle positivo (100 CD5 + CD14 - CD19 - tetramer - células) em cada linha (Figura 2.B ).
- Utilizando a citometria de fluxo estabelecida estratégia gating e configuração da placa, isolar as células-T de ligação de tetrâmero individuais directamente para a placa de 96 poços utilizando um classificador de células por citometria de fluxo.
5. Cultura e Expansão de clones de células T alo-específicas
- Após a conclusão da separação de células, a placa de centrifugar a 600 xg durante 5 min a 20 o C. Colocar a placa de cultura a 37 ° C num 6% incubadora de CO 2.
- Vortex estimuladores microesferas anti-CD3 / anti-CD28 durante 30 seg para ressuspender as esferas.
- Calcular o volume de grânulos activadores necessários para a estimulação de células T recolhidas (0,5 ul de microesferas de activadores / poço). Transferir volume calculado de contas estimulador para um tubo estéril de 5 ml. Adicionar 1 ml de meio de cultura de célula T humana e vortex.
- Coloque tubo com suspensão microbead em ímã. A tampa deve ser solta em cima do tubo. Incubar durante 2 min à temperatura ambiente.
- Retire com cuidadoda tampa do tubo. Segurando o tubo e um ímã em conjunto, o conteúdo do tubo decante para um novo tubo de 5 ml. Não bata nem sacuda o conteúdo do tubo.
- Retirar o tubo do ímã. Adicionar meio de cultura de células T humanas (100 / ul médias 0,5 ul de microesferas inicialmente adicionada).
- Aliquota de 100 ul de suspensão de activador do grânulo para cada poço da placa de 96 poços. Incubar a placa de cultura a 37 ° C em 6% de CO 2 incubadora.
- Monitorar o crescimento celular diariamente pelo exame microscópico. Os pequenos agregados de células em proliferação podem ser observadas ao microscópio após 5-7 dias de cultura (Figura 3.A).
NOTA: A visualização das culturas de células T, neste ponto pode ser difícil, e a ausência de agrupamentos de células observáveis, nesta fase, pode não ser indicativa de uma falta de crescimento de células T. - Aos 14 dias após o isolamento das células, culturas para alimentação animal, removendo cuidadosamente 100 ul de meio para fora do topo da cultura e substitua com 100 μ; L fresco humano T meio de cultura celular. Continuar a incubação placa de cultura a 37 ° C em 6% de CO 2 incubadora.
- Monitorizar o crescimento celular por dia por exame microscópico e avaliação da cor do meio de cultura. Grandes grupos de células deve ser visível microscopicamente 2 - 3 dias após a mudança do meio. Macroscopicamente, pelotas de células deve tornar-se visível durante os 14 dias seguintes à mudança de meio.
- Aos 28 dias após o isolamento de células, identificar clones que crescem através de exame microscópico. Transferir o volume de 200 ul das crescimento positivo de 96 poços da placa de culturas para poços individuais de uma placa de 48 poços de cultura de tecidos contendo 200 ul de meio de cultura de célula T humana.
- Adicionar 100 ul contendo 12,5 ul de microesferas anti-CD3 / anti-CD28 estimuladores (preparada tal como descrito nas secções 5,2-5,6). Incubar a placa de cultura a 37 ° C em 6% de CO 2 incubadora.
- Monitorar o crescimento cultura diariamente por ex microscópicaaminação e avaliação da cor do meio de cultura. Quando a cultura de células T atinge> 2x10 6 / ml (tipicamente 3-5 dias após re-estimulação, pode ser estimado pelo dia em que os meios de comunicação começa a transformá amarelo-palha), cultura da transferência para um poço de uma placa de cultura de tecido de 24 poços e adicionar 500 mL meio humana de células T.
- No dia 14/10 siga re-estimulação, coletar 200 mL de cultura de células T para avaliar aloantígeno especificidade análise por citometria de fluxo de pMHC tetramer ligação (utilizando a estratégia de rotulagem e gating descrito nas secções 3 e 4.1).
6. longo prazo Re-estimulação e Cultura de clones de células T
- Continuamente re-estimular e expandir culturas clonais de células T com a especificidade desejada podem ser a cada 14 dias. Recolhe culturas de células T para um tubo de 5 ml estéril no dia 14 após a última anti-CD3 / CD28 estimulação micropérola. Combinação de várias cavidades do mesmo clone de células T num único tubo, até um volume de 2,5 ml.
- Adicionar meio para levar o volume final para 2,5 ml e misturar suavemente por pipetagem.
- Colocar o tubo de 5 ml contendo a cultura de células T para o íman de separação de células para remover velhos microesferas a partir da cultura. A tampa deve ser solta em cima do tubo. Incubar durante 5 min à temperatura ambiente.
- Com cuidado, retire a tampa do tubo. Segurando o tubo e em conjunto íman, decanta-se a suspensão de células para um novo tubo de 5 ml. Não bata nem sacuda o conteúdo do tubo para remover as últimas gotas de líquido.
- Adicionar meio para levar o volume final a 4 ml. Amostra de 10 mL para contagem de células usando um hemocitômetro.
- Recuperar as células T através de centrifugação a 600 xg durante 5 min à temperatura ambiente.
- Decantar o sobrenadante. As células em 10 6 células / ml T humanas meio de cultura de células T Ressuspender. Transferir 1 ml de partes alíquotas para cada poço de uma placa de cultura de tecidos de 24 cavidades.
- Re-estimular as células T através da adição de 100 ul contendo meios de 12,5 ul de estimulador anti-CD3 / amicrobeads nti-CD28 (conforme descrito nas seções 5,2-5,6). Incubar a 37 ° C em 6% de CO 2 incubadora.
Resultados
Este protocolo descreve a geração de culturas de células T humanas clonal com aloantigénio especificidade definida por meio de um cordão de enriquecimento magnética e fluxo de uma única célula citometria de triagem estratégia. A Figura 1 apresenta um esboço do processo.
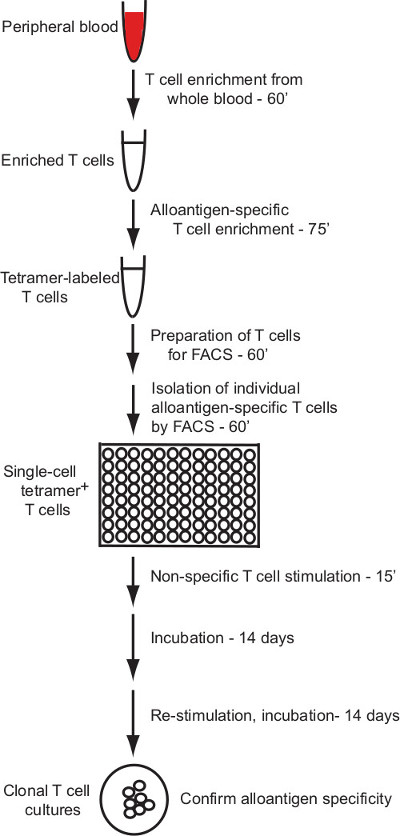
Figura 1: Vista geral Protocolo O protocolo aqui descrito prop...
Discussão
T cell alloreactivity is a long-studied and clinically-relevant phenomenon. The robust proliferative and effector responses of T cells to allogeneic stimulation has enabled extensive analyses of human T cell responses in vitro through relatively straightforward mixed lymphocyte reactions of peripheral blood T cells against inactivated allogeneic cells. However, these primary alloreactive T cell responses are oligoclonal, comprised of a large number of individual T cells responding to specific alloantigens. This ...
Divulgações
The authors declare no competing financial interests.
Agradecimentos
The author would like to thank the NIH Tetramer Core Facility for tetramer production. The author would also like to thank E.D. O’Connor and K.E. Marquez at the UCSD Human Embryonic Stem Cell Core Facility flow cytometry laboratory for assistance in cell sorting. This work was funded by National Institutes of Health grant K08AI085039 (G.P.M.).
Materiais
| Name | Company | Catalog Number | Comments |
| Sodium heparin venous blood collection tube 16 x 100 mm | Becton, Dickenson and Company | 366480 | |
| Lymphoprep | Stemcell Technologies | 7801 | |
| Rosette Sep Human T Cell Enrichment Kit | Stemcell Technologies | 15061 | |
| Dulbecco's PBS, 1x without Ca or Mg | Corning | 21-031-CV | |
| Bovine serum albumin | Sigma-Aldrich | A7906 | |
| EDTA | Sigma-Aldrich | E6635 | |
| Fluorophore-labeled pMHC tetramer | NIH Tetramer Facility | NA | |
| EasySep Biotin Selection Kit | Stemcell Technologies | 18553 | |
| EasySep Selection magnet | Stemcell Technologies | 18000 | |
| TruStain FcX Human Fc blocking solution | Biolegend | 422301 | |
| Anti-CD5 PE-Cy7 (clone UCHT2) | Biolegend | 300621 | |
| Anti-CD14 FITC (clone HCD14) | Biolegend | 325603 | |
| Anti-CD19 FITC (clone HIB19) | Biolegend | 302205 | |
| Iscove's DMEM, without b-ME or L-glutamine | Corning | 15-016-CV | |
| HEPES | Corning | 25-060-CI | |
| b-Mercaptoethanol | Life Technologies | 21985-023 | |
| Glutamax | Life Technologies | 35050061 | |
| Gentamicin sulfate (50 mg/ml) | Omega Scientific | GT-50 | |
| Human AB serum, male donor | Omega Scientific | HS-30 | |
| Recombinant human IL-2 | Peprotech | AF 200-02 | |
| Dynabeads Human T-Activator CD3/CD28 | Life Technologies | 11131D | |
| Media | |||
| Cell sorting buffer | |||
| PBS, pH 7.4 | 1 L | ||
| BSA | 10 g | ||
| EDTA (0.5 M) | 2 ml | ||
| Human T Cell Culture Medium | |||
| Iscove's DMEM | 351.6 ml | ||
| Heat-inactivated human AB serum | 40 ml | ||
| HEPES (1 M) | 4 ml | ||
| Glutamax (100x) | 4 ml | ||
| Gentamicin (50 mg/ml) | 0.4 ml | ||
| b-mercaptoethanol (14.3 M) | 1.4 ml | ||
| Recombinant human IL-2 (1 mg/ml) | 1 ml |
Referências
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S. T cell activation. Annu. Rev. Immunol. 27 (1), 591-619 (2009).
- Morris, G. P., Allen, P. M. How the TCR balances sensitivity and specificity for the recognition of self and pathogens. Nat. Immunol. 13 (2), 121-128 (2012).
- Arstilla, T. P., et al. A direct estimation of the human αβ T cell receptor diversity. Science. 286 (5441), 958-961 (1999).
- Robbins, H. S., et al. Comprehensive assessment of T-cell receptor β-chain diversity in αβ T cells. Blood. 114 (19), 4099-4107 (2009).
- Alanio, C., Lemaitre, F., Law, H. K. W., Hasan, M., Albert, M. L. Enumeration of human antigen-specific naive CD8+ T cells reveals conserved precursor frequencies. Blood. 115 (18), 3718-3725 (2010).
- Suchin, E. J., et al. Quantifying the frequency of alloreactive T cells in vivo: new answers to an old question. J. Immunol. 166 (2), 973-981 (2001).
- Felix, N. J., Allen, P. M. Specificity of T-cell alloreactivity. Nat. Rev. Immunol. 7 (12), 942-953 (2007).
- Morris, G. P., Ni, P. P., Allen, P. M. Alloreactivity is limited by the endogenous peptide repertoire. Proc. Natl. Acad. Sci. USA. 108 (9), 3695-3700 (2011).
- Suri, A., et al. In APCs, the autologous peptides selected by the diabetogenic I-Ag7 molecule are unique and determined by the amino acid changes in the P9 pocket. J. Immunol. 168 (3), 1235-1243 (2002).
- Yssl, H., Spits, H. Generation and maintenance of cloned human T cell lines. Curr. Protoc. Immunol. 7, (2002).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Moon, J. J., et al. Naive CD4+ T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity. 27 (2), 203-213 (2007).
- Chicz, R. M., et al. Specificity and promiscuity among naturally processed peptides bound to HLA-DR alleles. J. Exp. Med. 178 (1), 27-47 (1993).
- Ni, P. P., Allen, P. M., Morris, G. P. The ability to rearrange dual TCRs enhances positive selection, leading to increased allo- and autoreactive T cell repertoires. J. Immunol. In press, (2014).
- Morris, G. P., Uy, G. L., Donermeyer, D., DiPersio, J. F., Allen, P. M. Dual receptor T cells mediate pathologic alloreactivity in patients with acute graft-versus-host disease. Sci. Transl. Med. 5 (188), (2013).
- Altman, J. D., Reay, P. A., Davis, M. M. Formation of functional peptide complexes of class II major histocompatibility complex proteins from subunits produced in Escherichia coli. Proc. Natl. Acad. Sci. USA. 90 (21), 10330-10334 (1993).
- Sabatino, J. J., Huang, J., Zhu, C., Evavold, B. D. High prevalence of low affinity peptide-MHC II tetramer-negative effectors during polyclonal CD4+ T cell responses. J. Exp. Med. 208 (1), 81-90 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados