È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Generazione di Human alloantigene-specifiche cellule T da sangue periferico
In questo articolo
Riepilogo
This article describes a method for the generation and propagation of human T cell clones that specifically respond to a defined alloantigen. This protocol can be adapted for cloning human T cells specific for a variety of peptide-MHC ligands.
Abstract
The study of human T lymphocyte biology often involves examination of responses to activating ligands. T cells recognize and respond to processed peptide antigens presented by MHC (human ortholog HLA) molecules through the T cell receptor (TCR) in a highly sensitive and specific manner. While the primary function of T cells is to mediate protective immune responses to foreign antigens presented by self-MHC, T cells respond robustly to antigenic differences in allogeneic tissues. T cell responses to alloantigens can be described as either direct or indirect alloreactivity. In alloreactivity, the T cell responds through highly specific recognition of both the presented peptide and the MHC molecule. The robust oligoclonal response of T cells to allogeneic stimulation reflects the large number of potentially stimulatory alloantigens present in allogeneic tissues. While the breadth of alloreactive T cell responses is an important factor in initiating and mediating the pathology associated with biologically-relevant alloreactive responses such as graft versus host disease and allograft rejection, it can preclude analysis of T cell responses to allogeneic ligands. To this end, this protocol describes a method for generating alloreactive T cells from naive human peripheral blood leukocytes (PBL) that respond to known peptide-MHC (pMHC) alloantigens. The protocol applies pMHC multimer labeling, magnetic bead enrichment and flow cytometry to single cell in vitro culture methods for the generation of alloantigen-specific T cell clones. This enables studies of the biochemistry and function of T cells responding to allogeneic stimulation.
Introduzione
I linfociti T sono componenti critici del sistema immunitario adattativo. Le cellule T sono responsabili non solo mediare direttamente risposte immunitarie protettive a patogeni attraverso una varietà di meccanismi effettori, ma anche mantenere attivamente immunologica auto-tolleranza e dirigere le risposte di altre cellule del sistema immunitario. Queste funzioni sono diretti attraverso una serie di segnali integrati, compreso recettore delle cellule T (TCR) legatura, citochine e chemochine, e metaboliti 1. Di questi segnali, il TCR è di particolare importanza, in quanto fornisce la specificità caratteristica che definisce il ruolo delle cellule T nell'immunità adattativa. Un TCR interagisce con antigeni peptidici lineari presentati da MHC (HLA ortologo umano) molecole (complessi pMHC) in modo altamente specifico e sensibile per fornire i segnali che attivano la funzione delle cellule T effettrici. I parametri biochimici delle interazioni TCR con leganti pMHC non solo forniscono la specificità per Tattivazione delle cellule, ma anche avere un impatto qualitativo sulla funzione delle cellule T 2 successiva. Così, studiando la funzione delle cellule T richiede spesso di esaminare le risposte delle cellule T clonali con specificità antigenica definito.
Il vano umano delle cellule T, che contiene circa 10 12 cellule T αβ, contiene, secondo le stime 10 luglio-10 agosto αβTCRs distinte 3-4. Questo vasto repertorio offre opportunità per il riconoscimento della vasta gamma di peptidi da potenziali agenti patogeni tali da richiedere una risposta delle cellule T per l'immunità protettiva. Si stima che la frequenza delle cellule T rispondere ad un dato antigene estraneo presentata dalla auto-MHC è dell'ordine di 10 -4 - 10 -7 in assenza di prima risposta immunitaria a questo antigene 5. L'ingenuo repertorio delle cellule T è modellato dalla selezione timica per garantire la capacità di riconoscere auto-MHC presentano antigeni peptidici e limite reagisconoivity contro antigeni self-peptide, massimizzando l'utilità potenziale di mediare l'immunità protettiva 2. Tuttavia, in violazione del presente progettato reattività relativamente grande frequenza, 10 -3 - 10 -4, di cellule T da individui immunologicamente naive rispondere alla stimolazione con cellule allogeniche, riconoscendo entrambe le molecole MHC estere nonché peptidi endogeni che presentano 6. Il riconoscimento di allogenici ligandi pMHC è strutturalmente simile al riconoscimento di antigeni estranei presentate da auto-MHC; TCR rende interazioni biochimiche critici sia con la molecola MHC allogeniche e il peptide presentato 7. La natura robusta della risposta delle cellule T allogeniche ai risultati della stimolazione della diversità dei pMHC complessi presenti sulla superficie delle cellule allogeniche 8. Si stima che ogni MHC presenta circa 2 x 10 4 differenti antigeni peptidici endogeni 9. Questo breadth di risposta alla stimolazione allogenico è un aspetto significativo della patologia clinicamente rilevanti, come il rigetto o di malattia da trapianto contro ospite (GVHD), derivanti da alloreattività cellule T.
Studio delle cellule T risposte alloreattivi umani ha tradizionalmente invocato l'esame delle risposte policlonali di cellule T naive in seguito alla stimolazione con cellule allogeniche. Stimolazione ripetuta con la stessa linea di cellule allogeniche combinato con diluizione limite analisi è in grado di generare cellule T clonali con riconoscimento definito di allogenico HLA 10. Tuttavia, questo approccio è problematico per l'esame delle risposte ai singoli ligandi allogenici pMHC, come il grande e variegato repertorio di endogena pMHC complessi presenti per un determinato allogenico HLA stimola un ampio repertorio di cellule T. Questa stimolazione popolazione di massa e di limitare la diluizione approccio richiederebbe lo screening di un gran numero di cloni per isolare le cellule T con il riatti desideratovità contro un singolo ligando pMHC. Inoltre, la frequenza delle cellule T che rispondono ad un individuo allogenico pMHC ligando è relativamente bassa tra popolazioni di cellule T naive, che presenta una barriera efficace generazione di cloni di cellule T umane sensibili ad un dato antigene.
Identificazione e isolamento di cellule T antigene-specifiche da popolazioni policlonali sono stati abilitati dallo sviluppo di fluoroforo marcata pMHC multimeri 11. Questo approccio utilizza specifici antigeni peptidici caricati in molecole MHC ricombinanti solubili biotinilate, etichettati legandosi ad un fluoroforo streptavidina marcata. Multimerizzazione di pMHC aumenta l'avidità, compensando la intrinsecamente basso (mM) affinità del TCR per ligandi solubili pMHC. Cellule marcate possono essere identificati e isolati mediante citometria a flusso. Tuttavia, questo approccio è ancora limitata dalla bassa frequenza di cellule T antigene-specifiche tra naive popolazioni di cellule T, che sono tipicamenteordini di grandezza inferiore al limite di identificazione accurata e quantificazione sulla maggior citofluorimetri. Per affrontare questa limitazione, un metodo di etichettatura tetramero pMHC e successiva tallone arricchimento magnetico per cellule tetramero-marcato è stato sviluppato 12. Questo metodo ha dimostrato rilevamento affidabile, l'enumerazione, e l'isolamento di cellule T antigene-specifiche bassa frequenza.
Questo protocollo descrive un protocollo efficace per la generazione di cloni di cellule T umane che rispondono specificamente ai singoli ligandi allogenici pMHC. Il protocollo si applica pMHC (HLA) etichettatura Multimer e di arricchimento per l'isolamento di cellule T umane specifiche per alloantigene con citometria a flusso delle cellule di ordinamento e un metodo robusto per la coltura in vitro di cellule T umane per consentire la produzione di cloni di cellule T da cellule ordinati singole ( panoramica nella Figura 1).
Protocollo
NOTA: Questo protocollo richiede l'utilizzo di campioni di sangue periferico di volontari umani. Tutta la ricerca con soggetti umani deve essere esaminato e approvato da un studi sull'uomo Institutional Review Board per garantire la conformità con la Dichiarazione di Helsinki (2013) e l'Health Insurance Portability e Accountability Act del 1996.
1. Isolamento dei linfociti T da sangue intero
- Prima di iniziare, riscaldare il mezzo gradiente di densità a temperatura ambiente. Aliquota 4 ml di terreno gradiente di densità in 2-4 sterili da 15 ml provette coniche (1 tubo verrà utilizzato per ogni 10 ml di volume totale di sangue diluito).
- Ottenere 10-20 ml di sangue in 1-2 sodio eparina a spruzzo con rivestimento (verde-top) provette di raccolta del sangue venoso. Raccogliere campioni umani sotto la supervisione di persone addestrate e secondo un Institutional Review Board ha approvato il protocollo.
- Pulire la parte esterna dei tubi con il 70% di etanolo. Rimuovere con attenzione le cime della firiempito provette per il prelievo e decantare il sangue in una sterile 50 ml provetta da centrifuga.
- Aggiungere 10 ml sterile tampone fosfato salino (PBS) per ogni tubo di raccolta del sangue. Raccogliere il PBS, aggiungere al sangue intero decantato, e mescolare delicatamente.
- Aggiungere 25 microlitri T umano di arricchimento cellulare Cocktail / 2 ml di volume totale. Incubare a temperatura ambiente per 20 min.
- Usando una pipetta 10 ml, sovrapporre fino a 10 ml di 1: 1 sangue diluito delicatamente sulla sommità del mezzo gradiente di densità. Fare attenzione a non disturbare la superficie del terreno gradiente di densità.
- Centrifugare il sangue strati e media densità gradiente a 1.200 xg per 20 min a 20 ° C.
- Rimuovere le provette dalla centrifuga, avendo cura di non interrompere l'interfaccia tra il mezzo gradiente di densità e lo strato di leucociti all'interfaccia tra il mezzo gradiente di densità e il plasma diluito. Usando una pipetta da 5 ml, raccogliere con cura lo strato di leucociti e trasferimento in una nuova sterile 50 ml vasca conicae.
- Aggiungere PBS per portare il volume della raccolta PBL a 50 ml e mescolare delicatamente.
- Centrifugare a 600 xg per 5 min a 20 ° C. Decantare.
- Risospendere le cellule in pellet in 10 ml sterile flusso citometria ordinamento tampone (sterile filtrata PBS contenente 1% BSA). Esempio 10 ml di sospensione cellulare, diluire 1:10 (aggiungere a 90 ml) trypan blu per contare le cellule utilizzando un emocitometro (rendimento atteso 1 - 4 x 10 6 cellule / tubo di sangue intero).
- Rimuovere 1 ml un'aliquota, trasferire 5 ml di tubo, e tenere in ghiaccio per l'analisi delle cellule T non etichettati da tetramero. Tenere sospensione cellulare su ghiaccio.
2. magnetico arricchimento di cellule T alloantigene-specifici
- Diluire alloantigene pMHC tetramero a 1: 100 in tampone tipo sterile.
- Sospensione cellulare Centrifuga (9 ml dal punto 1.11) a 600 xg per 5 min a 20 ° C. Decantare.
- Aggiungere 50 ml di diluito alloantigene pMHC tetramero a pelletcellule (fino a 10 7 cellule). Mescolare delicatamente pipettaggio. Trasferimento in una provetta sterile da 5 ml. Incubare per 30 minuti a temperatura ambiente.
- Aggiungere 2 ml di tampone di sorta. Centrifugare a 600 xg per 5 min a 20 ° C. Decantare.
- Risospendere le cellule in 100 microlitri di buffer sorta. Aggiungere 10 ml biotina selezione di cocktail e incubare per 15 minuti a temperatura ambiente.
- Aggiungere 5 ml Nanoparticelle magnetiche e incubare per 10 minuti a temperatura ambiente.
- Aggiungere 2,5 ml sorta tampone e mescolare delicatamente con una pipetta. Togliere 100 ml un'aliquota, trasferimento in 5 ml di tubo, e tenere in ghiaccio per l'analisi di cellule pre-arricchimento.
- Posizionare il tubo 5 ml, contenente la sospensione cellulare nel magnete separazione cellulare. Il tappo deve essere vagamente in cima al tubo. Incubare per 5 minuti a temperatura ambiente.
- Rimuovere delicatamente il tappo dal tubo. Mantenendo il tubetto e magnete insieme, decantare il contenuto del tubo in una nuova provetta 5 ml. Non urtare o scuotere il contenuto della provetta perrimuovere le ultime gocce di liquido.
- Togliere la provetta dal magnete. Aggiungere 2 ml di tampone di tipo freddo e mescolare delicatamente con una pipetta. Esempio 10 ml di sospensione cellulare, diluire 1: 2 (aggiungere a 10 ml) trypan blu per contare le cellule utilizzando un emocitometro.
3. Preparazione delle cellule T per la singola cella di Citometria a Flusso Ordinamento cellulare
- Aggiungi buffer di tipo fredda a tutte le provette di cellule tetramero (senza etichetta, tetramero marcato non-arricchito, e tetramero marcati arricchito) per portare il volume a 3 ml.
- Centrifugare a 600 xg per 5 minuti a 4 ° C e tampone decantare per recuperare le cellule.
- Risospendere le cellule pellet in 25 microlitri di buffer tipo freddo. Aggiungere 5 ml di blocco Fc umana. Incubare in ghiaccio per 20 min.
- Preparare anticorpi per citometria a flusso ordinamento. Mescolare 15 ml di buffer sorta, 15 microlitri anti-CD5, 15 microlitri anti-CD14, e 15 microlitri anti-CD19.
- Aggiungere 20 ml di miscela di anticorpi a ciascuna provetta di cellule. Incubare in ghiaccio per 20 min.
- Aggiungere 2 ml di tampone di tipo freddo ad ogni provetta.
- Centrifugare a 600 xg per 5 minuti a 4 ° C e tampone decantare per recuperare le cellule.
- Risospendere le cellule ad una concentrazione di 1 -2 x 10 6 cellule / ml in tampone di ordinamento.
- Un'aliquota di 100 ml di terreno di coltura delle cellule T umane (DMEM di Iscove integrati con 2 Glutamax mM, HEPES 10 mM, 50 mg / ml di gentamicina, 50 mM 2-mercaptoetanolo, siero umano AB 10% inattivato al calore, e 2,5 ng / ml umana ricombinante IL-2) a ciascun pozzetto di una piastra di coltura cellulare a fondo rotondo da 96 pozzetti. Tenere su ghiaccio.
4. L'isolamento di cellule T tetramero marcato da Single-cell Citometria a flusso Ordinamento
- Stabilire citometria a flusso parametri di gating per identificare etichettati cellule T alloantigene-pMHC tetramero (Figura 2.a). Utilizzare la frazione tetramero di pre-arricchimento etichettati per stabilire gating strategie per eliminare doppietti, porta sui linfociti, cellule che esprimono CD19 escludere B e CD14esprimendo monociti, e identificare le cellule T dall'espressione CD5. Utilizzare il campione non etichettati con tetramero come una fluorescenza meno un controllo per stabilire il gating per l'identificazione di cellule tetramero legame T (con lo 0% di CD5 + CD14 - CD19 - le cellule del campione non etichettati da tetramero dovrebbero rientrare nell'ambito di questa porta) .
NOTA: Soppressione strategie che non sono sufficientemente stringenti comporterà isolamento di cellule non-T o cellule T non antigene specifico, mentre le strategie di gating eccessivamente restrittive riducono il numero di cellule T isolate. - Programmare i parametri di targa del singolo tipo cellulare. Dirigere il sorter di inserire 1 CD5 + CD14 - CD19 - tetramero + cellule in ciascun pozzetto. Dirigere il piatto creato per contenere 1 controllo negativo (assenza di cellule ordinate nel pozzo) e 1 controllo positivo (100 CD5 + CD14 - CD19 - tetramero - cellule) in ogni riga (Figura 2.B ).
- Utilizzando il flusso stabilito citometria strategia di gating e messa a punto piatto, isolare singole cellule tetramero vincolante T direttamente nella piastra a 96 pozzetti con un cell sorter citometria a flusso.
5. Cultura ed espansione di alloantigene-specifici cloni di cellule T
- Dopo il completamento della separazione delle cellule, piastra centrifugare a 600 xg per 5 min a 20 ° C. Luogo piastra di coltura a 37 ° C in un incubatore CO 2 al 6%.
- Vortex stimolatori microsfere anti-CD3 / anti-CD28-per 30 secondi per risospendere le sfere.
- Calcolare il volume di perline attivatore necessari per la stimolazione delle cellule T raccolti (0,5 ml di attivatore microsfere / pozzetto). Trasferire volume calcolato di perline stimolatore di una provetta sterile da 5 ml. Aggiungere 1 ml di cellule T umane terreno di coltura e vortice.
- Posizionare il tubo con sospensioni microbead magnete. Il tappo deve essere vagamente in cima al tubo. Incubare per 2 minuti a temperatura ambiente.
- Rimuovere delicatamenteil tappo dal tubo. Tenendo il tubo e magnete insieme, contenuto della provetta decantare in una nuova provetta da 5 ml. Non urtare o scuotere il contenuto della provetta.
- Togliere la provetta dal magnete. Aggiungere mezzo di coltura delle cellule T umane (100 microlitri medio / 0,5 ml di microsfere inizialmente aggiunto).
- Aliquotare 100 microlitri di sospensione attivatore tallone a ciascun pozzetto della piastra a 96 pozzetti. Incubare piastra di coltura a 37 ° C in un incubatore CO 2 al 6%.
- Monitorare la crescita cellulare tutti i giorni con l'esame microscopico. I piccoli gruppi di cellule proliferanti possono essere osservati al microscopio dopo 5 - 7 giorni di coltura (Figura 3.a).
NOTA: visualizzazione di colture cellulari T a questo punto può essere difficile, e l'assenza di gruppi di cellule osservabili in questa fase può non essere indicativo di una mancanza di cellule T in crescita. - A 14 giorni dopo l'isolamento delle cellule, le culture di alimentazione rimuovendo con cura 100 ml di mezzi fuori della parte superiore della cultura e sostituirli con 100 μ; L fresca umano T terreno di coltura cellulare. Continuare l'incubazione piastra di coltura a 37 ° C in un incubatore CO 2 al 6%.
- Monitorare la crescita cellulare giornalmente mediante controllo e valutazione del colore del mezzo di coltura microscopica. I grandi gruppi di cellule dovrebbero essere visibili microscopicamente 2 - 3 giorni dopo il cambio medio. Macroscopicamente, pellet cellulari dovrebbero diventare visibili durante i 14 giorni successivi al cambio medio.
- A 28 giorni dopo l'isolamento delle cellule, individuare i cloni che crescono con l'esame microscopico. Trasferire il volume di 200 microlitri della piastra a 96 pozzetti culture crescita positivi a singoli pozzetti di una piastra di coltura tissutale a 48 pozzetti contenente 200 microlitri terreno di coltura delle cellule T umane.
- Aggiungere 100 ml contengono 12,5 ml di microsfere di stimolo anti-CD3 / anti-CD28 (preparato come descritto nelle sezioni 5,2-5,6). Incubare piastra di coltura a 37 ° C in un incubatore CO 2 al 6%.
- Monitorare la crescita della cultura ogni giorno da microscopici examminazione e valutazione del colore del mezzo di coltura. Quando la cultura delle cellule T raggiunge> 2x10 6 / ml (in genere 3-5 giorni dopo la ri-stimolazione, può essere stimato dal giorno in cui i media inizia a trasformare giallo paglierino), la cultura trasferimento ad un pozzetto di una piastra di coltura da 24 pozzetti tessuto e aggiungere 500 media delle cellule T umane ml.
- A 10-14 giorni seguito ri-stimolazione, raccogliere 200 ml di coltura di cellule T per valutare la specificità alloantigene citometria a flusso di pMHC tetramero vincolante (utilizzando la strategia di etichettatura e gating descritto nelle sezioni 3 e 4.1).
6. a lungo termine Re-stimolazione e la cultura di cloni di cellule T
- Continuamente ri-stimolare ed espandere colture di cellule T clonali con la specificità desiderata può essere ogni 14 giorni. Raccogliere colture di cellule T in una provetta sterile da 5 ml al giorno 14 dopo l'ultima stimolazione microbead anti-CD3 / CD28. Combinare pozzi multipli dello stesso clone di cellule T in un unico tubo, fino ad un volume di 2,5 ml.
- Aggiungere mezzo per portare il volume finale di 2,5 ml e mescolare delicatamente con una pipetta.
- Posizionare il tubo 5 ml contenente la coltura di cellule T nel magnete separazione cellulare per rimuovere le microsfere dalla cultura. Il tappo deve essere vagamente in cima al tubo. Incubare per 5 minuti a temperatura ambiente.
- Rimuovere delicatamente il tappo dal tubo. Mantenendo il tubetto e magnete insieme, decantare la sospensione cellulare in una nuova provetta 5 ml. Non urtare o scuotere il contenuto della provetta per rimuovere le ultime gocce di liquido.
- Aggiungere mezzo per portare il volume finale a 4 ml. Campione di 10 microlitri per contare le cellule utilizzando un emocitometro.
- Recupero cellule T mediante centrifugazione a 600 xg per 5 minuti a temperatura ambiente.
- Decantare il surnatante. Risospendere le cellule T a 10 6 cellule / ml T umano mezzo di coltura cellulare. Trasferire 1 ml aliquote a ciascun pozzetto di una piastra di coltura tissutale a 24 pozzetti.
- Re-stimolare le cellule T con l'aggiunta di 100 microlitri supporti contenenti 12,5 ml di stimolazione anti-CD3 / amicrosfere NTI-CD28 (come descritto nelle sezioni 5,2-5,6). Incubare a 37 ° C in un incubatore CO 2 al 6%.
Risultati
Questo protocollo descrive la generazione di colture di cellule T clonale umani con definito alloantigene specificità attraverso un arricchimento tallone magnetico e flusso a cella singola citometria di ordinamento strategia. La Figura 1 fornisce una panoramica del processo.
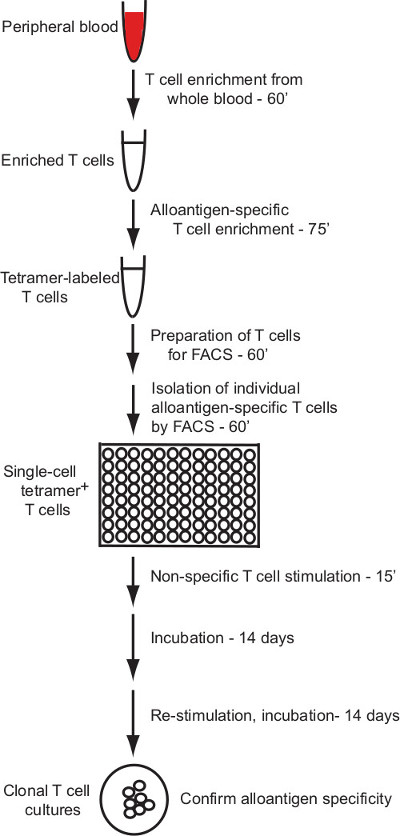
Figura 1: Panoramica del protocollo Il protocollo qui descritto forn...
Discussione
T cell alloreactivity is a long-studied and clinically-relevant phenomenon. The robust proliferative and effector responses of T cells to allogeneic stimulation has enabled extensive analyses of human T cell responses in vitro through relatively straightforward mixed lymphocyte reactions of peripheral blood T cells against inactivated allogeneic cells. However, these primary alloreactive T cell responses are oligoclonal, comprised of a large number of individual T cells responding to specific alloantigens. This ...
Divulgazioni
The authors declare no competing financial interests.
Riconoscimenti
The author would like to thank the NIH Tetramer Core Facility for tetramer production. The author would also like to thank E.D. O’Connor and K.E. Marquez at the UCSD Human Embryonic Stem Cell Core Facility flow cytometry laboratory for assistance in cell sorting. This work was funded by National Institutes of Health grant K08AI085039 (G.P.M.).
Materiali
| Name | Company | Catalog Number | Comments |
| Sodium heparin venous blood collection tube 16 x 100 mm | Becton, Dickenson and Company | 366480 | |
| Lymphoprep | Stemcell Technologies | 7801 | |
| Rosette Sep Human T Cell Enrichment Kit | Stemcell Technologies | 15061 | |
| Dulbecco's PBS, 1x without Ca or Mg | Corning | 21-031-CV | |
| Bovine serum albumin | Sigma-Aldrich | A7906 | |
| EDTA | Sigma-Aldrich | E6635 | |
| Fluorophore-labeled pMHC tetramer | NIH Tetramer Facility | NA | |
| EasySep Biotin Selection Kit | Stemcell Technologies | 18553 | |
| EasySep Selection magnet | Stemcell Technologies | 18000 | |
| TruStain FcX Human Fc blocking solution | Biolegend | 422301 | |
| Anti-CD5 PE-Cy7 (clone UCHT2) | Biolegend | 300621 | |
| Anti-CD14 FITC (clone HCD14) | Biolegend | 325603 | |
| Anti-CD19 FITC (clone HIB19) | Biolegend | 302205 | |
| Iscove's DMEM, without b-ME or L-glutamine | Corning | 15-016-CV | |
| HEPES | Corning | 25-060-CI | |
| b-Mercaptoethanol | Life Technologies | 21985-023 | |
| Glutamax | Life Technologies | 35050061 | |
| Gentamicin sulfate (50 mg/ml) | Omega Scientific | GT-50 | |
| Human AB serum, male donor | Omega Scientific | HS-30 | |
| Recombinant human IL-2 | Peprotech | AF 200-02 | |
| Dynabeads Human T-Activator CD3/CD28 | Life Technologies | 11131D | |
| Media | |||
| Cell sorting buffer | |||
| PBS, pH 7.4 | 1 L | ||
| BSA | 10 g | ||
| EDTA (0.5 M) | 2 ml | ||
| Human T Cell Culture Medium | |||
| Iscove's DMEM | 351.6 ml | ||
| Heat-inactivated human AB serum | 40 ml | ||
| HEPES (1 M) | 4 ml | ||
| Glutamax (100x) | 4 ml | ||
| Gentamicin (50 mg/ml) | 0.4 ml | ||
| b-mercaptoethanol (14.3 M) | 1.4 ml | ||
| Recombinant human IL-2 (1 mg/ml) | 1 ml |
Riferimenti
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S. T cell activation. Annu. Rev. Immunol. 27 (1), 591-619 (2009).
- Morris, G. P., Allen, P. M. How the TCR balances sensitivity and specificity for the recognition of self and pathogens. Nat. Immunol. 13 (2), 121-128 (2012).
- Arstilla, T. P., et al. A direct estimation of the human αβ T cell receptor diversity. Science. 286 (5441), 958-961 (1999).
- Robbins, H. S., et al. Comprehensive assessment of T-cell receptor β-chain diversity in αβ T cells. Blood. 114 (19), 4099-4107 (2009).
- Alanio, C., Lemaitre, F., Law, H. K. W., Hasan, M., Albert, M. L. Enumeration of human antigen-specific naive CD8+ T cells reveals conserved precursor frequencies. Blood. 115 (18), 3718-3725 (2010).
- Suchin, E. J., et al. Quantifying the frequency of alloreactive T cells in vivo: new answers to an old question. J. Immunol. 166 (2), 973-981 (2001).
- Felix, N. J., Allen, P. M. Specificity of T-cell alloreactivity. Nat. Rev. Immunol. 7 (12), 942-953 (2007).
- Morris, G. P., Ni, P. P., Allen, P. M. Alloreactivity is limited by the endogenous peptide repertoire. Proc. Natl. Acad. Sci. USA. 108 (9), 3695-3700 (2011).
- Suri, A., et al. In APCs, the autologous peptides selected by the diabetogenic I-Ag7 molecule are unique and determined by the amino acid changes in the P9 pocket. J. Immunol. 168 (3), 1235-1243 (2002).
- Yssl, H., Spits, H. Generation and maintenance of cloned human T cell lines. Curr. Protoc. Immunol. 7, (2002).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Moon, J. J., et al. Naive CD4+ T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity. 27 (2), 203-213 (2007).
- Chicz, R. M., et al. Specificity and promiscuity among naturally processed peptides bound to HLA-DR alleles. J. Exp. Med. 178 (1), 27-47 (1993).
- Ni, P. P., Allen, P. M., Morris, G. P. The ability to rearrange dual TCRs enhances positive selection, leading to increased allo- and autoreactive T cell repertoires. J. Immunol. In press, (2014).
- Morris, G. P., Uy, G. L., Donermeyer, D., DiPersio, J. F., Allen, P. M. Dual receptor T cells mediate pathologic alloreactivity in patients with acute graft-versus-host disease. Sci. Transl. Med. 5 (188), (2013).
- Altman, J. D., Reay, P. A., Davis, M. M. Formation of functional peptide complexes of class II major histocompatibility complex proteins from subunits produced in Escherichia coli. Proc. Natl. Acad. Sci. USA. 90 (21), 10330-10334 (1993).
- Sabatino, J. J., Huang, J., Zhu, C., Evavold, B. D. High prevalence of low affinity peptide-MHC II tetramer-negative effectors during polyclonal CD4+ T cell responses. J. Exp. Med. 208 (1), 81-90 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon