Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Generation of Human Alloantigen-spezifischen T-Zellen aus peripherem Blut
In diesem Artikel
Zusammenfassung
This article describes a method for the generation and propagation of human T cell clones that specifically respond to a defined alloantigen. This protocol can be adapted for cloning human T cells specific for a variety of peptide-MHC ligands.
Zusammenfassung
The study of human T lymphocyte biology often involves examination of responses to activating ligands. T cells recognize and respond to processed peptide antigens presented by MHC (human ortholog HLA) molecules through the T cell receptor (TCR) in a highly sensitive and specific manner. While the primary function of T cells is to mediate protective immune responses to foreign antigens presented by self-MHC, T cells respond robustly to antigenic differences in allogeneic tissues. T cell responses to alloantigens can be described as either direct or indirect alloreactivity. In alloreactivity, the T cell responds through highly specific recognition of both the presented peptide and the MHC molecule. The robust oligoclonal response of T cells to allogeneic stimulation reflects the large number of potentially stimulatory alloantigens present in allogeneic tissues. While the breadth of alloreactive T cell responses is an important factor in initiating and mediating the pathology associated with biologically-relevant alloreactive responses such as graft versus host disease and allograft rejection, it can preclude analysis of T cell responses to allogeneic ligands. To this end, this protocol describes a method for generating alloreactive T cells from naive human peripheral blood leukocytes (PBL) that respond to known peptide-MHC (pMHC) alloantigens. The protocol applies pMHC multimer labeling, magnetic bead enrichment and flow cytometry to single cell in vitro culture methods for the generation of alloantigen-specific T cell clones. This enables studies of the biochemistry and function of T cells responding to allogeneic stimulation.
Einleitung
T-Lymphozyten sind kritische Komponenten des adaptiven Immunsystems. T-Zellen sind nicht nur direkt Vermittlung schützende Immunantworten gegen Pathogene durch eine Vielzahl von Effektor-Mechanismen, sondern auch aktiv Aufrechterhalten immunologischen Selbsttoleranz und Lenken der Antworten von anderen Zellen des Immunsystems verantwortlich. Diese Funktionen werden durch eine Reihe von integrierten Signale, einschließlich T-Zell-Rezeptor (TCR), Ligation, Zytokine und Chemokine und Metaboliten 1 gerichtet. Dieser Signale ist von besonderer Bedeutung der TCR, da sie die charakteristische Besonderheit, die die Rolle der T-Zellen in der adaptiven Immunität definiert. Ein TCR wechselwirkt mit linearen Peptids durch MHC-Antigene (HLA menschliche Ortholog) Moleküle (pMHC-Komplexe) in eine hochspezifische und empfindliche Weise dargestellt, um die Signale, die T-Zell-Effektor-Funktion zu initiieren. Die biochemischen Parameter des TCR Wechselwirkungen mit pMHC Liganden bieten nicht nur die Spezifität für TZellaktivierung, sondern auch über eine qualitative Wirkung auf nachfolgende T-Zell-Funktion 2. So studieren T-Zell-Funktion erfordert häufig die Prüfung der Antworten der klonalen T-Zellen mit definierten Antigenspezifität.
Das menschliche T-Zell-Kompartiment, die ungefähr 10 12 αβ T-Zellen, enthält schätzungsweise 7. Oktober - 8. Oktober deutliche αβTCRs 3-4. Diese vielfältigen Repertoire bietet Gelegenheit für die Anerkennung der Vielzahl von Peptiden, die von potenziellen Krankheitserregern, die eine T-Zell-Antwort für eine schützende Immunität erfordern würden. Es wird geschätzt, daß die Frequenz von T-Zellen reagieren auf eine gegebene Fremdantigen durch Selbst MHC präsentiert wird, ist in der Größenordnung von 10 -4 - 10 -7 in der ohne vorherige Immunantwort auf dieses Antigen 5. Die naive T-Zell-Repertoire von Thymus Auswahl geformt, um die Fähigkeit zur Selbst-MHC-Antigene erkennen und präsentieren Peptide Grenze reagiert werdenduktivität gegen Selbstpeptidantigene, die Maximierung der potenziellen Nutzen für die Vermittlung eine schützende Immunität 2. Unter Verstoß gegen diese entwickelt Reaktivität, eine relativ große Frequenz, 10 -3 jedoch - 10 -4, der T-Zellen aus immunologisch naive Individuen reagieren auf die Stimulation mit allogenen Zellen, erkennen sowohl die fremden MHC-Moleküle sowie die endogene Peptide präsentieren sie 6. Die Erkennung von allogenen pMHC Liganden ist strukturell ähnlich der Erkennung von fremden Antigenen durch Selbst-MHC präsentiert; Die TCR macht kritischen biochemischen Wechselwirkungen sowohl mit dem allogenen MHC-Molekül als auch die Peptid 7 dargestellt. Die robuste Natur der Reaktion der T-Zellen allogene Stimulierung resultiert aus der Vielfalt der pMHC-Komplexen auf der Oberfläche einer allogenen Zellen 8 vorhanden. Es wird geschätzt, dass jedes MHC präsentiert etwa 2 x 10 4 unterschiedlichen endogenen Peptidantigene 9. Diese breadth der Antwort auf allogene Stimulation ist ein wesentlicher Aspekt der klinisch relevanten Pathologie, wie etwa Transplantatabstoßung oder Graft-versus-Host-Krankheit (GVHD), von T-Zell-Alloreaktivität resultieren.
Untersuchung der menschlichen T-Zellantworten alloreaktiven traditionell durch Prüfung polyklonalen Reaktionen von naiven T-Zellen nach Stimulation mit allogenen Zellen verlassen. Wiederholte Stimulierung mit dem gleichen allogenen Zelllinie zusammen mit Grenzverdünnungsanalyse ist in der Lage klonalen T-Zellen mit definierten Erkennung von allogenen HLA 10. Jedoch ist dieser Ansatz problematisch für die Prüfung Antworten auf individuelle allogenen pMHC-Liganden, da die großen und vielfältigen Repertoire von endogenen pMHC-Komplexe für eine gegebene allogenen HLA vorliegenden stimuliert ein breites Repertoire an T-Zellen. Diese Massenpopulation Stimulation und Grenzverdünnungs Ansatz Screening einer großen Anzahl von Klonen erforderlich T-Zellen mit der gewünschten Reacti isolierenvität gegen einen einzelnen pMHC Liganden. Zusätzlich ist die Häufigkeit von T-Zellen reagieren auf eine einzelne allogenen pMHC Ligand unter naive T-Zell-Populationen, die ein Hindernis für die effiziente Erzeugung von menschlichen T-Zell-Klone, die auf ein gegebenes Antigen präsentiert relativ gering.
Identifizierung und Isolierung von Antigen-spezifischen T-Zellen von polyklonalen Populationen wurden durch die Entwicklung von Fluorophor-markierten pMHC Multimere 11 aktiviert. Dieser Ansatz nutzt spezifische Peptidantigene in rekombinanten löslichen biotinylierten MHC-Moleküle, die durch Bindung an Streptavidin-markierten Fluorophor markiert werden geladen. Multimerisierung pMHC erhöht die Gier, Kompensieren des intrinsisch niedrigen (uM) Affinität der TCR für lösliche pMHC Liganden. Markierten Zellen identifiziert und mittels Durchflusszytometrie getrennt werden. Jedoch ist dieser Ansatz noch von der niedrigen Frequenz von Antigen-spezifischen T-Zellen unter naive T-Zell-Populationen, die in der Regel begrenztum Größenordnungen geringer als die Grenze der genaue Identifizierung und Quantifizierung der meisten Durchflusszytometer. Um diese Einschränkung zu beheben, wurde ein Verfahren zum pMHC Tetramer Kennzeichnung und anschließende magnetische Perle Bereicherung Tetramer-markierten Zellen wurden 12 entwickelt. Dieses Verfahren hat eine zuverlässige Erkennung, Zählung und Isolierung des Niederfrequenz-Antigen-spezifischen T-Zellen nachgewiesen.
Dieses Protokoll beschreibt ein wirksames Protokoll für die Herstellung von menschlichen T-Zell-Klone, die spezifisch auf einzelne allogenen pMHC-Liganden reagieren. Das Protokoll gilt pMHC (HLA) Multimer Kennzeichnung und Anreicherung für die Isolierung von Alloantigen-spezifischer menschlicher T-Zellen mit Durchflusszytometrie und Zellsortierung einem robusten Verfahren zur in vitro Kultur von humanen T-Zellen, die Produktion von T-Zell-Klonen, die aus Einzelzellen sortiert (Freigabe Übersicht in Figur 1).
Protokoll
HINWEIS: Dieses Protokoll erfordert die Verwendung von peripheren Blutproben von Probanden. Alle Forschung mit menschlichen Probanden sollten überprüft und durch eine Menschen Studies Institutional Review Board genehmigt, um die Einhaltung der Deklaration von Helsinki (2013) und dem Health Insurance Portability and Accountability Act von 1996 zu gewährleisten.
1. Isolierung von T-Zellen aus Vollblut
- Vor dem Start, warm das Dichtegradienten-Medium auf Raumtemperatur. Aliquot 4 ml Dichtegradienten-Medium in 2-4 sterile konische 15 ml-Zentrifugenröhrchen (1 Röhrchen pro 10 ml Gesamtvolumen verdünnt Blut verwendet werden).
- Erhalten 10-20 ml Blut in 1-2 Natrium-Heparin sprühbeschichteten (grün-top) venösen Blutröhrchen. Sammeln Humanproben unter der Aufsicht von ausgebildeten Personen und gemäß einem Institutional Review Board genehmigten Protokoll.
- Wischen Sie die Außenseite der Rohre mit 70% Ethanol. Die Spitzen des fi vorsichtig entfernengefüllt Sammelröhrchen und dekantiert die Blut in ein steriles 50 ml-Zentrifugenröhrchen.
- 10 ml sterile phosphatgepufferte Kochsalzlösung (PBS) zu jeder Blutsammelröhrchen. Sammeln Sie die PBS, fügen dem dekantiert Vollblut, und vorsichtig mischen.
- In 25 ul humanen T-Zell Enrichment Cocktail / 2 ml Gesamtvolumen. Inkubieren bei Raumtemperatur für 20 min.
- Verwendung einer 10 ml Pipette Schicht bis zu 10 ml der 1: 1 verdünnten Blut vorsichtig auf der Oberseite der Dichtegradienten-Medium. Achten Sie darauf, nicht die Oberfläche des Dichtegradientenmedium stören.
- Zentrifuge Schicht Blut und Dichtegradienten-Medium bei 1200 × g für 20 min bei 20 o C.
- Die Röhrchen aus der Zentrifuge, dabei die Schnittstelle zwischen dem Dichtegradienten-Medium und der Schicht aus Leukozyten an der Schnittstelle zwischen der Dichtegradienten-Medium und verdünnte Plasma nicht zu stören. Mit einem 5 ml Pipette vorsichtig sammeln die Leukozyten-Schicht und in ein neues steriles 50 ml konischen Wannee.
- In PBS, um das Volumen des gesammelten PBL auf 50 ml zu bringen und vorsichtig mischen.
- Zentrifuge bei 600 × g für 5 min bei 20 o C. Dekantieren.
- Resuspendieren pelletierten Zellen in 10 ml sterile Durchflusszytometrie Sortierpuffer (sterilfiltriert PBS, enthaltend 1% BSA). Probe 10 & mgr; l der Zellsuspension 1:10 verdünnen Trypanblau (90 ul addieren), um Zellen mit einer Zählkammer zählen (erwartete Ausbeute werden 1 - 4 x 10 6 Zellen / Röhrchen Vollblut).
- Entfernen 1 ml Aliquot, Transfer zum 5-ml-Tube und auf Eis zu halten für die Analyse von T-Zellen nicht durch Tetramer beschriftet. Halten Zellsuspension auf Eis.
2. Magnetische Anreicherung von Alloantigen-spezifischen T-Zellen
- Verdünnte Alloantigen pMHC Tetramer bis 1: 100 in sterilem Sortierpuffer.
- Zentrifuge Zellsuspension (9 ml von Schritt 1.11) bei 600 × g für 5 min bei 20 o C. Dekantieren.
- In 50 ul alloantigen pMHC Tetramer verdünnt, um pelletiertZellen (bis zu 10 7 Zellen). Mischen leicht Pipettieren. Transfer zu einem sterilen 5 ml-Tube. Inkubation für 30 min bei Raumtemperatur.
- 2 ml Art Puffer. Zentrifuge bei 600 × g für 5 min bei 20 o C. Dekantieren.
- Zellen in 100 ul Sortierpuffer. In 10 ul Biotin Selection Cocktail und Inkubation für 15 min bei Raumtemperatur.
- In 5 ul Magnetische Nanopartikel und Inkubation für 10 min bei Raumtemperatur.
- In 2,5 ml Art Puffer und vorsichtig mischen. Entfernen 100 ul Aliquot, Transfer zum 5-ml-Tube und auf Eis zu halten für die Analyse der Voranreicherungszellen.
- Legen Sie die 5 ml Röhrchen mit der Zellsuspension in der Zellseparation Magnet. Die Kappe sollte locker oben auf dem Rohr sein. Inkubation für 5 min bei Raumtemperatur.
- Entfernen Sie vorsichtig die Kappe von der Tube. Halten Sie die Röhre und Magnet zusammen, dekantiert man die Tubeninhalt in ein frisches 5-ml-Tube. Tippen Sie nicht oder schütteln die Tubeninhalt zuentfernt die letzten Tropfen Flüssigkeit.
- Entfernen Sie den Schlauch vom Magnet. 2 ml kaltem Sortierpuffer und vorsichtig mischen. Probe 10 ul Zellsuspension verdünnt 1: 2 (in den 10 ul) Trypanblau um Zellen zu zählen mit einer Zählkammer.
3. Herstellung von T-Zellen für die Einzelzell-Durchflusszytometrie Zellsortierung
- In kalten Sortierpuffer in alle Röhrchen von Zellen (Tetramer unmarkierten, Tetramer-markierten un-angereichert und Tetramer-markierten angereicherten), um die Lautstärke zu 3 ml zu bringen.
- Zentrifuge bei 600 × g für 5 min bei 4 ° C dekantiert Puffer in Zellen zu gewinnen.
- Resuspendieren pelletierten Zellen in 25 ul kalten Sortierpuffer. In 5 ul menschlichen Fc-Block. Inkubieren auf Eis für 20 min.
- Bereiten Antikörper für die Durchflusszytometrie Sortierung. Mischungs 15 ul Sortierpuffer, 15 & mgr; l anti-CD5, 15 & mgr; l Anti-CD14, und 15 & mgr; l Anti-CD19.
- Mit 20 & mgr; l der Antikörpermischung in jedes Röhrchen der Zellen. Inkubieren auf Eis für 20 min.
- 2 ml kaltem Sortierpuffer in jedes Röhrchen.
- Zentrifuge bei 600 × g für 5 min bei 4 ° C dekantiert Puffer in Zellen zu gewinnen.
- Die Zellen in einer Konzentration von 1 -2 x 10 6 Zellen / ml in Sortierpuffer.
- Aliquots von 100 ul des humanen T-Zellkulturmedium (Iscove DMEM mit 2 mM Glutamax, 10 mM HEPES, 50 ug / ml Gentamycin, 50 & mgr; M 2-Mercaptoethanol, 10% hitzeinaktiviertem humanem AB-Serum und 2,5 ng / ml rekombinanten menschlichen ergänzt IL-2) zu jedem Well einer 96-Well-Rundboden-Zellkulturplatte. Halten Sie auf dem Eis.
4. Isolierung von Tetramer-markierten T-Zellen durch Einzel-Zell-Durchflusszytometrie Sortierung
- Richten Durchflusszytometrie Gating Parameter alloantigen-pMHC Tetramer markierten T-Zellen (Abbildung 2.a) zu identifizieren. Verwenden Sie die Voranreiche Tetramer markierten Fraktion feststellen Gating Strategien zur Dubletten, Tor auf Lymphozyten zu eliminieren, auszuschließen CD19 exprimieren B-Zellen und CD14exprimierenden Monozyten und T-Zellen zu identifizieren, indem CD5 Ausdruck. Verwenden die Probe nicht mit Tetramer als Fluoreszenz minus einer Steuer markiert die Gating für die Identifizierung von Tetramer bindende T-Zellen zu etablieren (mit 0% von CD5 + CD14 - CD19 - Zellen aus der Probe nicht durch Tetramer markierten innerhalb dieses Tor fällt) .
HINWEIS: Gating-Strategien, die nicht ausreichend stringent werden in Isolation von nicht-T-Zellen oder T-Zellen, die nicht antigenspezifisch sind, ergeben, sind, während zu restriktiv Gating Strategien wird die Zahl der T-Zellen isoliert reduzieren. - Programm den Plattenparameter für die einzelne Zelle sortieren. Richten Sie die Sortierer 1 CD5 + CD14 platzieren - CD19 - Tetramer + Zelle in jede Vertiefung. Richten Sie die eingerichtet, um ein Negativkontrolle (keine Zellen in den gut sortierten) und 1 positive Kontrollvertiefung enthalten (100 CD5 + CD14 - CD19 - Tetramer - Zellen) Platte in jeder Reihe (Abbildung 2.B ).
- Mit dem etablierten Durchflusszytometrie Gating-Strategie und Plattenaufbau isolieren einzelnen Tetramer bindenden T-Zellen direkt in den 96-Well-Platte mit einem durchflusszytometrischen Zellsortierer.
5. Kultur und Ausbau der Alloantigen-spezifischen T-Zellklonen
- Nach Abschluss der Zellsortierung, Zentrifugenplatte bei 600 × g für 5 min bei 20 o C. Ort Kulturplatte bei 37 ° C in einer 6% CO 2 -Inkubator.
- Vortex stimulierenden anti-CD3 / anti-CD28 Microbeads für 30 Sekunden, um Perlen zu resuspendieren.
- Berechnen Sie Volumen von Aktivator Perlen für Stimulation der T-Zellen erforderlich gesammelt (0,5 ul Aktivator Mikroperlen / Vertiefung). Übertragen berechnete Volumen der Stimulator-Perlen in eine sterile 5 ml Tube. 1 ml Human-T-Zellkulturmedium und Wirbel.
- Zeigen Rohr mit Mikroperlen-Suspension in Magnet. Die Kappe sollte locker oben auf dem Rohr sein. Inkubation für 2 min bei Raumtemperatur.
- Entfernen Sie vorsichtigdie Kappe von der Röhre. Halten Sie die Röhre und Magnet zusammen, dekantieren Tubeninhalt in ein frisches 5-ml-Tube. Nicht tippen oder bewegen Tubeninhalt.
- Entfernen Sie den Schlauch vom Magnet. Hinzufügen menschlichen T-Zellkulturmedium (100 & mgr; l Medium / 0,5 ul Mikroperlen zunächst hinzugefügt).
- Aliquots von 100 ul Aktivator Perlensuspension in jede Vertiefung der 96-Well-Platte. Inkubieren Kulturplatte bei 37 ° C in einer 6% CO 2 -Inkubator.
- Überwachen Sie das Zellwachstum täglich durch mikroskopische Untersuchung. 7 Tage-Kultur (Abbildung 3.a) - kleine Cluster von proliferierenden Zellen nach 5 mikroskopisch beobachtet werden.
HINWEIS: Visualisierung der T-Zellkulturen zu diesem Zeitpunkt kann schwierig sein, und die Abwesenheit von beobachtbaren Zellcluster in diesem Stadium nicht notwendigerweise indikativ für einen Mangel an wachsenden T-Zellen sein. - 14 Tage nach der Zellisolierung, Futterkulturen durch vorsichtiges Entfernen 100 ul Medium weg von der Spitze der Kultur und mit 100 μ ersetzen; L frische humane T-Zellkulturmedium. Weiter Inkubieren Kulturplatte bei 37 ° C in einer 6% CO 2 -Inkubator.
- Überwachung des Zellwachstums täglich durch mikroskopische Untersuchung und Auswertung der Farbe des Kulturmediums. 3 Tage nach dem Mediumwechsel - große Zellhaufen sollte mikroskopisch 2 sichtbar sein. Makroskopisch sollte Zellpellets während der 14 Tage nach dem Mediumwechsel sichtbar.
- Mit 28 Tagen nach Zellisolierung, identifizieren wachsenden Klone durch mikroskopische Untersuchung. Übertragen die 200 & mgr; l Volumen der wachstums positive 96-Well-Plattenkulturen auf einzelne Vertiefungen einer 48-Well-Gewebekulturplatten, die 200 & mgr; l menschlichen T-Zell-Kulturmedium.
- Füge 100 & mgr; l, enthaltend 12,5 ul stimulierenden anti-CD3 / anti-CD28-Mikroperlen (hergestellt wie in Abschnitt 5.2 beschrieben - 5.6). Inkubieren Kulturplatte bei 37 ° C in einer 6% CO 2 -Inkubator.
- Überwachen Kulturwachstum täglich durch mikroskopische exPrüfung und Bewertung der Farbe von dem Kulturmedium. Wenn T Zellkultur erreicht> 2x10 6 / ml (in der Regel 3-5 Tage nach der erneuten Stimulation, kann von dem Tag, an dem das Medium beginnt geschätzt werden Drehen strohgelb), Transfer Kultur zu einer Vertiefung einer 24-Well-Gewebekulturplatte und fügen Sie 500 ul menschliche T-Zell-Medium.
- Bei 10-14 Tagen folgen Restimulation, sammeln 200 ul T-Zellkultur zu alloantigen Spezifität durch Strömungs beurteilen Zytometrie Analyse pMHC Tetramer Bindung (unter Verwendung der in den Abschnitten 3 und 4.1 beschrieben Kennzeichnung und Gating-Strategie).
6. Langfristige Wieder Stimulation und Kultur von T-Zellklonen
- Ständig neu zu stimulieren und zu erweitern klonalen T-Zell-Kulturen, die mit der gewünschten Spezifität kann alle 14 Tage. Sammeln T-Zellkulturen in eine sterile 5 ml Tube am Tag 14 nach der letzten Anti-CD3 / CD28 Mikrobead Stimulation. Kombinieren mehrerer Vertiefungen der gleichen T-Zell-Klon in einem einzigen Rohr, bis zu einem Volumen von 2,5 ml.
- In mittleren bis das Endvolumen auf 2,5 ml zu bringen und vorsichtig mischen.
- Legen Sie die 5 ml Röhrchen mit dem T-Zellkultur in die Zellseparation Magneten an alten Mikroperlen aus der Kultur zu entfernen. Die Kappe sollte locker oben auf dem Rohr sein. Inkubation für 5 min bei Raumtemperatur.
- Entfernen Sie vorsichtig die Kappe von der Tube. Halten Sie die Röhre und Magnet zusammen, dekantiert die Zellsuspension in ein frisches 5-ml-Tube. Nicht tippen oder bewegen Tubeninhalt, um die letzten Tropfen Flüssigkeit zu entfernen.
- Hinzufügen Medium, um das Endvolumen auf 4 ml zu bringen. Probe 10 ul, um Zellen mit einer Zählkammer zählen.
- Erholen T-Zellen durch Zentrifugation bei 600 × g für 5 min bei Raumtemperatur.
- Dekantieren. Resuspendieren T-Zellen bei 10 6 Zellen / ml menschlichen T-Zell-Kulturmedium. 1 ml Aliquots in jede Vertiefung einer 24-Well-Gewebekulturplatte.
- Wieder stimulieren T-Zellen durch Zugabe von 100 & mgr; l Medium, enthaltend 12,5 ul stimulierenden anti-CD3 / aNTI-CD28 Microbeads (- 5,6 wie in den Abschnitten 5.2 beschrieben). Inkubieren bei 37 ° C in einer 6% CO 2 -Inkubator.
Ergebnisse
Dieses Protokoll beschreibt die Erzeugung klonaler menschlichen T-Zellkulturen mit Alloantigen Spezifität über eine Magnetperle Anreicherung und Einzelzell Durchflusszytometrie Sortierstrategie festgelegt. Abbildung 1 gibt einen Überblick über den Prozess.
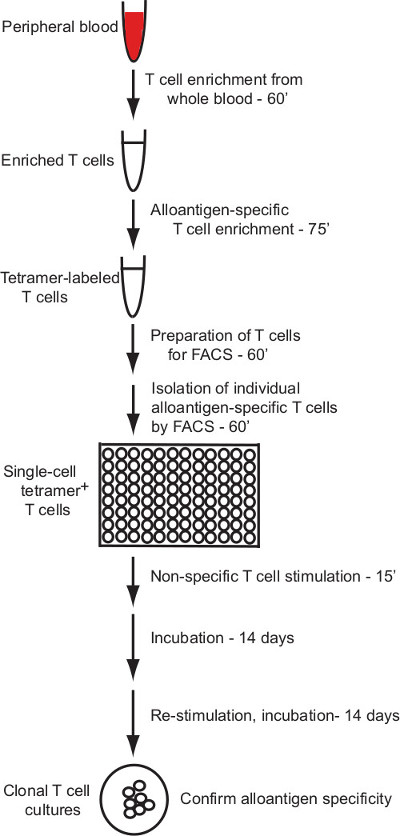
Figur 1: Protokoll Sicht Das hier beschriebene Protokoll stellt ein zuverlässiges Ve...
Diskussion
T cell alloreactivity is a long-studied and clinically-relevant phenomenon. The robust proliferative and effector responses of T cells to allogeneic stimulation has enabled extensive analyses of human T cell responses in vitro through relatively straightforward mixed lymphocyte reactions of peripheral blood T cells against inactivated allogeneic cells. However, these primary alloreactive T cell responses are oligoclonal, comprised of a large number of individual T cells responding to specific alloantigens. This ...
Offenlegungen
The authors declare no competing financial interests.
Danksagungen
The author would like to thank the NIH Tetramer Core Facility for tetramer production. The author would also like to thank E.D. O’Connor and K.E. Marquez at the UCSD Human Embryonic Stem Cell Core Facility flow cytometry laboratory for assistance in cell sorting. This work was funded by National Institutes of Health grant K08AI085039 (G.P.M.).
Materialien
| Name | Company | Catalog Number | Comments |
| Sodium heparin venous blood collection tube 16 x 100 mm | Becton, Dickenson and Company | 366480 | |
| Lymphoprep | Stemcell Technologies | 7801 | |
| Rosette Sep Human T Cell Enrichment Kit | Stemcell Technologies | 15061 | |
| Dulbecco's PBS, 1x without Ca or Mg | Corning | 21-031-CV | |
| Bovine serum albumin | Sigma-Aldrich | A7906 | |
| EDTA | Sigma-Aldrich | E6635 | |
| Fluorophore-labeled pMHC tetramer | NIH Tetramer Facility | NA | |
| EasySep Biotin Selection Kit | Stemcell Technologies | 18553 | |
| EasySep Selection magnet | Stemcell Technologies | 18000 | |
| TruStain FcX Human Fc blocking solution | Biolegend | 422301 | |
| Anti-CD5 PE-Cy7 (clone UCHT2) | Biolegend | 300621 | |
| Anti-CD14 FITC (clone HCD14) | Biolegend | 325603 | |
| Anti-CD19 FITC (clone HIB19) | Biolegend | 302205 | |
| Iscove's DMEM, without b-ME or L-glutamine | Corning | 15-016-CV | |
| HEPES | Corning | 25-060-CI | |
| b-Mercaptoethanol | Life Technologies | 21985-023 | |
| Glutamax | Life Technologies | 35050061 | |
| Gentamicin sulfate (50 mg/ml) | Omega Scientific | GT-50 | |
| Human AB serum, male donor | Omega Scientific | HS-30 | |
| Recombinant human IL-2 | Peprotech | AF 200-02 | |
| Dynabeads Human T-Activator CD3/CD28 | Life Technologies | 11131D | |
| Media | |||
| Cell sorting buffer | |||
| PBS, pH 7.4 | 1 L | ||
| BSA | 10 g | ||
| EDTA (0.5 M) | 2 ml | ||
| Human T Cell Culture Medium | |||
| Iscove's DMEM | 351.6 ml | ||
| Heat-inactivated human AB serum | 40 ml | ||
| HEPES (1 M) | 4 ml | ||
| Glutamax (100x) | 4 ml | ||
| Gentamicin (50 mg/ml) | 0.4 ml | ||
| b-mercaptoethanol (14.3 M) | 1.4 ml | ||
| Recombinant human IL-2 (1 mg/ml) | 1 ml |
Referenzen
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S. T cell activation. Annu. Rev. Immunol. 27 (1), 591-619 (2009).
- Morris, G. P., Allen, P. M. How the TCR balances sensitivity and specificity for the recognition of self and pathogens. Nat. Immunol. 13 (2), 121-128 (2012).
- Arstilla, T. P., et al. A direct estimation of the human αβ T cell receptor diversity. Science. 286 (5441), 958-961 (1999).
- Robbins, H. S., et al. Comprehensive assessment of T-cell receptor β-chain diversity in αβ T cells. Blood. 114 (19), 4099-4107 (2009).
- Alanio, C., Lemaitre, F., Law, H. K. W., Hasan, M., Albert, M. L. Enumeration of human antigen-specific naive CD8+ T cells reveals conserved precursor frequencies. Blood. 115 (18), 3718-3725 (2010).
- Suchin, E. J., et al. Quantifying the frequency of alloreactive T cells in vivo: new answers to an old question. J. Immunol. 166 (2), 973-981 (2001).
- Felix, N. J., Allen, P. M. Specificity of T-cell alloreactivity. Nat. Rev. Immunol. 7 (12), 942-953 (2007).
- Morris, G. P., Ni, P. P., Allen, P. M. Alloreactivity is limited by the endogenous peptide repertoire. Proc. Natl. Acad. Sci. USA. 108 (9), 3695-3700 (2011).
- Suri, A., et al. In APCs, the autologous peptides selected by the diabetogenic I-Ag7 molecule are unique and determined by the amino acid changes in the P9 pocket. J. Immunol. 168 (3), 1235-1243 (2002).
- Yssl, H., Spits, H. Generation and maintenance of cloned human T cell lines. Curr. Protoc. Immunol. 7, (2002).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Moon, J. J., et al. Naive CD4+ T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity. 27 (2), 203-213 (2007).
- Chicz, R. M., et al. Specificity and promiscuity among naturally processed peptides bound to HLA-DR alleles. J. Exp. Med. 178 (1), 27-47 (1993).
- Ni, P. P., Allen, P. M., Morris, G. P. The ability to rearrange dual TCRs enhances positive selection, leading to increased allo- and autoreactive T cell repertoires. J. Immunol. In press, (2014).
- Morris, G. P., Uy, G. L., Donermeyer, D., DiPersio, J. F., Allen, P. M. Dual receptor T cells mediate pathologic alloreactivity in patients with acute graft-versus-host disease. Sci. Transl. Med. 5 (188), (2013).
- Altman, J. D., Reay, P. A., Davis, M. M. Formation of functional peptide complexes of class II major histocompatibility complex proteins from subunits produced in Escherichia coli. Proc. Natl. Acad. Sci. USA. 90 (21), 10330-10334 (1993).
- Sabatino, J. J., Huang, J., Zhu, C., Evavold, B. D. High prevalence of low affinity peptide-MHC II tetramer-negative effectors during polyclonal CD4+ T cell responses. J. Exp. Med. 208 (1), 81-90 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten