A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מלכודת בתיווך Fusion של יחיד Proteoliposomes עם Bilayers Tethered הנתמך בתוך תא זרימת Microfluidic מנוטר על ידי Polarized TIRF מיקרוסקופי
In This Article
Summary
כאן, אנו מציגים פרוטוקול לזהות אירועי היתוך אחד, בתיווך מלכודת בין ליפוזומים bilayers נתמך ערוצי microfluidic באמצעות TIRFM המקוטב, עם רגישות מולקולה בודדת ~ 15 ברזולוצית זמן msec. ליפידים ושחרור מטען מסיס ניתן לאתר בו זמנית. Liposome גודל, diffusivity שומנים, ואת הנקבוביות היתוך מאפיינים נמדדים.
Abstract
בתהליך בכל המקום של היתוך קרום פתיחת הנקבוביות היתוך תיצור את החיבור הראשון בין שני תאים נפרדים לשעבר. במהלך הנוירוטרנסמיטר או שחרור הורמון באמצעות exocytosis, נקבובי ההיתוך יכול זמני לפתוח ולסגור שוב ושוב, קינטיקה שחרור מטען ויסות. דינמיקה נקבובית גם לקבוע את אופן מחזור שלפוחית; תוצאות resealing בלתי הפיכות החולף, "לנשק וברח" פיוז'ן, ואילו התרחבות מובילה היתוך מלא. כדי להבין טוב יותר מה גורמי מעצבי דינמיקה נקבובית, פתחנו assay לפקח היתוך הממברנה באמצעות קרינת השתקפות הפנימית מוחלטת מקוטב מיקרוסקופ (TIRF) עם רגישות מולקולה בודדת ~ 15 ברזולוצית זמן msec בתוך מוגדר היטב מבחינה ביוכימית במערכת במבחנה. פיוז'ן של שכותרתו fluorescently שלפוחית unilamellar קטנה המכילה חלבונים נ-מלכודת (נ-ורכבי שטח) עם מיסב bilayer מישוריים t-מלכודות, נתמך על כרית פולימר רכה (t-SBL, bilayer הנתמך-t), מנוטר. את assay משתמש ערוצי זרימת microfluidic המבטיחים צריכת מדגם מינימאלית תוך מתן צפיפות קבועה של רכבי שטח. ניצול שיפור האות המהיר עם העברת תוויות שומנים מתוך הרכב אל SBL במהלך היתוך, קינטיקה של העברת צבע שומנים מנוטרת. הרגישות של מיקרוסקופיה TIRF מאפשרת מעקב תוויות שומני פלורסנט בודדים, שממנו diffusivity שומנים וגודל SUV ניתן להסיק לכל אירוע היתוך. פעמי שחרור לצבוע ליפידים יכולה להיות הרבה יותר זמן מהצפוי למעבר הפרעה מנקבובי לצמיתות. באמצעות מודל המניח פיגור של שחרור שומנים נובע הנקבוביות הבהובים, נקבובית "פתיחות", את החלק היחסי של זמן הנקבובי נשאר פתוח במהלך היתוך, ניתן לאמוד. סמן מסיס ניתן גלום רכבי השטח עבור ניטור סימולטני של שומנים ושחרור מטען מסיס. מדידות כאלה מעידים כמה נקבוביים עשויים לחתום מחדש לאחר אובדן חלק מן המטען המסיס.
Introduction
היתוך ממברנה הוא תהליך ביולוגי אוניוורסלי הנדרש סחר תאי של שומנים וחלבונים, הפרשה, הפריה, פיתוח, ואפוף כניסת וירוס לתוך אורגניזמים מארח 1-3. עבור רוב תגובות היתוך התאי כולל שחרור של הורמונים ומוליכים עצביים באמצעות exocytosis, האנרגיה למזג שני bilayers שומנים מסופקת על ידי היווצרות של צרור ארבעה סליל בין חלבוני הקולטן חלבון מצורף גורם מאותו המקור המסיס N-ethylmaleimide רגיש (Snare), המעוגנת שלפוחית (v-Snare) ואת קרום היעד (t-Snare) 4, בהתאמה. Exocytosis שלפוחית סינפטית הוא תגובת ההיתוך המוסדרת ההדוק ביותר והוא מתרחש בתוך אלפית שני לאחר הגעתו של 1,4,5 פוטנציאל פעולה. נקבובי ההיתוך, הקשר הראשוני בין שני תאי פיוזינג, יכול להבהב פתוח וסגורים מספר פעמים לפני resealing או להרחיב באופן בלתי הפיך 5-7. התוצאות לשעברב חולף, "לנשק & לרוץ" היתוך, בעוד המוביל האחרון היתוך מלא. גורמים הקובעים את האיזון בין שני מצבים אלה של היתוך ומנגנוני ויסות מהבהב נקבובי אינם מובנים היטב 5,8.
חלבוני מלכודת נדרשים עבור exocytosis; איחוי שלפוחית סינפטית הוא בוטל על המחשוף של מלכודות ידי neurotoxins 9. ניסויי היתוך גורפים באמצעות שלפוחית unilamellar קטן (רכבי שטח) הראו כי מלכודות אינן נדרשות רק, אלא גם מספיק לנהוג היתוך קרום 10. ב assay בתפזורת זו, רכבי השטח מחדש עם v-מלכודות (נ-SUV) היו מסוממים עם פוספוליפידים ניאון (N - (7-ניטרו-2-1,3-benzoxadiazol-4-י.ל.) -phosphoethanolamine (NBD-PE) ו ( N -. (lissamine rhodamine B sulfonyl) -phosphoethanolamine (LR-PE) ומעורבבים עם שלפוחית ללא תווית המכילה t-מלכודות (t-SUV) בתחילה את הקרינה של-PE NBD ב-ורכבי שטח נ הוא הרווה ידי תהודה פורסטר אנרגיה העברה (סריג ) כדי LR-PE. כמו במעבדהeled נ-ורכבי שטח פתיל עם t-ורכבי שטח ללא תווית, צפיפות שטח fluorophore בקרום בשילוב עכשיו מצטמצמת ואת הגידול וכתוצאה מכך קרינת NBD-PE מדווח על היקף שומני ערבוב 10. כמו assay בתפזורת קל להגדיר ולנתח, זה כבר נעשה שימוש נרחב כדי לחקור מנגנונים של היתוך בתיווך מלכודת 10-14. עם זאת, יש מספר מגבלות, כגון רגישות נמוכה ורזולוצית זמן עניה. והכי חשוב, כמו מדידת הרכב, זה ממוצעי תוצאות לאורך כל האירועים עושים אפליה בין העגינה ואיחוי, כמו גם זיהוי של חומרי ביניים hemifusion קשים.
במהלך עשור הקבוצות כמה בעבר, כוללים שלנו, פתח מבחנים חדשים לפקח אירועי היתוך ברמת שלפוחית יחיד 15-27. Ha ועמיתיו השתמשו-ורכבי שטח נ קשורים על גבי משטח ומפוקחי ההיתוך שלהם עם 18,19 t-ורכבי שטח חינם. ערבוב ליפידים היה פיקוח באמצעות סריג בין זוג fluorophores הנכנס השומנים emמיטות ב V- ו-ורכבי שטח t, בהתאמה, באמצעות קרינת השתקפות פנימית מוחלטת (TIRF) מיקרוסקופיה 18. מאוחר יותר, המעבדה של Brunger השתמשה מיני שומני תווית אחת יחד עם סמן תוכן עבור זיהוי סימולטני של שומנים ותכני ערבוב 20,28. הן השומנים ואת סמני תוכן נכללו בריכוזים גבוהים, מרווה עצמית; פיוז'ן עם רכבי שטח ללא תווית הביא קרינת dequenching 20,28.
לאחרים יש התמזגו נ-רכבי השטח כדי bilayers מישוריים מחדש עם t-מלכודות 15-17,21-27,29. הגיאומטריה מישוריים של היעד (t-Snare המכיל) bilayer מחק טוב יותר את תהליך ההיתוך הפיזיולוגי של קטנה, שלפוחית מעוקלת מאוד עם קרום פלזמה שטוח. קבוצת סטיינם מועסקת ממברנות-פורש נקבובי מחדש עם t-מלכודות, תלוי מעל מצע סיליקון ניטריד נקבובי זוהתה היתוך עם רכבי שטח פרט נ באמצעות מיקרוסקופ סריקת ליזר confocal 23. אחרים ונ-ורכבי שטח משומש bilayers מישוריים מחדש עם t-מלכודות, נתמך על מצע זכוכית 15-17,21,22,24-27,29. היתרון הגדול של שימוש bilayers נתמך (SBLs) היא כי מיקרוסקופיה TIRF יכול לשמש כדי לזהות אירועים עגינה ואיחוי עם מעולה יחס אות לרעש וללא הפרעה מצד-ורכבי שטח נ בחינם, אם כי באמצעות מיקרופלואידיקה גם מספקת רזולוציה של אירוע יחיד באמצעות שדה רחוק תקן מיקרוסקופיה epifluorescence 24.
אחת הבעיות המרכזיות היא האם וכיצד אינטראקציות bilayer המצע משפיע נתמך איכות bilayer ותהליך היתוך. עבודה מוקדמת עשתה שימוש SBLs מישוריים שנתמכו ישירות על מצע זכוכית או קוורץ 15-17. SBLs אלה נעשו על ידי ספיחה, מתפרצת, מתפשטת ואיחוי של ממברנות t-SUV על פני המצע. זה מומש בקרוב, עם זאת, כי השמטת מרכיב t-Snare מפתח, SNAP25, מן SBLs ערוכים באופן זה הביא indistinguis קינטיקה עגינה ואיחוי נ-SUVדבר אליה מאלה שמתקבלות באמצעות t-מהלכודות 17 המלאות. בגלל SNAP25 דרוש לחלוטין עבור היתוך in vivo 30,31, הרלוונטיות הפיזיולוגית של ניסיונות המוקדמים ההם הועמדה בסימן השאלה. קבוצתו של תם התגבר על אתגר זה באמצעות היווצרות bilayer מבוקרת נתמך טוב יותר 21. זה היה אמור בתצהיר לאנגמיור-Blodgett עבור הכרוז הראשון ללא חלבון של SBL, ואחריו היתוך של monolayer כי עם t-ורכבי שטח 21. זה הביא היתוך SNAP25 התלוי.
כדי למנוע חפצים פוטנציאליים הקשורים עם bilayer הנתמך ישירות על מצע זכוכית ללא צורך להשתמש בשיטות לאנגמיור-Blodgett, Karatekin et al. הציג פולים רך, התייבשות (אתילן גליקול) (PEG) כרית בין bilayer ואת המצע 24. שינוי זה נבע גם היתוך SNAP25 תלוי 24. Bilayers מרופד על שכבת פולימר רכה היה ידוע לשמר הטרנסממברני טובניידות החלבון ותפקודו 32, וכבר נעשה שימוש במחקרים היתוך עם וירוסים 33. בנוסף, bilayers PEGylated נראה לשמור על כמה יכולת לריפוי עצמי והם מאוד חזקים 34,35. ראשית, שבריר זמין מסחרי, שרשרות PEG צמודי שומנים כלולים בקרום t-SUV. כאשר t-ורכבי שטח אלה פרצו ויוצרים bilayer מישוריים על מצע זכוכית, מברשת PEG מכסה גם עלונים של bilayer מישוריים. בגלל היווצרות bilayer מישוריים הוא מונע על ידי הדבקה של רשתות PEG שמסביב t-ורכבי שטח על גבי משטח הזכוכית הידרופילי, התפוצצות ליפוזום והיווצרות bilayer מישוריים אינם רגישים יחסית להרכב השומנים בשימוש. עם זאת, כאשר כמויות גדולות של כולסטרול כלולים, הגדלת הנכסים המלוכדים של רכבי השטח, רכבי השטח לא יכול להתפוצץ באופן ספונטני. אם זה מקרה, יוני הלם או divalent האוסמוטי יכולים להיות מועסקים על מנת לעזור היווצרות bilayer מישוריים 25.
כאמור, ב ap זהproach מברשת PEG מכסה משני צידי מישוריים, נתמך bilayer. המברשת מול ערוץ הזרימה microfluidic מסייעת במניעת הידבקות ספציפית של רכבי שטח נ נכנסים אשר מכוסים גם בדרך כלל בשכבת PEG. כינונה של מתחמי V- וטי-Snare מתחיל מן הקרום-דיסטלי N-טרמיני תמורה בשלבים לעבר תחומי הפרוקסימלי קרום 36. עבור-ורכבי שטח נ לקיים אינטראקציה עם t-SBL, את V- וטי-המלכודת N-Termini הצורך כדי לבלוט מעל מברשות PEG, אשר נראה כי המקרה בתנאים של assay. גובה מברשת ניתן להתאימו לחקר חלבונים אחרים מאשר מלכודות על ידי שינוי הצפיפות של שומני PEGylated ואת אורך שרשרת PEG 37,38. יתרון נוסף של מברשות PEG כיסוי המשטחים הפרוקסימלי של bilayers פיוזינג הוא שהם לחקות את הסביבה הצפופה של ממברנות ביולוגיות אשר עמוסות 30,000-40,000 חלבונים בממברנה נפרדים לכל מ"ר מיקרון 39. בדיוק כמו שרשראות PEG ב assay זה, repuשכבת חלבון lsive כיסוי ממברנות ביולוגיות צריכה להידחף הצידה כדי לאפשר קשר בין שני bilayers פוספוליפידים להיתוך להתרחש.
ערוצי זרימה microfluidic משמשים assay זה, כפי שהם מציעים יתרונות ייחודיים. ראשית, זרימת microfluidic מאפשרת בתצהיר אחיד יותר של רכבי שטח t להתפשט פתיל כדי ליצור את חולצת SBL. שנית, היקף הערוץ הקטן (<1 μl) ממזער צריכת מדגם. שלישית, בנפחים הקטנים נדרשים לאפשר הניסוי כולו להתנהל תחת זרם בלתי פוסק. תזרים מסיר חלש, יש להניח שאינו ספציפי,-ורכבי שטח נ דבקו מן SBL 16. זה גם שומר צפיפות קבועה של רכבי שטח v מעל חולצת SBL, לפשט ניתוח הקינטית 17. לבסוף, שלפוחית עגנה נבדלת בקלות מאלו חינם נישאו על ידי הזרימה 25. ניתן להשתמש הרביעית, כמה ערוצים microfluidic באותו coverslip, כל חיטוט מצב שונה. זה מאפשר השוואה של דורות תנאיםng בטווח ניסיוני אותו. גישה דומה נוצל בעבר על ידי קבוצת ואן Oijen ללמוד היתוך בין וירוס שפעת SBLs מרופד 33.
במיקרוסקופיה TIRF, את הדעיכה מעריכית של שדה החלוף (עם קבוע דעיכה ~ 100 ננומטר) עירור קרינת גבולות למולקולות אלה נמצאים בסמיכות קרובות מאוד של הממשק-חיץ זכוכית. זה ממזער תרומה של מולקולות ניאון כי הם מרוחקים יותר, מגדיל את יחס אות לרעש, ומאפשר רגישות מולקולה בודדת עם זמני חשיפת מסגרת של 10-40 אלפיות שני. השדה חלוף גם מוביל לעליית אות על היתוך: כמו העברת השומנים שכותרתו מתוך הרכב לתוך SBL, הם מוצאים את עצמם, בממוצע, בשדה עירור חזק. עלייה זו הקרינה חזקה עבור ליפוזומים גדול.
אם אור המקוטב משמש להפקה בתחום החלוף, אפקטים נוספים לתרום לשינויי קרינה על transfer תוויות מתוך הרכב לתוך SBL. יש צבעי שומנים מסוימים כוללות דיפול המעבר בכיוון עם זווית העדיפה ממוצע ביחס bilayer שבה הם משובצים. זה יוצר הבדל בסך של הקרינה הנפלטת fluorophores כשהם נמצאים SUV מול SBL, מאז הקורה המקוטב שילהיב צבעים בשתי ממברנות שונות. לקבלה לשעבר, קורה העירור יהיה אינטראקציה עם הדיפולים מעבר אורינטציה ברחבי SUV הכדורי, ואילו האחרון, אורינטציות דיפול תהיינה מוגבלות על ידי גיאומטרית SBL השטוחה. לדוגמה, כאשר s-מקוטב לאור האירוע (מקוטב נורמלי אל מישור הפגיעה) משמש, עירור יעיל יותר כאשר צבען הוא SBL מאשר את המכונית בשביל מקביל אוריינטציה דיפול המעבר השומנים לצבוע קרום 29,40 (כמו זה של DiI או עשה 41-43). רכב שטח מסומם עם fluorophore כזה מופיע לעמעם כשזה רציפים על SBL (איור 7, Representat ive תוצאות). כתוצאה נקבובי היתוך פותח ומחבר את ממברנות SUV ו SBL, בדיקות ניאון מפוזר לתוך SBL ולהיות יותר סיכוי להיות נרגש שדה החלוף המקוטב של 25,27,29. כתוצאה מכך, אות הקרינה שולב סביב אתר ההיתוך מגבירה בחדות במהלך העברה לצבוע מתוך הרכב לתוך 27 SBL (איור 3 ו האיור 7). גורם נוסף שתורם לאותת שינויים נלווים היתוך dequenching של תוויות ניאון כפי שהם המדולל כאשר הועברו אל SBL. תרומת dequenching היא בדרך כלל מינורי לעומת תופעות ריקבון קיטוב שדה חלוף ב assay המתואר כאן, כי רק חלק קטן ( 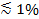 ) של השומנים מסומנים.
) של השומנים מסומנים.
גידול האות על היתוך ניתן לנצל כדי להסיק נכסים נקבוביים היתוך ידי השוואה בין הזמן,1 "src =" / files / ftp_upload / 54,349 / 54349eq2.jpg "/>, הנדרשת עבור השומנים לברוח דרך נקבוביות כי הוא חדיר בחופשיות שומנים לזמן השחרור בפועל,  . אם שני סולמות הזמן ניתנים להשוואה, זה היה להסיק כי נקבובי מציג התנגדות מעט זרימת שומנים. עם זאת, אם זמן השחרור בפועל הוא משמעותי יותר מאשר הזמן לשחרור דיפוזיה-מוגבל, זה היה להצביע על תהליך, כגון הבהוב נקבובי, מעכבי שחרור שומנים. שעת השחרור מוגבל דיפוזיה,
. אם שני סולמות הזמן ניתנים להשוואה, זה היה להסיק כי נקבובי מציג התנגדות מעט זרימת שומנים. עם זאת, אם זמן השחרור בפועל הוא משמעותי יותר מאשר הזמן לשחרור דיפוזיה-מוגבל, זה היה להצביע על תהליך, כגון הבהוב נקבובי, מעכבי שחרור שומנים. שעת השחרור מוגבל דיפוזיה,  , תלוי בגודל של liposome פיוזינג ו-diffusivity השומנים; להערכתה דורשת שני פרמטרים אלה כדי לכמת. רגישות המולקולה הבודדה של assay מאפשרת diffusivity שומנים כדי להימדד על ידי מעקב אחר כמה fluorophores שומנים יחידים לאחר שחרורם לתוך SBL לכל אירוע היתוך 26. גודלו של כל שלפוחית פיוזינגניתן לאמוד 27 על ידי שילוב (i) את עוצמת צבע שומנים יחיד, (ii) שינוי הקרינה הכוללת סביב אתר עגינה אחרי הכל fluorophores מועבר לתוך SBL על היתוך, (iii) צפיפות התיוג הידועה של SUV שומנים, וכן (iv) באזור לכל שומנים. עבור אירועי היתוך רבים, פעמי שחרור שומנים בפועל נמצאו הרבה איטי מצפוי על ידי שחרור מבוקר דיפוזיה 27, כפי שצוינו בהנחת גודל SUV האחיד בעבר 44. בהנחת פיגור של שחרור שומנים נובע הנקבוביות הבהובים, מודל כמוני מאפשר אמיד של "פתיחות נקבובית", את החלק היחסי של זמן הנקבובי נשאר פתוח במהלך ההיתוך 27.
, תלוי בגודל של liposome פיוזינג ו-diffusivity השומנים; להערכתה דורשת שני פרמטרים אלה כדי לכמת. רגישות המולקולה הבודדה של assay מאפשרת diffusivity שומנים כדי להימדד על ידי מעקב אחר כמה fluorophores שומנים יחידים לאחר שחרורם לתוך SBL לכל אירוע היתוך 26. גודלו של כל שלפוחית פיוזינגניתן לאמוד 27 על ידי שילוב (i) את עוצמת צבע שומנים יחיד, (ii) שינוי הקרינה הכוללת סביב אתר עגינה אחרי הכל fluorophores מועבר לתוך SBL על היתוך, (iii) צפיפות התיוג הידועה של SUV שומנים, וכן (iv) באזור לכל שומנים. עבור אירועי היתוך רבים, פעמי שחרור שומנים בפועל נמצאו הרבה איטי מצפוי על ידי שחרור מבוקר דיפוזיה 27, כפי שצוינו בהנחת גודל SUV האחיד בעבר 44. בהנחת פיגור של שחרור שומנים נובע הנקבוביות הבהובים, מודל כמוני מאפשר אמיד של "פתיחות נקבובית", את החלק היחסי של זמן הנקבובי נשאר פתוח במהלך ההיתוך 27.
בכל פעם מעשית, חשוב לבחון מנגנוני היתוך באמצעות שני שומנים ותוויות תוכן מסיסים. לדוגמא, הודעת שומנים יכולה להיות מפגר ידי תהליכים אחרים מאשר מהבהב נקבובי, כגון הגבלת דיפוזיה שומנים ידי חלבוני המלכודת מקיף tהוא נקבובי. אם זה היה המקרה, ולאחר מכן שחרר תוכן שתקדים שחרור תוויות שומנים, ספק את הנקבוביות הן גדולות מספיק כדי לאפשר מעבר של בדיקות מסיסות. פגם מהותי יותר בגישה יכול להיות ההנחה כי העברת שומנים שכותרתו אל SBL מתרחשת הדרך נקבובית היתוך צר המחבר את SBL על שלפוחית כי שמרה צורה מראש ההיתוך שלה במידה רבה. העברת ליפידים לתוך SBL יכולה גם לנבוע התרחבות מהירה של הנקבובית ההיתוך עם תכונת לוואי, הקריסה מהירה מאוד של SUV לתוך קרום SBL, כמו בעבר מוצע מבוססת על נתוני שחרור שומנים לבד 29. ניטור הוא השומנים ותכנים לשחרר בו זמנית, נמצא כי נקבוביים רבים חזרו וחתום לאחר שחרור כל תוויות השומנים שלהם, אבל שמור על כמה המטענים המסיסים שלהם 27. זה מצביע על כך לפחות ליפוזומים כמה לא לקרוס לתוך SBL לאחר היתוך, וכי העביר לצבוע שומנים לתוך SBL מתרחש דרך נקבובית היתוך. בנוסף, lשחרור ipid ותכנים התרחשו בעת ובעונה אחת 27, ולכן קטן הסיכוי כי פיגור של שחרור השומנים נבע מעצור של דיפוזיה השומנים ידי חלבונים המלכודת סביב הנקבובית 45.
פרוטוקול היתוך SUV-SBL כי לא פקח על שחרור תוכן מסיס פורסם בעבר על ידי Karatekin ורוטמן 25. הנה, ההתפתחויות אחרונות יותר כלולות, כלומר ניטור סימולטני של שומנים ותכנים לשחרר ואמידה של SUV, שומנים בדם, ומאפיינים נקבוביים היתוך 27. פרוטוקול מתחיל עם הוראות להכנת תאים microfluidic, שנעשו על ידי מליטה פולי (siloxane דימתיל) (PDMS) אלסטומר המכיל לחסום חריצים עם coverslip זכוכית 25. לאחר מכן, הכנה-ורכבי שטח נ עם שומנים הם וסמני תוכן מוסברת. סעיפים 4 ו -5 לספק הוראות להרכבת תאים microfluidic, להרכיב את SBLs באתרו ובדיקת ליקויים ונזילות, כניסתה של VSיובס לתוך תאי הזרימה וזיהוי של אירועי היתוך. סעיף 6 מספק הוראות לניתוח נתונים.
Protocol
1. הכנת בלוק PDMS כדי ליצור את ערוץ microfluidic
Microfabrication איור 1. תבנית זרימת תא PDMS לחסום הכנה. (א) עיצוב של תא זרימת ארבעה ערוצים שמתאים על coverslip זכוכית 24 x 60 מ"מ (למטה). שישה עיצובים זהים מסודרים כדי להתאים על גבי פרוסות סיליקון 10 ס"מ (למעלה). (ב) לגזור בלוק של כ PDMS עבה 5-8 מ"מ על אגרופן חור. (C) קלטי צינור לתוך חור האגרוף באמצעות פינצטה. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- השג תבנית תא זרימה כגון אחד באיור 1 א. ערוצים אופייניים הם רחבים 0.3-1 מ"מ, 70-100 מיקרומטר גבוהים, וארוכים 1-2 סנטימטר. לפברק תבנית לנוing טכניקות photolithography סטנדרטי במתקן cleanroom 25 או צו אם גישה לחדרים נקיים אינו זמין. לחלופין, מכונת תבנית עם ממדים גדולים יותר מחומר מתאים.
הערה: צוות החדר נקי יכול לאמן ולהדריך משתמשים שנמנים (גישה למתקן cleanroom תמיד מוגבל למשתמשים עם הכשרה מתאימה) בתכנון והזמנת ניקוי מסכה, רקיק, ו photolithography. ברגע תבנית מתקבלת, ניתן להשתמש בו מחוץ לחדרים הנקיים שוב ושוב, בתנאי שהוא נשמר בצלחת סגורה טיפול נלקח להוציא אבק. - הכן תערובת של PDMS מיליליטר ~ 100 (אלסטומר בסיס סיליקון) ו ~ 10 מיליליטר של מקשר צולב (סוכן ריפוי) בתוך כוס פלסטיק חד פעמית. לשבור את קצה פיפטה פנויה לטפל PDMS הצמיגה יותר בקלות. לשקול את PDMS לתוך כוס פלסטיק כמו pipetting אינה מדויקת.
- מערבבים את התערובת היטב. הסר את בועות אוויר רבות על ידי סילוק גזים בחלל ריק ייבוש (כ -20דקות). כמו הגביע מושם תחת ואקום, הבועות בתחילה תגדלנה בגודל, הגדלת נפח התערובת מאוד. השליטה ואקום כי מוחל לוודא שהכוס עמוקה מספיק כדי למנוע דליפה.
- יוצקים ירידה גדולה של תערובת PDMS degassed לתוך צלחת זכוכית פטרי (150 מ"מ x 20 מ"מ) ולחץ על רקיק על PDMS עם תבנית פונה כלפי מעלה. זה ימנע בועות להילכד מתחת רקיק. בועות לכודים תרחבנה ועלולות להטות את הרקיק כאשר המנה מושמת בתנור. עכשיו לשפוך PDMS degassed על תבנית על גבי פרוסות סיליקון עד לכיסוי בכ 5-8 מ"מ של PMDS. אם בועת אוויר מתרחשת בעדינות להסיר אותו עם קצה פיפטה.
- אופים את PMDS בתנור על 60 מעלות צלזיוס במשך 3 שעות. ודא כי המנה היא רמה.
- השתמש בלהב סכין מנתחים חדש לגזור בלוק PDMS המכיל את מבני ערוץ היצוקים. הבלוק לגזור צריך להתאים על coverslip (ראה שלב 4.1.9).
- מקלף את הגוש לגזור מהצלחת ו PLאס אותו על פיסת נייר אלומיניום נקי.
הערה: בלוקי PMDS הצולבים יכולים להישמר במשך כמה חודשים. על אחת רקיק, יש 6 סטים של ערוצי זרימה (איור 1 א), כך 6 רחובות PDMS ניתן לייצר דפוס PDMS יחיד. לאחר חיתוך את כל 6 של אבני PDMS, חלקים רופפים נקי של PDMS, אבל חוץ מזה לא ניתן להסיר את PDMS הנותרים לפני ומזג cross-linking את המנה הבאה, אשר יחייב רק כמחצית PDMS המשמש את המנה הראשונה. תבנית טובה יכולה להימשך כמה שנים. - השתמש מחורר לקדוח דרך הבלוק PDMS בתנועה אחת ישר (איור 1B). התחל בצד של חריצי הערוץ. הקפד להסיר את חתיכת אגרוף מתוך PDMS. חזור על פעולה זו עבור כל שמונת החורים של עיצוב ערוץ ארבעה.
- הנח את צד הערוץ לחסום PDMS למטה על גבי פיסה חדשה ללא קמטים של רדיד אלומיניום. אחסן את הבלוק עד כמה חודשים בתוך קופסא יבשה, אידיאלי ייבוש.
- דחוף את הצינורות (0.25 מ"מ מזהה, 0.76 מ"מ OD) כשליש לתוך חור האגרוף באמצעות פינצטה (תרשים 1C). חותך את הצינורות מלוכסנים ל להחדרה קלה יותר. השאר צינורות מספיק זמן כדי להגיע מאגר SUV ואת משאבת המזרק, בהתאמה. לאחר צבת השבב התאסף על מיקרוסקופ, לחתוך את הצינורות שוב אם הם ארוכים מדי.
- כדי להתחבר המזרקים של המשאבה, לחתוך קטע קצר של צינורות סיליקון גדולים (מזהה 0.51 מ"מ, 2.1 מ"מ OD) והכניס את הצינור הדק לתוך צד אחד. בלוק מוכן לשימוש זה של PDMS יכול להישמר במשך כמה חודשים.
2. Coverslip ניקוי
- Coverslips נקי על פי הפרוטוקול המתואר Karatekin ורוטמן 25 באמצעות תערובת חמצון חזקה של חומצה גופרתית (H 2 SO 4) ואת מי חמצן (H 2 O 2). בצע נוהל זה בתוך חדר נקי, ולבחון אמצעי בטיחות נאותים. לחלופין, להשתמש ג cleanroom ניקהoverslip כי היא זמינה באופן מסחרי (ראה רשימת חומרים).
3. הכנה-ורכבי שטח נ המכילה גם שומנים ותוויות תוכן

ליפידים איור 2. סכמטי של הכנת SUV. מעורבבים בתוך שפופרת זכוכית (1) ממס מתאדה כדי ליצור סרט שומנים על ידי החלפה של הצינור בתוך אמבט מים (2). עקבות של ממס נותרים יוסרו תחת ואקום גבוה (3). סרט השומנים הוא hydrated חיץ כינון מחדש המכיל חומרי ניקוי וחלבון בעוד vortexed (4). אם לצבוע תוכן הוא להיות במארז, הוא נכלל בשלב זה, כמו גם בשלב הדילול (5). דילול של ריכוז חומר הניקוי מתחת ריכוז micelle הביקורתי שלה מוביל liposome היווצרות. דטרגנט הוא dialyzed ולא תחזור הלילה (6). עבור T-ורכבי שטח להיווצרות SBL כולל NBD-PE (ירוק), שלפוחית הם ריחפו שיפוע צפיפות שנאספוהממשק בין שתי שכבות (7 א). כדי להפריד-ורכבי שטח נ בטוש תוכן Encapsulated מן לצבוע חינם המדגם הוא נדרס עמודה בגודל הדרה ונאספים 0.5 מ"ל שברים (7b). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- הכן 4 ליטר של חיץ הכינון מחדש, המכיל 25 מ"מ HEPES-KOH, 140 מ"מ KCl, 100 מיקרומטר EGTA ו 1 מ"מ DTT, pH 7.4. השתמש ביותר של החיץ עבור מיליליטר דיאליזה 100 לצעדים אחרים.
הערה: מאגרים אחרים עשויים לשמש, אך חשוב לשמור על osmolarity חיץ עקבי לאורך כל הניסוי ולבחור התנאים שבהם חלבונים הם פונקציונליים. להכנה-ורכבי שטח נ המכילים תוויות שומנים רק וטי-ורכבי שטח, בצע Karatekin ורוטמן 25. - בעוד המניות השומנים מאוחסנים ב -20 מעלות צלזיוס כלורופורם או כלורופורם: מתנול (2: 1, V / V), לתת צלוחיות להגיע לטמפרטורת החדר לפני הפתיחה כדילמנוע התעבות.
- לשטוף שפופרת זכוכית עם כלורופורם כדי להסיר כמויות זעירות של חומר ניקוי ומערבבים ליפידים בבית היחס הרצוי עם סכום סופי של 1 μmol בתערובת של כלורופורם מתנול (2: 1, V / V). השתמש רק זכוכית מזרקים / צינורות לטפל ממסים אורגניים / שומנים מומסים.
הערה: שומנים כאן הם השתמשו POPC: SAPE: DOPS: כולסטרול: PEG2000-DOPE: האם לפי יחס טוחנת של 57.4: 15: 12: 10: 4.6: 1 עבור שלפוחית המכילה נ-המלכודת ואת POPC: SAPE: DOPS: כולסטרול : PI המוח (4,5) P 2: PEG2000-DOPE: NBD-PE (54.9: 15: 12: 10: 3: 4.6: 0.5) עבור t-Snare ורכבי שטח. ראה חומר לפרטים. ניתן להשתמש קומפוזיציות שומנים אחרות. - להתאדות הממס תחת זרם עדין של חנקן, או מאייד סיבובי. לטבול את קצה הצינור באמבט מים (37 מעלות צלזיוס) מחומם מעל טמפרטורת ההתכה הגבוהה ביותר של השומנים להניב סרט שומנים הומוגנית כדי למנוע שינויים גדולים בטמפרטורה תוך מתאדים הממסים. התחל ואקום בסביבות300 mbar עד שסרט השומנים נוצר, ואז להמשיך עבור ~ 2 דקות ואקום אפשרי הגבוה המאייד הסיבובי.
- הסר את שפופרת זכוכית ועוטפים אותו בנייר אלומיניום, כדי למנוע חשיפה לאור ולהסיר שאריות של ממס על ידי הנחת צינור ייבוש תחת ואקום גבוה במשך שעה לפחות 2. צעד זה גם יכול לרוץ לילה.
- רעננותם סרט השומנים היבש, להכין תערובת של אבקת כביסה (n-Octyl-β-D-glucopyranoside, OG), חלבון (נ-מלכודות), ו SRB חיץ כינון מחדש (500 נפח סופי μl). לשמור על ריכוז חומר הניקוי הסופי ~ 2 פעמים מעל ריכוז micelle הביקורתי (CMC, 20-25 מ"מ עבור OG) ולהתאים את עוצמת הקול הסופי כך דטרגנט יחס שומנים הוא> 10. ממסי Sulforhodamine B (SRB) אבקה בתמיסת החלבון-דטרגנט לקבל ריכוז סופי של 10-50 מ"מ SRB ידי ניעור בעדינות את הפתרון. התאם את osmolarity של חיץ הכינון מחדש בעת הוספת ריכוזים גבוהים של SRB ידי צמצום שיתוףncentration של אשלגן כלורי בהתאם.
הערה: יחס ליפידים לחלבון (LP) עבור t-מלכודות גבוה (LP ~ 20,000, ~ 70 t-מלכודות למ"ר מיקרון 25.). באופן משמעותי צפיפויות t-Snare גבוהות SBL עלולות להוביל אגרגטים חלבון פעילים עם 17,24 הקטינו את שיעורי ההיתוך משמעותי. LP עבור נ-מלכודות הוא הרבה יותר נמוך (LP ~ 200, ~ 7,000 נ-מלכודות לכל מיקרומטר 2), קרוב צפיפויות נ-Snare למצוא 46,47 שלפוחית סינפטית. כדי להבטיח תפקוד חלבונים לאחר ביטוי רקומביננטי וטיהור V- וטי-מלכודות כדאי לבצע assay היתוך בתפזורת פשוט 48 לפני שהם עוברים את כל השלבים של assay איחוי שלפוחית היחיד. - הנער בעדינות את שפופרת הזכוכית המחוממת מראש המכילה את סרט שומנים היבש תוך הוספת פתרון החלבון-דטרגנט-SRB משלב 3.6. נסה להימנע מיצירת בועות. המשך ללחוץ במשך 15 דקות ב 37 מעלות צלזיוס.
- לדלל את חומר הניקוי פי חמישה על ידי הוספת כינון מחדשמאגר המכיל SRB (להוסיף 2 מ"ל, 2.5 נפח סופי מ"ל) תוך vortexing במהירות כדי למנוע הדרגתיים ריכוז. המשך ללחוץ במשך 15 דקות עד 1 שעה על 37 מעלות צלזיוס.
הערה: יעילות כינון מחדש חלבון עליית דגירה ארוכה. הדילול המהיר מקטין את ריכוז חומרי הניקוי מתחת CMC ומוביל להיווצרות של ליפוזומים קטן. - Dialyze השעית השלפוחית הראשון נגד ~ 1 ליטר של חיץ כינון מחדש במשך 1-2 שעות בטמפרטורת הסביבה ולאחר מכן נגד 3 ליטר של חיץ כינון מחדש הלילה ב 4 ° C עם 4 גרם של סופח קלקר, באמצעות צינור או קלטת דיאליזה 20,000 MWCO. השתמש כוסות שונות לדיאליזה של שלפוחית עם ובלי SRB למנוע זיהום צולב.
- לאזן עמודת סינון ג'ל עם חיץ כינון מחדש. הפעל את ההשעיה שלפוחית דרך העמודה להפריד SRB חינם מן-ורכבי שטח נ עם SRB כמוס. השתמש חיץ הכינון מחדש ללא SRB כמו eluent פעם המדגם כולו ישנכנס בטור. אוספים ורכבי שטח נ ב 0.5 מ"ל שברים.
- ודא אנקפסולציה SRB המוצלחת בריכוזים-רווה עצמית על ידי מדידת קרינת SRB לפני ואחרי תוספת של חומר ניקוי כדי aliquot של שלפוחית 16. באמצעות ספקטרומטר קרינה, להלהיב את המדגם ב 550 ננומטר ו לסרוק את פליטת SRB בין 570 ננומטר ו 630 ננומטר. צופה עליית 4-8 לקפל קרינת SRB בהתאם לכמות הכמוסה על תוספת חומר ניקוי כמו הקרום הוא solubilized ואת SRB שוחרר הוא מדולל.
- לאפיין את התאוששות שומנים וחלבונים באמצעות ספקטרוסקופיית קרינת 24 ו ג'ל אלקטרופורזה SDS-PAGE, בהתאמה. השתמש בשיטה מכתימה רגישה, במיוחד עבור דגימות t-SUV LP הגבוהה (ראה רשימת חומרים). בדרך כלל כ -50% הן קלט השומנים והחלבונים אבד במהלך תקופת ההכנה וכתוצאה מכך LP קרוב לערך הנקוב.
- לאפיין גדלים SUV באמצעות אור דינאמי פיזור 24 או אלקטרונים microscoפירו 48. SRB חנות המכילה ורכבי שטח נ ב 4 ° C עד ~ 3-4 ימים. אין להקפיא, כמו הקפאה להפשרה שוברת את הקרום ומשחרר SRB הכמוס.
4. SUV-SBL Assay Fusion לפקח שחרור ליפידים רק
- כינונה של bilayer הנתמך הקשור בתוך ערוצי זרימת microfluidic
- מניחים את גוש PDMS (שלב 1.11) תחת ואקום גבוה לפני 20 דקות לפחות כדי הניסוי להסיר גזים מומסים. זו מקטינה באופן משמעותי את הסיכון של בועות אוויר בתוך ערוצי microfluidic במהלך ניסוי ההיתוך.
- הפעל את ההתקנה מיקרוסקופ ומחמם במה בעל מדגם (איורים 3 ו -4) לטמפרטורה הרצויה.
- סנן את חיץ הכינון מחדש המשמש לדילול שלפוחית דרך פילטר עם גודל נקבובי 0.45 מיקרומטר או קטנים.
- לדלל ~ 30 μl של-PE NBD שכותרתו T-ורכבי שטח או ללא חלבון (PF-ורכבי שטח) ליפוזומים שליטה (מלאהפתרון 0.5-1 שומני מ"מ) עם ~ 60 μl של חיץ. הריכוז הסופי אינו קריטי כאן.
- דגה זו תערובת באמצעות מזרק 3 מ"ל. לחץ החוצה רוב באוויר מעל המדגם תוך החזקת המזרק במאונך. חותם את הקצה (מחט חינם) באמצעות סרט פרפין וליצור ואקום ידי משייך את הבוכנה. הקש על חבית מזרק כדי להאיץ degassing של הפתרון. חזור על תהליך זה כמה פעמים עד אין יותר בועות להתרחש כאשר ואקום מוחל.
- השתמש מחט מזרק בקוטר מעט גדול יותר הצינורות מחוברים אל בלוק PDMS אגרוף חור הכובע של צינור microcentrifuge. ודא כי פיסת פלסטיק האגרוף הוא לא בתוך הצינור כיוון שהוא עלול לסתום את הצינורות המחוברים כניסת ערוץ microfluidic מאוחר יותר.
- מלא את פתרון SUV degassed לתוך צינור microcentrifuge שיש לך חור במכסה ומניח אותו לתוך מחזיק על במת מיקרוסקופ כדי לאזן את טמפרטורת הסט.
- Plמסיים בהצטיינות coverslip ניקה בעבר (סעיף 2) ב שואב פלזמה ולהפעיל פלזמת אוויר למשך כ -5 דקות. שים את coverslip פלזמת מטופלים (צד מטופלים פונה כלפי מעלה) על גבי כמה רקמות נטולות מוך משמשים כרית.
- מורידים את נייר הכסף אלומיניום מהגוש PDMS degassed ומניחים הבלוק על גבי coverslip. בעת שימוש חוזר הבלוק PDMS לשים על ולנתק פיסת נייר דבק לצד ערוץ לנקות אותו. לחץ כלפי מטה על PDMS לחסום על coverslip באמצעות פינצטה כדי שתיצמד, אבל לא ללחוץ חזק מדי כמו הזכוכית עלולה להישבר.
- מניח את תא הזרימה התאסף לבמת מיקרוסקופ ולחבר את הצינורות אל מאגר SUV ואת משאבת המזרק, בהתאמה. קלטתי את coverslip אל הבמה (איור 3 ב).
- התחל aspirating ורכבי שטח ב 3 μl / min עד הפתרון ממלא את ערוצי לחלוטין (~ 2.25 מ"מ / sec עבור חתך ערוץ 75 מיקרומטר x 300 מיקרומטר). כאשר פתרונות לכל הערוצים מתחילים לנוע עד הצינורות דואר בצד היציאה, הקטן את זרימת 0.5 μl / min דגירה במשך 30-45 דקות.
שימו לב: בפעם בין פלזמה בטיפול שקופיות הזכוכית וזורמת רכבי השטח לתוך התעלה לא תעלה על 10-20 דקות כמו ההשפעה של הטיפול בפלזמה הוא חולף. - בדקו את ערוצי דליפה כלשהי. השתמש אובייקטיבי אוויר 10-20X להתבונן הקרינה NBD-PE מן טריקו או PF-ורכבי שטח NBD-PE המכיל. Excite NBD fluorophores באמצעות לייזר 488 ננומטר. הדלפות קשות לזהות באמצעות תאורה בשדה בהירה.
- לשים צינור עם חיץ כינון מחדש degassed לתוך המחזיק ולתת לאזן את טמפרטורת שינויים מהר ככל בטמפרטורה עלול לגרום למומים של SBL. עצור את הזרימה ולחכות ~ 1 דקות כדי לוודא את זרימת פסיק לחלוטין ואין בועות אוויר תהיה aspirated לתוך הצינור לפני מעבר צינורות הכניסה למאגר degassed.
- יש לשטוף את כל הערוצים עם חיץ degassed לשטוף רכבי שטח מאוגדים.
- לעבור higheמטרת r הגדלת TIRF (60X, שמן, NA 1.45-1.49) ולוודא כי bilayer נראה הומוגני והוא ללא פגמים בקנה מידה גדולה ברורים כגון כתמים כהים או tubules שומנים המתמשך מן SBL.
- בדקו את הנזילות של bilayer
- אם יחידת FRAP ייעודית אינה זמינה, או אם רצף FRAP לא ניתן לתכנת, אז נזילות הממברנה מבחן איכותיות כדלקמן.
- סגור את הסרעפת שדה לגודל קטן (~ 40 מיקרומטר קוטר) ולהתאים את עוצמת האור עירור 488 ננומטר באמצעות התוכנה (20-80 μW, או 15-60 NW / מיקרומטר 2) כדי להלבין את הקרינה-PE NBD ב החשוף אזור משמעותי, אבל לא לגמרי. במשך bilayer נוזל, על מצב יציב, את עוצמת הקרינה באמצע באזור החשוף צריכה להיות נמוכה יותר מאשר בקצוות, כמו מולקולות NBD-PE ללא פגע להיכנס לשטח החשוף מפוזרות מרחק מסוים לפני הלבנה. לעומת זאת, אם פני השטח-דבק Sנובס נכשל להתפוצץ, או מכל סיבה אחרת את bilayer הנתמך אינו נוזל, כל fluorophores באזור החשוף צריך להלבין.
הערה: ערך עוצמת ליזר בצעדים זה ובהמשך מקבל כנקודת התחלה מחוספסת צריך להיות מותאם במיוחד קבוצה של תנאים נתונים. - עצור את התאורה ולהתחיל את זה שוב כמה דקות מאוחר יותר כדי לאמת את התוצאות של מדידות מצב היציבות
- סגור את הסרעפת שדה לגודל קטן (~ 40 מיקרומטר קוטר) ולהתאים את עוצמת האור עירור 488 ננומטר באמצעות התוכנה (20-80 μW, או 15-60 NW / מיקרומטר 2) כדי להלבין את הקרינה-PE NBD ב החשוף אזור משמעותי, אבל לא לגמרי. במשך bilayer נוזל, על מצב יציב, את עוצמת הקרינה באמצע באזור החשוף צריכה להיות נמוכה יותר מאשר בקצוות, כמו מולקולות NBD-PE ללא פגע להיכנס לשטח החשוף מפוזרות מרחק מסוים לפני הלבנה. לעומת זאת, אם פני השטח-דבק Sנובס נכשל להתפוצץ, או מכל סיבה אחרת את bilayer הנתמך אינו נוזל, כל fluorophores באזור החשוף צריך להלבין.
- לתכנת רצף FRAP עבור מדידה כמותית יותר, אם אפשר. ראה קבצים משלימים והאגדה המקבילה לפרטים.
הערה: לפעמים ורכבי שטח תדבק על coverslip זכוכית, אך אינם מצליחים לפרוץ ויוצרים bilayer נוזל. אם זה קורה, יש לשטוף את ערוצי עם חיץ degassed הכינון מחדש המכיל 10 מ"מ Mg 2+ לעזור היווצרות bilayer תמכו. השתמש קרינה לבנה להעריך נזילות bilayer כמו 4.2. פעם bilayer נוזל נוצר, לשטוף עם Mg 2 + ללא recoחיץ תשס"ו.
- אם יחידת FRAP ייעודית אינה זמינה, או אם רצף FRAP לא ניתן לתכנת, אז נזילות הממברנה מבחן איכותיות כדלקמן.
- היכרות נ-ורכבי שטח לתוך ערוצי הזרימה microfluidic
- דגת כינון חיץ ולהשתמש בו כדי לדלל את פתרון המניות נ-SUV בפקטור של כ -10 3 ל 10 5 תלויים בריכוז המניות נ-SUV. כוון דילול שתוצאתו על 10-100 אירועי היתוך בתוך 60 שניות ב שדה הראייה.
הערה: יותר מדי בשילובים להגדיל את קרינת הרקע (כי כל PE-LR פיקדונות אירוע או עושים תוויות שומנים לתוך SBL) ולעשות זיהוי וניתוח של אירועי היתוך קשה. לעומת זאת, שיעור היתוך כי הוא תוצאות נמוכות מדי בסטטיסטיקה עניה או דורש רכישה של סרטים רבים יותר. ריכוז v-SUV של השומנים 0.1 מ"מ, להתחיל על ידי דילול 5 μl המניות SUV חיץ 995 μl הכינון מחדש ואז לדלל 5-50 μl של זה במאגר הכינון מחדש 950-995 μl. - בואו טמפרטורה לאזן לפני הפסקת הזרימה inserטינג את צינור היניקה לתוך תמיסת נ-SUV המדולל.
- התאם את הזווית TIRF וקיטוב כדלקמן.
- לאחר הגדרת הקיטוב הרצוי על ידי החלפה של קרן עירור, לכוונן את הטיית המראה שפיקד על ומיקום הקרן באמצעות מנוע צעד באמצעות התוכנה. לאט לאט להזיז את המיקום של קרן לייזר ממרכז המטרה במישור המוקד האחורי לצד אחד מחוץ למרכז. שים לב בין האור ובין האובייקטיבי על הצד הקדמי לצאת עם זווית הגדלה ביחס לצייר מטרה כעמדה מועברת נוספת מחוץ למרכז.
- הערת מיקום המנוע כאשר קורה היציאה נעלם ראשון לתוך המטרה, כלומר, כאשר TIR המושגת ראשונה.
- לאט להמשיך לנוע עמדת קרן נוספת מחוץ למרכז תוך ניטור הקרינה מפני השטח. הערת מיקום המנוע כאשר קרינת המשטח נעלמת כאשר הקורה עבר רחוק מדי מחוץ למרכז.
- בחר positio קרן n בין שני במגבלות שקבע לעיל. עבור יחס אות לרעש הטוב ביותר והשבחת אות יותר על היתוך, לבחור עומק חדירה רדוד (מיקום קורה קרוב יותר לקצה של אובייקטיבי) כי עדיין מספק תאורה אחידה של viewfield.
הערה: עדיף לשמור על אותו בעמדה קרן טיר (עומק החדירה אותו) עבור כל הניסויים לאחר הגדרות מותאמות. ודא סיבוב הקיטוב אינו לגרום לשינויים במצב קורה.
- הזרימה ורכב שטח נ לתוך התעלה בקצב זרימה של 2 μl / min, המתאימה למהירות זרימה ליניארי ממוצעת של ~ 1.5 מ"מ / sec עבור חתך של 75 מיקרומטר x 300 מיקרומטר. החלף ל הגדרות עירור / פליטה לפקח השומנים ערבוב (LR או שמא רק).
- דגת כינון חיץ ולהשתמש בו כדי לדלל את פתרון המניות נ-SUV בפקטור של כ -10 3 ל 10 5 תלויים בריכוז המניות נ-SUV. כוון דילול שתוצאתו על 10-100 אירועי היתוך בתוך 60 שניות ב שדה הראייה.
- היתוך התבוננות בין רכבי שטח-נ יחיד ואת SBL
.jpg "/>
איור 3. התקנת pTIRF ניסיון. (א) ייצוג סכמטי של נ-SUV וחולצת SBL על מצע זכוכית. תמונות TIRFM False-צבע של אירוע פיוז'ן יחיד SUV-SBL מראות עגינת שומני בדם (1) ושחרור לצבוע שומנים לתוך SBL (2) ואחריו הלבנת ירידה של עוצמת הקרינה (3). עוצמת הקרינה הכוללת (סכום הערכים פיקסל 5.3 מיקרומטר x 5.3 מיקרומטר מסגרת) האות מוצגת. (ב) coverslip מלוכדת לבלוק PDMS הוא מודבק לבמה המחוממת. צינור היניקה עבור ערוצי microfluidic לצייר דוגמאות מהצינור במחזיק המתכת מדגם (מימין) aspirated ידי משאבת מזרק (משמאל). מתחת למשאבה היא יחידת הפליטה הכפולה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
oad / 54,349 / 54349fig4.jpg "/>
איור 4. סכמטי של הגדרת הניסוי. הגל החולף נוצר על הממשק-חיץ זכוכית בערוץ microfluidic. SBL נוצר על הזכוכית נ-SUV הוא aspirated מבעל מתכת המדגם (מימין למעלה) דרך הערוץ לתוך המזרק (למעלה משמאל). M, במראה; DM, מראה dichroic; L, עדשה; F, מסנן; P, מקטב. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- ברציפות לרגש לפקח הקרינה נ-SUV באמצעות ננומטר 561 (עבור LR-PE) או 638 ננומטר (עבור DID) לייזר תלוי fluorophore המאוגדת-ורכבי שטח נ. כמו-ורכבי שטח נ להגיע ערוץ הזרימה ואת המזח על פיוז עם SBL, אות קרינת רקע מתחילה לצבור.
- התאם את עוצמת הלייזר עירור באמצעות התוכנה כדי להלבין ברקע ברציפותקרינה כך באירועי עגינה ואיחוי חדשים מצב יציבים ניתן לצפות בקלות.
הערה: אם הלבנה היא איטית מדי, קרינת רקע תהיה גבוהה מדי. אם הלבנה היא מהירה מדי, אותות שמקורו ברכבי שטח עגן ומן fluorophores מתפזרת SBL יימוגו במהירות, הקטנת החלון שבמהלכה ההיתוך של רכבי שטח עגנה ניתן לאתר או fluorophore ניתן לעקוב. לקבלת LR-PE נרגש ב -561 ננומטר, 2.5-7.5 כוח mW ומאיר עיגול בקוטר 190 מיקרומטר (100-250 NW / מיקרומטר 2) הוא ערך סביר להתחיל. עבור 638 ננומטר עירור של האם, 0.8-1.6 כוח mW מעל עיגול בקוטר 190 מיקרומטר (30-60 NW / מיקרומטר 2) יכול לשמש לבדיקות ראשוניות. - רוכש בכמה סרטים בנקודות שונות בתוך ערוץ נתון. בדוק קרינת NBD-PE כדי לוודא כי SBL אין פגמים בעמדות אלה. רוכשת סרטי מסגרת מלאה בשיעור המרבי (~ 50 מסגרות / השני) או אזור קצוץ של ריבית בשיעור פריים גבוה יותר (עד~ 100 הרץ) למשך 60 שניות.
- לעבור עוד ערוץ microfluidic וחזור הקלטות תנאים אחרים. כלול בקרות שליליות כגון SBL או רכבי שטח חלבון ללא, להוסיף את הדומיין cytoplasmic המסיס נ-Snare VAMP2 (CDV) כמעכב או לטפל-SUV נ עם עצבי טטנוס (30 דקות ב 37 מעלות צלזיוס) באחד או יותר הערוצים על אותו coverslip.
- לנקות ומיחזור PDMS
- על מנת לעשות שימוש חוזר הבלוק PDMS, יש לשטוף את ערוצי microfluidic עם ~ 200 μl של אתנול 70% בקצב זרימה של 5 μl / דקה. לבסוף, לשאוב אוויר דרך הצינורות והתעלות.
- לנתק את PDMS לחסום בעדינות מן coverslip ידי לחיצות קלות. מניח אותו על פיסה נקיה של נייר אלומיניום. אחסן ייבוש ואקום. זה ניתן לעשות שימוש חוזר מספר פעמים.
- לניקוי יסודי יותר לשטוף את הערוצים עם פתרון הידרוקסיד חומר ניקוי או נתרן לפני אתנול 70%. לחילופין, להסיר את כל צינורות הלוך ושוב מ 'PDMS ו sonicate הבלוק למשך 30 דקות ב isopropanol, לפני ייבוש החדרת צינורות חדשים.
5. SUV-SBL Assay Fusion לפקח שחרור ליפידים ותוכן במקביל
- עבור ניטור צבע כפול של השומנים סימולטני ותכנים מסיסים לשחרר, חזרו על אותן הפעולות כאמור בסעיף 4, למעט ליפוזומים שימוש שכותרתו עם שני השומנים (DID) וכן תוכן מסיסים (SRB) התווית, כפי שהוסבר בסעיף 3. SRB הוא כמוס ב 10 מ"מימ והוא בתחילה פערים רווים עצמי.
- שימוש בתצורה הראו באופן סכמטי באיור 4, לרגש SRB ועשה הקרינה בו זמנית באמצעות 561 ננומטר 638 nm לייזרים, בהתאמה. מראה dichroic (640 ננומטר) ומחלק את הפליטה לשתי קורות שמופעלות באמצעות (ננומטר 595/50) קצר ארוך (700/75 ננומטר) מסנן אורכי גל כדי לזהות את SRB ועשה פליטות, בהתאמה. שתי אלומות הפליטה מוקרנות Side-by-side על שבב EM-CCD.
- ניתוח של נתוני FRAP
- השתמש בתוכנית MATLAB מסופק במידע משלים להעריך את מקדם הדיפוזיה השומנים, D. התכנית קוראה את רשימת הקבצים שתו-TIFF 49, מזהה באזור המולבן, מגרשי ערכי פיקסל מתכוון באזור המולבן כפונקציה של זמן, ומתאימה את עקומת התאוששות וכתוצאה מכך למודל ידי Soumpasis 50 כדי לחלץ את זמן ההחלמה,
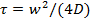 שם, w הוא רדיוס המעגל המולבן.
שם, w הוא רדיוס המעגל המולבן.
הערה: תוכנית MATLAB סופק קודם לכן 25 לניתוח של סרטים FRAP באמצעות קבצי ND2 ניקון. התכנית הנוכחית קוראה שת-TIFF קבצי 49, כי רוב פורמטי קבצים ניתן להמיר בקלות שת-TIFF. ניתוח כמותי של נתוני FRAP הכי והמדויק ביותר כאשר ההלבנה הוא מיידית, את bleacבאזור הד הוא מעגל, לבן במהלך-אאוט לקרוא זניח. אף על פי שקריטריונים אלה אינם מרוצים ורק מדידות FRAP פשוט המתואר כאן, אומדן סביר של מקדם הדיפוזיה ניתן להשיג. לקבלת אומדן מדויק יותר, להשתמש במעקב של צבעי שומנים יחידים (סעיף 6.3).
- השתמש בתוכנית MATLAB מסופק במידע משלים להעריך את מקדם הדיפוזיה השומנים, D. התכנית קוראה את רשימת הקבצים שתו-TIFF 49, מזהה באזור המולבן, מגרשי ערכי פיקסל מתכוון באזור המולבן כפונקציה של זמן, ומתאימה את עקומת התאוששות וכתוצאה מכך למודל ידי Soumpasis 50 כדי לחלץ את זמן ההחלמה,
- ניתוח של שיעור עגינה, שיעור פיוז'ן עגינה ל-היתוך פעמים עיכוב
- השתמש ImageJ לפתוח סרט לנתח ולהתאים הבהירות והניגודיות לזהות עגינה שלפוחית בבירור ואירועים פיוזינג. הפעל את תוסף 26 SpeckleTrackerJ. ראה סמית et al. 26 ותיעוד מקוון עבור SpeckleTrackerJ לקבלת הוראות לשימוש.
- לזהות את כל רכבי השטח חדש עגן SpeckleTrackerJ. כדי להבחין רכבי שטח כי לעגון בחוזקה מאלו ומוחזרות SBL, להטיל משך עגינת מינימום של כמה מסגרות. שמור את המסלולים, וחזור עבור כל הסרטים.
הערה: עבור docמלך שיעור, כל מה שחשוב הוא לזהות כאשר עגנה רכב שטח, אז רק את המסגרת הראשונה שבה ורכבי שטח עגנה הצרכים שיירשמו במסלולים אלה. שאר המסלולים לא יילקח בחשבון בניתוח. עם זאת, אוטומטי ומעקב אחר כל SUV עד לבנה או נתיכים עוזר רכבי שטח סימן שכבר במעקב. - לזהות את כל שלפוחית פיוזינג. עבור אלה, הפסים צריכים לכלול את כל המסגרות של המסגרת הראשונה רכב שטח עגן עד המסגרת הראשונה שבה ההיתוך ניכר ידי עלייה פתאומית הקרינה של הנקודה במעקב. משכי הזמן של מסלולים אלה משמשים כדי לחשב את עיכובי עגינה ל-פיוז'ן. שמור את כל הרצועות. חזור על הפעולה עבור כל הסרטים.
- לניתוח אצווה של נתוני עגינה או היתוך, ליצור רשימה של קבצים מסלולים מהסרטים הרלוונטיים ולהפעיל את תוכניות MATLAB מסופקות עם Karatekin ורוטמן 25. פעל בהתאם להוראות המופיעות בה יחד עם התוכניות.
הערה: תוכניות עלילה בהצטיינותאירועי עגינה ואיחוי ulative כפונקציה של זמן, בהתבסס על מידע המופק קבצי המסלול. שיעורי עגינה ואיחוי נאמדים מהמורדות חלקות אלה. לקבלת נתונים היתוך, העיכובים עגינה ל-היתוך מחושבים גם והפצתם זממו כמזימה הישרדות, דהיינו, ההסתברות כי היתוך לא קרה עדיין ע"י עיכוב שניתנו לאחר העגינה.
- diffusivity ליפידים
- עבור כל אירוע היתוך, לעקוב שומני פלורסנט בודדים כאשר הם הופכים להבחין כאשר הם מתפזרים מספיק ממקום ההיתוך (איור 6). השתמש SpeckleTrackerJ למעקב, ולשמור את המסלולים לניתוח נוסף באמצעות MATLAB. בהתאם לגודל של שלפוחית פיוזינג, בדרך כלל 3-30 fluorophores יחיד יכול להיות במעקב. בגלל שירים כבר רצויים לחישוב
 , מנסה לעקוב אחר מולקולות בודדות כל עודככל האפשר, באמצעות תיקון של מסלולים ידניים במידת צורך.
, מנסה לעקוב אחר מולקולות בודדות כל עודככל האפשר, באמצעות תיקון של מסלולים ידניים במידת צורך. - לחשב את הממוצע בריבוע עקירה (MSD) עבור מסלולי סמן שומנים יחידים שנמשכים> 40-50 מסגרות (כ ~ 1.5 שניות). השתמש MSD לחשב את מקדם הדיפוזיה שומנים,
 . ראה סמית et al. 26 סטראטון et al. 27 לפרטים.
. ראה סמית et al. 26 סטראטון et al. 27 לפרטים.
- עבור כל אירוע היתוך, לעקוב שומני פלורסנט בודדים כאשר הם הופכים להבחין כאשר הם מתפזרים מספיק ממקום ההיתוך (איור 6). השתמש SpeckleTrackerJ למעקב, ולשמור את המסלולים לניתוח נוסף באמצעות MATLAB. בהתאם לגודל של שלפוחית פיוזינג, בדרך כלל 3-30 fluorophores יחיד יכול להיות במעקב. בגלל שירים כבר רצויים לחישוב
- עוצמת צבע שומנים יחידה, מקדם הפחתה בעוצמת SUV-SBL, וגודל שלפוחית
- מדוד את סכום הערכים פיקסל של סמן שומנים באזור 3 x 3 פיקסל (0.8 מיקרומטר x 0.8 מיקרומטר) ברחבי הסמן ~ 15 מסגרות לפני ואחרי לבנת סמן אחד צעד. הפחת את עוצמת רקע בממוצע לכל המסגרות שלאחר אקונומיקה מעוצמת מראש אקונומיקה בממוצע לפני הלבנת להשיג את עוצמת סמן השומנים במעקב. חזור על המדידה עבור סמנים רבים ככל מעשית נתון סרט.
- מגרש חלוקת עוצמת תווית שומנים יחידים,
 , ו להתאים גאוס להעריך את הממוצע.
, ו להתאים גאוס להעריך את הממוצע. - חשב את ההשהיה בין כאשר ההיתוך התרחש כאשר מסלולו של סמן שומנים הסינגל באירוע שהסתיים הלבנה בשלב יחיד. השג את זמן ההלבנה עבור fluorophore בבית SBL,
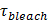 , על ידי התוויית ניצול הפונקציה של העיכובים והולמים ל מעריכים.
, על ידי התוויית ניצול הפונקציה של העיכובים והולמים ל מעריכים.
הערה: מאחר זוגות שדה עירור המקוטבים יותר חלוש כדי fluorophores על רכב שטח, בפעם הלבנה של SUV הוא בדרך כלל הרבה יותר איטית 27. - לְהַעֲרִיך
 , הגורם לירידה בעוצמת עבור צבע שומנים כאשר יחסית SUV כאשר הוא נמצא SBL, בעקבות סטראטון 27 (tp_upload / 54,349 / 54349eq8.jpg "/>
, הגורם לירידה בעוצמת עבור צבע שומנים כאשר יחסית SUV כאשר הוא נמצא SBL, בעקבות סטראטון 27 (tp_upload / 54,349 / 54349eq8.jpg "/>  העוצמה היא של צבע יחיד SUV).
העוצמה היא של צבע יחיד SUV).
הערה: אם לבן היו זניחים, יהיה שווה את עוצמת עגנה
יהיה שווה את עוצמת עגנה 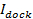 (נקודה (1) באיור 3A, פנל מימין), מחולק מהעוצמת הכוללת הגיעה אחרי הכל fluorophores מופקדת לתוך SBL על היתוך (קו מקווקו שכותרתו
(נקודה (1) באיור 3A, פנל מימין), מחולק מהעוצמת הכוללת הגיעה אחרי הכל fluorophores מופקדת לתוך SBL על היתוך (קו מקווקו שכותרתו 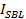 באיור 3). עם זאת, בשל הלבנה מהירה SBL,
באיור 3). עם זאת, בשל הלבנה מהירה SBL, 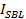 בדרך כלל לא הוא הגיע אומדן מדויק של
בדרך כלל לא הוא הגיע אומדן מדויק של  דורש הולם קינטיקה השחרור כדי ביטוי 27 כי כולל udes הוא
דורש הולם קינטיקה השחרור כדי ביטוי 27 כי כולל udes הוא 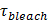 (ראה 6.4.3) ו
(ראה 6.4.3) ו  . ביטויים נפרדים ניתנים סטרטון ואח 27 למקרים של קינטיקה שחרור הנקבוביות-מוגבל דיפוזיה מוגבלת.; במקרה בכושר הטוב ביותר משתנה מאירוע לאירוע (ראה 6.5.1 עבור המקרה של קינטיקה המוגבלת הנקבובית).
. ביטויים נפרדים ניתנים סטרטון ואח 27 למקרים של קינטיקה שחרור הנקבוביות-מוגבל דיפוזיה מוגבלת.; במקרה בכושר הטוב ביותר משתנה מאירוע לאירוע (ראה 6.5.1 עבור המקרה של קינטיקה המוגבלת הנקבובית). - לחשב את שטח השלפוחית לאירועים פרטיים מ -27
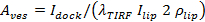 , איפה
, איפה 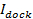 היא עוצמת SUV עגנה,
היא עוצמת SUV עגנה,  הוא מתכוון עוצמת צבע שומנים יחיד SBL,
הוא מתכוון עוצמת צבע שומנים יחיד SBL,  הוא מקדם הפחתה בעוצמת עבור צבע שומנים כאשר הוא נמצא ביחס SUV כאשר הוא נמצא SBL, ו1 ation "src =" / files / ftp_upload / 54,349 / 54349eq12.jpg "/> היא הצפיפות האזורית הידועה של צבעי שומנים.
הוא מקדם הפחתה בעוצמת עבור צבע שומנים כאשר הוא נמצא ביחס SUV כאשר הוא נמצא SBL, ו1 ation "src =" / files / ftp_upload / 54,349 / 54349eq12.jpg "/> היא הצפיפות האזורית הידועה של צבעי שומנים.
- מאפיינים נקבוביים Fusion
- בהנחת שחרורו היא נקבובית מוגבל, להתאים את קינטיקה שחרור תווית שומנים ל -27
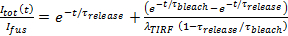 , איפה
, איפה 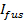 היא עוצמת SUV עגנה רק לפני היתוך ואת הפרמטרים האחרים כהגדרתו קודם לכן. השתמש ערך
היא עוצמת SUV עגנה רק לפני היתוך ואת הפרמטרים האחרים כהגדרתו קודם לכן. השתמש ערך 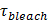 שהושג 6.4.3 כפרמטר קבוע, ולחלץ את הערכות בכושר הטובות ביותר עבור
שהושג 6.4.3 כפרמטר קבוע, ולחלץ את הערכות בכושר הטובות ביותר עבור  ו
ו  .
. - להעריך את החלק היחסי של זמן הנקבובי פתוח, P 0, פיגור בהנחה של שחרור שומנים נובע נקבובי מהבהב 27:60;
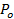 =
= 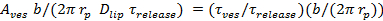 , כאשר A ves הוא אזור השלפוחית (הסעיף 6.4.5), b הוא הגובה הנקבובי (נלקח בדרך כלל להיות ~ 15 ננומטר), r p ≈ 3 ננומטר הוא הרדיוס הנקבובי היעיל כפי שניתן לראות על ידי תוויות שומנים לשדר וכולל חצי עובי bilayer (~ 2 ננומטר),
, כאשר A ves הוא אזור השלפוחית (הסעיף 6.4.5), b הוא הגובה הנקבובי (נלקח בדרך כלל להיות ~ 15 ננומטר), r p ≈ 3 ננומטר הוא הרדיוס הנקבובי היעיל כפי שניתן לראות על ידי תוויות שומנים לשדר וכולל חצי עובי bilayer (~ 2 ננומטר),  הוא diffusivity השומנים (מחושב 6.3), ו
הוא diffusivity השומנים (מחושב 6.3), ו  הזמן הוא עבור השומנים להשתחרר מתוך הרכב לתוך SBL (מ 6.5.1).
הזמן הוא עבור השומנים להשתחרר מתוך הרכב לתוך SBL (מ 6.5.1). - כדי לאשר כי P הנומינלי 0> 1 מצביע על נקבוביות פתוחות לחלוטין, P 0 = 1, להתאים את הקורס בעוצמה זמן למשוואה 4 של סטרטון et al. 27, קינטיקה ניבאו נקבובית פתוח באופן קבוע. בכושר זה אמור להיות טוב יותר מאשר fitting את הביטוי 6.5.1 עבור נקבובית פתוחה באופן קבוע.
- בהנחת שחרורו היא נקבובית מוגבל, להתאים את קינטיקה שחרור תווית שומנים ל -27
תוצאות
איכות SBL
זה חיוני כדי לוודא את האיכות ובזרימה של SBL לפני ניסוי ההיתוך. הקרינה בצד התחתונה, כוס ערוץ microfluidic צריכה להיות אחידה, ללא כל פגם נראה לעין. אם בועת אוויר עוברת אף את הערוץ, זה ב...
Discussion
יישום מוצלח של assay היתוך SUV-SBL המתואר כאן תלוי באופן קריטי על צעדים מרכזיים, כגון כינון מחדש תפקודי של חלבונים לתוך ליפוזומים, קבלת SBLs באיכות טובה, ובחירת פרמטרי הדמית הזכות לזהות מולקולות בודדות. למרות שזה עשוי לקחת קצת זמן ומאמץ כדי להצליח, לאחר assay מיושמת בהצלחה, הוא ?...
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
We thank Vladimir Polejaev (Yale West Campus Imaging Core) for the design and construction of the polarized TIRF microscope, David Baddeley (Yale University) for help with two-color detection instrumentation, and James E. Rothman (Yale University) and Ben O'Shaughnessy (Columbia University) and members of their groups for stimulating discussions. EK is supported by a Kavli Neuroscience Scholar Award from the Kavli Foundation and NIH grant 1R01GM108954.
Materials
| Name | Company | Catalog Number | Comments | |
| Reagents | ||||
| Milli-Q (MQ) water | Millipore | |||
| KOH | J.T. Baker | 3040-05 | ||
| Ethanol 190 Proof | Decon | |||
| Isopropanol | Fisher Chemical | A416P4 | ||
| HEPES | AmericanBio | AB00892 | ||
| Sodium Cholride (KCl) | AB01915 | |||
| Dithiothreitol | AB00490 | |||
| N-[2-hydroxyethyl] piperazine-N'-[2-ethanesulfonic acid] (HEPES) | AmericanBio | AB00892 | ||
| EGTA | Acros Organics | 409911000 | ||
| Buffers | ||||
| HEPES-KOH buffer (pH 7.4) | 25 mM HEPES-KOH, 140 mM KCl, 100 μM EGTA, 1 mM DTT | |||
| Solvents | ||||
| Chloroform | J.T. Baker | 9180-01 | in glass bottle, CAUTION, wear PPE | |
| Methanol | J.T. Baker | 9070-03 | in glass bottle, CAUTION, wear PPE | |
| Liposome preparation | ||||
| Gastight Hamilton syringe | Hamilton | var. sizes | only use glass sringe with solents (Chlorophorm/ Methanon, 2:1, v/v) | http://www.hamiltoncompany.com |
| Glass tubes Pyrex Vista 11 ml, 16x100 mm screw cap culture tube | Pyrex | 70825-16 | clean thoroughly, rinse with chloroform | http://catalog2.corning.com/LifeSciences/ |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine, 16:0-18:1 PC (POPC) | Avanti Polar Lipids | 850457 | Lipids come dissolved in CHCl3 or as lyphilized powder in sealed vials. Aliquot upon opening. Store extra as dried lipid films under inert atmosphere at -20 °C. Keep stocks in CHCl3/MeOH (2:1, v/v) at -20 °C. let come to RT before opening | http://www.avantilipids.com/ |
| 1,2-dioleoyl-sn-glycero-3-phospho-L-serine (sodium salt), 18:1 PS (DOPS) | 840035 | |||
| 1-stearoyl-2-arachidonoyl-sn-glycero-3-phosphoethanolamine, 18:0-20:4 PE (SAPE) | 850804 | |||
| L-α-phosphatidylinositol-4,5-bisphosphate (Brain, Porcine) (ammonium salt), Brain PI(4,5)P2 | 840046 | |||
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (ammonium salt), 18:1 NBD PE | 810145 | |||
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt), 18:1 PEG2000 PE | 880130 | |||
| cholesterol (ovine wool, >98%) | 700000 | |||
| DiD' oil; DiIC18(5) oil (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindodicarbocyanine Perchlorate) | Molecular Probes | D-307 | https://www.thermofisher.com/ | |
| Rotavapor R-210 | Buchi | R-210 | heat bath above Tm of lipids used | http://www.buchi.com/ |
| OG n-Octyl-β-D-Glucopyranoside | Affymetrix | 0311 | store at -20°C, let come to RT before opening | https://www.anatrace.com/ |
| Shaker - Eppendorf Thermomixer R | Eppendorf | https://www.eppendorf.com/ | ||
| Slide-A-Lyze Dialysis Cassettes, 20K MWCO, 3 mL | life technologies | 66003 | https://www.lifetechnologies.com/ | |
| Bio-Beads SM-2 Adsorbents | Bio-Rad | 1523920 | http://www.bio-rad.com/ | |
| OptiPrep Density Gradient Medium | Sigma-Aldrich | D1556 | http://www.sigmaaldrich.com/ | |
| Ultracentrifugation tube, Thinwall, Ultra-Clear, 13.2 mL, 14 x 89 mm | Beckman Coulter | 41121703 | https://www.beckmancoulter.com/ | |
| Beckman SW41 Ti rotor | ||||
| SuflorhodamineB | Molecular Probes | S-1307 | https://www.thermofisher.com/ | |
| Econo-Column Chromatography Columns, 2.5 × 10 cm | Bio-Rad | 7372512 | http://www.bio-rad.com/ | |
| Sepharose CL-4B | GE Healthcare | 17-0150-01 | http://www.gelifesciences.com/ | |
| SYPRO Orange Protein Gel Stain | Molecular Probes | S-6650 | 5,000X Concentrate in DMSO | https://www.lifetechnologies.com/ |
| PDMS block | ||||
| Sylgard 184 Silicone elastomer kit, PDMS | Dow Corning | 3097358-1004 | http://www.dowcorning.com/ | |
| Pyrex glass petri dish, 150 x 20 mm, complete with cover | Corning | 3160-152 | http://catalog2.corning.com/LifeSciences/ | |
| Hole puncher - Reusable Biopsy Punch, 0.75mm | World Precision Instruments | 504529 | http://www.wpi-europe.com/ | |
| Manual Hole Punching Machine | SYNEO | MHPM-UNV | http://www.syneoco.com/ | |
| Drill .035 x .026 x 1.5 304 SS TiN coated round punch | CR0350265N20R4 | drill diameter: 0.9 mm | ||
| Tygon Microbore tubing, 0.25 mm ID, 0.76 mm OD | Cole-Parmer | 06419-00 | 0.010" ID, 0.030" OD | http://www.coleparmer.com/ |
| Silicone Tubing (0.51 mm ID, 2.1 mm OD | 95802-00 | 0.020" ID, 0.083" OD | ||
| Cover glass - cleanroom cleaned | ||||
| Schott Nexterion cover slip glass D | Schott | 1472305 | http://www.us.schott.com/ | |
| plasma cleaner | Harrick | PDC-32G | http://harrickplasma.com/ | |
| pTIRF setup and accessories | ||||
| IX81 microscope body | Olympus | IX81 | http://www.olympus-lifescience.com/en/ | |
| EM CCD camera | Andor | ixon-ultra-897 | http://www.andor.com/ | |
| Thermo Plate, heated microscope stage | Tokai Hit | MATS-U52RA26 | http://www.tokaihit.com/ | |
| 1 ml hamilton glass syringes (4x) | Hamilton | 81365 | http://www.hamiltoncompany.com | |
| syringe pump | kd Scientific | KDS-230 | http://www.kdscientific.com/ |
References
- Sudhof, T. C., Rothman, J. E. Membrane fusion: grappling with SNARE and SM proteins. Science. 323, 474-477 (2009).
- Wickner, W., Schekman, R. Membrane fusion. Nat Struct Mol Biol. 15, 658-664 (2008).
- Harrison, S. C. Viral membrane fusion. Nat Struct Mol Biol. 15, 690-698 (2008).
- Jahn, R., Scheller, R. H. SNAREs--engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Lindau, M., Alvarez de Toledo, G. The fusion pore. Biochim Biophys Acta. 1641, 167-173 (2003).
- Staal, R. G., Mosharov, E. V., Sulzer, D. Dopamine neurons release transmitter via a flickering fusion pore. Nat Neurosci. 7, 341-346 (2004).
- Wu, Z., et al. Nanodisc-cell fusion: Control of fusion pore nucleation and lifetimes by SNARE protein transmembrane domains. Sci. Rep. 6, 27287 (2016).
- Alabi, A. A., Tsien, R. W. Perspectives on kiss-and-run: role in exocytosis, endocytosis, and neurotransmission. Ann Rev Physiol. 75, 393-422 (2013).
- Rossetto, O., Pirazzini, M., Montecucco, C. Botulinum neurotoxins: genetic, structural and mechanistic insights. Nature Rev Microbiol. 12, 535-549 (2014).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Nickel, W., et al. Content mixing and membrane integrity during membrane fusion driven by pairing of isolated v-SNAREs and t-SNAREs. Proc Natl Acad Sci U S A. 96, 12571-12576 (1999).
- McNew, J. A., et al. Compartmental specificity of cellular membrane fusion encoded in SNARE proteins. Nature. 407, 153-159 (2000).
- Melia, T. J., You, D. Q., Tareste, D. C., Rothman, J. E. Lipidic antagonists to SNARE-mediated fusion. J Biol Chem. 281, 29597-29605 (2006).
- Hernandez, J. M., et al. Membrane fusion intermediates via directional and full assembly of the SNARE complex. Science. 336, 1581-1584 (2012).
- Fix, M., et al. Imaging single membrane fusion events mediated by SNARE proteins. Proc Natl Acad Sci U S A. 101, 7311-7316 (2004).
- Bowen, M. E., Weninger, K., Brunger, A. T., Chu, S. Single molecule observation of liposome-bilayer fusion thermally induced by soluble N-ethyl maleimide sensitive-factor attachment protein receptors (SNAREs). Biophys J. 87, 3569-3584 (2004).
- Liu, T., Tucker, W. C., Bhalla, A., Chapman, E. R., Weisshaar, J. C. SNARE-driven, 25-millisecond vesicle fusion in vitro. Biophys J. 89, 2458-2472 (2005).
- Yoon, T. Y., Okumus, B., Zhang, F., Shin, Y. K., Ha, T. Multiple intermediates in SNARE-induced membrane fusion. Proc Natl Acad Sci U S A. 103, 19731-19736 (2006).
- Diao, J., et al. A single-vesicle content mixing assay for SNARE-mediated membrane fusion. Nat Commun. 1, 1-6 (2010).
- Kyoung, M., et al. In vitro system capable of differentiating fast Ca2+-triggered content mixing from lipid exchange for mechanistic studies of neurotransmitter release. Proc Natl Acad Sci U S A. 108, E304-E313 (2011).
- Domanska, M. K., Kiessling, V., Stein, A., Fasshauer, D., Tamm, L. K. Single vesicle millisecond fusion kinetics reveals number of SNARE complexes optimal for fast SNARE-mediated membrane fusion. J Biol Chem. 284, 32158-32166 (2009).
- Kreutzberger, A. J., Kiessling, V., Tamm, L. K. High Cholesterol Obviates a Prolonged Hemifusion Intermediate in Fast SNARE-Mediated Membrane Fusion. Biophys J. 109, 319-329 (2015).
- Schwenen, L. L., et al. Resolving single membrane fusion events on planar pore-spanning membranes. Sci Rep. 5, 12006 (2015).
- Karatekin, E., et al. A fast, single-vesicle fusion assay mimics physiological SNARE requirements. Proc Natl Acad Sci U S A. 107, 3517-3521 (2010).
- Karatekin, E., Rothman, J. E. Fusion of single proteoliposomes with planar, cushioned bilayers in microfluidic flow cells. Nat Protoc. 7, 903-920 (2012).
- Smith, M. B., et al. Interactive, computer-assisted tracking of speckle trajectories in fluorescence microscopy: application to actin polymerization and membrane fusion. Biophys J. 101, 1794-1804 (2011).
- Stratton, B. S., et al. Cholesterol Increases the Openness of SNARE-mediated Flickering Fusion Pores. Biophysical journal. 110, (2016).
- Diao, J., et al. Synaptic proteins promote calcium-triggered fast transition from point contact to full fusion. Elife. 1, e00109 (2012).
- Kiessling, V., Domanska, M. K., Tamm, L. K. Single SNARE-mediated vesicle fusion observed in vitro by polarized TIRFM. Biophys J. 99, 4047-4055 (2010).
- Blasi, J., et al. Botulinum neurotoxin A selectively cleaves the synaptic protein SNAP-25. Nature. 365, 160-163 (1993).
- Washbourne, P., et al. Genetic ablation of the t-SNARE SNAP-25 distinguishes mechanisms of neuroexocytosis. Nat Neurosci. 5, 19-26 (2002).
- Diaz, A. J., Albertorio, F., Daniel, S., Cremer, P. S. Double cushions preserve transmembrane protein mobility in supported bilayer systems. Langmuir. 24, 6820-6826 (2008).
- Floyd, D. L., Ragains, J. R., Skehel, J. J., Harrison, S. C., van Oijen, A. M. Single-particle kinetics of influenza virus membrane fusion. Proc Natl Acad Sci U S A. 105, 15382-15387 (2008).
- Albertorio, F., et al. Fluid and air-stable lipopolymer membranes for biosensor applications. Langmuir. 21, 7476-7482 (2005).
- Daniel, S., Albertorio, F., Cremer, P. S. Making lipid membranes rough, tough, and ready to hit the road. Mrs Bulletin. 31, 536-540 (2006).
- Gao, Y., et al. Single reconstituted neuronal SNARE complexes zipper in three distinct stages. Science. 337, 1340-1343 (2012).
- Kenworthy, A. K., Hristova, K., Needham, D., Mcintosh, T. J. Range and Magnitude of the Steric Pressure between Bilayers Containing Phospholipids with Covalently Attached Poly(Ethylene Glycol). Biophys J. 68, 1921-1936 (1995).
- Knoll, W., et al. Solid supported lipid membranes: New concepts for the biomimetic functionalization of solid surfaces. Biointerphases. 3, Fa125-Fa135 (2008).
- Quinn, P., Griffiths, G., Warren, G. Density of newly synthesized plasma membrane proteins in intracellular membranes II. Biochemical studies. J Cell Biol. 98, 2142-2147 (1984).
- Sund, S. E., Swanson, J. A., Axelrod, D. Cell membrane orientation visualized by polarized total internal reflection fluorescence. Biophys J. 77, 2266-2283 (1999).
- Johnson, D. S., Toledo-Crow, R., Mattheyses, A. L., Simon, S. M. Polarization-controlled TIRFM with focal drift and spatial field intensity correction. Biophys J. 106, 1008-1019 (2014).
- Anantharam, A., Onoa, B., Edwards, R. H., Holz, R. W., Axelrod, D. Localized topological changes of the plasma membrane upon exocytosis visualized by polarized TIRFM. J Cell Biol. 188, 415-428 (2010).
- Axelrod, D. Carbocyanine dye orientation in red cell membrane studied by microscopic fluorescence polarization. Biophys J. 26, 557-573 (1979).
- Wang, T., Smith, E. A., Chapman, E. R., Weisshaar, J. C. Lipid mixing and content release in single-vesicle, SNARE-driven fusion assay with 1-5 msec resolution. Biophys J. 96, 4122-4131 (2009).
- Chernomordik, L. V., Frolov, V. A., Leikina, E., Bronk, P., Zimmerberg, J. The pathway of membrane fusion catalyzed by influenza hemagglutinin: restriction of lipids, hemifusion, and lipidic fusion pore formation. J Cell Biol. 140, 1369-1382 (1998).
- Takamori, S., et al. Molecular anatomy of a trafficking organelle. Cell. 127, 831-846 (2006).
- Wilhelm, B. G., et al. Composition of isolated synaptic boutons reveals the amounts of vesicle trafficking proteins. Science. 344, 1023-1028 (2014).
- Scott, B. L., et al. Liposome fusion assay to monitor intracellular membrane fusion machines. Methods Enzymol. 372, 274-300 (2003).
- Linkert, M., et al. Metadata matters: access to image data in the real world. J Cell Biol. 189, 777-782 (2010).
- Soumpasis, D. M. Theoretical analysis of fluorescence photobleaching recovery experiments. Biophys J. 41, 95-97 (1983).
- Ohki, S. A mechanism of divalent ion-induced phosphatidylserine membrane fusion. Biochim Biophys Acta. 689, 1-11 (1982).
- Berquand, A., et al. Two-step formation of streptavidin-supported lipid bilayers by PEG-triggered vesicle fusion. Fluorescence and atomic force microscopy characterization. Langmuir. 19, 1700-1707 (2003).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys J. 47, 105-113 (1985).
- Rawle, R. J., van Lengerich, B., Chung, M., Bendix, P. M., Boxer, S. G. Vesicle fusion observed by content transfer across a tethered lipid bilayer. Biophys J. 101, L37-L39 (2011).
- Wagner, M. L., Tamm, L. K. Reconstituted syntaxin1a/SNAP25 interacts with negatively charged lipids as measured by lateral diffusion in planar supported bilayers. Biophys J. 81, 266-275 (2001).
- Kalb, E., Frey, S., Tamm, L. K. Formation of Supported Planar Bilayers by Fusion of Vesicles to Supported Phospholipid Monolayers. Biochimica Et Biophysica Acta. 1103, 307-316 (1992).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved