Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Polarize TIRF Mikroskopi tarafından İzlenen mikroakışkan Akış Hücredeki Gergin Desteklenen Bilayers Tek Proteoliposomes ve tuzak aracılı Fusion
Bu Makalede
Özet
Burada, tek bir molekül duyarlılık ve ~ 15 msn zaman çözünürlüğü ile polarize TIRFM kullanılarak lipozomlar ve mikroakışkan kanallarda desteklenen iki katmanlı arasındaki tek tuzak aracılı füzyon olayları tespit etmek için bir protokol mevcut. Lipid ve çözünür kargo sürümü aynı anda tespit edilebilir. Lipozom boyutu, lipit yayınım ve füzyon gözenek özellikleri ölçülmüştür.
Özet
membran füzyon her yerde sürecinde bir füzyon gözenek açılması iki eski ayrı bölmeleri arasında ilk bağlantı kurar. ekzositoz yoluyla nörotransmiter veya hormon salınımı sırasında, füzyon gözenek geçici açık ve kapalı defalarca düzenleyen kargo bırakma kinetiği yapabilirsiniz. Gözenek dinamikleri de vezikül geri dönüşüm modu belirlemek; Geçici, "kiss-ve-run" füzyon geri dönüşümsüz tekrar mühürleme sonuçları, oysa dilatasyon tam erimesine yol açıyor. Daha iyi gözenek dinamikleri yöneten faktörlerin neler olduğunun anlaşılması için, biz tek bir molekülün duyarlılık ve ~ bir biyokimyasal vitro sistemde iyi tanımlanmış 15 msn zaman çözünürlüğü ile polarize toplam iç yansıma floresan (TIRF) mikroskopi kullanılarak membran füzyon izlemek için bir tahlil geliştirdi. Fusion floresan düzlemsel iki tabakalı rulman t-tuzaklarına ile V-Snare proteinler (v-SUV) içeren küçük tek tabakalı veziküller etiketli, yumuşak bir polimer yastık desteklenen (t-SBL, t-desteklenen iki tabakalı) Izlenir. Tahlil SUV sabit bir yoğunluğa tedarik ederken en az numune tüketimini sağlamak mikroakışkan akış kanalları kullanır. füzyon sırasında SBL için SUV lipit etiket transferi üzerine hızlı sinyal geliştirme istismar lipit boya transferi kinetik izlenir. TIRF mikroskopi duyarlılığı lipit yayınım ve SUV boyutu her füzyon olayı için çıkarılabilir hangi tek floresan lipit etiketleri, izleme sağlar. Lipid boya bırakma süreleri kalıcı olarak açık gözenekler aracılığıyla engelsiz geçiş için beklenenden çok daha uzun olabilir. Lipid sürümü geriliği titremesini gözenek nedeniyle bir gözenek "açıklık", gözenek füzyonu sırasında açık kalır zaman kısmını kabul, bir modeli kullanarak, tahmin edilebilir. Bir çözünür işaret lipid ve çözünür kargo sürümü aynı anda izlenmesi için SUV kapsüllü edilebilir. Bu tür ölçümler, bazı gözenekler çözünür kargo bir kısmını kaybettikten sonra yeniden mühürlemek olabilir göstermektedir.
Giriş
Membran füzyon lipidler ve proteinler, sekresyon, gübreleme, gelişme hücre içi kaçakçılığı için gerekli evrensel bir biyolojik süreçtir ve konak organizmalar 1-3 içine virüs girişini sardı. Ekzositoz ile hormonlar ve nöron iletici serbest bırakılması da dahil olmak üzere pek çok hücre içi füzyon reaksiyonları için, iki lipit iki katmanlı sigorta enerji demirli, aynı kökenli çözünür, N-etilmaleimit duyarlı faktörü bağlama proteini reseptörü (SNARE) proteinleri arasında dört sarmal demet oluşumu ile sağlanır vezikül (V-SNARE), sırasıyla, hedef membran (t-SNARE) 4. Sinaptik vezikül ekzositoz en sıkı regüle füzyon reaksiyonudur ve bir aksiyon potansiyeli 1,4,5 geldikten sonra bir milisaniye içinde gerçekleşir. Füzyon gözenek, iki füzyon bölmeleri arasında ilk bağlantı, açık titreşmeye ve yeniden mühürleme ya da geri dönüşümsüz 5-7 genişletmeden önce birden çok kez kapalı olabilir. eski sonuçlargeçici olarak, ikincisi yol açar iken tam füzyon, füzyon "öpücük ve çalıştırın". Bu iki füzyon modları ve gözenek titremesini düzenleyen mekanizmalar arasındaki dengeyi düzenleyen faktörler de 5,8 anlaşılmamıştır.
Snare proteinler ekzositoz için gerekli olan; sinaptik vezikül füzyon nörotoksin 9 ile tuzaklarına ayrılması üzerine kaldırılmıştır. Küçük tek lamelli vesiküller (SUVler) kullanılarak yığın füzyon deneyleri membran füzyon 10 çalıştırmak için yeterli tuzak, sadece gerekli değildir; ancak şu. Bu toplu deneyde, SUV V-tuzak (V-SUV) ile yeniden flüoresan fosfolipid (N katkılı edildi - (7-nitro-2-1,3-benzoksadiazol-4-il) -phosphoethanolamine (NBD-PE) ve ( N -. (lisamin rodamin B sülfonil) -phosphoethanolamine (LR-PE) ve V-SUV NBD-PE Başlangıçta floresans Förster rezonans enerji transferi ile söndürüldü t-tuzak (t-SUV) ihtiva eden etiketlenmemiş veziküller ile (FRET ) LR-PE. laboratuvarda gibiELED v SUV etiketsiz t-SUV ile sigorta, şimdi kombine zarında fluorofor yüzey yoğunluğu azalır ve NBD-PE floresan sonuçlanan artış lipit 10 karıştırma ölçüde bildirir. Toplu tahlil kurmak ve analiz etmek kolay olduğu gibi, yaygın tuzak aracılı füzyon 10-14 mekanizmaları incelemek için kullanılır olmuştur. Ancak, bu düşük duyarlılık ve kötü zaman çözünürlüğü gibi çeşitli sınırlamalar vardır. En önemlisi, bir topluluk ölçü olarak, zor hemifusion ara maddelerin yerleştirme ve füzyon arasındaki ayrım, yanı sıra algılama yaparak tüm olaylar üzerinde bu ortalamalara sonuçları.
Bizimki de dahil olmak üzere geçmiş on yılda birkaç grup, üzerinde, tek vezikül düzeyinde 15-27 füzyon olayları izlemek için yeni testlerin geliştirdik. Ha ve arkadaşları bir yüzey üzerine gergin v SUV kullanılan ve ücretsiz t-SUV 18,19 ile füzyon izlenir. Lipid karıştırma lipide bağlı flüoroforların bir çifti arasında FRET kullanılarak izlenmiştir emtoplam iç yansıma floresan (TIRF) mikroskopi 18 kullanılarak, sırasıyla V- ve t-SUV, içinde yataklı. Daha sonra, Brünger laboratuar lipit içeriği 20,28 karıştırma eş zamanlı saptanması için bir dizin işaretleyici ile birlikte tek bir lipit etiketli türler kullanılabilir. lipit ve içerikleri belirteçleri hem de yüksek, kendini söndürme konsantrasyonlarda dahil edildi; etiketlenmemiş SUV füzyon 20,28 dequenching floresan ile sonuçlanmıştır.
Diğerleri t-tuzaklarına 15-17,21-27,29 ile yeniden düzlemsel bilayers v-SUV kaynaşmış. hedefin (içeren t-Snare) iki tabakalı iyi taklit düz bir plazma zarı ile küçük, son derece kavisli veziküllerin fizyolojik füzyon süreci düzlemsel geometrisi. Steinem grubu gözenekli silisyum nitrür alt-tabaka üzerinde süspansiyon haline t-tuzak ile yeniden gözenek kapsayan membranlar kullanılabilmekte ve konfokal lazer tarama mikroskobu 23 kullanılarak tek tek h-SUV ile füzyon tespit edildi. Diğerleri ft-tuzak ile yeniden düzlemsel iki katmanlı, kullanılmış h-SUV bir cam alt-tabaka 15-17,21,22,24-27,29 desteklenir. Desteklenen bilayers (SBLs) kullanarak büyük avantajı mikroakışkanları kullanarak da kullanarak tek olay çözünürlüğü sağlar, ancak TIRF mikroskopi, mükemmel sinyal-gürültü oranı ile ücretsiz v-SUV müdahalesi olmaksızın yerleştirme ve füzyon olayları tespit etmek için kullanılabilir olmasıdır standart uzak alan Epifloresans mikroskobu 24.
Bir büyük endişe substrat-iki tabakalı etkileşimleri iki tabakalı kalitesi ve füzyon süreci desteklenen etkiler ve nasıl olduğunu. Erken çalışma, doğrudan bir cam veya kuvars alt tabaka 15-17 desteklenen edildi düzlemsel SBLs kullandı. Bu SBLs yayma ve alt-tabaka t-SUV membran füzyonu, patlama, adsorpsiyon ile yapılmıştır. Kısa bir süre sonra önemli bir T-SNARE bileşenini çıkararak SNAP-25'in bu şekilde hazırlandı SBLs V-SUV yerleştirme füzyon kinetiği indistinguis sonuçlandı ki, gerçekleşmiştirtam t-tuzaklarına 17 kullanılarak elde edilenlerden hable. SNAP-25'in kesinlikle vivo 30,31 füzyon için gerekli olduğundan, bu erken girişimleri fizyolojik alaka soru konulmuştur. Tamm grubu daha iyi desteklenen kontrollü iki tabakalı oluşumunu 21 kullanarak bu zorluğu aştı. Bu t-SUV 21 ile bu tek tabakalı füzyonu tarafından takip SBL protein içermeyen ilk broşürü için Langmuir-Blodgett birikimi kullanılır. Bu SNAP-25'in bağımlı füzyon ile sonuçlanmıştır.
Şirketinden Langmuir-Blodgett yöntemleri kullanmaya gerek kalmadan, bir cam alt-tabaka üzerinde desteklenen bir çift-katlı ile bağlantılı potansiyel eserler önlemek için, Karatekin'i ve ark., Çift-katlı ve alt-tabaka 24 ile yumuşak, hidratlanmış poli (etilen glikol) (PEG) yastık kişiye. Bu modifikasyon aynı zamanda SNAP-25'in bağımlı füzyon 24 sonuçlandı. yumuşak bir polimer tabakası üzerinde yastıklı bilayers daha iyi transmembran korumak için malûmProtein hareketlilik ve fonksiyon 32, ve virüsler 33 ile füzyon çalışmalarında kullanılan olmuştu. Buna ek olarak, PEG'lenmiş bilayers-iyileşmek kendini bazı yeteneğini korumak gibi görünüyor ve 34,35 derece sağlamdır. İlk olarak, ticari olarak temin edilebilir, lipid bağlı PEG zincirlerinin bir kısmı, t-SUV zar dahildir. Bu T-SUV patlama ve bir cam alt-tabaka üzerinde düzlemsel bir çift tabakası oluşturur, PEG fırçası düzlemsel iki katmanlı iki broşür içerir. düzlemsel bir iki tabakalı oluşum hidrofilik bir cam yüzeyi üzerine, T-SUV Çevre PEG zincirlerinin yapışma tahrik sayesinde, lipozom patlama ve düzlemsel iki katmanlı oluşum şeklinde kullanılan yağ bileşimine nispeten hassas değildirler. kolesterol büyük miktarlarda dahil edilir, ancak, SUV kohesif özelliklere artan, SUV kendiliğinden patlama olabilir. Bu durumda, ozmotik şok ve çift değerli iyonlar, düzlemsel bir iki tabakalı oluşum 25 yardımcı olarak kullanılabilir.
Bu ap olarak, yukarıda da belirtildiği gibiPEG fırçası düzlemsel her iki tarafını da kapsar yaklasımlarında iki tabakalı desteklenir. mikroakışkan akış kanalı bakan fırçası, genellikle, bir PEG tabakası ile kaplanmış olan gelen V-SUV spesifik olmayan yapışmasını önlemeye yardımcı olur. V- ve t-Snare komplekslerinin oluşumu zara yakın etki 36 doğru kademeli olarak zara-uzak N-termini ve gelirleri başlar. v-SUV t-SBL, V ve tayinin koşulları altında durum gibi görünüyor PEG fırçalar, üzerinde çıkıntı t-tuzak N-termini ihtiyacı ile etkileşim için. Fırça yüksekliği PEG'lenmiş lipidlerin yoğunluğu ve PEG bağ uzunluğunun gösterildiği 37,38 değiştirilerek tuzak dışındaki proteinlerin incelemek için adapte edilebilir. Füzyon iki katmanlı proksimal yüzeyleri kaplayan PEG fırçalar başka yararı da meydanda mikron 39 başına 30,000-40,000 integral membran proteinleri ile paketlenir biyolojik membranların kalabalık ortamı taklit olmasıdır. Sadece bu testte PEG zincirleri gibi, Repubiyolojik zarlardan kapsayan lsive protein tabakası füzyonu meydana gelmesi için, iki fosfolipid ikili tabakalar arasındaki temas sağlamak için bir kenara gerekmektedir.
bunlar özel avantajlar sunar olarak mikroakışkan akış kanalları, bu deneyde kullanılır. İlk olarak, mikro-akışkan akış t-SBL oluşturulması için daha düzgün yayılması için T-SUV çökelmesini ve sigorta sağlar. İkincisi, küçük kanal hacmi (<1 ul) örnek tüketimini en aza indirir. Üçüncü olarak, gerekli küçük hacimler, tüm deney sürekli akışı altında iletilmesine olanak tanımaktadırlar. Akış zayıf kaldırır, muhtemelen non-spesifik, SBL 16 yapıştırılır v-SUV. Ayrıca, kinetik analiz 17 basitleştirilmesi t-SBL Yukarıda h-SUV, sabit bir yoğunluğa tutar. Son olarak, demirledi kesecikler kolaylıkla akışı 25 tarafından taşınan serbest olanlardan ayırt edilir. Dördüncü olarak, çok sayıda mikroakışkan kanal her biri farklı bir durum tarama aynı lamel kullanılabilir. Bu koşullar Duri karşılaştırılmasına olanak sağlarAynı deney çalıştırmak ng. Benzer bir yaklaşım influenza virüsü ve yastıklı SBLs 33 arasında füzyon incelemek için van Oijen grubu tarafından kullanılmaktadır.
TIRF mikroskopi, cam tampon arayüzü çok yakın olan bu moleküllere sınırlandırır floresan uyarma (bir çürüme sabit ~ 100 nm) ile yiten alanın üstel çürüme. Bu, daha uzak olan floresan moleküller katkısını en aza indirir sinyal-gürültü oranını artırır ve 10-40 milisaniye çerçeve pozlama süreleri ile tek bir molekül hassasiyeti sağlar. fani alanı da füzyon üzerine bir sinyal artışına neden olur: SBL içine SUV etiketli lipidler transferi gibi, kendilerini bulmak, ortalama olarak, daha güçlü bir uyarım alanında. floresanstaki bu artış daha büyük lipozomlar için kuvvetlidir.
polarize ışık kaybolan alan üretmek için kullanılırsa, ilave özellikler t üzerine floresanstaki değişikliklere katkıdaSBL içine SUV etiket ransfer. Bazı lipid boyalar da gömülü olduğu çift-katlı göre bir tercih edilen ortalama açı ile yönlendirilmiş bir geçiş dipol sahiptir. Polarize ışın farklı iki zarlarında boyalar heyecanlandıracak çünkü bu, onlar SBL karşı SUV olduğunda fluorophores tarafından yayılan floresan miktarında bir fark yaratmaktadır. ikincisi için, dipol yönelimleri düz SBL geometri ile sınırlı olacak, oysa eski için, uyarma kiriş, küresel SUV etrafında odaklı geçiş dipol ile etkileşim olacaktır. Boya zar 29,40 bir lipit, boya geçişi dipol yönelimli paralel SUV daha SBL olduğunda, örneğin, S-polarize (yansıma düzlemine dik polarize) gelen ışık kullanıldığında, uyarım daha etkilidir (örneğin, DII bu veya yaptıkları 41-43 gibi). Böyle bir fluorofor ile katkılı bir SUV loş göründüğünde SBL (Şekil 7, representat üzerine bu rıhtım ) Sonuçları ive. Bir füzyon gözenek açılır ve SUV ve SBL membranlar bağlayan gibi, floresan sondalar SBL nüfuz ve s-polarize kaybolan alanda 25,27,29 tarafından heyecan daha olası hale gelir. Sonuç olarak, füzyon site çevresinde entegre floresans sinyali SBL 27 (Şekil 3 ve Şekil 7) içine SUV boya transferi sırasında büyük oranda artar. SBL aktarılır zaman seyreltilmiş olarak füzyon floresan etiket dequenching olduğunu eşlik değişiklikleri sinyal katkıda ek bir faktör. dequenching katkısı nedeniyle sadece küçük bir kısmı (burada anlatılan deneyde kaybolan alan çürüme ve polarizasyon etkileri ile karşılaştırıldığında genellikle önemsizdir  ) Lipidlerin etiketlenmiştir.
) Lipidlerin etiketlenmiştir.
füzyon üzerine sinyal artışı zamanı karşılaştırarak füzyon gözenek özelliklerini anlamak için kullanılabilir,1 "src =" / files / ftp_upload / 54349 / 54349eq2.jpg "/>, bir lipit fiili bırakma süresi lipidler serbestçe geçirgen bir gözenek yoluyla kaçmak için gerekli olan,  . İki zaman ölçekleri karşılaştırılabilir ise, gözenek lipit akışına çok az direnç sunar sonucuna olacaktır. Gerçek serbest bırakma süresi daha uzun difüzyon ile sınırlı serbest bırakılması için zaman önemli ölçüde ise, ancak, bu lipit salgılamayı geciktiren, bu gözenek titremesi gibi bir işlem işaret eder. Difüzyon sınırlı bırakma zamanı,
. İki zaman ölçekleri karşılaştırılabilir ise, gözenek lipit akışına çok az direnç sunar sonucuna olacaktır. Gerçek serbest bırakma süresi daha uzun difüzyon ile sınırlı serbest bırakılması için zaman önemli ölçüde ise, ancak, bu lipit salgılamayı geciktiren, bu gözenek titremesi gibi bir işlem işaret eder. Difüzyon sınırlı bırakma zamanı,  , Fırınlama lipozom ve lipid-yayılma büyüklüğüne bağlıdır; onun tahmini bu iki parametre sayısal gerektirir. Testin tek bir molekülün duyarlılık lipit yayınım her füzyon olayı 26 için SBL onların serbest bırakıldıktan sonra birkaç tek lipit fluorophores takip ölçülebilir sağlar. Her füzyon vezikül büyüklüğü(i) tek bir lipid boyanın yoğunluğu, SUV (ii) tüm flüoroforlar füzyon üzerine SBL aktarılır sonra yerleştirme site çevresinde toplam parlaklıkta meydana gelen değişiklikler (III) bilinen bir etiketleme yoğunluğu birleştirilerek 27 tahmin edilebilir lipitler, ve (iv) lipit alan başına. Üniforma SUV boyutu 44 varsayarak Daha önce de belirtildiği gibi birçok füzyon etkinlikleri için gerçek lipit bırakma süreleri, difüzyon kontrollü salım 27 tarafından beklenenden çok daha yavaş olduğu tespit edildi. Lipid sürümü geriliği varsayarsak titremeyi gözenek nedeniyle, nicel bir model "gözenek açıklık" tahmin edilebilir, zaman kesir gözenek füzyonu 27 boyunca açık kalır.
, Fırınlama lipozom ve lipid-yayılma büyüklüğüne bağlıdır; onun tahmini bu iki parametre sayısal gerektirir. Testin tek bir molekülün duyarlılık lipit yayınım her füzyon olayı 26 için SBL onların serbest bırakıldıktan sonra birkaç tek lipit fluorophores takip ölçülebilir sağlar. Her füzyon vezikül büyüklüğü(i) tek bir lipid boyanın yoğunluğu, SUV (ii) tüm flüoroforlar füzyon üzerine SBL aktarılır sonra yerleştirme site çevresinde toplam parlaklıkta meydana gelen değişiklikler (III) bilinen bir etiketleme yoğunluğu birleştirilerek 27 tahmin edilebilir lipitler, ve (iv) lipit alan başına. Üniforma SUV boyutu 44 varsayarak Daha önce de belirtildiği gibi birçok füzyon etkinlikleri için gerçek lipit bırakma süreleri, difüzyon kontrollü salım 27 tarafından beklenenden çok daha yavaş olduğu tespit edildi. Lipid sürümü geriliği varsayarsak titremeyi gözenek nedeniyle, nicel bir model "gözenek açıklık" tahmin edilebilir, zaman kesir gözenek füzyonu 27 boyunca açık kalır.
Ne zaman pratik, lipid ve çözünür içeriği etiketleri her ikisini de kullanarak füzyon mekanizmaları test etmek önemlidir. Örneğin, lipit bırakma gibi Snare proteinler Surround ton lipit difüzyon kısıtlanması olarak gözenek titremesi başka süreçler tarafından geciktirilebilir olabilirO gözenek. Bu durumda olsaydı, o zaman, lipit etiket salınmasını önce olur içeriğinin serbest boşluk çözünebilir problar geçişine izin verecek kadar büyük olması gereklidir. yaklaşımı daha temel bir kusur SBL etiketli lipitlerin transferi büyük ölçüde öncesi füzyon şeklini korudu bir kesecik için SBL bağlayan dar bir füzyon gözenek yoluyla gerçekleşir varsayım olabilir. Daha önce lipit bırakma verilerine yalnız 29 dayalı önerdi olarak SBL içine lipid transfer de, bir eşlik eden füzyon gözenek, SBL membran içine SUV son derece hızlı çöküşü hızlı genleşme sonucu olabilir. Her iki lipid İzleme ve içeriği aynı anda bırakın, birçok gözenekler tüm lipit etiketlerini serbest bıraktıktan sonra yeniden mühürlenerek bulundu, ancak kendi çözünür kargo 27 bazı tutuldu. Bu en azından bazı lipozomlar SBL içine lipit boya transferi bir füzyon gözenek yoluyla oluşur birleşmesinden sonra SBL içine çökmeye ve yok olduğunu gösterir. Buna ek olarak, lIPID ve içeriği bırakma lipit sürümü geriliği gözenek 45 çevreleyen Snare protein lipid difüzyon engel teşkil nedeniyle olduğunu olmayan, aynı anda 27 oluştu.
Çözünür içeriği serbest izlemek vermedi bir SUV-SBL füzyon protokol daha önce Karatekin ve Rothman 25 tarafından yayımlandı. Burada, daha son gelişmeler dahil lipid yani eşzamanlı izleme ve içerikleri serbest ve SUV, lipit ve füzyon gözenek özellikleri 27 tahmini vardır. Protokol, bir cam lamel 25 bir poli (dimetil siloksan) yapıştırılması ile yapılan mikro-akışkan hücreleri (PDMS) elastomer blok ihtiva eden oluklar hazırlanması için talimatlar ile başlar. Daha sonra, lipid ve içeriği belirteçlerinin her ikisi de V-SUV hazırlanması açıklanmıştır. Bölümler 4 ve 5, VS giriş, mikroakışkan hücre montaj yerinde SBLs şekillendirme ve kusurları ve akışkanlığı kontrol için yönergeler sağlarakış hücreleri füzyon etkinlikleri algılama içine UV'lerinizi. Bölüm 6 Veri analizi için yönergeler sağlar.
Protokol
Mikroakışkan Kanal Form PDMS Blok 1. Hazırlık
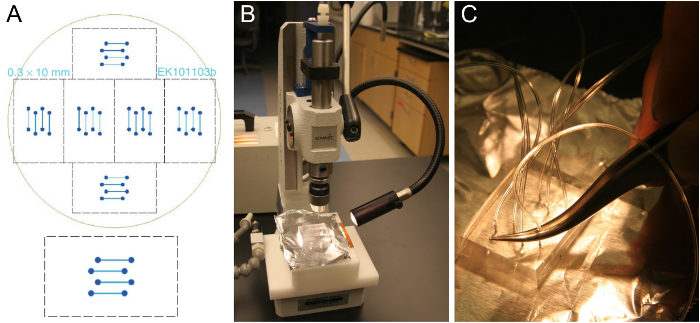
Akış hücresi şablonu ve PDMS Blok hazırlanması Şekil 1. Mikro ve (A). 24 x 60 mm cam lamel (alt) uyan bir dört kanallı akış hücresinin tasarımı. Altı denk tasarımların 10 cm'lik bir silikon (üst) uydurmak için düzenlenmiştir. (B) bir delik zımba yaklaşık 5-8 mm kalınlığında PDMS bloğu kesin. (C) Yerleştirme cımbız kullanarak delinmiş deliğe boru. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Bu Şekil 1A olarak bir akış hücresi şablonu elde edilir. Tipik kanallar 0,3-1 mm genişliğinde 70-100 mikron yüksek ve 1-2 cm uzunluğundadır. Bir şablon bize ÜretiyorBir temiz oda tesisine 25 veya sırayla standart fotolitografi teknikleri ing temiz oda erişimi mevcut değilse. Alternatif olarak, makine uygun malzemeden büyük boyutlara sahip bir şablon.
Not: Temiz oda personeli eğitmek ve tecrübesiz kullanıcılara maske, gofret temizleme ve fotolitografi tasarım ve sıralamada (her zaman doğru eğitim ile kullanıcılara kısıtlı bir temiz oda tesisine erişim) rehberlik eder. Bir şablon elde edildikten sonra, bu, sürekli olarak temiz oda dışında kullanılması, bir kapalı kabı tutulur ve bakım toz hariç tutmak için alınır sağlanabilir. - bir kullanılıp atılabilir plastik bir kap içinde ~ 100 mi PDMS karışımı (silikon elastomer baz) ve • çapraz bağlayıcı (sertleştirici), 10 ml hazırlayın. daha kolay viskoz PDMS işlemek için tek kullanımlık pipet ucu kesiyorum. pipet doğru değil gibi plastik kap içine PDMS tartılır.
- iyi karışımı karıştırın. (Yaklaşık 20 bir vakum kurutucu içinde gaz alma birçok hava kabarcıklarını çıkarmakdakika). kap vakum altına yerleştirildi gibi, kabarcıklar, başlangıçta önemli ölçüde karışımının hacmi, artan boyutta artacaktır. uygulanan vakum kontrol etmek ve kupa bir dökülme önlemek için yeterince derin olduğundan emin olun.
- Cam Petri kabı (150 mm x 20 mm) içine gazı alınmış PDMS karışımı büyük bir damla dökün ve şablon yukarı bakacak şekilde PDMS üzerine gofret basın. Bu kabarcıklar gofret altında hapsolmak önler. Trapped kabarcıklar genişletmek ve çanak fırında yerleştirildiğinde gofret eğin olabilir. o pmds yaklaşık 5-8 mm kaplıdır kadar şimdi gofret üstüne şablonun üzerine gazı alınmış PDMS dökün. Bir hava kabarcığı nazikçe oluşursa bir pipet ile çıkarın.
- 3 saat 60 ° C'de bir fırın içinde pmds pişirin. çanak seviyesi olduğundan emin olun.
- kalıplı kanal yapılarını içeren bir PDMS bloğu kesip yeni bir neşter bıçak kullanın. kesip blok lamel üzerine sığdırmak için gereken (adım 4.1.9 bakınız).
- pl çanak kesip bloğu soyun vetemiz alüminyum folyo bir parça üzerine ace.
Not: çapraz bağlı pmds blokları birkaç ay boyunca muhafaza edilebilir. Tek bir gofret, yani 6 PDMS blokları tek bir PDMS kalıplama üretilebilir akış kanalları (Şekil 1A) 6 takım bulunmaktadır. dökme ve ilk parti için kullanılan sadece yaklaşık yarısı PDMS gerektirecek bir sonraki toplu, çapraz bağlama önce kalan PDMS çıkarmayın, aksi takdirde PDMS bloklar, PDMS temiz gevşek parçalarının hepsini 6 kesip, ama sonra. İyi bir şablon, bir kaç yıl sürebilir. - Tek bir düz hareket (Şekil 1B) PDMS bloğu ile delmek için bir delgeç kullanın. Kanal olukların tarafında başlayın. PDMS dışarı yumrukladı parçası kaldırmak için emin olun. Dört kanal tasarımının tüm sekiz delikler için bu işlemi tekrarlayın.
- alüminyum folyo, yeni ve kırışıksız parça üzerine aşağı PDMS blok kanal tarafını yerleştirin. ideal bir kurutucuda, Kuru bir kutu içerisinde, birkaç aya kadar için blok saklayın.
- Cımbız (Şekil 1C) bir çift kullanarak delinmiş deliğe üçte hakkında boru (0,25 mm kimliği, 0.76 mm OD) itin. kolay sokulması için eğimli boru kesin. sırasıyla, SUV rezervuar ve şırınga pompası ulaşmak için yeterince uzun tüpler bırakın. mikroskop üzerine monte çip yerleştirdikten sonra, onlar çok uzun ise yine tüpleri kesti.
- Pompanın şırınga bağlanmak için, büyük silikon tüp (0.51 mm ID, 2.1 mm OD) kısa bir parça kesilir ve bir tarafı içine ince tüp yerleştirin. PDMS Bu hazır kullanımlı bloğu birkaç ay muhafaza edilebilir.
2. Coverslip Temizleme
- Sülfürik asit (H 2 SO4) ve hidrojen peroksit güçlü oksitleyici karışımı kullanarak Karatekin'in Rothman 25 tarif edilen protokole göre temiz lamelleri (H2O 2). bir temiz oda bu yordamı gerçekleştirin ve uygun güvenlik önlemleri alın. Alternatif olarak, bir temiz oda temizliği c kullanınbu, ticari olarak mevcuttur overslip (Malzeme listesine bakınız).
Lipid ve İçerik Etiketleri Hem İçeren v SUV 3. hazırlanması

SUV hazırlama Şekil 2. şematik. Lipidler bir cam tüp (1) 'de karıştırılır ve çözücü, bir su banyosu içinde tüp döndürerek bir lipid film oluşturmak için buharlaştırılır (2). kalan eriyik kalıntıları yüksek vakum (3) altında çıkarılır. Lipid filmi deterjan ve protein içeren bir çözme tamponu içinde hidre ise girdap oluşturularak karıştırıldı (4). İçeriği boya kapsüllenecek ise, bu adımda olarak seyreltme adımı (5) yer almaktadır. kritik misel konsantrasyonunun altında deterjan konsantrasyonuna seyreltilmesi oluşumunu lipozom yol açar. Deterjan gece boyunca uzakta diyaliz edilir (6). NBD-PE (yeşil) içeren SBL formasyonu için T-SUV için keseciklerin bir yoğunluk gradyanı içinde süzülüyor ve toplanıriki kat (7a) arasındaki arayüz. Örnek bir boyut dışlama sütun üzerinde çalıştırmak ve 0.5 ml kesirler (7b) toplanır serbest boyadan Kapsüllü içerik işaretleyici ile v-SUV ayırmak için. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- 25 mM HEPES-KOH, 140 mM KCI, 100 uM EGTA ve 1 mM DTT, pH 7.4 ihtiva eden bir çözme tamponu 4 L, hazırlayın. diğer adımlar diyaliz ve 100 ml tampon en kullanın.
Diğer tamponlar kullanılabilir, ancak deney boyunca tutarlı bir tampon ozmolarite tutmak ve proteinler işlevsel olan koşullar seçmek önemlidir: edin. Sadece lipid etiketleri içeren V-SUV ve t-SUV hazırlamak için, Karatekin ve Rothman 25 izleyin. - Lipid stokları kloroform veya kloroform içinde, -20 ° C de saklanır: metanol (2: 1, hac / hac), şişelerine açmadan önce oda sıcaklığına ulaşmasına izinyoğunlaşmayı önlemek.
- kloroform ve metanol karışımı içinde 1 umol nihai miktarı ile istenilen oranda deterjan eser miktarda kalmayana ve lipidler karışımı kloroform ile bir cam tüp yıkayın (2: 1, hac / hac). Sadece organik çözücüler / çözünmüş lipitleri işlemek için cam şırıngalar / tüpler kullanın.
Not: SAPE: DOPS: Kolesterol: PEG2000-DOPE: Burada kullanılan lipitler POPC olan 15: 10: 4.6: SAPE: DOPS: H-SNARE içeren veziküller ve POPC 1 12 Kolesterol 57.4 bir mol oranında yaptığımız : beyin PI (4,5) P2: PEG2000-DOPE: NBD-PE (54.9: 15: 12: 10: 3: 4.6: 0.5) t-tuzak SUV'lar için. Daha fazla bilgi için Malzeme bakın. Diğer lipid bileşimleri kullanılabilir. - hafif bir azot akımı altında çözücü buharlaştırılmakta, veya bir döner buharlaştırıcı içinde. homojen bir lipid film elde edilir ve çözücü madde buharlaştınlır ise büyük sıcaklık değişiklikleri önlemek için lipid yüksek erime sıcaklığının üzerinde ısıtılır, bir su banyosu (37 ° C) boru ucu bırakın. etrafında vakum başlatLipid filmi oluşana kadar 300 mbar, daha sonra döner bir buharlaştırıcı içinde 2 ° min mümkün olan en yüksek vakum devam edin.
- Cam tüp çıkarın ve hafif maruz kalmasını önlemek ve en az 2 saat boyunca yüksek vakum altında bir desikatör içinde tüp yerleştirilmesi ile çözücünün geri kalan izlerini silmek için alüminyum folyo ile sarın. Bu adım aynı zamanda bir gecede çalıştırabilirsiniz.
- kurutuldu lipid filminin rehidrate, sulandırma tamponu içinde bir deterjanın karışım (n-oktil-β-D-glukopiranosid, RG), Protein (V-tuzak) ve SRB (500 ul nihai hacim) hazırlanması. kritik misel konsantrasyonu (CMC, OG için 20-25 mM) Yukarıdaki ~ 2 kere son deterjan konsantrasyonu tutmak ve lipid oranı deterjan> 10 olacak şekilde son ses seviyesini ayarlamak. hafifçe çözeltiyi çalkalayarak 10-50 mm SRB bir son konsantrasyon elde etmek için, protein-deterjan solüsyonunda sülforhodamin B (SRB) toz içinde çözülür. co azaltarak SRB yüksek konsantrasyonlarda eklerken sulandırma tamponu osmolarite ayarlayınBuna uygun olarak, potasyum klorid ncentration.
Not: t-tuzaklarına için Lipid-to-protein oranı (LP) (., ~ Kare başına 70 t-tuzaklarına mikron 25 LP ~ 20.000) yüksektir. Önemli ölçüde füzyon oranlarını 17,24 indirgendi anlamlı SBL yüksek t-SNARE yoğunlukları inaktif protein birikmeleri neden olabilir. V Snares için LP (~, mikron 2 başına 7,000 v tuzaklarına LP ~ 200) sinaptik veziküller 46,47 bulunan v-Snare yoğunlukları yakın çok daha düşüktür. Rekombinant ifade ve V- ve t-tuzaklarına saflaştırılması sonra protein fonksiyonunu sağlamak için tek vezikül füzyon deneyinde tüm adımları gitmeden önce basit bir yığın füzyon deneyi 48 gerçekleştirmek için faydalıdır. - Yavaşça adım 3,6 protein deterjan-SRB çözümü eklerken kurutulmuş lipid filmi içeren önceden ısıtılmış cam tüp sallayın. hava kabarcıkları oluşturarak önlemek için deneyin. 37 ° C'de 15 dakika süreyle çalkalanmaya devam edin.
- sulandırma ekleyerek beşli deterjan sulandırmakHızla konsantrasyon değişimlerini önlemek için vorteks ederken tampon içeren SRB (2 ml, 2.5 ml nihai hacim ekleyin). 37 ° C'de 1 saat 15 dakika süreyle çalkalanmaya devam edin.
Not: Daha uzun inkübasyon artışı protein sulandırma verimliliği. Hızlı seyreltme CMC aşağıdaki deterjan konsantrasyonu düşer ve küçük lipozomlar oluşmasına yol açar. - çevre sıcaklığında 1-2 saat ve 20,000 MWCO diyaliz tüpü ya da kaseti kullanılarak polistiren yüzerme 4 g, 4 ° C'de bir gece boyunca yeniden oluşturma tamponu daha sonra 3 karşı L ilk sulandırma tamponu 1 ~ karşı L vezikül süspansiyonunun diyaliz. Çapraz bulaşmayı önlemek için ve SRB olmadan veziküllerin diyaliz için farklı beher kullanın.
- sulandırma tamponu ile bir gel filtreleme sütunu dengelenmesi. Kapsüllenmiş SRB ile V-SUV serbest SRB ayırmak için kolon boyunca vezikül süspansiyonunun çalıştırın. Tüm örnek vardır bir kez yıkama sıvısı olarak SRB olmadan sulandırma tamponu kullanınsütun girdi. 0.5 ml'lik kısımlar halinde, V-SUV toplayın.
- Önce ve veziküllerin 16 alınan bir örnek, bir deterjan ilave edildikten sonra SRB floresan ölçümü ile kendini söndürüldü konsantrasyonlarda başarılı bir SRB kapsülleme edin. Bir flüoresan spektrometresi kullanılarak 550 nm'de örnek tahrik ve 570 nm ve 630 nm arasında SRB emisyon taraması. Membran çözündürülmüş ve serbest SRB seyreltilir gibi deterjan ilave edildikten sonra kapsüllenmiş miktarına bağlı olarak SRB floresanstaki bir 4-8 kat artış beklenebilir.
- Sırasıyla fluoresans spektroskopisi 24 ve SDS-PAGE jel elektroforezi kullanılarak lipid ve protein kurtarma karakterize. Özellikle yüksek LP t-SUV örnekleri için, hassas bir boyama yöntemi kullanın (Malzeme Listesine bakınız). Tipik haliyle, her iki lipid ve protein girişinin yaklaşık% 50, nominal değere yakın lp elde hazırlanması sırasında kaybolur.
- 24 ya da elektron mikroskobik saçılma dinamik ışık kullanarak SUV boyutları karakterizepy 48. ~ 3-4 gün kadar 4 ° C 'de V-SUV içeren mağazası SRB. donma ve çözülme membran ve bültenleri kapsüllü SRB tatili olarak, donma yok.
4. SUV-SBL Füzyon Analizi Lipid Release Sadece Monitör
- Mikroakışkan akış kanalları içinde gergin desteklenen iki katmanlı oluşum
- çözünmüş gazları uzaklaştırmak için deney öncesinde en az 20 dakika boyunca yüksek vakum altında PDMS bloğu (aşama 1.11) yerleştirin. Bu büyük ölçüde, füzyon deneyi sırasında mikroakışkan kanal içinde hava kabarcıklarının riskini azaltır.
- Mikroskop kurulumu açın ve istenilen sıcaklığa sahne ve örnek tutucu (Şekil 3 ve 4) ısıtın.
- 0.45 um veya daha küçük bir gözenek boyutuna sahip bir filtre boyunca veziküller seyreltmek için kullanılan sulandırma tamponu filtre.
- (Stok ~ NBD-PE 30 ul t-SUV veya protein içermeyen (pf-SUV) kontrol lipozomlar etiketli sulandırmaktampon ~ 60 ul çözüm 0.5-1 mM lipid). nihai konsantrasyon burada kritik değildir.
- Gazını 3 ml hava ile bu karışım. dikey şırınga tutarak numunenin üzerindeki havanın çoğu dışarı basın. parafin film kullanarak (iğnesiz) ucu Seal ve pistonu aşağı çekerek bir vakum oluşturur. çözümün zehirli gazların hızlandırmak için şırınga varil dokunun. vakum uygulandığı zaman daha fazla kabarcıklar meydana gelene kadar bu işlemi birkaç kez tekrarlayın.
- mikrosantrifüj tüpü kap içinde bir delik PDMS bloğuna bağlı boru biraz daha büyük bir çapı olan bir hipodermik iğne kullanarak. daha sonra mikroakışkan kanal girişine bağlı boru yapışmasına neden olabilir olarak plastikten delikli parça tüp içinde olmadığından emin olun.
- kap bir deliğe sahip mikrosantrifüj tüpe gazdan arındırılmış SUV çözüm doldurun ve ayarlanan sıcaklığa gelmesini mikroskop sahnede tutucuya yerleştirin.
- plBir plazma temizleyici önceden temizlenmiş lamel (bölüm 2) ace ve yaklaşık 5 dakika boyunca hava plazma çalıştırın. Bir yastık olarak hizmet veren birkaç havsız dokuların üstünde plazma tedavi lamel (tedavi tarafı yukarı bakacak şekilde) koyun.
- gazı alınmış PDMS bloğundan alüminyum folyoyu çıkarın ve kapak üstüne blok yerleştirin. yeniden kullanırken PDMS blok koymak ve bunu temizlemek için kanal tarafına yapışkan bant bir parça ayırın. PDMS aşağı bastırın sopa yapmak için bir cımbız kullanarak lamel üzerine bloke, ama çok sert cam bozabilir olarak basmayın.
- Mikroskop sahneye monte akış hücresi yerleştirin ve sırasıyla SUV rezervuar ve şırınga pompası hortumu bağlayın. Evre (Şekil 3B) lamel bantlayın.
- Çözelti, kanal doldurana kadar 3 ul / dk'da SUV aspire başlayın (~ 2.25 mm / 75 mm x 300 mm bir kanal kesiti sn). Tüm kanallar için çözümler th yukarı hareket başladığınızdaçıkış tarafına e boru, 0.5 ul / dk akış azaltmak ve 30-45 dakika inkübe edilir.
Not: Plazma cam slayt tedavi ve kanala SUV akan arasındaki zaman plazma tedavinin etkisi olarak 10-20 dakika geçmemelidir geçicidir. - Herhangi bir sızıntı kanallarını kontrol edin. t veya pf-SUV içeren NBD-PE NBD-PE floresan gözlemlemek için 10-20X hava hedefini kullanın. Excite NBD 488 nm lazer kullanarak fluorophores. Kaçaklar parlak bir alan aydınlatma kullanılarak tespit etmek zordur.
- tutucu içine gazı alınmış sulandırma tamponu ile bir tüp koymak ve sıcaklık SBL kusurları neden olabilir sıcaklık hızlı değişiklikleri dengelemek edelim. akışını durdurmak ve emin akışı tamamen durdu ve hiçbir hava kabarcığı gazı giderilmiş tampon giriş tüpleri geçmeden önce tüp içine aspire edilecek yapmak için ~ 1 dakika bekleyin.
- ilişkisiz SUV'lar yıkayacak gazı alınmış tamponu ile tüm kanalları durulayın.
- Bir highe geçinr büyütme TIRF objektif (60X, yağ, NA 1,45-1,49) ve iki tabakalı homojen görünüyor ve bu tür karanlık yamalar veya SBL dışarı uzanan lipit tübüller olarak belirgin büyük ölçekli arızasız olduğunu doğrulayın.
- Bilayeri akışkanlığını kontrol
- özel bir sıkı bağlamak birimi mevcut değildir, ya da aşağıdaki gibi bir sıkı bağlamak dizisi, ardından niteliksel deney membran akışkanlığını programlanabilir olamaz eğer.
- Küçük boyut (~ 40 mikron çapında) saha diyafram kapatın ve açık olarak NBD-PE floresan ağartmak için yazılım aracılığıyla (20-80 uW veya 15-60 nW / um 2) 488 nm uyarma ışık yoğunluğunu ayarlayın Konum anlamlı ama tamamen değil. bozulmamış NBD-PE molekülleri maruz alana girmek ve ağartma önce belirli bir mesafe yaygın olarak bir sıvı çift-katlı için kararlı durumda, maruz alanının ortasında floresan yoğunluğu, kenarlarında daha düşük olmalıdır. Bunun tersine, yüzeye yapıştırılır • EğerUV'lerin patlamaya başarısız veya desteklenen iki tabakalı akışkan olmayan başka bir nedenden dolayı, maruz alandaki tüm fluorophores çamaşır suyu olmalıdır.
Not: Bu ve sonraki adımda lazer yoğunluk değerleri kaba bir başlangıç noktası olarak verilmiştir ve belirli bir koşullar kümesi için optimize edilmelidir. - aydınlatma durdurun ve kararlı durum ölçümlerinin sonuçlarını doğrulamak için bir kaç dakika sonra tekrar başlatın
- Küçük boyut (~ 40 mikron çapında) saha diyafram kapatın ve açık olarak NBD-PE floresan ağartmak için yazılım aracılığıyla (20-80 uW veya 15-60 nW / um 2) 488 nm uyarma ışık yoğunluğunu ayarlayın Konum anlamlı ama tamamen değil. bozulmamış NBD-PE molekülleri maruz alana girmek ve ağartma önce belirli bir mesafe yaygın olarak bir sıvı çift-katlı için kararlı durumda, maruz alanının ortasında floresan yoğunluğu, kenarlarında daha düşük olmalıdır. Bunun tersine, yüzeye yapıştırılır • EğerUV'lerin patlamaya başarısız veya desteklenen iki tabakalı akışkan olmayan başka bir nedenden dolayı, maruz alandaki tüm fluorophores çamaşır suyu olmalıdır.
- Mümkünse, bir daha nicel ölçümü için bir sıkı bağlamak dizisi programlayın. ek dosyaları ve detaylar için ilgili tabloya bakın.
Not: Bazen SUV cam lamel üzerine yapışır, ama daldı ve akışkan bilayeri oluşturmak için başarısız olur. Bu durum ortaya çıkarsa, desteklenen iki katmanlı oluşumuna yardımcı olmak için 10 mM Mg 2+ içeren gazı alınmış sulandırma tamponu ile kanalları durulayın. 4.2 gibi iki tabakalı akışkanlığını değerlendirmek için floresan beyazlatma kullanın. Bir akışkan iki tabakalı oluşturulduktan sonra, içermeyen Recó Mg +2 ile yıkayınAnayasa'da tamponu.
- özel bir sıkı bağlamak birimi mevcut değildir, ya da aşağıdaki gibi bir sıkı bağlamak dizisi, ardından niteliksel deney membran akışkanlığını programlanabilir olamaz eğer.
- Mikroakışkan akış kanallarına h-SUV tanıtılması
- Gazını tampon ve V-SUV hazır konsantrasyonuna bağlı olarak 5 ila 10, yaklaşık 10 3 kat h-SUV stok solüsyonu seyreltilmesi kullanmak yeniden oluşturulması. görüş alanında 60 saniye içinde yaklaşık 10-100 füzyon etkinlikleri ile sonuçlanan bir seyreltme için Amaç.
Not: Çok fazla füzyonlar (her olay mevduat LR-PE beri veya DiD lipit etiketler SBL içine) arka plan floresan artırmak ve füzyon olayları algılama ve analiz zorlaştırmaktadır. Buna karşılık, kötü istatistikte çok düşük sonuçlar veya çok daha fazla film kazanılmasını gerektiren bir füzyon hızı. 0.1 mM lipid V-SUV konsantrasyonu için, 995 ul sulandırma tamponu içinde 5 ul SUV stok seyreltilmesi ile başlamak ve daha sonra 950-995 ul sulandırma tamponu içinde Bu 5-50 ul seyreltin. - Sıcaklık akışı ve INSER durdurmadan önce muvazene edelimting seyreltilmiş v SUV çözüm içine giriş borusu.
- aşağıdaki gibi TIRF açısını ve kutuplaşmayı ayarlayın.
- uyarma ışını çevirerek istenen kutuplaşmayı ayarladıktan sonra, yazılım aracılığıyla bir adım motoru aracılığı ile ışının pozisyonunu komuta aynanın eğimini ayarlayın. Yavaş yavaş off-center bir tarafa arka odak düzlemi de hedefin merkezine lazer ışınının konumunu taşıyın. konumu merkez dışı daha fazla hareket objektif eksenine göre giderek artan bir açı ile ortaya ön tarafında amacı ışığı dikkate alınmalıdır.
- TIR ilk elde edildiğinde çıkan ışın ilk yani objektif, kaybolur, motor konumuna dikkat edin.
- Yavaş yavaş yüzeyden floresan izlerken off-center ayrıca ışın pozisyonu hareketli tutmak. kiriş çok uzakta merkezden taşındı zaman yüzey floresan kaybolur Motor konumuna dikkat edin.
- Bir ışın positio seçin n iki limit arasında yukarıda belirledi. füzyon üzerine en iyi sinyal-gürültü oranı ve daha fazla sinyal artışı için hala Viewfield homojen aydınlatma sağlayan sığ bir penetrasyon derinliğini (yakın hedefi kenarına ışın pozisyonu) seçin.
Not: Bu ayarları optimize edilmiştir sonuçta deneyler için aynı TIR ışın pozisyonu (aynı penetrasyon derinliği) tutmak en iyisidir. kiriş konumunda değişikliklere neden olmayan polarizasyon döndürülmesi emin olun.
- 75 mm x 300 mm bir kesiti için 1.5 mm / sn ~ ortalama doğrusal akış hızına karşılık gelen, 2 ul / dk'lık bir akış oranında kanala h-SUV akış. uyarma / emisyon ayarlarına geçin lipid karıştırma monitör (LR veya sadece DiD) için.
- Gazını tampon ve V-SUV hazır konsantrasyonuna bağlı olarak 5 ila 10, yaklaşık 10 3 kat h-SUV stok solüsyonu seyreltilmesi kullanmak yeniden oluşturulması. görüş alanında 60 saniye içinde yaklaşık 10-100 füzyon etkinlikleri ile sonuçlanan bir seyreltme için Amaç.
- Tek v SUV ve SBL arasında gözlemleme füzyon
.jpg "/>
Şekil 3. Deneysel pTIRF kurulumu., Bir cam alt-tabaka üzerinde bir V SUV ve bir t-SBL (A) şematik temsili. Lipid yerleştirme gösteren tek SUV-SBL füzyon olayı yanlış renk TIRFM görüntüleri (1) ve SBL içine lipit boya bırakma (2) ağartma ve floresan yoğunluğu azalma ardından (3). toplam floresan yoğunluğu sinyali (5.3 mm x 5.3 mm kutu piksel değerlerinin toplamı) gösterilir. (B) PDMS blok bağlanmış lamel ısıtılmış sahneye bantlanmış. mikroakışkan kanallar için giriş tüpü şırınga pompası (solda) ile aspire metal numune tutucu (sağda) tüpten örnekleri çizin. Pompa çift emisyon birimi altında. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
OAD / 54349 / 54349fig4.jpg "/>
Deney düzeneği Şekil 4. şematik. Kaybolan dalga mikroakışkan kanal cam-tampon arayüzü oluşturulur. SBL cam üzerine oluşturulmuştur ve v-SUV (sol üst) şırınga içine kanalıyla metal numune tutucu (sağ üstte) aspire edilir. M, ayna; DM, dikroik ayna; L, lens; F, filtre; P, polarize. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Sürekli heyecanlandırmak ve V-SUV dahil fluorofor bağlı v-SUV (LR-PE için) 561 nm kullanılarak floresan veya (DiD için) 638 nm lazer izlemek. v-SUV SBL ile akış kanalı ve dok üzerine ve sigortayı ulaşmak gibi, arka plan floresan sinyali birikmeye başlar.
- Sürekli arka plan ağartmak için yazılım aracılığıyla uyarma lazer yoğunluğunu ayarlayınkararlı durum yeni yerleştirme ve füzyon etkinliklerinde kolayca görülebilir şekilde floresan.
Not: ağartıcı çok yavaş ise, arka plan flüoresan çok yüksek olacaktır. ağartma çok hızlı olursa, demirledi SUV gelen ve SBL salınan fluorophores gelen sinyaller demirledi SUV füzyon tespit edilebilir ya da fluorofor izlenebilir sırasında pencereyi kısalma, hızla kaybolacak. LR-PE 561 nm'de heyecanlı için 2,5-7,5 mW güç 190 mikron çaplı bir daire (100-250 nW / um 2) aydınlatıcı başlamak için makul bir değerdir. DiD 638 nm uyarma, 190 mikron çapında bir daire (30-60 nW / um 2) üzerinde 0.8-1.6 mW güç için ilk testler için kullanılabilir. - Belirli bir kanalda farklı pozisyonlarda birkaç film kazanır. SBL bu pozisyonlarda kusurları olmadığını doğrulamak için NBD-PE floresan kontrol edin. Maksimum hızı (~ 50 kare / sn) veya daha yukarı kare hızında ilgi kırpılmış bir bölge (tam çerçeve filmleri Edinme~ 100 Hz), 60 sn.
- Başka bir mikroakışkan kanal taşı ve diğer koşullar için kayıtları tekrarlayın. Bu tür bir protein içermeyen SBL veya SUV, bir inhibitörü olarak V-SNARE VAMP2 (CDV) çözünür sitoplazmik alan ekleme veya bir veya daha fazla tetanoz nörotoksinin (37 ° C'de 30 dakika) ile V-SUV tedavi negatif kontrol olarak dahil aynı lamel kanalları.
- Ve PDMS geri dönüşüm temizleyin
- PDMS bloğu yeniden için, 5 ul / dakika'lık bir akış hızında% 70 etanol içinde yaklaşık 200 ul mikro-akışkan kanalları yıkayın. Son olarak, boru ve kanallarla havayı aspire.
- PDMS hafifçe sıkarak lamel yavaşça engellemek ayırın. bir alüminyum folyo temiz bir parça üzerine yerleştirin. bir vakum desikatörde saklayın. Bu birkaç kez tekrar edilebilir.
- Daha kapsamlı bir temizlik için% 70 etanol önce bir deterjan ya da sodyum hidroksit çözeltisi ile kanal yıkayın. Alternatif olarak, sağa sola bütün tüpleri kaldırmak PDMS m ve kurutma ve yeni boru yerleştirmeden önce, izopropanol içinde 30 dakika için blok sonikasyon.
5. SUV-SBL Füzyon Analizi eş zamanlı Lipid ve İçerik Release Monitör
- eşzamanlı lipid ve çözünür içerikleri bölümünde açıklandığı gibi, kullanım hem lipit (DiD) ile etiketlenmiş lipozomlar ve çözünebilir içerikleri (SRB) etiketin dışında, bölüm 4'te olduğu gibi aynı adımları takip edin, bırakın çift renk izlenmesi için 3. SRB kapsüllü 10 mM başlangıçta yüksek öz-söndürülür ve olduğunu.
- Şekil 4'te şematik olarak gösterilen konfigürasyon kullanılarak SRB tahrik ve floresans aynı zamanda, sırasıyla 561 nm ve 638 nm lazer kullanarak mi. Bir dikroik ayna (640 nm) sırasıyla emisyonları SRB algılamak ve DiD iki kısa (595/50 nm) aracılığıyla çalıştırmak kiriş ve uzun (700/75 nm) dalga boyu filtrenin içine emisyon böler. İki emisyon kirişler EM-CCD çipi üzerine yan yana tahmin edilmektedir.
- FRAP verilerinin analizi
- Lipid difüzyon katsayısı D tahmin etmek Ek Bilgiler sağlanan MATLAB programı kullanın. Program, OME-TIFF dosyalar 49 listesini okur ağartılmış alan algılar zamanın bir fonksiyonu olarak beyazlatılmış alanda ortalama piksel değerlerini araziler, ve iyileşme süresini ayıklamak için Soumpasis 50 tarafından bir model ortaya çıkan kurtarma eğrisi uyar
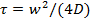 W ağartılmış çemberin yarıçapı olduğu.
W ağartılmış çemberin yarıçapı olduğu.
Not: Bir MATLAB programı Nikon ND2 dosyalarını kullanarak sıkı bağlamak filmlerin analizi için daha önce 25 sağlandı. En dosya formatları kolayca OME-TIFF dönüştürülebilir çünkü Mevcut program, OME-TIFF 49 dosyaları okur. Sıkı bağlamak verilerin bir nicel analiz kolay ve ağartma sırasında en doğru anlık olduğunu, bleached bölge okuma-out sırasında bir daire ve ağartma olduğunu göz ardı edilebilir. bu kriterler kesinlikle burada anlatılan basit sıkı bağlamak ölçümleri memnun olmasa da, difüzyon katsayısı makul bir tahmini elde edilebilir. daha doğru bir tahmin için, tek lipit boyalar (bölüm 6.3) izleme özelliğini kullanabilirsiniz.
- Lipid difüzyon katsayısı D tahmin etmek Ek Bilgiler sağlanan MATLAB programı kullanın. Program, OME-TIFF dosyalar 49 listesini okur ağartılmış alan algılar zamanın bir fonksiyonu olarak beyazlatılmış alanda ortalama piksel değerlerini araziler, ve iyileşme süresini ayıklamak için Soumpasis 50 tarafından bir model ortaya çıkan kurtarma eğrisi uyar
- Yerleştirme oranı, füzyon oranı ve yerleştirme-to-füzyon gecikme süreleri Analizi
- açıkça vezikül yerleştirme ve eritme olayları tanımlamak için parlaklığı ve kontrastı analiz ve ayarlamak için bir film açmak için ImageJ kullanın. SpeckleTrackerJ 26 eklenti başlatın. Kullanım için talimatlar için SpeckleTrackerJ için Smith ve diğ. 26 ve çevrimiçi belgelerine bakın.
- SpeckleTrackerJ tüm yeni demirledi SUV belirleyin. SBL kapalı çıkma olanlardan sıkıca sabitlemek SUV ayırt etmek için bir kaç kare minimum yerleştirme süresi empoze. parçaları kaydedin ve tüm filmler için tekrarlayın.
Not: doc içinkral oranı, tüm bu konularda bir SUV Yuvalandığında, SUV bu pistlerde kaydedilmek üzere ihtiyaçlarını demirledi hangi nedenle sadece ilk karesini tespit etmektir. parça kalan analizinde hesaba alınmayacaktır. Ancak otomatik izleme o beyazlatır veya sigortalar kadar her SUV zaten takip edilmiştir işareti SUV yardımcı olur. - Tüm füzyon veziküller belirleyin. Bunlar için, parça bir SUV füzyon izlenen noktanın floresan ani artışı ile belirgin olan ilk kareye kadar yuvaya ilk kareden itibaren tüm kareleri içermelidir. Bu parçaların süreleri yerleştirme-to-füzyon gecikmeler hesaplamak için kullanılır. Tüm parçaları kaydedin. tüm filmler için tekrarlayın.
- Yerleştirme veya füzyon verilerinin toplu analizi için, ilgili filmleri yörünge dosyaların bir listesini derlemek ve Karatekin ve Rothman 25 ile sağlanır MATLAB programları çalıştırmak. programlarıyla birlikte sağlanan yönergeleri izleyin.
Not: programlar cum arsayörünge dosyalarından çıkarılan bilgilere dayanarak, zamanın bir fonksiyonu olarak ulative yerleştirme ve füzyon olayları. Yerleştirme ve füzyon oranları bu parsellerin yamaçlarından tahmin edilmektedir. Füzyon verileri için yerleştirme-to-füzyon gecikmeler de hesaplanır ve bunların dağılımı yani hayatta kalma arsa, füzyon henüz yerleştirme sonrası verilen gecikmeden meydana olmadığını olasılık olarak çizilir.
- lipid yayınım
- Yeterince uzakta füzyon sitesinden (Şekil 6) dan yayılmış zaman onlar fark olmak gibi, her füzyon olayı için, tek floresan lipidler izleyebilirsiniz. izleme için SpeckleTrackerJ kullanın ve MATLAB kullanarak daha fazla analiz için parça kaydedin. eritme vezikül büyüklüğüne bağlı olarak, genellikle 3-30 tek fluorophores izlenebilir. uzun parça hesaplanması için arzu edilir, çünkü
 , Sürece tek molekülleri izlemek için deneyinGerekirse mümkün olduğunca, yörüngeler manuel düzeltme kullanarak.
, Sürece tek molekülleri izlemek için deneyinGerekirse mümkün olduğunca, yörüngeler manuel düzeltme kullanarak. - Ortalama (yaklaşık ~ 1.5 sn)> 40-50 kare son tek lipit işaretleyici yörüngeleri için deplasman (MSD) kare hesaplayın. Lipid difüzyon katsayısını hesaplamak için MSD kullanın
 . Smith ve diğ. 26 ve Stratton ve diğ. 27 bilgileri.
. Smith ve diğ. 26 ve Stratton ve diğ. 27 bilgileri.
- Yeterince uzakta füzyon sitesinden (Şekil 6) dan yayılmış zaman onlar fark olmak gibi, her füzyon olayı için, tek floresan lipidler izleyebilirsiniz. izleme için SpeckleTrackerJ kullanın ve MATLAB kullanarak daha fazla analiz için parça kaydedin. eritme vezikül büyüklüğüne bağlı olarak, genellikle 3-30 tek fluorophores izlenebilir. uzun parça hesaplanması için arzu edilir, çünkü
- Tek lipit boya yoğunluğu, SUV-SBL yoğunluk azaltma faktörü, ve vezikül boyutu
- önce ve tek bir adımda işaretleyici ağartıcılar sonra ~ için işaretin etrafında bir 3 x 3 piksel (0.8 mm x 0.8 mm) alanında 15 kare lipid marker piksel değerlerinin toplamını ölçün. Arka plan yoğunluğu izlenen lipit marker yoğunluğunu elde etmek için beyazlatma önce ortalama öncesi ağartıcı yoğunluğu post-ağartıcı çerçeveleri üzerinden ortalama çıkarın. Belirli bir pratik olduğu kadar çok belirteçler için ölçümü tekrarlayın film.
- Tek lipit etiketi yoğunluklarının dağıtım arsa
 Ve ortalama tahmin etmek bir Gauss uygun.
Ve ortalama tahmin etmek bir Gauss uygun. - bu olay yayımlanan tek lipit marker yörüngesi bir tek adım beyazlatma sona erdi zaman füzyon meydana gelmiş ve ne zaman arasındaki gecikmeyi hesaplayın. SBL bir fluorofor için ağartma zamanı elde,
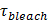 Bir üstel için kurtulan gecikmeler fonksiyonu ve uydurma çizerek.
Bir üstel için kurtulan gecikmeler fonksiyonu ve uydurma çizerek.
Not: daha zayıf bir SUV fluorophores için polarize uyarma alan çiftler, bir SUV ağartma süresi 27 genellikle daha yavaş olduğu için. - Tahmin
 , Zaman Stratton 27 aşağıdaki, SBL olduğunda SUV göreli bir lipid boya için yoğunluk azaltma faktörü (tp_upload / 54349 / 54349eq8.jpg "/>
, Zaman Stratton 27 aşağıdaki, SBL olduğunda SUV göreli bir lipid boya için yoğunluk azaltma faktörü (tp_upload / 54349 / 54349eq8.jpg "/>  SUV tek boya) yoğunluğudur.
SUV tek boya) yoğunluğudur.
Not: ağartma önemsiz olsaydı, sabitlenmiş yoğunluğuna eşit olacaktır
sabitlenmiş yoğunluğuna eşit olacaktır 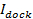 Tüm fluorophores sonra ulaşılan toplam yoğunluğu bölü (Şekil 3A, sağ panel noktası (1)), füzyon üzerine SBL yatırılır (kesikli çizgi etiketli
Tüm fluorophores sonra ulaşılan toplam yoğunluğu bölü (Şekil 3A, sağ panel noktası (1)), füzyon üzerine SBL yatırılır (kesikli çizgi etiketli 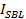 Şekil 3'te). Ancak, SBL hızlı ağartma nedeniyle
Şekil 3'te). Ancak, SBL hızlı ağartma nedeniyle 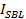 tipik ulaştı ve doğru tahmini ve değil
tipik ulaştı ve doğru tahmini ve değil  bir ifade 27 o dahil salım kinetiği uydurma gerektirir udes hem
bir ifade 27 o dahil salım kinetiği uydurma gerektirir udes hem 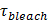 (6.4.3) ve
(6.4.3) ve  . Ayrı ifadeler Stratton ve ark verilmiştir gözenek sınırlı ve difüzyon sınırlı sürüm kinetik vakalar için 27.; en uygun gelen olay (gözenek sınırlı kinetik durumu için 6.5.1 bakınız) olay değişir.
. Ayrı ifadeler Stratton ve ark verilmiştir gözenek sınırlı ve difüzyon sınırlı sürüm kinetik vakalar için 27.; en uygun gelen olay (gözenek sınırlı kinetik durumu için 6.5.1 bakınız) olay değişir. - 27 bireysel olaylar için vezikül alanı hesaplayın
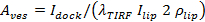 , nerede
, nerede 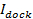 demirledi SUV yoğunluğu,
demirledi SUV yoğunluğu,  SBL tek lipit boya yoğunluğunu anlama geliyor,
SBL tek lipit boya yoğunluğunu anlama geliyor,  o SBL olduğunda SUV nisbetle olduğu zaman, bir lipid boya için yoğunluk azaltıcı faktörüdür vetirme 1 "src =" / files / ftp_upload / 54349 / 54349eq12.jpg "/> lipit boyaların bilinen alansal yoğunluğudur.
o SBL olduğunda SUV nisbetle olduğu zaman, bir lipid boya için yoğunluk azaltıcı faktörüdür vetirme 1 "src =" / files / ftp_upload / 54349 / 54349eq12.jpg "/> lipit boyaların bilinen alansal yoğunluğudur.
- Füzyon gözenek özellikleri
- Serbest varsayarsak, gözenek sınırlıdır 27'ye lipit etiket bırakma kinetiği sığacak
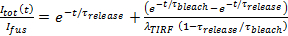 , nerede
, nerede 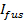 Sadece füzyonundan önceki yerleştirilmiş SUV yoğunluğu ve diğer parametreler daha önce tanımlandığı gibidir. değerini kullanın
Sadece füzyonundan önceki yerleştirilmiş SUV yoğunluğu ve diğer parametreler daha önce tanımlandığı gibidir. değerini kullanın 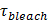 sabit bir parametre olarak 6.4.3 elde ve için en uygun tahminleri ayıklamak
sabit bir parametre olarak 6.4.3 elde ve için en uygun tahminleri ayıklamak  ve
ve  .
. - P 0, lipit sürümü varsayarak retardasyon 27 titremeyi gözenek nedeniyle, gözenek açık zaman bölümünü tahmin:60;
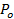 =
= 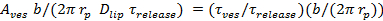 Bir ves vezikül alanı (kısmı 6.4.5) olduğu, B 3 mil difüzyon lipit etiket tarafından görülen ve yarım içerir etkili gözenek yarıçapıdır (tipik olarak ~ 15 nm olarak alınmıştır), gözenek boyu, Rp ≈ olan İki katmanlı kalınlığı (~ 2 nm)
Bir ves vezikül alanı (kısmı 6.4.5) olduğu, B 3 mil difüzyon lipit etiket tarafından görülen ve yarım içerir etkili gözenek yarıçapıdır (tipik olarak ~ 15 nm olarak alınmıştır), gözenek boyu, Rp ≈ olan İki katmanlı kalınlığı (~ 2 nm)  (6.3 hesaplanan) lipit yayınım ve
(6.3 hesaplanan) lipit yayınım ve  lipidler (6.5.1 itibaren) SBL içine SUV tahliye edilecek zamanıdır.
lipidler (6.5.1 itibaren) SBL içine SUV tahliye edilecek zamanıdır. - Nominal P 0> 1 tamamen açık gözenek gösterir onaylamak için = 1 P 0, sürekli olarak açık gözenek için Stratton ve ark. 27, tahmin kinetik 4 eşitliğine yoğunluk zaman ders uygun. Bu uyum fittin daha iyi olmalıdırg devamlı açık gözenek için 6.5.1 de ifade.
- Serbest varsayarsak, gözenek sınırlıdır 27'ye lipit etiket bırakma kinetiği sığacak
Sonuçlar
SBL Kalite
Füzyon deneyi öncesinde SBL kalite ve akışkanlığı kontrol etmek çok önemlidir. mikroakışkan kanal alt cam tarafında floresan belirgin kusurlar olmadan düzgün olmalıdır. Bir hava kabarcığı kanalı olsa geçerse, genellikle SBL görünür izleri bırakır. Böyle büyük ölçekli izleri / kusurları varsa, o kanalı kullanmayın. Bazen SUV alt tabaka üzerine yapışır ama sürekl...
Tartışmalar
Burada anlatılan SUV-SBL füzyon deneyinde başarılı bir şekilde uygulanması kaliteli SBLs elde ve tek molekülleri tespit etmek için doğru görüntüleme parametrelerini seçerek, bu tür lipozomlar içine proteinlerin fonksiyonel sulandırma gibi birkaç önemli adımlar, kritik bağlıdır. O başarılı olmak için biraz zaman ve çaba alabilir rağmen tahlil başarıyla uygulandıktan sonra, Giriş bölümünde tartışılan başka in vitro füzyon deneyi bulunmayan füzyon süreci hakkında bilgi b...
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları olduğunu beyan ederim.
Teşekkürler
We thank Vladimir Polejaev (Yale West Campus Imaging Core) for the design and construction of the polarized TIRF microscope, David Baddeley (Yale University) for help with two-color detection instrumentation, and James E. Rothman (Yale University) and Ben O'Shaughnessy (Columbia University) and members of their groups for stimulating discussions. EK is supported by a Kavli Neuroscience Scholar Award from the Kavli Foundation and NIH grant 1R01GM108954.
Malzemeler
| Name | Company | Catalog Number | Comments | |
| Reagents | ||||
| Milli-Q (MQ) water | Millipore | |||
| KOH | J.T. Baker | 3040-05 | ||
| Ethanol 190 Proof | Decon | |||
| Isopropanol | Fisher Chemical | A416P4 | ||
| HEPES | AmericanBio | AB00892 | ||
| Sodium Cholride (KCl) | AB01915 | |||
| Dithiothreitol | AB00490 | |||
| N-[2-hydroxyethyl] piperazine-N'-[2-ethanesulfonic acid] (HEPES) | AmericanBio | AB00892 | ||
| EGTA | Acros Organics | 409911000 | ||
| Buffers | ||||
| HEPES-KOH buffer (pH 7.4) | 25 mM HEPES-KOH, 140 mM KCl, 100 μM EGTA, 1 mM DTT | |||
| Solvents | ||||
| Chloroform | J.T. Baker | 9180-01 | in glass bottle, CAUTION, wear PPE | |
| Methanol | J.T. Baker | 9070-03 | in glass bottle, CAUTION, wear PPE | |
| Liposome preparation | ||||
| Gastight Hamilton syringe | Hamilton | var. sizes | only use glass sringe with solents (Chlorophorm/ Methanon, 2:1, v/v) | http://www.hamiltoncompany.com |
| Glass tubes Pyrex Vista 11 ml, 16x100 mm screw cap culture tube | Pyrex | 70825-16 | clean thoroughly, rinse with chloroform | http://catalog2.corning.com/LifeSciences/ |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine, 16:0-18:1 PC (POPC) | Avanti Polar Lipids | 850457 | Lipids come dissolved in CHCl3 or as lyphilized powder in sealed vials. Aliquot upon opening. Store extra as dried lipid films under inert atmosphere at -20 °C. Keep stocks in CHCl3/MeOH (2:1, v/v) at -20 °C. let come to RT before opening | http://www.avantilipids.com/ |
| 1,2-dioleoyl-sn-glycero-3-phospho-L-serine (sodium salt), 18:1 PS (DOPS) | 840035 | |||
| 1-stearoyl-2-arachidonoyl-sn-glycero-3-phosphoethanolamine, 18:0-20:4 PE (SAPE) | 850804 | |||
| L-α-phosphatidylinositol-4,5-bisphosphate (Brain, Porcine) (ammonium salt), Brain PI(4,5)P2 | 840046 | |||
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (ammonium salt), 18:1 NBD PE | 810145 | |||
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt), 18:1 PEG2000 PE | 880130 | |||
| cholesterol (ovine wool, >98%) | 700000 | |||
| DiD' oil; DiIC18(5) oil (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindodicarbocyanine Perchlorate) | Molecular Probes | D-307 | https://www.thermofisher.com/ | |
| Rotavapor R-210 | Buchi | R-210 | heat bath above Tm of lipids used | http://www.buchi.com/ |
| OG n-Octyl-β-D-Glucopyranoside | Affymetrix | 0311 | store at -20°C, let come to RT before opening | https://www.anatrace.com/ |
| Shaker - Eppendorf Thermomixer R | Eppendorf | https://www.eppendorf.com/ | ||
| Slide-A-Lyze Dialysis Cassettes, 20K MWCO, 3 mL | life technologies | 66003 | https://www.lifetechnologies.com/ | |
| Bio-Beads SM-2 Adsorbents | Bio-Rad | 1523920 | http://www.bio-rad.com/ | |
| OptiPrep Density Gradient Medium | Sigma-Aldrich | D1556 | http://www.sigmaaldrich.com/ | |
| Ultracentrifugation tube, Thinwall, Ultra-Clear, 13.2 mL, 14 x 89 mm | Beckman Coulter | 41121703 | https://www.beckmancoulter.com/ | |
| Beckman SW41 Ti rotor | ||||
| SuflorhodamineB | Molecular Probes | S-1307 | https://www.thermofisher.com/ | |
| Econo-Column Chromatography Columns, 2.5 × 10 cm | Bio-Rad | 7372512 | http://www.bio-rad.com/ | |
| Sepharose CL-4B | GE Healthcare | 17-0150-01 | http://www.gelifesciences.com/ | |
| SYPRO Orange Protein Gel Stain | Molecular Probes | S-6650 | 5,000X Concentrate in DMSO | https://www.lifetechnologies.com/ |
| PDMS block | ||||
| Sylgard 184 Silicone elastomer kit, PDMS | Dow Corning | 3097358-1004 | http://www.dowcorning.com/ | |
| Pyrex glass petri dish, 150 x 20 mm, complete with cover | Corning | 3160-152 | http://catalog2.corning.com/LifeSciences/ | |
| Hole puncher - Reusable Biopsy Punch, 0.75mm | World Precision Instruments | 504529 | http://www.wpi-europe.com/ | |
| Manual Hole Punching Machine | SYNEO | MHPM-UNV | http://www.syneoco.com/ | |
| Drill .035 x .026 x 1.5 304 SS TiN coated round punch | CR0350265N20R4 | drill diameter: 0.9 mm | ||
| Tygon Microbore tubing, 0.25 mm ID, 0.76 mm OD | Cole-Parmer | 06419-00 | 0.010" ID, 0.030" OD | http://www.coleparmer.com/ |
| Silicone Tubing (0.51 mm ID, 2.1 mm OD | 95802-00 | 0.020" ID, 0.083" OD | ||
| Cover glass - cleanroom cleaned | ||||
| Schott Nexterion cover slip glass D | Schott | 1472305 | http://www.us.schott.com/ | |
| plasma cleaner | Harrick | PDC-32G | http://harrickplasma.com/ | |
| pTIRF setup and accessories | ||||
| IX81 microscope body | Olympus | IX81 | http://www.olympus-lifescience.com/en/ | |
| EM CCD camera | Andor | ixon-ultra-897 | http://www.andor.com/ | |
| Thermo Plate, heated microscope stage | Tokai Hit | MATS-U52RA26 | http://www.tokaihit.com/ | |
| 1 ml hamilton glass syringes (4x) | Hamilton | 81365 | http://www.hamiltoncompany.com | |
| syringe pump | kd Scientific | KDS-230 | http://www.kdscientific.com/ |
Referanslar
- Sudhof, T. C., Rothman, J. E. Membrane fusion: grappling with SNARE and SM proteins. Science. 323, 474-477 (2009).
- Wickner, W., Schekman, R. Membrane fusion. Nat Struct Mol Biol. 15, 658-664 (2008).
- Harrison, S. C. Viral membrane fusion. Nat Struct Mol Biol. 15, 690-698 (2008).
- Jahn, R., Scheller, R. H. SNAREs--engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Lindau, M., Alvarez de Toledo, G. The fusion pore. Biochim Biophys Acta. 1641, 167-173 (2003).
- Staal, R. G., Mosharov, E. V., Sulzer, D. Dopamine neurons release transmitter via a flickering fusion pore. Nat Neurosci. 7, 341-346 (2004).
- Wu, Z., et al. Nanodisc-cell fusion: Control of fusion pore nucleation and lifetimes by SNARE protein transmembrane domains. Sci. Rep. 6, 27287 (2016).
- Alabi, A. A., Tsien, R. W. Perspectives on kiss-and-run: role in exocytosis, endocytosis, and neurotransmission. Ann Rev Physiol. 75, 393-422 (2013).
- Rossetto, O., Pirazzini, M., Montecucco, C. Botulinum neurotoxins: genetic, structural and mechanistic insights. Nature Rev Microbiol. 12, 535-549 (2014).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Nickel, W., et al. Content mixing and membrane integrity during membrane fusion driven by pairing of isolated v-SNAREs and t-SNAREs. Proc Natl Acad Sci U S A. 96, 12571-12576 (1999).
- McNew, J. A., et al. Compartmental specificity of cellular membrane fusion encoded in SNARE proteins. Nature. 407, 153-159 (2000).
- Melia, T. J., You, D. Q., Tareste, D. C., Rothman, J. E. Lipidic antagonists to SNARE-mediated fusion. J Biol Chem. 281, 29597-29605 (2006).
- Hernandez, J. M., et al. Membrane fusion intermediates via directional and full assembly of the SNARE complex. Science. 336, 1581-1584 (2012).
- Fix, M., et al. Imaging single membrane fusion events mediated by SNARE proteins. Proc Natl Acad Sci U S A. 101, 7311-7316 (2004).
- Bowen, M. E., Weninger, K., Brunger, A. T., Chu, S. Single molecule observation of liposome-bilayer fusion thermally induced by soluble N-ethyl maleimide sensitive-factor attachment protein receptors (SNAREs). Biophys J. 87, 3569-3584 (2004).
- Liu, T., Tucker, W. C., Bhalla, A., Chapman, E. R., Weisshaar, J. C. SNARE-driven, 25-millisecond vesicle fusion in vitro. Biophys J. 89, 2458-2472 (2005).
- Yoon, T. Y., Okumus, B., Zhang, F., Shin, Y. K., Ha, T. Multiple intermediates in SNARE-induced membrane fusion. Proc Natl Acad Sci U S A. 103, 19731-19736 (2006).
- Diao, J., et al. A single-vesicle content mixing assay for SNARE-mediated membrane fusion. Nat Commun. 1, 1-6 (2010).
- Kyoung, M., et al. In vitro system capable of differentiating fast Ca2+-triggered content mixing from lipid exchange for mechanistic studies of neurotransmitter release. Proc Natl Acad Sci U S A. 108, E304-E313 (2011).
- Domanska, M. K., Kiessling, V., Stein, A., Fasshauer, D., Tamm, L. K. Single vesicle millisecond fusion kinetics reveals number of SNARE complexes optimal for fast SNARE-mediated membrane fusion. J Biol Chem. 284, 32158-32166 (2009).
- Kreutzberger, A. J., Kiessling, V., Tamm, L. K. High Cholesterol Obviates a Prolonged Hemifusion Intermediate in Fast SNARE-Mediated Membrane Fusion. Biophys J. 109, 319-329 (2015).
- Schwenen, L. L., et al. Resolving single membrane fusion events on planar pore-spanning membranes. Sci Rep. 5, 12006 (2015).
- Karatekin, E., et al. A fast, single-vesicle fusion assay mimics physiological SNARE requirements. Proc Natl Acad Sci U S A. 107, 3517-3521 (2010).
- Karatekin, E., Rothman, J. E. Fusion of single proteoliposomes with planar, cushioned bilayers in microfluidic flow cells. Nat Protoc. 7, 903-920 (2012).
- Smith, M. B., et al. Interactive, computer-assisted tracking of speckle trajectories in fluorescence microscopy: application to actin polymerization and membrane fusion. Biophys J. 101, 1794-1804 (2011).
- Stratton, B. S., et al. Cholesterol Increases the Openness of SNARE-mediated Flickering Fusion Pores. Biophysical journal. 110, (2016).
- Diao, J., et al. Synaptic proteins promote calcium-triggered fast transition from point contact to full fusion. Elife. 1, e00109 (2012).
- Kiessling, V., Domanska, M. K., Tamm, L. K. Single SNARE-mediated vesicle fusion observed in vitro by polarized TIRFM. Biophys J. 99, 4047-4055 (2010).
- Blasi, J., et al. Botulinum neurotoxin A selectively cleaves the synaptic protein SNAP-25. Nature. 365, 160-163 (1993).
- Washbourne, P., et al. Genetic ablation of the t-SNARE SNAP-25 distinguishes mechanisms of neuroexocytosis. Nat Neurosci. 5, 19-26 (2002).
- Diaz, A. J., Albertorio, F., Daniel, S., Cremer, P. S. Double cushions preserve transmembrane protein mobility in supported bilayer systems. Langmuir. 24, 6820-6826 (2008).
- Floyd, D. L., Ragains, J. R., Skehel, J. J., Harrison, S. C., van Oijen, A. M. Single-particle kinetics of influenza virus membrane fusion. Proc Natl Acad Sci U S A. 105, 15382-15387 (2008).
- Albertorio, F., et al. Fluid and air-stable lipopolymer membranes for biosensor applications. Langmuir. 21, 7476-7482 (2005).
- Daniel, S., Albertorio, F., Cremer, P. S. Making lipid membranes rough, tough, and ready to hit the road. Mrs Bulletin. 31, 536-540 (2006).
- Gao, Y., et al. Single reconstituted neuronal SNARE complexes zipper in three distinct stages. Science. 337, 1340-1343 (2012).
- Kenworthy, A. K., Hristova, K., Needham, D., Mcintosh, T. J. Range and Magnitude of the Steric Pressure between Bilayers Containing Phospholipids with Covalently Attached Poly(Ethylene Glycol). Biophys J. 68, 1921-1936 (1995).
- Knoll, W., et al. Solid supported lipid membranes: New concepts for the biomimetic functionalization of solid surfaces. Biointerphases. 3, Fa125-Fa135 (2008).
- Quinn, P., Griffiths, G., Warren, G. Density of newly synthesized plasma membrane proteins in intracellular membranes II. Biochemical studies. J Cell Biol. 98, 2142-2147 (1984).
- Sund, S. E., Swanson, J. A., Axelrod, D. Cell membrane orientation visualized by polarized total internal reflection fluorescence. Biophys J. 77, 2266-2283 (1999).
- Johnson, D. S., Toledo-Crow, R., Mattheyses, A. L., Simon, S. M. Polarization-controlled TIRFM with focal drift and spatial field intensity correction. Biophys J. 106, 1008-1019 (2014).
- Anantharam, A., Onoa, B., Edwards, R. H., Holz, R. W., Axelrod, D. Localized topological changes of the plasma membrane upon exocytosis visualized by polarized TIRFM. J Cell Biol. 188, 415-428 (2010).
- Axelrod, D. Carbocyanine dye orientation in red cell membrane studied by microscopic fluorescence polarization. Biophys J. 26, 557-573 (1979).
- Wang, T., Smith, E. A., Chapman, E. R., Weisshaar, J. C. Lipid mixing and content release in single-vesicle, SNARE-driven fusion assay with 1-5 msec resolution. Biophys J. 96, 4122-4131 (2009).
- Chernomordik, L. V., Frolov, V. A., Leikina, E., Bronk, P., Zimmerberg, J. The pathway of membrane fusion catalyzed by influenza hemagglutinin: restriction of lipids, hemifusion, and lipidic fusion pore formation. J Cell Biol. 140, 1369-1382 (1998).
- Takamori, S., et al. Molecular anatomy of a trafficking organelle. Cell. 127, 831-846 (2006).
- Wilhelm, B. G., et al. Composition of isolated synaptic boutons reveals the amounts of vesicle trafficking proteins. Science. 344, 1023-1028 (2014).
- Scott, B. L., et al. Liposome fusion assay to monitor intracellular membrane fusion machines. Methods Enzymol. 372, 274-300 (2003).
- Linkert, M., et al. Metadata matters: access to image data in the real world. J Cell Biol. 189, 777-782 (2010).
- Soumpasis, D. M. Theoretical analysis of fluorescence photobleaching recovery experiments. Biophys J. 41, 95-97 (1983).
- Ohki, S. A mechanism of divalent ion-induced phosphatidylserine membrane fusion. Biochim Biophys Acta. 689, 1-11 (1982).
- Berquand, A., et al. Two-step formation of streptavidin-supported lipid bilayers by PEG-triggered vesicle fusion. Fluorescence and atomic force microscopy characterization. Langmuir. 19, 1700-1707 (2003).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys J. 47, 105-113 (1985).
- Rawle, R. J., van Lengerich, B., Chung, M., Bendix, P. M., Boxer, S. G. Vesicle fusion observed by content transfer across a tethered lipid bilayer. Biophys J. 101, L37-L39 (2011).
- Wagner, M. L., Tamm, L. K. Reconstituted syntaxin1a/SNAP25 interacts with negatively charged lipids as measured by lateral diffusion in planar supported bilayers. Biophys J. 81, 266-275 (2001).
- Kalb, E., Frey, S., Tamm, L. K. Formation of Supported Planar Bilayers by Fusion of Vesicles to Supported Phospholipid Monolayers. Biochimica Et Biophysica Acta. 1103, 307-316 (1992).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır