Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
SNARE-опосредованного Слияние единого Протеолипосомы с ПРИВЯЗНЫХ Поддержанные Бислои в ячейке Микрожидкостных Flow, отслеживаемых поляризованной TIRF микроскопией
В этой статье
Резюме
Здесь мы приводим протокол для обнаружения одиночных, SNARE-опосредованного слияния событий между липосомами и поддерживаемых бислоями в микроканалов с помощью поляризованных TIRFM, с одной молекулой чувствительностью и ~ 15 мс временным разрешением. Липидный и растворимым высвобождением груза могут быть обнаружены одновременно. Размер липосом, липидный температуропроводности, слитый пор свойства измеряются.
Аннотация
В повсеместного процессе слияния мембран открытие поры слияния устанавливает первое соединение между двумя ранее отдельными отсеками. Во время нейромедиатора или выделения гормона через экзоцитоза, слитый пор может скоротечно открываются и закрываются неоднократно, регулирующие кинетика высвобождения груза. Динамика Поры также определить режим рециркуляции везикул; необратимые результаты распечатывания в переходном, "целуют и беги" фьюжн, в то время как дилатация приводит к полному слиянию. Чтобы лучше понять , какие факторы определяют динамику пор, мы разработали анализ для контроля за слияние мембран с использованием поляризованного полного внутреннего отражения флуоресценции (TIRF) микроскопия с одной молекулой чувствительностью и ~ 15 мс разрешение времени в биохимически хорошо определены в пробирке системы. Слияние флуоресцентно меченных небольшие однослойные везикулы, содержащие V-SNARE белки (V-SUV) с плоской двуслойной подшипник Т-силков, нанесенный на мягкую полимерную подушке (трет-SBL, т при поддержке бислой), Находится под контролем. Анализ использует микроканалов потоков, которые обеспечивают минимальное потребление пробы при подаче постоянной плотности внедорожников. Эксплуатируя быстрое усиление сигнала при передаче липидных меток от SUV к SBL в процессе слияния, кинетика переноса липидного красителя контролируется. Чувствительность TIRF микроскопии позволяет отслеживать одиночные флуоресцентные липидные метки, из которых липидный коэффициент диффузии и размер SUV может быть выведенные для каждого события слияния. Жировые время высвобождения красителя может быть намного больше, чем ожидалось, для беспрепятственного прохождения через постоянно открытые поры. Используя модель, которая предполагает замедление высвобождения липидов из-за поры мерцает, пористую "открытости", доля времени пор остается открытым во время сварки, может быть оценена. Растворимый маркер может быть воплощен в SUVs для одновременного мониторинга липидного и растворимого высвобождения груза. Такие измерения показывают некоторые поры могут запечатать после потери доли растворимого груза.
Введение
Мембранные слияние является универсальным биологическим процессом , необходимый для внутриклеточного транспорта липидов и белков, секреции, оплодотворение, развитие и окутал запись вируса в организме - хозяине 1-3. Для большинства реакций внутриклеточного синтеза , включая высвобождение гормонов и нейротрансмиттеров через экзоцитоза, энергия для сплавления двух бислоев обеспечивается образованием четырех-винтового пучка между родственными растворимы N-этилмалеимид-чувствительных рецепторов прикрепление белок фактора (SNARE) белки, закрепленные в везикулы (V-SNARE) и целевой мембрана (трет-SNARE) 4, соответственно. Synaptic пузырек экзоцитоза является наиболее жестко регулируется термоядерная реакция и происходит в течение миллисекунды после прихода к потенциала действия 1,4,5. Слияние пор, начальное соединение между двумя дублирующих отсеков, могут мерцать открытые и закрытые несколько раз , прежде чем опечатывания или расширения необратимо 5-7. Прежние результатыв переходном процессе, "поцелуй и запустить" слияние, в то время последних приводит к полному слиянию. Факторы , определяющие баланс между этими двумя режимами слияния и механизмов , регулирующих пор мелькать недостаточно хорошо изучены 5,8.
SNARE белки необходимы для экзоцитоза; синаптической слияние везикул упразднены при расщеплении SNAREs нейротоксинами 9. Массовые эксперименты с использованием слитых небольшие однослойные везикулы (SUV) показал , что SNAREs не только необходимо, но и достаточно , чтобы диск слияние мембран 10. В этом объемном анализе внедорожников восстанавливали с треугольным SNAREs (V-SUV) легировались флуоресцентных фосфолипидов (N - (7-нитро-2-1,3-benzoxadiazol-4-ил) -phosphoethanolamine (НБД-РЕ) и ( N -. (лиссамин родамина B сульфонил) -phosphoethanolamine (LR-PE) и смешивают с немеченых везикул , содержащих трет-SNAREs (T-SUV) Первоначально флуоресценции NBD-PE в V-внедорожников гасят Форстера резонансного переноса энергии (FRET ) для LR-PE. в лабораторииeled V-внедорожников сливаться с немеченых т-внедорожников, плотность флуорофор поверхности в объединяемых теперь мембраны уменьшается , и в результате увеличения НБД-PE флуоресценции сообщает степень липидного смешивания 10. По мере того как основная часть анализа легко настроить и анализировать, он широко используется для изучения механизмов SNARE-опосредованного слияния 10-14. Тем не менее, он имеет ряд недостатков, таких как низкая чувствительность и низким разрешением времени. Самое главное, как совокупность измерений, она составляет в среднем результаты по всем событиям, делающих дискриминацию между стыковке и фьюжн, а также обнаружение hemifusion промежуточных сложных.
За последнее десятилетие несколько групп, в том числе у нас, разработали новые анализы для мониторинга слитые событий на одном уровне везикул 15-27. Ха и его коллеги использовали V-внедорожники ПРИВЯЗНЫХ на поверхность и контролировать их слияние с бесплатными т-внедорожников 18,19. Липидный смешивание контролировали с помощью FRET между парой липидных переплете флуорофоров EMутопленным в v- и Т-внедорожников, соответственно, с использованием полного внутреннего отражения флуоресценции (TIRF) микроскопии 18. Позже лаборатория Brunger использовали один вид липидами этикетки вместе с маркером содержание для одновременного определения липидов и содержание смешивания 20,28. Оба липида и маркеры содержание были включены при высоких, самогасящихся концентрации; слияние с немеченых внедорожников привело к флуоресценции dequenching 20,28.
Другие слиты V-внедорожников для плоских двухслойных воссозданных с трет-SNAREs 15-17,21-27,29. Плоская геометрия мишени (трет-SNARE, содержащий) двухслойная лучше имитирует физиологический процесс слияния небольших, высоко загнутыми везикул с плоской мембраной плазмы. Группа Стеинем использовали поры мембраны остовного реконструированные с трет-SNAREs, подвешенные над пористой подложке из нитрида кремния и обнаружено слияние с отдельными клиновых внедорожников с помощью конфокальной лазерной сканирующей микроскопии 23. Другие Fб клиновые внедорожников в планарный бислоями восстанавливали трет-SNAREs, нанесенный на стеклянную подложку 15-17,21,22,24-27,29. Большим преимуществом использования поддерживаемых бислоя (SBLs) является то, что TIRF микроскопия может быть использована для обнаружения стыковки и фьюжн события с отличным отношением сигнал-шум и без помех со стороны свободных v-внедорожников, хотя использование микрофлюидики также обеспечивает разрешение одного события, используя стандарт дальнего поля эпифлуоресцентной микроскопии 24.
Одной из основных проблем является, влияют ли и как субстрат-двухслойная взаимодействие поддерживается качество двухслойную и процесс сварки. Ранние работы использовали плоских SBLs, непосредственно нанесенных на стеклянную или кварцевую подложку 15-17. Эти SBLs были сделаны с помощью адсорбции, распирает, распространение и слияние T-SUV мембраны на подложке. Вскоре стало ясно, однако, что опуская ключевой компонент трет-силки, SNAP-25, из SBLs, полученных таким образом, привело к v-SUV стыковки и слияния кинетики indistinguisHable от полученных с использованием полного трет-SNAREs 17. Поскольку SNAP-25 абсолютно необходим для синтеза в естественных условиях 30,31, физиологическая значимость этих ранних попыток была поставлена под сомнение. Группа Тамма преодолели эту проблему, используя более эффективный контроль при поддержке формирования двухслойную 21. Он использовал осаждение пленок Ленгмюра-Блоджетт для безбелковом первой листке SBL, с последующим слиянием этого монослоя с Т-21 внедорожников. Это привело к SNAP-25-зависимого синтеза.
Для того, чтобы избежать возможных артефактов , связанных с бислой поддерживается непосредственно на стеклянной подложке без необходимости использования методов Ленгмюра-Блоджетт, Karatekin и др. Ввели мягкую, гидратированный поли (этиленгликоль) (ПЭГ) подушку между бислой и подложкой 24. Эта модификация также привело к SNAP-25-зависимого слияния 24. Бислои подкладкой на мягком полимерном слое было известно лучше сохранить трансмембранныйподвижность белка и функции 32, и были использованы в слитых исследованиях с вирусами 33. Кроме того, ПЭГилированные двухслойные , кажется, сохраняют некоторую способность к самовосстановление и являются очень прочными 34,35. Во-первых, часть коммерчески доступных, липидные-сшитый цепей ПЭГ включены в T-SUV мембраны. Когда эти Т-внедорожники лопаются и образуют плоскую бислой на стеклянной подложке, щетка ПЭГ охватывает как листовки плоского бислой. Поскольку образование планарных бислой обусловлена адгезией цепей ПЭГ, окружающих т-внедорожников на гидрофильной поверхности стекла, липосомами разрывной и образование планарных бислой относительно нечувствительны к липидной композиции, используемой. Однако, когда большое количество холестерина включены, увеличивая липких свойства внедорожников, внедорожники не могут лопнуть спонтанно. Если это так, осмотический ионы ударные или двухвалентные могут быть использованы , чтобы помочь образованию двухслойных планарный 25.
Как упоминалось выше, в этом аргах щетка ПЭГ охватывает обе стороны плоской, поддерживается бислой. Щетки перед каналом микрожидкостных потока помогает предотвратить неспецифическую адгезию входящих v-внедорожников, которые также, как правило, покрыты слоем PEG. Формирование V- и T-SNARE комплексов начинается с мембранно-дистальный N-концах и протекает в стадии по отношению к мембране проксимальных доменов 36. Для клиновых внедорожников взаимодействовать с трет-SBL, в v- и трет-SNARE N-концы необходимости выступать над щетками PEG, который, кажется, дело в условиях анализа. Высота щетки может быть адаптирована для изучения отличных SNAREs белков путем варьирования плотности пегилированного липидов и длину 37,38 ПЭГ - цепи. Еще одно преимущество щеток PEG , охватывающих проксимальные поверхности клеевой бислоев, что они имитируют переполненном окружающую среду биологических мембран , которые упакованы с 30000-40000 интегральными мембранными белками на квадратный микрон 39. Так же, как и цепей ПЭГ в этом анализе Республики Корlsive белковый слой, покрывающий биологические мембраны должен быть выдвинут в сторону, чтобы обеспечить контакт между двумя фосфолипидных бислоев для слияния, чтобы произойти.
Микрожидком проточные каналы используются в данном анализе, так как они предлагают уникальные преимущества. Во-первых, Микрожидкостных поток обеспечивает более равномерное осаждение Т-внедорожников для распространения и предохранитель, чтобы сформировать Т-SBL. Во-вторых, малый объем канала (<1 мкл) сводит к минимуму потребление пробы. В-третьих, малые объемы, необходимые позволяют весь эксперимент будет проводиться под постоянным потоком. Flow удаляет слабо, по- видимому , неспецифически, прилипшие V-внедорожники от SBL 16. Он также поддерживает постоянную плотность клиновых внедорожников выше трет-SBL, упрощающих кинетический анализ 17. И, наконец, стыковка везикулы легко отличить от свободных , переносимых потоком 25. В-четвертых, несколько микроканалов могут быть использованы в той же покровным, каждый зондировании другое состояние. Это позволяет проводить сравнение условий Дуринг один и тот же экспериментальный прогон. Аналогичный подход был использован группой ван Oijen изучить слияние между вирусом гриппа и уютными SBLs 33.
В TIRF микроскопии, экспоненциальный распад исчезающего поля (с постоянной распада ~ 100 нм) ограничивает возбуждения флуоресценции тех молекул, которые находятся в непосредственной близости от поверхности раздела стекла и буфера. Это сводит к минимуму вклад флуоресцентных молекул, которые еще дальше, увеличивает отношение сигнал-шум и позволяет одиночной молекулы чувствительности с временем экспозиции кадра 10-40 мс. Затухающих поле также приводит к увеличению сигнала после слияния: в качестве меченого переноса липидов из джипа в SBL, они оказываются, в среднем, в более сильном поле возбуждения. Это увеличение флуоресценции сильнее для больших липосом.
Если поляризованный свет используется для генерации эванесцентной поля, дополнительные эффекты способствуют изменения флуоресценции при Тransfer этикеток из внедорожника в SBL. Некоторые липидные красители имеют дипольный ориентированный с предпочтительным средним углом по отношению к бислой, в котором они включены. Это создает разницу в количестве флуоресценции , испускаемой флуорофоров , когда они находятся в SUV по отношению к SBL, так как поляризованный пучок будет возбуждать красители в двух мембран по- разному. Для первого пучка возбуждения будет взаимодействовать с переходной диполей, ориентированных вокруг сферического SUV, в то время как для последних, ориентации диполей будет ограничена плоской геометрией SBL. Например, при использовании S-поляризованный падающий свет (поляризованный по нормали к плоскости падения), возбуждение является более эффективным , когда краситель находится в SBL , чем в SUV для липидного красителя дипольных ориентированной параллельно мембране 29,40 (как , например, из DiI или Оказалась 41-43). Внедорожник , легированного с такой флуорофора тускнеет , когда он доки на SBL (рисунок 7, предст Результаты ив). Как слитый отверстие открывается и соединяет джипа и SBL мембран, флуоресцентные зонды диффундировать в SBL и стать более вероятно, будут возбуждаться S-поляризованный затухающих поле 25,27,29. Следовательно, сигнал флуоресценции интегрированы вокруг зоны сварки резко возрастает во время переноса красителя из джипа в SBL 27 (рисунок 3 и рисунок 7). Дополнительным фактором, который вносит свой вклад в сигнал изменения, которые сопровождают слияние dequenching флуоресцентных меток, поскольку они разбавляются при передаче в SBL. Вклад dequenching, как правило, незначительны по сравнению с исчезающим полем распада и поляризационных эффектов в анализе, описанном здесь, потому что лишь небольшая часть (  ) Липидов, помечены.
) Липидов, помечены.
Увеличение сигнала при слиянии могут быть использованы вывести свойства поры слияния путем сравнения времени,1 "SRC =" / файлы / ftp_upload / 54349 / 54349eq2.jpg "/>, необходимое для липидный бежать через поры, которая свободно проницаема для липидов к фактическому времени выпуска,  , Если два шкалы времени сопоставимы, было бы сделать вывод о том, что пора представляет небольшое сопротивление потоку липидов. Тем не менее, если фактическое время высвобождения значительно больше, чем время для диффузионного ограниченного выпуска, это будет указывать на процесс, такие как поры мерцанием, замедляющие высвобождение липидов. Диффузии ограниченного времени выпуска,
, Если два шкалы времени сопоставимы, было бы сделать вывод о том, что пора представляет небольшое сопротивление потоку липидов. Тем не менее, если фактическое время высвобождения значительно больше, чем время для диффузионного ограниченного выпуска, это будет указывать на процесс, такие как поры мерцанием, замедляющие высвобождение липидов. Диффузии ограниченного времени выпуска,  , Зависит от размера плавящимся липосом и липидный-диффузивности; его оценка требует эти два параметра должны быть определены количественно. Одна молекула чувствительность анализа позволяет липидный коэффициент диффузии измеряется путем отслеживания нескольких одного липидные флуорофоры после их высвобождения в SBL для каждого слитого события 26. Размер каждого сплавленных везикулыможно оценить 27 путем объединения (I) интенсивность одного липидного красителя (II) изменение общей флуоресценции вокруг док - сайта после того, как все флуорофоры переносятся в SBL при слиянии, (III) известной плотности маркировки внедорожника липиды, и (IV), область на липида. Для многих слитых событий, были найдены фактическое время высвобождения липидов, гораздо медленнее , чем ожидалось диффузионной-регулируемого высвобождения 27, как было отмечено ранее в предположении унифицированный размер SUV 44. Предполагая , что замедление высвобождения липидов из - за пор мерцает, количественная модель позволяет оценить "открытость пор", доля времени пор остается открытым во время плавления 27.
, Зависит от размера плавящимся липосом и липидный-диффузивности; его оценка требует эти два параметра должны быть определены количественно. Одна молекула чувствительность анализа позволяет липидный коэффициент диффузии измеряется путем отслеживания нескольких одного липидные флуорофоры после их высвобождения в SBL для каждого слитого события 26. Размер каждого сплавленных везикулыможно оценить 27 путем объединения (I) интенсивность одного липидного красителя (II) изменение общей флуоресценции вокруг док - сайта после того, как все флуорофоры переносятся в SBL при слиянии, (III) известной плотности маркировки внедорожника липиды, и (IV), область на липида. Для многих слитых событий, были найдены фактическое время высвобождения липидов, гораздо медленнее , чем ожидалось диффузионной-регулируемого высвобождения 27, как было отмечено ранее в предположении унифицированный размер SUV 44. Предполагая , что замедление высвобождения липидов из - за пор мерцает, количественная модель позволяет оценить "открытость пор", доля времени пор остается открытым во время плавления 27.
Всякий раз, когда практические, важно проверить механизмы слитые с использованием как липидный и растворимые содержимое этикетки. Например, высвобождение липидов может быть тормозится отличных пор мерцанием процессов, таких как ограничение диффузии липидов с помощью силки белков, которые окружают тон пор. Если бы это было так, то выброс содержимого будет предшествовать выпуск липидных меток, при условии, что поры достаточно большой, чтобы позволить прохождение растворимых зондов. Более фундаментальный недостаток в подходе может быть в предположении, что передача меченых липидов в SBL происходит через узкий поры слияния, соединяющей SBL с пузырьком, который в значительной степени сохранил свой предварительно слитый форму. Перенос липидов в SBL может также быть результатом быстрого дилятацией поры слияния с сопутствующим, чрезвычайно быстрым распадом SUV в мембрану SBL, как и предполагалось ранее на основе данных высвобождения липидного только 29. Мониторинг жиро- и содержание выпустить одновременно, было обнаружено , что многие поры закупорить после освобождения всех их липидного метки, но сохранил некоторые из их растворимой груза 27. Это указывает на то, что по крайней мере некоторые липосомы не разрушаются в SBL после слияния, и что передача липидная красителя в SBL происходит через поры слияния. Кроме того, лIPID и содержание релиз произошло одновременно 27, что делает его маловероятным , что замедление высвобождения липидов было связано с затруднением диффузии липидов с помощью SNARE белков , окружающих поры 45.
Протокол слияния SUV-SBL , который не контролировать содержание растворимых релиз ранее опубликованных Karatekin и Ротман 25. Здесь более недавние события включены, а именно одновременный мониторинг липидов и содержание релиз и оценка SUV, липидных и слитый пор свойства 27. Протокол начинается с инструкции по подготовке Микрожидкостных клетки, изготовленные путем соединения поли (диметил силоксан) (PDMS) эластомер блок , содержащий канавки с покровным стеклом 25. Далее, подготовка V-внедорожников с обоими липида и содержание маркеров объясняется. Разделы 4 и 5 содержат инструкции по сборке Микрожидкостных клеток, образуя SBLs на месте и проверки на наличие дефектов и текучестью, введение VŠUVS в клетки потока и обнаружение слитых событий. Раздел 6 содержит инструкции для анализа данных.
протокол
1. Подготовка PDMS блока, чтобы сформировать канал микрожидком
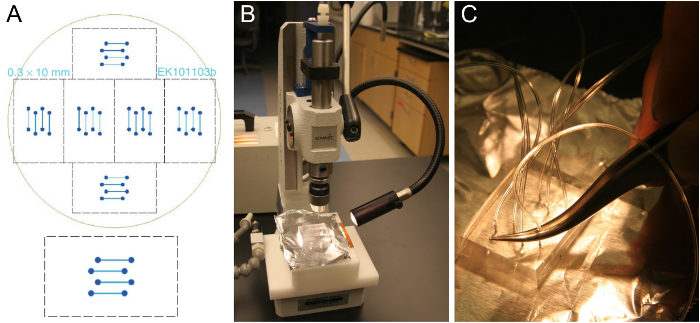
Рисунок 1. микротехнологий шаблона проточной ячейки и подготовки PDMS блока. (А) Конструкция проточной ячейки четырехканальной , который помещается на покровным стеклом 24 х 60 мм (снизу). Шесть одинаковых конструкций выполнены с возможностью размещения на кремниевой пластине 10 см (сверху). (Б) Вырежьте блок толщиной PDMS около 5-8 мм на отверстие перфоратором. (C) Вставка трубки в пробитое отверстие с помощью пинцета. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Получить шаблон проточной ячейки , например, на рисунке 1А. Типичные каналы шириной 0,3-1 мм, 70-100 мкм высокой, и длиной 1-2 см. Изготовить шаблон с намиING стандартных методов фотолитографии в чистой комнате объекта 25 или для того , если доступ чистых помещений недоступен. В качестве альтернативы, машина шаблон с большими размерами из подходящего материала.
Примечание: Сотрудники Cleanroom могут обучать и направлять неопытных пользователей (доступ к чистой комнате объекта всегда ограничен для пользователей с надлежащей подготовки) в области разработки и упорядочения маски, очистки поверхности полупроводниковых пластин и фотолитографии. После того, как шаблон получается, он может быть использован вне чистого помещения многократно, при условии, что хранится в закрытой посуде и приняты меры, чтобы исключить пыль. - Приготовить смесь из ~ 100 PDMS мл (силиконовый эластомер основа) и ~ 10 мл сшивающего агента (отвердитель) в одноразовом пластиковом стакане. Оторвать кончик пипетки одноразового использования для обработки вязких PDMS более легко. Взвесьте PDMS в пластиковый стаканчик, как пипеткой не является точным.
- Перемешать смесь хорошо. Удалите много воздушных пузырьков дегазацией в вакуумном эксикаторе (около 20мин). По мере того как чашка помещается под вакуумом, пузырьки будут первоначально растут в размерах, увеличивая объем смеси значительно. Контроль вакуума, который применяется и убедитесь, что чаша достаточно глубоко, чтобы избежать разлива.
- Залить большую каплю дегазированной смеси PDMS в стеклянную чашку Петри (150 мм х 20 мм) и нажмите на пластину на PDMS с шаблоном лицевой стороной вверх. Это позволяет избежать пузырьков в ловушке под пластиной. Захваченные пузырьки будут расширяться и могут иметь наклон пластины, когда блюдо помещается в печь. Теперь налить дегазирован PDMS на шаблон в верхней части пластины до тех пор, пока не будет покрыто около 5-8 мм PMDS. Если воздушный пузырь происходит аккуратно удалить его с кончика пипетки.
- Выпекать PMDS в печи при температуре 60 ° С в течение 3 ч. Убедитесь в том, что блюдо уровень.
- Используйте новый лезвие скальпеля, чтобы вырезать PDMS блок, содержащий формованные структуры каналов. Вырезанный блок должен соответствовать на покровное (см шаг 4.1.9).
- Пил из вырезанного блок из тарелки и пласе его на кусок чистой алюминиевой фольги.
Примечание: Сшитые блоки PMDS могут храниться в течение нескольких месяцев. На одной пластине, есть 6 комплектов каналов потока (Фигура 1А), поэтому 6 PDMS блоки могут быть изготовлены в одном PDMS литья. После вырезания все 6 из PDMS блоков, чистых сыпучих кусков PDMS, но в противном случае не снимайте оставшиеся PDMS перед заливкой и сшивание следующую партию, что потребует лишь около половины PDMS, используемых для первой партии. Хороший шаблон может длиться несколько лет. - Используйте отверстие перфоратором для бурения через блок PDMS в одном прямом движении (рис 1В). Начало на стороне канавок канала. Не забудьте удалить штампуют кусок PDMS. Повторите эту процедуру для всех восьми отверстий конструкции четыре канала.
- Поместите сторону блок канала PDMS вниз на новый и без морщин кусок алюминиевой фольги. Храните блок на срок до нескольких месяцев в сухом боксе, в идеале в эксикаторе.
- Вставьте трубку (0,25 мм ID, 0,76 мм OD) около одной трети в пробитое отверстие с помощью пинцета (рис 1C). Обрежьте трубку наклонную для облегчения вставки. Оставьте трубки достаточно долго, чтобы достигнуть резервуара SUV и шприцевой насос, соответственно. После размещения в собранном виде чипа в микроскоп, вырезать трубки снова, если они слишком долго.
- Для подключения к шприцам насоса, вырезать короткую часть большего силиконовой трубки (0,51 мм ID, 2,1 мм OD) и вставьте тонкую трубку в одну сторону. Это готовый к использованию блок PDMS может храниться в течение нескольких месяцев.
2. покровного Очистка
- Чистые покровные в соответствии с протоколом , описанным в Karatekin и Ротманом 25 с использованием сильной окислительную смесь серной кислоты (H 2 SO 4) и пероксид водорода (H 2 O 2). Выполните эту процедуру в чистом помещении, и соблюдать соответствующие меры предосторожности. В качестве альтернативы, используйте чистых помещений очищено грoverslip, который является коммерчески доступным (см список материалов).
3. Подготовка V-Внедорожников, содержащей оба липидных и информационного наполнения Этикетки

Рисунок 2. Схема подготовки SUV. Липиды смешивают в стеклянной трубке (1) и растворитель выпаривают с образованием липидной пленки путем вращения трубки на водяной бане (2). Оставшиеся следы растворителя удаляют в высоком вакууме (3). Липидную пленку гидратируют в восстанавливающий буфер, содержащий детергент и белок в то время как перемешивают круговыми (4). Если содержание краситель должен быть инкапсулирован, он включен в этом шаге, а также на стадии разбавления (5). Разбавление концентрации моющего средства ниже его критической концентрации мицеллообразования приводит к образованию липосому. Моющее средство диализуют в течение ночи в сторону (6). Для T-внедорожников для формирования SBL включая NBD-PE (зеленый), пузырьки всплывают в градиенте плотности и собирали вграница раздела между двумя слоями (7а). Отделить V-внедорожники с герметизированной содержимого маркера из свободного красителя образец выполняется через колонку вытеснительной и собирали в 0,5 мл фракции (7b). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Приготовьте 4 л буфера, восстанавливающей, содержащей 25 мМ HEPES-KOH, 140 мМ KCl, 100 мкМ EGTA и 1 мМ DTT, рН 7,4. Используйте большую часть буфера для диализа и 100 мл для других шагов.
Примечание: Другие буферы могут быть использованы, но важно , чтобы поддерживать буфер осмолярность постоянной в течение всего эксперимента и выбрать условия , в которых белки являются функциональными. Для получения V-внедорожников , содержащих только липидные этикетки и т-внедорожников, следуют Karatekin и Ротман 25. - Поскольку запасы липидов хранят при -20 ° С в хлороформе или хлороформ: метанол (2: 1, об / об), пусть флаконах до комнатной температуры перед открытием вВо избежание образования конденсата.
- Ополосните стеклянную трубку с хлороформом, чтобы удалить следовые количества моющего средства и смешивать липиды в желаемом соотношении с конечным количеством 1 мкмоль в смеси хлороформа и метанола (2: 1, об / об). Используйте только стеклянные шприцы / трубки для обработки органических растворителей / растворенные липиды.
Примечание: липиды , используемые здесь POPC: SAPE: DOPS: Холестерин: PEG2000-DOPE: DiD при молярном соотношении 57,4: 15: 12: 10: 4,6: 1 для v-SNARE , содержащих везикулы и РОРС: SAPE: DOPS: Холестерин : мозг PI (4,5) P 2: PEG2000-DOPE: NBD-PE (54,9: 15: 12: 10: 3: 4,6: 0,5) для т-SNARE внедорожников. См Материал для деталей. Другие композиции липидов могут быть использованы. - Выпаривают растворитель при слабом токе азота, или в ротационном испарителе. Опустить конец трубки в водяной бане (37 ° C), нагревают до температуры выше самой высокой температуры плавления липидов с образованием гомогенной липидной пленки и, чтобы избежать больших изменений температуры во время выпаривания растворителя. Начало вакуума около300 мбар до тех пор пока липидная пленка не образуется, а затем продолжают в течение ~ 2 мин при максимально возможный вакуум в роторном испарителе.
- Удалите стеклянную трубку и завернуть его в алюминиевую фольгу, чтобы избежать воздействия света и удаления остаточных следов растворителя путем размещения трубки в эксикаторе под высоким вакуумом в течение не менее 2 часов. Этот шаг также может работать в течение ночи.
- Регидрировать высушенную липидную пленку, приготовить смесь моющего средства (н-октил-β-D-глюкопиранозид, OG), белок (V-SNAREs) и SRB в восстанавливающий буфер (500 мкл конечный объем). Хранить конечную концентрацию моющего средства, ~ 2 раза выше критической концентрации мицеллообразования (ККМ, 20-25 мМ для OG) и корректировки конечного объема таким образом, что моющее средство соотношение липидов составляет> 10. Растворите сульфородамина B (SRB) порошка в белковом растворе детергента, чтобы получить конечную концентрацию 10-50мм SRB, осторожно встряхивая раствор. Отрегулируйте осмолярность буфера восстанавливающей при добавлении высоких концентраций СРБ за счет сокращения сотрудничестваncentration хлорида калия соответственно.
Примечание: липида-к-белка соотношение (LP) для T-SNAREs высока (LP ~ 20000, ~ 70 т-SNAREs на кв микрон 25.). Значительно более высокая плотность т-SNARE в SBL может привести к неактивных белковых агрегатов с существенно снижает темпы слитые 17,24. LP для У-SNAREs значительно ниже (LP ~ 200, ~ 7000 V-SNAREs в мкм 2), близкие к плотности v-SNARE найденных на синаптических везикул 46,47. Для обеспечения функции белка после рекомбинантной экспрессии и очистки v- и трет-SNAREs полезно для выполнения простого насыпной фьюжн анализа 48 прежде , чем идти через все этапы единого анализа везикулы слияния. - Осторожно встряхните предварительно нагретом стеклянную трубку, содержащую высушенную липидную пленку при добавлении раствора белка-моюще-SRB со стадии 3.6. Постарайтесь, чтобы избежать создания пузырьков. Продолжайте встряхивают в течение 15 мин при 37 ° С.
- Разведите моющее средство в пять раз, добавляя воссозданиебуфер, содержащий SRB (добавьте 2 мл, 2,5 мл конечного объема), тогда как быстро встряхивая, чтобы избежать градиентов концентрации. Продолжайте встряхивают в течение 15 мин до 1 ч при 37 ° С.
Примечание: Более длительный инкубационный увеличение эффективности белка восстановления. Быстрое разбавление снижает концентрацию моющего средства ниже CMC и приводит к образованию мелких липосом. - Диализировать в суспензии везикул сначала против ~ 1 л восстанавливающий буфер в течение 1-2 ч при температуре окружающей среды и затем против 3 л восстанавливающий буфер на ночь при 4 ° С с 4 г полистирола адсорбента, используя 20000 MWCO диализную трубку или кассету. Используйте различные мензурки для диализа везикул с и без SRB для предотвращения перекрестного загрязнения.
- Равновесие гель-фильтрационную колонку с восстанавливающий буфер. Запуск везикул суспензии через колонку, чтобы отделить свободную SRB от V-внедорожников с инкапсулированной SRB. Используйте восстанавливающий буфер без SRB в качестве элюента смесь после того, как весь образец имеетвошел в колонку. Собирают V-внедорожников в 0,5 мл фракции.
- Проверка успешной SRB герметизацию при автомодельных гасили путем измерения концентрации SRB флуоресценции до и после добавления моющего средства к аликвоте пузырьках 16. Используя флуоресцентный спектрометр, возбуждают образца при длине волны 550 нм и сканируют излучение SRB между 570 нм и 630 нм. Ожидать 4-8 кратное увеличение SRB флуоресценции в зависимости от инкапсулированного количества моющего средства после того, как мембрана солюбилизируют и освобожденный СБО разбавляют.
- Охарактеризовать липидный и белковый восстановление с использованием флуоресцентной спектроскопии 24 и электрофорез SDS-PAGE гель соответственно. Используйте чувствительный метод окрашивания, особенно для высоких LP образцов Т-SUV (см список материалов). Как правило, приблизительно 50% от обоих липидов и белков вход теряется во время приготовления, что приводит к LP, близкой к номинальной стоимости.
- Охарактеризуйте размеры SUV с использованием динамического рассеяния света 24 или электронный microscoPY 48. Магазин SRB, содержащий V-внедорожников при 4 ° С до ~ 3-4 дней. Не замораживать, так как замораживание и оттаивание разрушает мембрану и высвобождает инкапсулированный SRB.
4. SUV-SBL Fusion анализа для мониторинга липида только релиз
- Формирование привязанной поддерживаемых бислоя в микроканалов потока
- Поместите блок PDMS (этап 1.11) в высоком вакууме в течение не менее 20 мин до эксперимента, чтобы удалить растворенные газы. Это значительно снижает риск возникновения воздушных пузырьков в микроканалов во время эксперимента фьюжн.
- Включите установку микроскопа и нагреть почву и держателя образца (фиг.3 и 4) до требуемой температуры.
- Фильтр буфер восстановленным используется для разбавления везикул через фильтр с размером пор 0,45 мкм или менее.
- Развести ~ 30 мкл NBD-PE-меченый т джипов или небелковых (пф-внедорожники) контроль липосом (АОраствор 0,5-1 мМ липида) с ~ 60 мкл буфера. Конечная концентрация не имеет решающего значения здесь.
- Дега эту смесь с помощью 3 мл шприца. Нажмите большую часть воздуха над образцом, держа шприц вертикально. Уплотнение (игла свободный) наконечник с помощью парафиновой пленки и создать вакуум, потянув вниз поршень. Нажмите цилиндр шприца, чтобы ускорить дегазацию раствора. Повторите эту процедуру несколько раз, пока не больше пузырьков не происходит, когда применяется вакуум.
- С помощью иглы для подкожных инъекций с диаметром немного больше, чем трубы, который присоединен к блоку PDMS, чтобы пробить отверстие в крышке микроцентрифужных трубки. Убедитесь, что штампуют кусок пластика не находится внутри трубки, как это может засорить трубопровод, соединенный с входным отверстием микрожидком канала позже.
- Заполните Дегазированную решение SUV в микроцентрифужных трубки, имеющей отверстие в крышке и поместите его в держатель на столике микроскопа для уравновешивания до заданной температуры.
- Plтуз ранее очищенную покровное (раздел 2) в чистой плазмы и запустить воздушную плазму в течение примерно 5 мин. Помещенный плазмы обработанный покровное (лечение стороной вверх) на вершине несколько безворсовых тканей, выступающей в качестве подушки.
- Удалите алюминиевую фольгу из дегазированной блока PDMS и поместить блок в верхней части покровного стекла. При повторном использовании блок PDMS надеть и снять кусок клейкой ленты на стороне канала, чтобы очистить его. Нажмите вниз PDMS блок на покровное с помощью пинцета, чтобы сделать его придерживаться, но не нажимайте слишком сильно, как стекло может сломаться.
- Поместите собранный проточную ячейку на столик микроскопа и подключить трубку к резервуару SUV и шприцевой насос, соответственно. Лента покровное на сцену (рис 3B).
- Запуск аспирационных внедорожников в 3 мкл / мин до тех пор, пока раствор не заполняет каналы полностью (~ 2,25 мм / с при х 300 мкм канала сечением 75 мкм). Когда решения для всех каналов начинают двигаться вверх-ед трубы на стороне выхода, уменьшить расход до 0,5 мкл / мин и инкубировать в течение 30-45 мин.
Примечание: Время между плазменной обработки предметного стекла и протекающий внедорожников в канале не должна превышать 10-20 мин , как эффект плазменной обработки непостоянно. - Проверьте каналы для какой-либо утечки. Используйте объектив 10-20X воздуха для наблюдения NBD-PE флуоресценции от NBD-PE, содержащего t- или пф-внедорожников. Excite НБД флуорофоров с использованием 488 нм лазер. Утечки трудно обнаружить с помощью светлого поля освещения.
- Положите трубку с дегазированной буфером восстанавливающей в держатель, и пусть температура уравновешивания, как быстрые изменения температуры могут вызвать дефекты в SBL. Остановить поток и ждать ~ 1 мин, чтобы убедиться, что поток полностью остановлен и не воздушный пузырь не будут набраны в трубку перед переключением впускной трубы к дегазированной буфера.
- Промойте все каналы с дегазированной буфером, чтобы смыть несвязанных внедорожников.
- Переключиться на ВЫСОг объективное увеличение TIRF (60X, масло, Н. А. 1.45-1.49) и убедитесь, что двухслойная выглядит однородным и свободен от каких-либо очевидных крупномасштабных дефектов, таких как темные пятна или липидных канальцев, простирающихся из SBL.
- Проверьте текучесть бислой
- Если выделенный блок FRAP недоступен, или если последовательность FRAP не может быть запрограммирована, то качественно тест текучесть мембран следующим образом.
- Закройте полевую диафрагму малого размера (диаметром ~ 40 мкм) и регулировать интенсивность света возбуждения 488 нм с помощью программного обеспечения (20-80 мкВт, или 15-60 нВт / мкм2) отбелить флуоресценции НБД-PE в облученной площадь значительно, но не полностью. Для бислой жидкости, в устойчивом состоянии, интенсивность флуоресценции в середине пораженном участке должна быть ниже, чем у краев, а интактные молекулы НБД-PE ввести пораженный участок и диффузные определенное расстояние до того отбеливания. В противоположность этому, если поверхностно-придерживалась SУвс не удалось прорваться, или по какой другой причине поддерживается двухслойная не жидкость, все флуорофоры в пораженном участке следует отбеливать.
Примечание: значения интенсивности лазерного излучения в этом и последующих шагов приводятся в качестве приблизительного отправной точки и должны быть оптимизированы для данного набора условий. - Остановить освещение и запустить его снова через несколько минут, чтобы проверить результаты стационарных измерений
- Закройте полевую диафрагму малого размера (диаметром ~ 40 мкм) и регулировать интенсивность света возбуждения 488 нм с помощью программного обеспечения (20-80 мкВт, или 15-60 нВт / мкм2) отбелить флуоресценции НБД-PE в облученной площадь значительно, но не полностью. Для бислой жидкости, в устойчивом состоянии, интенсивность флуоресценции в середине пораженном участке должна быть ниже, чем у краев, а интактные молекулы НБД-PE ввести пораженный участок и диффузные определенное расстояние до того отбеливания. В противоположность этому, если поверхностно-придерживалась SУвс не удалось прорваться, или по какой другой причине поддерживается двухслойная не жидкость, все флуорофоры в пораженном участке следует отбеливать.
- Программирования последовательности FRAP для более количественного измерения, если это возможно. См дополнительные файлы и соответствующие условные обозначения для деталей.
Примечание: Иногда Внедорожники будут придерживаться на покровного стекла, но не лопаются и образуют бислой жидкости. Если это произойдет, промойте каналы с дегазированной восстанавливающий буфер , содержащий 10 мМ Mg 2+ , чтобы помочь образованию поддерживаемую двухслойное. С помощью флуоресцентного отбеливания для оценки двухслойную текучестью согласно пункту 4.2. После того, как двухслойная жидкость образуется, ополоснуть Mg 2+ -бесплатно выздоровеетnstitution буфера.
- Если выделенный блок FRAP недоступен, или если последовательность FRAP не может быть запрограммирована, то качественно тест текучесть мембран следующим образом.
- Представляя V-внедорожники в микроканалов потока
- Дега восстановление буфера и использовать его для разбавления исходного раствора v-SUV с коэффициентом около 10 3 до 10 5 в зависимости от концентрации акций v-SUV. Цель для разбавления, которое приводит к приблизительно 10-100 слитых событий в течение 60 с в поле зрения.
Примечание: Слишком много слитые увеличения фоновой флуоресценции (поскольку каждое событие месторождений LR-PE или же липидные метки в SBL) и сделать обнаружение и анализ слитых событий трудно. В противоположность этому, скорость слияния, что слишком низкие результаты в плохой статистики или требует приобретения многих других фильмов. Для концентрации v-SUV 0,1 мМ липида, начните путем разбавления 5 мкл SUV запас в 995 мкл буфера восстанавливающей, а затем разбавить 5-50 мкл этого в 950-995 мкл восстанавливающий буфер. - Пусть температура уравновешивания перед остановкой потока и INSERтин впускной трубки в разбавленный раствор v-SUV.
- Отрегулируйте угол TIRF и поляризацию следующим образом.
- После установки желаемой поляризации путем поворота луча возбуждения, регулировки наклона зеркала командным положение луча с помощью шагового двигателя с помощью программного обеспечения. Медленно перемещайте положение лазерного луча от центра объектива на задней фокальной плоскости в одну сторону от центра. Обратите внимание на свет из объектива на передней стороне всплывать с увеличивающимся углом относительно объективной оси, как положение перемещается дальше от центра.
- Обратите внимание на положение двигателя при выходе луч сначала исчезает в цель, то есть, когда МДП впервые достигнута.
- Медленно двигаться положение луча дальше от центра, контролируя при этом флуоресценции от поверхности. Обратите внимание, положение двигателя, когда поверхность флуоресценция исчезает, когда луч переместился слишком далеко от центра.
- Выберите луч Positio п между двумя крайними определены выше. Для достижения наилучшего соотношения сигнал-шум и более усиление сигнала при слиянии, выберите малую глубину проникновения (положение луча ближе к краю цели), которая до сих пор обеспечивает равномерное освещение viewfield.
Примечание: Лучше всего , чтобы сохранить ту же позицию луча МДП (такой же глубины проникновения) для всех экспериментов после настройки оптимизированы. Убедитесь, что вращающаяся поляризация не приводит к изменению положения луча.
- Поток V-образным SUVs в канал со скоростью потока 2 мкл / мин, что соответствует средней линейной скорости потока ~ 1,5 мм / с для поперечного сечения 75 мкм х 300 мкм. Переключение в режим настройки возбуждения / эмиссии для контроля липида смешивания (LR или сделал только).
- Дега восстановление буфера и использовать его для разбавления исходного раствора v-SUV с коэффициентом около 10 3 до 10 5 в зависимости от концентрации акций v-SUV. Цель для разбавления, которое приводит к приблизительно 10-100 слитых событий в течение 60 с в поле зрения.
- Наблюдая слияние между отдельными клиновых внедорожников и SBL
.jpg "/>
Рисунок 3. Экспериментальная установка pTIRF. (А) Схематическое представление V-SUV и трет-SBL на стеклянной подложке. Ложно-цветные TIRFM изображения одного слитого события SUV-SBL, показывающие липидный стыковки (1) и выпуск липидного красителя в SBL (2) с последующим отбеливанием и уменьшению интенсивности флуоресценции (3). Суммарная интенсивность флуоресценции (сумма значений пикселей в X Box 5,3 мкм 5,3 мкм) сигнала показана. (В) покровное , связанный с блоком PDMS выявляется на нагретую стадии. Впускную трубу для микроканалов забора пробы из пробирки в держателе образца металла (справа) всасываемого шприцевой насос (слева). Под насос является двойственной блок эмиссии. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
OAD / 54349 / 54349fig4.jpg "/>
Рисунок 4. Схема экспериментальной установки. Мимолетной волна создается на границе раздела стекло-буфера в микрожидком канале. SBL формируется на стекле и V-внедорожников отсасывают из держателя образца металла (справа вверху) через канал в шприц (верхний левый угол). M, зеркало; DM, дихроичное зеркало; L, объектив; F, фильтр; P, поляризатор. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Постоянно возбуждать и контролировать v-SUV флуоресценцию с использованием 561 нм (для LR-PE) или 638 нм (для лазера) DiD в зависимости от флуорофора, включенного в V-внедорожников. Как V-внедорожники достигают проточный канал и док-станцию на и предохранитель с SBL, сигнал фоновой флуоресценции начинает накапливаться.
- Отрегулируйте интенсивность лазерного возбуждения с помощью программного обеспечения, чтобы непрерывно отбелить фонфлуоресценции таким образом, что в стационарном состоянии новые стыковки и слияния событий легко можно наблюдать.
Примечание: Если отбеливание является слишком медленным, фон флуоресценции будет слишком высокой. Если отбеливание слишком быстро, сигналы от состыкованных внедорожников и из флуорофоров, выбрасываемых в SBL будет быстро исчезать, сокращая окно, в течение которого слияние состыкованных внедорожников может быть обнаружен или флуорофор может быть прослежен. Для LR-PE возбуждается при 561 нм, 2,5-7,5 мВт мощности освещения круг 190 Диаметр мкм (100-250 нВт / мкм 2) представляет собой разумное значение , чтобы начать. Для 638 нм возбуждения, 0,8-1,6 DiD мВт мощности над диаметром круга 190 мкм (30-60 нВ / мкм 2) могут быть использованы для начальных испытаний. - Приобретите несколько фильмов на разных позициях в данном канале. Проверьте NBD-PE флуоресценцию, чтобы убедиться, что SBL не имеет дефектов в этих положениях. Приобретать полнокадровых фильмы на максимальной скорости (~ 50 кадров / сек) или обрезанной области, представляющей интерес при более высокой частоте кадров (до~ 100 Гц) в течение 60 сек.
- Переход к другому микрожидком канала и повторите записи для других условий. Включите отрицательные элементы управления, такие как безбелковом SBL или джипов, добавьте растворимый цитоплазматический домен V-SNARE VAMP2 (CDV) в качестве ингибитора или лечения V-SUV с столбнячного нейротоксина (30 мин при 37 ° С) в одном или нескольких каналов на одном покровное.
- Очистка и PDMS рециркуляции
- Для того, чтобы повторно использовать блок PDMS, ополаскивают микроканалов с ~ 200 мкл 70% этанола, при скорости потока 5 мкл / мин. И, наконец, аспирация воздуха через трубку и каналов.
- Отделите PDMS блок мягко от покровного, сжимая его немного. Поместите его на чистую кусок алюминиевой фольги. Хранить в вакуумном эксикаторе. Он может быть использован повторно несколько раз.
- Для более тщательной очистки промойте каналы с помощью моющего средства или раствор гидроксида натрия до уровня 70% этанола. В качестве альтернативы, удалить все трубы сюда м PDMS и разрушать ультразвуком блок в течение 30 мин в изопропиловом спирте, перед сушкой и вставки новой трубки.
5. SUV-SBL Fusion анализа для мониторинга липидного и Content Release Одновременно
- Для получения двойного контроля цвета одновременного липидов и растворимых содержание высвобождения, выполните те же действия, что и в разделе 4, за исключением использования липосом, меченных и липидный (DID) и растворимого содержимого (SRB) этикетке, как описано в разделе 3. SRB инкапсулируется при концентрации 10 мМ и изначально сильно себя останавливали.
- С помощью конфигурации , показанной схематически на рисунке 4, возбуждают SRB и выполнил флуоресценции одновременно с использованием 561 нм и 638 нм лазеров, соответственно. Дихроичных зеркал (640 нм) расщепляется излучение на два луча, которые проходят через короткий (595/50 нм) и длинной (700/75 нм) длины волны фильтр для обнаружения SRB и выполнил выбросы, соответственно. Два пучка излучения, по прогнозам, бок о бок на чип EM-CCD.
- Анализ данных FRAP
- Используйте программу MATLAB , представленную в качестве дополнительной информации для оценки коэффициента диффузии липидов, D. Программа считывает список Оме-TIFF файлов 49, обнаруживает беленой область, участки значений средней пиксель в беленой области в зависимости от времени, и соответствует результирующей кривой восстановления для модели с помощью Soumpasis 50 для извлечения времени восстановления,
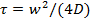 , Где W представляет радиус окружности беленой.
, Где W представляет радиус окружности беленой.
Примечание: Программа MATLAB была представлена ранее 25 для анализа FRAP фильмов с помощью Nikon ND2 файлов. Текущая программа считывает Оме-TIFF файлы 49, так как большинство форматов файлов могут быть легко преобразованы в OME-TIFF. Количественный анализ данных FRAP является самым простым и наиболее точным, когда отбеливание происходит мгновенно, то bleacHed область представляет собой круг, и отбеливание во время считывания незначительна. Хотя эти критерии не строго выполняются в простых измерений FRAP, описанных здесь, разумная оценка коэффициента диффузии может быть получено. Для получения более точной оценки, использовать отслеживание отдельных красителей липидных (раздел 6.3).
- Используйте программу MATLAB , представленную в качестве дополнительной информации для оценки коэффициента диффузии липидов, D. Программа считывает список Оме-TIFF файлов 49, обнаруживает беленой область, участки значений средней пиксель в беленой области в зависимости от времени, и соответствует результирующей кривой восстановления для модели с помощью Soumpasis 50 для извлечения времени восстановления,
- Анализ скорости стыковки, скорости сварки , а также док-к-фьюжн времени задержки
- Используйте ImageJ, чтобы открыть фильм анализировать и регулировать яркость и контрастность, чтобы четко определить везикул стыковку и сплавляя события. Запустите плагин SpeckleTrackerJ 26. См Smith и др. 26 и электронной документации по SpeckleTrackerJ Инструкции по эксплуатации.
- Определить все вновь стыковка внедорожников в SpeckleTrackerJ. Чтобы отличить внедорожников, что док-станция плотно от тех, которые отскакивают от SBL, наложить минимальную продолжительность стыковки нескольких кадров. Сохраните дорожки и повторите для всех фильмов.
Примечание: Для доккороль ставка, все, что имеет значение, чтобы определить, когда внедорожник на стоянке, так что только первый кадр, в котором внедорожники пристыкован потребности должны быть записаны в этих треков. Остальные треки не будут приниматься во внимание при анализе. Тем не менее, автоматическое отслеживание каждого внедорожника, пока он не отбеливает или предохранители помогает Марк внедорожников, которые уже отслеживаются. - Определить все сплавляя везикулы. Для них, дорожки должны включать все кадры из первого кадра внедорожник не пристыкован до первого кадра, в котором слияние очевидно внезапным увеличением флуоресценции гусеничного пятна. Длительности этих треков используются для вычисления задержки стыковки-к-фьюжн. Сохранить все дорожки. Повторите эти действия для всех фильмов.
- Для периодического анализа стыковки или слияния данных, составить список файлов траекторных из соответствующих фильмов и запускать программы MATLAB , поставляемые с Karatekin и Ротман 25. Следуйте инструкциям, прилагаемым вместе с программами.
Примечание: Программы построить дипломulative стыковка и слитые события, как функцию времени, на основе информации, извлеченной из траекторных файлов. Стыковка и слитые ставки оцениваются со склонов этих участков. Для получения данных слияния, задержки стыковки-к-фьюжн также рассчитываются и их распределение на графике как выживания участка, то есть вероятность того, что слияние еще не произошло с заданной задержкой после стыковки.
- Липидный коэффициент диффузии
- Для каждого события фьюжн, отслеживать единичные флуоресцентные липиды , как они становятся различимы , когда они распространяются достаточно далеко от зоны сварки (рисунок 6). Используйте SpeckleTrackerJ для отслеживания, а также сохранять треки для дальнейшего анализа с использованием MATLAB. В зависимости от размера плавящимся везикулы, как правило, 3-30 одиночные флуорофоры могут быть отслежены. Поскольку более длинные треки желательны для расчета
 , Пытаются отслеживать отдельные молекулы, как долгонасколько это возможно, с помощью ручного коррекции траекторий, если это необходимо.
, Пытаются отслеживать отдельные молекулы, как долгонасколько это возможно, с помощью ручного коррекции траекторий, если это необходимо. - Вычислить средний квадрат смещения (HSA) для одиночных липидных маркеров траекторий, которые длятся> 40-50 кадров (около 1,5 ~ сек). Используйте MSD для расчета коэффициента диффузии липидов,
 , См Smith и др. 26 и Stratton и др. 27 для деталей.
, См Smith и др. 26 и Stratton и др. 27 для деталей.
- Для каждого события фьюжн, отслеживать единичные флуоресцентные липиды , как они становятся различимы , когда они распространяются достаточно далеко от зоны сварки (рисунок 6). Используйте SpeckleTrackerJ для отслеживания, а также сохранять треки для дальнейшего анализа с использованием MATLAB. В зависимости от размера плавящимся везикулы, как правило, 3-30 одиночные флуорофоры могут быть отслежены. Поскольку более длинные треки желательны для расчета
- Интенсивность одного липидного красителя, SUV-SBL коэффициент уменьшения интенсивности, и размер везикул
- Измерить сумму значений пикселов липидной маркера в 3 х 3 пиксела (0,8 мкм х 0,8 мкм) области вокруг маркера ~ 15 кадров до и после того, как маркерных отбеливателей на одной стадии. Вычитание усредненная интенсивность фона в течение пост-отбеливатель кадров от интенсивности предварительно отбеливателя усредненный до того отбеливания, чтобы получить интенсивность гусеничного липидного маркера. Повторите измерение для столько маркеров, сколько практическое значение для заданного кино.
- Постройте распределение интенсивности меток одного липида,
 , И установите гауссово оценить среднее.
, И установите гауссово оценить среднее. - Рассчитайте задержку между моментом, когда произошло слияние и когда траектория одного липидного маркера выпущен в этом случае закончилась одноступенчатой отбеливания. Получить время отбеливания для флуорофора в SBL,
 , Путем построения графика функции переживший задержек и подгонку к экспоненциальному.
, Путем построения графика функции переживший задержек и подгонку к экспоненциальному.
Примечание: Поскольку поляризованном поле возбуждения пары слабее к флуорофоров на SUV, время отбеливание SUV, как правило , намного медленнее 27. - Оценить
 , Коэффициент уменьшения силы света в липидном красителем когда в SUV относительно когда он находится в SBL, следуя Stratton 27 (tp_upload / 54349 / 54349eq8.jpg "/>
, Коэффициент уменьшения силы света в липидном красителем когда в SUV относительно когда он находится в SBL, следуя Stratton 27 (tp_upload / 54349 / 54349eq8.jpg "/>  интенсивность одного красителя в SUV).
интенсивность одного красителя в SUV).
Примечание: Если отбеливание были незначительными, будет равна интенсивности пристыкован
будет равна интенсивности пристыкован 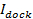 (пункт (1) на рисунке 3А, правая панель), деленное на суммарную интенсивность достигается после всех флуорофоров откладываются в SBL при слиянии (пунктирная линия , помеченная
(пункт (1) на рисунке 3А, правая панель), деленное на суммарную интенсивность достигается после всех флуорофоров откладываются в SBL при слиянии (пунктирная линия , помеченная 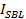 на рисунке 3). Тем не менее, из-за быстрого отбеливания в SBL,
на рисунке 3). Тем не менее, из-за быстрого отбеливания в SBL, 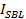 как правило, не достигается, и точная оценка
как правило, не достигается, и точная оценка  требует подгонки кинетики высвобождения к выражению 27 , что в т.ч. НЖЯ как
требует подгонки кинетики высвобождения к выражению 27 , что в т.ч. НЖЯ как 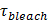 (См 6.4.3) и
(См 6.4.3) и  , Отдельные выражения представлены в Stratton и др 27 для случаев пор ограниченной диффузии и ограниченный выпуск кинетики. наилучшим образом подходит случай варьируется от случая к случаю (см 6.5.1 для случая пор ограниченной кинетики).
, Отдельные выражения представлены в Stratton и др 27 для случаев пор ограниченной диффузии и ограниченный выпуск кинетики. наилучшим образом подходит случай варьируется от случая к случаю (см 6.5.1 для случая пор ограниченной кинетики). - Вычислить площадь везикул для отдельных событий из 27
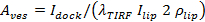 , где
, где 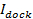 является стыковка интенсивность внедорожник,
является стыковка интенсивность внедорожник,  это средняя интенсивность одного липидного красителя в SBL,
это средняя интенсивность одного липидного красителя в SBL,  является коэффициент уменьшения интенсивности для липидной красителя, когда он находится в SUV по отношению к тому, когда он находится в SBL, ивания 1 "SRC =" / файлы / ftp_upload / 54349 / 54349eq12.jpg "/> является известным поверхностная плотность липидных красителей.
является коэффициент уменьшения интенсивности для липидной красителя, когда он находится в SUV по отношению к тому, когда он находится в SBL, ивания 1 "SRC =" / файлы / ftp_upload / 54349 / 54349eq12.jpg "/> является известным поверхностная плотность липидных красителей.
- Свойства Fusion поры
- Предполагая , что выпуск является внутрипоровой ограничено, соответствовать кинетики высвобождения липидного этикетки до 27
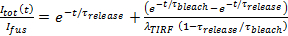 , где
, где 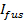 это пристыкован интенсивность SUV непосредственно перед расплавление и другие параметры, такие, как определено ранее. Используйте значение
это пристыкован интенсивность SUV непосредственно перед расплавление и другие параметры, такие, как определено ранее. Используйте значение 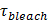 полученного в 6.4.3, как фиксированный параметр, и извлечь лучшие оценки, пригодный для жизни
полученного в 6.4.3, как фиксированный параметр, и извлечь лучшие оценки, пригодный для жизни  а также
а также  ,
, - Оценить долю времени пор открыт, P 0, предполагая замедление высвобождения липидов из - за пор мерцает 27:60;
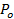 знак равно
знак равно 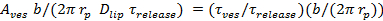 , Где VES является площадь везикулы (раздел 6.4.5), б высота пор ( как правило , принимается равным ~ 15 нм), г р ≈ 3 нм эффективный радиус пор как видно диффундирующих липидных этикетки и включает в себя половину толщина бислой (~ 2 нм),
, Где VES является площадь везикулы (раздел 6.4.5), б высота пор ( как правило , принимается равным ~ 15 нм), г р ≈ 3 нм эффективный радиус пор как видно диффундирующих липидных этикетки и включает в себя половину толщина бислой (~ 2 нм),  является липидная коэффициент диффузии (рассчитанный в 6.3), и
является липидная коэффициент диффузии (рассчитанный в 6.3), и  настало время для липиды, чтобы освободиться от SUV в SBL (от 6.5.1).
настало время для липиды, чтобы освободиться от SUV в SBL (от 6.5.1). - Для того, чтобы подтвердить , что номинальный P 0> 1 указывает полностью открытыми порами, P 0 = 1, установите ход времени интенсивности к уравнению 4 из Stratton и др. 27, предсказанных кинетики для постоянно с открытыми порами. Это подходит должно быть лучше, чем fittinг выражение в 6.5.1 для постоянно с открытыми порами.
- Предполагая , что выпуск является внутрипоровой ограничено, соответствовать кинетики высвобождения липидного этикетки до 27
Результаты
Качество SBL
Крайне важно, чтобы проверить качество и текучесть SBL до слияния эксперимента. Флуоресценции в нижней части, стеклянной стороне микрожидком канала должен быть однородным, без каких-либо видимых дефектов. Если возд...
Обсуждение
Успешное осуществление анализа гибридного SUV-SBL, описанного здесь в решающей степени зависит от нескольких ключевых шагов, таких как функционального восстановления белков в липосомы, получение хорошего качества SBLs, и выбирая правильные параметры изображения для обнаружения одиночны?...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
We thank Vladimir Polejaev (Yale West Campus Imaging Core) for the design and construction of the polarized TIRF microscope, David Baddeley (Yale University) for help with two-color detection instrumentation, and James E. Rothman (Yale University) and Ben O'Shaughnessy (Columbia University) and members of their groups for stimulating discussions. EK is supported by a Kavli Neuroscience Scholar Award from the Kavli Foundation and NIH grant 1R01GM108954.
Материалы
| Name | Company | Catalog Number | Comments | |
| Reagents | ||||
| Milli-Q (MQ) water | Millipore | |||
| KOH | J.T. Baker | 3040-05 | ||
| Ethanol 190 Proof | Decon | |||
| Isopropanol | Fisher Chemical | A416P4 | ||
| HEPES | AmericanBio | AB00892 | ||
| Sodium Cholride (KCl) | AB01915 | |||
| Dithiothreitol | AB00490 | |||
| N-[2-hydroxyethyl] piperazine-N'-[2-ethanesulfonic acid] (HEPES) | AmericanBio | AB00892 | ||
| EGTA | Acros Organics | 409911000 | ||
| Buffers | ||||
| HEPES-KOH buffer (pH 7.4) | 25 mM HEPES-KOH, 140 mM KCl, 100 μM EGTA, 1 mM DTT | |||
| Solvents | ||||
| Chloroform | J.T. Baker | 9180-01 | in glass bottle, CAUTION, wear PPE | |
| Methanol | J.T. Baker | 9070-03 | in glass bottle, CAUTION, wear PPE | |
| Liposome preparation | ||||
| Gastight Hamilton syringe | Hamilton | var. sizes | only use glass sringe with solents (Chlorophorm/ Methanon, 2:1, v/v) | http://www.hamiltoncompany.com |
| Glass tubes Pyrex Vista 11 ml, 16x100 mm screw cap culture tube | Pyrex | 70825-16 | clean thoroughly, rinse with chloroform | http://catalog2.corning.com/LifeSciences/ |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine, 16:0-18:1 PC (POPC) | Avanti Polar Lipids | 850457 | Lipids come dissolved in CHCl3 or as lyphilized powder in sealed vials. Aliquot upon opening. Store extra as dried lipid films under inert atmosphere at -20 °C. Keep stocks in CHCl3/MeOH (2:1, v/v) at -20 °C. let come to RT before opening | http://www.avantilipids.com/ |
| 1,2-dioleoyl-sn-glycero-3-phospho-L-serine (sodium salt), 18:1 PS (DOPS) | 840035 | |||
| 1-stearoyl-2-arachidonoyl-sn-glycero-3-phosphoethanolamine, 18:0-20:4 PE (SAPE) | 850804 | |||
| L-α-phosphatidylinositol-4,5-bisphosphate (Brain, Porcine) (ammonium salt), Brain PI(4,5)P2 | 840046 | |||
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (ammonium salt), 18:1 NBD PE | 810145 | |||
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt), 18:1 PEG2000 PE | 880130 | |||
| cholesterol (ovine wool, >98%) | 700000 | |||
| DiD' oil; DiIC18(5) oil (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindodicarbocyanine Perchlorate) | Molecular Probes | D-307 | https://www.thermofisher.com/ | |
| Rotavapor R-210 | Buchi | R-210 | heat bath above Tm of lipids used | http://www.buchi.com/ |
| OG n-Octyl-β-D-Glucopyranoside | Affymetrix | 0311 | store at -20°C, let come to RT before opening | https://www.anatrace.com/ |
| Shaker - Eppendorf Thermomixer R | Eppendorf | https://www.eppendorf.com/ | ||
| Slide-A-Lyze Dialysis Cassettes, 20K MWCO, 3 mL | life technologies | 66003 | https://www.lifetechnologies.com/ | |
| Bio-Beads SM-2 Adsorbents | Bio-Rad | 1523920 | http://www.bio-rad.com/ | |
| OptiPrep Density Gradient Medium | Sigma-Aldrich | D1556 | http://www.sigmaaldrich.com/ | |
| Ultracentrifugation tube, Thinwall, Ultra-Clear, 13.2 mL, 14 x 89 mm | Beckman Coulter | 41121703 | https://www.beckmancoulter.com/ | |
| Beckman SW41 Ti rotor | ||||
| SuflorhodamineB | Molecular Probes | S-1307 | https://www.thermofisher.com/ | |
| Econo-Column Chromatography Columns, 2.5 × 10 cm | Bio-Rad | 7372512 | http://www.bio-rad.com/ | |
| Sepharose CL-4B | GE Healthcare | 17-0150-01 | http://www.gelifesciences.com/ | |
| SYPRO Orange Protein Gel Stain | Molecular Probes | S-6650 | 5,000X Concentrate in DMSO | https://www.lifetechnologies.com/ |
| PDMS block | ||||
| Sylgard 184 Silicone elastomer kit, PDMS | Dow Corning | 3097358-1004 | http://www.dowcorning.com/ | |
| Pyrex glass petri dish, 150 x 20 mm, complete with cover | Corning | 3160-152 | http://catalog2.corning.com/LifeSciences/ | |
| Hole puncher - Reusable Biopsy Punch, 0.75mm | World Precision Instruments | 504529 | http://www.wpi-europe.com/ | |
| Manual Hole Punching Machine | SYNEO | MHPM-UNV | http://www.syneoco.com/ | |
| Drill .035 x .026 x 1.5 304 SS TiN coated round punch | CR0350265N20R4 | drill diameter: 0.9 mm | ||
| Tygon Microbore tubing, 0.25 mm ID, 0.76 mm OD | Cole-Parmer | 06419-00 | 0.010" ID, 0.030" OD | http://www.coleparmer.com/ |
| Silicone Tubing (0.51 mm ID, 2.1 mm OD | 95802-00 | 0.020" ID, 0.083" OD | ||
| Cover glass - cleanroom cleaned | ||||
| Schott Nexterion cover slip glass D | Schott | 1472305 | http://www.us.schott.com/ | |
| plasma cleaner | Harrick | PDC-32G | http://harrickplasma.com/ | |
| pTIRF setup and accessories | ||||
| IX81 microscope body | Olympus | IX81 | http://www.olympus-lifescience.com/en/ | |
| EM CCD camera | Andor | ixon-ultra-897 | http://www.andor.com/ | |
| Thermo Plate, heated microscope stage | Tokai Hit | MATS-U52RA26 | http://www.tokaihit.com/ | |
| 1 ml hamilton glass syringes (4x) | Hamilton | 81365 | http://www.hamiltoncompany.com | |
| syringe pump | kd Scientific | KDS-230 | http://www.kdscientific.com/ |
Ссылки
- Sudhof, T. C., Rothman, J. E. Membrane fusion: grappling with SNARE and SM proteins. Science. 323, 474-477 (2009).
- Wickner, W., Schekman, R. Membrane fusion. Nat Struct Mol Biol. 15, 658-664 (2008).
- Harrison, S. C. Viral membrane fusion. Nat Struct Mol Biol. 15, 690-698 (2008).
- Jahn, R., Scheller, R. H. SNAREs--engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Lindau, M., Alvarez de Toledo, G. The fusion pore. Biochim Biophys Acta. 1641, 167-173 (2003).
- Staal, R. G., Mosharov, E. V., Sulzer, D. Dopamine neurons release transmitter via a flickering fusion pore. Nat Neurosci. 7, 341-346 (2004).
- Wu, Z., et al. Nanodisc-cell fusion: Control of fusion pore nucleation and lifetimes by SNARE protein transmembrane domains. Sci. Rep. 6, 27287 (2016).
- Alabi, A. A., Tsien, R. W. Perspectives on kiss-and-run: role in exocytosis, endocytosis, and neurotransmission. Ann Rev Physiol. 75, 393-422 (2013).
- Rossetto, O., Pirazzini, M., Montecucco, C. Botulinum neurotoxins: genetic, structural and mechanistic insights. Nature Rev Microbiol. 12, 535-549 (2014).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Nickel, W., et al. Content mixing and membrane integrity during membrane fusion driven by pairing of isolated v-SNAREs and t-SNAREs. Proc Natl Acad Sci U S A. 96, 12571-12576 (1999).
- McNew, J. A., et al. Compartmental specificity of cellular membrane fusion encoded in SNARE proteins. Nature. 407, 153-159 (2000).
- Melia, T. J., You, D. Q., Tareste, D. C., Rothman, J. E. Lipidic antagonists to SNARE-mediated fusion. J Biol Chem. 281, 29597-29605 (2006).
- Hernandez, J. M., et al. Membrane fusion intermediates via directional and full assembly of the SNARE complex. Science. 336, 1581-1584 (2012).
- Fix, M., et al. Imaging single membrane fusion events mediated by SNARE proteins. Proc Natl Acad Sci U S A. 101, 7311-7316 (2004).
- Bowen, M. E., Weninger, K., Brunger, A. T., Chu, S. Single molecule observation of liposome-bilayer fusion thermally induced by soluble N-ethyl maleimide sensitive-factor attachment protein receptors (SNAREs). Biophys J. 87, 3569-3584 (2004).
- Liu, T., Tucker, W. C., Bhalla, A., Chapman, E. R., Weisshaar, J. C. SNARE-driven, 25-millisecond vesicle fusion in vitro. Biophys J. 89, 2458-2472 (2005).
- Yoon, T. Y., Okumus, B., Zhang, F., Shin, Y. K., Ha, T. Multiple intermediates in SNARE-induced membrane fusion. Proc Natl Acad Sci U S A. 103, 19731-19736 (2006).
- Diao, J., et al. A single-vesicle content mixing assay for SNARE-mediated membrane fusion. Nat Commun. 1, 1-6 (2010).
- Kyoung, M., et al. In vitro system capable of differentiating fast Ca2+-triggered content mixing from lipid exchange for mechanistic studies of neurotransmitter release. Proc Natl Acad Sci U S A. 108, E304-E313 (2011).
- Domanska, M. K., Kiessling, V., Stein, A., Fasshauer, D., Tamm, L. K. Single vesicle millisecond fusion kinetics reveals number of SNARE complexes optimal for fast SNARE-mediated membrane fusion. J Biol Chem. 284, 32158-32166 (2009).
- Kreutzberger, A. J., Kiessling, V., Tamm, L. K. High Cholesterol Obviates a Prolonged Hemifusion Intermediate in Fast SNARE-Mediated Membrane Fusion. Biophys J. 109, 319-329 (2015).
- Schwenen, L. L., et al. Resolving single membrane fusion events on planar pore-spanning membranes. Sci Rep. 5, 12006 (2015).
- Karatekin, E., et al. A fast, single-vesicle fusion assay mimics physiological SNARE requirements. Proc Natl Acad Sci U S A. 107, 3517-3521 (2010).
- Karatekin, E., Rothman, J. E. Fusion of single proteoliposomes with planar, cushioned bilayers in microfluidic flow cells. Nat Protoc. 7, 903-920 (2012).
- Smith, M. B., et al. Interactive, computer-assisted tracking of speckle trajectories in fluorescence microscopy: application to actin polymerization and membrane fusion. Biophys J. 101, 1794-1804 (2011).
- Stratton, B. S., et al. Cholesterol Increases the Openness of SNARE-mediated Flickering Fusion Pores. Biophysical journal. 110, (2016).
- Diao, J., et al. Synaptic proteins promote calcium-triggered fast transition from point contact to full fusion. Elife. 1, e00109 (2012).
- Kiessling, V., Domanska, M. K., Tamm, L. K. Single SNARE-mediated vesicle fusion observed in vitro by polarized TIRFM. Biophys J. 99, 4047-4055 (2010).
- Blasi, J., et al. Botulinum neurotoxin A selectively cleaves the synaptic protein SNAP-25. Nature. 365, 160-163 (1993).
- Washbourne, P., et al. Genetic ablation of the t-SNARE SNAP-25 distinguishes mechanisms of neuroexocytosis. Nat Neurosci. 5, 19-26 (2002).
- Diaz, A. J., Albertorio, F., Daniel, S., Cremer, P. S. Double cushions preserve transmembrane protein mobility in supported bilayer systems. Langmuir. 24, 6820-6826 (2008).
- Floyd, D. L., Ragains, J. R., Skehel, J. J., Harrison, S. C., van Oijen, A. M. Single-particle kinetics of influenza virus membrane fusion. Proc Natl Acad Sci U S A. 105, 15382-15387 (2008).
- Albertorio, F., et al. Fluid and air-stable lipopolymer membranes for biosensor applications. Langmuir. 21, 7476-7482 (2005).
- Daniel, S., Albertorio, F., Cremer, P. S. Making lipid membranes rough, tough, and ready to hit the road. Mrs Bulletin. 31, 536-540 (2006).
- Gao, Y., et al. Single reconstituted neuronal SNARE complexes zipper in three distinct stages. Science. 337, 1340-1343 (2012).
- Kenworthy, A. K., Hristova, K., Needham, D., Mcintosh, T. J. Range and Magnitude of the Steric Pressure between Bilayers Containing Phospholipids with Covalently Attached Poly(Ethylene Glycol). Biophys J. 68, 1921-1936 (1995).
- Knoll, W., et al. Solid supported lipid membranes: New concepts for the biomimetic functionalization of solid surfaces. Biointerphases. 3, Fa125-Fa135 (2008).
- Quinn, P., Griffiths, G., Warren, G. Density of newly synthesized plasma membrane proteins in intracellular membranes II. Biochemical studies. J Cell Biol. 98, 2142-2147 (1984).
- Sund, S. E., Swanson, J. A., Axelrod, D. Cell membrane orientation visualized by polarized total internal reflection fluorescence. Biophys J. 77, 2266-2283 (1999).
- Johnson, D. S., Toledo-Crow, R., Mattheyses, A. L., Simon, S. M. Polarization-controlled TIRFM with focal drift and spatial field intensity correction. Biophys J. 106, 1008-1019 (2014).
- Anantharam, A., Onoa, B., Edwards, R. H., Holz, R. W., Axelrod, D. Localized topological changes of the plasma membrane upon exocytosis visualized by polarized TIRFM. J Cell Biol. 188, 415-428 (2010).
- Axelrod, D. Carbocyanine dye orientation in red cell membrane studied by microscopic fluorescence polarization. Biophys J. 26, 557-573 (1979).
- Wang, T., Smith, E. A., Chapman, E. R., Weisshaar, J. C. Lipid mixing and content release in single-vesicle, SNARE-driven fusion assay with 1-5 msec resolution. Biophys J. 96, 4122-4131 (2009).
- Chernomordik, L. V., Frolov, V. A., Leikina, E., Bronk, P., Zimmerberg, J. The pathway of membrane fusion catalyzed by influenza hemagglutinin: restriction of lipids, hemifusion, and lipidic fusion pore formation. J Cell Biol. 140, 1369-1382 (1998).
- Takamori, S., et al. Molecular anatomy of a trafficking organelle. Cell. 127, 831-846 (2006).
- Wilhelm, B. G., et al. Composition of isolated synaptic boutons reveals the amounts of vesicle trafficking proteins. Science. 344, 1023-1028 (2014).
- Scott, B. L., et al. Liposome fusion assay to monitor intracellular membrane fusion machines. Methods Enzymol. 372, 274-300 (2003).
- Linkert, M., et al. Metadata matters: access to image data in the real world. J Cell Biol. 189, 777-782 (2010).
- Soumpasis, D. M. Theoretical analysis of fluorescence photobleaching recovery experiments. Biophys J. 41, 95-97 (1983).
- Ohki, S. A mechanism of divalent ion-induced phosphatidylserine membrane fusion. Biochim Biophys Acta. 689, 1-11 (1982).
- Berquand, A., et al. Two-step formation of streptavidin-supported lipid bilayers by PEG-triggered vesicle fusion. Fluorescence and atomic force microscopy characterization. Langmuir. 19, 1700-1707 (2003).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys J. 47, 105-113 (1985).
- Rawle, R. J., van Lengerich, B., Chung, M., Bendix, P. M., Boxer, S. G. Vesicle fusion observed by content transfer across a tethered lipid bilayer. Biophys J. 101, L37-L39 (2011).
- Wagner, M. L., Tamm, L. K. Reconstituted syntaxin1a/SNAP25 interacts with negatively charged lipids as measured by lateral diffusion in planar supported bilayers. Biophys J. 81, 266-275 (2001).
- Kalb, E., Frey, S., Tamm, L. K. Formation of Supported Planar Bilayers by Fusion of Vesicles to Supported Phospholipid Monolayers. Biochimica Et Biophysica Acta. 1103, 307-316 (1992).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены