Method Article
采用触摸诱发反应和运动测定以评估在斑马鱼肌肉性能和功能
摘要
Zebrafish are an excellent model to study muscle function and disease. During early embryogenesis zebrafish begin regular muscle contractions producing rhythmic swimming behavior, which is altered when the muscle is disrupted. Here we describe a touch-evoked response and locomotion assay to examine swimming performance as a measure of muscle function.
摘要
斑马鱼的肌肉发育高度与哺乳动物系统使他们成为优秀的模型来研究肌肉功能和疾病保守。影响骨骼肌功能多肌病可以在斑马鱼在胚胎发育的最初几天快速,方便地进行评估。通过后24小时受精(HPF),野生型斑马鱼自发收缩其尾部的肌肉和由48 HPF,斑马鱼表现出受控游泳行为。减少的频率,或者在其它的改变,这些运动可以指示骨骼肌功能障碍。为了分析的游泳行为和早期斑马鱼发育评估肌肉性能,我们利用两个触摸诱发逃避反应和运动检测。
触诱发逃避反应测定法可以用于评估在从快肌纤维的收缩引起的短脉冲动作肌肉性能。响应于外部刺激,在这种情况下是上一抽头头部,于2天后受精(DPF)野生型斑马鱼通常呈现出爆发出强大的游泳,伴随着急转弯。我们的方法是由一个脉冲串游泳运动期间测量的最大加速度,所述加速度被直接正比于由肌肉收缩产生的力量化骨骼肌功能。
相比之下,早期的斑马鱼幼体发育过程中运动试验是用来在肌肉活动持续时间来评估肌肉性能。使用追踪系统,以监测游泳行为,我们得到的活性和距离的频率在6天龄的斑马鱼的自动计算,反射其骨骼肌功能的。游泳的性能测量是疾病模型,影响骨骼肌功能突变或化学处理的高通量筛选的表型的评估价值。
引言
在过去的十年,斑马鱼已经被越来越多地用于研究肌细胞生物学和疾病。在斑马鱼胚胎,加上其光学清晰度的快速发展外,允许肌肉形成,生长和功能的直接可视化。肌肉发育的过程是高度保守的斑马鱼,这使得一系列肌肉疾病,包括肌肉萎缩症和先天性肌病1-8成功造型。斑马鱼模型的详细检查,不仅提供了新的见解的这些条件下,病理学,但也提供了一个平台,合适的治疗6,9-13的测试。
肌肉疾病的斑马鱼模型的分析依赖于可靠和可重复的实验来测量肌肉性能。先前的研究已经成功地测量3和7之间的鱼的斑马鱼躯干肌肉由DPF的力产生能力电刺激附连到力传递系统14的固定化的鱼的收缩。这可提供的力详细的测量,但不适合于更高的吞吐量实验和有向游泳期间测量肌肉性能的优点。在2 DPF斑马鱼的肌肉功能全面,并且鱼可以对刺激的反应引起的突发游泳运动。触引起逃避反应测定法中使用的脉冲串的游泳运动,它可以用来作为收缩力的量度期间测量加速度。
在一个病人肌病肌肉功能使用最多的措施是6分钟步行试验,记录在坚硬平整的表面15,16的总距离走去。我们已在6施加一个可比试验,测定肌肉功能的dpf斑马鱼,由此我们监测的总距离游过,并且由每个幼虫在10分钟内取得运动的总数。这被执行使用自动跟踪系统,它提供的肌肉性能可靠和高通量测量。两个肌肉测试是高度可再现,并已用于量化在斑马鱼肌病模型8肌肉性能的差异。
研究方案
1.触摸诱发反应分析
- 制备2 DPF胚胎触摸诱发反应分析
- 确保在该试验中进行一天中的时间是实验之间是一致的,因为活动可以在整个17,18一天显着变化。
注:应进行实验蒙蔽和测试的顺序随机尽量减少实验文物。 - 分配鱼菌株一个数字,它是未知的个体进行实验。在此之后,利用免费提供的在线工具生成指示测试的顺序的随机表。
- 至少一小时测试前,dechorionate胚胎由绒毛膜翻录的孔,轻轻拉开绒毛膜用一对细镊子。回到28℃培养箱之前从培养皿任何碎片。
- 确保在该试验中进行一天中的时间是实验之间是一致的,因为活动可以在整个17,18一天显着变化。
- 执行触摸诱发反应分析
- 热站GE至28°C至少15分钟后再开始测试。
注意:这个阶段的温度控制,并且将保持在28 °下测试的持续时间。温度将影响活动和维持恒定的温度是很重要的。如果一个加热阶段是不可用,则水的温度应监视和所有实验应该在相同的温度下进行。 - 放置培养皿填充有胚胎培养基(5毫摩尔NaCl,0.17氯化钾,0.33毫氯化钙 ,0.33毫硫酸镁在水中)上被照明的阶段和在培养皿装入高速摄像机。
- 启动摄像机录制软件(如流Pix的5,这里描述)和"工作空间"选项卡下选择每秒(1000帧)为拍摄速度1000帧,以保证鱼的那么快的游泳动作被记录下来。
- 同时与一个胚胎工作,将胚胎在MIDD陪替氏培养皿与斑马鱼中的视场清晰可见的文件中。
注:如果胚胎游走了之前毕业典礼实验用另一个替换它,为夺回和胚胎的定位可能会导致它变得不敏感的刺激和反复爆反应可能促使某些疾病模型肌肉无力。 - 通过点击"记录"按钮,开始录制,通过与头顶部的钝针轻轻抚摸它传递mechanosensory刺激胚胎。
- 停止录制胚胎已经游出的视场或退回休息后。
注意:下面的机械刺激的突发逃逸响应的第一个0.2秒内的加速度峰值。因此,确保至少逃逸响应记录鱼是在视场的第一0.2秒期间。使用在步骤1.2.3中描述的软件,数据将自动保存作为一个.AVI视频文件。另类视频捕捉软件,如免费的视频捕捉或SOFTONIC,这两者都是可免费下载,也可以使用。 - 返回胚胎到新的培养皿中,并选择另一个胚胎进行测试。在最少15鱼执行测试。
- 热站GE至28°C至少15分钟后再开始测试。
- 游泳行为的量化
- 为了量化游泳行为,启动软件,选择"单幼虫步态没有背景减法"模块,打开保存的AVI视频文件。
- 使用"写意"或影片的菜单栏中选择区"多边形"工具,用于分析。确保该区域既包括鱼的原来位置,并且将鱼游入区。确保探针从要分析的区域中排除。该软件将自动跟踪所需的区域内的鱼的运动轨迹。
- 要,执行t他分析,在菜单栏中点击"实验",然后选择"执行"。当系统提示保存原始数据的分析文件(.phr格式)所需的位置。保存后,点击"开始",开始分析。通过结束在"实验"点击"停止"分析下拉菜单。将显示一个包含结果窗口。
- 滚动到获得"最大加速度"值的权利。如果需要,通过关闭结果窗口,并在"结果"点击"导出瞬时结果"按钮,导出这些数据下拉菜单。选择适当的原始数据的分析文件并单击打开。可在电子表格程序打开的文本文件将保存在目标文件夹。
- 重复此过程为每个单独的鱼和平均以获得每个应变平均最大加速度(参见图1)。
注意:作为替代全光照克此处所描述的软件,类似的软件包如免费提供的ImageJ软件可用于提取相关的运动数据。三维粒子跟踪器的插件可被用来跟踪游泳轨迹。
2.步态分析 - 10分钟的游泳测试
- 制备6 DPF胚胎游泳分析
- 如果需要的话,排序胚胎所需基因型,例如,通过检查一个荧光蛋白或表型的表达,并将其放置到一个单独的陪替氏培养皿(每皿25-30胚胎)。可替代地,基因型可以跟随运动测定的完成来确定。
- 在3 DPF,重新审视培养皿中,并移除任何未孵化的胚胎和碎屑。返回培养皿至28℃培养箱,直到6 DPF。
- 执行上午9点和12点,这是在该斑马鱼是最活跃的时间之间所有菌株进行测试。随机测试和位置的顺序在p迟野生型和突变体的样品,以最大限度地减少的昼夜差异和其他实验偏差的影响。
注:重要的是,测试时间是实验之间是一致的,因为活性可以全天显着变化。 - 至少30分钟测试之前,地点幼虫与每孔1个幼虫一个48孔板。转印之后,填充孔,以使水面为刚好低于井的顶部,确保没有气泡。返回板块28℃培养箱。
- 取板出孵化并在光适应环境进行测试前5分钟。
- 执行步态分析
- 放置48孔板到记录室中,其中配备有红外线的数码相机,捕捉到60帧/秒,以使幼虫能在黑暗中进行检测。检查所有的井都放在圆形网格内的运动软件和所有的幼虫CLEArly的检测。
- 启动软件,选择"跟踪"模块。下的"文件"点击"产生新的协议",并编辑用于实验井的数量。同时设置了实验时间和通过点击"参数"整合周期为10分钟下拉菜单,选择"协议参数"和随后的"时间"选项卡。在相同的"协议参数"对话框中单击"选项"选项卡上,确保"Numeriscope"复选框,单击下面其中的"协议参数"对话框,可以关闭。
- 要设置记录区域突出的井之一整个网格并双击。点击"绘制区域"按钮和周围的左上角,右上角和左下角画井,点击"生成",它允许软件自动确定每个位置很好。在规模也借鉴条中点击"应用到组"。完成后,点击"绘制区域"按钮。
- 通过滑动"检测阈值"栏在哪只鱼的动作都强调没有背景信号的电平直观判断的检测阈值。
注:检测阈值将毒株,因而阈值,每当有一个新的应变测试,以确定各不相同。在代表性数据呈现为25mm的检测阈值/使用秒。 - 在开始测试之前进入门槛的运动检测活动,以及小型和大型运动。
注意:在代表性数据呈现6毫米/秒的一个不活动阈值和30毫米的活动突发阈/使用秒。阈值确定最小运动被认为是积极的和所需要的水平被认为爆发活动,让活动的分类成小(活跃,但低于爆裂活性状况TY阈值)和大(比猝发活动阈值)的动作。的阈值可以根据所分析的特定鱼株的活性而改变。
注意:虽然测定可以在光或暗条件下进行,斑马鱼幼体已显示出更加活跃在黑暗中18。 - 将室内的光强度下的"参数"点击"灯驱动设置"按钮是在0%下拉菜单。在产生的对话框中,添加所需的灯光设置。
注:该腔室内部的光强度可触发在测试时间开启和关闭,以刺激幼虫活动 - 关闭录音室的门,开始录像。
- 游泳行为的量化
- 实验完成后,点击"停止"下的"实验"下拉菜单。一个对话框博x,其中所有的结果将显示。
- 要访问"打开包含文件夹"这些结果在Excel点击打开出现在生成的文件夹Excel文件。最重要的参数是"smlct"(小运动计数),"larct"(大运动计数),"smldist"(由鱼小的移动覆盖总距离)和"lardist"(由鱼大动作覆盖总距离)。
注:继记录,该软件还返回两个额外的输出文件的.avi文件的形式(含10分记录的视频)的10时和PNG图片文件(包含运动的视觉表现分钟实验;参见图2)。 - 一旦运动值计算,重放.avi和.png文件审查精确计算运动值是否描绘了鱼的游泳动作( 见图3)。
注意:作为替代使用此处描述的软件,程序包如免费提供的ImageJ软件可以被用来跟踪运动器官的行为。
结果
触诱发反应测定法可用于确定速度和游泳运动的加速度这是肌肉力量成比例的量度。响应于机械刺激,如在头部2的dpf野生型斑马鱼表现出快速的游泳动作小抽头。画被抓获和用于两种不同的斑马鱼肌病模型分析:Tg的(ACTA1 D286G-EGFP),已经显示出具有显著肌无力杆状体肌病的模型,并且其中严重的肌肉缺陷已经描述杜氏肌营养不良症的模型在5 DPF 19,20。从一个典型的触摸的视频图像分析诱发图1A中的代表。斑马鱼的加速进行了检查和突发游泳逃避反应( 图1B)的第一个0.2秒内发现高峰。该峰的最大加速度提供一种措施,是成正比的力克enerating骨骼肌的能力。最大加速度值的平均值,以获得每个菌株的平均最大加速度值(±标准误差均值):Tg的(ACTA1 D286G -EGFP):平均值= 276.0±28.8米/秒2,n = 3的独立重复实验包括15个人的鱼;野生型对照:平均= 500.8±50.28米/秒2,N = 15,包括鱼个体3个独立重复实验; DMD PC2 - / -突变:平均值= 249.9±19.1米/秒2,N = 12-19包括鱼个体3个独立重复实验; DMD PC2 +/-杂合子:平均值= 235.9±8.7米/秒2,N = 16-27包括鱼个体3个独立重复实验; DMD PC2 + / +野生型纯合子:平均值= 230.9±8.7米/秒2,N = 8-27,包括鱼个体(图1C)3个独立的重复实验。正如所料,Tg的(ACTA1 D286ģ-EGFP)鱼中发现有在最大加速度指示肌肉功能降低,这是与小鼠模型和患者数据8,21,22一致的显著下降。在DMD PC2 - / -然而,突变体鱼表现出的最大加速度没有差别,在2旦,与检测肌肉缺陷来自3旦20( 图1D)相一致。
运动测定法在6单丝旦执行以确定通过斑马鱼株的活性和距离游过作为肌肉性能的指示。以下测试,产生游泳运动在十分钟的测试期间的示意图,分别表示慢速和快速运动的时段的红色和绿色的线和代表非活动期间( 图2)的黑线。不活动的相对无周期,oppos个别野生斑马鱼秀高活性教育署的Tg(ACTA1 D286G-EGFP)鱼,这是在测试期间( 图2B)不太活跃。
游泳行为通过用各鱼( 图3)的平均运动的数量和距离游过的各个值进行定量。两者的Tg(ACTA1 D286G -EGFP)鱼( 图3A和3B)和DMD PC2 - / -突变体鱼( 图3C和3D)被发现有在运动和距离的平均数目显著减少游泳相比各自控制是Tg(ACTA1 D286G-EGFP)鱼:运动的平均数= 94.3±13.6,平均游过的距离= 112.9±18.4毫米,N = 45,包括鱼3个独立重复实验;野生型对照:平均变动数= 177.4±14.0,平均游过的距离= 300.2±22.8毫米,N = 3自主研发eplicate实验包括45鱼类; DMD PC2 - / -突变:是指动作的数量= 163.3±30.0,平均距离游过:298.4±60.37毫米,每组包括12-20鱼3个独立重复实验; DMD PC2 +/-杂合子:运动的平均数= 362.3±38.8,平均距离游过:660.3±86.1毫米N = 17-27,包括鱼3个独立重复实验; DMD PC2 + / +野生型纯合子:平均变动数= 341.9±91.6,平均游过的距离= 574.3±170.9毫米N = 8-25,包括鱼3个独立的重复实验。
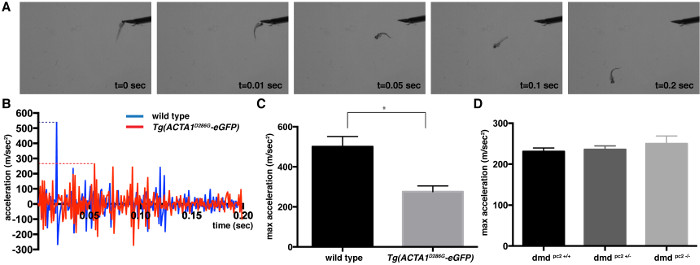
图1:在2 DPF中的定量触摸唤起反应分析2 DPF斑马鱼胚胎控制斑马鱼(A)快照映像触摸唤起检测。 (B)为一个第一0.2秒加速度信息单一的Tg(ACTA1 D286G-EGFP)(红色),并按照触摸刺激的申请单控(蓝色)的斑马鱼。的最大加速度是由虚线表示。 (C,D)从(C)的Tg的(ACTA1 D286G -EGFP)斑马鱼的触诱发反应分析所记录的最大加速度(米/秒2)的定量和 (D)DMD PC2 - / -鱼突变体在较2 DPF控制斑马鱼。误差棒代表±SEM 3重复实验,* P <0.05。 请点击此处查看该图的放大版本。
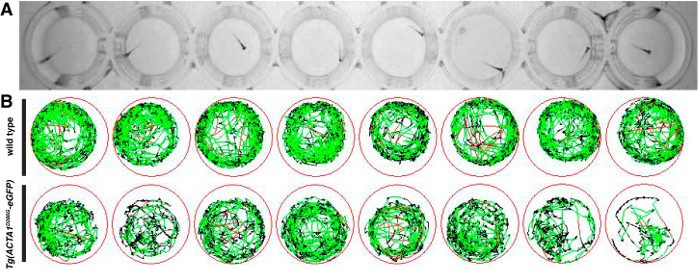
图 2: 运动检测的斑马鱼胚胎的表示 (A)的斑马鱼的胚胎放置在48孔板和运动从上方用红外数字照相机记录。 ( 二 )在测试期间用红色线条描绘快速移动,描绘动作缓慢和黑线描绘活动(如通过在软件中输入的检测阈值确定)绿线的斑马鱼的运动原理。 请点击此处查看大图这个数字。
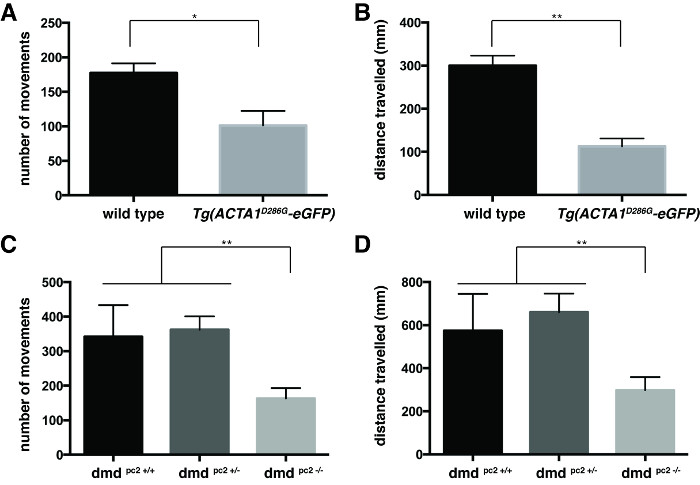
图 3: 运动检测的定量6 DPF斑马鱼运动的(A)号的量化和(B)的距离由旅行的Tg比在6 DPF控制斑马鱼(ACTA1 D286G-EGFP)斑马鱼。/ - -鱼突变体相比,6 DPF控制斑马鱼的运动的(C)号和(D)的定量由DMD PC2距离。误差棒代表±SEM 3重复实验,* P <0.05,** P <0.01。 请点击此处查看该图的放大版本。
讨论
许多不同的动物模型,包括小鼠,狗,斑马鱼,苍蝇和蠕虫已经对我们的肌肉疾病的遗传和分子基础的认识作出了贡献,并在打击这些治疗方法的发展援助。斑马鱼拥有了肌肉疾病的研究几个优点。斑马鱼提供了一种转基因可操纵系统,以评估在合适的生理环境,这是不可能的, 在体外培养系统中复杂的肌肉图案化。不像其他脊椎动物的动物模型,大量生产的鱼,其光学透明度在一起,方便快速,高通量体内的化学和遗传筛查。
这里,我们描述斑马鱼运动测定的发展提供了高通量和自动化方法斑马鱼胚胎发生期间,以评估肌肉性能。对于这两种检测必须承认,昼夜节律和外界环境的刺激会显著影响斑马鱼游泳行为17,18。相同的斑马鱼的反复测试也将导致习惯响应于触觉引起的降低刺激23。因此,为了实现实验之间可重现的结果各斑马鱼胚胎只应测试一次,当天和照明条件的时间应标准化,并且水温需要被紧密调节。
使用触摸在2诱发分析旦我们可以直接测量突发游泳动作,这是成正比的肌肉力量的最大加速度。在斑马鱼先前的技术已通过把胚胎实验设备以下是使用电场和肌肉14的力产生能力哪些肌肉收缩刺激的被测量的两端检测肌肉力量。虽然这种方法测量力产生的T能力他幼虫肌肉,它不游泳期间测量由幼虫肌肉产生的实际力。因此,我们发展到间接评估正常幼虫游泳运动过程中所产生的力,提供肌肉健康的一个全面衡量的方法。高速视频系统中,能够记录在1000帧的帧速率单独斑马鱼的动作/秒,可用于识别在肌肉功能小而显著的差异,这是不被眼睛直接识别。这将有兴趣来看看如何此前报道的电刺激力产生变化,在游泳的性能变化相关。
除了触摸诱发反应测定法也可以用于评估游泳运动,如游泳运动24在体波的形状和速度,以得到运动器官行为的定量测量。
由于斑马鱼的自发运动肥胖幼虫后3旦,我们无法进行触摸唤起测定以测量肌肉功能。相反地,我们通过测定在6单丝旦由斑马鱼的距离游过测量在较长时期内的肌肉性能。该试验中,虽然肌肉功能的间接测量,可被用来识别鱼显示受损肌肉性能8或神经变性25,26。这个试验不仅提供类似于6分钟步行试验的测量,但也适用于自动化高通量药物在体内的或诱变的屏幕。
披露声明
The authors have nothing to disclose.
致谢
We thank Viewpoint for their kind sponsorship of this manuscript. This work was funded by an Australian National Health and Medical Research Council (NHMRC) Project Grant (APP1010110).
材料
| Name | Company | Catalog Number | Comments |
| 21 G x 1' Blunt Needle | Terumo/Admiral Medical Supplies | TE2125 | |
| 48-well plates | Sigma | M8937 | |
| 90 mm Petri Dishes | Pacific Laboratory Products PT | S90001 | |
| High Speed Camera | Baumer | HXC20 | |
| http://www.randomization.com | N/A | Steps 1.1.2, 2.1.3 | |
| Incubator | Thermoline Scientific | TEI-43L | |
| Plastic Pipette | VWR | 16001-188 | |
| StreamPix5 | NorPix | Step 1.2.3 | |
| Temperature Control Unit | Viewpoint | ||
| Tweezers, style 8 | ProSciTech | T04-821 | |
| Zebrabox System | Viewpoint | ||
| Zebralab | Viewpoint | Steps 1.3.1, 2.2.1 |
参考文献
- Bassett, D. I., Bryson-Richardson, R. J., Daggett, D. F., Gautier, P., Keenan, D. G., Currie, P. D. Dystrophin is required for the formation of stable muscle attachments in the zebrafish embryo. Development. 130 (23), 5851-5860 (2003).
- Gupta, V. A., Kawahara, G., et al. A splice site mutation in laminin-α2 results in a severe muscular dystrophy and growth abnormalities in zebrafish. PLoS ONE. 7 (8), e43794 (2012).
- Gupta, V., Kawahara, G., et al. The zebrafish dag1 mutant: a novel genetic model for dystroglycanopathies. Hum Mol Genet. 20 (9), 1712-1725 (2011).
- Kawahara, G., Karpf, J. A., Myers, J. A., Alexander, M. S., Guyon, J. R., Kunkel, L. M. Drug screening in a zebrafish model of Duchenne muscular dystrophy. Proc Natl Acad Sci. 108 (13), 5331-5336 (2011).
- Telfer, W. R., Nelson, D. D., Waugh, T., Brooks, S. V., Dowling, J. J. neb: a zebrafish model of nemaline myopathy due to nebulin mutation. Dis Model & Mech. 5 (3), 389-396 (2012).
- Ruparelia, A. A., Oorschot, V., Vaz, R., Ramm, G., Bryson-Richardson, R. J. Zebrafish models of BAG3 myofibrillar myopathy suggest a toxic gain of function leading to BAG3 insufficiency. Acta Neuropathol. 128 (6), 821-833 (2014).
- Sztal, T. E., Sonntag, C., Hall, T. E., Currie, P. D. Epistatic dissection of laminin-receptor interactions in dystrophic zebrafish muscle. Hum Mol Genet. 21 (21), 4718-4731 (2012).
- Sztal, T. E., Zhao, M., et al. Zebrafish models for nemaline myopathy reveal a spectrum of nemaline bodies contributing to reduced muscle function. Acta Neuropathol. 130 (3), 389-406 (2015).
- Pichler, F. B., Laurenson, S., Williams, L. C., Dodd, A., Copp, B. R., Love, D. R. Chemical discovery and global gene expression analysis in zebrafish. Nat Biotechnol. 21 (8), 879-883 (2003).
- Peterson, R. T., Shaw, S. Y., et al. Chemical suppression of a genetic mutation in a zebrafish model of aortic coarctation. Nat Biotechnol. 22 (5), 595-599 (2004).
- Kawahara, G., Serafini, P. R., Myers, J. A., Alexander, M. S., Kunkel, L. M. Characterization of zebrafish dysferlin by morpholino knockdown. Biochem Bioph Res Co. 413 (2), 358-363 (2011).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov. , (2005).
- Smith, L. L., Beggs, A. H., Gupta, V. A. Analysis of skeletal muscle defects in larval zebrafish by birefringence and touch-evoke escape response assays. J Vis Exp. (82), e50925 (2013).
- Sloboda, D. D., Claflin, D. R., Dowling, J. J., Brooks, S. V. Force measurement during contraction to assess muscle function in zebrafish larvae. J Vis Exp. (77), (2013).
- McDonald, C. M., Henricson, E. K., et al. The 6-minute walk test as a new outcome measure in Duchenne muscular dystrophy. Muscle Nerve. 41 (4), 500-510 (2010).
- McDonald, C. M., Henricson, E. K., et al. The 6-minute walk test and other clinical endpoints in duchenne muscular dystrophy: reliability, concurrent validity, and minimal clinically important differences from a multicenter study. Muscle Nerve. 48 (3), 357-368 (2013).
- Hurd, M. W., Debruyne, J., Straume, M., Cahill, G. M. Circadian rhythms of locomotor activity in zebrafish. Physiol Behav. 65 (3), 465-472 (1998).
- MacPhail, R. C., Brooks, J., Hunter, D. L., Padnos, B., Irons, T. D., Padilla, S. Locomotion in larval zebrafish: Influence of time of day, lighting and ethanol. Neurotoxicology. 30 (1), 52-58 (2009).
- Berger, J., Berger, S., Jacoby, A. S., Wilton, S. D., Currie, P. D. Evaluation of exon-skipping strategies for Duchenne muscular dystrophy utilizing dystrophin-deficient zebrafish. J Cell Mol Med. 15 (12), 2643-2651 (2011).
- Berger, J., Sztal, T., Currie, P. D. Quantification of birefringence readily measures the level of muscle damage in zebrafish. Biochem Bioph Res Co. 423 (4), 785-788 (2012).
- Ravenscroft, G., Jackaman, C., et al. Mouse models of dominant ACTA1 disease recapitulate human disease and provide insight into therapies. Brain. 134 (4), 1101-1115 (2011).
- Ravenscroft, G., Wilmshurst, J. M., et al. A novel ACTA1 mutation resulting in a severe congenital myopathy with nemaline bodies, intranuclear rods and type I fibre predominance. Neuromuscular Disord. 21 (1), 31-36 (2011).
- Wolman, M. A., Jain, R. A., Liss, L., Granato, M. Chemical modulation of memory formation in larval zebrafish. Proc Natl Acad Sci. 108 (37), 15468-15473 (2011).
- Müller, U. K., van Leeuwen, J. L. Swimming of larval zebrafish: ontogeny of body waves and implications for locomotory development. J Exp Biol. 207 (Pt 5), 853-868 (2004).
- Cheng, W., Tian, J., Burgunder, J. M., Hunziker, W., Eng, H. L. Myotonia congenita-associated mutations in chloride channel-1 affect zebrafish body wave swimming kinematics. PLoS ONE. 9 (8), e103445 (2014).
- Moggio, M., Colombo, I., et al. Mitochondrial disease heterogeneity: a prognostic challenge. Acta Myol. 33 (2), 86-93 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。