A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
طرق تقدير من معدلات الجلوكوز والأحماض الدهنية الأكسدة في عزل قلب الجرذ العمل
In This Article
Summary
The following protocol describes the preparation and utilization of buffers for the quantitative measurement of rates of glucose and fatty acid oxidation in the isolated working rat heart. The methods used for sample analysis and data interpretation are also discussed.
Abstract
قلب الثدييات هو المستهلك الرئيسي للاعبي التنس المحترفين ويتطلب امدادات ثابتة من ركائز الطاقة للانكماش. ليس من المستغرب، وقد تم ربط التعديلات التمثيل الغذائي عضلة القلب في تطوير الخلل مقلص وفشل القلب. ولذلك، كشف الصلة بين التمثيل الغذائي وتقلص يجب تسليط الضوء على بعض الآليات التي تحكم التكيف القلب أو سوء التكيف في الحالات المرضية. العاملين إعداد قلب فأر معزولة يمكن استخدامها لمتابعة، في وقت واحد وفي الوقت الحقيقي، وظيفة مقلص القلب وتدفق الطاقة وتوفير ركائز في المسارات الأيضية المؤكسدة. ويهدف هذا البروتوكول إلى تقديم وصف مفصل للأساليب المستخدمة في إعداد واستخدام مخازن للقياس الكمي لمعدلات الأكسدة لالجلوكوز والأحماض الدهنية، والطاقة الرئيسية التي تقدم ركائز للقلب. وتناقش أيضا الأساليب المستخدمة لتحليل العينات وتفسير البيانات.وباختصار، يعتمد هذه التقنية على توريد 14 ج الجلوكوز رديولبلد و3 H- رديولبلد سلسلة طويلة من الأحماض الدهنية إلى خارج الجسم الحي القلب النابض عن طريق نضح شبه البلوري سوي الحرارة 14 CO 2 و 3 H 2 O، تركات نهاية التفاعلات الأنزيمية تشارك في الاستفادة من هذه ركائز توفير الطاقة، ثم يتم استردادها من الناحية الكمية من النفايات السائلة التاجي. مع المعرفة من نشاط معين من ركائز رديولبلد استخدامها، ومن ثم من الممكن ل quantitate بشكل فردي تدفق الجلوكوز والأحماض الدهنية في مسارات الأكسدة. وظيفة مقلص من القلب معزولة يمكن تحديد بالتوازي مع أجهزة التسجيل المناسبة وترتبط مباشرة بالقيم التمويه الأيضية. هذه التقنية مفيدة للغاية لدراسة العلاقة الأيض / انكماش في استجابة لظروف الإجهاد المختلفة مثل التغييرات في مرحلة ما قبل وبعد الحمل ونقص التروية، وهو دواء أو circulaعامل تينغ، أو بعد تغيير في التعبير عن الجين المنتج.
Introduction
أهمية سريرية
في قلب الثدييات، هناك علاقة إيجابية قوية بين تدفق ركائز من خلال المسارات الأيضية المؤكسدة، وتوليد ATP وعمل القلب 1. أدى التحقيق في الصلة المعقدة بين الأيض القلبية وظيفة على مدى العقدين الماضيين أن ندرك أن التغيرات في التمثيل الغذائي القلب هي سبب لضعف انقباض و إعادة هيكلية ربما المرضية في تحديد أنواع مختلفة من أمراض القلب 2-4. ولذلك، فإنه من المتوقع أن فهمنا للآليات التي تحكم إعادة التمثيل الغذائي للقلب وشدد سيؤدي إلى تحديد الأهداف العلاجية لمنع أو علاج قصور القلب 5-7. نشر مؤخرا بيانا علميا من جمعية القلب الأمريكية على "تقييم القلب الأيض" يؤكد الاهتمام المتزايد من جانب المجتمع العلمي لرحقله من الأبحاث 8. لكن في حين أن التقدم التكنولوجي في مجال التصوير القلبي تسمح الآن للتقييم الدقيق والسريع لالتشكل القلب وظيفة، لا تزال الدراسة في الجسم الحي الأيض القلب محدودة ومرهقة: يمكن الرنين المغناطيسي (NMR) الطيفي والنووي التصوير المقطعي بالإصدار البوزيتروني (PET) التصوير يتم استخدامها لمتابعة القلب الطاقة العالية الفوسفات التمثيل الغذائي والنشاط دورة كريبس، ولكن تعاني هذه التقنيات من ارتفاع تكاليف التشغيل وعدم قدرتهم على تحديد مساهمة مختلف ركائز لالأيض المؤكسدة في ظروف الحالة المستقرة 9. لهذا التاريخ وخارج الجسم الحي العمل إعداد القلب يمثل تقنية الوحيدة والفريدة المتاحة للدراسة، في وقت واحد وفي الوقت الحقيقي، وظيفة مقلص وتدفق ركائز في المسارات الأيضية المؤكسدة 7،9. ويهدف البروتوكول التالية لتوفير مبادئ توجيهية في إعداد واستخدام الكواشف المستخدمة لتحديد الفئرانوفاق من استخدام ركائز في معزولة الفئران عمل القلب.
ومعزولة القوارض العمل القلب جهاز
على الرغم من أن الأسلوب هو قرن تقريبا نصف القديمة، ومعزولة العمل إعداد قلب فأر يبقى الأسلوب المفضل لأبحاث القلب والأوعية الدموية. كما هو الحال مع إعداد قلب Langendorff، قلب القوارض العمل يوفر وسيلة بسيطة نسبيا، يمكن الاعتماد عليها، وغير مكلفة لقياس مجموعة واسعة من المعلمات القلب بشكل مستقل عن آثار الخلط من الأجهزة الأخرى، الهرمونية العصبية والعوامل المتداولة الأخرى. ولكن على النقيض من القلب perfused Langendorff، لا يزال قلب العمل لأداء عمل القلب شبه الفسيولوجية، وهو شرط أساسي لتوليد تدفق الأيض التأكسدي إلى المستويات التي هي ذات الصلة إلى الأوضاع في الجسم الحي. ويتحقق ذلك من خلال تقديم العازلة نضح إلى البطين الأيسر (LV) عبر قنية مرتبطة إلى الأذين الأيسر، وكما يملأ LV والعقود، ويتم إخراج عازلة من خلال خط الأبهر ضد بعد التحميل الضغط الهيدروليكي العزم. تصميم جهاز نضح وصف في الأصل من قبل نيلي وزملاؤه 10 وتحسنت فيما بعد Taegtmeyer، حمص وكريبس 11، ولكن لم يتغير سوى القليل جدا منذ ذلك الحين. كما هو موضح في الجهاز الأصلي، وظيفة مقلص يمكن تقييمه من خلال تحديد النتاج القلبي، وذلك باستخدام أي أكثر من أسطوانة مدرجة وساعة توقيت لقياس الأبهر وتدفقات التاجي 10،11. عدة بائعين تقدم الآن أنظمة كاملة القوارض العمل نضح القلب. يمكن الحصول على هذه الأجهزة متوفرة تجاريا مع flowprobes، محولات الضغط، قسطرة حجم الضغط وجميع المعدات اللازمة للحصول على البيانات وظيفي في القلب والتحليل. توفر البائعين جلسات الوثائق وتدريبية مكثفة لتعريف المستخدم الجديد مع معداتهم. عدة مقالات المراجعة أيضا بروتوكولات التفاصيل عن instrum قلب العملentation وعلى استخدام القسطرة لقياس وظيفة القلب لدى القوارض 12-15. لهذا السبب، فإننا سوف أذكر فقط لفترة وجيزة على انشاء الجهاز نضح وأجهزة التسجيل. ويهدف هذا البروتوكول إلى حد ما تكمل المعلومات المتاحة بالفعل مع وصف الأساليب التي يمكن تنفيذها لقياس الوقت نفسه معدلات الجلوكوز وسلسلة طويلة للأكسدة الأحماض الدهنية، وهما توفير الطاقة ركائز رئيسية في القلب الطبيعي. وصفنا هنا كل الخطوات المتبعة في استخدام الطاقة ركائز رديولبلد لتقييم عملية التمثيل الغذائي الناتج عن الأكسدة عضلة القلب، من إعداد الكواشف ومخازن للانتعاش وتجهيز العينات، لتحليل البيانات.
مبادئ الطريقة
العضلية تولد معظم طاقتها لتقلص من الفسفرة التأكسدية من الأحماض الدهنية (أساسا الأحماض الدهنية طويلة السلسلة) والكربوهيدرات (glucosه واللاكتات). قلب محدودة جدا احتياطيات الطاقة وتعتمد على إمدادات ثابتة من هذه ركائز توفير الطاقة من الدورة الدموية. وهدم الجلوكوز من خلال مسار حال السكر ينتج البيروفات التي يتم بعد ذلك decarboxylated من قبل مجمع نازعة البيروفات للغشاء الميتوكوندريا الداخلية. الأحماض الدهنية طويلة السلسلة، المستخرجة من تعميم الزلال أو البروتين الدهني الدهون الثلاثية، وتنشيط أولا إلى جزيئات أسيل، لجنة الزراعة في العصارة الخلوية ونقل بعد ذلك داخل المصفوفة الميتوكوندريا من خلال المكوك الكارنيتين لدخول مسار بيتا للأكسدة. جزيئات أسيتيل جنة الزراعة التي تنتجها هدم الجلوكوز والأحماض الدهنية تغذي دورة كريبس لتوليد حكمه الحد (NADH والقوات المسلحة الهايتية 2) والتي تستخدم من قبل في سلسلة نقل الإلكترون لبناء قوة البروتون الدافع عبر غشاء الميتوكوندريا الداخلية و توليد ATP من خلال نشاط سينسيز اعبي التنس المحترفين. الماء وثاني أكسيد الكربون والمنتجات الثانوية نهايةالتفاعلات الأنزيمية التي تجري داخل دورة كريبس. توريد 14 ج و 3 H- ركائز رديولبلد (مثل 14 الجلوكوز C-رديولبلد وحمض الأوليك 3 H-رديولبلد) إلى قلب العمل معزولة سيؤدي بالتالي إلى إنتاج 14 CO 2 و 3 H 2 O التي يمكن سيتم استردادها من الناحية الكمية من النفايات السائلة التاجي. ويتم جمع 14 CO 2 عن طريق الحفاظ على القلب perfused معزولة في غرفة مغلقة ويتعافى على الفور النفايات السائلة التاجي فور خروجها من القلب. ويستخدم عمود الصرف أنيون صغير لفصل واستعادة 3 H 2 O من النفايات السائلة التاجي. يتم قياس النشاط الإشعاعي من العينات المصنعة مع عداد التلألؤ السائل، ومطلع على نشاط معين من ركائز رديولبلد استخدامها، ومن ثم من الممكن ل quantitate بشكل فردي تدفق الجلوكوز والأحماض الدهنية فيالأكسدة مسارات 16،17.
Protocol
ملاحظة: تم تنفيذ جميع الإجراءات الحيوانية وفقا لسياسة الخدمات الصحية المعاهد الوطنية للصحة العامة لرعاية الإنسان واستخدام الحيوانات وتمت الموافقة من قبل لجنة رعاية واستخدام الحيوان المؤسسي من المركز الطبي بجامعة ميسيسيبي. وقد وافق جميع الإجراءات التي تنطوي على استخدام النظائر المشعة وأجريت وفقا للمبادئ التوجيهية التي وضعتها مكتب السلامة من الإشعاع من المركز الطبي بجامعة ميسيسيبي.
1. إعداد ألبوم حلول العازلة والكواشف
- كريبس-هنسلايت (KH) للمخزون الاحتياطي حلول
- إعداد 2 لتر من محلول 20x وتتركز الأسهم الملح التي تحتوي (في مول / لتر) 2.37 كلوريد الصوديوم، 0.0948 بوكل، 0.0236 KH 2 PO 4، و0.0236 MgSO 4 * 7H 2 O. تصفية على 0.45 ميكرون المسام حجم وحدة الترشيح وتخزينها في درجة حرارة الغرفة لمدة تصل إلى 1 في الشهر.
- إعداد 2 لتر من محلول 20x ومركزة (0.5 مول / لتر) من NaHCO 3. الحل يمكن أن يكونتخزينها في درجة حرارة الغرفة لفترة غير محددة من الوقت.
- إعداد 250 مل من 1 مول / لتر محلول المخزون من CaCl 2. تصفية على 0.45 ميكرون المسام حجم وحدة الترشيح وتخزينها في درجة حرارة الغرفة لمدة تصل إلى 1 في الشهر.
- تحويل أنيون تبادل راتينج من نموذج كلوريد إلى نموذج هيدروكسيد
- غسل راتنج تبادل شاردي عن طريق إعادة التعليق في الماء عالى النقاء 1 لتر. تسمح الراتنج ليستقر وتخلصي من الماء الزائد. كرر هذه الخطوة 4 مرات أكثر.
- صب الراتنج في كوب تحليل مجهري حامل فلتر فراغ شنت على قارورة التصفية.
- تحويل الراتنج لشكل هيدروكسيد عن طريق تمرير ببطء من خلال 22 مجلدا من 1 N هيدروكسيد الصوديوم. خلط الطين بشكل متقطع مع ملعقة الفولاذ المقاوم للصدأ.
- غسل الراتنج مع الماء عالى النقاء حتى تنخفض درجة الحموضة أقل من 9.0. تحقق من درجة الحموضة بشكل منتظم عن طريق غمس درجة الحموضة شريط الاختبار بالقرب من سطح الطين الراتنج. تغطية وتخزين الراتنج مع الماء عالى النقاء إلى بوزجاجة rosilicate وحماية من ضوء. لا تسمح الراتنج لتجف قبل الاستخدام.
ملاحظة: عند تخزينها بشكل صحيح، فإن الراتنج آخر 3 أشهر على الأقل.
- الأوليك حمض الألبومين الحل 8X المركزة المالية
- في قارورة 4 L مخروطي، مزيج 200 مل من 20x والمالحة المركزة حل سهم و 200 مل من تتركز حل 20x وNaHCO 3 مع الماء عالى النقاء 3.6 لتر.
- باستخدام أنبوب تشتت الغاز مع اسطوانة fritted والغاز الحل لمدة 15 دقيقة مع خليط من غاز ثاني أكسيد الكربون بنسبة 5٪ والأكسجين 95٪ لتحقيق الاستقرار في درجة الحموضة.
- صب 470 مل العازلة في كوب من الزجاج 1 لتر. إضافة 8.75 مل من 1 مول / لتر CaCl حل 2 الأسهم إلى المخزن المؤقت 3530 مل المتبقية في القارورة 4 L مخروطي وتوضع جانبا.
- إضافة 40 غرام من خالية من الأحماض الدهنية BSA إلى الدورق الزجاجي 1 لتر ويقلب مع بقضيب حتى يذوب.
- في 15 مل أنبوب مخروطي الشكل، وإعداد 4 مل من 50٪ (ت: ت) الحل الايثانول في الماء عالى النقاء. إضافة 487 ملغ sodiuيذوب تماما م أوليات ودوامة حتى مسحوق.
ملاحظة: بعض المحققين استخدام حمض البالمتيك بدلا من حمض الأوليك في المنطقة العازلة نضح. A-حمض الألبومين حل الأسهم البالمتيك قد تكون على استعداد باتباع نفس الإجراء. ومع ذلك، فمن المستحسن لتدفئة حل في 70 درجة مئوية لتحقيق ذوبان كامل للبالميتات الصوديوم. - إضافة قطرة قطرة الحل أوليات لخالية من الأحماض الدهنية حل جيش صرب البوسنة مع الاستمرار في التحريك وانتظر 10 دقيقة أكثر للمجمع حمض الأوليك BSA لتشكيل.
ملاحظة: يجب أن يكون الحل لون أصفر فاتح ويكون خاليا من جزيئات مرئية. وجود راسب أو جزيئات غير قابلة للذوبان قد يشير الاقتران غير كاملة من الأحماض الدهنية لجيش صرب البوسنة. إذا حدث هذا، يجب التخلص من الحل وبدأت عملية تكرارا.
ملاحظة: سوف بالميتات يعجل إذا ما سمح لها الجلوس في ماصة ولا يمكن إضافة قطرة قطرة. قد تكون درجة حرارة الحل أثار لجيش صرب البوسنة في 37 درجة مئوية لتسهيل المربوطةغرام من حمض البالمتيك. لا افراط لأن هذا قد يسبب تمسخ وتجميع جيش صرب البوسنة.
تنبيه: الخطوات المقبلة من هذا البروتوكول ينطوي على تلاعب من المواد المشعة. ارتداء معدات الوقاية الشخصية المناسبة واتباع قواعد السلامة والتخلص من النفايات التي حددها مكتب السلامة من الإشعاع المؤسسة. - إضافة 160 ميكرولتر (0.8 MCI) [9،10- 3 H] حامض الأوليك إلى حل التحريك من الأوليك حمض BSA ويحرك المزيج لمدة 10 دقيقة أخرى.
- إضافة 2.5 مل من 1 مول / لتر CaCl حل 2 الأسهم إلى حل التحريك من الأوليك حمض BSA.
- قطع ما يقرب من 1.2 متر غسيل الكلى غشاء الأنابيب وشطف الداخل والخارج مع ماء الصنبور على حد سواء. فرك أنابيب غسيل الكلى بقوة تحت ماء الصنبور لمدة 10 إلى 15 دقيقة لإزالة طلاء الجلسرين من الغشاء. بدلا من ذلك، إزالة الطلاء عن طريق نقع أنابيب غسيل الكلى في ماء دافئ لمدة 1 ساعة قبل الاستخدام. الانتهاء من ذلك بدهن أنابيب غسيل الكلى مع توفير المياه فائقة النقاءص.
- ربط آمن من واحدة من نهاية الأنبوب غسيل الكلى. ملء مع الحل حمض الأوليك BSA وربطة عنق قبالة الطرف الآخر من الأنبوب غسيل الكلى.
- وضع أنابيب غسيل الكلى شغل في قارورة 4 L مخروطي من العازلة KH والسماح dialyzing بين عشية وضحاها في 4 درجة مئوية مع التحريك لطيف مع التحريك.
- في اليوم التالي، وإزالة تتركز الأوليك حل 8X حمض BSA من أنابيب غسيل الكلى. استخدام الحل حمض الأوليك BSA فورا لنضح أو قسامة ومخزن في -20 درجة مئوية. قسامات المجمدة مستقرة لمدة 2 أشهر على الأقل. تجنب متعددة تجميد أذاب دورات لأن هذا قد يعرض للخطر الذوبان في الأوليك مجمع حمض BSA.
ملاحظة: استخدام الماء عالى النقاء فقط ((المقاومة) من 18.2 MΩ.cm في 25 درجة مئوية، الكربون العضوي الكلي <10 جزء في البليون، الكائنات الدقيقة ≤ 1 كفو / مل، والجسيمات مع حجم أكثر من 0.22 ميكرون ≤1 / مل) لتحضير الكواشف ومخازن تستخدم لنضح القلب. تحويل راتنج تبادل شاردي من كلوريد لها لم إلى النموذج هيدروكسيد يمكن تجنبها عن طريق الشراء المباشر من شكل هيدروكسيد في مصروف إضافي (انظر المواد الجدول). وبالاضافة الى أوليات أو بالميتات، أي نوع آخر من تحدث بشكل طبيعي الأحماض الدهنية يمكن أن تستخدم أيضا، طالما نسخة معالج بالتريتيوم من الأحماض الدهنية غير متاح لمتابعة الأكسدة.
2. إعداد العازلة الإرواء
- في قارورة 4 L مخروطي، مزيج 200 مل من 20x والمالحة المركزة حل سهم و 200 مل من تتركز حل 20x وNaHCO 3 مع الماء عالى النقاء 3.6 لتر. الغاز هو الحل لمدة 15 دقيقة مع خليط من غاز ثاني أكسيد الكربون بنسبة 5٪ والأكسجين 95٪، ثم إضافة 10 مل من 1 مول / لتر CaCl حل 2 الأوراق المالية لتعيين تركيز الكالسيوم الحرة 2+ على 2،5 مليمول / لتر.
تنبيه: وتشمل الخطوات التالية دون التعامل مع المواد المشعة. ارتداء معدات الوقاية الشخصية المناسبة واتباع قواعد السلامة والتخلص من النفايات التي وضعتها را المؤسسةمكتب السلامة الومضة. - نقل 1.750 عازلة L KH إلى زجاجة البورسليكات الزجاج 2 لتر. إضافة 250 مل من 8X تتركز حل حمض الأوليك BSA، 1.802 غرام مد الجلوكوز، 400 الأنسولين ميكرولتر في 0.4 U / مل، و 200 ميكرولتر (0.2 MCI) [U- 14 C] الجلوكوز. عكس زجاجة إلى المزيج. وهذا يعطي 2 لتر من العازلة نضح كاملة تحتوي على حمض الأوليك (0.4 مليمول / لتر)، D-الجلوكوز (5 مليمول / لتر)، والانسولين (40 μU / مل).
ملاحظة: حجم 2 لتر يكفي ليروي في العمل قلب فأر بالغ في ظروف غير إعادة تدوير للا يقل عن 60 دقيقة. - استخدام بعض العازلة KH غير المشعة لملء اثنين من أطباق تشريح ووضع على الجليد لتبريد.
3. إعداد جهاز نضح
ملاحظة: للمحقق يمكن أن تختار لاستخدام جهاز نضح مبنية خصيصا مثل التي وصفها Taegtmeyer، حمص وكريبس 11، أو واحد من النظم المتاحة تجاريا. وعادة ما تتألف أنظمة نضح منعناصر وصفها في الشكل 1 أدناه. إلى جانب أنابيب والأواني الزجاجية، وبقية أجهزة التسجيل اختيارية واستخدامه سوف تعتمد على احتياجات المحقق لمعالجة مسألة التجريبية التي طلبت. ومع ذلك، فإننا نوصي باستخدام الميكروية الأكسجين لتحديد تركيز O 2 في دخول العازلة وتخرج من الدورة الدموية التاجية (الشكل 1). وهذا سوف يساعد على السيطرة محقق أن يتم تزويد القلب مع كمية مناسبة من الأكسجين، والتي امدادات الاوكسجين لا تختلف بين التجارب. وبالإضافة إلى ذلك، تحديد "الشرايين والأوردة" الفرق الأكسجين يمكن أن تستخدم لحساب استهلاك الأوكسجين عضلة القلب وكفاءة القلب 16،18.
- بدوره على حمام ماء تعميم وضعت في 37 درجة مئوية في عملية الاحماء جهاز نضح.
- بدوره على جهاز الكمبيوتر ونظام الحصول على البيانات التي سوفيمكن استخدامها لقياس وظيفة القلب.
- ربط أجهزة التسجيل (قسطرة الضغط، ضغط حجم القسطرة، الميكروية الأكسجين، تدفق متر، الخ) إلى نظام الحصول على البيانات وإجراء معايرة الأجهزة باتباع إرشادات الشركة المصنعة.
- ملء خزان العازلة مع الماء عالى النقاء. بدوره على مضخة تحوي واخراج الماء من خلال جميع الأنابيب والأواني الزجاجية لشطف النظام. إيقاف المضخة تحوي وتأكد من عدم إقامة المياه في أنابيب و / أو الأواني الزجاجية لأن هذا قد يؤثر على تركيز العازلة نضح وإعداد القلب.
- توصيل 1.0 ميكرون جديد فلتر الألياف الزجاجية للنظام. ربط خزان الغاز التي تحتوي على خليط من غاز ثاني أكسيد الكربون بنسبة 5٪ والأكسجين 95٪ إلى غرفة بالاكسجين.
تنبيه: وتشمل الخطوات التالية دون التعامل مع المواد المشعة. ارتداء معدات الوقاية الشخصية المناسبة واتباع قواعد السلامة والتخلص من النفايات التي وضعتها المؤسسةمكتب الصورة السلامة من الإشعاع. - ملء خزان العازلة مع العازلة نضح. تشغيل المضخة وضمان شغل جميع الأنابيب والأواني الزجاجية مع العازلة نضح. تشغيل المخزن المؤقت نضح من خلال جهاز نضح في وضع إعادة تدوير والأوكسجين لمدة 30 دقيقة على الأقل قبل الاستخدام.
- إرفاق بإحكام أنبوب حقنة 20 مل تحت الغرفة القلب لاسترداد النفايات السائلة التاجي. ربط غيض من حقنة لقمة ثلاثي محبس. ربط الذراع الجانب إلى حقنة 3 مل. ربط الذراع السفلي عبر أنابيب إلى حاوية للنفايات المشعة السائلة.
ملاحظة: عند استخدام الدهنية حمض BSA معقدة، لا يمكن أن يتم الأوكسجين في المخزن المؤقت نضح من خلال محتدما المباشر مع أنبوب الغاز التشتت وهذا سوف يسبب رغوة المفرطة من الحل. استخدام مكساج غشاء (الشكل 1) أو غرفة بالاكسجين تدفق ورقة لهذا الغرض. ينصح به للغاية للتحقق من مستوى س المناسبوصلت و الأوكسجين عن طريق وضع مسرى مكروي الأكسجين في الدائرة نضح (الشكل 1).
4. الجرذ عزل القلب وكيفية تركيب الكانيولا
- وزن الفئران على نطاق واسع.
- تحضير حقنة مع جرعة التخدير من 150 ملغم / كغم thiobutabarbital هيدرات ملح الصوديوم وحقنة السلين مع 200 جامعة جنوب المحيط الهادئ وحدات الهيبارين.
- حقن thiobutabarbital الملكية الفكرية وانتظر الحيوانية ليفقد وعيه. وكلاء تحريض الآخرين يمكن استخدام طويلة مثل هذا لن يتعارض مع الغرض من التجربة (انظر اختيار التخدير في قسم مناقشة أدناه).
- تحقق من وجود مستوى مناسب من التخدير بتأكيد عدم وجود منعكس قرصة أخمص قدميه. تأكد للحفاظ على عمق مناسب من التخدير للتأكد من أن الحيوان لا يشعر بالألم أثناء العملية.
- وبمجرد أن الفئران فاقد الوعي تماما ولا يستجيب لقرصة أخمص القدمين، وضعه على ظهره على طاولة العمليات وثانيةأطرافه لدى عودتهم مع الشريط أو الدبابيس.
- مقطع مجانا البطن من الشعر وإجراء شق خط الوسط من البطن. لا تقم أبدا بفتح تجويف الصدر عند هذه النقطة بعد. نقل المعدة والأمعاء جانبا لكشف الوريد الأجوف السفلي. حقن الهيبارين مباشرة في الوريد الأجوف السفلي وانتظر 5 إلى 10 ثانية قبل المتابعة.
- قطع باستخدام مقص الحجاب الحاجز وجانبي القفص الصدري لفضح المحتوى من تجويف الصدر.
- بدقة والاستيلاء على القلب بين الإبهام، السبابة والوسطى والمكوس على حد سواء القلب والرئتين معا. قطع على مستوى الشريان الأورطي النازل، والحرص على عدم الإضرار قوس الأبهر والشريان الأبهر الصاعد في هذه العملية. على الفور نقل القلب والرئتين إلى واحد من الأطباق تشريح مليئة عازلة KH-الجليد الباردة.
- بعد توقف القلب النابض، ونقل في طبق تشريح الثاني وتقليم قبالة أي قطع كبيرة من أنسجة الرئة المرفقة مع الحفاظ على القلب غارقة في المخزن KH-الجليد الباردة. قطع الهبوطجي الشريان الأورطي الحق فوق قوس الأبهر.
تنبيه: وتشمل الخطوات التالية دون التعامل مع المواد المشعة. ارتداء معدات الوقاية الشخصية المناسبة واتباع قواعد السلامة والتخلص من النفايات التي حددها مكتب السلامة من الإشعاع المؤسسة. - تدفق خط الأبهر من جهاز نضح لملء قنية الأورطي مع العازلة الحار والقضاء على أي ماء أو الهواء التي قد تكون لا تزال موجودة في الأنبوب. تسمح المخزن المؤقت نضح أن يتقطر من قنية الشريان الأبهر لتقليل فرصة الصمات الهواء في الوقت الذي تعلق القلب للقنية.
- باستخدام اثنين من ملقط تشريح الصغرى فتح بعناية الشريان الأورطي، وحرك القلب حتى على قنية الشريان الأبهر. تأمين الشريان الأورطي في قنية مع مقطع الصغير والشروع Langendorff نضح القلب. مراقبة القلب يبدأ الضرب مرة أخرى، وطرد كل الدم المتبقي في الأوعية الدموية التاجية في الثواني التالية بداية من نضح.
ملاحظة: من المهم جدا لتنفيذ الخطوات 4.من 6 إلى 4.10 سريع قدر الإمكان لمنع الضرر الدماغية لا رجعة فيه إلى القلب. من ذوي الخبرة، وينبغي أن الإجراء بأكمله يستغرق ما بين 1 و 2 دقيقة. عندما ينزلق الشريان الأورطي حتى على قنية، يجب الحرص على عدم تمرير جذر الأبهر لأن هذا قد يؤدي إلى نقص انسياب الدم عضلة القلب وتلف الصمام الأبهري. - ربط الشريان الأورطي إلى قنية الأورطي مع خياطة الحرير 3-0 وإزالة مقطع الصغير. تحديد موقع الوريد الرئوي. قد يكون من الضروري لخفض الأنسجة غير القلبية للعثور عليه، ولكن لا تقطع الكثير من الأنسجة غير القلب لأنها سوف تعمل على ربط الأذين الأيسر إلى قنية.
- تدفق خط الأذيني الأيسر من جهاز نضح لملء قنية الأذيني مع العازلة الحار والقضاء على أي ماء أو الهواء التي قد تكون لا تزال موجودة في الأنبوب. توخي الحذر بشكل خاص لإزالة أي فقاعة الهواء من الجهاز لتقليل فرصة الصمات الهواء في الوقت الذي تعلق القلب للقنية.
- باستخدام اثنين الصغير forc تشريحالعائد على السهم انتزاع بدقة افتتاح الوريد الرئوي والشريحة قلب حتى على قنية الأذينية. قد يكون من الضروري أن يعيد القلب بلطف الدورية للقنية الأذيني و / أو الأبهر لإنجاز هذه الخطوة. في أي حال، تأكد من أن الإجراء لا تفرض الإفراط في الضغط على القلب ويسبب الانحناء من الشريان الأورطي. ربط الأذين الأيسر إلى الأذين قنية مع خياطة 3-0 الحرير.
- فتح خط الأذيني والتبديل في وقت واحد خط الأبهر من وضع Langendorff لطريقة العمل. إذا تسرب عازلة للخروج من الأذين الأيسر، إغلاق خط الأذيني، أن يعود مرة أخرى إلى خط الأبهر إلى Langendorff نضح، واستخدام الخيط الحرير 3-0 آخر لربط الأذين الأيسر أكثر أمانا للقنية.
5. قياس وظيفة القلب وجمع العينات
ملاحظة: سيتم تحديد تدفقات التمثيل الغذائي يتطلب معرفة تدفق التاجي (CF). كما هو موضح أدناه، يمكن للقيم تدفق التاجية يكونتم الحصول عليها مع استخدام بسيط من ساعة توقيت. بالإضافة إلى ذلك، فإن قياس تدفق الأبهر (AF) بنفس طريقة تسمح بتحديد النتاج القلبي (CO = CF + AF)، والتي يمكن أن تستخدم بعد ذلك لحساب قوة القلب (CP) كإجراء العام من وظيفة القلب عن طريق تطبيق الصيغة CP = CO (م 3 / ثانية) * بعد التحميل (باسكال). طريقة أخرى متاحة لتقييم وظيفة القلب تعتمد على قياس الوقت الحقيقي للضغط النبض مع محول الضغط (الشكلان 3 و 4). على الرغم من اختياري، وقياسات أكثر دقة وتفصيلا من وظيفة وديناميكا الدم مقلص القلب، بما في ذلك تحديد الأيسر الانقباضية للبطين وظائف الانبساطي، وسوف يتحقق مع استخدام الضغط حجم (PV) القسطرة تصرف. يصف هذا الفصل بإيجاز قسطرة القلب معزولة. معلومات إضافية عن معايرة القسطرة الكهروضوئية وتحليل البيانات مع البرامج الإحصائية يمكن أن يكونوجدت في المراجع 14،15.
تنبيه: وتشمل الخطوات التالية دون التعامل مع المواد المشعة. ارتداء معدات الوقاية الشخصية المناسبة واتباع قواعد السلامة والتخلص من النفايات التي حددها مكتب السلامة من الإشعاع المؤسسة.
- إذا تضمنت التجربة القياس المباشر وظيفة LV مع القسطرة، ثقب قمة LV مع 26 G إبرة وإدخال القسطرة عن طريق ثقب.
- عند استخدام القسطرة حجم الضغط، ضع بعناية القسطرة بحيث يتم محاذاة رمح مع المحور الطولي الوقف، مع القطب البعيدة الحق دون صمام الأبهري والمتاخمة للحدود الشغاف، والقطب القريب فقط داخل جدار البطين.
- ختم القلب في غرفة القلب تغلف المياه ومراقبة المعلمات وظيفية القلب مع البرنامج الحصول على البيانات. بدء التسجيل بعد أن تم المعلمات القلب أساسية مستقرة لأكثر من 5 دقائق.
- تحديد تدفق التاجي من قبل شركة طيران الشرق الأوسطسورينغ الوقت المطلوب لملء أنبوب حقنة 20 مل تعلق تحت غرفة القلب. بعد القياس، فتح ثلاثي محبس لتفريغ النفايات السائلة التاجي في حاوية النفايات السائلة المشعة.
ملاحظة: يمكن أيضا قياسات التدفق أن يؤديها باستخدام مقياس الجريان وflowprobes. - استخدام حقنة 3 مل تعلق على الذراع جانب ثلاثي محبس لاسترداد ~ 2 مل النفايات السائلة التاجي فور خروجها من القلب. نقل 0.5 مل من النفايات السائلة التاجي إلى 2 مل أنبوب كابليس microcentrifuge لوالشروع فورا في تحديد معدلات أكسدة الجلوكوز (القسم 6 أدناه).
- نقل بقية العينة السائلة التاجية (~ 1.5 مل) في أنبوب microcentrifuge المسمى بشكل مناسب وتخزينها على الجليد.
- كرر الخطوات من 5،4-5،6 على فترات منتظمة (مثل كل 5 أو 10 دقيقة) حتى نهاية التجربة الارواء.
- في حالة استخدام القسطرة حجم الضغط، وضخ بلعة 10 ميكرولتر من محلول ملحي مفرط التوتر (15٪)في خط الأذيني والحق قبل قنية الأذيني قبل الختامية للتجربة. استخدام هذا حقن البلعة لحساب تصرف الموازي (V ع)، وهو أمر حاسم لتحديد دقيق لحجم القلب 15.
- فضها غرفة القلب وإزالة القسطرة من LV إذا تم استخدام واحد في التجربة. استرداد القلب باستخدام أحد الخيارات التالية:
- إذا لم يكن هناك حاجة لعزل مناطق معينة من القلب للتحليلات المصب وإذا كان جهاز نضح يسمح لها، خطوط كلا الأذيني والشريان الأبهر وثيقة ومباشرة تجميد المشبك القلب على قنية وذلك باستخدام ملقط Wollenberger قبل تبريده في النيتروجين السائل.
- بدلا من ذلك، خفض قلب قبالة قنية وأسقطه إلى عازلة KH-الجليد الباردة. تجف بسرعة قلب على منشفة ورقية وقياس وزنه الرطب. قلب ومن ثم يمكن تشريح وجمع عينات الأنسجة لمقاييس محددة. تجميد الأنسجة المتبقية باستخدام Wollenberger تونغالصورة قبل تبريده في النيتروجين السائل.
- تخزين أنسجة القلب المجمدة في -80 درجة مئوية حتى تحديد الوزن الجاف (انظر القسم 8. الحسابات).
6. تحديد عضلة القلب الجلوكوز الأكسدة الاسعار
ملاحظة: يتكون الأسلوب في الانتعاش الكمي من 14 CO 2 من النفايات السائلة التاجي مع حل محاصرة من هيدروكسيد من hyamine. 14 CO 2 الذائبة، حيث يتم استرداد H 14 CO3- التالية تحمض المخزن المؤقت مع حمض البيركلوريك. وينبغي معالجة عينات مباشرة بعد شفائهم كما الانتشار السلبي للغاز بين الهواء وعينة سيؤدي إلى فقدان 14 CO 2 مع مرور الوقت. قارورة التلألؤ يجب أن تكون مختومة بإحكام مع سدادات المطاط الأكمام لمنع خسارة 14 CO 2 بعد إضافة حمض البيركلوريك. إذا لزم الأمر، بارافيلم يمكن استخدامها لتأمين السدادات المطاطية كم لقارورة (الشكل 2).
- إضافة 1 مل من هيدروكسيد 10X مركزة من hyamine إلى قارورة التلألؤ الزجاج (قنينة واحدة لكل عينة + اثنين من قوارير اضافية لتحديد النشاط الخلفية).
تنبيه: هيدروكسيد من hyamine عالية السمية ويسبب حروق شديدة. استشر MSDS المنتج لمناولة وتخزين مناسبة. - باستخدام الملقط نقل بدقة 2 مل أنبوب كابليس microcentrifuge تحتوي العينة السائلة 0.5 مل التاجية لشغلها قبل قارورة مع هيدروكسيد من hyamine. استخدام 0.5 مل العازلة نضح لتحديد النشاط الخلفية.
- تتويج القارورة مع سدادة مطاطية كم. بارافيلم يمكن استخدامها لتأمين ختم من القارورة. باستخدام حقنة 1 مل و إبرة 23 G طويلة، وضخ 200 ميكرولتر من حمض البيركلوريك (60٪ ث: ث٪) من خلال سدادة مطاطية كم ومباشرة في أنبوب كابليس 2 مل.
ملاحظة: النفايات السائلة التاجي يجب أن تتحول الأبيض بسبب هطول الأمطار من جيش صرب البوسنة. - السماح للقارورة الصورةبين عشية وضحاها.
تنبيه: حامض البيركلوريك هو تآكل للغاية، يمكن أن يكون بمثابة مؤكسد و / أو تسبب خطر الانفجار. استشر MSDS المنتج لمناولة وتخزين مناسبة. - في اليوم التالي، وإزالة السدادات المطاطية كم. بعناية استرداد كل أنبوب كابليس 2 مل مع ملاقط وغسل أسفل أنبوب على رأس القنينة مفتوحة مع 1 مل التلألؤ كوكتيل لاسترداد كافة هيدروكسيد من hyamine. تجاهل أنبوب كابليس في حاوية النفايات المشعة وصفت بشكل مناسب.
- إضافة 9 مل التلألؤ كوكتيل إضافي في قنينة. إضافة 0.5 مل العازلة نضح مباشرة لاثنين من قوارير مليئة 10 مل السائل كوكتيل التلألؤ لتحديد نشاط معين. هز قارورة بقوة من جهة، والانتظار لا يقل عن 6 ساعة للسماح فقاعات الهواء لتبديد قبل القياس في عداد التلألؤ السائل حددت بشكل مناسب حتى للتجارب التسمية المزدوجة.
ملاحظة: استخدام قوارير الزجاج واضحة لتصور شمال شرقedle عند اختراق السدادات المطاطية كم. لا تسقط حمض البيركلوريك إلى هيدروكسيد من hyamine لأن هذا سوف تدمر رد فعل. إضافة النشرات حمض البيركلوريك 14 CO 2 من النفايات السائلة التاجي في الهواء. على الرغم من أن قارورة يجب أن تكون مختومة بإحكام وكل 14 CO 2 يجب أن المحاصرين في hyamine من هيدروكسيد، فمن المستحسن لإجراء هذا الفحص تحت غطاء الدخان الكيميائي.
7. تحديد عضلة القلب أوليئات الأكسدة الاسعار
ملاحظة: تعتمد هذه الطريقة على فصل الكمي واسترجاع 3 H 2 O من النفايات السائلة التاجية باستخدام الراتنج القوي الصرف أنيون. وخلافا لاسترداد 14 CO 2، ليس هناك قضية الاستقرار عينة والنفايات السائلة التاجي يمكن أن تبقى على الجليد أو تخزينها في الثلاجة قبل إجراء الفحص.
- إعداد أنيون الأعمدة راتنج التبادل (عمود واحد لكل عينة + رالتعليم الجامعي أعمدة إضافية لتحديد النشاط الخلفية) عن طريق ملء غيض من أنابيب حقنة 3 مل مع الصوف الزجاجي. إضافة الطين الراتنج / الماء مع ماصة نقل حتى يصل الراتنج علامة 2 مل على أنبوب حقنة.
- غسل الراتنج عن طريق تمرير 2 مل من الماء عالى النقاء من خلال العمود. كرر هذه الخطوة مرتين أخريين.
- ضع قارورة التلألؤ مفتوحة تحت الأعمدة وتحميل 0.5 مل النفايات السائلة التاجي في العمود. تحميل 0.5 مل العازلة نضح لتحديد النشاط الخلفية.
- غسل الأعمدة على التوالي مع 0.5 و 1 و 2 مل من الماء عالى النقاء. وبمجرد الانتهاء من شطف، تجاهل الأعمدة في حاوية النفايات المشعة وصفت بشكل مناسب.
- إضافة كوكتيل التلألؤ 13 مل السائل في قارورة التلألؤ. إضافة 0.5 مل العازلة نضح مباشرة لاثنين من قوارير مليئة 13 مل السائل كوكتيل التلألؤ لتحديد نشاط معين. هز قارورة بقوة والانتظار لا يقل عن 6 ساعة قبل قياس في الخيال العلمي السائلntillation مكافحة تعيين بشكل مناسب حتى للتجارب التسمية المزدوجة.
8. الحسابات
- إذا لم تقم بالفعل، وتحديد الوزن الرطب للمجلس بكامل هيئته perfused القلب.
ملاحظة: لا تسمح الأنسجة المجمدة لذوبان الجليد إذا التحليلات الجزيئية والكيمياء الحيوية هي التي يتعين القيام بها في وقت لاحق على الأنسجة المتبقية. - تحديد الوزن الرطب للعينة من نسيج كامل يروي القلب (استخدم ما يقرب من 15 إلى 30٪ من القلب كله). ضع عينة الأنسجة في فرن وضعت في 50 درجة مئوية خلال الليل وقياس وزنه الجاف. استخدام الوزن الرطب / الجافة نسبة وزن عينات الأنسجة لتحديد الوزن الجاف للقلب كله في غرام (غرام بالوزن الجاف).
- في كل مرة نقطة س تعبير عن قيمة التاجي تدفق CF س في مل / دقيقة.
- تحديد معدل أكسدة الجلوكوز
- متوسط اثنين من التفكك / دقيقة من آثارها القيم المقاسة للنشاط خلفية 14 مئوية إلى determiشمال شرق معامل التصحيح 14C DPM درجة البكالوريوس.
- تحديد 14 C متوسط قيمة نشاط معين 14C DPM سا.
- تحديد النشاط الإشعاعي محدد من الجلوكوز في DPM / مكرومول (F غلو) من خلال تطبيق المعادلة
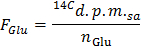
ملاحظة: أين ن حمض الغلوتاميك (مكرومول) = C حمض الغلوتاميك (مكرومول / L) * حجم العينة (L) = 2.5 عند استخدام الجلوكوز في 5 مليمول / لتر وعينة 0.5 مل. - تحدد لكل نقطة زمنية س معدل إنتاج 14 CO 2 في DPM / دقيقة (A) من خلال تطبيق المعادلة
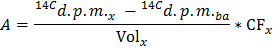
ملاحظة: أين المجلد العاشر (مل) = 0.5 - تقسيم من قيمة محددة من الوزن الجاف القلب للحصول على نسبة طبيعية من إنتاج 14 CO 2 (A نورم ) في DPM / دقيقة لكل وزن ز الجافة.
- تطبيق الصيغة GO = قاعدة / F حمض الغلوتاميك للحصول على معدل أكسدة الجلوكوز (GO) في مكرومول الجلوكوز / دقيقة لكل غرام بالوزن الجاف.
- تحديد أسعار الأكسدة أوليات
- متوسط اثنين من التفكك / دقيقة من آثارها القيم المقاسة للنشاط خلفية 3 H لتحديد معامل التصحيح 3H DPM درجة البكالوريوس.
- تحديد 3 H بلغ متوسط قيمة نشاط معين 3H DPM سا.
- تحديد النشاط الإشعاعي محدد من أوليات في DPM / مكرومول (F رأ ه) من خلال تطبيق المعادلة
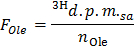
ملاحظة: أين ن اولي (مكرومول) = C اولي (مكرومول / L) * حجم العينة (L) = 0.2 عند استخدام أوليات عند 0.4 ملمول / لتر وعينة 0.5 مل. - تحديد لكل تيمالنقطة ج العاشر معدل الإنتاج من 3 H 2 O في DPM / دقيقة (ب) من خلال تطبيق المعادلة
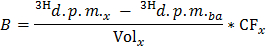
ملاحظة: أين المجلد العاشر (مل) = 0.5 - الفجوة B من قيمة محددة من الوزن الجاف القلب للحصول على معدل تطبيع إنتاج 3 H 2 O (ب نورم) في DPM / دقيقة لكل غرام بالوزن الجاف.
- تطبيق الصيغة OO = B نورم / F اولي للحصول على معدل أكسدة أوليات (OO) في مكرومول من أوليات / دقيقة لكل غرام بالوزن الجاف.
النتائج
ووصف اثنان من التجارب التمثيلية في الأرقام أدناه. في كلتا الحالتين، تم عزل قلب 16 أسبوع من العمر من الذكور سبراغ داولي الفئران وperfused في طريقة العمل مع العازلة KH أعدت وفقا للبروتوكول السابق. في كل تجربة، تعرض القلب لحالة التوتر يؤثر على عمل القلب. تم ت?...
Discussion
تفاصيل البروتوكول السابق الطرق لتحديد وقت واحد تدفق الركيزة عن طريق الأكسدة الجلوكوز وأكسدة الأحماض الدهنية في الفئران المعزولة عمل القلب. ويمكن بعد ذلك القياسات يتم فرضه على المعلمات الوظيفية القلب المسجلة لتحديد العلاقة بين ركائز عملية التمثيل الغذائي وعمل القل...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
This work was supported by National Institutes of Health Grants R00 HL112952 (to R. H.), R01 HL108618 (to J.P.G.), P01 HL051971, and P20 GM104357. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
Materials
| Name | Company | Catalog Number | Comments |
| Sodium Chloride (NaCl) | Fisher Scientific | BP358 | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher Scientific | P284 | |
| Magnesium Sulfate Heptahydrate (MgSO4*7H2O) | Fisher Scientific | M63 | |
| Sodium Bicarbonate (NaHCO3) | Fisher Scientific | S233 | |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C5670 | |
| AG 1-X8 resin, chloride form, 100 - 200 dry mesh size, 500 g | Bio-Rad | 1401441 | This item can be replaced by purchasing directly the hydoxide form (see reference below), but this will cost almost 8 times more |
| AG 1-X8 resin, hydroxide form, 100 - 200 dry mesh size, 100 g | Bio-Rad | 1432445 | Purchasing this item allows to bypass the conversion of the anion exchange resin from the chloride form to the hydroxide form (See section 1.2 of protocol) |
| Glass Microanalysis Vacuum Filter Holder | Fisher Scientific | 09-753-2 | |
| Sodium Hydroxide (NaOH) | Fisher Scientific | S318 | Corrosive. Consult the product MSDS for appropriate handling and storage. |
| Gas Dispersion Tube with Fritted Cylinder | Fisher Scientific | 11-138B | |
| Probumin Bovine Serum Albumin Fatty Acid Free, Powder | EMD Millipore | 820027 | We recommend the use of a charcoal-defatted BSA, as other purification process such as cold ethanol fractionation may leave residues toxic for the heart. |
| Sodium Oleate | Sigma-Aldrich | O7501 | |
| Oleic Acid, [9,10-3H(N)]- | PerkinElmer | NET289005MC | Radioactive material. Follow your Institution's radiation safety office guidelines for ordering and handling. |
| Dialysis Membrane Tubing, 29 mm diameter | Fisher Scientific | 08-667E | |
| D-(+)-Glucose | Sigma-Aldrich | G7021 | |
| Glucose, D-[14C(U)]- | PerkinElmer | NEC042B005MC | Radioactive material. Follow your Institution's radiation safety office guidelines for ordering and handling. |
| Humulin R U-100 | Eli Lilly and Company | NDC 0002-8215-01 (HI-210) | |
| Inactin Hydrate | Sigma-Aldrich | T133 | Controlled substance on USDEA Schedule III |
| 3-0 Silk Black Braid | Roboz Surgical | SUT-15-3 | |
| 10x Hyamine Hydroxide | PerkinElmer | 6003005 | Highly toxic and causes severe burns. Consult the product MSDS for appropriate handling and storage |
| 20 ml Glass Scintillation Vials | Fisher Scientific | 03-341-25E | Use glass vials for quantitative recovery of 14CO2 |
| 20 ml HDPE Scintillation Vials | Fisher Scientific | 03-337-23B | Use HDPE vials for quantitative recovery of 3H2O |
| Red Rubber Sleeve Stoppers | Fisher Scientific | 14-126DD | Fit 20 mL scintillation vials; Reusable |
| BD PrecisionGlide Needle 23G x 40 mm | BD | 305194 | Use to inject perchloric acid through the rubber sleeve stopper of the CO2 trap |
| Perchloric Acid, 60% | Fisher Scientific | A228 | Highly corrosive and may act as an oxidizer and/or cause an explosion hazard. Consult the product MSDS for appropriate handling and storage |
| Ultima Gold, Scintillation Cocktail | PerkinElmer | 6013327 | |
| Glass Wool | Fisher Scientific | AC38606 | |
| Decon Dri-Clean Detergent Powder | Fisher Scientific | 04-355 | For cleaning of glassware, plastic parts, and tubing |
| Alconox Tergazyme Enzyme-Active Powered Detergent | Fisher Scientific | 16-000-115 | For cleaning of "hard to reach" surfaces (tubing, glassware) contaminated by fatty acid-BSA residue |
References
- Neely, J. R., Morgan, H. E. Relationship between carbohydrate and lipid metabolism and the energy balance of heart muscle. Annu Rev Physiol. 36, 413-459 (1974).
- Sen, S., et al. Glucose regulation of load-induced mTOR signaling and ER stress in mammalian heart. J Am Heart Assoc. 2, e004796 (2013).
- Young, M. E., McNulty, P., Taegtmeyer, H. Adaptation and maladaptation of the heart in diabetes: Part II: potential mechanisms. Circulation. 105, 1861-1870 (2002).
- Stanley, W. C., Recchia, F. A., Lopaschuk, G. D. Myocardial substrate metabolism in the normal and failing heart. Physiol Rev. 85, 1093-1129 (2005).
- Fillmore, N., Lopaschuk, G. D. Targeting mitochondrial oxidative metabolism as an approach to treat heart failure. Biochim Biophys Acta. 1833, 857-865 (2013).
- Jaswal, J. S., Keung, W., Wang, W., Ussher, J. R., Lopaschuk, G. D. Targeting fatty acid and carbohydrate oxidation--a novel therapeutic intervention in the ischemic and failing heart. Biochim Biophys Acta. 1813, 1333-1350 (2011).
- Taegtmeyer, H. Cardiac metabolism as a target for the treatment of heart failure. Circulation. 110, 894-896 (2004).
- Taegtmeyer, H., et al. Assessing Cardiac Metabolism: A Scientific Statement From the American Heart Association. Circ Res. , (2016).
- Barr, R. L., Lopaschuk, G. D. Methodology for measuring in vitro/ex vivo cardiac energy metabolism. J Pharmacol Toxicol Methods. 43, 141-152 (2000).
- Neely, J. R., Liebermeister, H., Battersby, E. J., Morgan, H. E. Effect of pressure development on oxygen consumption by isolated rat heart. Am J Physiol. 212, 804-814 (1967).
- Taegtmeyer, H., Hems, R., Krebs, H. A. Utilization of energy-providing substrates in the isolated working rat heart. Biochem J. 186, 701-711 (1980).
- Liao, R., Podesser, B. K., Lim, C. C. The continuing evolution of the Langendorff and ejecting murine heart: new advances in cardiac phenotyping. Am J Physiol Heart Circ Physiol. 303, H156-H167 (2012).
- Cingolani, O. H., Kass, D. A. Pressure-volume relation analysis of mouse ventricular function. Am J Physiol Heart Circ Physiol. 301, H2198-H2206 (2011).
- Pacher, P., Nagayama, T., Mukhopadhyay, P., Batkai, S., Kass, D. A. Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats. Nat Protoc. 3, 1422-1434 (2008).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. J Vis Exp. , (2015).
- Harmancey, R., et al. Insulin resistance improves metabolic and contractile efficiency in stressed rat heart. FASEB J. 26, 3118-3126 (2012).
- Harmancey, R., Vasquez, H. G., Guthrie, P. H., Taegtmeyer, H. Decreased long-chain fatty acid oxidation impairs postischemic recovery of the insulin-resistant rat heart. FASEB J. 27, 3966-3978 (2013).
- Goodwin, G. W., Taylor, C. S., Taegtmeyer, H. Regulation of energy metabolism of the heart during acute increase in heart work. J Biol Chem. 273, 29530-29539 (1998).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiol Rev. 90, 207-258 (2010).
- Neely, J. R., Denton, R. M., England, P. J., Randle, P. J. The effects of increased heart work on the tricarboxylate cycle and its interactions with glycolysis in the perfused rat heart. Biochem J. 128, 147-159 (1972).
- Katz, J., Dunn, A. Glucose-2-t as a tracer for glucose metabolism. Biochemistry. 6, 1-5 (1967).
- Gillis, A. M., Kulisz, E., Mathison, H. J. Cardiac electrophysiological variables in blood-perfused and buffer-perfused, isolated, working rabbit heart. Am J Physiol. 271, H784-H789 (1996).
- Qiu, Y., Hearse, D. J. Comparison of ischemic vulnerability and responsiveness to cardioplegic protection in crystalloid-perfused versus blood-perfused hearts. J Thorac Cardiovasc Surg. 103, 960-968 (1992).
- Cotter, D. G., Schugar, R. C., Crawford, P. A. Ketone body metabolism and cardiovascular disease. Am J Physiol Heart Circ Physiol. 304, H1060-H1076 (2013).
- Huang, Y., Zhou, M., Sun, H., Wang, Y. Branched-chain amino acid metabolism in heart disease: an epiphenomenon or a real culprit?. Cardiovasc Res. 90, 220-223 (2011).
- Buse, M. G., Biggers, J. F., Friderici, K. H., Buse, J. F. Oxidation of branched chain amino acids by isolated hearts and diaphragms of the rat. The effect of fatty acids, glucose, and pyruvate respiration. J Biol Chem. 247, 8085-8096 (1972).
- Liepinsh, E., et al. The heart is better protected against myocardial infarction in the fed state compared to the fasted state. Metabolism. 63, 127-136 (2014).
- Niu, Y. G., Hauton, D., Evans, R. D. Utilization of triacylglycerol-rich lipoproteins by the working rat heart: routes of uptake and metabolic fates. J Physiol. 558, 225-237 (2004).
- Goodwin, G. W., Arteaga, J. R., Taegtmeyer, H. Glycogen turnover in the isolated working rat heart. J Biol Chem. 270, 9234-9240 (1995).
- Sender, P. M., Garlick, P. J. Synthesis rates of protein in the Langendorff-perfused rat heart in the presence and absence of insulin, and in the working heart. Biochem J. 132, 603-608 (1973).
- Hindlycke, M., Jansson, L. Glucose tolerance and pancreatic islet blood flow in rats after intraperitoneal administration of different anesthetic drugs. Ups J Med Sci. 97, 27-35 (1992).
- Zuurbier, C. J., Keijzers, P. J., Koeman, A., Van Wezel, H. B., Hollmann, M. W. Anesthesia's effects on plasma glucose and insulin and cardiac hexokinase at similar hemodynamics and without major surgical stress in fed rats. Anesth Analg. 106, 135-142 (2008).
- Oguchi, T., Kashimoto, S., Yamaguchi, T., Nakamura, T., Kumazawa, T. Is pentobarbital appropriate for basal anesthesia in the working rat heart model?. J Pharmacol Toxicol Methods. 29, 37-43 (1993).
- Segal, J., Schwalb, H., Shmorak, V., Uretzky, G. Effect of anesthesia on cardiac function and response in the perfused rat heart. J Mol Cell Cardiol. 22, 1317-1324 (1990).
- Webster, I., Smith, A., Lochner, A., Huisamen, B. Sanguinarine non- versus re-circulation during isolated heart perfusion--a Jekyll and Hyde effect?. Cardiovasc Drugs Ther. 28, 489-491 (2014).
- Belke, D. D., Larsen, T. S., Lopaschuk, G. D., Severson, D. L. Glucose and fatty acid metabolism in the isolated working mouse heart. Am J Physiol. 277, R1210-R1217 (1999).
- Iannaccone, P. M., Jacob, H. J. Rats! . Dis Model Mech. 2, 206-210 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved