Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İndüklenebilir T7 RNA Polimeraz aracılı Çok Boylu İfade Sistemi, pMGX
Bu Makalede
Özet
Bu çalışma, pMGX plazmid sistemini kullanarak Escherichia coli'de tek bir plasmidden çoklu genlerin T7 aracılı co-ekspresyonu için yöntemleri açıklamaktadır.
Özet
Birden fazla proteinin birlikte ekspresyonu, sentetik biyoloji, protein-protein kompleksleri ve biyosentetik yolların belirlenmesi ve işlenmesi için gittikçe zorunludur. Bu yazıda, indiglenebilir bir T7 RNA polimerazın kontrolü altında multigen sentetik operonların oluşturulması için oldukça etkili bir sistemin kullanımı anlatılmıştır. Bu sistem birçok genin aynı anda bir plazmitten eksprese edilmesini sağlar. Burada, hem ampisilin hem de kanamisin direnci seçilebilir markeri (A ve K) olan ve ya bir N-terminal hekzahistidin'e sahip olan ya da olmayan bir dizi dört ilgili vektör, pMGX-A, pMGX-hisA, pMGX-K ve pMGX-his Etiket (onun) ifşa edilmektedir. Bu vektör sistemi kullanılarak sentetik operonların inşası için ayrıntılı protokoller, beş gen ihtiva eden bir pMGX tabanlı sistemin Escherichia coli'de beş şifrelenmiş proteinin her birinin üretilmesi için kolayca oluşturulabileceğini ve kullanılan olabileceğini gösteren karşılık gelen verilerle birlikte sağlanmaktadır. Bu sistEm ve protokolü, araştırmacıların E. coli'deki karmaşık çok bileşenli modülleri ve yolakları rutin olarak ifade etmelerini sağlar.
Giriş
Birden fazla proteinin birlikte ekspresyonu, özellikle sentetik biyoloji uygulamalarında, birden fazla fonksiyonel modülün ifade edilmesi gerektiği durumlarda giderek önemlidir; Protein-protein kompleksleri üzerinde çalışırken, ekspresyon ve fonksiyonun sık sık birlikte ifade etmesini gerektirir 2 , 3 ; Ve patolojideki her bir genin 4 , 5 , 6 , 7 , 8 olarak ifade edilmesi gereken biyosentetik yolları karakterize etme ve harekete geçirme. Özellikle konakçı organizma Escherichia coli , laboratuvar rekombinant protein ekspresyonu için çalışma atında, birlikte ifade için bir takım sistemler geliştirilmiştir. Örneğin, farklı seçilebilir işaretleyicilere sahip birden fazla plazmid, farklı ex miktarları kullanılarak bireysel proteinleri ifade etmek için kullanılabilir Baskı vektörleri 10 , 11 . Çoklu protein ekspresyonu için tekli plazmid sistemleri, her bir gen 10 , 12'nin ekspresyonunu kontrol etmek için çoklu promotörleri kullandı; Sentetik operanlar, burada birden fazla gen tek bir kopyada kodlanmıştır 2 , 13 ; Veya, bazı durumlarda, nihai olarak proteolitik olarak işlenmiş, ilgilenilen istenen proteinleri üreten bir polipeptidi kodlayan tek bir gen.
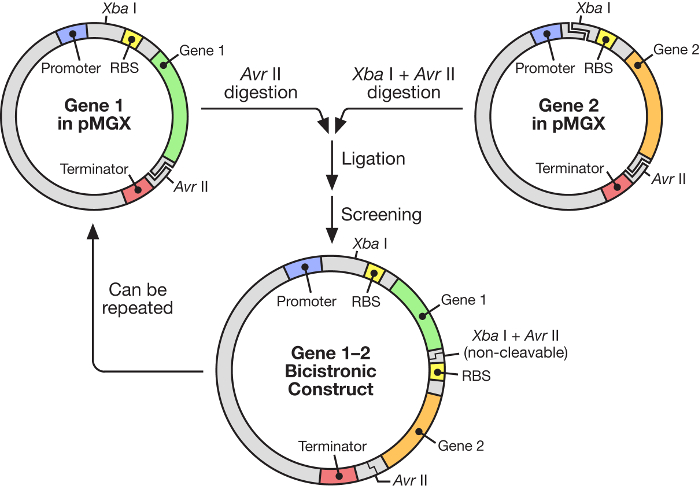
Şekil 1: Bir polisistronik vektörün yapımını gösteren pMGX iş akışı. PMGX sistemi, indüklenebilir bir T7 promoterinin kontrolü altındaki sentetik operonların oluşturulması için esnek ve kullanımı kolay bir strateji sağlar.E-posta: e.com/files/ftp_upload/55187/55187fig1large.jpg "target =" _ blank "> Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Bu yazıda, indiglenebilir bir T7 RNA polimeraz ( Şekil 1 ) kontrolü altında multijene sentetik operonların inşası için oldukça etkili bir sistemin kullanımı açıklanmaktadır. Bu sistem birçok genin aynı anda bir plazmitten eksprese edilmesini sağlar. Başlangıçta pKH22 olarak adlandırılan, 6 , 7 , 8 numaralı farklı uygulamalar için başarıyla kullanılan bir plazmid sistemini temel alır. Burada, bu plazmid seti, dört ilgili vektörü içerecek şekilde genişletilir: pMGX-A, herhangi bir C veya N-terminal etiketi içermeyen bir ifade vektörü ve ampisilin direnci markörü; PMGX-hisA, bir N-terminal hekzahistidin etiketini kodlayan bir ifade vektörü ve ampisilin direnci markörü; PMGX-K, bir ifade vektörüC veya N-terminal etiketlerini ve kanamisin direnç işaretleyicisini ölçmek; Ve bir N-terminal hekzahistidin etiketini kodlayan bir ifade vektörü ve kanamisin dirençli markör olan pMGX-hisK. Bu çalışmada, pMGX sistemi, özellikle pMGX-A kullanılarak beş gen ihtiva eden bir polisistronik vektör üretme yöntemi, her bir proteinin Escherichia coli'de başarılı bir şekilde üretilmesi ile birlikte gösterilmiştir.
Protokol
1. İlgi Genleri Almak
- Sentetik genleri tasarla.
- E. coli ekspresyonu için bir gen dizilimi optimize edin.
- Seksten herhangi bir problemli kısıtlama yerini (AvrII, NdeI, EcoRI ve XbaI) çıkarın.
- Klonlama için kısıtlama alanlarını ekleyin; Bir 5'-NdeI bölgesi ve bir 3'-EcoRI bölgesi önerilmektedir. Gerekirse başka siteler de kullanılabilir; Seçilen plazmitin çoklu klonlama bölgesine ( Şekil S1- S4 ) bakın. İsterseniz, Western blot algılaması için 5 'veya 3' kodlama etiketi ekleyin.
- Tasarlanan geni ticari olarak sipariş edin.
- Ya üreticinin talimatlarına göre geni kör bir klonlama kiti kullanarak künt bir vektöre köreltin; Geni yükseltmek için primerleri tasarımlayın (ardından Adım 1.2.2'ye geçin); Veya bir pMGX plazmidine direkt klonlama için ek 5 've 3' uçları ekleyin ve Adım 2'ye geçin.Temsilci sonuçlar ilgi genlerini kör bir klonlamaya dayanır.
- İstenilen geni (tasarımlanmış ve optimize edilmiş sentetik gen veya istenen geni içeren şablon DNA'dan) amplifiye edin 15 .
- Klonlama için kısıtlama alanları olan tasarım primerleri; Bir 5'-NdeI bölgesi ve bir 3'-EcoRI bölgesi önerilmektedir. Gerekirse başka siteler de kullanılabilir; Seçilen plazmitin çoklu klonlama bölgesine ( Şekil S1- S4 ) bakın. İsterseniz, Western blot algılaması için 5 'veya 3' kodlama etiketi ekleyin.
- PCR istenen geni çoğaltın 15 .
- PCR'ı agaroz jel elektroforezi ile analiz edin 16 .
- Belirgin olmayan bir amplifikasyon varsa, genleştirilen geni jel özütleme ile temizleyin. Değilse, bir enzim temizleme kiti kullanın.
- Bir spektrofotometre kullanarak DNA'yı absorbanc'ı kontrol ederek ölçünE 260 nm'de; Elüsyon tamponlu boş 17 .
2. İlgi Genleri Bir Multigen Ekspresyon Sistemi Vektörüne Klonlama, pMGX 18
- Kısıtlama, elde edilen geni ve istenen vektör olan pMGX'yi NdeI ve EcoRI ile sindirir.
NOT: Çok miktarda tekrar sirkülale edilmiş plazmid elde edilirse, EcoRI eklemeden önce NdeI reaksiyonunun 1 saat devam etmesine izin verin.- 0.5-1.5 μg DNA ve uygun olan 10x tamponun 4 μL'si ile her bir enzimden 1 uL içeren 40 uL'lik bir sindirim reaksiyonu kullanın.
- NdeI ve EcoRI sindirimi için EcoRI tamponu kullanın ve önce NdeI endonükleaz ekleyin. 37 ° C'de 1 saat boyunca özümleyin. Ardından EcoRI endonükleaz ekleyin ve sindirimin bir saat daha ilerlemesine izin verin. NdeI, DNA'nın sonuna yakın bölünmelere duyarlıdır, bu yüzden EcoRI'nin ilk sindirimi NdeI'nin etkili sindirimini önleyebilir.
- ElektrOphorese agaroz jel üzerindeki kısıtlama sindirimini (1 kb'lik bir gen için, 55 dakika için 110 V'da% 0,7 agaroz jel kullanın; farklı gen boyutları için agaroz jel yüzdesini seçmek için, referans 16'ya bakın.
- Temiz bir neşter veya bıçak bıçağı kullanarak ek parça ve vektör bantları tüketim yapın ve kesilen jel segmanını 1.5 mL tüp içine yerleştirin.
- Üreticinin protokolüne göre bir jel özütleme kiti kullanarak DNA'yı agaroz jelden ayıklayın.
- İlgili geni pMGX vektörüne, 3: 1 insert-vektör oranı kullanarak ligate edin; Eklemesiz sindirilmiş pMGX negatif bir ligasyon ayarlayın.
- 1 μL T4 DNA ligaz, 0.15-0.5 μg vektör DNA'sı (~ 5 μL) ve insertin uygun bir miktarda 3: 1 insert-to-vektör oranına ve boyutuna dayalı 20 μL ligasyon reaksiyonu oluşturun Gen eklenir; PMGX omurgaları boyutu 5,312 ile 5,504 bp arasındadır. Her şeyi içeren olumsuz bir kontrol reaksiyonu ekleyin.Gen eklendi. Vektör DNA miktarının negatif kontrol ligasyonunda ve vektör artı ligasyon reaksiyonlarında eşdeğer olduğundan emin olun.
- Ligasyon reaksiyonlarını, XL1-Blue kimyasal olarak yetkili E. coli hücrelerine ve ligandlı plazmidler pMGX- yfg1 (ilgi geni içeren), pMGX- yfg2 (ilgi geni içeren) ... pMGX- yfgn (ilgilenilen geni içeren n). Aseptik tekniği kullanın (biyogüvenlik kabininde veya alev altında).
- 5 dakika boyunca buz üzerinde kimyasal olarak yetkili XL1-Blue E. coli 100 mcL alikotları çözülmüş ve sonra ligasyon reaksiyonları 5 mcL ekleyin. Buz üzerinde 30 dakika inkübe edin.
- 42 ° C'de tutulan su banyosunda 45 saniye boyunca hücrelere ısı ile çarpın ve daha sonra 200 μL soğuk LB ekleyin. 2 dk buzda inkübe edin.
- Hücreleri 1 saat boyunca 37 ° C, 220 rpm'de çalkalayın ve daha sonra bir plakayı içeren bir LB-agar plakasına 100 ulPriate seçilebilir markeri (ya ampisilin ya da kanamisin).
- Pozitif transformantlar için klonları tarayın.
- Negatif kontrol ve ligasyon plakaları üzerindeki koloni sayılarını karşılaştırın. 1: 2'den büyük bir koloni sayımı aralığı istenir. Negatif kontrol plakasında çok sayıda koloni varsa, Adım 2.1'e dönün ve notu gözden geçirin.
- Tarama için eklenen farklı genlerin (1 n) her ligasyon tepkimesinden 4-8 bireysel koloni (negatif kontrol bağlı olarak: ligasyon oranı) seçin ve 4 mL LB ve uygun antibiyotik gece kültür / bireysel koloni inoküle edin. Gece boyunca 37 ° C'de ve 220 rpm'de sallayarak kültürleri büyütün.
- Üreticinin protokolüne göre bir plazmid DNA izolasyon kiti kullanarak plazmid DNA'yı izole edin.
- 150-500 ng DNA ve her bir enzimden 1 uL uygun 10x tampon ile 2 μL içeren 20 uL NdeI + EcoRI sindirim reaksiyonu oluşturun. InciDurumda, ilgili genin sınırlama siteleri arasında olması için NdeI ve EcoRI'yi ekleyin. Boş pMGX vektörü ile negatif bir kontrol önerilir. 37 ° C'de 2 saat su banyosunda sindirin.
3. Gen 2'yi Gen 1 içeren pMGX Vektörüne Ekleme , pMGX- yfg1
- Restriksiyon, pMGX-yfg1'i AvrII ile sindirecek ve buzağı bağırsak fosfatazı (CIP) ile muamele edecektir .
- 0.5-1.5 μg vektör DNA'sını (izole edilmiş DNA ~ 5-10 uL) ve uygun 10x tampon maddenin 4 uL'si ile 1 μL AvrII içeren bir 40 μL sindirim reaksiyonu kullanın. 37 ° C'de 1.5 saat sindirin ve sonra 1.5 μL CIP ekleyin. 30 dakika daha 37 ° C'de bırakın.
- İlgili geni serbest bırakmak için AvrII ve Xbal ile kısıtlama pMGX-yfg2 sindirin .
- 0.5-1.5 μg DNA ve 1 μ içeren bir 40 μL sindirim reaksiyonu kullanın; Her bir enzimin L'si, uygun 10x tamponun 4 uL'si ile. 37 ° C'de 2 saat boyunca özümleyin.
- Uygun bir yüzde (% 0.7) agaroz jeli üzerinde elektroforez kısıtlaması sindirilir ve temiz bir neşter / bıçak bıçağı kullanarak ekleme ve vektör bantlarını çıkarır (bkz. Adımlar 2.2-2.3).
- Üreticinin protokolüne göre bir jel özütleme kiti kullanarak DNA'yı ayıklayın ve DNA 17'yi ölçün.
- 3: 1 insert-vektör oranı kullanarak gen 2'yi pMGX- yfgl'e ligate edin . Sindirilmiş pMGX- yfg1'in negatif bir bağlanmasını ilave ek olmadan yapın. Yukarıdaki gibi Adım 2.5'te ayarlayın.
- Bağlama reaksiyonlarının 5 μL'sini XL1-Blue kimyasal olarak yetkili E. coli hücrelerine, ligandlı plazmidler pMGX- yfg1,2'ye (ilgilenilen geni içeren 1 ve 2 geni) ve negatif pMGX- yfg1 kontrolüne, Adım 2.6'da görüldüğü gibi çevirin .
- Negatif kontrol ve ligasyon plakaları üzerindeki koloni sayısını karşılaştırın. Bir koloni sayı oranı gReaktan 1: 2'den daha arzu edilir. Negatif kontrol plakasında çok sayıda koloni varsa, Adım 3.1'e dönün ve CIP tedavisini gözden geçirin.
- Ligasyon reaksiyonundan 4-8 bireysel koloniyi (negatif kontrol: bağlanma oranına bağlı olarak) seçin ve bireysel koloni başına 4 mL LB artı uygun antibiyotik aşılayın ve gece boyunca 37 ° C ve 220 rpm'de büyütün.
- Üreticinin protokolüne göre bir plazmid DNA izolasyon kiti kullanarak plazmid DNA'yı izole edin ve DNA 17'yi ölçün.
- EcoRI ile pMGX- yfg1,2'nin bir kısıtlama sindirimini uygulayarak ikinci genin etkili bir şekilde eklenmesini ekranlayın .
- 150-500 ng DNA ve 1 μL EcoRI enzim içeren 2 uL EcoRI 10x tampon içeren 20 uL sindirim reaksiyonu kullanın. 37 ° C'de 2 saat boyunca özümleyin.
- Uygun bir yüzde agaroz jel üzerinde elektronforasyon kısıtlama sindirimi; Karşılık gelen bir grup arayınS gen 2 boyutuna (bkz. Adım 2.2). Bir gen vektör içine istenmeyen ters yönde yerleştirilebilir.
4. Genler 1 ve 2'yi içeren pMGX Vektörüne Üçüncü Bir Genin Eklenmesi, pMGX- yfg1,2
- Restriksiyon sindirimi pMGX- yfg1,2 , AvrII ile gerçekleştirin ve Adım 3.1'de görüldüğü gibi CIP ile işleme sokun .
- Adım 3.2'de görüldüğü gibi AvrII ve XbaI ile kısıtlama sindirimi pMGX- yfg3 .
- Elektroforez, uygun bir yüzde agaroz jelinde kısıtlama sindirerek temiz bir neşter / bıçak bıçağı kullanarak ekleme ve vektör bantları tüketmek; Adımlar 2.2-2.3'e bakın.
- Jel özütleme kiti kullanarak DNA'yı agaroz jelden ayıklayın ve DNA'yı nicelleştirin 17 .
- 3: 1 insert-vektör oranı kullanılarak gen 3'ü pMGX-yfgl.2'ye bağlayın ve Adım 3.5'te görüldüğü gibi ilave bir ekleme olmadan sindirilmiş pMGX- yfg1,2'nin negatif bir ligasyonu oluşturun.
- Ligasyon reaksiyonlarının 5 μL'sini XL'ye çevirinAdım 2.6'da görüldüğü gibi, 1-Mavi kimyasal olarak yetkili E. coli hücreleri, ligand plasmid pMGX- yfg1,2,3 (1, 2 ve 3 ilgi genleri içerir) ve negatif pMGX- yfg1,2 kontrolü.
- Negatif kontrol ve ligasyon plakaları üzerindeki koloni sayısını karşılaştırın. Negatif kontrol plakasında çok sayıda koloni varsa, Adım 4.1'e dönün ve CIP tedavisini gözden geçirin.
- Ligasyon reaksiyonundan 4-8 bireysel koloni seçin (negatif kontrol: bağlanma oranına bağlı olarak) ve her koloni için uygun antibiyotik artı 4 mL LB'yi inoküle edin; Gece boyunca 37 ° C'de ve 220 rpm'de büyür.
- Üreticinin protokolüne göre bir plazmid DNA izolasyon kiti kullanarak plazmid DNA'yı izole edin.
- Adım 3.10'da görüldüğü gibi EcoRI ile pMGX- yfg1,2,3'ün bir kısıtlama sindirimini uygulayarak üçüncü genin etkin şekilde eklenmesini ekranlayın .
- Uygun bir yüzde agaroz jel üzerinde elektronforasyon kısıtlama sindirimi; bakGen 2 ve gen 3 boyutlarına karşılık gelen bantlar için (bkz. Adım 2.2). Not: gen 3 vektör içine istenmeyen, ters yönde yerleştirilebilir. Genler 2 ve 3 aynı büyüklükte ise, tarama için başka bir uygun kısıtlama sindirim bölgesi seçilmelidir.
NOT: Her bir yeni gen için gerektiği gibi tekrarlayın.
5. Çok Boyutlu Bir İfade Sistemi Kullanarak Proteinlerin Üretilmesi ve Üretimin Batı Lekeleme ile Değerlendirilmesi
- İlgili tüm genleri içeren pozitif klon, kimyasal olarak yetkin, protein üreten E. coli'ye , örneğin BL21- (λDE3) dönüştürülür.
- 5 dakika süreyle kimyasal olarak yetkili BL21- (λDE3) E. coli'nin 100 uL'lik kısımlarını çözündükten sonra pozitif klonlanmış plazmid DNA'sının 1 uL'ini ekleyin; Buz üzerinde 30 dakika inkübe edin.
- Isı hücrelerini, 42 ° C'de tutulan bir su banyosu içinde 45 s boyunca şoklayın ve daha sonra 200 μL soğuk LB'yi ekleyin. Buz üzerinde 2 dakika inkübe edin.
- Hücreleri 37 ° C'de ve 220 rpm'de 1 saat boyunca çalkalayın ve daha sonra uygun seçilebilir işaretleyiciyi (ya ampisilin ya da kanamisin) içeren bir LB agar plakasına 100 ul plakaya yayın.
- Proteini, izopropil-β-D-l-tiogalaktopiranosid (IPTG) indüksiyonu ile ifade edin.
- B21- (λDE3) transformasyon plakasından izole edilmiş bir koloni seçin ve 4 mL LB ve uygun antibiyotiği inoküle edin; Gece boyunca büyür, 37 ° C'de ve 220 rpm'de çalkalama.
- 100 mL'lik bir LB'yi ve 1 mL'lik gece kültürü kullanılarak uygun antibiyotik kültürü inoküle edin.
- 37 ° C'de büyütün ve 220 rpm'de çalkalayarak OD 600'ü 0.6'ya getirin.
- Kültürü 100 uM IPTG ile indükleyin ve 25 ° C'de ve 220 rpm'de 15 saat büyütün.
- Kültür 1 ml çıkarın ve 1 dakika için 13.000 xg de santrifüj; Süpernatanı atın.
- Üreticinin talimatlarına göre lizis çözeltisini kullanarak hücreleri LyseVe tüm proteinlerin başarılı bir şekilde üretilip üretilmediğini belirlemek için çözünebilir hücre lizatı için bir Western leke hazırlayın 19 .
Sonuçlar
Bu çalışmada, amaç, tek bir plazmitten beş proteinin birlikte ekspresyonu yapmaktı. N-veya C-terminalli hekzahistidin etiketlerini kodlayan beş kodon optimize edilmiş sentetik gen fragmanları ticari olarak satın alınmıştır. Sentetik genler PCR ile amplifiye edildi ve ayrı ayrı bir PCR-künt vektör içine klonlandı ve sekanslandı. Polisistronik plasmid üretmek için, ilgilenilen beş gen uygun bir pMGX plazmidi, pMGX-A'ya klonlandı. Şekil 2
Tartışmalar
Birden fazla genin ortak ekspresyonu, özellikle karmaşık, multigenik metabolik yolları karakterize etme ve yeniden yapılandırmada 3 , 4 , 5 için giderek daha fazla önemlidir. PMGX sistemi E. coli rutininde 6 , 7 , 8 randevularında multijen ortak ekspresyonu yapar ve çeşitli araştırmacılar tarafından erişilebili...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma Kanada Doğa Bilimleri ve Mühendislik Araştırma Konseyi tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Enzymes | |||
| Alkaline Phosphatase, Calf Intestinal (CIP) | New England Biolabs | M0290S | |
| AvrII | New England Biolabs | R0174S | |
| EcoRI | New England Biolabs | R0101S | |
| NdeI | New England Biolabs | R0111S | |
| XbaI | New England Biolabs | R0145S | |
| Herculase II Fusion DNA Polymerase | Agilent Technologies | 600677 | |
| T4 DNA Ligase | New England Biolabs | M0202S | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 1 kb DNA ladder | New England Biolabs | N3232L | |
| 4-20% Mini-PROTEAN TGX Stain-Free Protein Gels | Bio-Rad | 456-8095 | |
| 50x TAE | Fisher Thermo Scientific | BP1332-4 | |
| Agar | Fisher Thermo Scientific | BP1423-500 | |
| Agarose | Fisher Thermo Scientific | BP160-500 | |
| Ampicilin | Sigma-Alrich | A9518-5G | |
| BL21 (DE3) chemically comeptent cells | Comeptent cell prepared in house | ||
| B-PER Bacterial Protein Extraction Reagent | Fisher Thermo Scientific | PI78243 | |
| dNTP mix | Agilent Technologies | Supplied with polymerase | |
| Gel Extraction Kit | Omega | D2500-02 | E.Z.N.A Gel Extraction, supplied by VWR Cat 3: CA101318-972 |
| Glycine | Fisher Thermo Scientific | BP381-1 | |
| His Tag Antibody [HRP], mAb, Mouse | GenScript | A00612 | |
| Immobilon Western Chemiluminescent HRP Substrate | EMD Millipore | WBKLS0100 | |
| IPTG | Sigma-Alrich | 15502-10G | |
| LB | Fisher Thermo Scientific | BP1426-500 | |
| Methanol | Fisher Thermo Scientific | A411-20 | |
| Pasteurized instant skim milk powder | Local grocery store | No-name grocery store milk is adequate | |
| Nitrocellulose membrane | Amersham Protran (GE Healthcare Life Sciences) | 10600007 | Membrane PT 0.45 µm 200 mm x 4 m, supplied by VWR Cat #: CA10061-086 |
| Plasmid DNA Isolation Kit | Omega | D6943-02 | E.Z.N.A Plasmid DNA MiniKit I, supplied by VWR Cat #: CA101318-898 |
| pMGX | Boddy Lab | Request from the Boddy Lab Contact cboddy@uottawa.ca | |
| Primers | Intergrated DNA Technologies | Design primers as needed for desired gene | |
| Synthetic Gene | Life Technologies | Design and optimize as needed | |
| Thick Blot Filter Paper | Bio-Rad | 1703932 | |
| Tris base | BioShop | TRS001.1 | |
| Tween-20 | Sigma-Alrich | P9416-50ML | |
| XL1-Blue chemically competent cells | Comeptent cell prepared in house | ||
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| BioSpectrometer | Eppendorf | RK-83600-07 | |
| Gel box - PAGE | Bio-Rad | 1658005 | Mini-PROTEIN Tetra Vertical Electrophoresis Cell |
| Gel Imager | Alpha Innotech | AlphaImager EC | |
| Incubator-oven | Fisher Thermo Scientific | 11-690-650D | Isotemp |
| Incubator-shaker | Fisher Thermo Scientific | SHKE6000-7 | MaxQ 6000 |
| Personna Razors | Fisher Thermo Scientific | S04615 | |
| Power Pack | Bio-Rad | S65533Q | FB300 |
| Transilluminator | VWR International | M-10E,6W | |
| Thermocylcer | Eppendorf | Z316091 | Mastercycler Personal, supplied by Sigma |
| UV Face-Shield | 18-999-4542 | ||
| Waterbath | Fisher Thermo Scientific | 15-460-2SQ | |
| Western Transfer Apparatus | Bio-Rad | 1703935 | Mini-Trans Blot Cell |
Referanslar
- Purnick, P. E. M., Weiss, R. The second wave of synthetic biology: from modules to systems. Nat. Rev. Mol. Cell Biol. 10 (6), 410-422 (2009).
- Bieniossek, C., et al. Automated unrestricted multigene recombineering for multiprotein complex production. Nat. Methods. 6 (6), 447-450 (2009).
- Jochimsen, B., et al. Five phosphonate operon gene products as components of a multi-subunit complex of the carbon-phosphorus lyase pathway. Proc. Natl. Acad. Sci. USA. 108 (28), 11393-11398 (2011).
- Martin, V. J. J., Pitera, D. J., Withers, S. T., Newman, J. D., Keasling, J. D. Engineering a mevalonate pathway in Escherichia coli for production of terpenoids. Nat. Biotechnol. 21 (7), 796-802 (2003).
- Ajikumar, P. K., et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science. 330 (6000), 70-74 (2010).
- Boddy, C. N., Hotta, K., Tse, M. L., Watts, R. E., Khosla, C. Precursor-directed biosynthesis of epothilone in Escherichia coli. J. Am. Chem. Soc. 126 (24), 7436-7437 (2004).
- Lundgren, B. R., Boddy, C. N. Sialic acid and N-acyl sialic acid analog production by fermentation of metabolically and genetically engineered Escherichia coli. Org. Biomol. Chem. 5 (12), 1903-1909 (2007).
- Horsman, M. E., Lundgren, B. R., Boddy, C. N. N-Acetylneuraminic Acid Production in Escherichia coli Lacking N-Acetylglucosamine Catabolic Machinery. Chem. Eng. Commun. 203 (10), 1326-1335 (2016).
- Romier, C., et al. Co-expression of protein complexes in prokaryotic and eukaryotic hosts: experimental procedures, database tracking and case studies. Acta Crystallogr. D, Biol. Crystallogr. 62 (Pt 10), 1232-1242 (2006).
- Tolia, N. H., Joshua-Tor, L. Strategies for protein coexpression in Escherichia coli. Nat. Methods. 3 (1), 55-64 (2006).
- Chanda, P. K., Edris, W. A., Kennedy, J. D. A set of ligation-independent expression vectors for co-expression of proteins in Escherichia coli. Protein Expr. Purif. 47 (1), 217-224 (2006).
- Kim, K. -. J., et al. Two-promoter vector is highly efficient for overproduction of protein complexes. Protein Sci. 13 (6), 1698-1703 (2004).
- Tan, S., Kern, R. C., Selleck, W. The pST44 polycistronic expression system for producing protein complexes in Escherichia coli. Protein Expr. Purif. 40 (2), 385-395 (2005).
- Chen, X., Pham, E., Truong, K. TEV protease-facilitated stoichiometric delivery of multiple genes using a single expression vector. Protein Sci. 19 (12), 2379-2388 (2010).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J. Vis. Exp. (63), e3998 (2012).
- Lee, P. Y., Costumbrado, J., Hsu, C. -. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J. Vis. Exp. (62), (2012).
- Sukumaran, S. Concentration determination of nucleic acids and proteins using the micro-volume BioSpec-nano-spectrophotometer. J. Vis. Exp. (48), (2011).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Molecular Cloning. J. Vis. Exp Available from: https://www.jove.com/science-education/5074/molecular-cloning (2016)
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The Western Blot. J. Vis. Exp Available from: https://www.jove.com/science-education/5065/the-western-blot (2016)
- Laible, M., Boonrod, K. Homemade site directed mutagenesis of whole plasmids. J. Vis. Exp. (27), (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır