Method Article
Péptidos de penetración celular biotinilado para estudiar interacciones de proteínas intracelulares
En este artículo
Resumen
Se trata de un protocolo para el estudio de las interacciones proteína-proteína intracelular basadas en el sistema de pull-down de biotina-avidina con la novedad de combinar secuencias de penetrar en la célula. La principal ventaja es que la secuencia de destino se incuba con las células vivas en lugar de lysates de la célula y por lo tanto las interacciones ocurrirán dentro del contexto celular.
Resumen
Aquí presentamos un protocolo de estudio de las interacciones proteína-proteína intracelular que se basa en el ampliamente utilizado biotina-avidina desplegable sistema. La modificación presentada incluye la combinación de esta técnica con secuencias de penetrar en la célula. Proponemos diseñar cebos penetración celular que pueden incubarse con células vivas en lugar de lysates de la célula y por lo tanto los que ocurren en el contexto intracelular reflejará las interacciones encontradas. Connexin43 (Cx43), una proteína que forma canales de ensambladura de gap y hemichannels es regula en gliomas de alto grado. La región de Cx43 compuesto por aminoácidos 266-283 es responsable de la inhibición de la actividad oncogénica del c-Src en células de glioma. Aquí utilizamos TAT como la secuencia de penetración celular, biotina como la etiqueta desplegable y la región de Cx43 entre aminoácidos 266-283 como el objetivo de encontrar interacciones intracelulares en las células de glioma humano difícil de transfectar. Una de las limitaciones del método propuesto es que la molécula utilizada como cebo podría dejar de doblar correctamente y, en consecuencia, las interacciones encontradas no podrían ser asociadas con el efecto. Sin embargo, este método puede ser especialmente interesante para las interacciones involucradas en vías de transducción de señal porque generalmente se realizan por regiones intrínsecamente desordenadas y, por lo tanto, no necesitan un plegamiento ordenado. Además, una de las ventajas del método propuesto es que la relevancia de cada residuo de la interacción puede ser estudiada fácilmente. Este es un sistema modular; por lo tanto, pueden emplearse otras secuencias de penetración celular, otras etiquetas y otros objetivos intracelulares. Finalmente, el alcance de este protocolo es mucho más allá de la interacción de proteínas porque este sistema puede aplicarse a otras cargas bioactivas tales como secuencias de RNA, nanopartículas, virus o cualquier molécula que puede ser transduced secuencias de penetrar en la célula y fundido a las etiquetas desplegables para estudiar su mecanismo intracelular de acción.
Introducción
Las interacciones proteína-proteína son esenciales para una gran variedad de procesos celulares. Para comprender estos procesos, se requieren métodos para la identificación de las interacciones de proteínas en el complejo entorno intracelular. Uno de los métodos más utilizados para identificar a socios de la interacción de una proteína es utilizar esa proteína o un péptido mimético de una parte de esa proteína como cebo en los experimentos de desplegable de afinidad seguidos de detección de proteínas. El sistema avidina-biotina se utiliza con frecuencia debido a la alta afinidad, especificidad e interacción estable entre avidina y la biotina de1,2. Generalmente, la biotina es covalentemente al cebo (proteína o péptido) y después de un período de incubación con los lysates de la célula para permitir el establecimiento de interacciones, el cebo biotinilado a sus socios intracelulares es derribado con avidina o avidina derivados conjugan con granos de apoyo. Entonces, se detectan las interacciones proteína cebo después de lavado y elución análisis desnaturalizando electroforesis seguida de Western blot. Uno de los problemas de esta técnica es que las interacciones entre la proteína de interés y sus socios intracelulares tienen lugar fuera del contexto celular. Esto es especialmente importante para las interacciones involucradas en vías de transducción de señal porque ocurren en lugares específicos intracelulares, son transitorios y típicamente son realizadas por proteínas no abundantes. Por lo tanto, dentro de los lysates de la célula estas interacciones se pueden enmascarar por otros más abundantes proteínas o por proteínas que generalmente no están en las inmediaciones.
Péptidos de penetración celular (CPPs) son péptidos cortos (≤ 40 aminoácidos), compuestas en su mayor parte por aminoácidos catiónicos que son capaces de transportar una amplia gama de moléculas en casi cualquier celular3. Cargas tales como proteínas, DNA plasmídico, siRNA, virus, agentes de imagen y diferentes nanopartículas han sido conjugadas a CPPs y eficientemente internalizada4,5. Debido a esta capacidad de transporte son también conocidos como dominios proteína de transducción de señales (PTDs), membrana translocan secuencias (MTSs) y péptidos troyanos. Entre la CPPs, el TAT péptido de la proteína del transactivator de VIH TAT6 ha sido uno de los más ampliamente estudiados 7,8,9. TAT es un nonapéptido que contiene 2 residuos de lisina y arginina 6 y por lo tanto es altamente catiónico. Sustitución de estudios ha demostrado que la carga positiva neta de TAT es necesaria por interacciones electrostáticas con las membranas del plasma de las células eucariotas y su posterior interiorización10. Semejantemente a otros CPPs, TAT cargado positivamente fuertemente se une electrostáticamente a las varias cargado negativamente especies presentes en la superficie extracelular de las membranas celulares, incluyendo los grupos cabeza del lípido, glicoproteínas y proteoglicanos3 , 10. la bioactivos de cargas transportadas por TAT ser inmediatamente libres en el citosol para llegar a sus socios intracelulares.
Aquí presentamos un método que combina el CPP TAT con biotina para el estudio de las interacciones intracelulares. El objetivo es diseñar cebos de penetrar en la célula mediante la fusión de la biomolécula blanco al TAT y a la biotina. La principal ventaja de esta propuesta es que las interacciones entre el cebo y sus socios llevará a cabo dentro de su contexto celular. Para demostrar la eficacia de este método que utiliza como cebo una pequeña secuencia de la proteína Cx43 que se ha reportado interacción intracelular con el proto-oncogene c-Src11,12,13. Cx43 es una proteína integral de membrana que se expresa ampliamente en astrocitos14regula en gliomas de alto grado, el tumor maligno más común del sistema nervioso central15,16,17 ,18. Ha sido demostrado previamente que la región de Cx43 que interactúa con el c-Src (aminoácidos 266-283 de Cx43 humana; PubMed: P17302) fundido a TAT (TAT-Cx43266-283) inhibe la actividad oncogénica del c-Srcin las células de glioma y células de glioma madre (GSCs)19,20,21. Para diseñar el cebo intracelular, Cx43266-283 ha fundido a TAT en el N-terminal (TAT-Cx43266-283) y a la biotina en la terminal C (TAT-Cx43266-283- B). Esta estrategia se ha utilizado con éxito en el glioma de rata C6 línea de celular para identificar c-Src, c-terminal Quinasa Src (CSK) y fosfatasa y tensina (PTEN) de homólogo como intracelulares asociados de esta región de Cx4320. Aquí, describimos este método probar su eficacia en humanos GSCs, que son muy relevantes para el tratamiento de glioma, pero mucho más difícil transfectar que las células de glioma de tallo no.
Protocolo
Todos los procedimientos experimentales se llevaron a cabo en la Universidad de Salamanca.
1. las células
- Dos días antes de comenzar el procedimiento, la placa de las células a la densidad requerida a ser confluentes el día del experimento. La placa de las células en placas o frascos. Sin embargo, la extracción de proteína será más fácil de las placas. Es conveniente preparar por lo menos 4 placas de 78 cm2 o 2 frascos de 150 cm2 por condición por experimento, para asegurarse que los resultados sean coherentes.
- En este estudio, placa humana G166 GSCs en 4 frascos de 150 cm2, cultivados en células de RHB-A suplementado con 2% B27, 1% N2, 20 ng/mL EGF y b-FGF descrito por Pollard et al.22. Proceso cuando se alcanza la confluencia. Por ejemplo, cuando las células 5 x 106 G166 fueron plateadas en un matraz de 150 cm2 , se procesaron 2 días después de la galjanoplastia.
2. biotinilado CPPs
- Gira los frascos que contienen el liofilizado biotinilado CPPs (BCPPs) en 8200 x g durante 30 s, para evitar algunos del polvo restante en la tapa. Incluir un control BCPP para asegurarse de que las interacciones encontradas son específicas de la secuencia de destino. En este estudio, el control BCPP era TAT-biotina (TAT-B) y el tratamiento BCPP era TAT Cx43266-283- B. Podrían utilizarse otros controles, tales como TAT fragmentos fusionados para revueltos o mutados bond a la biotina.
- Disolver el BCPPs en el medio de cultivo correspondiente a la solución indicada por el fabricante; por ejemplo, para obtener una solución de 2 mg/mL BCPP para tratar GSCs Añadir 0,5 mL de medio de cultivo de GSC a un vial que contiene 1 mg de lo BCPP. Vórtice y asegúrese de que el péptido se disuelve bien.
3. tubos
Nota: Prepare por lo menos doce tubos de 1.5 mL por condición necesaria en la sección 7.
- Marque los primeros 3 tubos por condición. Tengan el volumen total de Lisados celulares obtenidos en el paso 6.4.
- Marque en 3 tubos por condición. Estos tubos tienen el primer sobrenadantes obtenidos tras paso de lisis y girando los lisados celulares, 7.2.
- La marca B en 3 tubos por condición. Estos tubos tendrá una pequeña alícuota de sobrenadante de la primera. Estos lisados servirá como las muestras de Western blot en paso 7.3.
- La marca C en 3 tubos por condición. Estos tubos tienen los sobrenadantes obtenidos tras el desplegable con NeutrAvidin, paso 7.7.
Nota: Esto es importante en caso de que el Western blot no mostraron ninguna señal de proteínas, lo que significa las proteínas no fueron tiradas o se perdieron en algún paso del procedimiento. Si esto fuera la situación, repita el proceso para bajar las proteínas.
4. celular tratamiento con las BCPPs
- Aspire el medio de cultivo.
- Vuelva a colocar el correspondiente volumen de medio fresco necesaria para incubar las BCPPs en el menor volumen posible de medio según los tiempos de incubación. Es muy importante que en cualquier caso, el medio cubre completamente toda la superficie de la placa/frasco para que las células no se resequen, por ejemplo, 6 mL por 150 cm2 para una incubación de 30 min.
- Añadir el volumen de la solución madre de BCPP a las culturas de célula para llegar a la concentración que ha demostrado para ser eficaz. En este estudio 50 μm TAT Cx43266-283- B ha demostrado para reducir la proliferación de GSC.
- Por lo tanto, añadir 92,8 μl de 2 mg/mL de Cx43 TAT266-283- B (MW = 3723.34 g/mol) por mL de medio de cultivo para obtener una concentración final de 50 μm TAT Cx43266-283- B. Si el volumen a añadir es diferente de péptidos de control, con medio de cultivo hasta el mismo volumen final. Por ejemplo, 49,1 μl TAT-B (MW = 1914.31 g/mol) más 43,7 μl de medio de GSC se agregaron por mL de medio de cultivo para obtener una concentración final de 50 μm TAT-B.
- Colocar las células en la incubadora a 37 ° C y 5% de CO2 durante 30 minutos para asegurarse de que las interacciones entre lo BCPP y sus socios intracelulares ocurren. Si la interacción dura más, incubar por más tiempo o ajustar tiempos en caso de que la experimento consistió en un curso de tiempo. Además, la interacción de interés puede ser promovida o impedida por estimulantes diferentes vías de señalización intracelulares.
5. tampones y soluciones.
- Preparar pH PBS 7.4: 136 mM NaCl; 2,7 mM de KCl; 7,8 mM Na2HPO4·2H2O; 1,7 mM KH2PO4.
- Preparación de buffer de lisis de proteínas: 20 mM Tris-HCl (pH 8,0), 137 mM NaCl, 1% IGEPAL, antes de usar, agregar lo siguiente: 1/100 (v/v) proteasa inhibidor de Cocktail, 1 mM de fluoruro de sodio, 1 mM Phenylmethanesulfonyl fluoruro (PMSF) y 0,1 mM ortovanadato de sodio.
- Preparar el Tampón Laemmli: (4 x: 0.18 M Tris-HCl pH 6.8; 5 M glicerol; 3,7% SDS (p/v); 0,6 M β-mercaptoetanol o 9 mM DTT, azul de bromofenol 0.04% (v/v) (BB)).
6. extracción de proteínas
Nota: Extracción de proteínas se realizó como se describió anteriormente20,23. Llevar a cabo esta sección del procedimiento a 4 ° C.
- Aspire completamente el medio de cultivo.
- Lavado 3 x 10 mL de fosfato helada con tampón salino (PBS) por 150 cm2 muy cuidadosamente para evitar la separación de la célula.
- Para obtener la célula lisada, añadir 3 mL de tampón de lisis por 150 cm2 y bien raspar la superficie utilizando un raspador celular. El placa/el matraz a 45 grados de inclinación hará más fácil reunir los lysates de la célula en sus tubos correspondientes.
- Vierta 1 mL de lisado por el tubo celular en tres tubos de 1,5 mL. Estos tubos se marcará con la condición y la repetición como se indica en el paso 3.1.
7. pull-down
- Centrifugar los tubos de 1,5 mL a 11.000 x g por 10 min a 4 ° C.
- Transferir el sobrenadante a nuevos tubos (A).
- Tomar una alícuota de este sobrenadante por condición a tubos diferentes (B), es decir, 50 μL por tubo. Añadir 4 x Laemmli buffer (a 16.6 μl para 50 μl de lisado) y congelar a-20 ° C. Estos lisados servirá muestras de inmunoblot como de costumbre.
- Homogeneizar muy bien el NeutrAvidin Agarose por agitación suave. Cortar las puntas de las pipetas para aumentar su diámetro y mejorar el uso de los granos.
Nota: Los sobrenadantes (tubos D) ahora están listos para ser cargado en el Western blot o congelar a-20 ° C.
8. Western Blot
Nota: Western blotting se realizó como se describió previamente24.
- Volumen equivalente de cada muestra por carril en midigels Bis-Tris (4-12%) en un sistema de electroforesis de Midi-célula de carga.
- Proteínas de Transblot usando un sistema Blot seco en una pila normal de nitrocelulosa.
- La membrana con el 10% de la mancha Ponceau durante 10 minutos.
- Lavar las membranas 3 x 5 min con 5 mL de TTBS.
- Bloquear las membranas con leche 7% en TTBS durante 1 h con agitación suave en tubos o cajas pequeñas. Asegúrese de que el volumen utilizado es suficiente para cubrir las membranas y que no seque, es decir, 40 mL por membrana midi todo.
- Lavar 3 veces, 5 minutos con 5 mL de TTBS.
- Incubar durante una noche a 4 ° C con anticuerpo primario contra la proteína de interés con agitación suave.
- Lavar 3 veces, 5 minutos con 5 mL de TTBS.
- Incubar la membrana a temperatura ambiente con el correspondiente conjugado con peroxidasa de anticuerpo secundario en TTBS durante 1 hora.
- Lavar 3 veces, 5 minutos con 5 mL de TTBS.
- Desarrollar con un sustrato quimioluminiscente en un sistema de quimioluminiscencia.
9. resolución de problemas
- Si después de desarrollar el Western blot ninguna de las muestras no mostraron ninguna señal en absoluto para las proteínas, compruebe el Ponceau.
Nota: La membrana de Ponceau debe mostrar definida y cargado de numerosas bandas a lo largo de los carriles. Si las bandas no son muy sensibles, la cantidad de proteínas cargada puede no ser suficiente o la transferencia puede haber ido mal. Considerar repetir el Western blot. - Si no hay ninguna mancha en la membrana de Ponceau en cualquier carril, repita todo el procedimiento desde el paso 7.4 en los tubos (C).
- Si después de desarrollar el Western blot, una señal de la proteína es muy débil pero el Ponceau mostró proteínas, incubar nuevamente la membrana con el anticuerpo primario por más tiempo. Si la señal sigue siendo bastante débil, incubar nuevamente a temperatura ambiente.
10. otras técnicas usadas en este artículo
- Inmunocitoquímica de BCPPs
- Fijar las células en paraformaldehído al 4% (0,2 mL por cm2) por 20 min.
- Lavar 3 veces, 5 minutos con PBS (0,2 mL por cm2).
- Aplicar el anticuerpo correspondiente (por lo menos 0,15 mL por cm2) diluido en solución de anticuerpo a la concentración indicada del fabricante contra la proteína de interés durante la noche a 4 ° C.
- Incuban con un anticuerpo secundario conjugado con fluoróforo (0,15 mL por cm2) por 2 h a temperatura ambiente.
- Repita los pasos 10.1.2-10.1.4 con otros anticuerpos contra las proteínas de sus interés. Tenga cuidado de no hacer uso de la misma especie para diferentes anticuerpos primarios o mismo fluoróforos de longitud de onda para los anticuerpos secundarios.
- Monte las células usando el reactivo antifade (0,005 mL por cm2).
- Analice en un microscopio de fluorescencia, conectado a una cámara digital.
- Ensayo MTT
- Las células a 37 ° C en placas de 24 pocillos de cultivo.
- Incubar las células en la oscuridad durante 75 min con 0.15 mL del medio de cultivo por cm2 que contiene 0,5 mg/mL MTT.
- Aspire el medio e incubar las células durante 10 min en la oscuridad con dimetil sulfóxido (0,25 mL por cm2) con agitación suave.
- Medir la absorbancia a una longitud de onda de 570 nm utilizando un lector de microplacas.
Resultados
Antes de usar BCPPs para estudio de la interacción intracelular, es fundamental para comparar los efectos de BCPP vs CPP para validar los resultados obtenidos con BCPP. Por lo tanto, para estudiar si la inclusión de la biotina modifica la actividad de la secuencia de destino, en primer lugar analizamos el efecto de Cx43 TAT266-283- B en comparación con TAT Cx43266-283 G166 GSCs morfología. Para ello, se realizaron algunos análisis de inmunofluorescencia de dos proteínas citoesqueléticas, F-actina y α-tubulina después de 24 h de tratamiento. La figura 1 que muestra G166 GSCs en presencia de 50 μm TAT Cx43266-283 o TAT-Cx43266-283- B adquieren una forma más redondeada en comparación con las prolongaciones celulares alargadas y ampliadas que se muestra en los controles (TAT o TAT-B). De hecho, la Figura 1b muestra que filamentos de actina están montados sobre todo como redes de actina cuando las células fueron tratadas con TAT Cx43266-283 o TAT-Cx43266-283- B mientras que forman más haces de actina en las células control (tratado con TAT o TAT-B)25. Por el contrario, distribución de α-tubulina no varía entre las diferentes condiciones. Estos resultados mostraron que la presencia de biotina no modificó el efecto de la secuencia de destino en la morfología del GSCs G166. En anteriores estudios20,21, nos mostró que el TAT-Cx43266-283 redujo G166 GSCs proliferación. En este estudio, investigamos si TAT Cx43266-283- B ejerce los mismos efectos en el crecimiento como TAT-Cx43266-283. Para ello, analizamos la proliferación G166 GSCs por ensayo MTT después de 72 h de tratamiento. El ensayo MTT es un ensayo colorimétrico para evaluar la actividad metabólica de la célula. MTT se metaboliza por las enzimas de oxidorreductasas NAD (P) H en la mitocondria, lo que refleja el número de células viables presentes. La figura 2 muestra que la reducción en la viabilidad de las células G166 GSCs no es significativamente diferente cuando las células fueron tratadas con 50 μm TAT Cx43266-283 o 50 μm TAT Cx43266-283- B. De hecho, ambos disminución significativa de la proliferación G166 GSCs en comparación con el control, TAT o TAT-B.
Una vez que confirmamos que el efecto de la secuencia Diana en G166 GSCs (TAT-Cx43266-283) no fue modificado por la inclusión de la biotina en la terminal C (TAT-Cx43266-283- B), investigamos los socios intracelulares de esta secuencia siguiendo el protocolo descrito en este estudio (figura 3). Porque han participado en el mecanismo de internalización de TAT26caveolas, se analizó la presencia de caveolina-1 (Cav-1) en los desplegables. Análisis de Western blot (figura 4) mostraron que TAT-B y TAT-Cx43266-283- B interactuar con Cav-1. Sin embargo, la capacidad de Cx43 TAT266-283- B contratar c-Src, PTEN y CSK es más fuerte que la encontrada con TAT-B. Quinasa de adhesión focal (FAK) es un sustrato de c-Src que no se ha demostrado que interactuar con la Cx43. De hecho, FAK no mostró ninguna interacción significativa con TAT-B o TAT-Cx43266-283- B.
Para confirmar la interacción entre TAT Cx43266-283- B y c-Src, GSCs G166 se incubaron con 50 μm TAT Cx43266-283- B por 30 min y su localización fue seguida con estreptavidina fluorescente microscopia confocal (figura 5 ). Nuestros resultados mostraron que la distribución intracelular de Cx43 TAT266-283- B está cerca de la membrana plasmática (demostrada por la coloración de fosfatidilserina) y coincide con el de c-Src. De hecho, los análisis de colocalización revelaron algunos puntos de co-localización (blanco) entre TAT Cx43266-283- B y c-Src de la imagen de fusión. En consecuencia, la microscopia confocal estudios confirman los resultados obtenidos con el protocolo de desplegable BCPP descrito en este estudio.
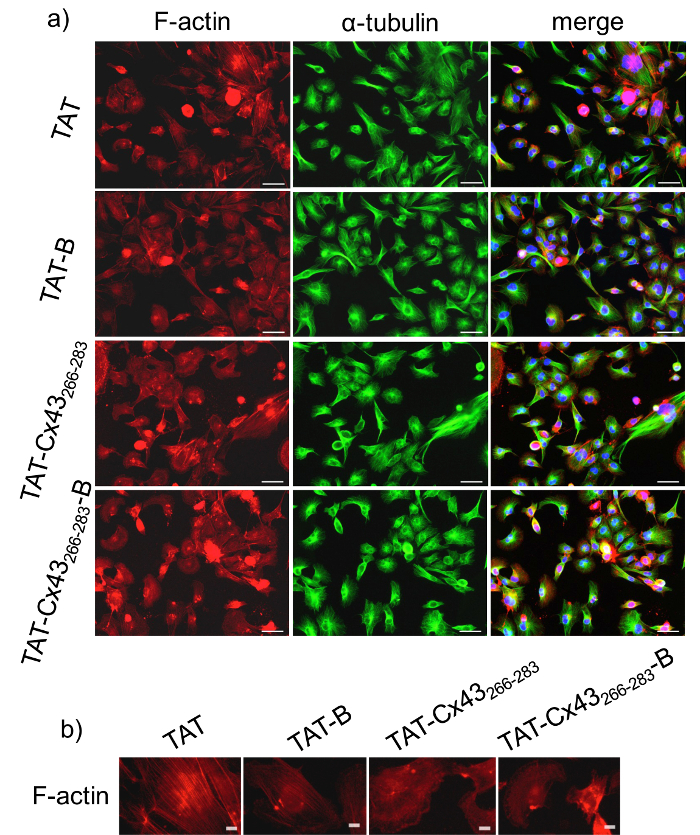
Figura 1: Efecto de BCPP y CPP sobre la morfología de la GSC.
G166 GSCs era plateados con una densidad baja (2 x 104 células / cm2) y después de 24 h se incubaron con control μm 50 CPP (TAT), control BCPP (TAT-B), CPP (TAT-Cx43266-283) el tratamiento o tratamiento BCPP (TAT-Cx43266-283- B) . a) F-actina (rojo), α-tubulina (verde) y combinadas + DAPI immunostaining del mismo campo mostrando G166 GSCs morfología. Barra = 50 μm. b) immunostaining de F-actina que la distribución diferente de la F-actina en G166 GSCs después de la incubación por 24 h con 50 μm CPP (TAT) de control o control BCPP (TAT-B) en comparación con el tratamiento de μm 50 CPP (TAT-Cx43266-283) o BCPP (TAT- de la Cx43 266-283-B). Barras = 10 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Efecto de BCPP y CPP sobre la viabilidad de la GSC.
GSCs G166 se plateado en 5500 células/cm2 en multiwell 24 placas y se incubaron con 50 μm control péptidos, CPP (TAT) o BCPP (TAT-B), o 50 μm tratamiento péptidos CPP (TAT-Cx43266-283) o BCPP (TAT-Cx43266-283- B). La viabilidad celular se analizó mediante un análisis MTT después de 72 h. Los resultados se expresan como absorbancia del MTT y son la media ± SEM de por lo menos 3 experimentos (++ p˂0.01 vs control. ** p˂0.01, *** p˂0.001 vs TAT o TAT-B; unidireccional ANOVA withTukey después del ensayo). Tenga en cuenta que no existen diferencias significativas entre los efectos de la CPPs vs BCPPs. haga clic aquí para ver una versión más grande de esta figura.
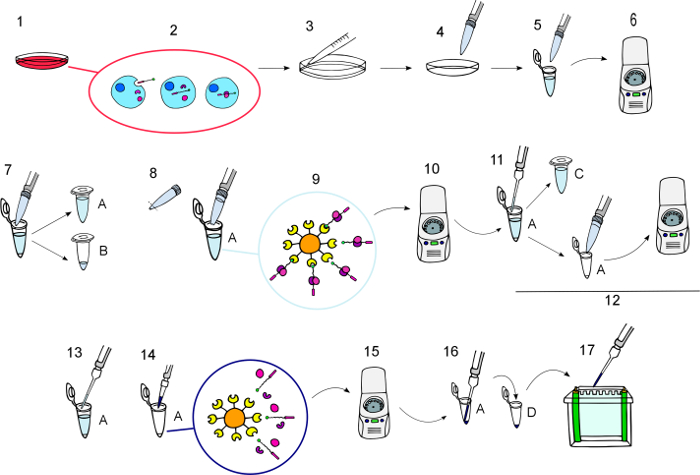
Figura 3: Diagrama de protocolo.
Representación gráfica paso a paso del procedimiento como se describe en la sección "Protocolo", desde la incubación de las BCPPs hasta las BCPPs eluídas y sus proteínas interactuantes obtained.1) incubar las células en cultivo con BCPPs en la concentración deseada para el tiempo requerido. 2) durante la incubación, las BCPPs se internalizan e interactúan con sus compañeros intracelulares. 3) lavar las células 3 veces en el hielo con PBS helado. 4) lyse las células para extraer las proteínas. 5) a los tubos de transferencia lysates de la célula.6) girar a 11000 x g por 10 min a 4 ° C. 7) transferencia los sobrenadantes a nuevos tubos (A) y mantenga una pequeña alícuota de los lisados de proceso como regular Western blot muestras en tubo (B). 8) suspender las cuentas NeutrAvidin Agarose y añadir 50 μL en cada tubo un utilizando una pipeta de corte. 9) incubar con agitándolo suavemente durante 12 h a 4 ° C para permitir que las perlas de agarosa NeutrAvidin interactuar con BCPPs y sus socios. 10) de la vuelta durante 1 min a 3000 x g a los granos con el biotinilado de pellets cebos y sus proteínas interactuantes a ellos. 11) transferir sobrenadante a tubos nuevos (C) y mantenerlos para utilizar en caso de que el desplegable necesita ser repetido. 12) lavar el sedimento cinco veces con tampón de lisis fresco, suspender por inversión, de la vuelta durante 1 min a 3000 x g y descartar el sobrenadante. 13) eliminar cuidadosamente el sobrenadante. 14) añadir el volumen deseado de 4 x Tampón Laemmli y eluir las proteínas a 100 ° C por 5 min 15) Spin en 8200 x g durante 30 s para que sedimenten los granos. 16) transferir las proteínas eluídas encontradas en el sobrenadante con capilares consejos a nuevos tubos (D). 17) cargar en geles para el análisis de Western blot. Haga clic aquí para ver una versión más grande de esta figura.
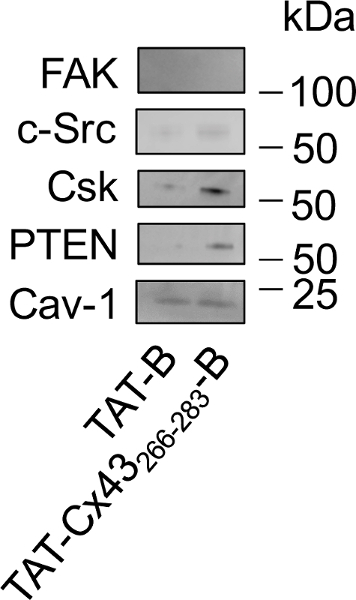
Figura 4: Estudio de las interacciones intracelulares de Cx43 TAT266-283- B en G166 GSCs por hacia abajo seguida de Western blot.
GSCs G166 se incubaron con 50 μm B TAT o TAT-Cx43266-283- B. Después de 30 minutos, las células fueron sometidas a lisis y TAT-B o TAT-Cx43266-283- B a sus socios intracelulares fueron tirados con NeutrAvidin granos. Las proteínas eluídas se carga y se analizaron por Western blot para el estudio de los niveles de FAK, c-Src, CSK, PTEN y Cav-1. Nota: que Cav-1 interactúa con ambos B TAT TAT Cx43266-283- B, c-Src, PTEN y CSK interactúan preferentemente con TAT Cx43266-283- B y FAK no mostró ninguna interacción con TAT-B o TAT-Cx43266-283-B. por favor Haga clic aquí para ver una versión más grande de esta figura.
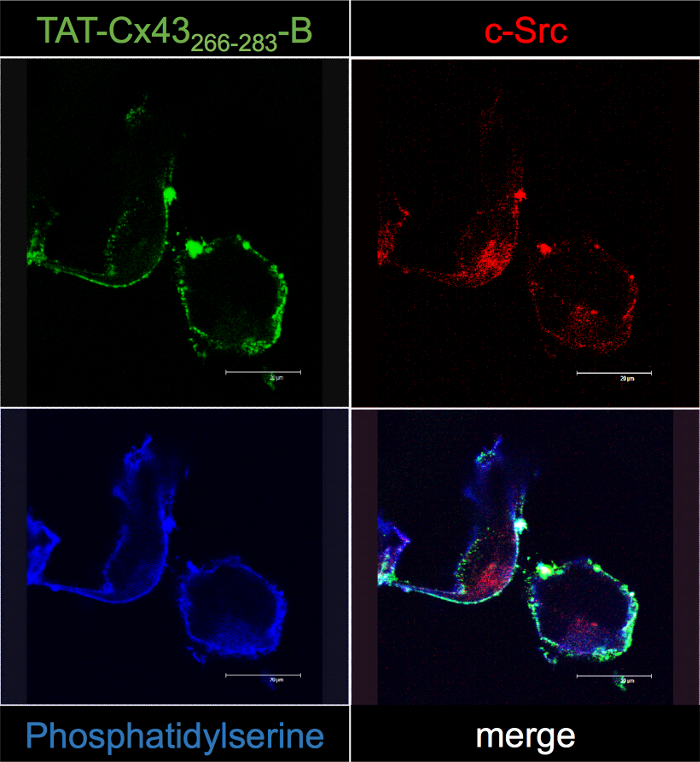
Figura 5: Confirmación de Cx43 TAT266-283- B intracelulares interacciones en G166 GSCs por microscopia confocal.
GSCs G166 se incubaron con 50 μm TAT Cx43266-283- B. Después de 30 min, células eran fijadas y procesadas para localizar TAT Cx43266-283- B con Cy2-estreptavidina (verde), c-Src por inmunofluorescencia (rojo) y fosfatidilserina con anexina V (azul). Tener en cuenta algunos puntos de co-localización (blanco) entre TAT Cx43266-283- B y c-Src, cerca de la membrana del plasma en las imágenes de fusión. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Hay muchos métodos para el estudio de las interacciones proteína-proteína. El método presentado en este estudio se basa en el sistema de desplegable de biotina-avidina ampliamente utilizado en el que un cebo biotinilado se incuba con lysates de la célula para permitir el establecimiento de interacciones. La modificación presentada en este estudio incluye la combinación de esta técnica con secuencias de penetrar en la célula. Proponemos diseñar cebos penetración celular que pueden incubarse con células vivas en lugar de lysates de la célula y por lo tanto las interacciones encontradas reflejará los ocurridos en el contexto celular.
Aquí utilizamos TAT como la secuencia de penetración celular, biotina como la etiqueta desplegable y la región de Cx43 entre aminoácidos 266-283 como el objetivo de encontrar interacciones intracelulares en GSCs humanas. La base estructural para la interacción de Cx43 y c-Src es conocida11,12. Se trata de una interacción importante porque inhibe la actividad oncogénica del c-Src en glioma células24,13. De hecho, CPPs que contiene esta región (TAT-Cx43266-283) mímico las características antioncogenic de Cx43 en células de glioma19,20,21. En células de C6 de glioma de rata, el mecanismo por el cual inhibe la Cx43 TAT266-283 c-Src incluye el reclutamiento de c-Src junto con sus inhibidores endógenos de la CSK y PTEN20. Cabe mencionar que GSCs son muy interesantes como un objetivo en el tratamiento del glioma, ya que constituyen una subpoblación que es resistente a los tratamientos convencionales y por lo tanto responsable de la recurrencia de este de tumores cerebrales malignos27. Además, son duros para transfectar las células y por lo tanto el estudio de las interacciones intracelulares se vuelve más difícil. CPPs se internalizan rápidamente y eficientemente en GSCs19 favoreciendo su uso para el estudio de las interacciones intracelulares. En este estudio, utilizando CPPs Unidas a biotina confirmamos la interacción de la secuencia de Cx43266-283 con c-Src junto con sus inhibidores endógenos CSK y PTEN en GSCs humanas.
Este método es muy potente para estudiar el mecanismo intracelular de compuestos bioactivos. Sin embargo, es muy importante confirmar que el efecto biológico del cebo penetrante biotinilado de la célula no es diferente de la que se obtiene con el no biotinilado uno. Este paso es necesario asociar las interacciones con el efecto de los compuestos bioactivos. Además, la estabilidad del compuesto, su posible degradación por proteasas, así como su posible toxicidad, debe ser probada cuidadosamente y tener en cuenta antes de planear el experimento. En el ejemplo presentado, el efecto anti-proliferativo de TAT-Cx43266-283 en G166 GSCs humanas ha sido previamente documentada20. En este estudio, nos confirman que el efecto anti-proliferativo de Cx43 TAT266-283- B y de TAT-Cx43266-283 es muy similar. Además, el análisis de la morfología celular reveló que α-tubulina y distribución de la F-actina es muy similar en G166 GSCs tratados con TAT Cx43266-283- B o con TAT Cx43266-283. En conjunto, estos resultados indican que la inclusión de la biotina en el c-término de Cx43 TAT266-283 no modificó los efectos de este compuesto en GSCs humanas. Sin embargo, si biotina modificar los efectos de la molécula bioactive, otras etiquetas para la purificación de la proteína pueden probarse, como la bandera octapéptido (DYKDDDDK)28, la etiqueta de derivados de hemaglutinina influenza humana HA (YPYDVPDYA) o glutatión S-transferasa (GST)29. Del mismo modo, si TAT destino la población de células de interés, otra célula secuencias penetrantes, como penetratin, MPG (para una revisión, véase30) o secuencias específicas de la célula pueden ser utilizado31.
Además de estudio de las proteínas que interaccionan específicamente con la secuencia de destino, idealmente, debería ser la presencia de proteínas que interactúan con el control y la secuencia de destino y las proteínas que no interactúan con ellos, como controles positivos y negativos, dirigida. En este sentido, encontramos Cav-1 en el control y tratamiento situación, sugiriendo que los caveolae han estado involucrados en el mecanismo de internalización, como se ha demostrado previamente26. Además, FAK, que interactúa con el c-Src pero no debe para interactuar con la terminal c de Cx43, estuvo ausente en el control y la situación tratada. Estos resultados refuerzan la especificidad de la interacción entre TAT Cx43266-283- B, c-Src, CSK y PTEN. Para confirmar los resultados obtenidos con este protocolo, la microscopia confocal puede utilizarse para visualizar la distribución de las proteínas obran recíprocamente y estudiar su colocalización. Así, encontramos TAT Cx43266-283- B y c-Src exhiben una distribución intracelular similar con algunos puntos de co-localización, confirmando los resultados obtenida con los experimentos de pull-down. De hecho, TAT-Cx43266-283- B se distribuye cerca de la membrana plasmática, sugiriendo que la carga, en este estudio de Cx43266-283, dirige a la molécula a sus socios intracelulares.
Una de las limitaciones del método propuesto es que la molécula utilizada como cebo podría dejar de doblar correctamente y los efectos esperados no se encontrarían. En esta situación, las interacciones encontradas no pueden estar asociadas al efecto. Sin embargo, este método puede ser especialmente interesante para las interacciones involucradas en vías de transducción de señal porque generalmente se realizan por regiones intrínsecamente desordenadas32 y por lo tanto no necesitan un plegamiento ordenado. Además, una de las ventajas del método propuesto es que puede seguirse el curso del tiempo de la interacción, que es especialmente importante para las interacciones transitorias. Además, se puede estudiar fácilmente la importancia de cada residuo de la interacción. De hecho, es posible estudiar la pertinencia de las modificaciones postraduccionales en la interacción de proteínas, por ejemplo, en phosphomimetic la sustitución de glutamato para la serina o treonina. Asimismo, sustitución de serina o treonina de alanina o tirosina por fenilalanina permite probar el efecto de no phosphorylatable serina, treonina o tirosina.Para imitar el fosfo-tirosina, la forma más precisa es la substitución de Tyr p-Tyr33.
Finalmente, el alcance de este protocolo es mucho más allá de la interacción de proteínas porque este sistema puede aplicarse a otras cargas bioactivas tales como secuencias de RNA, nanopartículas, virus u otras moléculas que pueden ser fusionados a la biotina y transduced con CPP para estudiar su mecanismo intracelular de acción.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a M. Morales y J. Bravo por su ayuda con el diseño de la CPPs y J.C. Arévalo por su ayuda con el protocolo de pull-down. Estamos agradecidos por la asistencia técnica de T. del Rey. Este trabajo fue financiado por el Ministerio de Economía y Competitividad, España; FEDER BFU2015-70040-R, Junta de Castilla y León, España; SA026U16 FEDER y la Fundación Ramón Areces. M. Rodríguez de Jaraíz y A. González Sánchez son los beneficiarios de una beca de la Junta de Castilla y León y Fondo Social Europeo.
Materiales
| Name | Company | Catalog Number | Comments |
| G166 GSC line | BioRep | ||
| RHB-A stem cell medium | Takara | Y40001 | |
| Laminin Mouse Protein | Invitrogen, Life Technologies, ThermoFisher Scientific | 23017-015 | 10 µg/ml |
| B-27 Serum free Supplement (50X) | Invitrogen, Life Technologies, ThermoFisher Scientific | 17504-044 | 2% |
| N-2 Supplement (100x) | Invitrogen, Life Technologies, ThermoFisher Scientific | 17502-048 | 1% |
| Recombinant Human EGF | Peprotech | AF-100-15 | 20 ng/ml |
| Recombinant Human b-FGF | Peprotech | AF-100-18B | 20 ng/ml |
| PBS pH 7.4: In deionized water, 136 mM NaCl ; 2.7 mM KCl; 7.8 mM Na2HPO4·2H2O ; 1.7 mM KH2PO4 | |||
| Accutase | Sigma | A6964 | |
| Cryostor CS10 cryopreservation medium | StemCell Technologies | 7930 | |
| TAT | GenScript | - | Custom made |
| TAT-B | GenScript | - | Custom made |
| TAT-Cx43266-283 | GenScript | - | Custom made |
| TAT-Cx43266-283-B | GenScript | - | Custom made |
| Alexa Fluor 594 Phalloidin | Molecular Probes, Life Technologies, ThermoFisher Scientific | A1275737 | 1/20 |
| Monoclonal α-tubulin mouse antibody | Sigma-Aldrich | T9026 | 1/500 |
| 4',6-diamidino-2-phenylindole (DAPI) | Molecular Probes, Life Technologies, ThermoFisher Scientific | 1.25 mg/ml | |
| Pierce™ NeutrAvidin™ Agarose | ThermoFisher Scientific | 29200 | |
| Protein lysis buffer: 5 mM Tris-HCl (pH 6.8), 2% (w/v) SDS, 2 mM EDTA , 2 mM EGTA | |||
| Protease Inhibitor Cocktail Set III. EDTA-Free | Calbiochem, Bionova | 539134 | 1/100 (v/v) |
| Sodium Fluoride | PanReac AppliChem | 141675 | 1 mM |
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma-Aldrich | P7626 | 1 mM |
| Sodium orthovanadate | Sigma-Aldrich | S6508 | 0.1 mM |
| Laemmli buffer: (4x: 0.18 M Tris-HCl pH 6.8; 5 M glycerol; 3.7 % (w/v) SDS; 0.6 M β-mercaptoethanol or 9 mM DTT ; 0.04% (v/v) bromophenol blue (BB) . | 1X | ||
| Xcell 4 SureLock Midi-Cell Electrophoresis System | Life Technologies, ThermoFisher Scientific | WR0100 | |
| NuPAGE Novex Bis-Tris Midi-Gels 4-12% | Life Technologies, ThermoFisher Scientific | WG1402box | |
| NuPAGE MOPS SDS Running Buffer (20X) | Life Technologies, ThermoFisher Scientific | NP0001 | 1X |
| NuPAGE Transfer Buffer 20x | Life Technologies, ThermoFisher Scientific | NP0006 | 1X |
| Precision Plus Protein Dual Color Standard | Bio-Rad | 161-0374 | |
| iBlot 2 NC Regular Stacks (nitrocellulose membranes) | Life Technologies, ThermoFisher Scientific | IB23001 | |
| iBlot 2 Dry Blotting System - Gel transfer device | Life Technologies, ThermoFisher Scientific | IB21001 | |
| 10% Ponceau S Solution (0.1% Ponceau (w/v) in 5% acetic acid (v/v)) in water | Sigma | P7170 | |
| FAK polyclonal rabbit antibody | Life Technologies, ThermoFisher Scientific | AHO0502 | 1/500 |
| Src polyclonal rabbit antibody | Cell Signalling (WERFEN) | 2108S | 1/500 |
| Csk polyclonal rabbit antibody | Cell Signalling (WERFEN) | 4980 | 1/500 |
| PTEN polyclonal mouse antibody | Cell Signalling (WERFEN) | 9552 | 1/500 |
| Caveolin-1 polyclonal rabbit antibody | Abcam | ab2910 | 1/1000 |
| Goat anti-mouse IgG-HRP antibody | Quimigen, Santa Cruz Biotechnology | Sc-2005 | 1/5000 |
| Goat anti-rabbit IgG-HRP antibody | Quimigen, Santa Cruz Biotechnology | SC-2030 | 1/5000 |
| Western Blotting Luminol Reagent | Santa Cruz Biotechnology | SC-2048 | |
| Src polyclonal rabbit antibody | Cell Signalling (WERFEN) | 2108S | 1/500 |
| Antibody solution: PBS, 10% FBS, 0.1 M lysine, 0.02% sodium azide | |||
| Alexa Fluor 488 goat anti-mouse IgG | Invitrogen, Life Technologies, ThermoFisher Scientific | A11029 | 1/1000 |
| Cy2-conjugated streptavidin | Jackson ImmunoResearch | 016-220-089 | 1/500 |
| MicroChemi Luminescence system | DNA Bio-Imaging Systems | ||
| Dead Cell Apoptosis Kit with Annexin V Alexa Fluor® 488 & Propidium Iodide (PI) | Molecular Probes, Life Technologies, ThermoFisher Scientific | V13241 | 1/500 |
| SlowFade Gold antifade reagent | Life Technologies, ThermoFisher Scientific | S36936 | |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M2128 | |
| Dimethyl sulfoxide for UV-spectroscopy, >=99.8% (GC) | Honeywell | 41641-1L | |
| Appliskan 2001 | Thermo Electron Corporation, Thermo Scientific |
Referencias
- Green, N. M. Avidin. 3. The nature of the biotin-binding site. Biochem J. 89, 599-609 (1963).
- Wilchek, M., Bayer, E. A. Applications of avidin-biotin technology: literature survey. Methods Enzymol. 184, 14-45 (1990).
- Herce, H. D., Garcia, A. E., Cardoso, M. C. Fundamental molecular mechanism for the cellular uptake of guanidinium-rich molecules. J Am Chem Soc. 136 (50), 17459-17467 (2014).
- Ramsey, J. D., Flynn, N. H. Cell-penetrating peptides transport therapeutics into cells. Pharmacol Ther. 154, 78-86 (2015).
- Fominaya, J., Bravo, J., Rebollo, A. Strategies to stabilize cell penetrating peptides for in vivo applications. Ther Deliv. 6 (10), 1171-1194 (2015).
- Vives, E., Brodin, P., Lebleu, B. A truncated HIV-1 Tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus. J Biol Chem. 272 (25), 16010-16017 (1997).
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol Med. 13 (10), 443-448 (2007).
- Brooks, H., Lebleu, B., Vives, E. Tat peptide-mediated cellular delivery: back to basics. Adv Drug Deliv Rev. 57 (4), 559-577 (2005).
- Cuesto, G., et al. Phosphoinositide-3-kinase activation controls synaptogenesis and spinogenesis in hippocampal neurons. J Neurosci. 31 (8), 2721-2733 (2011).
- Schmidt, N., Mishra, A., Lai, G. H., Wong, G. C. Arginine-rich cell-penetrating peptides. FEBS Lett. 584 (9), 1806-1813 (2010).
- Sorgen, P. L., et al. Structural changes in the carboxyl terminus of the gap junction protein connexin43 indicates signaling between binding domains for c-Src and zonula occludens-1. J Biol Chem. 279 (52), 54695-54701 (2004).
- Giepmans, B. N., Hengeveld, T., Postma, F. R., Moolenaar, W. H. Interaction of c-Src with gap junction protein connexin-43. Role in the regulation of cell-cell communication. J Biol Chem. 276 (11), 8544-8549 (2001).
- Tabernero, A., Gangoso, E., Jaraíz-Rodríguez, M., Medina, J. M. The role of connexin43-Src interaction in astrocytomas: A molecular puzzle. Neuroscience. 323, 183-194 (2016).
- Giaume, C., Koulakoff, A., Roux, L., Holcman, D., Rouach, N. Astroglial networks: a step further in neuroglial and gliovascular interactions. Nat Rev Neurosci. 11 (2), 87-99 (2010).
- Shinoura, N., et al. Protein and messenger RNA expression of connexin43 in astrocytomas: implications in brain tumor gene therapy. J Neurosurg. 84, 839-845 (1996).
- Soroceanu, L., Manning, T., Sontheimer, H. Reduced expression of connexin-43 and functional gap junction coupling in human gliomas. Glia. 33, 107-117 (2001).
- Pu, P., Xia, Z., Yu, S., Huang, Q. Altered expression of Cx43 in astrocytic tumors. Clin Neurol Neurosurg. 107 (1), 49-54 (2004).
- Crespin, S., et al. Expression of a gap junction protein, connexin43, in a large panel of human gliomas: new insights. Cancer Med. 5 (8), 1742-1752 (2016).
- Gangoso, E., Thirant, C., Chneiweiss, H., Medina, J. M., Tabernero, A. A cell-penetrating peptide based on the interaction between c-Src and connexin43 reverses glioma stem cell phenotype. Cell Death & Disease. 5, (2014).
- Gonzalez-Sanchez, A., et al. Connexin43 recruits PTEN and Csk to inhibit c-Src activity in glioma cells and astrocytes. Oncotarget. 7 (31), 49819-49833 (2016).
- Jaraíz-Rodríguez, M., et al. A short region of connexin43 reduces human glioma stem cell migration, invasion and survival through Src, PTEN and FAK. Stem Cell Reports. , (2017).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem Cell. 4 (6), 568-580 (2009).
- Yu, T., et al. In vivo regulation of NGF-mediated functions by Nedd4-2 ubiquitination of TrkA. J Neurosci. 34 (17), 6098-6106 (2014).
- Herrero-Gonzalez, S., et al. Connexin43 inhibits the oncogenic activity of c-Src in C6 glioma cells. Oncogene. 29 (42), 5712-5723 (2010).
- Cooper, G. M. . The Cell: A Molecular Approach. , (2000).
- Fittipaldi, A., et al. Cell membrane lipid rafts mediate caveolar endocytosis of HIV-1 Tat fusion proteins. J Biol Chem. 278 (36), 34141-34149 (2003).
- Dirks, P. B. Brain tumor stem cells: the cancer stem cell hypothesis writ large. Mol Oncol. 4 (5), 420-430 (2010).
- Hopp, T. P., et al. A Short Polypeptide Marker Sequence Useful for Recombinant Protein Identification and Purification. Nat Biotech. 6 (10), 1204-1210 (1988).
- Benard, V., Bokoch, G. M. Assay of Cdc42, Rac, and Rho GTPase activation by affinity methods. Methods Enzymol. 345, 349-359 (2002).
- Guidotti, G., Brambilla, L., Rossi, D. Cell-Penetrating Peptides: From Basic Research to Clinics. Trends Pharmacol Sci. 38 (4), 406-424 (2017).
- Hu, Q., et al. Glioma therapy using tumor homing and penetrating peptide-functionalized PEG-PLA nanoparticles loaded with paclitaxel. Biomaterials. 34 (22), 5640-5650 (2013).
- Babu, M. M., van der Lee, R., de Groot, N. S., Gsponer, J. Intrinsically disordered proteins: regulation and disease. Curr Opin Struct Biol. 21 (3), 432-440 (2011).
- Anthis, N. J., et al. Beta integrin tyrosine phosphorylation is a conserved mechanism for regulating talin-induced integrin activation. J Biol Chem. 284 (52), 36700-36710 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados