A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ויזואליזציה של מודולי קורטיקליים Cortices יונקים שעברו שיטוח
In This Article
Summary
מאמר זה מתאר מתודולוגיה מפורט כדי להשיג מקטעים וצורניים שעברו שיטוח של יונקים cortices והמחש מודולים בקליפת המוח באמצעות פתולוגיה ושיטות immunohistochemical.
Abstract
קליפת בתרבית של מוח הוא parcellated לתוך substructures ברורים או מודולים. מודולים בקליפת המוח בדרך כלל לשקר מקבילה לגליון קורטיקלית, יכול להיות המותווית על ידי מסוימים פתולוגיה ושיטות immunohistochemical. במחקר זה, אנו מדגישים שיטה כדי לבודד את קליפת המוח של המוח יונקים ולשטח אותם לקבל במקביל סעיפים בגיליון קורטיקלית. אנחנו עוד גולת הכותרת שנבחרה פתולוגיה, immunohistochemical שיטות לעיבוד אלה משוטחים מקטעים וצורניים להמחיש מודולים קורטיקלית. בתוך קליפת המגע של יונקים שונים, אנו מבצעים להסטולוגיה אוקסידאז ציטוכרום כדי לחשוף את הגוף מפות או מודולים קורטיקלית המייצגים חלקים שונים של הגוף של החיה. בתוך קליפת entorhinal המדיאלי, אזור שבו נוצרים תאי הרשת, אנו מנצלים immunohistochemical שיטות לסימון מודולים של נוירונים נקבע גנטית אשר מסודרים בתבנית-רשת בגליון בקליפת המוח על פני מספר מינים. בסך הכל, אנו מספקים מסגרת כדי לבודד ולהכין layer-wise משוטחים חלקים קורטיקליים, ותנסו לדמיין את המודולים בקליפת המוח באמצעות פתולוגיה ושיטות immunohistochemical במגוון רחב של יונקים את המוח.
Introduction
חלק מהשינויים המשמעותיים במבנה המוח על פני האמיניות נראים גם קליפת המוח. למרות הבדלים משמעותיים, קליפת המוח של בעלי חיים עוקב אחר תבנית משותפת, ניתן לחלק בשתי דרכים נפרדות, על-ידי שכבות ואזורי1. שכבות קורטיקלית לשקר מקביל פני השטח של המוח, משתנים מספר 3 שכבות cortices הזוחלים2 על 6 שכבות cortices בתרבית של1. אזורים קורטיקליים לעומת אזורים הנבדלים זה מזה של קליפת המקבילים במידה רבה פונקציות שונות, למשל, קליפת המגע מעורב התחושה של מגע או קליפת הראיה בעיבוד חזותי תשומות. אזורים קורטיקליים אלה לעיתים קרובות נחלקים תיקונים או מודולים3, אשר נמצאים באופן קבוע חוזרות מבנים אנטומיים, בעיקרו של דבר מצא מקבילות אל פני השטח pial של המוח. מודולים בקליפת המוח עשוי להיות מוגבל רובד4, או להרחיבו על-גבי שכבות מספר5.
אופטים בשיטות הרגילות של המוח לערב מקטעים רגילים על פני השטח של המוח, כמו הילתית או הווריד. בעוד שיטות אלה ניתן להשתמש כדי להמחיש מודולים קורטיקלית, שפע של תכונות מעניינות יכול להתגלות כאשר המודולים בקליפת המוח הם דמיינו tangentially, במישור מקביל פני השטח של המוח. למשל, מודולים המגע במוח מכרסמים המייצג שפם, מופיעות כמו חביות כאשר visualized נורמלי השטח במוח, ולכן האזורים להפיק קליפת חבית שם. עם זאת, בלהמחיש את החביות בכיוון משיק, הם מגלים שפם-מפה, עם הקנים להיות אצלה כיוון טופוגרפית שיקוף את המבנה המדוייק של נכון על פני גוף חיצוני. במקרים מסוימים, אפילו ברח הסידור המודולרי זיהוי לתקופות ניכר, כאשר visualized באופן שאינו סוטה. קליפת entorhinal המדיאלי, ידועה הנוכחות של תאי הרשת, נוירונים אשר אש בתבנית משושה הרגילה כאשר חיים הוא וחוצה סביבה. למרות שזה אזור ובדוקים בכבדות, עד לאחרונה, הנוכחות של תיקונים או מודולים של תאים בקליפת entorhinal המדיאלי, אשר נפרסות פיזית בתוך תבנית משושה6, נמלט זיהוי. הנוכחות ואת הסידור של המודולים במוח עכברוש, היה בהנחייתם עושה קטעים וקולו של קליפת entorhinal המדיאלי, חוקרת את cytoarchitecture באופן layer-wise.
לאחר חלוקתה, ההיבט המסוים של ויזואליזציה של מודולים בקליפת המוח גם ניתן למימוש בדרכים רבות. בסגנון קלאסי, יש לימודי התחום מודולים מבוסס על התא צפיפות או סיבים פריסה1. גישה פופולרית נוספת היא השימוש ציטוכרום אוקסידאז להסטולוגיה, אשר חושף את תחומי פעילות גבוהה יותר8. גישות חדשות יותר כוללים מסתכל על סוגי תאים נקבע גנטית, מכובד על בסיס שלהם חלבון ביטוי פרופילים6,8.
במחקר זה, אנו מדגישים שיטות כדי לבודד את קליפת המוח של המוח יונקים, להשיג חלקים וצורניים שעברו שיטוח להמחיש מודולים קורטיקלית המבוסס על להסטולוגיה אוקסידאז ציטוכרום אימונוהיסטוכימיה של חלבונים מסוימים סוג התא.
Protocol
כל ההליכים ניסיוני בוצעו על פי הנחיות גרמני על רווחת בעלי חיים תחת פיקוחו של ועדות האתיקה המקומית (LaGeSo). האדם ואת נתוני המוח בת נגזר נאומן. et al. 5 בהליך שלהלן מבוצע על עכבר Wistar זכר בוגר (זן: RJHan:WI).
1. זלוף והפקת המוח
הערה: על מנת לקבל מוח למשל קבוע ללא דם, transcardial זלוף של החיה הוא מעודדים, כמו שרידי דם מגביר את האות רקע לא ספציפי במהלך צביעת. בכל זאת, זה גם ניתן להשיג חלקים שעברו שיטוח של הדגימה perfused לא תכתים אותם. הקלות של טיפול הדגימה משתנה עם ריכוז מקבע בשימוש. קיבוע מעט מדי מגביר את הסיכון של טיפול נזק למוח במהלך השטחת ו גזירה, בעוד ריכוזים גבוהים מדי להוריד את הגמישות לשיטוח והאיכות של האות מוכתמים.
- Transcardially perfuse החיה, באמצעות מחט 23 גרם. מדריך מפורט יותר, ראה Gage. et al. 9
- השתמש פוספט מאגר מלוחים10 (PBS; מ' 0.02 נקודות; pH 7.4) כדי. להוריד את הדם במוח ובגוף של החיה. המשך עד עירוי נוזלים מופיע ברור, לפחות 150 מ ל- PBS להיות חדורים דרך מערכת כלי הדם.
הערה: התוצאות הטובות ביותר מושגות, בלחץ הדומה הטווח של לחץ הדם פיזיולוגיים של החיה להיות perfused (לדוגמה, עכברוש: 120-130 מ מ כספית). לחלופין, הוסף הפרין (10 U/mL) הפתרון כדי למנוע קרישת דם11. - כדי לתקן את המוח, transcardially להשרות מינימום של 100 מ ל paraformaldehyde12 (PFA, 4%; ב 0.1 M פוספט מאגר (PB)13) עד הצוואר של החיה הוא נוקשה.
התראה: PFA הוא קרצינוגן פוטנציאליים.
הערה: התוצאות הטובות ביותר עבור פעילות פתולוגיה מכתים, כגון ציטוכרום אוקסידאז, מושגות, בעת שימוש 2% מחברים. לשני מכתים, כגון אימונוהיסטוכימיה, 4% PFA היא עדיפה.
- השתמש פוספט מאגר מלוחים10 (PBS; מ' 0.02 נקודות; pH 7.4) כדי. להוריד את הדם במוח ובגוף של החיה. המשך עד עירוי נוזלים מופיע ברור, לפחות 150 מ ל- PBS להיות חדורים דרך מערכת כלי הדם.
- תמצית המוח מהגולגולת.
הערה: ראה Gage. et al. 9 לפרטים.- לבודד את הראש באמצעות מספריים גדולים או עצם שירס.
- באמצעות מספריים בסדר, לחתוך את העור לאורך האמצע של הצוואר האף. להפריד את העור כדי לחשוף את הגולגולת. הסר את הצוואר ואת השרירים הזמני באמצעות מספריים משובחים.
- להפוך את קו האמצע לחתוך דרך העצם interparietal החל מאגנום נקב עד לעצם.
- השתמש Rongeurs כדי לקלף את העצם interparietal. שקופית בסדר מספריים לאורך התפר המשונן וחותכים מהקצה האחורי של הקודקוד לקצה הקדמי של העצמות הקדמית.
- השתמש Rongeurs כדי לקלף את הקודקוד ואת עצמות המצח. לחלופין, הרם את העצמות משם באמצעות מלקחיים. השתמש בכף כדי לחתוך חוטי עצב הגחון, מסירים את המוח. להעביר את המוח PB (0.1 M; pH 7.4).
- תקן האו ם perfused את המוח על-ידי טבילה 4% מחברים עבור h 1-3-4 מעלות צלזיוס (תלוי בגודל המוח בדיקה: חדף: ~ 1 h, האדם: ~ 3 h).
הערה: עבור גדול gyrencephalic את המוח כמו בני אדם, לבודד, לגזור את תחום העניין כדי לצמצם את זמן קיבעון. - כדי להשיג אזורים קורטיקליים גדולים יותר במקטע, לשטח את המוח לפני קיבוע שאחרי נוספות; המשך לשלב 2. עם זאת, כדי להשיג חלקים יותר קשה להגיע לאזורים כמו קליפת entorhinal המדיאלי, פוסט-לתקן את המוח ב- 4% מחברים עבור 24 שעות לפני שתמשיך לשלב 2.
2. המוח לנתיחה ושיטוח
- הפרד את ההמיספרות במוח באמצעות גילוח (lissencephalic מוחות) או אזמל (gyrencephalic מוחות).
הערה: אם המוח לא תוקנה פוסט, זה רגישים לנזק על ידי טיפול. - שלב אופציונלי לסיוע הערכה ורישום הצטמקות סעיף הבאים:
- לנקב קליפת המוח באזור הלא-מעניינים, עם מחט 35G נורמלי השטח קורטיקלית. חזור על השלב פעמיים במרחקים המוגדרים לאורך הגיליון קורטיקלית. כדי לקבוע את המרחק לאורך הגיליון בקליפת המוח, להשתמש חוט חתוכות מראש באורך קבוע (למשל, 5 מ מ) ושים אותה על פני קורטיקלית לקביעת נקודות דקירה.
- Lissencephalic המוח: להסיר מבנים subcortical באמצעות מרית ויבתר. קריטית: לשמור את המוח לחות עם חמאת בוטנים (0.1 M; pH 7.4) לאורך כל התהליך.
- להחזיק את המוח על ידי המוח הקטן ולהוסיף בעדינות את המרית לפתוח מטוס דיסקציה כפיס המוח. קצה עגול מרית יצביע מן הקליפה.
- שקופית המרית נוסף ומשוך בעדינות עד המרית בין קליפת המוח התלמוס. מבנים subcortical נפרד עם גירוד תנועות.
- לבדוק את הכדור עבור אפילו עובי.
הערה: בכל אזורי לא אחיד עלולה לגרום הדרגתי הטרנס-שכבה במהלך חלוקתה. על חלוקתה משיקי, להשתמש אזמל לעשות חתך נקי דרך המוח, מקביל פני השטח pial של האזור שממנו מקטעים וצורניים הם הרצויה. - צעדים אופציונלי לשיפור באיכות השיטוח:
- לעשות חתך נקי דרך סטריאטום, גרעין האקומבנס, קליפת orbitofrontal, מאז הם מגבירים את העובי של קליפת המוח באזור לרוחב. בנוסף, להוסיף חתך להקלה על בסיס של האזור הפנימי של קליפת המוח הקדם חזיתית, אשר מאפשר התגלגלות של חלקים המדיאלי של קליפת המוח.
- למקם את הכדור (כלפי מטה קליפת המוח) על משטח זכוכית. המשך לשלב 2.6.
- Gyrencephalic המוח: להסיר חומר לבן להתגלות gyri (עבור פרוטוקולים מפורט, ראה: Sincich. et al. 14; Tootell, סילברמן15). קריטית: שימוש PB (0.1 M; pH 7.4) לשמור על המוח לח. כל הזמן.
- לשים את תחום העניין על נייר הסינון לח בצלחת פטרי גדולה, עם הקליפה כלפי מעלה.
- להסיר את מעידה קרום pia באמצעות מלקחיים שני.
- השתמש מקלון צמר גפן לח ולהוסיף בעדינות כל sulcus לנתק הידבקויות בין gyri.
- תסתובב המוח באמצעות נייר סינון נוסף לח.
- השתמש שני שפכטלים מיקרו מעוקל להתגלות gyri יחיד. השתמש הצד הקמור של תרוודים להתגרות מתפרק החומר הלבן עד שהגיע קרוב לסוף קעורה הפיתול. השתמש מקלון צמר גפן לח ולהמשיך עם תנועות מתערבל להגיע לסוף קעורה של הפיתול.
- להקניט gyri יחידה בנפרד. אם יש צורך, להוסיף להקלת קטן חותך אם המתח גבוהה מדי.
- לשטח את המוח פרש הפטרי או מיכל דומה.
- לחלופין, במקום מוח גדול יותר על ספוג מכוסה נייר סינון, כדי להבטיח כי אזורים לא יתייבש.
- במקום שתי חתיכות חימר התגלגל על שני הצדדים. קריטית: כמו העובי של החימר מגדיר כמה הכדור יכול יתבצע שיטוח, להבטיח כי החימר הוא 10-20% דק יותר קליפת האו ם שעברו שיטוח.
- לחץ בעדינות השני זכוכית שקופיות/קטן פטרי על קליפת המוח, עד הכדור הוא שטוח לגמרי. כדי להשיג את התוצאות הטובות ביותר עבור אזור הרצוי, במקום השקופית זכוכית קודם על האזור המתאים. כדי להשיג את התוצאות הטובות ביותר עבור המוח lissencephalic, למקם את השקופית זכוכית tangentially בחלק הלטראלי קודם והפעילו לחץ מרוכז על אזור זה.
- לשים משקולת (למשל, קרמיקה זכוכית השעון) על שקופיות זכוכית/הפטרי ולשטח את הכדור עבור h 3-5-4 מעלות צלזיוס ב PB.
- עבור קיבוע שאחרי, לשחרר את הלחץ ולהסיר את השקופיות זכוכית. הכניס הכדור שעברו שיטוח מחברים (צף חינם) למשך 24 שעות על מטרף-4 מעלות צלזיוס.
הערה: התוצאות הטובות ביותר עבור פעילות פתולוגיה stainings מושגות כאשר משתמש 1% מחברים. עבור stainings אחרים, כגון אימונוהיסטוכימיה, שכל perfused האו ם, 2% PFA יכול לשמש.
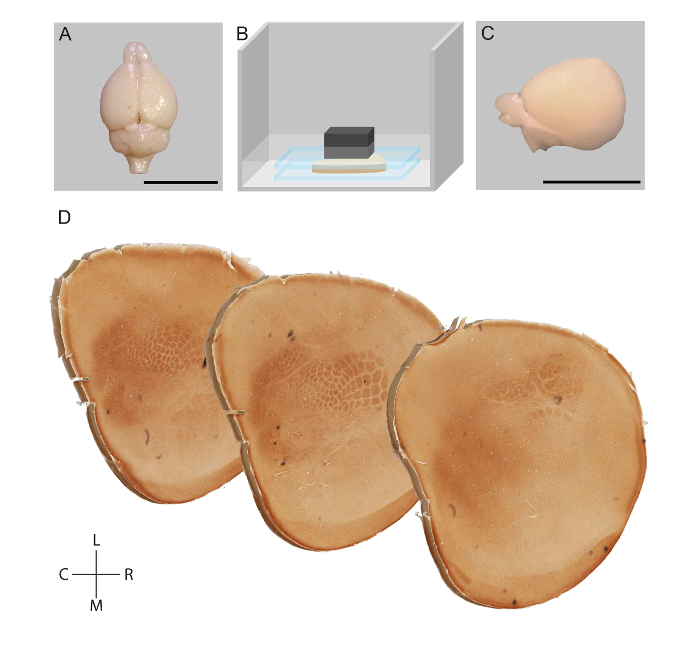
איור 1: ייצוג סכמטי של זרימת עבודה עבור שיטוח של האונה קורטיקלית עכברוש ו ויזואליזציה של מודולי קליפה המגע. מיד לאחר transcardial זלוף, המוח של עכבר היה גזור (A). מבנים subcortical הוסרו, קליפת שוטח בין שתי שקופיות זכוכית במאגר פוספט (B). שעברו שיטוח האונה (C) היה פוסט קבוע, tangentially למחלקה, והוא ישאר לכל פעילות ציטוכרום אוקסידאז (D). גודל ברים = 1 ס מ. ר: Rostral, c: Caudal, l: לרוחב, מ ': המדיאלי. איור מקורי לאואר. et al. 23 אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
3. חיתוך קטעים וצורניים
הערה: בהתאם לדרישות של הפרוטוקולים מוכתמים, בתהליך חיתוך ועובי ניתן להתאים. Vibratome שימש לחתוך את ההמיספרות לעיבוד נוסף פתולוגיה (שלב 3.2) ב- 80-150 מיקרומטר. אולם, לצורך עיבוד immunohistochemical, סעיפים דקים הם הרצויה, מיקרוטום הקפאה שימש אופטים (שלב 3.3) ב 10-60 מיקרומטר. ראה וידאו 1.
- לשטוף את הכדור שעברו שיטוח ב PB (0.1M; pH 7.4) למשך 15 דקות.
- חותכים את הכדור על vibratome.
- במקום הכדור tangentially על המחזיק עם פרוסות. לחלופין, הקש שוב בעדינות עם מגלשת זכוכית לפני מתקן אותו בעמדה (למשל, עם דבק מגע).
הערה: למזער את כמות הדבק משמש, כי חפצים חיתוך עלולה לגרום בגלל העובי הקטן של ההמיספרות שעברו שיטוח. - חותכים הכדור מהקצה עבה יותר, יציבה יותר לקראת הסוף רזה (האחורי כדי הקדמי, כאן) העובי הנדרש. המשך לשלב 3.4.
הערה: אם ריכוזים נמוכים קיבוע שימשו, לחתוך אותו במהירות איטית ו משרעת גבוהה
- במקום הכדור tangentially על המחזיק עם פרוסות. לחלופין, הקש שוב בעדינות עם מגלשת זכוכית לפני מתקן אותו בעמדה (למשל, עם דבק מגע).
- חותכים את הכדור על מיקרוטום הקפאה.
- Cryoprotect המוח במועט זה בתמיסה 30% סוכרוז (PB) עד כיורים.
הערה: בהתאם לגודל של הרקמה להיות cryoprotected, נקלט הפתרון יכול לנוע בין כמה שעות עד כמה ימים. מוח גדול יותר שיטות חלופיות cryoprotection עשוי להיחשב (ראה Rosene. et al. 16). - טופס קרח בסיס מיקרוטום הקפאה כדי לטעון את המוח. לבנות בסיס הקרח על ידי הקפאת PB על פני לחסום מיקרוטום הקפאה. קריטית: ודא כי פני השטח של בסיס קרח במקביל הלהב מיקרוטום. כדי לעשות זאת, חותכים את הקרח ריק הבסיס באמצעות הלהב מיקרוטום ליישור בדיוק הבסיס קרח במקביל למשטח חיתוך.
- להטביע את המוח קפואים בינוני והר זה פנייך לחסום האזמל הקטן עם השטח של עניין מקביל פני בלוק. פני השטח pial של המוח לכיוון פני לחסום האזמל הקטן. קריטי: להתאים את טמפרטורת הקיפאון בהתאם לגודל המדגם; טמפרטורות גבוהות יותר להבטיח את תקינות סעיף טוב יותר בעת חלוקתה, אך חלקים גדולים דורשים טמפרטורות נמוכות יותר להקפיא מדגם אחיד.
- לחתוך את המוח tangentially על העובי הנדרש (מהירויות חיתוך איטית ואחידה התוצאה בסעיף האיכות הטובה ביותר).
- Cryoprotect המוח במועט זה בתמיסה 30% סוכרוז (PB) עד כיורים.
- רחץ בסעיפים PB למשך 15 דקות על מטרף.

1 וידאו: וידאו סכמטי של חלוקתה וצורניים עכברוש המדיאלי entorhinal קליפת, הפריסה של parasubicular ומודולי entorhinal. קליפת entorhinal המדיאלי של מוח מכרסמים ממוקם בקצה האחורי של קליפת המוח, מטים כלפי הצד המדיאלי של הגחון. סעיפים וצורניים מתקבלים על ידי המכוונת סכין לאורך זווית זו. כתוצאה מכך, סוג התא המתאים ספציפית מכתים מגלה מבנים מודולריים המדיאלי entorhinal קליפת ו parasubiculum הסמוך. וידאו מותאם ברכט וריי8. אנא לחץ כאן כדי לצפות בסרטון. (לחיצה ימנית כדי להוריד.)
4. ויזואליזציה של מודולים בקליפת המוח באמצעות צביעת ציטוכרום אוקסידאז
הערה: בפרוטוקולי מכתימים שונים יש פותחה לצורך זיהוי פתולוגיה של פעילות ציטוכרום אוקסידאז, למשל, קודם על ידי וונג-ריילי17 , שונה מאוחר יותר על-ידי דיבאץ. ואח 18 לפרוטוקול זה מבוסס על האחד על ידי דיבאץ. et al. 18, מאז השימוש של ניקל-אמוניום סולפט (NiAS) גורמת להגברת הניגודיות ומודולים כדאי שהוגדר באזורים קורטיקליים מוכתם.
- להכין את אוקסידאז ציטוכרום מכתים פתרון (ראה דיבאץ. et al. 18)-10 מ"ל של פתרון, הוסיפו: 10 מ"ל HEPES מאגר (0.1 M, pH 7.4), 400 מ ג סוכרוז, 12.5 מ ג NiAS, 2 מ ג ציטוכרום C, diaminobenzidine 6 מ ג (DAB).
התראה: DAB ו- NiAS הם חומרים מסרטנים.
הערה: להוסיף DAB ממש לפני דגירה של מקטעים. - לשטוף את המקטעים במאגר HEPES (0.1 M, pH 7.4) על מטרף למשך 15 דקות.
- דגירה בסעיפים הפתרון מכתימים בטמפרטורת החדר על מטרף.
הערה: לבחון את המהירות של צביעה. אם אין תגובה גלויה, לשנות הדגירה ב 37 º C. בהתאם לכמות של קיבעון, צביעת יכול להיות שנצפו לאחר 10 דקות או כמה שעות. - לעצור את התגובה על-ידי הוספת 4% PFA; פעולה זו מונעת מחדש למות לא רצויים, עלייה של רקע אות.
- לשטוף את המקטעים שלושה זמני באמצעות מאגר HEPES למשך 10 דקות.
- הר ויבש הסעיפים בשקופיות זכוכית.
- מייבשים הסעיפים עם שורה הגוברת אלכוהול:
- לשטוף השקופיות 60% אתנול עבור 1 מינימלית שטיפת השקופיות 80% אתנול עבור מינימלית 1 לשטוף את השקופיות אתנול 96% עבור 2 דק. לשטוף את השקופיות 100% אתנול במשך 3 דקות לשטוף את השקופיות ב אלכוהול איזופרופיל עבור 5 דק. לשטוף את השקופיות של קסילן במשך 5 דקות.
- מיד להוסיף אמצעי התקשות-הרכבה מהירה, להוסיף את coverslip. קריטי: אל תשתמש מדיומים גובר על בסיס מים, כפי NiAS יהיה שטף ולבזות ההכתמה.
- לשמור על הסעיפים 4 ° C לאחסון לטווח ארוך.
5. ויזואליזציה של מודולים בקליפת המוח באמצעות נוגדן
הערה: פרוטוקולים מרובים זמינים עבור אימונוהיסטוכימיה, אופטימיזציה עבור הדגימה ואת הסוג של בדיקה. מספרות לקולנוע שניתן יהיה כנדרש, על ידי ריכוזים שונים של נוגדנים, סוכנים permeabilizing ושעות הדגירה. להלן כללי התנהגות מוביל לתוצאות טובות לגילוי מגוון גדול של נוגדנים והדמיה מאת הגששים פלורסנט.
- לשטוף את המקטעים ב- PBS (0.1 M; pH 7.4) למשך 15 דקות.
- אופציונלי: לבצע אחזור אנטיגן לחשוף epitope שימוש באמבט מים (על סמך ג'יאו. et al. 19; שיטות אלטרנטיביות, ראו Pileri. et al. 20).
- מחממים באמבט מים עד 80 ° C. להכין tri-סודיום ציטרט מאגר19 (pH 8.0) ומחממים אותה באמבט מים עד 80 ° C.
- להעביר את המקטעים tri-סודיום ציטרט מאגר. דגירה הסעיפים למשך 30 דקות ב 80 ° C
- מגניב הסעיפים עד לטמפרטורת החדר
- רחץ בסעיפים PBS למשך 15 דקות.
- לשטוף את הסעיפים פעמיים ב- PBS-X (0.5% טריטון-X, ב- PBS 0.1 M) למשך 15 דקות.
- לחסום epitopes לא ספציפי על-ידי המקננת הסעיפים בפתרון של אלבומין שור (BSA; 2.5%), טריטון-X (0.75%) ב- PBS כבר שעתיים.
- דגירה בסעיפים נוגדן ראשוני, למשל, Calbindin - D28k (1:5, 000, 1% BSA ב- PBS-X), 2-3 ימים מטרף-4 מעלות צלזיוס.
הערה: דילול אופטימלית עבור נוגדן ראשוני תלוי נוגדן ספציפי משמש. עיין המידע של היצרן כדי להשיג דילול לקריטריונים נוגדנים ספציפיים. נוגדנים מרובים יכולים לשמש יחד אבל צריך להעלות כנגד מינים שונים. - לשטוף את הסעיפים 3 פעמים ב- PBS למשך 15 דקות כל אחד.
- דגירה מקטעים לילה נוגדנים משניים (1:200, BSA 1% ב- PBS) ב 4 ° C-מטרף.
הערה: מספר נוגדנים משניים ניתן להשתמש ב ספקטרום שונה אם מספר נוגדנים העיקרי שימשו. - לשטוף הנוגדן משני על ידי שטיפת הסעיפים 3 פעמים ב- PBS למשך 10 דקות.
- הר ויבש הסעיפים על משטח זכוכית עבור מיקרוסקופ.
הערה: הסעיפים עדיין צריך להיות לח לפני הרכבה של coverslip. - להחיל בינוני הרכבה מתאים צבעי זריחה על הסעיפים רקמות ולהחיל על coverslip.
- יבש הסעיפים לשעה.
- לאחסון לטווח ארוך, לאטום את coverslip באמצעות לק ולשמור באפלה ב 4 º C.
תוצאות
אנו להשיג חלקים קורטיקליים שעברו שיטוח של קליפת המגע במגוון של המוח, לעבד אותם להסטולוגיה אוקסידאז ציטוכרום להמחיש את המודולים somatotopic המייצגים את חלקי הגוף השונים. גישה השוואתית זו מאפשרת לימוד כוחות האבולוציוני הזה cortex צורה, למשל, מראה מאוד שנשמרת ייצוג mystacial vibrissae ...
Discussion
מודולריות ב קליפת התגלתה תוך שימוש במגוון טכניקות. המודולים המוקדם של קורטיקלית מחקרים בדרך כלל מזוהה גם דמיין תא אזורים צפופים או היעדרות של סיבים1. שיטות עוקבות נעזרו הנוכחות של חבילות דנדריטים24, afferents אזור מסוים25, או העשרה של נוירוטרנסמיטורים
Disclosures
המחברים מצהירים כי המחקר בוצע בהיעדר יחסים מסחריים או פיננסי שיכול להחשב בתור ניגוד אינטרסים פוטנציאליים.
Acknowledgements
עבודה זו נתמך על ידי Humboldt Universität זו ברלין, המרכז ברנשטיין לברלין Neuroscience חישובית, המרכז הגרמנית עבור מחלות ניווניות (DZNE), הגרמני הפדרלי במשרד החינוך, המחקר (BMBF, Förderkennzeichen 01GQ1001A), NeuroCure, של גוטפריד וילהלם לייבניץ פרס DFG. אנו מודים Shimpei אישיאמה לעיצוב גרפי מצוין, ניגן Diederichs לסיוע טכני מעולה.
Materials
| Name | Company | Catalog Number | Comments |
| Cytochrome oxidase staining | |||
| Cytochrome c from equine heart | Sigma-Aldrich | C2506 | |
| 3,3'Diaminobenzidine tetrahydrochloride hydrate | Sigma-Aldrich | D5637 | |
| D(+)-Saccharose | Carl Roth | 4621.1 | |
| Ammonium nickel(II) sulfate hexahydrate | Sigma-Aldrich | A1827 | |
| HEPES | Carl Roth | 9105.4 | |
| Name | Company | Catalog Number | Comments |
| Antigen retrieval | |||
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | |
| Citric acid monohydrate | Sigma-Aldrich | C1909 | |
| Name | Company | Catalog Number | Comments |
| Phosphate buffer/phosphate-buffered saline/prefix/PFA | |||
| Potassium dihydrogen phosphate | Carl Roth | 3904.2 | |
| Sodium chloride | Carl Roth | 9265.1 | |
| Di-Sodium hydrogen phosphate dihydrate | Carl Roth | 4984.3 | |
| Paraformaldehyde | Carl Roth | 0335.3 | |
| TRITON-X 100 | Carl Roth | 3051.3 | |
| Name | Company | Catalog Number | Comments |
| Immunohistochemistry | |||
| Calbindin D-28k puriefied from chicken gut, Mouse monoclonal | Swant | RRID: AB_10000347 | |
| Calbindin D-28k from recombinant rat calbindin D-28k, Rabbit polyclonal | Swant | RRID: AB_10000340 | |
| Albumin Fraction V, biotin free | Carl Roth | 0163.4 | |
| Name | Company | Catalog Number | Comments |
| Mounting or freezing media | |||
| Fluoromount (immunofluorescence) | Sigma-Aldrich | F4680 | |
| Eukitt (histochemistry) | Sigma-Aldrich | 03989 | |
| Tissue freezing medium | Leica Biosystems | NC0696746 | |
| Name | Company | Catalog Number | Comments |
| Alcohol dehydration | |||
| Ethanol 100% | Carl Roth | 9065.3 | |
| Ethanol 96% | Carl Roth | P075.3 | |
| 2-Propanol | Carl Roth | 6752.4 | |
| Xylene substitute | Fluka | 78475 | |
| Name | Company | Catalog Number | Comments |
| Devices/tools | |||
| Microm HM 650V | Thermo Scientific | ||
| Jung RM2035 | Leica Biosystems | ||
| Dumont #55 Forceps - Inox | Fine Science Tools | 11255-20 | |
| Dumont #5 Forceps - Inox Biology Tip | Fine Science Tools | 11252-30 | |
| Dumont #5SF Forceps - Inox Super Fine Tip | Fine Science Tools | 11252-00 | |
| Bone Shears - 24 cm | Fine Science Tools | 16150-24 | |
| Friedman Rongeur | Fine Science Tools | 16000-14 | |
| Blunt Scissors | Fine Science Tools | 14000-18 | |
| Surgical Scissors - Large Loops | Fine Science Tools | 14101-14 | |
| Surgical Scissors - Sharp-Blunt | Fine Science Tools | 14001-13 | |
| Fine Iris Scissors | Fine Science Tools | 14094-11 |
References
- Brodmann, K. . Vergleichende Lokalisationslehre der Grosshirnrinde in ihren Prinzipien dargestellt auf Grund des Zellenbaues. , (1909).
- Naumann, R. K., et al. The reptilian brain. Curr Biol. 25 (8), R317-R321 (2015).
- Kaas, J. H. Evolution of columns, modules, and domains in the neocortex of primates. Proc Natl Acad Sci U S A. 109 (Supplement 1), 10655-10660 (2012).
- Woolsey, T. A., Van der Loos, H. The structural organization of layer IV in the somatosensory region (SI) of mouse cerebral cortex: the description of a cortical field composed of discrete cytoarchitectonic units. Brain Res. 17 (2), 205-242 (1970).
- Naumann, R. K., Ray, S., Prokop, S., Las, L., Heppner, F. L., Brecht, M. Conserved size and periodicity of pyramidal patches in layer 2 of medial/caudal entorhinal cortex. J Comp Neurol. 524 (4), 783-806 (2016).
- Ray, S., Naumann, R., Burgalossi, A., Tang, Q., Schmidt, H., Brecht, M. Grid-layout and theta-modulation of layer 2 pyramidal neurons in medial entorhinal cortex. Science. 343 (6173), 891-896 (2014).
- Wong-Riley, M. T. Cytochrome oxidase: an endogenous metabolic marker for neuronal activity. Trends Neurosci. 12 (3), 94-101 (1989).
- Ray, S., Brecht, M. Structural development and dorsoventral maturation of the medial entorhinal cortex. Elife. 5, e13343 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- . Phosphate-buffered saline (PBS). Cold Spring Harb. Protoc. , (2006).
- Olson, S. T., Chuang, Y. J. Heparin activates antithrombin anticoagulant function by generating new interaction sites (exosites) for blood clotting proteinases. Trends Cardiovasc Med. 12 (8), 331-338 (2002).
- . Paraformaldehyde (PFA; 4%). Cold Spring Harb. Protoc. , (2009).
- . Sodium phosphate (PB). Cold Spring Harb. Protoc. , (2006).
- Sincich, L. C., Adams, D. L., Horton, J. C. Complete flatmounting of the macaque cerebral cortex. Visual Neurosci. 20 (6), 663-686 (2003).
- Tootell, R. B., Silverman, M. S. Two methods for flat-mounting cortical tissue. J Neurosci Methods. 15 (3), 177-190 (1985).
- Rosene, D. L., Roy, N. J., Davis, B. J. A cryoprotection method that facilitates cutting frozen sections of whole monkey brains for histological and histochemical processing without freezing artifact. J Histochem Cytochem. 34 (10), 1301-1315 (1986).
- Wong-Riley, M. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171 (1), 11-28 (1979).
- Divac, I., Mojsilovic-Petrovic, J., López-Figueroa, M. O., Petrovic-Minic, B., Møller, M. Improved contrast in histochemical detection of cytochrome oxidase: metallic ions protocol. J Neurosci Methods. 56 (2), 105-113 (1995).
- Jiao, Y., et al. A simple and sensitive antigen retrieval method for free-floating and slide-mounted tissue sections. J Neurosci Methods. 93 (2), 149-162 (1999).
- Pileri, S. A., et al. Antigen retrieval techniques in immunohistochemistry: comparison of different methods. J Pathol. 183 (1), 116-123 (1997).
- Woolsey, T. A., Welker, C., Schwartz, R. H. Comparative anatomical studies of the SmL face cortex with special reference to the occurrence of "barrels" in layer IV. J Comp Neurol. 164 (1), 79-94 (1975).
- Krubitzer, L. The organization of neocortex in mammals: are species differences really so different?. Trends Neurosci. 18 (9), 408-417 (1995).
- Lauer, S. M., Lenschow, C., Brecht, M. Sexually selected size differences and conserved sexual monomorphism of genital cortex. J Comp Neurol. , (2017).
- Fleischhauer, K., Petsche, H., Wittkowski, W. Vertical bundles of dendrites in the neocortex. Anat Embryol. 136 (2), 213-223 (1972).
- Bernardo, K. L., Woolsey, T. A. Axonal trajectories between mouse somatosensory thalamus and cortex. J Comp Neurol. 258 (4), 542-564 (1987).
- Ray, S., Burgalossi, A., Brecht, M., Naumann, R. K. Complementary Modular Microcircuits of the Rat Medial Entorhinal Cortex. Front Syst Neurosci. 11, (2017).
- Livingstone, M. S., Hubel, D. H. Thalamic inputs to cytochrome oxidase-rich regions in monkey visual cortex. Proc Natl Acad Sci U S A. 79 (19), 6098-6101 (1982).
- Land, P. W., Simons, D. J. Cytochrome oxidase staining in the rat SmI barrel cortex. J Comp Neurol. 238 (2), 225-235 (1985).
- Welker, C., Woolsey, T. A. Structure of layer IV in the somatosensory neocortex of the rat: description and comparison with the mouse. J Comp Neurol. 158 (4), 437-453 (1974).
- Retzius, G. Die Cajal'schen zellen der grosshirnrinde beim menschen und bei säugetieren. Biol Unters. 5, 1-9 (1893).
- Cajal, S. R. . Histologie du Systeme Nerveux de l'Homme et des vertébrés. , (1911).
- Chapin, J. K., Lin, C. S. Mapping the body representation in the SI cortex of anesthetized and awake rats. J Comp Neurol. 229 (2), 199-213 (1984).
- Löwel, S., Freeman, B., Singer, W. Topographic organization of the orientation column system in large flat-mounts of the cat visual cortex: A 2-deoxyglucose study. J Comp Neurol. 255 (3), 401-415 (1987).
- Tang, Q., et al. Functional architecture of the rat parasubiculum. J Neurosci. 36 (7), 2289-2301 (2016).
- Snyder, J. P. . Map projections--A working manual (Vol. 1395). , (1987).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nat Methods. 10 (6), 508-513 (2013).
- Renier, N., Wu, Z., Simon, D. J., Yang, J., Ariel, P., Tessier-Lavigne, M. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved