Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cardiomiopatía Taquicardia-inducida como un modelo de insuficiencia cardíaca crónica en porcino
En este artículo
Resumen
Aquí, presentamos un protocolo para producir cardiomiopatía Taquicardia-inducida en los cerdos. Este modelo representa una manera potente para el estudio de la hemodinámica de la insuficiencia cardíaca crónica progresiva y los efectos del tratamiento aplicado.
Resumen
Un modelo de insuficiencia cardíaca crónica estable y confiable se requiere de muchos experimentos para comprender la hemodinámica o para probar efectos de nuevos métodos de tratamiento. Presentamos un modelo de cardiomiopatía Taquicardia-inducida, que puede ser producida por la estimulación en los cerdos cardiaca rápida.
Un solo cable de estimulación es transvenously introducida en cerdos sanos completamente anestesiados, hasta el ápice del ventrículo derecho y fijado. Su otro extremo entonces es tunelizado dorsalmente a la región paravertebral. Allí, se conecta a una unidad de marcapasos del corazón modificados en que luego se implanta en un bolsillo subcutáneo.
Después de 4-8 semanas de estimulación ventricular rápida en dosis de 200-240 latidos/min, la examinación física reveló signos de insuficiencia cardíaca grave - fatiga, taquipnea y taquicardia sinusal espontánea. Ecocardiografía y rayos x mostraron dilatación de las cámaras del corazón, derrames y disfunción sistólica severa. Estos resultados corresponden bien a la cardiomiopatía dilatada descompensada y también se conservan tras el cese de la estimulación.
Este modelo de la cardiomiopatía Taquicardia-inducida puede ser utilizado para el estudio de la fisiopatología de la insuficiencia cardíaca crónica progresiva, especialmente de los cambios hemodinámicos causados por nuevas modalidades de tratamiento como apoyo circulatorio mecánico. Esta metodología es fácil de realizar y los resultados son sólidos y reproducibles.
Introducción
Es lo que refleja la variedad de nuevos métodos de tratamiento para la insuficiencia cardíaca (IC), especialmente el uso en todo el mundo creciente de soportes circulatorios mecánicos y oxigenación por membrana extracorpórea (ECMO) en la práctica clínica, en pruebas experimentales preclínicos. El objetivo principal ha sido en los cambios hemodinámicos causados por las modalidades de tratamiento examinado, es decir, en la presión arterial sistémica1, contractilidad del miocardio, presión y cambios de volumen en las cámaras del corazón y corazón trabajo2,3, flujo de sangre arterial en sistémicas y periféricas arterias, junto con compensación metabólica4 - saturación del tejido regional, la perfusión pulmonar y gasometría arterial. Otros estudios están dirigidos a efectos a largo plazo de la ayuda circulatoria5, inflamación concomitante o aparición de hemólisis. Todos estos tipos de estudio necesitan un biomodelo estable de la IC congestiva.
La mayoría de los experimentos publicados en izquierda ventricular performance (LV) y hemodinámica de soporte circulatorio mecánico se han realizado en modelos experimentales de agudos HF2,6,7,8 , 9 , 10, o incluso en el corazón totalmente intacto. Por otra parte, en la práctica clínica, soportes circulatorios mecánicos a menudo se están aplicando en un estado de descompensación circulatoria que se desarrolla en los terrenos previamente presente cardiopatía crónica. En estos casos, los mecanismos de adaptación están completamente desarrollados y pueden jugar papeles importantes en la inconsistencia de los resultados observados según la "agudeza o cronicidad" de enfermedad cardiaca subyacente11. Por lo tanto, un modelo estable de la IC crónica puede ofrecer nuevas penetraciones en los mecanismos fisiopatológicos y la hemodinámica. Aunque hay razones por qué el uso de modelos HF crónica es escaso - preparación de mucho tiempo, la inestabilidad del ritmo cardíaco, las cuestiones éticas y tasa de mortalidad - sus ventajas son claras, ya que ofrecen la presencia de la activación neurohumoral a largo plazo, adaptación sistémica general, cambios funcionales de cardiomiocitos y alteraciones estructurales del corazón músculo y válvulas de12,13.
En general, la disponibilidad y variedad de modelos animales para estudios hemodinámicos es amplia y ofrece la opción para muchas necesidades específicas. Para estos experimentos, sobre todo porcinos, caninos, ovinos, o murino de ajustes más pequeños modelos, están siendo elegido y oferta una buena simulación de reacciones corporales humanas esperado14. Además, formas de experimentos de órgano solo se están volviendo más frecuentes15. Para imitar confiablemente la fisiopatología de la IC, la circulación está siendo deteriorada artificialmente. Daño al corazón puede deberse a varios métodos, a menudo por isquemia, arritmias, sobrecarga de presión o efectos cardiotóxicos de las drogas, con ninguno de estos lleva a deterioro hemodinámico del modelo. Para producir un modelo verdadero de la IC crónica, tiempo tiene que ser proporcionado para el desarrollo de la adaptación a largo plazo de todo el organismo. Un modelo confiable y estable es representado bien por cardiomiopatía Taquicardia-inducida (TIC), que puede ser producida por rápido cardiaco en animales de experimentación.
Se ha demostrado que en corazones predispuestos, taquiarritmias incesantes de larga duración pueden conducir a la disfunción sistólica y dilatación con disminución gasto cardiaco. La condición conocida como TIC era primer descrito en 191316, ampliamente utilizado en los experimentos desde 196217y ahora es un desorden conocido. Su origen puede mentir en varios tipos de arritmias - supraventricular y taquicardia ventricular pueden conducir a un deterioro progresivo de la función sistólica, dilatación biventricular y progresivos signos clínicos de la IC, incluyendo ascitis, edemas, letargo y descompensación cardiaca en última instancia conduce a HF terminal y, si no recibe tratamiento, muerte.
Se observaron efectos similares de supresión circulatoria por la introducción de la alta tarifa cardiacas en modelos animales. En un modelo porcino, un pulso atrial o ventricular más de 200 pulsaciones por minuto es lo suficientemente potente como para inducir la fase final HF en un período de 3-5 semanas (fase progresiva) con las características de las TIC, aunque existen diferencias interindividuales18, 19. estos hallazgos corresponden bien a cardiomiopatía descompensada y son, importante, conserva también tras el cese de la estimulación (fase crónica)19,20,21,22, 23.
Porcina, canina, ovina TIC modelos repetidamente se prepararon para el estudio de la fisiopatología de la HF14, como cambios en el LV mímico las características de la miocardiopatía dilatada24. Las características hemodinámicas son bien descritas - aumento ventriculares diastólica final de las presiones, cardíaco disminución de la salida, aumentaron la resistencia vascular sistémica y la dilatación de ambos ventrículos. En cambio, la hipertrofia de la pared no se observa constantemente, y adelgazamiento de la pared incluso fue descrito por algunos investigadores25,26. Con la progresión de dimensiones ventriculares, regurgitación de válvulas auriculoventriculares desarrolla26.
En esta publicación, presentamos un protocolo para producir un TIC por largo plazo rápido establecimiento del paso cardiaco en los cerdos. Este biomodelo representa medios potentes para el estudio de la miocardiopatía dilatada descompensada, hemodinámica de la IC crónica progresiva con bajo gasto cardiaco y los efectos del tratamiento aplicado.
Protocolo
Este protocolo experimental fue revisado y aprobado por el Comité de expertos de Animal institucional en la primera facultad de medicina de la Universidad de Charles y fue realizado en el laboratorio experimental de Universidad, Departamento de fisiología, primera facultad de Medicina, Universidad de Charles en Praga, República Checa, según acta Nº 246/1992, Recop., sobre la protección de animales contra la crueldad. Todos los animales fueron tratados y atendidos según la guía para el cuidado y uso de animales de laboratorio, 8ª edición, publicado por la prensa nacional de Academias, 2011. Todos los procedimientos fueron realizados según estándar convenciones de veterinaria y en la realización de cada estudio, el animal fue sacrificado y una necropsia. Debido a la anatomía adecuada, cinco saludables cruza hembra porcina (Sus scrofa domestica) hasta 6 meses de edad fueron incluidos en este experimento. Su peso corporal promedio fue de 66 ± 20 kg en el día de recogida de datos.
1. anestesia general
- Después de 1 día de ayuno, iniciar anestesia la administración intramuscular de midazolam (0.3 mg/kg) y ketamina clorhidrato (15-20 mg/kg) a la región glútea.
- Inserte la cánula periférica en la vena marginal de la oreja para los usos de drogas por vía intravenosa.
- Administrar bolos intravenosos de propofol (2 mg/kg) y morfina (0.1 - 0.2 mg/kg).
- Proporcione oxígeno mediante una máscara facial y avance orotraqueal intubación con un tubo endotraqueal con manguito con un diámetro de 6.5-7.5 mm a animales.
- Continuar la anestesia intravenosa total por la combinación de propofol (6-12 mg/kg/h), midazolam (0.1 - 0.2 mg/kg/h) y la morfina (0.1 - 0.2 mg/kg/h), ajuste las dosis según las respuestas individuales - suprimir la respiración espontánea, reflejos corneales, y respuesta motora. Proteger los ojos del animal con ungüento para evitar la sequedad.
- Funcionar la ventilación mecánica por un dispositivo automático de circuito cerrado, ajustado a la ventilación de soporte adaptable para mantener destino fin-de marea del CO2 de 38-42 mmHg y la saturación de hemoglobina adecuada de 95-99%. Supervisar todas las funciones vitales, especialmente la frecuencia cardíaca y temperatura corporal.
- Sujete al animal por asegurar sus piernas suavemente a la tabla de operación en la posición supina.
- Administrar antibióticos de amplio espectro - 1 g de cefazolina por vía intravenosa a través de la cánula de la vena de la oreja.
2. implantación de plomo ventricular
- Localizar sitios quirúrgicos y afeitarse la piel correctamente utilizando una maquinilla de afeitar (1) la región yugular sobre el músculo esternocleidomastoideo y (2) la región paravertebral unilateral en la parte posterior del cuello del animal.
- Utilizando la sonda de ultrasonido vascular, visualizar la vena yugular externa y marcar su localización en la piel. Localizar la arteria carótida así como para evitar su lesión.
- Después de la desinfección de la piel amplia utilizando yodo povidona, cubierta con un paño quirúrgico estéril con el orificio sobre la región yugular marcada.
- Preparar todas las herramientas necesarias para la implantación de marcapasos y mantenerlos estériles. Es crucial mantener un ambiente estéril durante el procedimiento.
- Cortar la piel paralelo por encima de la vena yugular externa, forma un bolsillo subcutáneo superficial en tejidos blandos no más de 10 mm de profundidad. No exponga cualquier vasos grandes.
- Desde el fondo de la cavidad preformada, inserte una vaina en la vena yugular externa, mediante la técnica de Seldinger estándar. En primer lugar, inserte una guía de punta suave a través de una aguja de punción 12G y luego sobre la guía presentar un desgarro plástico 7 francés lejos introductor con dilatador.
- Bajo guía fluoroscópica, introducir un 58 cm estimulación plomo a través de esta vaina y colocar su punta en el ápice del ventrículo derecho. Luego, retirar la vaina y para fijar la punta activa del electrodo en el miocardio, girando hacia fuera de su hélice.
- Comprobar los parámetros de estimulación - la señal detectada del plomo de electrocardiograma ventricular e impedancia debe ser estable, el umbral de estimulación debe estar debajo de una amplitud de 1 V con 0,4 ms de duración del pulso.
- Un manguito de goma tirando el cable de estimulación y fijar ambos juntos en la parte inferior del bolsillo subcutáneo yugular preformado de dos puntadas de hilo de sutura no absorbible trenzada. Lo importante, suficiente longitud del cable de estimulación se debe insertar, teniendo en cuenta el posible crecimiento futuro del animal.
3. subcutáneo plomo el hacer un túnel
- Entregar el animal a su lado y desinfectar la piel previamente afeitada región lateral a la espina dorsal, luego cubrir con un paño quirúrgico estéril con un agujero. Asegúrese de que el bolsillo subcutáneo yugular y el cable permanecen estériles.
- Cortar la piel lateral a la columna vertebral y forman un bolsillo subcutáneo, espacioso y profundo. Uso preparación embotado y detener cualquier sangrado posible.
- Tomar un tubo de extensión de goma suave de una infusión estéril establecer y cortar ambos extremos de sus. Utilizando una herramienta de efecto túnel, un túnel subcutáneo directo conectando los bolsillos subcutáneos yugulares y dorsales con este tubo de extensión de preformas.
- Conecte extremo libre del tubo la ventricular tirando en su conector IS-1 y sacar el cable a través del túnel preformado en el bolsillo subcutáneo dorsal tirando el tubo dorsal. Puede ser útil garantizar la conexión con una corbata de seda.
- Retire la herramienta de túnel y el tubo de extensión, exponiendo el electrodo ventricular desde la bolsa subcutánea dorsal.
4. implantación de marcapasos
- Configurar la unidad de marcapasos implantables de doble cámara de corazón con la "Y" parte de conexión. La conexión "Y" permite una conexión convergente de ambos marcapasos salidas se unió y conectados juntos a la estimulación solo plomo (figura 1 y figura 2). Esta configuración más adelante ofrecerá una amplia gama de frecuencias de estimulación.
- Después de conectar el cable de estimulación, apriete todos los tornillos de conexión de la IS-1 en la unidad de cabecera de marcapasos y la conexión del cable "Y".
- Ocultar todo el sistema en el bolsillo dorsal profunda de estimulación. Debe haber suficiente espacio para acomodar la unidad de marcapasos y cualquier plomo redundante.
- Comprobar los parámetros de estimulación finales. Asegúrese de que es posible tanto salidas de marcapasos de estimulación ventricular cardiaca.
- Lavar con povidona yodada y cerrar dos bolsillos subcutáneos. Uso absorbible trenzado hilo para suturar las capas de tejido fibroso y sutura no absorbible de adaptación de la piel.
5. posoperatorio cuidado
- Observar cuidadosamente al animal hasta que recupere conciencia suficiente.
- Continuar en un régimen de antibióticos intravenosos de amplio espectro hasta que sanen las heridas - cefazolina 1 g cada analgésicos de 12 h. administrar en caso de dosificación, por ejemplo, morfina 0,2 mg/kg cada 6-12 h durante 3 días por inyección subcutánea. Si es necesario, hacer ajustes de dosis para prevenir adecuadamente el dolor.
- Coloque el animal en un establecimiento cómodo y tranquilo a temperatura ambiente. Permitir el libre acceso a agua y alimentación adecuada.
- Vestido de las heridas con peelings estériles regularmente para preservar la curación limpia.
- Para proporcionar reposo después del procedimiento quirúrgico, mantenga al marcapasos inhibido por el ritmo del corazón nativo durante al menos 3 días.
- Retire las suturas no absorbibles de piel cuando sanado completamente, aproximadamente 10-14 días después del procedimiento.
6. Protocolo de estimulación
- Iniciar el protocolo de estimulación después de un período adecuado de descanso. Inicialmente, aumentar la frecuencia ventricular ritmo de corazón a 200 latidos/min estableciendo los marcapasos de doble cámara en modo D00 100 lat/min y concomitante ajuste el retraso AV a 300 ms (para coincidir exactamente con el ritmo ritmo intervalo, ver tabla 1). Seleccione la estimulación unipolar en ambas salidas.
- Aumentar paso a paso el ritmo cardíaco a 220 lat/min después de 1 semana y 240 lat/min después de 2 semanas (figura 3). Mantener continua la estimulación en esta frecuencia a menos que no es tolerada hemodinámicamente. Si el HF progresa demasiado rápido, reducir el ritmo cardíaco antes de aumentar nuevamente después de otra semana.
- Utilice auscultación del latido cardiaco, ECG y marcapasos interrogatorio diario para verificar la frecuencia cardíaca y la constante estimulación de los parámetros, incluida la duración de la batería.
7. insuficiencia cardíaca inducción y seguimiento
- Un cuidado regular de un veterinario especializado y supervisar el estado de salud general del animal. Observaciones clínicas de aumento de corazón nativo y tasas respiratorias, evaluación de la oximetría de pulso periférico y la reducción en la actividad física espontánea o apetito proporcionan información sobre la progresión de la HF.
- Utilizar la ventaja de interrogatorio marcapasos transcutáneo sin hilos y, si es posible, registro continuo de ECG - taquicardias ventriculares no sostenidas frecuentes (VT) son un signo de progresión severa de la HF.
- Utilizar evaluaciones ecocardiográficas para revelar los cambios estructurales y funcionales del corazón. Prestar atención a encontrar una ventana de imagen óptima según la anatomía porcina y dilatación del corazón - para una vista de 4 cámara típico, colocar el transductor a la derecha justo debajo del xifoides y ángulo al punto en el cuello o el hombro izquierdo. Vistas del eje corto, use windows intercostales. Reducción de la fracción de eyección ventricular en ritmo del corazón nativo y las regurgitaciones auriculoventriculares debe ser visibles después de un par de semanas.
Nota: Existen diferencias interindividuales de tolerancia estimulación ventricular de alta tasa. Por lo tanto, es necesario monitoreo frecuente y ajuste individualmente adaptado del Protocolo de estimulación.

Figura 1: esquema unidad estimulación del corazón. Los marcapasos de doble cámara (1), un adaptador en forma de "Y" (2) realización de convergently tanto salidas de marcapasos para una única estimulación plomo (3). La punta del cable está fijada en la parte apical de la cavidad de RV (4). Esta configuración proporciona una amplia gama de frecuencias de estimulación alta. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Unidad de marcapasos del corazón (A) la radiografía y fotografía (B) de los marcapasos de doble cámara (1), en forma de "Y" adaptador (2), y el establecimiento del paso ventricular plomo (3). Haga clic aquí para ver una versión más grande de esta figura.
| HORA deseada | Tipo de sistema de marcapasos | Ritmo ritmo intervalo |
| lat/min | lat/min | MS |
| 200 | 100 | 300 |
| 220 | 110 | 270 |
| 240 | 120 | 250 |
| 250 | 125 | 240 |
Tabla 1: parámetros de marcapasos. Para permitir alta tasa cardiaca la estimulación con la unidad implantada marcapasos del dual-compartimiento modificado de casa en, la tabla muestra la deseada al ritmo cardíaco (HR) y el ritmo correspondiente a valores de intervalo de ritmo. El marcapasos debe establecerse en modo de operación D00 a una tasa de la mitad de la hora deseada, y el retraso AV ajustar al ritmo correspondiente a ritmo intervalo en milisegundos.
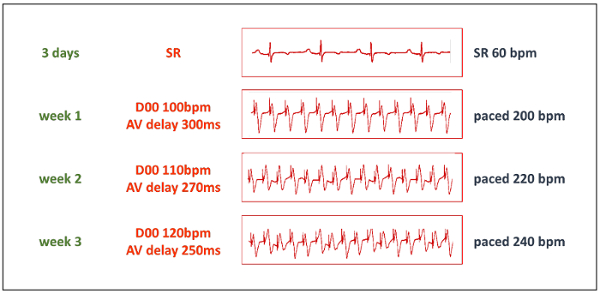
Figura 3 : Protocolo de estimulación. La fase progresiva de la inducción TIC comienza después de un período de descanso de 3 días. Entonces, el marcapasos se encuentra en modo D00 con una frecuencia de estimulación de 50% de la frecuencia al ritmo deseado, y retraso AV se establece en el ritmo de juego a ritmo de intervalo (ver tabla 1). Gracias al adaptador en forma de "Y", ambas salidas de marcapasos se realizan a un solo cable de estimulación. BPM = beats por minuto. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
El modelo de la prueba: Después de signos de la IC crónica descompensada llegó a ser prominentes, anestesia y la ventilación artificial se administraron nuevamente siguiendo los principios descritos anteriormente, pero dosificación fue ajustada debido a la baja cardiaco salida27. Debido a la posible cardiodepressive efectos de la anestesia, cuidado intensivo monitoreo de funciones vitales es necesario.
Discusión
ICC es un importante problema de salud que contribuye en gran medida a la morbilidad y mortalidad. La patogénesis y progresión de la IC en los seres humanos es compleja, por lo que un modelo animal apropiado es esencial para investigar los mecanismos subyacentes y para probar terapias novedosas que pretenden interferir en la progresión de la enfermedad de graves materna. Para el estudio de su patogénesis, se utilizan modelos animales grandes para pruebas experimentales.
En general, los mod...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por becas de investigación de la Universidad GA Reino Unido nº 538216 y GA Reino Unido nº 1114213.
Materiales
| Name | Company | Catalog Number | Comments |
| Medication | |||
| midazolam | Roche | Dormicum | anesthetic |
| ketamine hydrochloride | Richter Gedeon | Calypsol | anesthetic |
| propofol | B.Braun | Propofol | anesthetic |
| cefazolin | Medochemie | Azepo | antibiotic |
| Silver Aluminium Aerosol | Henry Schein | 9003273 | tincture |
| povidone iodine | Egis Praha | Betadine | disinfection |
| morphine | Biotika Bohemia | Morphin 1% inj | analgetic |
| Tools | |||
| Metzenbaum scissors, lancet with #22 blade, DeBakey forceps, needle driver | basic surgical equipment | ||
| cauterizer | |||
| 2-0 Vicryl | Ethicon | V323H | absorbable braided suture |
| 2-0 Perma-Hand Silk | Ethicon | A185H | silk tie suture |
| 2-0 Prolene | Ethicon | 8433H | non-absorbable suture |
| Diagnostic devices | |||
| ESP C-arm | GE Healthcare | ESP | X-ray fluoro C-arm |
| Acuson x300 | Siemens Healthcare | ultrasound system | |
| Acuson P5-1 | Siemens Healthcare | echocardiographic probe | |
| Acuson VF10-5 | Siemens Healthcare | sonographic vascular probe | |
| 3PSB, 4PSB and 6PSB | Transonic Systems | perivascular flow probes | |
| TS420 | Transonic Systems | perivascular flow module | |
| TruWave | Edwards Lifesciences | T001660A | fluid-filled pressure transducer |
| 7.0F VSL Pigtail | Transonic Systems | pressure sensor catheter | |
| INVOS 5100C Cerebral/Somatic Oximeter | Somanetics/Medtronic | near infrared spectroscopy | |
| CCO Combo Catheter | Edwards Lifesciences | 744F75 | Swan-Ganz pulmonary artery catheter |
| Vigillace II | Edwards Lifesciences | VIG2E | cardiac output monitor |
| 7.0F VSL Pigtail | Transonic Systems | pressure-volume catheter | |
| ADV500 | Transonic Systems | pressure-volume system | |
| LabChart and PowerLab | ADInstruments | data acquisition and analysis system | |
| Prism 6 | GraphPad | statistical analysis software | |
| Pacing devices | |||
| ICS 3000 | Biotronic | 349528 | pacemaker programmer |
| ERA 3000 | Biotronic | 128828 | external pacemaker |
| Effecta DR | Biotronic | 371199 | dual-chamber pacemaker |
| Tendril STS | St. Jude Medical | 2088TC/58 | ventricular pacing lead |
| Lead permanent adapter | Osypka | Article 53422 | convergent "Y" connecting part |
| Lead permanent adapter | Osypka | Article 53904 | convergent "Y" connecting part |
| Tear-Away Introducer 7F | B.Braun | 5210593 | tear away introducer sheath |
| Split Cath Tunneler | medComp | AST-L | tunneling tool |
| infusion line | MPH Medical Devices | 2200045 | connecting line |
Referencias
- Ostadal, P., et al. Direct comparison of percutaneous circulatory support systems in specific hemodynamic conditions in a porcine model. Circ Arrhythm Electrophysiol. 5 (6), 1202-1206 (2012).
- Ostadal, P., et al. Increasing venoarterial extracorporeal membrane oxygenation flow negatively affects left ventricular performance in a porcine model of cardiogenic shock. J Transl Med. 13, 266 (2015).
- Shen, I., et al. Left ventricular dysfunction during extracorporeal membrane oxygenation in a hypoxemic swine model. Ann Thorac Surg. 71 (3), 868-871 (2001).
- Hala, P., et al. Regional tissue oximetry reflects changes in arterial flow in porcine chronic heart failure treated with venoarterial extracorporeal membrane oxygenation. Physiol Res. 65 (Supplementum 5), S621-S631 (2016).
- Church, J. T., et al. Normothermic Ex-Vivo Heart Perfusion: Effects of Live Animal Blood and Plasma Cross-Circulation. ASAIO J. , (2017).
- Bavaria, J. E., et al. Changes in left ventricular systolic wall stress during biventricular circulatory assistance. Ann Thorac Surg. 45 (5), 526-532 (1988).
- Shen, I., et al. Effect of extracorporeal membrane oxygenation on left ventricular function of swine. Ann Thorac Surg. 71 (3), 862-867 (2001).
- Ostadal, P., et al. Novel porcine model of acute severe cardiogenic shock developed by upper-body hypoxia. Physiol Res. 65 (4), 711-715 (2016).
- Ostadal, P., et al. Noninvasive assessment of hemodynamic variables using near-infrared spectroscopy in patients experiencing cardiogenic shock and individuals undergoing venoarterial extracorporeal membrane oxygenation. J Crit Care. 29 (4), e611-e695 (2014).
- Mlcek, M., et al. Hemodynamic and metabolic parameters during prolonged cardiac arrest and reperfusion by extracorporeal circulation. Physiol Res. 61 (Suppl 2), S57-S65 (2012).
- Tarzia, V., et al. Extracorporeal life support in cardiogenic shock: Impact of acute versus chronic etiology on outcome. J Thorac Cardiovasc Surg. 150 (2), 333-340 (2015).
- Howard, R. J., Stopps, T. P., Moe, G. W., Gotlieb, A., Armstrong, P. W. Recovery from heart failure: structural and functional analysis in a canine model. Can J Physiol Pharmacol. 66 (12), 1505-1512 (1988).
- Moe, G. W., Armstrong, P. Pacing-induced heart failure: a model to study the mechanism of disease progression and novel therapy in heart failure. Cardiovasc Res. 42 (3), 591-599 (1999).
- Power, J. M., Tonkin, A. M. Large animal models of heart failure. Aust N Z J Med. 29 (3), 395-402 (1999).
- Trahanas, J. M., et al. Achieving 12 Hour Normothermic Ex Situ Heart Perfusion: An Experience of 40 Porcine Hearts. ASAIO J. 62 (4), 470-476 (2016).
- Gossage, A. M., Braxton Hicks, J. A. On auricular fibrillation. Quarterly Journal of Medicine. 6, 435-440 (1913).
- Whipple, G. H., Sheffield, L. T., Woodman, E. G., Theophilis, C., Friedman, S. Reversible congestive heart failure due to chronic rapid stimulation of the normal heart. Proceedings of the New England Cardiovascular Society. 20 (1), 39-40 (1962).
- Spinale, F. G., Grine, R. C., Tempel, G. E., Crawford, F. A., Zile, M. R. Alterations in the myocardial capillary vasculature accompany tachycardia-induced cardiomyopathy. Basic Res Cardiol. 87 (1), 65-79 (1992).
- Shinbane, J. S., et al. Tachycardia-induced cardiomyopathy: a review of animal models and clinical studies. J Am Coll Cardiol. 29 (4), 709-715 (1997).
- Moe, G. W., Stopps, T. P., Howard, R. J., Armstrong, P. W. Early recovery from heart failure: insights into the pathogenesis of experimental chronic pacing-induced heart failure. J Lab Clin Med. 112 (4), 426-432 (1988).
- Takagaki, M., et al. Induction and maintenance of an experimental model of severe cardiomyopathy with a novel protocol of rapid ventricular pacing. J Thorac Cardiovasc Surg. 123 (3), 544-549 (2002).
- Tomita, M., Spinale, F. G., Crawford, F. A., Zile, M. R. Changes in left ventricular volume, mass, and function during the development and regression of supraventricular tachycardia-induced cardiomyopathy. Disparity between recovery of systolic versus diastolic function. Circulation. 83 (2), 635-644 (1991).
- Schmitto, J. D., et al. Large animal models of chronic heart failure (CHF). J Surg Res. 166 (1), 131-137 (2011).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259 (1 Pt 2), H218-H229 (1990).
- Chow, E., Woodard, J. C., Farrar, D. J. Rapid ventricular pacing in pigs: an experimental model of congestive heart failure. Am J Physiol. 258 (5 Pt 2), H1603-H1605 (1990).
- Howard, R. J., Moe, G. W., Armstrong, P. W. Sequential echocardiographic-Doppler assessment of left ventricular remodelling and mitral regurgitation during evolving experimental heart failure. Cardiovasc Res. 25 (6), 468-474 (1991).
- Roberts, F., Freshwater-Turner, D. Pharmacokinetics and anaesthesia. Contin Educ Anaesth Crit Care Pain. 7 (1), 25-29 (2007).
- Carter, B. S., Farrell, C., Owen, C. Microsurgical clip obliteration of middle cerebral aneurysm using intraoperative flow assessment. J Vis Exp. (31), (2009).
- Wolf, M., Ferrari, M., Quaresima, V. Progress of near-infrared spectroscopy and topography for brain and muscle clinical applications. J Biomed Opt. 12 (6), 062104 (2007).
- Mateu Campos, M. L., et al. Techniques available for hemodynamic monitoring. Advantages and limitations. Med Intensiva. 36 (6), 434-444 (2012).
- Baan, J., et al. Continuous measurement of left ventricular volume in animals and humans by conductance catheter. Circulation. 70 (5), 812-823 (1984).
- Ellenbroek, G. H., et al. Primary Outcome Assessment in a Pig Model of Acute Myocardial Infarction. J Vis Exp. (116), (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. J Vis Exp. (111), (2016).
- van Hout, G. P., et al. Admittance-based pressure-volume loops versus gold standard cardiac magnetic resonance imaging in a porcine model of myocardial infarction. Physiol Rep. 2 (4), e00287 (2014).
- Kass, D. A., et al. Comparative influence of load versus inotropic states on indexes of ventricular contractility: experimental and theoretical analysis based on pressure-volume relationships. Circulation. 76 (6), 1422-1436 (1987).
- Glower, D. D., et al. Linearity of the Frank-Starling relationship in the intact heart: the concept of preload recruitable stroke work. Circulation. 71 (5), 994-1009 (1985).
- Hendrick, D. A., Smith, A. C., Kratz, J. M., Crawford, F. A., Spinale, F. G. The pig as a model of tachycardia and dilated cardiomyopathy. Lab Anim Sci. 40 (5), 495-501 (1990).
- Wyler, F., et al. The Gottinger minipig as a laboratory animal. 5. Communication: cardiac output, its regional distribution and organ blood flow (author's transl). Res Exp Med (Berl). 175 (1), 31-36 (1979).
- Cruz, F. E., et al. Reversibility of tachycardia-induced cardiomyopathy after cure of incessant supraventricular tachycardia. J Am Coll Cardiol. 16 (3), 739-744 (1990).
- Umana, E., Solares, C. A., Alpert, M. A. Tachycardia-induced cardiomyopathy. Am J Med. 114 (1), 51-55 (2003).
- Dixon, J. A., Spinale, F. G. Large animal models of heart failure: a critical link in the translation of basic science to clinical practice. Circ Heart Fail. 2 (3), 262-271 (2009).
- Xanthos, T., et al. Baseline hemodynamics in anesthetized landrace-large white swine: reference values for research in cardiac arrest and cardiopulmonary resuscitation models. J Am Assoc Lab Anim Sci. 46 (5), 21-25 (2007).
- Little, W. C. Diastolic dysfunction beyond distensibility: adverse effects of ventricular dilatation. Circulation. 112 (19), 2888-2890 (2005).
- Montgomery, C., Hamilton, N., Ianuzzo, C. D. Effects of different rates of cardiac pacing on rat myocardial energy status. Mol Cell Biochem. 102 (2), 95-100 (1991).
- Qin, F., Shite, J., Mao, W., Liang, C. S. Selegiline attenuates cardiac oxidative stress and apoptosis in heart failure: association with improvement of cardiac function. Eur J Pharmacol. 461 (2-3), 149-158 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados