JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Widefield 형광 현미경을 사용 하 여 Mechanobiology 연구에 대 한 부드러운 실리콘 기판의 강성 측정
요약
Kilopascal 범위에 있는 강성과 기판은 순수 관련 마이크로 환경 강성을 세포의 반응을 유용 합니다. Widefield 형광 현미경을 사용 하 여, 소프트 실리콘 젤의 영의 계수는 들여쓰기를 사용 하 여 적합 한 영역을 확인할 수 있습니다.
초록
인간의 신체에서 부드러운 조직 일반적으로 kilopascal (kPa) 범위에 강성을 있다. 따라서, 실리콘 및 히드로 유연한 기판 경작 조건 비보에 부분적으로 모방 하는 실제 microenvironment에서 셀에 대 한 유용한 기판 될 입증 되었습니다. 여기, 우리가 영의 계수 등방성 선형 탄성 기판 mechanobiology 연구에 일반적으로 사용의 특성화에 대 한 간단한 프로토콜 제시. 준비 하는 페 트리 접시 또는 뻣 뻣 한 실리콘에 부드러운 실리콘 기판, 형광 구슬 실리콘 기판의 윗 표면 코팅,는 형광 이미징 (중력)에 의해 상면을 밀리미터 단위 구체를 사용 하 여 프로토콜 구성 들여쓰기 실리콘에 구슬 표면 형광 현미경을 사용 하 여 및 실리콘 기판의 영의 계수 계산 결과 이미지를 분석 합니다. 기판의 상면 (형광 구슬) 뿐만 아니라 응용 세포 외 기질 단백질 커플링 실리콘 기판을 셀 도금 및 견인 힘 현미경 실험을 사용 하 여 후속 연구에 쉽게 사용할 수 있습니다. 부드러운 실리콘 베이스로 페 트리 접시 대신 뻣 뻣 한 실리콘의 사용을 외부 뻗 기를 포함 하는 mechanobiology 연구를 사용 하 여 수 있습니다. 이 프로토콜의 구체적인 장점은 많은 실험실에서 일반적으로 사용할 수 있는 widefield 형광 현미경,이 절차에 필요한 주요 장비입니다. 우리는 다른 탄성 계수의 부드러운 실리콘 기판의 영의 계수를 측정 하 여이 프로토콜을 보여 줍니다.
서문
부드러운 조직에 세포의 강성은 kilopascal 범위1, 누구의 강성은 몇 배나 더 높은 조직 문화 요리 달리 마이크로-환경에 거주. 세포 외 기질 단백질 코팅 부드러운 기판에 초기 실험 기판 강성 영향 어떻게 세포 이동으로2,3아래 기질을 보여주었다. 사실, 기판 강성 근본적으로 영향을 퍼지는 생 화 확 적인 신호를 유사한 방식으로 셀 기능4 . (세포 외 기질 단백질 코팅) polyacrylamide 젤은 (물 permeating) hydrogels mechanobiology 연구5대 문화 기질 세포로 광범위 하 게 사용 되었습니다. 입니다 (PDMS), 가장 일반적인 실리콘 (polysiloxane), 널리 사용 되었습니다 뻣 뻣 한 실리콘으로 megapascal 범위 강성과 마이크론 스케일 제조6. 더 최근에, 소프트 실리콘 기판 더 순수 관련 kilopascal 범위에서 경직 된 mechanobiology 연구7,8셀 문화 기판으로 고용 되었습니다.
여러 가지 방법은 유연한 기판, 원자 힘 현미경 검사 법, 스트레칭, 유동성, 및 들여쓰기 영역을 사용 하 고 둥글게 밀고 microindentors9 시 전체 샘플의 거시적인 변형 등의 강성을 측정 하는 데 사용 되었습니다. . 각 기술에는 그것의 자신의 이점 및 불리, 구체와 들여쓰기만 widefield 형광 현미경에 액세스 해야 하는 특히 단순 하지만 상당히 정확한 방법입니다. 금속 구체와 들여쓰기 hydrogels 이전 작업3,,910의 강성을 측정 하기 위해 사용 되었습니다. 셀 운동 기판 강성의 중요성을 설명 하는 초기 작업 히드로 기판 강성3를 결정 하는이 방법을 활용. 더 최근에, confocal 현미경 검사 법 또한 우아한 특성10에 대 한 사용 되었습니다.
여기, 우리 제시 부드러운 실리콘 기판 준비 단계별 프로토콜 형광 구슬 커플링 (과 콜라겐과 같은 세포 외 기질 단백질 나) 상단 표면에 단지 단계 들여쓰기 구와 최고 표면 사용 하 여 이미징 및 형광 이미징, 각각, 그리고 마지막으로 실리콘 기판의 영의 계수를 계산 하기 위해 이미지를 분석. 이 방식으로 준비 하는 부드러운 실리콘 기판 견인 힘 현미경 실험에 대 한 쉽게 사용할 수 있습니다. 부드러운 실리콘 기반으로 (배양 접시) 대신 뻣 뻣 한 실리콘의 사용은 또한 mechanobiology 연구를 외부 뻗 기를 사용 하 여 수 있습니다. 보증, 어디 가능한 합병증 방지에 필요한 실용적인 고려 사항 또한 표시 됩니다.
프로토콜
1입니다. 부드러운 실리콘 기판의 제작
- 1.75 g A 구성 요소 및 B 구성 요소의 1.75 g으로 무게 (A:B = 1:1) 부드러운 실리콘 엘라 스토 머 키트 (폴리스 티 렌)를 사용 하 여 트레이 무게.
- A 구성 요소 무게 트레이에 B 구성 요소에 추가 하 고 적절 한 주걱 스틱을 사용 하 여 5 분 동안 함께 그들을 섞는다.
- 35 mm 페 트리 접시 위의 혼합물을 추가 합니다. 몇 분 동안 배양 접시에 걸쳐 균등 하 게 확산 혼합물을 허용 한다.
참고: 페 트리 접시 지름과 부드러운 실리콘의 양을 부드러운 실리콘 두께 결정 합니다. 여기, 두께 약 3.5 m m; 될 것입니다. 토론 섹션에서 고무 두께 선택 하는 것에 대 한 더 많은. - 모든 기포를 제거 하려면 15 분 동안 진공 챔버에, 뚜껑 실리콘 혼합물으로 페 트리 접시를 놓습니다. 이 시간 동안 미리 70 ° c 뜨거운 접시가 열
- 핫 플레이트에는 70 ° C에 도달 하면, 유리 슬라이드에 놓고 유리 슬라이드에 실리콘 혼합물으로 페 트리 접시를 놓습니다. 실리콘을 하자 30 분 동안 70 ° C에서 치료. 로 페 트리 접시 녹아 있습니다 핫 플레이트에 직접 폴리스 티 렌 접시를 배치 하지 마십시오.
2. 부드러운 실리콘에 형광 Microbeads 커플링
- (발견된 페 트리 접시)에 치유 부드러운 실리콘 깊은 UV 챔버 (185 및 254 nm의 빛 파장의 깊은 UV 램프와 인클로저)에 배치 합니다. 부드러운 실리콘 샘플 (UV 램프에서 ~ 5-10 cm) 5 분에 대 한 깊은 자외선 노출.
- 실리콘 깊은 자외선에 노출 되는, 아래 단계 2.2-2.6와 함께 진행 합니다. 깊은 자외선 노출 후 샘플을 검색 하기 전에 적어도 5 분 동안 깊은 UV 챔버를 드.
- 한편, 19 mg microcentrifuge 1.5 mL 튜브에 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDC)의 밖으로 무게 하 고 그것에 이온된 수 (DI) 물 500 μ를 추가 합니다. 부드럽게 튜브를 떨고 하 여 EDC를 분해.
- 별도 1.5 mL microcentrifuge 튜브, 11 mg N-hydroxysulfosuccinimide (sulfo NHS)의 밖으로 무게, 디 물 500 μ를 추가 하 고 부드럽게 튜브를 떨고 sulfo NHS를 해산. 그런 다음, 단일 microcentrifuge 튜브에 EDC sulfo NHS 솔루션 결합.
- 이 EDC/sulfo NHS 솔루션 (1 %w / v 재고 농도)와 30 μ 0.44 μ m 직경 빨간색 (또는 필터 큐브 형광 현미경에서 사용할 수에 따라 다른 형광 색)의 수정 카복실산 형광 microbeads을 추가 합니다.
- EDC/sulfo NHS/비드 혼합물에 추가 하는 콜라겐의 0.02 m g (쥐 꼬리, 0.02 M 초 산에 4 mg/mL의 재고 농도)에서 나 약 0.02 mg/mL의 농도를.
- EDC/NHS/구슬/콜라겐 소용돌이 나 구슬 결합 하기 전에,에 걸쳐 균등 하 게 분산은 되도록 짧게 혼합물.
- 플라스틱 EDC/NHS/구슬/콜라겐의 1 mL 나 혼합물 parafilm 다른 얕은, 평면 뚜껑 (작은 직경)의 상단에 배치의 조각에. 반전이 혼합물에 부드러운 실리콘 페 트리 접시는 부드러운 실리콘 표면 혼합물을 연결 하지만 아래 작은 페 트리 접시의 뚜껑의 표면을 직접 만지지 않는다. 거꾸로 페 트리 접시 스페이서의 양쪽에서 하나 또는 두 개의 유리 슬라이드를 사용 하 여 거꾸로 페 트리 접시, 인상.
참고: 그림 1 단계 2.7를 수행 하는 방법을 볼 수를 참조 하십시오. - 알루미늄 호 일 샘플을 커버 하 고 30 분 동안 실내 온도에 그것을 품 어.
- 부드러운 실리콘 페 트리 접시를 제거 하 고 그것을 똑바로 설정 (실리콘-쪽).
- 접시에 PBS (pH 7.4)의 2 개 mL를 추가 하 여 인산 염 버퍼 식 염 수 (PBS)와 부드러운 실리콘 표면 세척. 몇 분 동안 앉아 보자. PBS에서 aspirate 그리고 2 mL의 PBS로 다시 실리콘 세척. 실리콘 추가 대 한 치료는 하루에 대 한 하자. 그 이유로 장소 부드러운 실리콘 샘플 PBS에서 37 ° C에서 하룻밤.
3. Widefield 형광 현미경을 사용 하 여 영역 들여쓰기와 실리콘 강성 측정
- 부드러운 실리콘 페 트리 접시를 검색 하 고 실리콘 표면 액체 표면 아래 몇 mm을 PBS의 1 mL 이상 포함 되어 있는지 확인 합니다.
- 날카로운된 핀셋을 사용 하 여, 부드러운 실리콘에 5 1 m m 지르코늄 구체 indentors 드롭. 액체 매체에 구체를 담가 그리고 실리콘 레이어 및 다른 indentors의 위치에서 적어도 5 indentor 직경의 가장자리에서 그들을 드롭.
참고: 액체 표면 위에 떨어졌다 구체 실패할 수 있습니다 액체 매체 (부동 소수점) 입력 액체 매체의 표면 장력 때문. - 기본 페 트리 접시를 통해 이미지 수 있도록 현미경 스테이지에 부드러운 실리콘 페 트리 접시를 놓습니다.
- 10 X 목표 단계 이미지를 사용 하 여 (건조 10 X 같은 나 0.30의 객관적인), 찾아서 초점으로 구체 indentor를가지고.
- 부품의 단계 이미지는 indentor의 전부를가지고 고이 이미지를 저장. 타일 스캔을 사용 하 여 사용 가능한 경우. 어떤 눈에 보이는 결점에서 indentor 있으면 삭제 하 고 다른 indentor 바꿉니다.
- 프레임의 왼쪽된 가장자리는 적어도 ~1.5 R indentor 센터에서의 거리를 라이브 단계 영상에서 indentor의 가장자리의 왼쪽에 이동 합니다. 센터는 indentor의 그대로 오른쪽 이미지 프레임의 오른쪽 가장자리 근처에 표시 됩니다 확인 하십시오. 단계 이미지 하 고 그것을 저장 합니다.
- 빨간 형광 채널에 대 한 조명 현미경 광원을 전환 합니다. X-및 y-좌표 변경 ( x-indentor 센터 내에서 하지만 프레임의 오른쪽 가장자리 근처의y 위치), 초점 (Z 감소) 아래로 구체 indentor의 센터 아래 빨간 형광 microbeads까지 그냥 초점 이동 합니다.
- (영상 프레임의 왼쪽된 가장자리) 근처 indentor 멀리 실리콘의 상위 계층에 microbeads 초점 이동까지 모든 z-0.5 µ m의 증가 대 한 이미지와 z 스택을 가져가 라.
- 샘플에 다른 indentors와 3.4-3.8 단계를 반복 합니다.
4. 실리콘의 강성 (탄성 계수)를 계산
- ImageJ, 선 도구에 클릭을 사용 하 여 indentor의 위상 이미지를 열고 픽셀에서 indentor의 직경을 측정 합니다. 클릭 한 채로 indentor 가장자리에 지점에 커서를 정반대로 반대 지점에 가장자리에 고 길이 픽셀 커서를 해제 하기 전에 ImageJ 메인 윈도우의 상태 표시줄에 표시 합니다.
- 분석을 클릭 하 여 길이 단위를 픽셀로 설정 되어 있는지 확인 | 설정 규모 길이의 단위를 확인 하 고.
- 객관적인 확대 및 CCD 카메라 픽셀 크기에 의해 μ m indentor의 반경 픽셀 단위 변환 (μ R = R x μ m에 CCD 카메라 픽셀 크기 (픽셀)에서 / 객관적인 확대).
- 열고 microbead 이미지의 빨강 채널 z-스택 (해당 되는 경우는 microbeads는 빨간색 형광) ImageJ에서 파일을 클릭 하 여 | 가져오기 | 이미지 시퀀스 고 스택의 모든 이미지를 선택 하 고 스택의 열을 확인 을 클릭 합니다.
참고: f 1에서 indentor 센터에서 microbeads 최상의 가능한 초점 이며 F2 프레임 번호는 프레임의 왼쪽된 가장자리 근처 (구슬 중심에서 R ~1.5의 지역)에서 microbeads에 있는 최상의 가능한 초점 프레임 번호입니다. Z-두 프레임 간의 차이 들여쓰기 깊이 δ.- ImageJ에서 선 도구를 사용 하 여, 이미지에 잘 정의 된 microbead에서 선을 그립니다. 클릭 분석 | 프로필을 플롯 구슬에서 다른 프레임을 선택 하는 동안 업데이트 된 라인 스캔 강도를 라이브 버튼을 클릭 하십시오. 초점에서 프레임으로 최대 강도의 높은 가치를 제공 하는 프레임을 선택할 수 있습니다.
- Z-z-스택 프레임 사이 증가 0.5 μ m 이므로, δ로 μ m에서 들여쓰기 깊이 계산 (F2-F1) = 0.5 x.
- (마이너스 반대 부 력 힘), 그것의 무게 때문 indentor 여 즉 젤에가 해지는 힘을 계산, 들여쓰기 강제 F, 중력 때문에 가속도 x indentor-액체 매체의 밀도 (밀도) x indentor의 볼륨으로. 방정식 F 를 사용 하 여 = (4/3) x (ρindentor -ρ중간) x (R3) x 3.142 g R 은 indentor의 반지름 x ρindentor indentor, ρ매체 의 밀도 액체 매체의 밀도 이며 g 는 중력 (9.81 m/s2) 때문에 가속도. SI 단위의 F (N)를 오른쪽에 모든 수량을 표현 한다.
- 영의 계수 (E) 수정된11 헤르츠 모델12 방정식을 사용 하 여 실리콘의 계산:
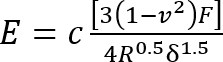
장소:
c =; 뒤에 헤르츠 모델 식을 수정 하는 수정 계수
v = (비압축 자료7에 관해서는 0.5로 찍은); 실리콘 젤의 Poisson의 비율
F = 들여쓰기 힘;
R = indentor 반경; 그리고
Δ = 들여쓰기 깊이.
전자 실바에서를 SI 단위로 오른쪽에 모든 수량 표현- 보정 계수 c 3을 다음과 같이 계산 합니다.
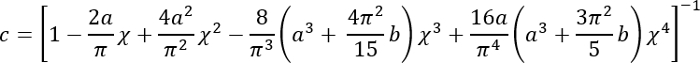
장소: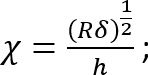
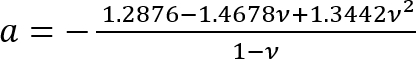 ; 그리고
; 그리고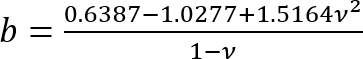 .
.
이 수정 계수는 부드러운 실리콘 (있는 경우) 아래는 페 트리 접시 (또는 뻣 뻣 한 실리콘)을 잘 준수 하는 경우에 사용 하기 위해 특별히 주목 한다. - H 양의 실리콘 추가 페 트리 접시 지름에 따라 부드러운 실리콘 층의 높이 계산 합니다. 또는, 직접 단계 영상에 의해 실리콘 층의 위쪽 및 아래쪽 표면의 z 좌표를 결정 하 여 h를 구하는 (작은 불순물 중 표면에 초점에와 서). 큰 h에 대 한 유의 (h2 > Rδ), 보정 계수 c 1에 가깝다.
- 보정 계수 c 3을 다음과 같이 계산 합니다.
- 각 indentor 단계 4.1-4.4 반복 합니다. 영의 계수는 실리콘 샘플에 대 한 평균 탄성 계수를 각 indentor에서 얻은 평균.
결과
위에서 자세히 설명 하는 프로토콜을 사용 하 여, 우리 준비 35 mm 페 트리 접시에에서 부드러운 실리콘, 30 분 동안 70 ° C에서 그것을 치료 하 고 형광 microbeads 결합 (및 콜라겐 나) 개요로 서 그림 1에 표시 된 위쪽 표면에. 깊은 UV 기판13커플링 최종 단백질에 대 한 이전 사용 되었습니다. (나) 경화 조건 여기에 사용 되는이 부드러?...
토론
영역 들여쓰기 메서드는 쉽게 구현할 수, indentor의 선택과 부드러운 실리콘 샘플의 두께에 주의 지불 한다. 영의 계수를 계산 하는 데 사용 하는 방정식 조건11의 세트에서 유효 하 고 이들은 일반적으로 실리콘 샘플의 두께 indentor 반지름의 > 10% 일 때 만족 하 고 < indentor 반지름 x 13 ~. 우리는 발견 실리콘 두께 5-10 x의 indentor 반경 했다 좋은 선택, 어떤 점에서 샘플 두께 너무 높은 (...
공개
저자는 공개 없다.
감사의 말
우리 감사 마가렛 Gardel 아낌없이 고분자의 사용을 허용. 우리 인정이 작업을 사용 하는 NIH (1R15GM116082)에서 지원 합니다.
자료
| Name | Company | Catalog Number | Comments |
| CY 52-276 A/B silicone elastomer kit | Dow Corning | CY 52-276 | Store at room temperature |
| Thermo Scientific Pierce EDC | Fisher Scientific | PI22980 | Store at -20°C |
| Thermo Scientific Pierce Sulfo-NHS crosslinker | Fisher Scientific | PI-24510 | Store at 4°C |
| Carboxyl fluorescent pink particles, 0.4-0.6 µm, 2 mL | Spherotech, Inc. | CFP-0558-2 | Store at 4°C, do not freeze |
| 1.0 mm Acid washed Zirconium beads | OPS Diagnostics LLC | BAWZ 1000-250-33 | |
| Deep UV chamber with ozone evacuator | Novascan Technologies, Inc. | PSD-UV4, OES-1000D | |
| Wide field fluorescence microscope | Leica Microsystems | DMi8 | |
| Collagen I, from rat tail | Corning | 354236 | Stock concentration = 4 mg/ml; store at 4°C |
| ImageJ-NIH | N/A | N/A | public-domain software |
참고문헌
- Handorf, A. M., Zhou, Y., Halanski, M. A., Li, W. J. Tissue stiffness dictates development, homeostasis, and disease progression. Organogenesis. 11 (1), 1-15 (2015).
- Pelham, R. J., Wang, Y. -. L. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proceedings of the National Academy of Sciences. 94 (25), 13661-13665 (1997).
- Lo, C. M., Wang, H. B., Dembo, M., Wang, Y. L. Cell movement is guided by the rigidity of the substrate. Biophysical Journal. 79, 144-152 (2000).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue cells feel and respond to the stiffness of their Substrate. Science. 310, 1139-1143 (2005).
- Kandow, C. E., Georges, P. C., Janmey, P. A., Beningo, K. A. Polyacrylamide hydrogels for cell mechanics: steps toward optimization and alternative uses. Methods in Cell Biology. 83, 29-46 (2007).
- Johnston, I. D., McCluskey, D. K., Tan, C. K. L., Tracey, M. C. Mechanical characterization of bulk Sylgard 184 for microfluidics and microengineering. Journal of Micromechanics and Microengineering. 24 (3), 035017 (2014).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Lee, E., et al. Deletion of the cytoplasmic domain of N-cadherin reduces, but does not eliminate, traction force-transmission. Biochemical and Biophysical Research Communications. 478 (4), 1640-1646 (2016).
- Frey, M. T., Engler, A., Discher, D. E., Lee, J., Wang, Y. L. Microscopic methods for measuring the elasticity of gel substrates for cell culture: microspheres, microindenters, and atomic force microscopy. Methods Cell Biol. 83, 47-65 (2007).
- Lee, D., Rahman, M. M., Zhou, Y., Ryu, S. Three-dimensional confocal microscopy indentation method for hydrogel elasticity measurement. Langmuir. 31 (35), 9684-9693 (2015).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophysical Journal. 82 (5), 2798-2810 (2002).
- Hertz, H. Über die Berührung fester elastischer Körper. Journal für die reine und angewandte Mathematik. 92, 156-171 (1882).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M., Cassimeris, L., Tran, P. Protein micropatterns: a direct printing protocol using deep UVs. Microtubules: In Vivo. , 133-146 (2010).
- Bashirzadeh, Y., Qian, S., Maruthamuthu, V. Non-intrusive measurement of wall shear stress in flow channels. Sensors and Actuators A: Physical. 271, 118-123 (2018).
- Muhamed, I., Chowdhury, F., Maruthamuthu, V. Biophysical tools to study cellular mechanotransduction. Bioengineering (Basel). 4 (1), 12 (2017).
- Dumbali, S. P., Mei, L., Qian, S., Maruthamuthu, V. Endogenous sheet-averaged tension within a large epithelial cell colony. Journal of Biomechanical Engineering. 139 (10), 101008 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유