Method Article
В Vivo Прямое перепрограммирование резидентных глиальных клеток в интернейроны путем внутримозговой инъекции вирусных векторов
В этой статье
Резюме
Этот протокол направлен на генерацию непосредственно перепрограммированных интернейронов in vivo, используя вирусную систему на основе AAV в головном мозге и репортера GFP, управляемого синапсином FLEX, который позволяет идентифицировать клетки и дальнейший анализ in vivo.
Аннотация
Преобразование резидентов глии в головном мозге в функциональные и подтип-специфических нейронов in vivo обеспечивает шаг вперед к развитию альтернативных клеточных терапии замены, а также создание инструментов для изучения судьбы клеток на месте. На сегодняшний день, было возможно получить нейроны через in vivo перепрограммирования, но точный фенотип этих нейронов или как они созревают не был проанализирован в деталях. В этом протоколе мы описываем более эффективное преобразование и клеточную идентификацию перепрограммированных нейронов in vivo с использованием вирусной векторной системы на основе AAV. Мы также предоставляем протокол для функциональной оценки нейронального созревания перепрограммированных клеток. Путем впрыскивания флип-эксцизии (FLEX) векторов, содержащих перепрограммирование и синапсин-управляемых генов репортера к определенным типам клеток в мозге которые служат как цель для перепрограммирования клетки. Этот метод позволяет легко идентифицировать вновь перепрограммированных нейронов. Результаты показывают, что полученные перепрограммированные нейроны функционально созревают с течением времени, получают синаптические контакты и показывают электрофизиологические свойства различных типов интернейронов. Используя транскрипционные факторы Ascl1, Lmx1a и Nurr1, большинство перепрограммированных клеток обладают свойствами быстропиковых, парвальбумминсодержащих интернейронов.
Введение
Общая цель этого метода заключается в эффективном преобразовании мозга резидентов глии in vivo в функциональных и подтип конкретных нейронов, таких как парвальмин-выражение interneurons. Это дает шаг вперед к развитию альтернативной клеточной заместительной терапии заболеваний головного мозга без необходимости в экзогенном источнике клеток. Он также создает инструмент для изучения клеточной судьбы переключатели на месте.
Мозг имеет только ограниченную способность для генерации новых нейронов. Поэтому при неврологических заболеваниях существует потребность в экзогенных источниках клеток для восстановления мозга. Для этого, различные источники клеток были подвергнуты интенсивным исследованиям на протяжении многих лет, в том числе клетки из первичной ткани, стволовых клеток, полученных клеток и перепрограммированных клеток1,2,3. Прямое перепрограммирование резидентных клеток мозга в нейроны является недавний подход, который может обеспечить привлекательный метод для ремонта мозга, как он использует собственные клетки пациента для генерации новых нейронов внутри мозга. На сегодняшний день, несколько докладов показали, in vivo перепрограммирования через вирусный вектор доставки в мозге4,5,6,78,9 в различных областях мозга, таких как коры головного мозга, спинного мозга,стриатума и среднего мозга 5,10,11,а также в нетронутых и поврежденных головного мозга5,8,11,12. Оба ингибирующих и возбуждающих нейронов былиполучены 4,8, но точный фенотип или функциональность этих клеток еще не были проанализированы в деталях.
В этом протоколе мы описываем более эффективное перепрограммирование и клеточную идентификацию нейронов in vivo. Мы предоставляем протокол для функциональной оценки нейронального созревания и характеристики фенотипа на основе функциональности и иммуногистохимических признаков.
Мы использовали Cre-индуцированный вектор AAV и репортер GFP для идентификации in vivo перепрограммированных нейронов. Этот выбор вирусных векторов имеет преимущество заражения как деления, так и неразделяющихся клеток мозга, увеличивая количество целевых клеток, в качестве альтернативы использованию ретровируса7,8. Нейрон-специфический синапсин-управляемый репортер FLEX (GFP), позволил нам специально обнаружить вновь созданные нейроны. Предыдущие исследования использовали подтип конкретных промоутеров для in vivo перепрограммирования7,9, которые также позволяют выражение перепрограммирования генов и репортеров в конкретных типах клеток. Однако этот метод требует дальнейшего выявления перепрограммированных нейронов путем посмертного анализа совместного выражения репортера и нейрональных маркеров. Использование нейронов конкретных репортер, таких, как один описано в этом, позволяет для прямой идентификации. Это обеспечивает прямое доказательство успешного преобразования и позволяет живой идентификации клеток, что требуется для патч-зажим электрофизиологии.
протокол
Все экспериментальные процедуры были проведены в соответствии с Директивой Европейского союза (2010/63/EU) и одобрены комитетом по этике по использованию лабораторных животных в Лундском университете и Шведском департаменте сельского хозяйства (Jordbruksverket). Мыши размещаются в 12 ч свет / темный цикл с ад libitum доступ к пище и воде.
1. Вирусные векторы
- Клонирование векторов AAV
- Чтобы создать Cre-индуцируемые векторы AAV5, вставьте cDNA для GFP, Ascl1, Lmx1a и NR4A2 (Nurr1) в обратной ориентации, окруженной двумяпарами гетеротипичных, антипараллельных последовательностей флип-эксцизии LoxP (FLEX). Для вставки cDNA используйте позвоночник, как pAAV-Cba-FLEX или один с аналогичной структурой, содержащей FLEX последовательностей и куриный бета-актин (CBA) промоутер.
- Вставьте каждую кДНК (например, Ascl1) в позвоночник с помощью полимеразной цепной реакции (ПЦР) и ферментов ограничения. Экспресс GFP под контролем синапсин промоутер и Ascl1, Lmx1a, Nurr1 под контролем вездесущий выраженный промоутер ЦБА.
ПРИМЕЧАНИЕ: Убедитесь, что эндотоксин свободной ДНК с помощью конкретных эндотоксинов без плазмидной ДНК изоляции комплектов. - Выполните анализ секвенирования и ограничения конструкций перед использованием, чтобы проверить успешность шага клонирования.
- Производство вирусного векторного вектора AAV5
ПРЕДЕКТО: Обратитесь к местным руководящим принципам биобезопасности при обращении с адено-ассоциированным вирусом (AAV). В Швеции AAV, используемый в этом протоколе, требует уровня биобезопасности 2 (BSL-2).- Семена HEK293T клетки со стандартными средствами массовой информации культуры (DMEM-Glutamax 10% FBS и пенициллин (100 U/ml) стрептомицин (100 мкг/мл), см. Таблица материалов) в T175 колбы при плотности 3 х 106 ячеек на колбу. Приходится 5 фляг на партию AAV и план для 6 партий одновременно.
- Когда клетки достигают 50-70% вспухить, подготовить следующую смесь для трансфекции (на 175 см2 колбы).
- В 50 мл центрифуги трубки, добавить эквимолярные количества вектор плазмиды и pDG серии помощник плазмида (pDP5, pDP6), в общей сложности 72 мкг на 175 см2 колбы.
- Добавьте буфер Tris-EDTA (TE буфер, 10 мм Tris-HCl, 1 мМ EDTA) к окончательному объему 144 мл.
- Добавьте ультрачистую воду так, чтобы общий объем стал 1296 мл и перемешайте.
- Добавьте 144 л из 2,5 M CaCl2 и перемешайте. Добавьте в раствор ДНК 1,92 л HEPES Buffered Saline (HBS) (1,5 мм Na2HPO 4,140 мМ NaCl, 50 мМ HEPES) и немедленно перемешайте путем вихря.
- Инкубировать при комнатной температуре (RT) ровно за 60 с. Перенесите раствор на 28 мл свежих клеточных культур и перемешайте.
- Замените среду в колбах средой клеточной культуры, содержащей трансфекционную смесь.
- Через три дня после трансфекции, урожай клеток, выливая thr среды из колбы в одноразовый контейнер для отходов и добавить 5 мл буфера урожая (EDTA добавил фосфат-буферный солен, см. Таблица материалов, DPBS до конечной концентрации 5 мМ) до концентрации 5 мМ) в каждой колбе, чтобы позволить отслоение клеток.
- Налейте клеточный раствор в 50 мл центрифуги трубки. Добавьте еще 4 мл DPBS к каждой колбе, чтобы промыть оставшиеся ячейки и бассейн с первым раствором ячейки. Центрифуге собранных клеток при 1000 х г в течение 5 мин при 4 градусах Цельсия.
- После центрифугации, удалить супернатант и растворить гранулы в 15 мл буфера из лисиса (50 мм Tris-HCl pH 8.5, 150 мМ NaCl, 1 мМ MgCl2) путем вихря.
- Заморозить ихв CO 2-лед / этанол ванны в течение 15 минут и хранить в морозильной камере -20 градусов. Оттепель собранной клетки лизат в водяной бане 37 градусов перед использованием.
- Очистка вирусного вектора AAV5
- Выполните AAV очистки iodixanol Gradient Ultracentrifugation13 и использовать ультрацентрифугу уплотнения труб с центрифугированием на 350000 х г в течение 1 ч и 45 мин на RT.
- Используйте 10 мл шприц с 18G иглы и вставить около 2 мм ниже 40/60% фазы границы с скотом лицом вверх для того, чтобы извлечь AAV-содержащей фазы. Убедитесь в том, чтобы остановить до достижения полосы белка после 5-6 мл был извлечен.
- Храните экстракты градиента в автоматических стеклянных бутылках при 4 градусах Цельсия. Избегайте хранения раз дольше, чем на ночь.
- Разбавить экстракт градиента Iodixanol в 3 раза медленно пайпеттинг в 12 мл iodixanol Elution (IE) буфер (20 мм Tris-HCl pH 8.0, 15 мМ NaCl) в то время как закрученного.
- Очистите и сконцентрируйте разбавленный градиент йодиксанола через фильтр обмена анионами. Протолкните его медленно со скоростью не быстрее, чем 1 капля/с. Нажмите 3 мл буфера IE медленно через фильтр, чтобы вымыть его.
- Выделите в центробежный фильтр с 1-2 мл элютионного буфера (20 мм Tris-HCl pH 8,0;250 мм NaCl). Добавьте DPBS к устройству до конечного объема 4 мл. Центрифуга при 2000 х г на РТ до менее чем 0,5 мл остается в фильтре. Удалите жидкость со дна трубки, пополнить с 4 мл DPBS и центрифуги снова. Повторите этот шаг еще два раза. Убедитесь, что объем концентрированного вектора на фильтре составляет около 200 зл после последнего шага центрифугации.
- Удалите 200 концентрированный вектор с помощью пипетки и протолкните концентрат через фильтр 0,22 мм, чтобы стерилизовать его. Aliquot 200 «Линто 9 мм стеклянный флакон с запертой вставкой (Таблицаматериалов).
ПРИМЕЧАНИЕ: Запасы векторов AAV5 могут храниться в морозильных камерах -80 градусов для длительного хранения или при температуре 4 градусов по Цельсию, если они используются в течение 2 недель.
- AAV5 вирусный вектор титер определение
- Определите AAV5 титр с помощью стандартной количественной полимериза цепи реакции (qPCR) с грунтовки для перевернутого терминала Повторите (ITR) последовательность и 5 "FAM / 3 BH'1 зонд для последовательности ITR (Таблица материалов). Используйте стандартную кривую, достигнутую с известным количеством ITR, содержащей плазмид. Каждый вектор AAV должен иметь диапазон 1ENo 14 - 1E15 копий генома на миллилитр, если последовательность ITR используется для определения титра.
ПРИМЕЧАНИЕ: Успешное производство вируса AAV5 дает запасы с титрами в минимальном диапазоне 3ENo13 - 7E13 единиц/мл.
- Определите AAV5 титр с помощью стандартной количественной полимериза цепи реакции (qPCR) с грунтовки для перевернутого терминала Повторите (ITR) последовательность и 5 "FAM / 3 BH'1 зонд для последовательности ITR (Таблица материалов). Используйте стандартную кривую, достигнутую с известным количеством ITR, содержащей плазмид. Каждый вектор AAV должен иметь диапазон 1ENo 14 - 1E15 копий генома на миллилитр, если последовательность ITR используется для определения титра.
2. Инъекция факторов перепрограммирования в мозг
- Установка животных, стереотаксичное размещение и бурение
Примечание:Этот протокол фокусируется на использовании Ascl1, Lmx1a и Nurr1 (ALN) для перепрограммирования глии NG2 в интернейроны. По нашему опыту, интернейроны аналогичного фенотипа могут быть получены с помощью других комбинаций факторов11 Год.- Перед операцией подготовьте вирусную смесь, содержащую векторы Cba-FLEX-Ascl1, Cba-FLEX-Lmx1a, Cba-FLEX-Nurr1 и репортерский вектор Syn-FLEX-GFP. Добавьте каждый из запасов, подготовленных в разделе 1, к окончательному смешиванию, так что окончательное вирусное решение имеет 5% от каждого из факторов перепрограммирования (Ascl1, Lmx1a и Nurr1) и 10% от конструкции репортера (5% A, 5% L, 5% N и 10% GFP).
ПРИМЕЧАНИЕ: Векторные смеси AAV5 могут храниться при 4 градусах Цельсия и храниться для использования в будущем in vivo. - Анестезируйка мышь с помощью 2% изолюран в смеси воздуха и закиси азота (N2O) в соотношении 4:1. Следите за дыханием животного, наблюдая за движениями диафрагмы. Во время операции, поддерживать анестезию с использованием 1-1,5% изофруран.
ПРИМЕЧАНИЕ: Мышь модель настоящим описано состоит из мыши штамм, который конкретно выражает Cre в NG2 глии. In vivo перепрограммирование может быть достигнуто с помощью различных штаммов мыши, которые выражают Cre в других популяциях глиальных клеток (например, астроциты14). - После того, как животное полностью обезболили (например,полное расслабление мышц и отсутствие ответа на щепотку в ноге площадку), брить области вокруг разреза сайта и довести животное до стереотаксической рамы.
- Для поддержания температуры тела животного во время операции прикрепите грелку к основанию стереотаксической рамы. Поместите мышь на чистое, сухое бумажное полотенце.
- Аккуратно поместите голову мыши в ухо баров. При правильном размещении не следует наблюдать боковое движение головы. Установите левую ушную перекладину до 4 мм, до начала размещения мыши в стереотаксической раме.
- Закрепите зубную стойку на месте, а затем затяните нос. Убедитесь, что голова не движется в любом измерении и точка прямо вперед (средняя линия перпендикулярно плоскости ухо баров). Нанесите офтальмологическую мазь для защиты глаз.
- Перед началом операции вводят соответствующую обезболивающее (например, 0,05 мг/кг бупренорфина, подкожного).
- Очистите область разреза хлопчатобумажной марлей или салфеткой, пропитанной 70% EtOH, не приближаясь к области глаза.
ПРИМЕЧАНИЕ: Для внутримозговой вирусной инъекции используется шприц калибра 5 или 10 мл, адаптированный с вытянутым стеклянным капилляром. Стеклянные капилляры вытягиваются с помощью выдвиженца микропипетта, в результате чего капилляр с очень тонким кончиком, что сведет к минимуму инвазивность процедуры. Чтобы адаптировать капилляр в шприц, используйте кусок резиновой трубки над соединением между иглой шприца и стеклянным капилляром и расплавить его с помощью источника тепла (например, зажигалки). Тесная связь между двумя частями будет убедиться, что Есть нет утечки жидкости во время инъекции. Перед началом операции проверьте это, заполнив шприц сольистым раствором и вытолкнив жидкость из шприца. - Сделайте разрез примерно 0,5-0,8 см вдоль средней линии головы. Вырезать через кожные и подкожные слои, с кальпелью.
- Расширьте шкуры кожи с каждой стороны разреза. Очистите разрез любой крови и соскребите подкожные слои ватным тампоном.
- Переместите руку M/L-D/V стереотаксической рамы на место (над животным) и защитите ее.
ПРИМЕЧАНИЕ: Стереотаксическая рама позволяет регулировать шприц по передней/задней (A/P, Y оси), Медиальной/боковой (M/L, X оси) и Дорсал/Вентрал (D/V, оси) оси. - Переместите шприц вдоль другой оси стереотаксической рамы, чтобы принести кончик стеклянного капилляра чуть выше брегмы (точка соединения, где встречаются различные пластины черепа).
- Убедитесь, что капиллярный наконечник идеально прямо в обоих A / P и M / L самолетов. В случае неоднозначной брегмы, возьмите среднее значение боковых и средней линии швов.
- Когда кончик капилляра правильно помещается выше брегмы, сбросьте значения M/L и A/P до 0,0 на цифровом счетчике координат.
- Чтобы убедиться, что голова животного находится в идеально ровном положении, используйте счетчик цифровых координат для измерения значения координат D/V, когда рука A/P находится на уровне 2,0 и -2,0 (М/л 0,0), а также при том, что рука M/L находится на уровне 2,0 и -2,0 (A/P ) 0,0). Отрегулируйте высоту зубной панели и ушных прутьев соответственно.
- Переместите шприц к нужным координатам для инъекции вирусных векторов в стриатуме (A/P - 1,0; М/Л -2.0, по отношению к брегме).
- Поднимите шприц немного и, глядя на место инъекции через микроскоп, просверлить отверстие с помощью стоматологического сверла на инъекционных координат. Начните сверлить на участке, работая в круговой и нежной манере.
ПРИМЕЧАНИЕ: Не ставьте слишком много понижательного давления, так как буровой бит должен быть достаточно острым, чтобы пройти через кость без дополнительной силы. Избегайте длительного, устойчивого бурения, так как это создает тепло. - В конце бурения убедитесь, что dura mater остается нетронутой и подвергается воздействию для инъекций.
- Перед операцией подготовьте вирусную смесь, содержащую векторы Cba-FLEX-Ascl1, Cba-FLEX-Lmx1a, Cba-FLEX-Nurr1 и репортерский вектор Syn-FLEX-GFP. Добавьте каждый из запасов, подготовленных в разделе 1, к окончательному смешиванию, так что окончательное вирусное решение имеет 5% от каждого из факторов перепрограммирования (Ascl1, Lmx1a и Nurr1) и 10% от конструкции репортера (5% A, 5% L, 5% N и 10% GFP).
- Подготовка установки шприца
- Поместите кусок хлопчатобумажной марли над открытым разрезом и промойте шприц солевым раствором.
- После промывки, возьмите пузырь воздуха 1-2 л, а затем 1 л раствора, содержащего вирусные векторы, избегая любых непреднамеренных пузырьков. Убедитесь, что вирусное решение может быть легко визуализировано ниже воздушного пузыря, в то время как вводили.
- Вирусная инъекция
- Удалите хлопчатобумажную марлю из-за места разреза и опустите шприц с помощью руки D/V стереотаксической рамы. По мере приближения поверхности черепа внимательно просматривайте микроскоп и измеряйте уровень D/V dura mater – он должен слегка выпуклый под нежным давлением.
- При прикосновении к дюре-матер кончиком капилляра установите координату D/V до 0,0.
- Опустите шприц, медленно продвигаясь до нужной глубины (D/V - -2.7, относительно dura mater). Убедитесь, что траектория очищается от фрагментов костей, так что не изгиб иглы / капилляра наблюдается.
ПРИМЕЧАНИЕ: Представленные координаты относятся к инъекциям факторов перепрограммирования в стриатум мышей NG2-Cre. Координаты, соответствующие другим областям мозга, могут быть использованы. Всегда проверяйте координаты для инъекций сначала с помощью красителя (например, Trypan Blue), цветной инъекции биса или репортера вирусного вектора до инъекции факторов перепрограммирования в мозг нового штамма мыши. При инъекциях Trypan Blue, животные должны быть принесены в жертву сразу после операции и мозг расчленена. Свежий мозг можно сократить с помощью микротома, в то время как замороженные, и место инъекции определяется визуализации положения красителя в головном мозге. При тестировании координат с использованием цветных бусин, можно определить место инъекции на проникнуты и вырезать мозгчерез через неделю после инъекции. Кроме того, инъекция с вирусным вектором проведения репортер ген может быть использован, и место инъекции определяется в perfused сократить мозги. - Вводят 1 л вирусного раствора в размере 0,4 л/мин. Когда весь объем вводится, довести диффузии период 2 мин до вывода шприца.
- После диффузии, медленно убирать шприц, пока кончик капилляра полностью из мозга.
- Поместите кусок хлопчатобумажной марли над раной и промыть шприц солевым раствором.
- Вывешить m/L-D/V руку стереотаксической рамы из рабочей области.
- Закрытие ран и послеоперационные процедуры
- Тщательно шов разреза с помощью шовной нити.
ПРИМЕЧАНИЕ: Все швы, используемые у инъекционных животных, должны быть утилизированы в чашке/флаконе, содержащем противовирусный моющее средство. То же решение используется для очистки всех поверхностей, окружающих область хирургии, которые были в контакте с хирургическими материалами. Все хирургические инструменты тщательно промываются и аутокративаются в конце каждого дня операции. - Удалите животное из стереотаксической рамы и поместите его в послеоперационную станцию, которая включает в себя чистую, отапливаемую клетку, доступ к пище и воде, и где животное остается до полного просрявания. В течение этого периода, внимательно следить за животным, пока сознание не придет в себя.
- Не размещайте оперированных животных с неуправляемыми животными до тех пор, пока бывшие полностью не оправились от операции.
- Ежедневно осуществляй надзор за животными. В зависимости от используемых швов убедитесь, что они удаляются в случае необходимости. Все животные были даны Bupenorphinum (Темгесик на 1 мл/кг) подкожный как послеоперационный уход.
ПРИМЕЧАНИЕ: При работе с использованием одного и того же шприца в течение двух дней подряд, промойте его водой, а затем этанол 70% и воды снова. Оставьте шприц, наполненный водой на ночь, чтобы растворить любые возможные остатки.
- Тщательно шов разреза с помощью шовной нити.
3. Электрофизиологические записи
- Ткань ломтик подготовки к электрофизиологии
ПРЕДЕКТО: Хорошо выполненная подготовка тканей необходима для достижения хороших электрофизиологических записей. Тщательно подготовьте помещение и поместите инструменты для перфузии и рассечения на льду.- Подготовка ледяной и насыщенной (95% O2 и 5% CO2) Кребс решение для перфузии, рассечения и резки (подготовить это в тот же день из 10x бульона путем разбавления бульона растворве в ультрачистой воде и добавления NaHCO3 и глюкозы). Компоненты в растворе Кребса в мМ (после разбавления до 1x): 126 NaCl, 2.5 KCl, 1.22PO4 H2O, 1.3 MgCl2No6H2O, и 2.4 CaCl2No6H2O, 22 NaHCO3, 10 глюкозы. Отрегулируйте рН раствора до 7,4.
- Выполните калибровку (Vibracheck) для вибратом с новым лезвием бритвы.
- Запустите охлаждающий блок вибратом (или заполните окружающую камеру льдом), заполните режущей камеру раствором Кребса для оксигенации 95 % O2 и 5% CO2 не менее чем за 30 минут до использования.
- Положите чашку Петри на лед и заполните его кислородом кребс раствором. Поместите лезвие, ножницы и монтажную пластину на лед.
ПРЕДЕКТО: Принесите клетку, содержащую мышь, в комнату не менее 1 ч перед началом процедуры акклиматизации. Стресс оказывает негативное влияние на состояние секций тканей мозга. - Неизлечимо обезопадайте мышь путем введения передозировки Pentobarbital и пусть животное заснуть. Когда рефлекс мига вне и животное не реагирует на болевые стимулы, transcardially пронизывает животное с ледяной кребс раствор в течение 2-3 мин (со скоростью 10-20 мл/мин).
- Быстро, но осторожно, вскрыть мозг и положить его с ног на голову в Петри-блюдо, которое помещается на лед (содержащий решение Кребс).
ПРИМЕЧАНИЕ: Для того, чтобы сравнить функциональное созревание перепрограммированных нейронов, жертвуйте животными для записи в разных временных точках поствирусной инъекции. Оцените огневые свойства различных подтипов нейронов на основе существующей литературы15 . - Сделайте корональную разрез вдоль мозжечка и приклейте эту сторону на монтажную пластину (также ледяную) для резки вибратом.
- Опустите клееный мозг тщательно в буферную камеру в вибратом.
ПРЕДЕКТО: Будьте осторожны, чтобы не коснуться лезвия бритвы для вашей собственной безопасности, и так, что лезвие будет оставаться откалибровано. - Вырезать из самой ростральной части мозга до стрататального уровня на высокой скорости. Затем вырежьте стриатум коронально на 275 мм при медленной скорости (0,10 мм/с).
- После каждого разреза тщательно удалите неинъекционную стриатальную сторону (например, с помощью согнутой иглы) и перенесите вводимые стороны в другую флакон в водяной бане, содержащую нижнюю сетку (оксигенизированную кребс на РТ), помещенную в водяную ванну. Держите это на RT, пока все разделы не будут вырезаны.
- Медленно повысьте температуру водяной ванны до 37 градусов по Цельсию и оставьте ее на 30 мин. Затем выключите обогреватель и дайте остыть до RT.
ПРИМЕЧАНИЕ: На этом этапе вы можете приостановить, пока не начнете запись. Разделы длятся 4-6 ч.
- Записи патч-зажима из цельных клеток
- Перенесите первую секцию ткани в камеру звукозаписи, погруженную в непрерывный поток раствора Кребса. Установите секцию, используя легкие веса и погрузите цель.
- Определите область стряпна в микроскопе и ищите GFP-положительные (перепрограммированные) нейроны. Выберите нейрон, который является обширным в морфологии и не покрыта волокна пучки или кровеносные сосуды.
- Приготовьте боросиликатные стеклянные пипетки (3-7 МЗ) для исправления и заполните следующим внутриклеточным раствором (в ММ): 122,5 глюкона калия, 12,5 КЛ, 0,2 EGTA, 10 HEPES, 2 MgATP, 0.3 Na3GTP и 8 NaCl, скорректированные на pH 7.3 с KOH.
- Для заполнения биоцитина добавьте 1 мг соли биоцитина к 1 мл внутреннего раствора и вихря.
ПРЕДЕКТО: Убедитесь в том, чтобы фильтровать внутреннее решение с биоцитином, как это в противном случае может засорить электрод. - Прикрепите стеклянную пипетку к записывающей электроду и окуните в раствор. Дважды проверьте сопротивление электрода. Затем медленно приближайтесь к клетке с пипеткой, сохраняя небольшое положительное давление в электроде, чтобы избежать подключения кончика.
ПРЕДЕКТО: Будьте осторожны, чтобы отслеживать вашу клетку при спуске электрода и не отбеливать флуоресценцию в клетке (т.е., выключите флуоресценцию лампы, когда вам это не нужно). - Тщательно промыть окружающие ткани, используя положительное давление электрода, и подойдите к клетке с помощью электрода. Найдите электрод прямо на верхней части клетки и спуститесь до тех пор, пока электрод не коснется мембраны. Сделайте уплотнение гига-я между электродом и клеточной мембраной, и с отрицательными импульсами давления, разрыв мембраны для создания цельноклеточного патча.
ПРЕДЕКТО: Перепрограммированные нейроны чувствительны. Будьте осторожны при исправлении и не ставьте слишком много негативного давления при достижении гига-я печать или открытие клеточной мембраны. Кроме того, исправления на животных, которые старше требует практики и терпения, как их соединительной ткани толще, и это труднее визуализировать нейронов. - Проверьте потенциалы мембраны отдыха сразу после взлома в режиме текущего зажима и запишите для анализа.
- В текущем зажиме, поддерживать ячейку от -60 мВт до -80 мВт и вводить 500 мс токов от -20 pA до 90 pA, с шагом 10 pA, чтобы вызвать потенциалдействия.
- Передача в напряжение-зажим и измерения внутрь натрия и задержки выправления калийных токов на деполяризации шаги 10 мВ.
ПРИМЕЧАНИЕ: Записи напряжения-зажима лучше оцениваются с помощью другого внутреннего раствора, состоящего из химических веществ, которые более эффективно зажимают мембрану. Однако, для перепрограммированных нейронов, количество клеток, которые можно записать из несколько и количество разделов тканей с этими нейронами ограничено. Следовательно, это преимущество для записи как в ток-зажим и напряжение-зажим из той же ячейки. - В режиме напряжения-зажима записываете спонтанную постсинаптическую активность на уровне -70 мВ. Отличительной ингибирующие постсинаптические события на мембранном потенциале 0 мВ от возбуждальных событий при -70 мВ.
- После достижения стабильной базовой линии, добавить Picrotoxin, АНТагонист рецепторов ГАМК, к решению Кребс, который впадает в камеру записи, чтобы извлечь возбуждающие события (добавить запас раствор Picrotoxin к окончательной концентрации 50 мМ в отдельном буферный шприц, подключенный к перфузии камеры. Соедините отток буфера из камеры в вакуумный пакет для безопасного удаления).
- После 20 минут добавьте CN'X (20 мМ), антагонист AMPA, к раствору Кребса, который впадает в камеру звукозаписи, чтобы блокировать ингибирующие события (используя ту же процедуру, что и для Picrotoxin). Оставьте еще на 20 минут, а затем промыть раствором Кребса. Удалите секцию ткани из камеры.
- После окончания записей сделайте автономный анализ спонтанных возбуждающих постсинаптических токов (EPSC) и ингибирующих постсинаптических токов (IPSC) с использованием обнаружения порога события (Зgt;5 pA) в программе анализа.
- В течение всей записи клетка будет медленно заполнена биоцитино-содержащим внутренним раствором. Держите патч, по крайней мере 20 минут, прежде чем медленно удалить электрод для того, чтобы достичь полного заполнения ячейки.
ПРЕДЕКТО: Будьте осторожны, чтобы не иметь никакого положительного давления в электроде, которые могли бы уничтожить последовательный морфологический анализ клеток впоследствии. - Для визуализации биоцитина поместите секцию тканей в 4% параформальдегида (PFA) на ночь при 4 градусах Цельсия. Промыть секцию в буфере фосфата калия 0,02 М (KPBS) с 0,1% Triton. Затем пятно для стрептавидина-Cy3 (1: 600 в КПБС-Т, 2 ч), для идентификации заполненных биоцитином клеток и морфологической визуализации перепрограммированного нейрона.
ПРИМЕЧАНИЕ: Биоцитина заполнения может быть использован аименной для морфологического анализа и иллюстраций патч нейронов.
4. Иммуногистохимия, стереология и количественная оценка
ПРИМЕЧАНИЕ: Посвятите определенную группу мышей иммуногистохимии, так как участки тканей, используемые для электрофизиологии, не являются оптимальными для иммуногистохимии.
- Анестезируйте мышей с инъекцией i.p. передозировки пентобарбитала и смонтировать животное для перфузии.
- Транскардиально пронзают мышей, сначала сольным раствором для удаления крови, а затем с ледяной 4% ПФА.
- Вскрыть мозги и пост-фикс, по крайней мере 12 ч в 4% PFA.
- Положите мозг в 25% сахарозы раствор (для криозащиты) в течение примерно 12 ч.
ПРИМЕЧАНИЕ: Мозги готовы быть сокращены, когда они тонут в 25% сахарозы решение, указывая, что сахароза проникла весь мозг мыши. - Сделайте корональный разрез через мозжечок, используйте плоскую, самую каудальную часть мозга, чтобы поместить мозг на микротомию и исправить его на месте с помощью оптимального соединения температуры резки (OCT).
- Разрежьте мозг на корональные ломтики толщиной 35 мм и разделите мозг на последовательные серии, помещенные во флаконы или колодцы, содержащие 0,02 М KPBS.
- Обработайте разделы для иммуногистохимии с использованием антител против GFP и интернерон маркеров, таких как GAD65/67, П.В., Чат (холин ацетилтрансферазы) и NPY (Neuropeptide Y), в соответствии со стандартными протоколами16, 17.
ПРИМЕЧАНИЕ: Мозг ломтики могут храниться при 4 градусах или -20 градусов по Цельсию в антифриза решение в течение длительного времени. - После окрашивания завершена, смонтировать разделы на стеклянной горке и накрыть стеклянным покрытием, используя монтажное решение, чтобы исправить его на месте. Оставьте крышкуспогнул слайды высохнуть на ночь.
ПРИМЕЧАНИЕ: Для наших исследований, целые мозги вырезаны в 1:8 серии (т.е., каждый флакон, содержащий разделы будет держать одну восьмую мыши мозга11). - Проанализируйте разделы с помощью перевернутой флуоресценции и/или конфокального микроскопа.
ПРЕДЕКТО: Флуоресцентная микроскопия полезна для общего обзора результатов и захвата изображений для расчета эффективности перепрограммирования. Для более детального анализа фенотипической идентичности путем наблюдения за двойными положительными клетками следует использовать конфокальную визуализацию. - Для количественной оценки различных маркеров, выраженных в GFPи нейронах в стриатуме, подсчитайте количество двойных положительных клеток по отношению к общему количеству GFPи клеток (т.е. перепрограммированных нейронов), по крайней мере в двух областях каждого стреч.
- Для определения приблизительного экстраполированного общего числа перепрограммированных нейронов на мозг, подсчитайте GFPи нейроны, присутствующие в стриатуме одной из серий мозга, вырезанных ранее, а затем умножайте на общее количество серий.
ПРИМЕЧАНИЕ: Различные методы количественной оценки могут быть использованы для выражения эффективности перепрограммирования, количество перепрограммированных нейронов на животное и процент нейронов, которые выражают определенные фенотипические маркеры. Для получения дополнительной информации смотрите предыдущую публикацию11. - Проанализируйте различия между условиями с помощью Graph Pad Prism или аналогичных.
ПРИМЕЧАНИЕ: Для расчета эффективности мы вводили мышей NG2-Cre с вектором преобразования ALN, зависящим от CRE, и репортером GFP. Для оценки эффективности преобразования, мы также вводили животных с Cre-зависимых GFP под вездесущий промоутер CBA, что делает все целевые клетки GFP . Используя это сравнение, мы подсчитали, что 66,81% и 38,38% целевых клеток, преобразованных в нейроны. Для проверки экспрессии каждого из генов может быть выполнено дополнительное двойное иммунофторесцентное окрашивание для GFP/Ascl1, GFP/Lmx1a и GFP/Nurr1. Кроме того, секвенирование генома, такое как секвенирование одноклеточной РНК, может выявить наличие каждого из генов в перепрограммированных клетках.
Результаты
Инъекция векторов AAV используется для успешной перепрограммирования резидентов NG2 клетки глии в нейроны в NG2-Cre мыши striatum(Рисунок 1A). Для конкретной цели NG2 глии, FLEX векторы с перепрограммированием / репортер генов, вставляются в антисмысловое направление и в окружении двух пар антипараллельных, гетеротипических локс-сайтов (Рисунок 1B). Каждый из трех генов перепрограммирования (Ascl1, Lmx1a и Nurr1) находится под контролем вездесущего промоутера cba на отдельных векторах. Для того, чтобы убедиться, что выражение GFP ограничивается перепрограммированных нейронов, происходящих из Cre-выражения клетки, GFP находится под контролем нейрон-специфических синапсин промоутер, (также в flex вектор).
Использование комбинации перепрограммирования и репортер конструкций позволяет для генерации GFP-положительных нейронов в мыши striatum(Рисунок 1C,C '). Использование конструкции репортера без присутствия генов перепрограммирования не дает GFP-положительных нейронов(рисунок 1D).
Перепрограммированные нейроны, заполненные биоцитином, видны после вскрытия иммуно-окрашивания(рисунок 2A). Если преобразование успешно, то должно быть обширное морфология нейронов. Электрофизиологические записи перепрограммированных нейронов показывают наличие постсинаптических функциональных связей с показателями спонтанной активности(рисунок 2B,C). Это может быть заблокирован либо с ионотропной ГАМК или глутаметергический блокатор (Picrotoxin или CN'X), предлагая как возбуждающий и ингибирующих синаптический вход в перепрограммированных нейронов. Возникновение спонтанной активности увеличивается с момента после вирусной инъекции(рисунок 2D), что свидетельствует о постепенном созревании.
Текущие индуцированные потенциалы действия присутствуют в функциональных нейронов. Потенциалы действий увеличиваются в количестве с течением времени после преобразования(рисунок 2E). Это также указывает на созревание в функции нейронов. В незрелых нейронов, ток будет вызывать либо нет или очень мало потенциалов действия(Рисунок 2F).
Модели стрельбы нейрона является типом клеток конкретных, как это зависит от таких факторов, как морфология клеток и экспрессии канала15. Записанные закономерности в перепрограммированных нейронах in vivo можно выделить на группы и по сравнению с эндогенными нейронными подтипами, например, быстро пиковые интернейроны (Cell Type B, Рисунок 3B)или другие типы клеток (Рисунок 3A,C,D ). Наблюдаемые электрофизиологические различия могут быть подтверждены наличием определенных маркеров подтипа и совместное выражение с GFP(рисунок 3E-H). В целом, эти данные указывают на то, что перепрограммированные нейроны, присутствующие в стриатуме, обладают свойствами различных типов интернейронов, таких как Парвальбумин-, ChAt- и NPY- выражающие интернейроны, а также полосатую среднюю колючую нейронную идентичность (DARPP32) ( Рисунок 3E -H).
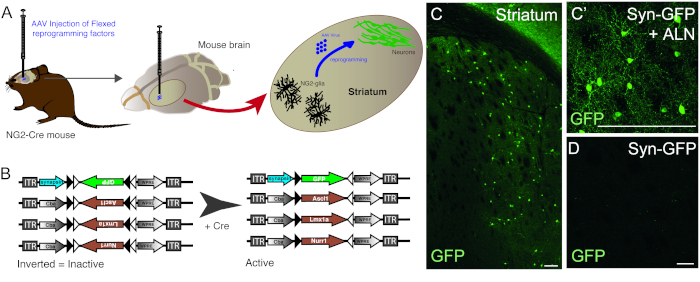
Рисунок 1: In vivo перепрограммирование резидентов NG2 глии в нейроны. (A) Схематическое представление AAV вирус-опосредовано in vivo перепрограммирование striatal ng2 глии. (B) Схематическое представление конструкций AAV5 FLEX, используемых для перепрограммирования in vivo, в которых экспрессия генов регулируется экспрессией Cre в целевых клетках. (C и C') In vivo перепрограммировали нейроны, в результате инъекции Syn-GFP и ALN в Striatum. (D) Отсутствие перепрограммированных нейронов, когда не перепрограммирование факторы добавляются в вирусный коктейль, и только репортер конструировать вводится in vivo. Шкала баров - 100 мм (С), 25 мм (C'), 25 мм (D). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
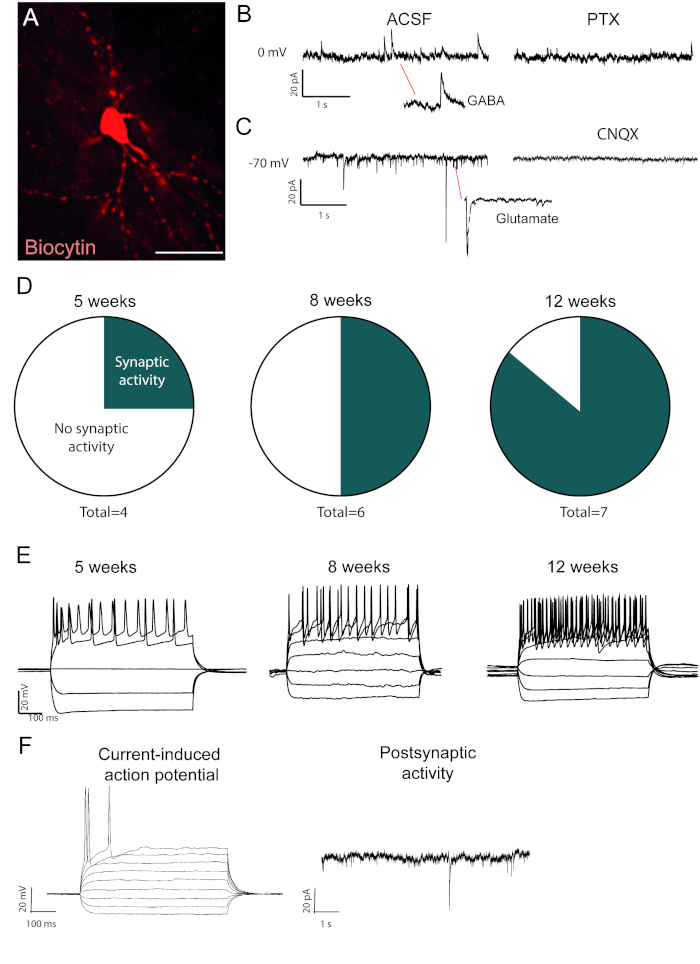
Рисунок 2: In vivo перепрограммированные нейроны являются функциональными и показывают созревание с течением времени. (A) Биоцитин заполненные перепрограммированный нейрон, показывает зрелые морфологии нейронов, в том числе дендритные шипы. Следы показывает (B) ингибирующая (ГАМК) активность, которая блокируется с пикротоксином, АНТагонист рецепторов ГАМК и (C) возбуждательной деятельности, которая блокируется с CN'X, антагонист рецепторов АМРА. (D) Количество нейронов с постсинаптической активностью увеличивается с течением времени. (E) Патч нейроны показывают повторяющиеся стрельбы уже на 5 недель после инъекции (w.p.i.) и продолжают показывать, что в 8 и 12 w.p.i. (F) Текущий индуцированных действий потенциал и postynaptic активность незрелых нейронов, показывая несколько синаптической события и несколько потенциалов действий по сравнению с B и D. Шкала бар 25 мм Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
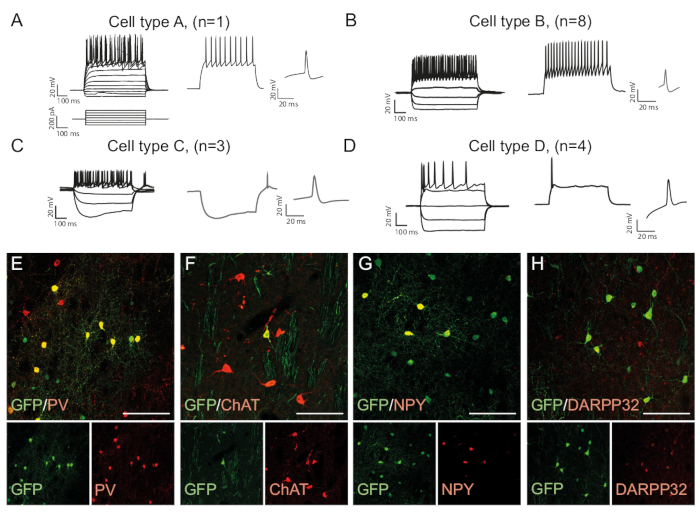
Рисунок 3: В Vivo перепрограммированные нейроны показывают иммуногистохимические и электрофизиологические свойства стриатальных интернейронов. (A-D) Модели стрельбы in vivo перепрограммированных нейронов могут быть различных типов: (A) Тип А похож на эндогенный средний колючий нейрон (DARPP32); (B) похож на быстропиковые (PV) интернейроны; (C) похож на низкопороговые пики нейронов с видными провисание (NPY); (D) нейроны стрельбы с большой после гиперполяризации (Chat). (E-H) Конфокальные изображения, показывающие совместное локализацию GFP и маркеров интернериона PV (E), ChAT (F), NPY (G), и проекционный нейрон маркер DARPP32 (H). Все бары масштаба 50 мм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Прямое перепрограммирование In vivo может быть достигнуто с помощью векторов AAV FLEX в cre-expressing mouse. Важно отметить, что различия между штаммами мыши в отношении перепрограммирования эффективности наблюдались. Для перепрограммирования in vivo в стриатуме линия мыши NG2-Cre оказалась более эффективной по сравнению с другими штаммами. Перед началом использования нового штамма животных, важно, чтобы проверить мыши поставщика руководящих принципов в отношении Cre выражение с течением времени, как возраст животных часто влияет на специфику этого выражения белка. В наших исследованиях, животные старше 12 недель не были использованы для перепрограммирования in vivo, так как существовал риск для экспрессии Cre в клетках, кроме глии NG2. Рекомендуется постоянное присутствие и мониторинг контрольных животных, вводимых только конструкцией Synapsin-FLEX-GFP. Это позволяет контролировать животных для GFP-положительных клеток, которые не должны присутствовать, если не используются гены перепрограммирования (ALN).
Для выявления вновь перепрограммированных нейронов, нейрон-специфический метод идентификации, такой как тот, описанный в этом протоколе, имеет первостепенное значение. Это позволяет для правильного идентификации и различия перепрограммированных нейронов из эндогенных окружающих клеток, что имеет особое значение при перепрограммировании в гомотопической области.
Важно также, чтобы целевой правильной структуры для вирусной инъекции. Таким образом, стереотаксическая хирургия для вирусной инъекции имеет важное значение и должна подходить с точностью, особенно при ориентации небольших структур мозга.
Ранее мы показали11, что это не надежно предсказать результат ы in vivo перепрограммирования на основе in vitro перепрограммирования экспериментов с использованием тех же факторов перепрограммирования. Поэтому все факторы, представляющие интерес, должны быть проверены в vivo. В наших руках, много различных комбинаций факторов дают тот же подтип нейронов (т.е. interneurons11 in vivo), несмотря на то, что эти гены были вовлечены в развитие других нейронов.
Цельнокленое зажим для перепрограммированных нейронов является деликатной техникой, и обработка тканей важна для хорошего результата. Перфузия с раствором ледяного кребса улучшает качество тканей. Кроме того, патч нейронов должны рассматриваться тщательно. Даже если созревание и фенотипическая идентичность перепрограммированных нейронов может быть несколько оценена с помощью цельноклеточного зажима патч, эти клетки не полностью сопоставимы с их эндогенных аналогов. Дополнительные типы анализа, такие как секвенирование генома (например, секвенирование РНК), должны использоваться для дальнейшего подтверждения перепрограммированной клеточной идентичности.
Метод, описанный в настоящем случае, может быть рассмотрен для развития будущих методов лечения, где нейронная замена необходима в головном мозге. Хотя перепрограммирование in vivo все еще находится на ранних стадиях и перевод на людей еще не предусмотрен, этот метод может обеспечить метод оценки функции экзогенного гена в мозге и изучения созревания клеток в vivo.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Марселла Биртеле финансируется Программой Европейского Союза Горизонт 2020 (H2020-MSCA-ITN-2015) в рамках Соглашения об инновационных учебных системах и грантах Марий Склодовска-Кюри No 676408. Даниэлла Рюландер Оттоссон финансируется Шведским исследовательским советом (2017-01234).
Материалы
| Name | Company | Catalog Number | Comments |
| REAGENTS FOR AAV5 CLONING AND VIRAL VECTOR PREPARATION | |||
| pAAV-CA-FLEX | AddGene | 38042 | |
| Ascl1 | AddGene | 67291 | NM_008553.4 |
| Lmx1a | AddGene | 33013 | NM_0033652.5 |
| Nurr1 | AddGene | 35000 | NM_013613.2 |
| GFP-syn | AddGene | 30456 | |
| LoxP (FLEX) sequence 1 | GATCTccataacttcgtataaagtatcctatac gaagttatatcaaaataggaagaccaatgcttc accatcgacccgaattgccaagcatcaccatcg acccataacttcgtataatgtatgctatacgaa gttatactagtcccgggaaggcgaagacgcgga agaggctctaga | ||
| LoxP (FLEX) sequences 2 | tactagtataacttcgtataggatactttatac gaagttatcattgggattcttcctattttgatc caagcatcaccatcgaccctctagtccacatct caccatcgacccataacttcgtatagcatacat tatacgaagttatgtccctcgaagaggttcgaa ttcgtttaaacGGTACCCTCGAC | ||
| pDP5 | Plasmid Factory | PF435 | |
| pDP6 | Plasmid Factory | PF436 | |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 10010023 | |
| FBS (Fetal bovine serum) | Thermo Fisher Scientific | 10500064 | |
| Penicillin streptomycin | Thermo Fisher Scientific | 15140122 | |
| DMEM (Dulbecco's Modified Eagle Medium)+ Glutamax | Thermo Fisher Scientific | 61965026 | |
| DPBS (Dulbecco's Phosphate Buffer Saline) | Thermo Fisher Scientific | 14190094 | |
| HEK293 cells | Thermo Fisher Scientific | 85120602-1VL | |
| Flasks | BD Falcon | 10078780 | 175 cm2 |
| Tris H-CL | Sigma Aldrich | 10812846001 | For TE buffer use 10 mM, pH 8.0; for lysis buffer use 50mM, pH 8.5; for IE buffer use 20 mM, pH 8.0; for elution buffer use 20 mM, pH 8.0 |
| EDTA | EDTA: Invitrogen | EDTA: AM9260G | For TE buffer use 1 mM EDTA |
| Ultrapure water | see Ultrapure water system | ||
| CaCl2 | SigmaAldrich | C5080 | 2.5 M |
| Dulbecco´s phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190136 | |
| NaCl | Sigma-Aldrich | S3014 | FOR HBS use 140 mM; for Lysis Buffer use 150 mM; for IE buffer use 15 mM; for elution buffer use 250 mM |
| MgCl2 | Sigma-Aldrich | M8266-100G | For lysis Buffer: 1 mM |
| Ultracentrifuge sealing tubes | Beckman Coulter | Quick-Seal® Polypropylene Tube | |
| OptiPrep™ Density Gradient Medium | Sigma Aldrich | D1556-250ML | |
| 10-mL syringe-18G needle | BD | 305064 | |
| Laboratory glass bottles | VWR | ? | |
| Anion exchange filter | PALL laboratory | MSTG25Q6 | Acrodisc unit with Mustang Q membrane |
| Centrifugal filter unit | Merck | Z740210-24EA | Amicon Ultra-4 device |
| Endotoxin-Free Plasmid DNA Isolation Kits | Thermo Fisher Scientific | A33073 | |
| Na2PO4 | Sigma-Aldrich | S7907 | |
| HEPES | Sigma-Aldrich | H7523 | 15 mL |
| Falcon tube | Thermo Fisher Scientific | Corning 352196 | |
| Falcon tube | Thermo Fisher Scientific | Corning 352070 | |
| Glass Vials | Novatech | 30209-1232 | CGGCCTCAGFGAGCGA |
| Forward Primer for Inverted Terminal Repeat (ITR) sequence | GGAACCCCTAGTGATGGAGTT | ||
| Reverse Primer for Inverted Terminal Repeat (ITR) sequence | CACTCCCTCTCTGCGCGCTCG | ||
| 5´FAM / 3´BHQ1 probe | Jena Bioscience | ||
| 0.22 mm filter | Merck | SLGV004SL | Millex-GV filter |
| EQUIPMENT AAV5 VIRAL VECTOR PREPARATION | |||
| Freezer -20 °C | |||
| Freezer -80 °C | |||
| Fridge +4 °C | |||
| AAV viral room | |||
| Ultrapure Water system | Merck | Milli-Q® IQ 7000 | |
| Vortex mixer | VWR | 444-0004 | |
| Ultracentrifuge | Beckman Coulter | Beckman Optima LE-80K Ultracentrifuge | |
| Autoclave | Tuttnauer | 2540 EL | |
| Polymerase Chain Reaction (PCR) | BioRad | C1000 Touch Thermal Cycler | |
| Quantitative PCR (qPCR) | Roche | LightCycler® 480 System | |
| Centrifuge | Thermo Fisher Scientific | Sorvall ST16 | |
| Water Bath | Thermo Fisher Scientific | TSGP02 | |
| ANIMAL MODEL | |||
| NG2-Cre mice | Jackson | NG2-CrexB6129, Stock #008533 | |
| REAGENTS FOR INJECTION OF REPROGRAMMING FACTORS INTO THE BRAIN | |||
| Water | |||
| Saline | Apoteket AB | 70% | |
| Ethanol | Solveco | ||
| Isolfurane | Apoteket AB | Dilute to 1% solution with warm water. | |
| Virkon | Viroderm | 7511 | |
| Pentobarbital | Apoteket AB | P0500000 | i.p. for terminal procedure at the dose of 60 mg/ml. |
| Sucrose | Merck | S0389-500G | |
| Trypan Blu | Thermo Fisher Scientific | 15250061 | |
| Retrobeads | Lumafluor | R170 | |
| Buprenorphine | Apoteket AB | ||
| EQUIPMENT FOR INJECTION OF REPROGRAMMING FACTORS INTO THE BRAIN | From RSG Solingen. | ||
| Scissors | VWR | 233-1552 | From Biochem. |
| Tweezers | VWR | 232-0007 | |
| Forcep | VWR | 232-0120 | |
| Scalpel holder | VWR | RSGA106.621 | Number 20. |
| Scalpel | VWR | RSGA106.200 | |
| Stereotaxic frame | Stoelting Europe | 51500D | |
| Mouse ear bars | Stoelting Europe | 51648 | 5 ul |
| Syringe with Removable needle | Hamilton Company | 65 | 0,75 inner diameter and 1.5 outer diameter. |
| Glass capilaries | Stoelting | 50811 | |
| Glass capillary puller | Sutter company | P-1000 | |
| Dental drill | Agnthos AB | 1464 | |
| Shaver | Agnthos AB | GT420 | |
| Isoflurane Chamber and pump | Agnthos AB | 8323101 | 2 mL |
| Syringes | Merck | Z118400-30EA | 25G |
| Needles | Merck | Z192414 Aldrich | |
| Mouse and neonatal rat adaptor for stereotaxic fram | Stoelting | 51625 | |
| Heating pad | Braintree scientific, inc | 53800M | From Covidien 2187. |
| Cotton gauze | Fisher Scientific | 22-037-902 | |
| Rubber tube | Elfa Distrelec | HFT-A-9.5/4.8 PO-X BK 150 | |
| Cotton swabs | Fisher Scientific | 18-366-473 | |
| REAGENTS FOR WHOLE-CELL PATCH CLAMP RECORDINGS | |||
| NaCl | Sigma-Aldrich | S3014 | |
| KCl | Sigma-Aldrich | P9333 | |
| NaH2PO4-H2O | Sigma-Aldrich | S9638 | |
| MgCl2-6 H2O | Sigma-Aldrich | M2670 | |
| CaCl2-6 H2O | Sigma-Aldrich | C8106 | |
| MgSO4-7 H2O | Sigma-Aldrich | 230391 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| Glucose | Sigma-Aldrich | G7021 | see Ultrapure Water system |
| Ultrapure Water | Prepare 1 or 2M. | ||
| KOH | Sigma-Aldrich | P5958-500G | |
| K-D-gluconate | Sigma-Aldrich | G4500 Sigma | |
| KCl | Sigma-Aldrich | P9541 | |
| KOH-EGTA (Etilene glycol-bis-N-tetracetic acid) | Sigma-Aldrich | E3889 Sigma | |
| KOH- Hepes acid (N-2-hydroxyethylpiperazine-N’-2-ethanesulfonic acid) | Sigma-Aldrich | H7523 | |
| NaCl | Sigma-Aldrich | S3014 | |
| Mg2ATP | Sigma-Aldrich | A9187 | |
| Na3GTP | Sigma-Aldrich | G8877 | |
| Biocytin | Sigma-Aldrich | B4261 | |
| Picrotoxin | Merck | P1675 Sigma | |
| CNQX | Merck | C239 Sigma | |
| Ice | |||
| EQUIPMENT FOR WHOLE-CELL PATCH CLAMP RECORDINGS | |||
| Borosilicate glass pipette | Sutter Company | B150-86-10 | |
| Glass capillary puller | Sutter company | P-1000 | |
| Vibratome | Leica | Leica VT1000 S | |
| WaterBath | Thermo Fisher Scientific | TSGP02 | |
| Clampfit software | Molecular Devices | ||
| Multiclamp software | Molecular Devices | ||
| REAGENTS FOR IMMUNOHISTOCHEMISTRY | Use at a concentration of 4%. CAUTION: PFA is a potent fixative. Avoid ingestion and contact with skin. | ||
| Paraformaldehyde (PFA) | Merck Millipore | 1040051000 | Use at a concentration of 0.1%. |
| Triton X-100 | Fisher Scientific | 10254640 | Donkey.Use at a concentration of 1 : 400. |
| Serum | Merck Millipore | S30-100ML | Reconstitute the powder in Milli-Q water to 1 mg/mL. Aliquot and store at -20°C, light sensitive. Use at a concentration of 1 : 500. |
| 4′,6-Diamidino-2′-phenylindole dihydrochloride (DAPI) | Sigma Aldrich | D9542 | 1: 600 in KPBS-T. |
| streptavidin- Cy3 | Thermo Fisher Scientific | 434315 | 1:5000, rabbit. |
| Anti-GAD65/67 | Abcam | 1:2000, mouse. | |
| Anti-PV | Sigma | P3088 | 1:200, goat. |
| Anti-Chat | Merk | AB143 | 1:5000, rabbit. |
| Anti-NPY | Immunostar | 22940 | |
| K2HPO4 | Sigma-Aldrich | P3786 | |
| NaCl | Sigma-Aldrich | S3014 | |
| KH2PO4 | Sigma-Aldrich | NIST200B | 1:1000, chicken. |
| Anti-GFP | Abcam | ab13970 | |
| Mounting solution | Merck | 10981 | Polyvinyl alcohol mounting medium with DABCO®, antifading |
| OCT | Agar Scientific | ||
| Glycerol | Sigma-Aldrich | G9012-100ML | |
| Distilled water | |||
| Anti-freeze solution | Tissue Pro Technology | AFS05-1000N, 1000 mL/ea. | |
| EQUIPMENT FOR IMMUNOHISTOCHEMISTRY | |||
| Inverted fluorescence microscope | Leica | DMI6000 B | |
| Confocal microscope | Leica | TCS SP8 laser scanning confocal microscope. | |
| Prism | GraphPad | ||
| Microtome | Leica | SM2010R |
Ссылки
- Barker, R. A., Parmar, M., Studer, L., Takahashi, J. Human Trials of Stem Cell-Derived Dopamine Neurons for Parkinson's Disease: Dawn of a New Era. Cell Stem Cell. 21 (5), 569-573 (2017).
- Southwell, D. G., et al. Interneurons from embryonic development to cell-based therapy. Science. 344 (6180), 1240622 (2014).
- Parmar, M., Torper, O., Drouin-Ouellet, J. Cell-based therapy for Parkinson's disease: A journey through decades toward the light side of the Force. European Journal of Neuroscience. , (2018).
- Torper, O., et al. In Vivo Reprogramming of Striatal NG2 Glia into Functional Neurons that Integrate into Local Host Circuitry. Cell Reports. 12 (3), 474-481 (2015).
- Su, Z., Niu, W., Liu, M. L., Zou, Y., Zhang, C. L. In vivo conversion of astrocytes to neurons in the injured adult spinal cord. Nature Communication. 5, 3338 (2014).
- Liu, Y., et al. Ascl1 Converts Dorsal Midbrain Astrocytes into Functional Neurons In Vivo. Journal of Neuroscience. 35 (25), 9336-9355 (2015).
- Guo, Z., et al. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer's disease model. Cell Stem Cell. 14 (2), 188-202 (2014).
- Grande, A., et al. Environmental impact on direct neuronal reprogramming in vivo in the adult brain. Nature Communication. 4, 2373 (2013).
- Niu, W., et al. In vivo reprogramming of astrocytes to neuroblasts in the adult brain. Nature Cell Biology. 15 (10), 1164-1175 (2013).
- Weinberg, M. S., Criswell, H. E., Powell, S. K., Bhatt, A. P., McCown, T. J. Viral Vector Reprogramming of Adult Resident Striatal Oligodendrocytes into Functional Neurons. Molecular Therapy. 25 (4), 928-934 (2017).
- Pereira, M., et al. Direct Reprogramming of Resident NG2 Glia into Neurons with Properties of Fast-Spiking Parvalbumin-Containing Interneurons. Stem Cell Reports. 9 (3), 742-751 (2017).
- Rivetti di Val Cervo, P., et al. Induction of functional dopamine neurons from human astrocytes in vitro and mouse astrocytes in a Parkinson's disease model. Nature Biotechnology. 35 (5), 444-452 (2017).
- Crosson, S. M., Dib, P., Smith, J. K., Zolotukhin, S. Helper-free Production of Laboratory Grade AAV and Purification by Iodixanol Density Gradient Centrifugation. Molecular Therapy Methods & Clinial Development. 10, 1-7 (2018).
- Torper, O., et al. Generation of induced neurons via direct conversion in vivo. Proceedings of the National Academy of Sciences of the United States of America. 110 (17), 7038-7043 (2013).
- Kawaguchi, Y., Kubota, Y. Correlation of physiological subgroupings of nonpyramidal cells with parvalbumin- and calbindinD28k-immunoreactive neurons in layer V of rat frontal cortex. Journal of Neurophysiology. 70 (1), 387-396 (1993).
- Grealish, S., et al. The A9 dopamine neuron component in grafts of ventral mesencephalon is an important determinant for recovery of motor function in a rat model of Parkinson's disease. Brain. 133 (Pt 2), 482-495 (2010).
- Thompson, L., Barraud, P., Andersson, E., Kirik, D., Bjorklund, A. Identification of dopaminergic neurons of nigral and ventral tegmental area subtypes in grafts of fetal ventral mesencephalon based on cell morphology, protein expression, and efferent projections. Journal of Neuroscience. 25 (27), 6467-6477 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены