Method Article
CRISPR-Cas9를 사용하여 꿀벌 뇌 섹션에서 항 RDL 및 안티 mGlutR1 수용체 항체 테스트
* 이 저자들은 동등하게 기여했습니다
요약
여기서 제시된 프로토콜은 항체 특이성을 시험하기 위해 성인 꿀벌 뇌에서 단백질의 생산을 감소시키기 위한 CRISPR-Cas9 시스템을 사용하는 프로토콜이다.
초록
클러스터 정기적으로 간격이 짧은 Palindromic 반복 (CRISPR)/CRISPR 관련 단백질 9 (Cas9)는 유전자 기능의 연구에서 널리 사용되는 유전자 편집 기술이다. 우리는 곤충 GABAA 수용체 소단위 저항디엘드린 (RDL) 및 대사성 글루타메이트 수용체 mGlutR1 (mGluRA)에 대하여 개발된 항체의 특이성을 확인하기 위하여 이 연구 결과에서 이 방법을 이용합니다. 항체는 열매파리(Drosophila melanogaster)뿐만아니라꿀벌(Apis mellifera)에특이적인 공액 펩티드에 대하여 토끼에서 발생하였다. 우리는 꿀벌 두뇌에 있는 수용체의 분포를 공부하기 위하여 꿀벌 두뇌 단면도에 있는 이 항체를 이용했습니다. 상기 항체는 펩티드에 대해 화결하고 면역블로팅 및 펩타이드 접합체를 이용한 퍼즈소어레이션의 고전적 방법으로 시험하여 항체가 제기된 해당 펩티드 접합체에 특이적임을 보여주었다. 여기에서 우리는 상응하는 수용체를 위해 디자인된 가이드 RNA를 가진 CRISPR-Cas9 주입 후에 두뇌에 있는 단백질 표적의 감소를 시험하기 위하여 CRISPR-Cas9 기술을 개발했습니다. CRISPR-Cas9 방법은 또한 하나 또는 다중 유전자가 수정될 필요가 있을 때 성인 꿀벌에 있는 행동 분석에서 이용될 수 있습니다.
서문
최근에 발견된 CRISPR/Cas9 시스템은 다양한 모델 시스템과 유기체에서 게놈 DNA를 변경하는 데 사용된 강력한 도구입니다. 그것은 이전 방법 보다 더 효율적이 고 강력한 게놈 수정을 함으로써 생물 의학 연구 및 주요 기술 돌파구를 가속화했다 1. S. pyogenes 박테리아가 원산지인 이 시스템은 Cas9 엔도뉴렐라제에 의존하며, 그 활성은 DNA에서 이중 가닥 휴식(DSBs)을 초래하고, Cas9 단백질을 특정 서열 의존적 위치로 지시하는 가이드 RNA(gRNA)에 의존합니다2. CRISPR/Cas9에 의해 생성된 이중 가닥 브레이크는 비상동성 최종 결합(NHEJ)을 통해 복구할 수 있으며, 이는 프레임 이동으로 이어질 수 있는 오류가 발생하기 쉬운 프로세스또는 기증자 템플릿이 있을 때 상동성 직접 수리로 이어질 수 있습니다. gRNA 자체는 표적 특이적 CRISPR RNA(crRNA)와 리보뉴클레오단백질 복합체(RNP)2,3으로서정제된 Cas9 뉴클레아제와 함께 화학적으로 합성및 전달될 수 있는 보편적 트랜스-활성화 crRNA(tracrRNA)로 구성된다. gRNA 또는 Cas9 뉴클레아제의 형광 표지는 형광 현미경 검사법을 통해 분자 성분의 검출 및 세포내 시각화를 허용할 수있습니다 4.
현재 의 작품에서, 우리는 성인 꿀벌 두뇌의 단백질 수준을 줄이기 위해 CRISPR-Cas9 시스템을 활용합니다. 우리는 대사성 글루타메이트 수용체 (mGluR) 및 항 mGlutR1 수용체 항체 및 GABAA 수용체 소단위 RDL 및 항 RDL 항체를 연구했습니다. 우리는 성인 꿀벌의 두뇌에 있는 단백질의 양을 감소시키는 간단한 방법을 개발하고 대응하는 단백질에 대하여 개발된 항체의 추가 시험을 몰기 위하여 그것을 이용했습니다. CRISPR-Cas9의 형광을 모니터링하여 단백질 감소에 관여하는 영역과 세포를 추정할 수 있었습니다.
이 방법을 사용하여, 우리는 또한 공액 펩티드에 대하여 토끼에서 만들어진 항 mGlutR1 항체를 특징으로 하였다. 꿀벌 게놈은 고도로 보존된 AmGluRA (NCBI 명명선에 따라 명명된 mGlutR1) 메타보트로픽 글루타메이트 수용체5를인코딩합니다. 꿀벌 mGlutR1 유전자는 NCBI 데이터베이스에 따라 4개의 예측된 스플라이스 변이체를 가지고 있습니다. 그것은 pupal 및 성인 꿀벌 단계 둘 다의 중추 신경계 (CNS)에서 표현되고 장기 기억 형성에 관여한다는 것을 보고되었습니다5. mGlutR1에 대해 개발된 항체는 꿀벌의 학습 및 기억 과정에서 글루타마테르기 시스템을 연구하는 데 필수적인 도구가 될 수 있습니다.
우리의 연구에서, 우리는 또한 아피스 mellifera RDL 수용체 소단위에서 공액 펩티드로 면역 토끼에서 개발 된 항 RDL 항체를 특징으로. 꿀벌 Rdl 유전자, AmRdl (XM_006565102.3, NCBI 데이터베이스), 14 예측 스플라이스 변이체가 있습니다. 부분적으로 복제된 조각은 NCBI 데이터베이스 AF094822.1에 보고되었습니다. RDL 수용체 기능 및 그 생리학은꿀벌9,10,11을포함하여 곤충6,7,8에서잘 연구된다. 항 RDL에 대하여 개발된 항체는 꿀벌에 있는 학습 그리고 기억 프로세스에 있는 GABAergic 시스템을 공부하기 위한 필수적인 공구일 수 있습니다.
옥토파민과 티라민 수용체의 역할에 대한 이전 연구는 서양 얼룩12,13에의한 단백질의 양을 후속 테스트로 뇌에 주입 RNAi를 사용했다. 그러나 RNAi에는 몇 가지 중요한 제한이 있습니다. 단백질의 감소가 발생하는 RNAi 주입 후 짧은 시간 창이있다 13. CRISPR-Cas9는 최근 꿀벌 배아에서 전체 동물14,15,16에서유전자를 삭제 또는 수정하는 데 사용되었다. 우리는 성인 꿀벌에 있는 단백질의 양을 감소시키기 위하여 CRISPR-Cas9의 사용을 보고했습니다. 우리는 통제된 실험실 조건 하에서 학습과 기억의 행동 연구 결과에 그것을 결합하는 기능 때문에 꿀벌을 위한 이 접근을개발했습니다 17.
본 작품에서, 우리는 2개의 수용체에 대하여 항체를 개발하고 단백질이 CRISPR-Cas9 주입에 의해 감소된 후에 성숙한 꿀벌 두뇌 단면도에 그(것)들을 시험했습니다. 동시에, 우리는 행동 실험에 대한 방법을 사용할 수있는 실험 디자인을 설립했다.
프로토콜
여기에 설명된 프로토콜은 애리조나 주립 대학의 동물 관리 지침을 따릅니다.
1. 아피스 멜라이프라의 뇌에서 얻은 총 단백질 분리
참고: 이 실험을 위해 알 수 없는 나이의 아피스 멜라이프라 신세계 카니올란 사료를 사용하세요.
- 알루미늄 메쉬 스크린을 벌집 입구 위에 놓아 벌집17을포획한다. 각 캡에 작은 구멍이있는 유리병에 각 꿀벌을 캡처합니다. 꿀벌이 들어있는 바이알을 얼음에 넣은 다음 체온을 낮추고 고정시되게 합니다. 꿀벌을 3분 이상 얼음에 두십시오.
- 고정된 꿀벌을 이전에 준비된 금속 홀더에 고정시. 꿀벌이 작은 덕트 테이프조각으로 고정될 수 있도록 금속 홀더를 제작하고, 여전히 등 흉부, 날개 및 머리를 노출시도록 하십시오.
주의: 꿀벌을 홀더에 넣으려고 시도하기 전에 완전히 움직이지 않도록 하십시오. - 꿀벌이 더 이상 배가 고프지 않을 때까지 5 mL 주사기를 사용하여 1 M 자당 용액으로 꿀벌에게 먹이. 젖은 종이 타월이 달린 상자에 고정된 꿀벌을 놓아 습한 환경을 보장합니다.
- Barraquer 아이리스 가위로 머리를 자르고 (재료 표참조) 꿀벌의 뇌를 빠르게 해부하고 가위를 사용하여 정면에서 머리를 엽니다.
- 머리 캡슐에서 뇌를 잘라, #5 집게로 뇌를 가지고, 감기의 100 μL에 배치 (4-8 °C) 용해 버퍼. 용해 버퍼는 120 mM Tris-HCl로 구성되며, 2% 나트륨 도데실 황산염 (SDS), 5% 글리세롤, 0.2 mM 디티오트레이톨, 1% 트리톤 X-100, 및 프로테아제 억제제 PMSF의 1-5 μg/mL (페닐메틸설포닐플루오라이드), 아프로티닌, 벤자미드인 (pH 6.C. 약 2 분 동안 유봉을 돌려 용해 용액에서 뇌를 균질화하십시오.
- 샘플을 12,000 x g에서 20 분 동안 원심 분리합니다.
- 형질계를 사용하여 총 단백질을 정량화하기 위해 상수의 1 μL을 섭취하십시오. 총 단백질의 대략적인 농도는 꿀벌 당 2-3 mg/mL 사이였습니다. 상급체의 10 μL을 취하고 6x Laemmli 완충액18의10 μL 및 10 μL의 라시스 버퍼를 추가합니다. 잠시 회전하고 3분간 끓인 다음 얼음을 식힙니다. 10,000 x g에서 1분 동안 회전하여 모든 이물질을 제거합니다. 꿀벌 뇌의 10분의 1은 총 단백질의 약 25ng를 함유하고 있습니다.
2화 웨스턴 블로팅19
- 12.15 mL의 초순수 증류수를 함유한 10% 러닝 젤의 30 mL를 만들어, 7.5 mL 의 1.5 ML 1.5 MTris-HCl (pH 8.8), 0.3 mL 의 10% SDS, 10% 아크릴아미드-비스 아크릴아미드 용액의 10 mL, 0.15 mL 의 10% 암모늄 퍼술페이트 (APS), 그리고 테트라메틸레테민 (테트라메틸레테민의 20 μL) ).
- 스페이서에 의해 분리 된 두 개의 유리 판 사이에 젤을 캐스팅합니다.
- 초순수 증류수 12.1 mL, 0.5 M Tris-HCl (pH 6.8), 0.2 mL의 10 % SDS, 2.6 mL의 아크릴 - 비스 아크릴 아미드, 0.1 mL의 10 % APS 및 20ML을 포함하는 20 mL 스태킹 젤을 만듭니다.
- 러닝 젤이 고형화되면 스태킹 젤을 붓는다. 조심스럽게 거품을 피하고, 로딩 레인을 캐스팅 플라스틱 분리기를 추가합니다. 젤이 굳어지때까지 15-30분 기다립니다.
- 5 μL의 단백질 표준을 사용하여 젤을 로딩하십시오. 차선당 1.8단계에서 20 μL의 리세이트 혼합물을 적재하고, 이는 꿀벌 뇌의 ~1/15 또는 차선당 총 단백질의 ~16ng에 해당한다. 스태킹 겔에서 16 mA및 러닝 젤에서 32 mA에서 총 3.5-4 시간 동안 샘플을 실행한다. 염료가 젤을 떠날 때 중지합니다.
- 단백질을 4°C에서 1시간 30분 동안 0.45 mA에서 전사 완충제(25 mM Tris-HCl, 192 mM 글리신, 15% 메탄올)에서 니트로셀룰로오스 막에 옮김을 옮니다.
- 면역블롯팅 전에 SDS-PAGE 다음의 단백질 전달 효율을 평가하려면 Ponceau S 염색 용액을 추가합니다(Ponceau S 0.1 g, 아세트산 5 mL를 물에 추가하여 최종 부피 100 mL). 4°C에서 1분 동안 보관하고 증류수로 빠르게 헹구세요.
- 볼펜으로 각 레인에 라벨을 붙이고, 뇌 균질화로 두 개의 레인이 들어있는 멤브레인을 자르고, 단백질 마커가 있는 1개의 레인을 자르고, 각각을 웨스턴 블롯 인큐베이팅 박스에 넣습니다. 0.1% 트웬 20(PBS-Tw)을 함유하는 인산완충식염수(PBS)에서 각각 5분동안 3x를 세척한다.
- 1시간 동안 서부 블롯 인큐베이팅 박스에서 10% NGS(일반 염소 혈청 1mL에서 PBS-Tw의 10 mL)로 멤브레인을 차단하고, 10%의 NGS의 항체5 μL을 anti-mGlutR1 희석한다. 안티 RDL1 및 안티 RDL2 희석을 확인 (10 % NGS 각각의 10 mL에서 항체의 5 μL). 각 상자의 차단 용액을 희석 된 항체로 교체하고 4 °C에서 하룻밤 (16-24 h)를 둡니다.
- PBS-Tw. 10% NGS PBS-Tw에서 1:10,000에서 1:10,000에서 이차 항체로 멤브레인을 상온(RT)에서 각각 5분 동안 3x로 세척합니다. PBS-Tw에서 멤브레인을 3배 씻은 다음 PBS에서 1배 세탁합니다.
- 웨스턴 케미밀광 HRP 기판을 사용하여 밴드를 검출합니다. RT에서 두 개의 기판을 1:1 (v/v) 혼합하고, 모든 멤브레인을 동일한 상자에 넣고 RT에서 2 분 동안 기판 혼합물로 덮습니다 (붉은 빛이있는 어두운 방에서) 여러 노출 시간을 가진 자가 사진 필름을 사용하여 단백질 검출을 진행하십시오. 일반적으로 하나의 항체는 무게 마커를 가진 2개 또는 3개의 차선 및 1개의 차선에 두뇌 균질성의 동일 희석을 포함하는 1개의 막에 시험됩니다.
3. 면역 세포 화학 절차
- 면역 세포 화학을 위해 꿀벌 의 두뇌를 해부하려면 꿀벌을 얼음에 30 초 동안 고정시하십시오. 꿀벌이 움직이지 않게 된 후, 꿀벌을 가위로 참수하고 PBS에서 4 % 파라 포름 알데히드 용액에 머리를 놓습니다. 연기 후드 에서 작업할 수 있습니다.
주의: 복부는 참수 후에도 여전히 따끔거릴 수 있기 때문에 신체를 신중하게 폐기해야 합니다. - 조심스럽게 신속하게 안테나, 복합 눈을 제거하고 Barraquer 아이리스 가위로 상단 외골격 주위를 잘라냅니다. 머리가 10 분 동안 고정 용액에 앉을 수 있게하십시오. 머리의 외골격의 나머지 부분을 제거하고 나머지 모든 기관을 잘라냅니다.
- 각 뇌를 4% 파라포름알데히드 용액의 적어도 1 mL을 함유하는 1.5 mL 마이크로원지 튜브에 놓고 4-8°C에서 하룻밤 동안 둡니다.
- 에를렌마이어 플라스크에 아가로즈 3.8 g과 증류수 50 mL를 혼합하여 7.6% 아가로즈 용액을 만듭니다. 아가로즈가 액화될 때까지 용액을 전자레인지에 돌리자.
참고 : 작은 티슈 페이퍼를 플라스크 개구부에 배치하여 아가로스 용액이 가열 중에 넘치지는 것을 방지 할 수 있습니다. - 고정 된 꿀벌 두뇌 (3-4 두뇌)를 35mm 페트리 접시에 놓고 티슈 페이퍼로 과도한 고정제를 제거하십시오. 뇌에 액체 아가로즈 용액을 붓습니다. 안테나 로브가 위를 향하게되도록 아가로즈의 뇌를 배향하십시오. 아가로스를 식히고 굳게 합니다.
- 아가로즈가 굳어진 후, 뇌를 포함하는 아가로즈 블록을 잘라냅니다.
- 진동 절제의 경우, 하단에 소수성 메쉬가있는 바구니가 들어있는 각 우물 24 웰 플레이트를 준비하십시오. PBS의 600 μL로 각 우물을 채웁니다.
- 각 블록을 진동 기계를 사용하여 70 μm 횡단면으로 자르고 PBS가 들어있는 바구니에 섹션을 놓습니다.
참고: 같은 뇌의 섹션이 같은 바구니에 놓여 있는지 확인합니다. - PBS-TX로 뇌 섹션을 6x 6x 세척하여 섹션에 고정이 남아 있지 않도록 합니다. 멀티웰 플레이트를 궤도 셰이커에 놓고 210rpm으로 뇌를 씻습니다. 세척 하기 전에 신선한 PBS-TX 솔루션으로 PBS-TX 솔루션을 교체 해야 합니다. 마지막 세척 시 1% 일반 당나귀 세럼으로 차단하십시오.
- 항-mGlutR1 1차 항체를 시험하기 위해, 15 mL 원심분리기 튜브에 9 mL의 PBS-TX를 80 μL에 첨가하여 항mGlutR1 항체의 1:112 희석을 준비한다. 튜브를 짧게 소용돌이로 완전히 섞어줍니다. 항체의 작업 희석은 예비 실험에서 결정되었다.
- 항 RDL 1차 항체를 시험하기 위해, 15 mL 원심분리튜브에서 항RDL 펩타이드 1, 항 RDL 펩타이드 2의 30 μL, 및 6 mL의 PBS-TX를 추가하여 항 RDL 항체의 1:100 희석을 준비한다. 튜브를 짧게 소용돌이로 완전히 섞어줍니다. 항체의 작업 희석은 예비 실험에서 결정되었다.
- 800 μL의 항체 용액을 플레이트의 각 우물에 추가하십시오. 멀티웰 플레이트를 덮고 알루미늄 호일에 싸서 빛에 노출되는 것을 방지합니다. 알루미늄 호일에 싸인 플레이트를 궤도 셰이커에 놓고 2시간 동안 210rpm에서 흔들어 줍니다. 그런 다음 RT에서 흔들림없이 하룻밤을 둡니다.
- 뇌 절편이 밤새 방치된 후, PBS-TX로 10분 동안 씻는다.
- PBS-TX의 9 mL에 이차 항체의 40 μL을 첨가하여 이차 항체의 1:225 희석을 함으로써 이차 항체(당나귀로부터의 항체)를 준비한다.
- 각각의 웰에 이차 항체 희석의 800 μL을 추가합니다. 접시를 덮고 알루미늄 호일에 싸서. 알루미늄 호일에 싸인 플레이트를 궤도 셰이커에 놓고 2시간 동안 210rpm에서 흔들어 줍니다. 그런 다음 RT에서 하룻밤 을 둡니다.
- 일반 PBS 용액으로 각각 PBS-TX와 3x로 뇌 섹션을 3x 10분 동안 세척합니다.
- 슬라이드에 섹션을 포함하기 위해 로드리게스 외20에서수정 된 장착 매체 / 글리세롤 임베딩 솔루션을 준비하십시오. 20 mL PBS에 장착 매체 5g을 넣고 마그네틱 교반기로 16시간 동안 저어줍니다. 글리세롤 10 mL를 넣고 마그네틱 교반기로 16시간 더 저어줍니다. 4,000 x g에서15 분 동안 원심 분리기를 취하고 액체 균질 한 초월제, 1 mL 튜브에서 알리쿼트합니다. -20 °C에서 유지
- 3.17 단계에서 준비된 마운팅 매체를 한 방울 떨어뜨리면서 슬라이드에 섹션을 포함시켜 각 슬라이드에 한 뇌의 섹션이 포함되어 있는지 확인합니다.
- 공액 펩티드와 면역 염색의 preadsorption 제어
- 항 RDL 및 공액 펩티드의 경우, RT에서 하룻밤 동안 상응하는 펩티드 컨쥬게이트와 항 RDL 항체의 작동 희석을 배양: 조건 1) 500 μg 펩티드 컨쥬게이션 키홀 림펫 헤모시아닌 (KLH) 글루타랄데히드를 통해; 조건 2) 어떤 컨쥬게이트없이.
- 각 혼합물을 10,000 x g에서 10분 동안 원심분리하고 두 조건(단계 3.19.1)으로부터 상급체를 수집한다.
- 위에서 설명한 이차 항체로 꿀벌 뇌의 직렬 섹션을 각 상수로 배양하고 과정을 진행합니다. 직렬 섹션은 진동 절편 절차 동안 서로 를 따르는 섹션입니다, 그래서 뇌의 동일한 부분은 긍정적이고 부정적인 컨트롤에 노출됩니다.
- 항-mGlutR1 및 공액 펩티드의 경우,10-4 M 펩티드(상태 1)를 함유하는 KLH 컨쥬게이트 펩티드와 RT에서 항-mGlutR1 항체의 작동 희석을 배양하고 어떤 컨쥬게이트(조건 2)도 없이 배양한다.
- 10,000 x g에서 10 분 동안 각 혼합물을 원심 분리하고 두 컨트롤에서 상류를 수집합니다.
- 꿀벌 뇌의 직렬 섹션을 이차 항체로 조건과 과정 모두에서 상수로 배양하십시오 (단계 3.14-3.15).
- 포함 매체를 사용하여 두 조건의 섹션을 슬라이드에 포함합니다(3.17 단계).
4. 해당 CRISPR-Cas9 시스템의 주입 후 꿀벌 뇌에서 면역 세포 화학에 의한 RDL 및 mGlutR1 단백질 발현 테스트 (섹션 3)
- AmRdl(XM_006565102.3)의 게놈 DNA 서열 및 mGlutR1(XM_006566244.3)의 서열을 사용하여 온라인 CRISPR-Cas9 설계도구(21)를 사용하여 가이드를 설계한다(표1). 5' 끝에 형광 염료 ATTO550을 사용하여 Cas9 crRNA 및 Cas-9 tracrRNA로 주문하십시오. Cas9 뉴클레아제 V3를 주문하십시오(재료 표참조).
- 각 가이드 crRNA 및 트라크RNA의 100 μM 스톡을 뉴클레아제 함유물을 사용하여 CRISPR-Cas 9 시스템의 구성요소를 준비한다. 알리쿼트 및 -20 °C에서 저장합니다. Cas 9 뉴클레아제 V3(10 mg/mL)의 2.5 μL을 47.5 μl의 뉴클레오티드 프리 버퍼에 추가하여 Cas-9 용액의 작동 농도를 준비하여 0.5 μg/μL의 최종 농도를 얻습니다.
- 각 가이드 RNA에 대한 gRNA 복합체 형성을 별도로 준비하십시오 (guideRNA:tracrRNAATTO550)
- gRNA의 이름으로 시험튜브에 라벨을 붙이고, 뉴클레오티드 프리 버퍼 92 μL, 100 μM CRISPR-Cas9 tracrRNA- 5'ATTO550, 및 가이드 crRNA 용액의 4 μL을 추가합니다. 부드럽게 섞어서 돌이십시오.
참고: RDL용 gRNA 튜브의 라벨링의 예: GRDL1, GRDL2, GRDL3(표 1의RDL 가이드 RNA에 대응). mGlutR1에 대한 gRNA 튜브의 라벨링의 예: GMGL1, GMGL2, GMGL3(표 1). - 용액을 95°C로 5분 간 가열하여 gRNA를 만듭니다. RT에서 혼합물을 10분간 식힙니다.
- gRNA의 이름으로 시험튜브에 라벨을 붙이고, 뉴클레오티드 프리 버퍼 92 μL, 100 μM CRISPR-Cas9 tracrRNA- 5'ATTO550, 및 가이드 crRNA 용액의 4 μL을 추가합니다. 부드럽게 섞어서 돌이십시오.
- RNP 복합체 형성(gRNA: S.p Cas9Nuclease), 전달 혼합물 및 대조군을 준비한다.
- RNP의 이름으로 시험관에 라벨을 붙이고 gRNA 용액 6 μL과 0.5 μg/μL S.p Cas9 Nuclease V3의 6 μL을 추가합니다. 부드럽게 혼합하고 주입하기 전에 10 분 동안 37 °C에서 용액을 배양하십시오.
참고: RNP 튜브 라벨의 예: RRDL1, RRDL2, RRDL3. - RNPRDLmix를 만드십시오. 주사에 사용되는 최종 혼합물을 준비하려면 RDL에서 각 RNP의 4 μL을 함께 추가하십시오. RNP/RDL 혼합 = 4 μL RRDL1 + 4 μL RRDL + 4 μL RRDL3.
- RNPmGlutR1mix를 만드십시오. mGlutR1에서 각 RNP의 4 μL을 함께 혼합하여 주사에 사용되는 최종 혼합물을 준비합니다 (RNPmGlutR1mix) = 4 μL RMG1 + 4 μL RMG2 + 4 μL RMG3.
참고: RNP 튜브 라벨의 예: RMG1, RMG2, RMG3. - 가이드RNA 대신 트라크RNA 4 μL, 완충액 92 μL 및 물 4 μL을 혼합하여 대조군 noguideRNA 용액을 만듭니다(섹션 4.3 참조). 이 노가이드RNA 용액의 6 μL과 0.5 μg/μL Cas9 Nuclease V3(단계 4.4.1)의 6 μL을 혼합하여 대조군 주입 용액을 생성한다.
- RNP의 이름으로 시험관에 라벨을 붙이고 gRNA 용액 6 μL과 0.5 μg/μL S.p Cas9 Nuclease V3의 6 μL을 추가합니다. 부드럽게 혼합하고 주입하기 전에 10 분 동안 37 °C에서 용액을 배양하십시오.
5. 주입 절차
- 1.3단계에서 설명한 대로 각 꿀벌을 고정시키고 1.4단계에서와 같이 사료한다. 흰색 상자 (실험 조건)와 블랙 박스 (제어): 다음, 주입 후 꿀벌을 해제하는 두 개의 나무 상자의 두 세트를 준비합니다. 각 상자에는 작은 빗과 먹이페트리 접시가 포함되어야 합니다. 각 상자의 한쪽면은 관찰을 위해 유리로 만들어졌습니다.
- 먹이 페트리 요리를 확인합니다. 35mm 페트리 접시의 덮개를 가지고 표면 의 내부에 왁스를 배치하고, 왁스에 페트리 접시의 하단 부분을 배치합니다. 접시를 상자에 고정합니다.
- 5 mL 주사기를 사용하여 접시의 덮개와 하단 부분에 1M 자당 용액을 주입하십시오. 꿀벌은 두 접시 사이에 신속하게 프로보시스를 넣을 수 있으며 48 시간 의 잠복기 동안 건조한 상태를 유지합니다. 각 상자에 접시 한 접시를 넣습니다.
- 미세 주입 시스템을 준비하려면 기포없이 미네랄 오일로 모세 혈관을 채웁니다. 미세 주입 시스템의 인젝터 홀더에 모세 혈관을 놓습니다. 모세관을 원하는 사출 용액으로 적재하려면 소수성 필름을 평평한 표면에 놓고 용액을 파이펫에 대십시오. 모세 혈관에서 오일을 주입하고 해당 RNP 혼합물로 혼합물을 교체합니다.
- 미세 주입 시스템을 사용하여, 각 꿀벌의 중간 오켈리에 직접 RNP 혼합물 용액의 345 nL를 주입.
- RDL-CRISPR-Cas9 주입의 경우, 단계 4.4.2에 기재된 대로 준비된 RNPRDLmix와 함께 8마리의 꿀벌을 주입합니다. 주사 후 1M 자당을 먹이십시오. 작은 빗과 함께 흰색 (실험) 상자에 그들을 해제하고 48 시간 동안 페트리 접시를 먹이. 주사없이 컨트롤로 다른 여덟 꿀벌을 사용하여, 그들을 공급하고, 검은 색 (제어) 상자에 해제.
- mGlutR1 CRISPR-Cas9의 경우, 4.4.3 단계에서 설명한 대로 준비된 RNPmGlutR1mix와 함께 9마리의 꿀벌을 주입합니다. 제어를 위해 4.4.4 단계에서 기재된 바와 같이 제조된 가이드(RNAmix_noguide)없이 RNA 혼합물로 8개의 꿀벌을 주입한다. 주사 후 1M 자당을 먹이십시오. 5.1절에 기재된 대로 꿀벌을 홀더에서 화이트 박스(실험 조건) 또는 블랙박스(대조군)로 방출한다.
- 습도를 위해 젖은 종이가 있는 폴리스티렌 용기에 상자를 넣습니다. 꿀벌을 48시간 동안 방치하고 하루에 2회 관찰하여 충분한 음식과 습도를 유지합니다.
- 섹션 3에 기재된 바와 같이 각 꿀벌의 뇌를 48시간(단계 3.1) 후 해부하고 면역세포화학을 위한 과정을 진행한다. 항-mGlutR1 면역 염색의 경우 3.11 단계 및 항 RDL 면역 염색을 사용하는 경우 3.12 단계를 사용하십시오.
- 면역 염색된 두뇌 단면도에 있는 형광의 수준을 평가하기 위하여 공초점 화상 진찰을 능력을 발휘합니다.
- 면역 표지된 두뇌에 있는 단백질의 감소를 평가하기 위하여는, 통제와 주입한 두뇌 둘 다를 위한 이득의 동일한 수준에 공초점 심상 수집을 이용하십시오.
6. CRISPR Cas9 RNPRDLmix 주입 후 변형 된 게놈 RDL DNA 48 H를 평가하기 위한 qPCR 기반 드롭오프 분석
- 프라이머, 제어 프로브 및 드롭오프 프로브를 설계하여 CRISPR-Cas9 주입에 의해 변형된 DNA의 양을 평가합니다. 각 프라이머는 CRISPR-Cas 9 가이드를 하나 이상 측면에 두며 앰플리콘 크기는 132bp가 되도록 설계되었습니다. 사용되는 프라이머와 프로브는 다음과 같습니다.
RDL1_For: CTCGGAGTGACCACCGT
RDL1_Rev: 카가그GC가아카카캣
RDL1_control_probe: /5HEX/CGA+C+G+TTT+A+C+CT/3IABkFQ/
RDL1_Drop off_probe: /56-FAM/CCTA+C+G+T+CA+A+GT/3IABkFQ/- 프라이머가 영역에 특정한 고유 시퀀스에 해당하는지 확인합니다. 드롭오프 프로브가 RDL-CRISPR-Cas9 가이드와 겹치는 영역에 대해 설계되었는지 확인합니다.
- 가이드 영역에 gDNA의 수정이 있는지 테스트하려면 단계 5.3.1에 설명 된 RNP_RDL 혼합물과 함께 오셀리에 12 개의 꿀벌을 주입하고 8 개의 주입되지 않은 꿀벌을 대조군으로 사용합니다.
- 주사 후 48시간 동안 주사 후 개뇌없이 꿀벌 뇌를 해부하고 각 주입된 꿀벌 뇌의 gDNA를 추출하고 제조사의 프로토콜에 따라 키트를 사용하여 꿀벌 뇌(광학 엽 제외)를 추출합니다(재료 표참조).
- 분광광도계를 사용하여 추출된 gDNA의 양, 품질 및 순도를 평가합니다.
- qPCR 기반 드롭오프 프로토콜 및 실시간 PCR 사이클러를 사용하여 AmRDL의 변형된 gDNA의 상대적 발현을 정량화합니다.
- 올리고를 100 μM으로 재중단하고 프라이머를 10 μM으로 희석하고 프로브를 5 μM으로 희석합니다.
- gDNA(3회 반복)의 1개 샘플에 대해 여기에 표시된 바와 같이 96웰 플레이트에서 PCR 반응을 설정합니다: 마스터 믹스 10 μL(재료 표참조), 순방향 프라이머 1 μL, 역방향 프라이머 1 μL, 대조군 프로브 1 μL, 드롭오프 프로브 1 μL, gDNA 2 μL(50 ng), 4 μL의 핵물질 물질을 2μl의 핵물질 물질을 가져온다.
참고: 컨트롤은 프로브 대신 샘플과 물 대신 솔루션입니다. - 실시간 PCR 사이클러에 대해 다음과 같이 사이클링 프로그램을 설정합니다: 3분 동안 95°C, 15s에 대해 95°C의 40 사이클, 1분 동안 60°C.
- 2-ΔΔCt 방법을 사용하여 상대유전자 변형을 평가합니다.
 및
및
7. RNPRDLmix 주입 후 RDL RNA 48 H의 상대 정량화
- RDL mRNA의 감소가 있는지 테스트하려면 단계 5.3.1에 설명된 대로 RNP_RDL 혼합물로 오셀리에 20개의 꿀벌을 주입하고 12개의 주입되지 않은 꿀벌을 대조군으로 사용합니다. 주사 후 48 시간 동안 꿀벌 뇌를 해부하고 각 주입 된 꿀벌에서 총 mRNA를 추출하고 제조업체의 프로토콜을 사용하여 분리하십시오 (재료 표참조).
- DNA가 없는 키트를 사용하여 시료에 남아 있는 DNA 잔류물을 제거합니다(재료 표참조).
- 분광광도계를 사용하여 추출된 RNA의 품질 과 순도를 평가합니다.
- 384 웰 플레이트에 대한 제조업체의 프로토콜을 사용하여 실시간 PCR 사이클러에서 시판되는 형광 녹색 RT-PCR키트(표)를사용하여 AmRDL의 발현을 정량화합니다.
참고: 이 실험에서는 이전에 게시된 프라이머가 사용되었습니다. AmRDL (AmRDL_F GGTCGATGCTACTACCTG; AmRDL_R TCGATACTTGATTAGGA)22 및 액틴 프라이머를 기준 유전자[AmActin_F TGCCAACACTGTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTG] AmActin_R 가트가카카카카]23. 상대적인 유전자 발현은2-ΔΔCt 방법(단계 6.6)을 사용하여 계산하였다.
8. RNPmGlutR1mix 주입 후 변형 된 게놈 DNA 48 H를 평가하기 위한 qPCR 기반 드롭오프 분석
- 프라이머, 제어 및 드롭오프 프로브를 설계하여 CRISPR-Cas9 주입에 의해 변형된 DNA의 양을 평가합니다. 프라이머를 설계하여 CRISPR-Cas 9 가이드를 하나 이상 측면에 두고 앰플리콘 크기가 96bp가 되도록 합니다.
mGlutR1_For: GGTGAACGAACGACGGA
AmGlurR1_Rev: 가가가그가가가가가가가가가가가가
AmGlurR1_control_probe: /5HEX/CGAGG+G+AAA+CGA+GT/3IABkFQ/
AmGlurR1_Drop off_probe: /56-FAM/CGA+C+A+C+CG+TC/3IABkFQ/
참고: 프라이머가 수정되어야 하는 영역과 관련된 고유 시퀀스에 해당하는지 확인합니다. 드롭오프 프로브는 CRISPR-Cas9 가이드와 중첩된 영역을 위해 설계되었습니다. - 가이드 영역에 gDNA의 수정이 있는지 테스트하려면 단계 5.3.1에 설명 된 대로 RNP_ GlutR1 혼합물로 오셀리에 12 개의 꿀벌을 주입하고 8 개의 주입되지 않은 꿀벌을 대조군으로 사용합니다.
- 주사 후 48 시간 (광학 엽없이) 꿀벌 뇌를 해부하고 각 주입에서 gDNA를 추출하고 제조업체의 프로토콜을 사용하여 꿀벌 뇌 (광학 엽없이)를 제어하십시오 (재료 표참조).
- 분광광도계를 사용하여 추출된 gDNA의 양, 품질 및 순도를 평가합니다.
- 6.5단계에서 설명한 바와 같이 qPCR 드롭오프 프로토콜 및 실시간 PCR 사이클러를 사용하여 gDNA AmGlutR1의 상대적 변형을 정량화합니다.
- 2-ΔΔCt 방법을 사용하여 상대유전자 변형을 평가합니다.
 및
및
9. RNPmGlutR1mix 주입 후 mGlutR1 RNA 48 시간 정량화
- mGlutR1 RNA mRNA에 있는 감소가 있는 경우에 시험하기 위하여는, 단계 5.3.2에서 기술된 대로 RNP_RDL 혼합으로 오셀리에 있는 6개의 꿀벌을 주입하고 통제로 6개의 주입되지 않은 꿀벌을 이용하십시오. 주사 후 48시간 동안 꿀벌 뇌를 해부하고, 각 주입된 꿀벌로부터 총 mRNA를 추출하고, RNA 분리를 위한 제조업체의 프로토콜을 사용하여 분리합니다(재료 표참조).
- DNA가 없는 키트를 사용하여 시료에 남아 있는 DNA 잔류물을 제거합니다(재료 표참조).
- 분광광도계를 사용하여 추출된 RNA의 품질 과 순도를 평가합니다.
- 384 웰 키트에 제공된 프로토콜을 사용하여 실시간 PCR 사이클러에서 SYBR 그린 RT-PCR 키트(재료 표참조)를 사용하여 mGlutR1의 발현을 정량화합니다. mGlutR1에 대한 다음 프라이머를 사용 (mGlut_F CCTCCTCAACGTCTCTCATA; mGlut_R TGCGTGTGTTGATTT) 및 기준 유전자로 액틴 프라이머 [AmActin_F TGCCAACACTGTTTTCTTG; AmActin_R 가트가카카카카]. 2-ΔΔCt 방법(단계 8.6)을 사용하여 상대적인 유전자 발현을 계산한다.
결과
안티 RDL 항체 테스트
항체는 도 1A에도시된 바와 같이 RDL 펩티드 접합체에 대하여 제조되었다. 항-RDL 항체를 특성화하는 첫 번째 단계는 항 RDL 항체및 HRP 표지염소 표지 된 IgG 이차 항체를 이용한 웨스턴 블롯을 사용하여 꿀벌 뇌로부터 추출된 단백질의 균질계를 확인하는것이다(도 1A,삽입). 두 항-RDL 항체는 RDL 소단위 이소포름 단백질의 추정 중량에 상응하는 ~50-60 kD(화살표)에 위치한 밴드를 인식했다. 항RDL 항체가 뇌 슬라이스에서 펩티드를 인식한다는 것을 입증하기 위해, 우리는 preadsorption 제어(그림 1B,C)를사용했다. 항체가 공액 펩티드로 미리 포인되었을 때, 섹션의 염색은 없었다. 이는 항-RDL 항체가 제기된 컨쥬게이트 펩티드를 인식한다는 것을 입증했다. 항 RDL 항체가 고정 된 뇌 조직에서 단백질을 인식한다는 것을 입증하기 위해 CRISPR-Cas9를 사용하여 세포에서 RDL 단백질을 생성하는 RDL 유전자를 제거했습니다. 도 1D1-3은,반RDL 항체로 표지된 대조군 전두엽 꿀벌 뇌 절편을 나타낸다. 이 꿀벌은 RDL-CRISPR-Cas9 RNP를 주입하지 않았다. 그림 1D1에서,반대로 RDL은 꿀벌 두뇌의 정면 단면도에 있는 neuropils를 표시합니다. 도 1D2의 동일한 정면 섹션은 RDL-CRISPR-Cas9 복합체가 주입되지 않았기 때문에 ATTO550에서 형광의 부재를 나타낸다.
도 1E1-E3는 RDL-CRISPR-Cas 9로 주입된 꿀벌로부터의 뇌 섹션을 도시하고 도 1D1-D3에서대조뇌와 동일한 양의 항체로 처리한다. 반RDL 염색은 주사 후 48시간 전체뇌에서 현저히 감소하였고, ATTO550의 분포는 뇌에서염색(도 1E2)은꿀벌 중간 오펠리에서 RDL-CRISPR-Cas 9 주사의 성공을 나타낸다. 뇌의 여러 산란 세포는 ATTO550을 전시합니다. RDL-CRISPR-Cas 9의 성공적인 주사는 대조군과 비교하여 단백질 발현을 감소하였다(도1E1-3). 8개의 면역염색된 꿀벌 뇌에서, 오직 한 뇌만이 버섯 체체, 프로토세레브럼 및 안테나 로브의 세포에서 RDL-CRISPR-Cas9의 높은 분포를 보였으며, 다른 뇌는 버섯 체내 꽃받침, 중앙 복합체, 안테나 로브에서 ATTO550으로 세포 염색을 했다. 이 꿀벌에서, 감소 반대로 RDL 면역 염색은 그림 1E1에도시된 두뇌에서 와 같이 극적이지 않았다는 것을 주의하는 것이 중요합니다.
다음으로, RDL-CRISPR-Cas9 주입 후 꿀벌48시간에서 수정된 RDL gDNA의 수준을 추정하기 위해, 우리는 드롭오프 프로브가 RDL gRNA 중 하나의 영역과 일치하도록 설계된 qPCR 드롭오프 테스트를 수행했습니다. 이러한 실험에서, RDL-CRISPR-Cas 9를 주입한 꿀벌 뇌에서, 형광의 상대적 감소는 샘플에서 변형된 gDNA의 수에 대응하였다. 본 시험에서 RDL-CRISPR-Cas9를 주입한 12마리의 꿀벌에서 gDNA에 이 가이드에 해당하는 영역은 비주입 된 꿀벌의 gDNA와 비교하여 64 % ± (평균 ± 30 % SD)이었다(그림 3A).
다음으로, 주사 후 48시간 동안 꿀벌에서 RDL RNA의 수준을 추정하기 위해, 우리는 별도의 꿀벌 군에서 qRT-PCR을 수행하였다(도3B). 우리는 RDL-CRISPR-Cas 9의 RDL RNA 수준을 주입되지 않은 꿀벌의 RNA 수준과 (n = 19) 주입되지 않은 꿀벌의 RNA 수준과 비교했습니다 (n = 12). 이들 실험에서, mRNA RDL의 상대적 감소는 비주입 된 꿀벌에서 RNA의 수준과 비교하여 59 % ± (평균 ± 15 % SE)이었다. 각 꿀벌의 RDL RNA 수준을 개별적으로 조사했을 때, 19개의 꿀벌 중 오직 13개의 꿀벌만이 RNA의 현저한 감소를 보였다. 이 데이터는 오셀리를 통해 RDL-CRISPR-Cas9의 주입이 항상 많은 수의 뇌 세포에 도달하지 않을 수 있음을 나타내며, 이는 RDL 면역 염색 RDL-CRISPR-Cas9 주입 꿀벌로 데이터를 확인합니다. 이러한 제제에서, 8개 중 1개의 꿀벌만이 다른 꿀벌 뇌와 비교하여 많은 뇌 세포(버섯 체, 프로토세레브룸 및 안테나 로브)에서 RDL CRISP-Cas9를 가졌으며, 여기서 RDL-CRISPR-Cas9의 분포는 프로토세레브룸(버섯 체꽃 체액 및 중앙 복합체)에 있는 세포에 집중되었지만 안테나 로브는 없었다(도4).
항 mGlutR1 항체 테스트
우리는 드로소필라 멜라노가스터에 특이적인 공액 펩티드에 대하여 토끼에서 생성된 항mGlutR1 항체를 사용하였다(도2A). 이러한 펩티드의 서열은 꿀벌 펩티드(CLSDKTRFDYFARTVPPD)를 가진 94% 동일정체성을 나타낸다. 첫째, 우리는 면역 블로팅을 사용하여 꿀벌 뇌 단백질에 대한 항체를 확인했습니다. 꿀벌 뇌 균질화는 10% SDS-PAGE로 분리하고 전기 영동을 니트로셀룰로오스 멤브레인으로 옮기고 안티-mGlutR1로 염색하였다. 그림2A의 삽입은 2개의 이소폼에 해당하는 예상 가중치(103 및 83 kD)를 가진 두 개의 밴드를 나타낸다. 우리가 꿀벌 두뇌에 이 항체를 시험할 때, 우리는 그림 2B,D에도시된 것과 같이 꿀벌 두뇌 단면도에 있는 neuropilar 단면도 및 세포를 레이블을 붙이는 것을 것을을 발견했습니다. 공액-mGlutR1 펩티드로 항-mGlutR1 항체의 퍼즈소어링 후, 꿀벌 뇌 슬라이스에서 특이적 염색이사라졌다(도 2C). 이는 항-mGlutR1 항체가 펩티드를 인식한다는 것을 확인한다(도2C). 다음으로, 우리는 중앙 오켈리에 mGlutR1-CRISPR-Cas9의 혼합을 주입하고 대조군 noguideRNA를 사용했습니다. 대조군 꿀벌(n=7)에서, ATTO550으로부터의 형광은 세포에 집중되지 않았다. 일부 뇌는 ATTO550 라벨을 산란했다. 따라서, 도 2D1-3의 대조군 제제는 ATTO550 형광이 아닌 뇌에서 안티-mGlutR1 염색을 나타낸다. mGlutR1-CRISPR-Cas9가 오셀리에 주입되고 많은 세포에 의해 채택되었을 때, 이차 항체의 형광 수준은 기능성 mGlutR1RNP를 취하는 영역에서 현저히 감소하였다(도2E1-3). 꿀벌은 48시간 동안 모니터링되었고, 각 실험 조건에서 벌 한 마리가 죽은 채로 발견되었습니다. 따라서, 이 실험에서는 7개의 대조군 꿀벌과 8마리의 CRISPR-Cas9 꿀벌을 확인했습니다. CRISPR-Cas9로 주입된 모든 꿀벌은 mGlutR1-CRISPR-Cas9에 세포를 주입하였다. 이 세포의 대부분은 버섯 바디 꽃받침에 있었다, 중앙 복합체, 및 후방 protocerebrum. 7개 중 2마리의 꿀벌만이 버섯 체체, 중앙 복합체 및 안테나 로브의 많은 세포에서 ATTO550 라벨링을 보였습니다. 이러한 꿀벌 중 하나의 예는 그림 2E에도시되어 있습니다. 이러한 제제에서 mGlutR1 염색의 수준이 감소하는 것은 유의했다. 다른 5마리의 꿀벌은 버섯 체체 및 후방 프로토세레브럼에서 mGlutR1 CRISPR-Cas9의 성공적인 전달에 상응하는 ATTO550 라벨링을 가지고 있지만 안테나 로브에는 없습니다.
다음으로, 주사 후 48시간 동안 꿀벌에서 수정된 mGlutR1 gDNA의 수준을 추정하기 위해, 우리는 qPCR 기반 드롭오프 테스트를 수행하였고, 여기서 드롭오프 프로브는 mGlutR1 가이드 근처 의 영역에 있도록 설계되었습니다. 이러한 실험에서, mGlutR1-CRISPR-Cas 9를 주입한 꿀벌 뇌에서, 12마리의 꿀벌에서 gDNA의 상대적 변형은 59% ±(평균 ± 33%SD)였고, 비주사된 꿀벌의 gDNA와 비교하였다(도3A).
이러한 결과는 또한 꿀벌의 다른 그룹에서 qRT-PCR 테스트에 의해 확인되었으며, 여기서 우리는 RNPmGlutR1mix로 주사 한 후 48 시간 동안 꿀벌에서 qRT-PCR을 사용하여 mGlutR1 RNA 수준을 추정했습니다(그림 3B). 우리는 mGlutR1-CRISPR-Cas9의 mGlutR1 RNA 수준을 주입되지 않은 꿀벌의 RNA 수준과 꿀벌 (n = 6)을 비교했습니다 (n = 6). 이러한 실험에서, 주입된 꿀벌에서 mRNA mGlutR1의 상대적 감소는 53% ±(평균 ±18% SE)였고, 무주사 된 꿀벌과 비교하였다(도3B).
버섯체의 케년 세포에서 RNP RDL-CRISPR-Cas9를 발현한 4개의 상이한 꿀벌의 절편은 도 4A-D에나타내고 있다. 버섯 체내에 ATTO550 형광과 안테나 로브를 가진 예는 도 4E,F에도시되어 있다.
| 가이드 | 시퀀스 | gRNA | RNP |
| [가이드RNA:트라크르RNA] | [gRNA:Cas9 뉴클레아제] | ||
| RDL_Guide1 | ACCGTACGACCCCCGCT | GRDL1 | RRDL1 |
| RDL_Guide2 | 아크GTCGATCGTGACGT | GRDL2 | RRDL2 |
| RDL_Guide3 | CCATGACGAAACACGCCC | GRDL3 | RRDL3 |
| mGlu_Guide 1 | CGAAGATCTGACGGT | GMGL1 | RMGL1 |
| mGlu_Guide 2 | TTCAACGAGAGCAAGTTCAT | GMGL2 | RMGL2 |
| mGlu_Guide 3 | GCAAACGTCGGTAGGAGGGA | GMGL3 | RMGL3 |
표 1: RDL 및 mGlutR1용으로설계된 가이드의 뉴클레오티드 서열.
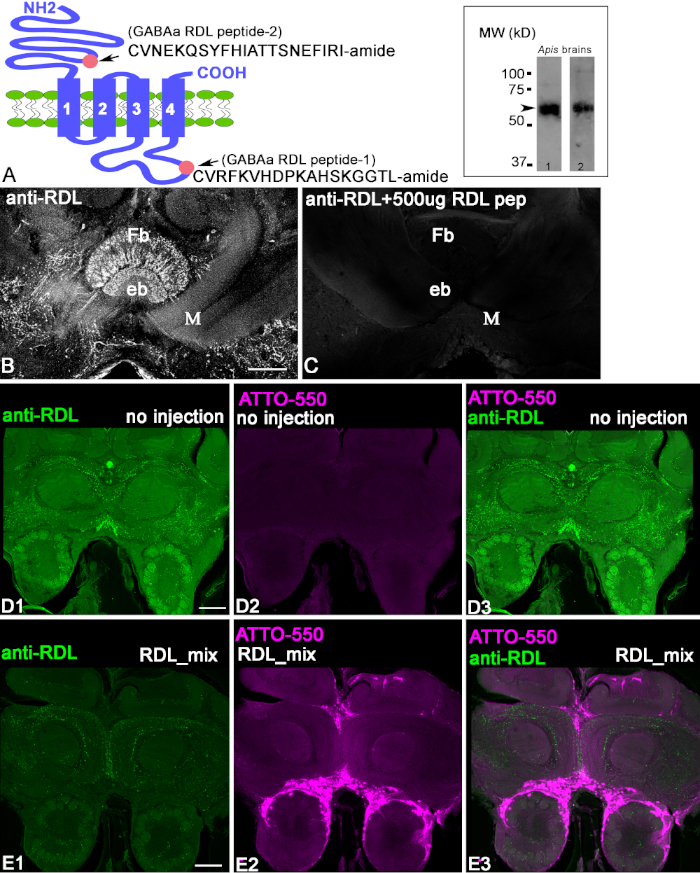
그림 1: 항 RDL 항체의 특성화. (A)RDL 소단위의 회로도는, 분홍색 원이 C-종단에서 N-종단 및 펩티드 1(세포내 CVRFKVVVKKKHSKGGL-amide)에서 펩티드 2(세포외 CVNEQSYFHIATSNEINI-amide)의 국소화를 나타낸다. A에 삽입된 것은 상응하는 항 RDL 항체(항 RDL 펩1 및 항 RDL 펩2)로 처리된 꿀벌 뇌 추출물의 서쪽 얼룩에 있는 밴드를 나타낸다. 각 면역블롯은 RDL 소단위의 다양한 이소폼의 추정 중량에 상응하는 단백질 ~50-60 kD의 명백한 크기를 나타낸다. (B, C) 공액 펩티드 1을 가진 반대로 RDL 항체의 preadsorption. C의 이미지는 항체가 공액 펩티드 1로 미리 인양되었을 때 섹션의 염색 감소를 나타낸다. 부채형 몸체(Fb)와 타원체(eb)는 뇌의 중앙 복합 구조입니다. M = 버섯 몸체의 내측 엽. (D1-3) 대조군, 48시간 후 무주사 된 꿀벌 뇌 섹션의 안티 RDL 염색. (D2) 이 꿀벌은 주입되지 않았으며 ATTO550 형광을 포함하지 않습니다. (D3) D1 및 D3에서 이미지를 병합 . (E1-3) RDL-CRISPR-Cas9의 주입은 세포 핵에서 48 시간(E2)ATTO550 형광 후 항 RDL 염색을 감소시키는 성공적인 RDL-CRISPR-Cas9 전달을 나타냈다. (E3) RDL(녹색)과 ATTO550(빨간색)의 병합된 이미지입니다. 배율 막대 = 100 μm (B-E). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
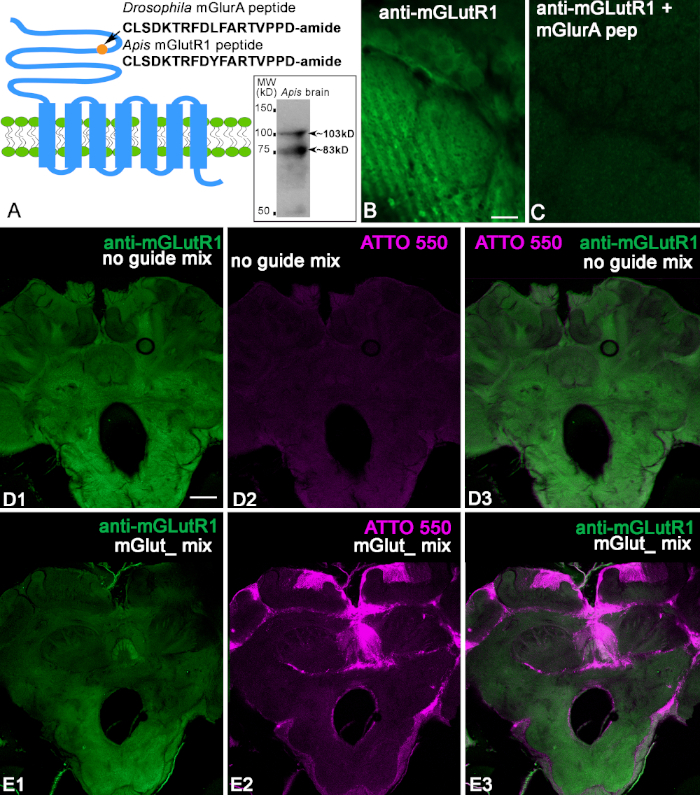
그림 2: 항 mGlutR1 항체의 특성화. (A)면역에 사용되는 드로필라 멜라노가스터 펩티드를 보여주는 GCPR mGluR의 회로도. 비교를 위해, 아피스 멜라이프라 펩티드는 아래와 같이 나타낸다. 원은 mGlutR1 수용체 세포외 도메인의 N-말기에서 펩티드의 국소화를 나타낸다. A에 삽입된 항-mGlutR1 항체는 알려진 이소폼의 추정 중량에 해당하는 꿀벌 뇌 ~103 kD 및 ~83 kD의 서쪽 블롯에서 두 개의 밴드를 인식한다는 것을 보여준다. (B, C) 안테나 로브 사구체의 연속2부에서 항mGlutR1 항체의 퍼디저프 제어. C의 안테나 사구체 섹션에서 항-mGlutR1 의 이미지는 항-mGlutR1 항체를 가진 항-mGlutR1 펩티드의 사전 인큐베이션의 결과로서 염색의 감소를 나타낸다. 이 절차는 항체가 B (예양에서 펩티드의 부재)와 비교하여 염색을 폐지하는 용액에서 침전시킵니다. (D1)중간 오셀루스에서 대조군 주사 후 꿀벌 뇌 슬라이스에서 항-mGlutR1의 염색을 나타낸다. 이 주사는 CRISPR-Cas9에 의한 mGlutR1 수용체의 노크를 가능하게 하는 mGlutR1 gRNA가 부족하여, 따라서 항-mGlutR1 항체의 염색이 감소되지 않았다(녹색). (D2) ATTO550 형광의 부재는 뇌에서 기능적 CRISPR-Cas9의 부재를 나타냅니다. (D3) 안티 mGlutR1 및 ATTO550의 병합 된 이미지. (E1-E3)는mGlutR1이 중앙 오셀루스에서 mGlutR1-CRISPR-Cas 9를 주사한 후 48시간 동안 영구적으로 쓰러진 뇌 섹션에서 안티-mGlutR1의 염색을 보여준다. 따라서, 많은 세포에서 mGlutR1의 성공적인 녹아웃으로 인해이 뇌의 얼룩이 크게 감소된다. (E2) 꿀벌 뇌의 많은 세포 핵에서 ATTO550 염색은 mGlut1-CRISPR-Cas 9의 주입이 성공적이었음을 나타냅니다. (E3) ATTO550 (빨간색) 및 안티 mGlutR1 (녹색)의 병합 된 이미지. 배율 막대 = 10 μm (B,C); 100 μm (D,E). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
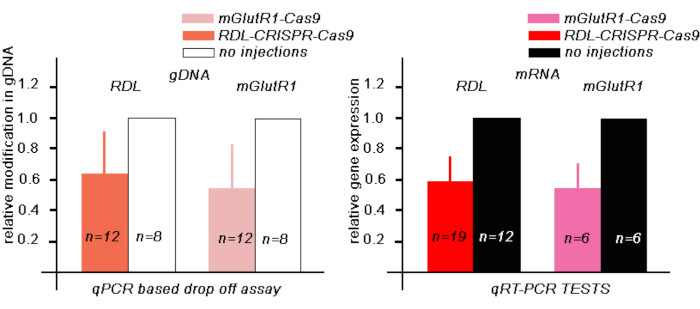
도 3: 상응하는 RPN CRISPR-Cas9의 345 nL로 주사 후 48시간 동안 꿀벌 뇌에서 RDL 및 mGLUTR1 mRNA의 변형된 gDNA 및 mRNA의 발현을 평가한다. (a)수정 면적을 가진 gDNA의 양을 평가하기 위한 qPCR 기반 드롭오프 분석 시험을2-ΔΔCt 방법을 사용하여 계산하고, 주입되지 않은 뇌의 제어에 대해 정규화하였다. 데이터는 평균 + SD로 표현된다.(B)TheqRT-PCR 시험은 CRISPR-Cas9주입 및 무주입 꿀벌에서 mRNA의 양을 평가하는데 사용되었다. 암액틴은 기준 유전자로서 사용하였다. 상대유전자 발현은2-ΔΔCt 방법을 사용하여 계산하고, 주입되지 않은 뇌의 제어에 대해 정규화하였다. 데이터는 평균 + SE로 표현됩니다.
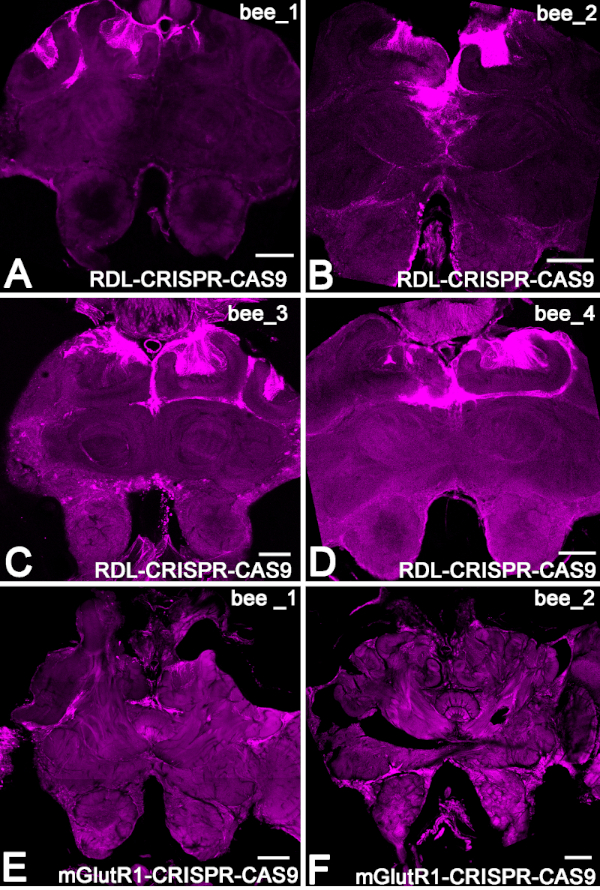
그림 4: ATTO550 형광을 통해 꿀벌 뇌에서 RNP CRISPR-Cas9의 분포의 예. (A-D) 버섯 몸의 케년 세포에서 RNP RDL-CRISPR-Cas9를 발현한 4개의 다른 꿀벌의 뇌 섹션. (E, F) RNPmGlutR1 CRISPR-Cas9로 주사 한 후 두 개의 뇌 48 시간의 예. 배율 막대 = 150 μm (A-F). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
안티 RDL 및 안티 mGlutR1의 특성화
첫째, 우리는 고정 된 꿀벌 뇌의 조각에 면역 블롯 및 사전 흡착에 의한 항 RDL 및 항 mGlutR1 항체를 특징으로합니다. 각 항체는 모든 알려진 이소폼을 인식하도록 만들어졌으며, 서양 분석은 예측된 분자량에 해당하는 밴드를 인식한다는 것을 보여줍니다. 다음으로, 두 항체는 꿀벌 뇌 섹션에서 생산된 공액 펩티드에 의해 차단되었다.
우리의 연구 결과에 있는 첫번째 목표의 한개는 특정 공액 펩티드에 대하여 생성된 항체가 고정된 두뇌 조직에 있는 그것의 단백질에 특정하다는 것을 설치하는 것이었습니다. 이를 위해 CRISPR-Cas9 시스템을 활용했습니다. 우리는 꿀벌 RDL 및 mGlutR1에 대한 특정 가이드를 설계하고 형광 프로브 ATTO550로 라벨CRISPR-Cas9를 만들기 위해 각각을 사용했다. 각 수용체에 대해, 우리는 우리가 디자인한 Cas9 시스템을 취한 세포에 있는 대응하는 유전자를 제거해서 성숙한 꿀벌 두뇌에 있는 표적으로 한 단백질의 양을 감소시키기 위하여 오셀리에 있는 3개의 다른 CRISPR-Cas9 리보뉴클레오 단백질의 혼합물을 주입했습니다. 우리의 연구에서, 우리는이 단계를 달성.
이러한 실험의 성공을 위한 첫 번째 중요한 단계 중 하나는 적절한 가이드 RNA를 설계하는 것입니다. 유전자 서열의 시작, 중간 및 끝에 위치한 최대 5개의 가이드 RNA를 설계하는 것이 좋습니다. 우리의 예비 작업에서, 우리는 3 ~ 5 마리의 꿀벌에 다양한 조합으로 테스트했습니다. 우리는 또한 주사의 다른 농도 시도, 뿐만 아니라 주사 후 시간, 그리고 주사에 RNP의 다양 한 혼합물. 우리는 두뇌를 해부하고 반대로 RDL 및 반대로 mGlutR1 항체를 사용하여 가공했습니다. 이러한 초기 테스트에서, 우리는 적절 한 조합을 설립, 주입 후 시간, 농도 및 주입에 대 한 CRISPR-Cas9의 양 뿐만 아니라. 이러한 초기 테스트는 여기에서 자세히 설명한 실험을 설정하기 위한 기초가 되었습니다.
목표는 두 배였다: 1) 우리의 항체 염색은 CRISPR-Cas9 및 2) 행동 연구를위한 최상의 실험 조건을 통해 작동하도록 치료 후 감소 된 꿀벌에서 입증. 따라서, 많은 세포 핵이 주사 후 CRISPR-Cas9 48 h를 함유하는 경우, 안티-RDL 및 안티-mGlutR1 염색의 감소가 중요하다는 것을 보여준다. 추가적으로, 시험된 항체가 꿀벌 두뇌 준비에 있는 mGlut1 그리고 RDL 단백질을 구체적으로 인식하고 꿀벌 두뇌에 있는 현지화 연구 결과에서 사용될 수 있다는 것을 보여줍니다.
행동 연구를 위한 실험 설정 CRISPR-Cas9
다음으로, 우리는 CRISPR-Cas9가 행동 연구에 사용될 수 있도록 실험을 설정했습니다. 8개 또는 9마리의 꿀벌을 대조군 및 실험적 치료를 위해 수집하였다. 그(것)들은 주입 전후에 행동으로 시험되고, 그 후에 그들의 두뇌는 표적 단백질의 감소를 보인 두뇌 지구를 결정하기 위하여 ATTO550 및/또는 면역세포화학을 위해 가공되었습니다. 여기서 한 세트의 실험에 대해 취한 꿀벌의 수는 대조군 및 실험 조건에 대해 8-9 개 이하의 꿀벌로 제한되었다는 점에 유의해야합니다. 이 방법으로 두 조건을 같은 날에 테스트할 수 있습니다. 또한, 일단 우리가 주사에 대 한 CRISPR-Cas9 혼합물을 준비, 우리는 결코 그들을 동결. CRISPR-Cas9 혼합물은 3일 연속으로 사용했을 때 효능이 변하지 않았고 4-8°C에서 보관하였다. 그러나, 우리는 3 일 후에 그것을 시험하지 않았습니다.
실험 주사의 두 세트와 두 항체 모두에 대한 결과 섹션에서 설명했듯이, 테스트된 16개 꿀벌 중 3개만이 버섯 체체, 프로토세레브룸 및 안테나 로브에서 큰 분포ATTO550을 보였다. 다른 모든 꿀벌에서, CRISPR-Cas9의 분포는 버섯 몸, 중앙 복합체 및/또는 후방 프로토세레브럼으로 제한되었습니다. 이 주입 방법을 사용 하 여 대상 단백질의 감소 꿀벌의 대부분에 버섯 시체에만 제한 됩니다 어떤 행동 연구에 대 한 이해 하는 것이 필수적이다. 그것은 안테나 로브 또는 식도 신경절로 확장되지 않습니다. 따라서, 우리가 사용하는 주입 기술은 행동 실험에서 버섯 체내 및 중앙 복합체의 수용체 감소의 효과를 연구하는 데 적합하며, CRISPR-Cas9를 도입하는 다른 방법은 다른 뇌 영역을 연구하는 데 더 적합할 것입니다.
결론적으로, 우리의 연구는 뇌의 항체 염색을 위한 대조군으로 CRISPR-Cas9의 성공적인 적용을 입증했습니다. 항체(anti-RDL 및 anti-mGlutR1)의 경우, mGlutR1-CRISPR-Cas9 또는 RDL-CRISPR-Cas9의 섭취가 성공했을 때, 상응하는 항체 염색의 수준도 현저히 감소되었다. 또한, 오켈리에 주입 균질 하지 않은 뇌에서 CRISPR-Cas9의 분포를 주도 하는 주의 하는 것이 필수적이다. 분포는 오켈리와 버섯 몸을 둘러싼 최소한의 영역에서 전체 뇌의 많은 세포에 다양. 세포에 의한 mGlutR1-또는 RDL-CRISPR-Cas9 의 가변성은 주사의 변화에 기인할 가능성이 높았다. 우리의 데이터는 CRISPR-Cas9 시스템이 꿀벌에서 작동한다는 것을 보여줍니다, 그러나 주입의 방법은 개별 꿀벌 두뇌에 걸쳐 CRISPR-Cas9 섭취량의 가변성을 감소시키기 위하여 향상될 필요가 있습니다. 이러한 제한 내에서, 행동 실험을 위한 성인 꿀벌에 있는 유전자를 조작하기 위하여 이 기술을 채택하는 것이 지금 가능합니다.
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 BHS에 다음과 같은 상에 의해 지원되었다: 인간 국경 과학 프로그램; NIH NIGMS (R01 GM113967); NSF 아이디어 랩 (1556337). DmGluRA에 대한 펩티드 및 항체는 DR. Serge Birman (마르세유, 루미니, 프랑스) 연구소에서 설계되었다 때 IS는 프로그램 d'Urgence FRM / Postdocs UFP20060306548 에 의해 지원되었다 라 Recherche 의료를 부어. 우리는 RDL 가이드와 qPCR 드롭 오프 어세의 설계에 대한 도움을 통합 DNA 기술 (IDT)에서 다니엘라 Junqueira 마로시와 알렉스 한터에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Acetic Acid | Sigma-Aldrich | A6283_100 mL | western blotting |
| Acrylamide-bis Acrylamide | Bio-Rad | 500 mL 1610156 | western blotting |
| Agarose | Sigma-Aldrich | A0169-250g | used with distilled water to fix honey bee brain in blocks |
| Alexa Fluor 488 AffiniPure F(ab')2 Fragment Donkey Anti-Rabbit IgG (H+L) | Jackson Research Laboratories | 711-546-152 | secondary antibody to reveal the primary antibodies from rabbit |
| Alt-R CRISPR-cas9 tracrRNA-5'ATTO | IDT | 1075934 | with desinged guide RNA, it creates gRNA |
| Alt-R S.p. Cas9 nuclease V3 | IDT | 1081058 | enzyme used to make ribonucleoprotein for CRISPR system |
| Ammonium Persulfate | Bio-RAD | 10 g 1610700 | western blotting |
| Anti-mGlutR1 antibodies | Covalab (FRANCE)/21st Century Biochemical | characterized by authors in present paper | Used for primary incubation of mGlut 1 in honey bees |
| Anti-RDL antibodies | 21st Century Biochemical | characterized by authors in present paper | Used for primary incubation of RDL in honey bees |
| Aprotinin | Sigma-Aldrich | Y0001154 | protease inhibitor |
| Barraquer Iris Scissors 7mm Blade Sharp point | World Precision Instruments | 14128-G | used for dissection honey bee brain |
| Benzamidine | Sigma-Aldrich | 12072 | protease inhibitor |
| Blade (breakable) for blade holder | Fine Science Tool | 10050-00 | dissection for western blotting |
| Blade holder and breaker | Fine Science Tool | 15309 | dissection for western blotting |
| Borosilicate glass capillaries | World Precision Instruments | 1B100 F | for injection procedure |
| Chemiluminescent western blot detection substrate | Bio-Rad | 1705062 | western blotting |
| Chloroform | Sigma-Aldrich | 472476-50mL | RNA isolation |
| Dithiothreitol | Bio-Rad | 1610611 | western blotting |
| DNA easy kit | QIAGEN | 69504 | DNA extractionuj |
| DNA-free kit | INVITROGEN | AM1907 | Used to remove DNA |
| Eppendorf Research plus pipette, 3-pack | Sigma-Aldrich | Z683884 | |
| Falcon 24 Well Polystyrene Multiwell | Falcon | 351147 | Multiwell |
| Flat Bottom Embedding Capsules, Polyethylene | Electron Microscopy Science | 70021 | basket for brain sections |
| Forceps Dumont #5 (pair) | Fine Science Tool | 11254-20 | for dissection of honey bee brain from the head |
| Forceps Dumont #5S (pair) | Fine Science Tool | 11252-00 | to clean up the brain from trachea befor dissection |
| Gene Expression Master Mix | Integrated DNA Technologies | 1055770 | qPCR drop off assay |
| Glutaraldehyde | EMS | 16220 | used for preparation of peptide conjugates for control peabsorption |
| Glycerol | Sigma-Aldrich | G5516-500 mL | western blotting, embedding media |
| Glycine | Bio-Rad | 1610718 | western blotting |
| Hydrophobic filtered nylonmesh | Spectrum Labs | 145910 | for bottom of basket for brain sections |
| Isopropyl alcohol | Sigma-Aldrich | I9030-50mL | RNA isolation |
| Keyhole limpet hemocyanin | Sigma-Aldrich | H7017 | used for preparation of conjugates for control |
| LSM800 cofocal microscope | Zeiss | ||
| mGlu_Guide 1 | IDT | designed guide RNA for CRISPR-Cas 9. Target mGlutR1 genome sequences | |
| mGlu_Guide 2 | IDT | designed guide RNA for CRISPR-Cas 9. Target mGlutR1 genome sequences | |
| mGlu_Guide 3 | IDT | designed guide RNA for CRISPR. Target mGlutR1 genome sequences | |
| methanol | Sigma-Aldrich | 34860 | western blotting |
| 96-well PCR microplate | Applied biosystem | 4346907 | qPCR drop off assay and qRT-PCR |
| 384-well PCR microplate | Sigma-Aldrich | Z374911 | qRT-PCR |
| Mineral oil | Sigma-Aldrich | M5904_500mL | for injection procedure |
| Model p87 Flaming Brown Micropipette Puller | Sutter Instrument Co. | Capillary Preparation | |
| Mowiol 4-88 | Sigma-Aldrich | 81381 | for embedding solution |
| Nanoliter 2000 | World Precision Instruments Nanoliter | Injection Apparatus | |
| Normal Donkey Serum | Jackson Research Laboratories | AB_2337258 | blocking agent for immunocytochemistry |
| Non-immune Goat Serum | Invitrogen | 50-062Z 100 mL | blocking agent for immunoblotting |
| Nuclease-free buffer | IDT | 1072570 | Nuclease-free buffer that is used in the preparation of CRISPR-Cas9 injection |
| Nuclease-free water | IDT | AM9337 | nuclease -free water that is used in preparation of CRISPR-Cas 9 system |
| OrbitalShaker Mp4 | Genemate | ||
| Paraformaldehyde | Sigma-Aldrich | 158127-500 g | used with PBS to make fixative for bee brains |
| Phenylmethylsulphonyl fluoride (PMSF) | Sigma-Aldrich | P7626-250 mg | protease inhibitor |
| Phosphate Buffer Saline | Sigma-Aldrich | P4417-100TAB | Used with Paraformaldehyde as fixative; buffer for antibodies |
참고문헌
- Harms, D. W., et al. Mouse Genome Editing Using the CRISPR/Cas System. Current Protocols in Human Genetics. 83 (15), 7-27 (2014).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Kouranova, E., et al. CRISPRs for Optimal Targeting: Delivery of CRISPR Components as DNA, RNA, and Protein into Cultured Cells and Single-Cell Embryos. Human Gene Therapy. 27 (6), 464-475 (2016).
- Schubert, M., et al. Fluorescently labeled tracrRNA provides efficient genome editing while allowing cellular microscopy and FACS analysis. Genome Editing. , 1-3 (2017).
- Kucharski, R., Mitri, C., Grau, Y., Maleszka, R. Characterization of a metabotropic glutamate receptor in the honeybee (Apis mellifera): implications for memory formation. Invertebrate Neuroscience. 7 (2), 99-108 (2007).
- Aronstein, K., Auld, V., Ffrench-Constant, R. Distribution of two GABA receptor-like subunits in the Drosophila CNS. Invertebrate Neuroscience. 2 (2), 115-120 (1996).
- Thompson, M., Steichen, J. C., ffrench-Constant, R. H. Conservation of cyclodiene insecticide resistance-associated mutations in insects. Insect Molecular Biology. 2 (3), 149-154 (1993).
- Chung, B. Y., Kilman, V. L., Keath, J. R., Pitman, J. L., Allada, R. The GABA(A) receptor RDL acts in peptidergic PDF neurons to promote sleep in Drosophila. Current Biology. 19 (5), 386-390 (2009).
- Taylor-Wells, J., Hawkins, J., Colombo, C., Bermudez, I., Jones, A. K. Cloning and functional expression of intracellular loop variants of the honeybee (Apis mellifera) RDL GABA receptor. Neurotoxicology. 60, 207-213 (2017).
- Jones, A. K., Sattelle, D. B. The cys-loop ligand-gated ion channel superfamily of the honeybee, Apis mellifera. Invertebrate Neuroscience. 6 (3), 123-132 (2006).
- Dupuis, J. P., et al. Homomeric RDL and heteromeric RDL/LCCH3 GABA receptors in the honeybee antennal lobes: two candidates for inhibitory transmission in olfactory processing. Journal of Neurophysiology. 103 (1), 458-468 (2010).
- Farooqui, T., Robinson, K., Vaessin, H., Smith, B. H. Modulation of early olfactory processing by an octopaminergic reinforcement pathway in the honeybee. Journal of Neuroscience. 23 (12), 5370-5380 (2003).
- Guo, X., Wang, Y., Sinakevitch, I., Lei, H., Smith, B. H. Comparison of RNAi knockdown effect of tyramine receptor 1 induced by dsRNA and siRNA in brains of the honeybee, Apis mellifera. Journal of Insect Physiology. 111, 47-52 (2018).
- Roth, A., et al. A genetic switch for worker nutrition-mediated traits in honeybees. PLOS Biology. 17 (3), e3000171 (2019).
- Kohno, H., Suenami, S., Takeuchi, H., Sasaki, T., Kubo, T. Production of Knockout Mutants by CRISPR/Cas9 in the European Honeybee, Apis mellifera L. Zoological Science (BIOONE). 33 (5), 505-512 (2016).
- Hu, X. F., Zhang, B., Liao, C. H., Zeng, Z. J. High-Efficiency CRISPR/Cas9-Mediated Gene Editing in Honeybee Apis mellifera Embryos. G3: Genes, Genomes, Genetics. 9 (5), 1759-1766 (2019).
- Smith, B. H., Burden, C. M. A Proboscis Extension Response Protocol for Investigating Behavioral Plasticity in Insects: Application to Basic, Biomedical, and Agricultural Research. Journal of Visualized Experiments. (91), e51057 (2014).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Rodriguez, J., Deinhardt, F. Preparation of a semipermanent mounting medium for fluorescent antibody studies. Virology. 12, 316-317 (1960).
- . Custom Alt-R® CRISPR-Cas9 guide RNA Available from: https://www.idtdna.com/site/order/designtool/index/CRISPR_CUSTOM (2019)
- Bonnafe, E., et al. Effect of a thymol application on olfactory memory and gene expression levels in the brain of the honeybee Apis mellifera. Environmental Science and Pollutant Research (International). 22 (11), 8022-8030 (2015).
- Wang, Y., et al. Regulation of behaviorally associated gene networks in worker honeybee ovaries. Journal of Experimental Biology. 215 (Pt 1), 124-134 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유