このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスにおけるインテコール内合成タンパク質の定量測定
要約
高い脊髄液タンパク質レベルは、変化した血液脳関門または細胞内合成を横切る血漿タンパク質の拡散の結果であり得る。この記事では、両方のケースを判別するのに役立ち、インテコール内合成タンパク質の定量的測定を提供する最適化されたテストプロトコルを紹介します。
要約
脳と脊髄に見られる液体である脳脊髄液(CSF)は、基礎科学と臨床科学の両方にとって非常に重要です。CSFタンパク質組成物の分析は、基本的な神経科学研究や神経疾患において重要な情報を提供します。1つの注意点は、CSFで測定されたタンパク質は、血清からの細胞内合成とトランスダクションの両方から得られ得ることであり、CSFのタンパク質分析は、これら2つの成分の合計のみを決定することができるということです。動物モデルおよびヒトにおける血液およびインテカリー産生タンパク質からのタンパク質のトランスレーションを区別するには、従来のタンパク質解析ツールを用いたCSFタンパク質プロファイリング測定には、アルブミンCSF/血清商法(Qアルブミン)、血液脳界面の完全性のマーカー(BBI)、およびタンパク質指数(Qタンパク質/Qアルブミン)の計算を含める必要があります。このプロトコルは、CSFおよび血液採取から商および指標計算まで、神経障害のマウスモデルにおける細胞内タンパク質合成およびBBI障害の定量的測定のための手順全体を示す。
概要
脳と脊髄を取り巻く透明で無色の液体である脳脊髄液(CSF)は、臨床的かつ基本的な科学的重要性を有する。CSFは、中枢神経系(CNS)の電解環境を維持し、全身酸基在状態のバランスをとり、神経細胞およびグリア細胞に栄養を供給し、CNSのリンパ系として機能し、CNS1全体でホルモン、神経伝達物質、サイトカインおよび他の神経ペプチドを輸送する。したがって、CSF組成物はCNSの活性を反映するように、この流体は、CNSの生理学的および病理学的状態を特徴付けるために、間接的であるが、貴重なアクセスを提供する。
CSFは100年以上にわたりCNSに影響を与える状態を診断するために使用されており、この時間のほとんどは、主に診断ツールとして臨床医によって研究されました。しかしながら、近年、神経生物学者は、CNSの病態生理学を研究するためのCSFの可能性を認識している。特に、神経科学分野では、CSFのタンパク質組成の詳細な研究を可能にするいくつかのハイスループットタンパク質解析ツールが導入されており、この解析が動的変化に関する洞察を提供する可能性があることを期待しています。CNS 内で発生します。
ルミネックスやシモア技術2、3などの多重免疫測定技術の技術開発は、今日、研究者に非常に低濃度で何百ものタンパク質を検出する能力を提供します。さらに、これらの同じ技術は、小さなサンプル量の使用を可能にし、それによって、CSFの限られたサンプル量が最近まで流体の詳細な特徴を排除しているマウスを含む小動物の研究を促進する。
それにもかかわらず、CSFで測定されたタンパク質は、血液脳界面(BBI)の損傷による血清からの細胞内合成および/またはトランスデュースに由来する可能性が1つの注意点である。残念ながら、CSF単独のタンパク質分析は、これら2つの成分の合計のみを決定することができます。トランスデートとインテカリー生産タンパク質を区別するには、利用可能なタンパク質分析ツールを使用したCSFタンパク質測定は、血清濃度およびバリア完全性の個々の変動性に合わせて調整する必要があります。しかしながら、この調整は臨床現場で一般的に用いられているが、例えば、心内IgG合成を検出する感度が高いCSF IgG指数4、5、6、血清濃度およびバリア完全性に対するCSFタンパク質濃度を補正した研究はこれまでにほとんどない。
現在、ライバーグラムアプローチは、タンパク質のバリア機能と内体合成を決定する最良の方法です。これは、排他的に血液由来タンパク質9、10を指す、組み込み方法で、バリア(dys)機能と細胞内タンパク質合成の両方を分析するCSF/血清商量図におけるグラフィカル評価である。非常に豊富なタンパク質アルブミンは、通常、肝臓でのみ産生され、その大きさは約70kDaが小さいタンパク質と大きなタンパク質11の間の中間であるため、通常参照タンパク質として選択される。分析図は、1987年にライバーとフェルゲンハウアーによって最初に定義された免疫グロブリン(Igs)11の主要なクラスについて、何千ものヒトサンプル9の分析から得られた結果に基づいて経験的に示されている。このアプローチは、その後、分子拡散/流量12の理論における拡散の2つのフィックの法則の適用によって確認された。このような理論は、バリアを介したタンパク質の拡散が双曲線分布を有し、CNS9、13におけるタンパク質のダイナミクスを定量的に説明できることを示す。全体的に、皮内タンパク質合成を実証するためにライバーグラムを使用する利点は、血清からCSFに入るタンパク質画分と、局所生産のためにCSFに見られるタンパク質の量を同時に同定することである。
本稿及び関連プロトコルは、CSF及び血液採取からCSFタンパク質レベルを補正する最終計算まで、神経学的マウスモデルにおける細胞内タンパク質合成の定量的測定のための手順全体を記述する。障害。この手順は、(1)任意のCSFタンパク質の病態生理学的起源および(2)バリア完全性の安定性および機能的意義を評価するためのベースラインを提供する。この手順とプロトコルは、マウスCSFサンプルを評価するのに有用であるだけでなく、神経疾患およびヒト患者の多数の動物モデルにおけるCSFの分析にも有用である。
プロトコル
すべての動物の仕事はダートマスのガイゼル医学部の制度動物ケアと使用委員会(IACUC)によってレビューされ、承認されたプロトコルを利用しています。
1. 流体の回収
メモ:血清とCSFの両方が必要です。生存と壊死には、流体回収ごとに2つのプロトコルが必要です。
- 生存手順を用いた血清及びCSF採取
注:生存液採取の場合、血清採取はCSF採取の前に置くべきである。CSFは血清引き出しの1週間以内に得なければならない。- 血清採取のためのレトロ軌道出血手順。
注:この手順は、マウス14の生存出血に対するものです。記載されている手順は、マウスの年齢、性別、およびひずみのいずれかに適用されます。IACUC規則では、体重の最大1%を1回の血液が1回の血液を引き出すとして除去できることが規定されているため、15gを超えるマウスに対してのみこの手順を行い推奨する。- マウスを含むケージをラックから適切な作業領域に移動します。酸素流量計を1L/分にして麻酔ガスマシンを準備します。
- 誘導室に動物を入れ、蓋をしっかりと閉じます。アイソフルラン気化器を3.5%にし、リカンベントするまで動物を監視します。
- チャンバーから動物を取り除き、ペダル反射、すなわちしっかりとしたフットパッドピンチによって麻酔のレベルを評価します。手順を実行する前に麻酔の十分な深さを確保する:しっかりしたピンチへの応答の欠如は、十分な麻酔を示す。
- 耳の後ろの緩い皮膚を、利き手の親指と人差し指でつかんで麻酔したマウスを拘束します。人差し指を使って目の上の皮膚を引き戻し、親指を使って目の下の皮膚を引き戻して目を膨らませます。
- パスツールピペットの先端を眼球の下の眼窩に置き(図1、左パネル)、先端を眼窩の中央に向けて約45°に向けます(図1、右側のパネル)。前方通路の間に指の間でピペットを回転させます。穏やかな圧力を適用し、血液がピペットに入るまで放出します。
注:この場所から一度に引き出される血液の最大量は、体重の約1%、例えば20gマウスから0.2 mLです。 - 眼の損傷を防ぐために毛細血管をそっと取り外し、採取した血液を1.5mL遠心管に入れます。まぶたを閉じ、ガーゼで軽度の圧力をかけて出血を防ぎます。完全にアラートとモバイル(通常は3〜5分)したら、マウスを保持ケージに戻します。
- 室温(RT)で30−60分間血液を凝固させ、4°C冷蔵遠心分離機で2,000 x gで10分間血液を遠心分離します。クリーンピペット技術を使用して、0.5 mLバイアルとラベル付けされた新しい血清を収集します。直ちに-80°Cで血清のバイアルを凍結する。
- 生存手順を伴うCSFコレクション
注:この手順は生存手術用であり、2008年に劉とダフが発表したプロトコルに基づいています。15.マウスはケタミン(20mg/mL)、キシラジン(0.5mg/mL)、およびアセプロマジン(0.5mg/mL)カクテルによって麻酔され、腹腔内投与される。- マウスを含むケージをラックから指定された手術作業領域に移動します。無菌環境で手術スペースを準備します。使用されるすべての器械および材料が外科の前に殺菌されることを確認する。
- マウスの重量を量り、必要な麻酔量(20gマウスの麻酔カクテルの0.1 mL)を計算します。腹腔内麻酔を注射16.数分後、フットパッドをつまんでマウスをテストし、十分な麻酔を確認します。さらに麻酔薬が必要な場合は、麻酔カクテルの0.01−0.03 mLをさらに注入する。
- はさみまたは剃毛剤のいずれかを使用して頭の小さな領域を剃り、頭の小さな領域を剃り、頭蓋骨の内側に、CSFコレクションのための十分な大きさの作業領域を露出させます。ステレオタキシック機器の位置にマウスを置き、イヤーバーを使用して頭をしっかりと動かします(図2A)。
メモ:マウスは、頭部が本体とほぼ135°の角度になるように置かれます(図2A)。動物が配置されると、外科的ドレープは、外科的部位で無菌フィールドを維持するために使用される。明確な接着ドレープは、動物の直接的かつより焦点を絞った可視化を可能にするので、マウスにおけるCSFコレクションに好ましい。 - 30%クロルヘキシジンジアセテートを用いた手術部位をスワブする。無菌メスを使用して、嚢科に劣る皮膚の矢状切開を行い、システナマグナの上に筋肉を露出させる。
- 鉗子による鈍い解剖によって、皮下組織と筋肉を分離してシステルナマグナを露出させる(図2B)。マイクロレトラクターを使用して筋肉を離し(図2B)、硬テルマメン科の層をシステナマグナの上に露出させる。
- 無菌リン酸緩衝生理食塩水(PBS)でやさしく洗浄し、血液汚染の可能性を除去します。ブロットは、滅菌綿棒で硬膜を乾燥させ、30G針でシスターナマグナを覆う膜を穏やかに穿刺します。CSFを収集するために、小さなガラス毛細管を素早くゆっくりと挿入します(図2C)。
注:頭蓋内圧により、CSFが毛細血管に自発的に流れ込む(図2C)。マウスの年齢とサイズに応じて、各マウスから約5~12μLのCSFが得られます。 - 膜から毛細管を慎重に取り外します。ポリエチレンチューブ(材料表)を介して3 mLシリンジにチューブを接続し、収集したCSFをラベル付き0.5 mLチューブに注入します(図2D)。バイアルを氷の中に入れておいてください。
- 使い捨て針でポリジオキサニン縫合糸(PDS)を使用し、埋もれた縫合糸17を使用することにより、切開を閉じる。乾燥した血液や組織の領域をきれいにします。
- マウスを皮下または腹腔内16に注入し、0.05−0.1 mg/kgのブプレノルフィン塩酸塩を鎮痛剤治療として用いた。また、脱水を防ぐために滅菌生理食塩分を皮下1mL注入する。
- 回復のために、マウスを清潔で暖かいケージに戻します。マウスが移動し、食べ物や水に到達できるようになったら、ケージをラックに戻します。
- 4°冷蔵遠心分離機で1,000 x gで10分間の遠心分離機CSF。キサントクロミアの同定とチューブ底部の赤いペレットの存在を目視検査で確認します。血液汚染されたサンプルを廃棄します。
注:血液汚染標本中のCSFタンパク質量の補正に利用される式は、CSFおよび血清中のタンパク質含有量、ヘマトクリット(HCT)、およびCSFおよび血液18における赤血球(RBC)カウントを含む式パラメータに基づいている。しかし、このような補正戦略は、体積が小さいためマウスCSF検体に容易に適用できないため、補正戦略は目視検査に限定される。 - クリーンピペット技術を使用して、新しい0.2 mLチューブにCSFを収集し、細胞でペレットの後ろに残します。CSF 1:3をPBSで希釈し、エアロゾルによる体積損失を低減します。直ちにCSFのバイアルを-80°Cで凍結します。
- 血清採取のためのレトロ軌道出血手順。
- 非生存手順を用いた血清およびCSF採取
注:非生存液採取の場合、CSFコレクションはマウスがパルスを持つ必要があるため、血清採取に先行します。- 壊死器でのCSFコレクション
メモ:この手順は非生存手術用であり、CSFの約10−20°Lが各マウスから得られます。無菌手術場が推奨されるが、非生存手術には必要ない。- マウスを含むケージをラックから快適な作業スペースに移動します。CSF コレクションの手順 1.1.2.2-1.1.2.7 および 1.1.2.11-1.1.2.12 に従います。血清採取についてはセクション1.2.2に進みます。
- 心内穿刺による採血(オープンアプローチ)
注:予想される血液量は体重の約3%、例えば20gマウスから0.6 mLです。- CSFコレクションに従って、マウスがフットパッドをつまむことによって十分に麻酔されていることを確認します。いずれかの反応が観察された場合は、麻酔薬の2回目の用量を投与する。反応が認められない場合は、続行します。
- 背中に動物を置き、70%のアルコールで腹部に皮膚をスワブ。外科的はさみで胸腔を開き、心臓を露出する。左心室に25G針(3mL注射器に取り付けられている)を挿入し、シリンジプランジャーに負圧を加える。血液が採取された後、針を引き出す。
- 動物が死んだことを確認するために、切断や子宮頸部脱臼などの安楽死の二次的な方法を実行します。
- 注射器のプランジャーを押し下げ、採取した血液を1.5mLバイアルに注入します。RTで30-60分間血液を凝固させ、4°Cの冷蔵遠心分離機で2,000 x gで10分間遠心分離します。
- クリーンピペット技術を使用して、0.5 mLバイアルとラベル付けされた新しい血清を収集します。直ちに-80°冷凍庫で血清のバイアルを凍結します。
- 壊死器でのCSFコレクション
2. タンパク質分析
- 一致した血清およびCSF検体中の標的タンパク質およびアルブミンを定量するために、例えばLuminex技術などの好ましい方法を使用する。
注:ここでは、Luminex磁気技術を使用して例を挙げていますが、酵素結合免疫吸着アッセイ(ELISA)を含むタンパク質量を測定する実質的にあらゆる技術を現在のプロトコルに適用できます。理想的には、CSFおよび血清サンプルは、同じプラットフォーム上のアルブミンおよび標的タンパク質の両方に対して実行される。アッセイ条件は、抗原ビーズカップリング濃度、血清およびCSFサンプル希釈、各検体に最適な標準曲線、非特異的反応性を低減するためのバッファー組成などのプロトコルの重要なステップに最適化する必要があります。市販のキットがタンパク質測定に使用される場合、例えば、免疫グロブリンアイソタイピングキット(材料表) で提示されたデータを取得するために使用されます。図 3、製造元の指示に従う必要があります。- 解凍および分析の前に、CSFおよび血清サンプル(10分間2,000 x g)を遠心分離し、上清を使用してフィルタープレートおよび/またはプローブの目詰まりを防ぎます。適切なサンプル希釈のためのキットに付属のアッセイ手順に従ってください。それ以外の場合は、各検体および流体に対して適切な希釈を決定する。それに応じてPBSでサンプルを希釈します。
注:特定のガイダンスや指示がない場合は、試験試験の前に、最も多く含まれる濃度推定値を得るために必要な適切な希釈範囲を決定することにより、各検体および流体の希釈を確立する必要があります。標準的な曲線の信頼できる範囲。分析される生物学的試料の特性を知ることは、例えば、流体中の生理学的および病理学的濃度を、低、中、および高い分析物含有量のサンプルで異なる希釈液を試すことを可能にする。サンプル内の濃度の予想範囲が事前がわかっている場合は、選択した標準曲線範囲内にするためにサンプルを希釈する必要がある回数を計算した後に希釈を選択できます。
注意: 希釈係数を計算することにより、CSF はすでに 1:3 希釈されていることを覚えておいてください。 - 目的のタンパク質ごとに標準曲線を調製し、例えば、図3のデータを生成するために使用されるアルブミンおよびIgGを、シリアル希釈基準標準タンパク質によって調製する。標準曲線の調製中に、次の希釈を行う前に、各高濃度を徹底的に混合します。
注:選択した定量方法に関係なく、アッセイを実行するたびに標準曲線を含めてサンプル中のタンパク質濃度を推定することが不可欠です。基準規格の最良の選択は、目的のタンパク質の精製された既知の濃度です。特定の希釈、および標準カーブの定義に使用されるデータ ポイントと反復の数は、標準曲線の非線形性の度合いに依存します。 - 適切な抗体結合磁気ビーズセットを選択します (材料の表)。ビーズの個々のバイアルの場合は、30sと渦の各バイアルを1分間超音波処理し、ビーズストックをアッセイ/ウォッシュバッファー(PBS、1%ウシ血清アルブミン[BSA])で各セット/μLの最終濃度50ビーズの最終濃度に希釈して「ワーキングビーズ混合物」を調製します。フラットボトム96ウェルプレート(材料の表)で各ウェルにミックスビーズの50°Lを追加します。
注意:蛍光ビーズは光に敏感です。したがって、それらは、手順全体を通して光への長時間の暴露から保護されるべきである。 - ウェル マップ ワークシート上の背景、標準、およびサンプルの配置を図示します。
- 各背景ウェルに50μLのアッセイ/洗浄バッファを追加し、各規格の50°Lを標準カーブのウェルに追加します。各希釈サンプルの50 mLを最後に適切なウェルにロードします。ホイルでプレートを包み、RTで30分間プレートシェーカーで攪拌(約800rpm)でインキュベートします。
- プレートをハンドヘルドマグネット(材料テーブル)に置き、磁気ビーズの完全な設定を可能にするために、約60sの磁石の上にプレートを置きます。プレートを軽くデカントし、吸収性パッドのプレートをタップして、残留液を除去して、よく内容物を取り除きます。
- プレートを磁石から取り出し、アッセイ/洗浄バッファーを200μL加えて、~30sで振とうして、最後に磁石に再び付着して洗浄する。3xを繰り返します。
- ビオチン化検出抗体、すなわち、タンパク質宿主種に対して上化されたビオチン標識抗体を、アッセイ/ウォッシュバッファー中で4μg/mLに希釈する。希釈した検出抗体をそれぞれウェルに50μL添加します。プレートを覆い、プレートシェーカーのRTで30分間インキュベートします。プレートを磁石の上に置き、手順 2.1.6 と 2.1.7 を繰り返します。
- 希薄フィコエリスリン(PE)-共役ストレプトアビジン(SAPE)からアッセイ/洗浄バッファーで4μg/mLまで。希釈された SAPE をそれぞれウェルに 50 μL 追加します。プレートを覆い、プレートシェーカーのRTで30分間インキュベートします。プレートを磁石の上に置き、手順 2.1.6 と 2.1.7 を繰り返します。
- 磁石からプレートを取り出し、アッセイ/洗浄バッファーの100°Lでビーズを再サスペンドします。PE蛍光強度(FI)の大きさの検出を可能にするデュアルレーザーフローベースの検出装置で井戸を読みます。
注:シグナルは、例えば、FI、生成されるビーズの表面に付着した標的抗原の量に比例する。 - 生データをエクスポートし、検出信号FIと標準タンパク質濃度をグラフ化することにより、標準曲線を作成します。標準曲線を使用して、サンプル内の検体の濃度を計算します。
注:アルブミンはg/dLで優先的に発現され、目的のタンパク質はmg/dLで優先的に発現されます。
- 解凍および分析の前に、CSFおよび血清サンプル(10分間2,000 x g)を遠心分離し、上清を使用してフィルタープレートおよび/またはプローブの目詰まりを防ぎます。適切なサンプル希釈のためのキットに付属のアッセイ手順に従ってください。それ以外の場合は、各検体および流体に対して適切な希釈を決定する。それに応じてPBSでサンプルを希釈します。
3. インテカル指数計算
- タンパク質濃度値をスプレッドシートに整理し、次の式を適用して結果を分析します。
- Qアルブミンを計算する:

ここでCSFアルブミンおよび血清アルブミンは、それぞれ一致した血清およびCSF標本におけるアルブミンの濃度である。 - Qタンパク質を計算します。
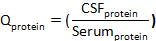
ここで、CSFタンパク質と血清タンパク質は、それぞれ一致した血清およびCSF検体中の標的タンパク質の濃度である。 - タンパク質インデックスを計算します。
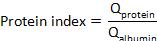
結果
この代表的な実験は、多発性硬化症(MS)の2つの臨床的に関連するげっ歯類モデルにおけるIgGの細胞内合成を比較することを目的とした:PLP139-151-誘発性再免疫性脳脊髄炎(R-EAE)と慢性進行性、テイラーのマウス脳脊髄炎ウイルス誘発性デミエリン症(TMED)。R-EAE は再発を制御する MS を理解するのに役立つモデルですが、TMEV-IDD モデルは慢性進行性 MS19を備えています。
...ディスカッション
増加したCSFタンパク質濃度の評価のための定量的方法は、CNSの生理学的および病理学的状態の特徴付けに有用なツールである。しかし、CSFタンパク質レベルの信頼性の高い定量を超えて、CSFタンパク質の検出には、CSFにおける血液およびCNS由来画分を区別する結果の発現が必要です。しかし、現在までに、一般的に使用されるタンパク質定量アッセイは、ハイスループットツールの助けを借?...
開示事項
著者たちは何も開示する必要はない。
謝辞
著者らは、ダートマスの比較医学研究センター(CCMR)のスタッフに、これらの研究に使用されるマウスの専門的なケアに感謝する。ボルンスタイン研究基金は、この研究に資金を提供しました。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL insulin syringe | BD | 329650 | |
| 1 mL syringe | BD | 329622 | |
| 25 gauge needle | BD | 305122 | |
| 3 mL syringe | BD | 309582 | |
| 30 gauge insulin needle | BD | 305106 | |
| Absorbent pads | Any suitable brand | ||
| Acepromazine | Patterson Vet Supply Inc | ||
| BioPlex Handheld Magnetic Washer | BioRad | 171020100 | Magnet |
| BioPlex MAGPIX Multiplex Reader | BioRad | 171015001 | |
| BioPlex Pro Flat Bottom Plates | BioRad | 171025001 | |
| Biotinilated detection antibody | Any suitable source | The antibody has to be directed against the species of the protein of interest. | |
| Bovine Serum Albumin (BSA) | Sigma | A4503 | |
| Buprenorphine hydrochloride | PAR Pharmaceutical | NDC 42023-179-05 | |
| Capillary Tubes | Sutter Instrument | B100-75-10 | OD: 1.0 mm, ID: 0.75 mm Borosilicate glass 10 cm; drawn over Bunsen to make ID smaller. |
| Centrifuge tube, 0.2 mL | VWR | 20170-012 | |
| Centrifuge tube, 0.5 mL | VWR | 87003-290 | |
| Centrifuge tube, 1.5 mL | VWR | 87003-294 | |
| Chlorhexidine diacetate | Nolvasan | E004272 | |
| Disposable pipettes tips | Any suitable brand | ||
| Ear bars | KOPF Instruments | 1921 or 1922 | |
| Ethanol | Kopter | V1001 | |
| Freezer | VWR | VWR32086A | |
| Gauze | Medline | NON25212 | |
| Heating pad | Sunbeam | XL King Size SoftTouch, 4 Heat Settings with Auto-Off, Teal, 12-Inch x 24-Inch | |
| Induction Chamber | VETEQUIP | ||
| Isoflurane | Patterson Vet Supply Inc | NDC 14043-704-06 | |
| Ketamine (KetaVed) | Patterson Vet Supply Inc | ||
| MagPlex Microspheres (antibody-coupled) | BioRad | Antibody-coupled magnetic bead | |
| Microplate Shaker | Southwest Scientific | SBT1500 | |
| Microretractors | Carfill Quality | ACD-010 | Blunt - 1 mm |
| Microsoft Office (Excel) | Microsoft | ||
| MilliPlex MAP Mouse Immunoglobulin Isotyping Magnetic Bead Panel | EMD Millipore | MGAMMAG-300K | Commercial kit for the quantification through Luminex of a panel of immunoglobulin isotypes and subclasses in mouse fluids. |
| Mouse Albumin capture ELISA kit | Novus Biological | NBP2-60484 | Commercial kit for the quantification through ELISA of albumin in mouse fluids. |
| Multichannel pipette | Eppendorf | 3125000060 | |
| Non-Sterile swabs | MediChoice | WOD1002 | Need to be autoclaved for sterility |
| Oxygen | AIRGAS | OX USPEA | |
| Pasteur Pippettes | Fisher | 13-678-20A | 5 & 3/4" |
| PDS suture with disposable needle, 6-0 Prolen | Patterson Vet | 8695G | P-3 Reverse Cutting, 18" |
| PE-Streptavidin | BD Biosciences | 554061 | |
| Pipetters | Eppendorf | Research seriers | |
| Polyethylene tubing | |||
| Refrigerated Centrifuge | Beckman Coulter | ALLEGRA X-12R | |
| Scale | Uline | H2716 | |
| Scalpel | Feather | EF7281 | |
| Shaver | Harvard Apparatus | 52-5204 | |
| Standard proteins | Any suitable source | The best choice for a reference standard is a purified, known concentration of the protein of interest. | |
| Stereotaxic instrument | KOPF Instruments | Model 900LS | Standard Accessories |
| Sterile 1 x PBS | Corning Cellgro | 21-040-CV | |
| Sterile saline | Baxter | 0338-0048-02 | 0.9 % Sodium Chloride Irrigation USP |
| Surgical Forceps Curved, 7 (2) | Fine Science Tools | 11271-30 | Dumont |
| Surgical Scissors | Fine Science Tools | 14094-11 | Stainless 25x |
| Vaporizer + Flow meter | Moduflex Anhestesia Instruments | ||
| Vortex | Fisher | 02-215-414 | |
| Warming pad | Kent Scientific Corporation | RT-JR-20 | |
| Water Sonicator | Cole Parmer | EW-08895-01 | |
| Xylazine | Patterson Vet Supply Inc |
参考文献
- Whedon, J. M., Glassey, D. Cerebrospinal fluid stasis and its clinical significance. Alternative Therapies in Health and Medicine. 15 (3), 54-60 (2009).
- Kang, J. H., Vanderstichele, H., Trojanowski, J. Q., Shaw, L. M. Simultaneous analysis of cerebrospinal fluid biomarkers using microsphere-based xMAP multiplex technology for early detection of Alzheimer's disease. Methods. 56 (4), 484-493 (2012).
- Barro, C., et al. Fluid biomarker and electrophysiological outcome measures for progressive MS trials. Multiple Sclerosis. 23 (12), 1600-1613 (2017).
- Tourtellotte, W. W., et al. Multiple sclerosis: measurement and validation of central nervous system IgG synthesis rate. Neurology. 30 (3), 240-244 (1980).
- Bonnan, M. Intrathecal IgG synthesis: a resistant and valuable target for future multiple sclerosis treatments. Multiple Sclerosis International. 2015, 296184 (2015).
- Reiber, H. Cerebrospinal fluid--physiology, analysis and interpretation of protein patterns for diagnosis of neurological diseases. Multiple Sclerosis. 4 (3), 99-107 (1998).
- DiSano, K. D., Linzey, M. R., Royce, D. B., Pachner, A. R., Gilli, F. Differential neuro-immune patterns in two clinically relevant murine models of multiple sclerosis. Journal of Neuroinflammation. 16 (1), 109 (2019).
- Pachner, A. R., Li, L., Lagunoff, D. Plasma cells in the central nervous system in the Theiler's virus model of multiple sclerosis. Journal of Neuroimmunology. 232 (1-2), 35-40 (2011).
- Reiber, H. Flow rate of cerebrospinal fluid (CSF)--a concept common to normal blood-CSF barrier function and to dysfunction in neurological diseases. Journal of Neurological Sciences. 122 (2), 189-203 (1994).
- Reiber, H., Zeman, D., Kusnierova, P., Mundwiler, E., Bernasconi, L. Diagnostic relevance of free light chains in cerebrospinal fluid - The hyperbolic reference range for reliable data interpretation in quotient diagrams. Clinica Chimica Acta. 497, 153-162 (2019).
- Reiber, H., Felgenhauer, K. Protein transfer at the blood cerebrospinal fluid barrier and the quantitation of the humoral immune response within the central nervous system. Clinica Chimica Acta. 163 (3), 319-328 (1987).
- Dorta-Contreras, A. J. Reibergrams: essential element in cerebrospinal fluid immunological analysis. Revista de Neurologia. 28 (10), 996-998 (1999).
- Metzger, F., Mischek, D., Stoffers, F. The Connected Steady State Model and the Interdependence of the CSF Proteome and CSF Flow Characteristics. Frontiers Neuroscience. 11, 241 (2017).
- Wolforth, J. Methods of blood collection in the mouse. Laboratory Animals. 29, 47-53 (2000).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. Journal of Visualized Experiments. (21), e960 (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), e2771 (2012).
- Johnston, S. A., Tobias, K. M. Veterinary Surgery: Small Animal Expert Consult - E-Book. Elsevier Health Sciences. , (2017).
- Nigrovic, L. E., Shah, S. S., Neuman, M. I. Correction of cerebrospinal fluid protein for the presence of red blood cells in children with a traumatic lumbar puncture. Journal of Pediatrics. 159 (1), 158-159 (2011).
- McCarthy, D. P., Richards, M. H., Miller, S. D. Mouse models of multiple sclerosis: experimental autoimmune encephalomyelitis and Theiler's virus-induced demyelinating disease. Methods in Molecular Biology. 900, 381-401 (2012).
- Link, H., Tibbling, G. Principles of albumin and IgG analyses in neurological disorders. II. Relation of the concentration of the proteins in serum and cerebrospinal fluid. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 391-396 (1977).
- Tibbling, G., Link, H., Ohman, S. Principles of albumin and IgG analyses in neurological disorders. I. Establishment of reference values. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 385-390 (1977).
- Deisenhammer, F., et al. Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force. European Journal of Neurology. 13 (9), 913-922 (2006).
- Johanson, C. E., Stopa, E. G., McMillan, P. N. The blood-cerebrospinal fluid barrier: structure and functional significance. Methods in Molecular Biology. 686, 101-131 (2011).
- Zaias, J., Mineau, M., Cray, C., Yoon, D., Altman, N. H. Reference values for serum proteins of common laboratory rodent strains. Journal of the American Association for Laboratory Animal Science. 48 (4), 387-390 (2009).
- Felgenhauer, K., Renner, E. Hydrodynamic radii versus molecular weights in clearance studies of urine and cerebrospinal fluid. Annals of Clinical Biochemistry. 14 (2), 100-104 (1977).
- Pachner, A. R., DiSano, K., Royce, D. B., Gilli, F. Clinical utility of a molecular signature in inflammatory demyelinating disease. Neurology, Neuroimmunology & Neuroinflammation. 6 (1), 520 (2019).
- Pachner, A. R., Li, L., Gilli, F. Chemokine biomarkers in central nervous system tissue and cerebrospinal fluid in the Theiler's virus model mirror those in multiple sclerosis. Cytokine. 76 (2), 577-580 (2015).
- Gerbi, C. Protein concentration in the arterial and venous renal blood serum of the rabbit. Archives of Biochemistry and Biophysics. 31 (1), 49-61 (1951).
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Reiber, H. Proteins in cerebrospinal fluid and blood: barriers, CSF flow rate and source-related dynamics. Restorative Neurology and Neuroscience. 21 (3-4), 79-96 (2003).
- Reiber, H. Knowledge-base for interpretation of cerebrospinal fluid data patterns. Essentials in neurology and psychiatry. Arquivos de Neuropsiquiatria. 74 (6), 501-512 (2016).
- Kuehne, L. K., Reiber, H., Bechter, K., Hagberg, L., Fuchs, D. Cerebrospinal fluid neopterin is brain-derived and not associated with blood-CSF barrier dysfunction in non-inflammatory affective and schizophrenic spectrum disorders. Journal of Psychiatric Research. 47 (10), 1417-1422 (2013).
- Bromader, S., et al. Changes in serum and cerebrospinal fluif cytokines in response to non-neurological surgery: an observational study. Journal of Neuroinflammation. 9, 242 (2012).
- Starhof, C., et al. Cerebrospinal fluid pro-inflammatory cytokines differentiate parkinsonian syndromes. Journal of Neuroinflammation. 15 (1), 305 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved