Method Article
Amostragem e Cultivo Simplificado da Larvacean Cosmopolita Pelagic, Oikopleura dioica
Neste Artigo
Resumo
Oikopleura dioica é um organismo modelo tunicate em vários campos da biologia. Descrevemos métodos de amostragem, identificação de espécies, configuração de cultivo e protocolos de cultivo para os animais e alimentação de algas. Destacamos fatores-chave que ajudaram a fortalecer o sistema cultural e discutir os possíveis problemas e resoluções.
Resumo
Oikopleura dioica é um chordate plantônico com excepcional capacidade de alimentação de filtros, tempo de geração rápida, desenvolvimento precoce conservado e um genoma compacto. Por essas razões, é considerado um organismo modelo útil para estudos ecológicos marinhos, biologia evolutiva do desenvolvimento e genômica. Como a pesquisa muitas vezes requer um fornecimento constante de recursos animais, é útil estabelecer um sistema de cultura confiável e de baixa manutenção. Aqui descrevemos um método passo-a-passo para estabelecer uma cultura O. dioica. Descrevemos como selecionar potenciais locais de amostragem, métodos de coleta, identificação de animais de destino e a configuração do sistema de cultivo. Fornecemos conselhos de solução de problemas com base em nossas próprias experiências. Também destacamos fatores críticos que ajudam a sustentar um sistema de cultura robusto. Embora o protocolo cultural aqui fornecido seja otimizado para O. dioica,esperamos que nossa técnica de amostragem e configuração cultural inspirem novas ideias para a manutenção de outros invertebrados frágeis pelagicos.
Introdução
Organismos modelo têm sido fundamentais para abordar muitas questões biológicas, incluindo aquelas relacionadas ao desenvolvimento, genética e fisiologia. Além disso, organismos de modelos adicionais facilitam novas descobertas e, portanto, são cruciais para alcançar uma maior compreensão da natureza1,2. Zooplâncton marinho são diversos grupos de organismos que desempenham um papel importante nos ecossistemas oceânicos3,,4,,5,6. Apesar de sua abundância e importância ecológica, organismos gelatinosos como tunicatos planctônicos são frequentemente sub-representados em estudos de biodiversidade de plâncton, pois sua transparência e fragilidade tornam a coleta e identificação de campodesafiadoras 7,,8. Técnicas de amostragem adaptadas e cultivo laboratorial permitem uma observação mais aprofundada dos animais in vitro, o que tem aprofundado o conhecimento na biologia dos tunicatos planctônicos9,,10,,11,12.
Larvaceans (Appendicularians) são uma classe de tunicatos marinhos de natação livre que compreende cerca de 70 espécies descritas em todo o mundo8,13. Como eles são um dos grupos mais abundantes dentro das comunidades zooplânctons14,,15,,16,17, larvaceans representam uma fonte primária de alimento para organismos plantônicos maiores, como larvas de peixe18,,19. Ao contrário dos ascidianos- os tunicates-larvaceanos sessile mantêm uma morfologia semelhante a um girino e permanecem plantônicos ao longo de suas vidas20. Cada animal vive dentro de uma estrutura auto-construída e intrincada de alimentação de filtros conhecida como casa. Eles acumulam partículas em suas casas criando correntes de água através do movimento ondulante de suas caudas21. Casas entupidas são descartadas ao longo do dia, algumas das quais formam agregados de carbono e eventualmente afundam no fundo do mar22; assim, as larvas desempenham um papel importante no fluxo global de carbono23. A maioria das espécies é relatada para viver na zona pelagica dentro dos 100 m superiores da coluna de água13; no entanto, o gigante larvacean Bathochordaeus é conhecido por habitar as profundezas de 300 m24. Um estudo sobre Bathochordaeus na Baía de Monterey, Califórnia, revelou que os animais também servem como vetor biológico de microplásticos, sugerindo uma potencial importância na compreensão do papel dos appendiculares no transporte vertical e distribuição de microplásticos nos oceanos25.
Oikopleura dioica, uma espécie de larvacean, tem atraído atenção nos últimos anos como um organismo modelo devido a várias características notáveis. É comumente relatado em todos os oceanos do mundo. É especialmente abundante em águas costeiras26,o que permite uma amostragem fácil da costa. A cultura estável e de longo prazo é possível com água do mar natural e artificial27,,28,,29. Os tempos de geração dependentes da temperatura são tão curtos quanto 4-9 dias em condições laboratoriais. Tem alta fecundidade com cada fêmea capaz de produzir >300 ovos ao longo do ano. Como tunicate, ocupa uma importante posição filogenética para a compreensão da evolução do chordate30,31. Com 70 Mb, O. dioica tem o menor genoma identificado entre todos os acordes32. Entre larvas, O. dioica é a única espécie não hermafroditica descrita até agora33.
A primeira cultura o. dioica bem sucedida com microalgae cultivada em laboratório foi relatada por Paffenhöfer34. O protocolo de cultura original utilizando motores e pás síncronos foi desenvolvido pela Fenaux e Gorsky35 e posteriormente adotado por vários laboratórios. Mais recentemente, Fujii et al.36 relataram o. dioica culminando em água do mar artificial, um sistema de cultura robusto e coleta de campo foram descritos por Bouquet et al.27 e um protocolo otimizado para um sistema simplificado e acessível foi relatado por Marti-Solans et al.29. Além do sistema tradicional de cultura Oikopleura, um design recém-relatado com um tanque de criação de tubo duplo também tem o potencial de cultivar Oikopleura sp. 37.
Apresentamos um protocolo detalhado para o início de uma monocultura O. dioica baseada em uma combinação de protocolos desenvolvidos por grandes grupos de pesquisa de Oikopleura no Centro Internacional de Biologia Molecular Marinha27, a Universidade de Barcelona29, Universidade de Osaka28, e nossas próprias observações. Em protocolos culturais publicados anteriormente, informações detalhadas sobre a composição de meios de comunicação algas, técnicas de amostragem em terra e identificação de Oikopleura foram apenas descritas aproximadamente, deixando muita ambiguidade. Aqui, com o auxílio de informações visuais no protocolo de vídeo, reunimos todas as informações críticas necessárias para configurar uma cultura O. dioica do zero de forma simples e passo a passo. Descrevemos como distinguir O. dioica de outra espécie comumente relatada, O. longicauda,que é um dos passos mais desafiadores. Embora os sistemas culturais existentes sejam aplicáveis para o cultivo de O. dioica em todo o mundo, destacamos a importância do ajuste de protocolos com base nas condições ambientais locais. As informações apresentadas combinam dados amplamente publicados, bem como conhecimento adquirido através da experiência. O protocolo atual é ideal para pesquisadores interessados em estabelecer uma cultura do zero.
Protocolo
1. Instalações de cultura O. dioica
- Sistema de filtro de água(Figura 1)
- Coletar água do mar natural de um porto a 2-3 m de profundidade. Passe a água do mar através de um filtro de areia (tamanho de poros 1,4 mm) e transporte para um tanque de reservatório compartilhado em laboratório. Use um filtro de recipiente para circular a água para manter a qualidade da água no reservatório compartilhado.
- Em uma sala de cultura, configure um sistema de filtro de várias etapas composto por um tanque de reservatório de 100 L com uma bomba de acionamento magnético, filtros de cartuchos de ferida de polipropileno de 5 μm e 1 μm e um esterilizador UV (100 V)(Figura 1).
- Transfira a água do mar do tanque do reservatório compartilhado para o tanque do reservatório da sala de cultura. Passe a água do mar através de uma unidade de filtro de 25 μm(Figura 1A,B) antes de entrar no tanque do reservatório da sala de cultura. Circule a água do mar através de filtros de 5 e 1 μm durante a noite para remover completamente partículas que poderiam potencialmente dificultar o desenvolvimento dos animais.
NOTA: Um filtro adicional com tamanho de malha maior (25-50 μm) é útil para evitar que partículas maiores entupimentem os filtros do cartucho com tamanhos de malha menores. A água do mar filtrada (fSW) está pronta para uso na manhã seguinte.
-
Unidade de cultivo Oikopleura (Figura 2)
- Mantenha os animais em 5 ou 10 L redondos, béquers plásticos transparentes.
- Coloque os béquers de cultura em uma unidade de prateleira de aço inoxidável de dois níveis (L x W x H = 150 cm x 45 cm x 90 cm) com uma placa de superfície acrílica transparente de 5 mm de espessura.
- Posicione luzes fluorescentes brancas sob a superfície acrílica para iluminar os animais a partir da parte inferior dos béquers.
- Coloque uma folha de plástico preta atrás dos béquers. A folha preta cria contraste e melhora a visualização dos animais transparentes.
- Conecte motores elétricos síncronos a pás acrílicas (L x H = 8 cm x 27 cm)(Arquivo Suplementar 2). Suspender as pás nos béquers de cultura de trilhos paralelos que correm ao longo do comprimento da unidade de prateleiras (Figura 2A).
- Ligue os motores para gerar um movimento circular suave nos béquers a 15 RPM.
NOTA: Os animais em suas casas de celulose são neutramente flutuantes; no entanto, a circulação de água ajuda a manter ovos, larvas e alimentos algas a serem suspensos e distribuídos uniformemente nos béquers da cultura.
- Bomba de dosagem automática (Opcional)
NOTA: Uma unidade de alimentação automática reduz os requisitos de pessoal, especialmente durante os finais de semana.- Calibrar o volume de distribuição de líquido de uma bomba de dosagem automática de acordo com as instruções do fabricante.
- Use tubos de 50 mL como reservatórios de algas.
- Faça dois furos de 5 mm nas tampas dos tubos de 50 mL para passar por tubos aéreos. Conecte um tubo a uma bomba de ar padrão do aquário para introduzir bolhas de ar, e o outro tubo à porta de entrada da bomba de dosagem(Figura 2B).
NOTA: A introdução de um fluxo fino de bolhas de ar ajuda a evitar que as algas se instalem na parte inferior dos tubos. - Programe o tempo e o volume de alimentação de algas a serem dispensados em um determinado dia.
- Estação de algas
- Use uma unidade de prateleira (L x W x H = 90 cm x 46 cm x 115 cm) para colocar quatro frascos de fundo redondos de 1 L contendo culturas de trabalho de algas (Ver passo 2.1).
- Ilumine as culturas de trabalho colocando luzes fluorescentes atrás dos frascos.
- Veda frascos com rolhas de borracha de dois furos.
- Passe uma pipeta descartável de 1 mL através da rolha de borracha. Use tubos de companhia aérea para conectar a pipeta a uma bomba de ar de aquário. Introduza um fluxo de bolhas de ar no frasco.
2. Alimentos microángicos
- Iniciando culturas algas
NOTA: Manter três conjuntos de culturas (estoque, sub-e culturas de trabalho) para três espécies microalgas, Chaetoceros calcitrans, Isochrysis sp., Rhinomonas reticulata, e uma espécie de cianobactéria, Synechococcus sp.. Estoque e subculturas são usados como backups. A cultura de trabalho é usada para alimentação diária.- Prepare os reagentes necessários para o cultivo de microalgas e cianobactérias (Tabela 1).
- Para iniciar a cultura do estoque, autoclave (121 °C, 25 min) 60 – 80 mL de fSW em um frasco de 100 mL Erlenmeyer. Asepticamente inoculado quantidade especificada de Conway médiomodificado 27 e microalgas(Tabela 2). Por exemplo, para inocular uma cultura de estoque de C. calcitrans, autoclave 60 mL de água do mar, asepticamente inoculada 30 μL cada uma da vitamina e solução A, 15 μL de silicato de sódio, 60 μL de estreptomicina, e 30 μL de C. calcitran da cultura de estoque anterior.
NOTA: R. reticulata passa de rosa-avermelhado para marrom-orangotango quando exposto a muita luz. Afaste-os da luz assim que começarem a passar de claro para rosa claro. - Mantenha a cultura do estoque em uma incubadora fixada a 17 °C com iluminação contínua. Após cerca de 10 dias, a cultura muda de cor para indicar o crescimento de algas(Figura 3). Uma vez que as cores apareçam, mova-as para 4 °C para armazenamento a longo prazo por até 1 mês.
- Em um banco limpo, inocular aseticamente uma subcultura da cultura de ações(Tabela 2). Incubar a 17 °C com iluminação contínua. Depois que as cores de algas aparecerem, continue armazenando-as na incubadora até 2 semanas.
- Cultura de trabalho inoculada a partir da subcultura (Tabela 2). Sele o frasco com uma tampa de borracha e insira 1 mL de pipeta descartável. Mova o frasco para a estação de algas e mantenha em temperatura ambiente com um fotoperíodo de 8 horas. Forneça com aeração constante. Renovar a cultura de trabalho a cada 4 dias.
- Mexa o estoque e subculturas duas vezes ao dia rodopiando.
NOTA: O armazenamento a longo prazo da cultura alga em mídia sólida e criopreservação é possível até 3 meses e 1 ano,respectivamente 29.
- Criando curvas de crescimento de algas (Opcional)
NOTA: A avaliação precisa da quantidade de alimentação é importante para manter uma cultura estável de O. dioica. Criamos curvas de crescimento para duas espécies primárias de alimentos algas, Chaetoceros calcitrans e Isochrysis sp.- Preparar C. calcitrans e Isochrysis sp. culturas de trabalho (Tabela 2).
- Para cada espécie de cultura de trabalho, prove três vezes diferentes e meça absorventes a 660 nm usando um espectrofotômetro. Tome as medidas médias dos triplicados de cada cultura de trabalho.
- Seguindo as instruções do fabricante para um contador automatizado de células, prepare amostras de algas para contagem. Conte cada amostra três vezes. Tome a média de três contagens para determinar o número total de células presentes em cada amostra.
- Continue a contar diariamente até que aproximadamente 50 medições médias sejam registradas.
- Criar curvas de crescimento para ambas as espécies de algas(Figura 4).
3. Coleção de campo de Oikopleura spp selvagem.
- Rede de plâncton modificada(Figura 5)
NOTA: A chave para uma amostragem bem-sucedida de Oikopleura spp. é o reboque lento de uma rede de plâncton com um extremidade de bacalhau ponderada e não filtrante. A Figura 5 mostra um diagrama esquemático de uma rede de plâncton modificada.- Substitua a extremidade do bacalhau de uma rede de plâncton portátil por uma garrafa de lavagem modificada de 500 mL.
- Faça um furo de 3 cm de diâmetro na tampa do parafuso de 4 cm de diâmetro da garrafa de lavagem para permitir que água e animais entrem na extremidade do bacalhau.
- Coloque a tampa da garrafa no final da rede de plâncton. Enrole-o firmemente com fita elétrica. Fixar ainda mais a tampa com um grampo de mangueira de aço inoxidável.
- Conecte um peso de 70 g ao exterior do cod-end modificado com laços zip.
- Conecte a coleira de segurança para proteger ainda mais o extremidade do bacalhau.
- Selecionando sites de coleta(Figura 6)
NOTA: Todas as coletas de amostras foram aprovadas pelo Comitê de Segurança do Trabalho de Campo da OIST. Pode haver variação sazonal na presença de Oikopleura spp. dependendo da localização(Figura 6). Evite a amostragem imediatamente após eventos climáticos extremos, como tempestades severas.- Use a exibição de satélite em um site de mapas para identificar possíveis locais de amostragem. Focamos em portos e píeres de pesca que são facilmente acessíveis de carro e localizados dentro de baías ou perto de quedas oceânicas onde plâncton tendem a se acumular: porto de Ishikawa em Kin Bay, Okinawa, Japão (GPS: 26°25'39.3"N 127°49'56.6"E).
- Visite possíveis locais de amostragem para avaliar a acessibilidade e segurança da costa de cada local. Obtenha licença de coleta das autoridades locais conforme necessário.
- Procedimento amostral
- Lance a rede de plâncton no mar e permita que o bacalhau afunde 1-2 m abaixo da superfície da água.
- Reboque a rede horizontalmente à mão em 50-100 cm s-1. Continue rebocando andando para frente e para trás por 2-5 minutos. Ajuste o tempo de reboque de acordo com a abundância de fitoplâncton no porto, com reboque mais curto quando houver mais fitoplâncton.
NOTA: Larvaceans são animais frágeis. Reboque rápido ou fundição repetida da rede pode danificar animais presos na extremidade do bacalhau. - Levante suavemente a rede. Transfira lentamente o conteúdo da extremidade do bacalhau em uma garrafa de vidro redondo de 500 mL. Encha completamente a garrafa de amostra com água do mar para evitar bolhas de ar.
NOTA: A presença de Oikopleura spp. pode ser confirmada visualizando garrafas de amostra contra um fundo preto. A maioria dos animais abandona suas casas enquanto são coletados. Portanto, a observação microscópica é necessária para identificação do nível das espécies. - Repita a amostragem até que três garrafas de 500 mL sejam coletadas.
- Meça salinidade, temperatura e clorofila usando um profiler CTD para registrar a gama de parâmetros físicos onde os animais existem naturalmente.
- Colete 10-15 L de água do mar superficial em um balde para aclimatar animais no ambiente de laboratório.
4. Isolamento e identificação animal(Figura 7, Figura 8)
-
Identificação oikopleura.
NOTA: Outros organismos plantônicos que podem se assemelhar a Oikopleura spp. à primeira vista incluem chaetognaths, Fritillaria spp., nematoides, larvas de peixe com gemas-sacos, e larvas ciona spp.- Para aclimatar animais para condições laboratoriais, transfira cada amostra de 500 mL para um béquer de 10 L contendo proporção de 1:1 de água do mar superficial do local de amostragem e água do mar filtrada (fSW) mantida no laboratório (Figura 7A,B). Ajuste o volume do béquer para 5-10 L, dependendo da concentração da amostra de plâncton.
NOTA: Se a amostra de plâncton contiver detritos indesejados, passe por um filtro grosseiro (tamanho de malha ~600 μm) antes de transferir para um béquer de 10 L. - Use uma pá presa a um motor elétrico síncrono (15 RPM) e mantenha o plâncton em suspensão durante a noite (passo 1.2.5).
- Identifique Oikopleura spp. procurando animais de 1-2 mm de comprimento, em forma de girino ondulando suas caudas dentro de uma casa esférica e translúcida. Alguns animais podem estar temporariamente nadando sem as casas. Transfira suavemente ~5 animais para uma placa de Petri vazia usando uma pipeta de ponta sem corte.
- Para identificação do gênero, despeje animais de suas casas cutucando suavemente a casa com uma pipeta de transferência.
- Observe animais sem casa sob um microscópio de campo escuro de 20-40x e confirme Oikopleura spp(Figura 8).
- Para aclimatar animais para condições laboratoriais, transfira cada amostra de 500 mL para um béquer de 10 L contendo proporção de 1:1 de água do mar superficial do local de amostragem e água do mar filtrada (fSW) mantida no laboratório (Figura 7A,B). Ajuste o volume do béquer para 5-10 L, dependendo da concentração da amostra de plâncton.
-
Identificação de O. dioica
NOTA: O. dioica pode ser identificado visualmente pela presença de machos e fêmeas totalmente maduros ou duas grandes células subcordais localizadas na metade distal de suas caudas. A distância entre duas células subcorrdais pode variar entre indivíduos.- Em seguida, verifique se há uma Oikopleura totalmente amadurecida com uma gônada cheia de óvulos(Figura 8A) ou esperma(Figura 8B). Se o animal possui apenas óvulos ou espermatozoides, pule para o passo 4.2.3, pois é O. dioica, a única espécie não hermafroditica descrita.
- Se o animal for imaturo(Figura 8C),procure duas células subcorrdais no final de sua cauda(Figura 8D).
- Uma vez confirmada a espécie, transfira-a para uma nova placa de Petri. Repetição passos 4.1.3-4.2.2 até 10-20 indivíduos são confirmados no nível das espécies.
NOTA: Para facilitar a identificação, anestesia animais em uma placa de Petri contendo 0,015% de metanossulfonato de tricaine (MS222) em fSW. - Se não for encontrado nenhum O. dioica, mantenha os béquers suspensos por mais um dia ou dois. Pode haver o dioica imaturo que continuará crescendo e se tornará mais fácil de ser detectado. Se nenhum aparecer após uma semana, descarte a amostra e tente a amostragem novamente.
5. Protocolo de cultivo para O. dioica
- Iniciando uma monocultura O. dioica a partir de uma amostra coletada de campo (Figura 7)
NOTA: A alimentação algal é preparada diariamente a partir de culturas de trabalho e cada béquer de monocultura é alimentado três vezes por dia às 9:00, 12:00 e 17:00, respectivamente (Ver passo 5.2). Os animais são mantidos a 23 °C. Nessas condições, o ciclo de vida de Okinawa O. dioica é de 4 dias(Figura 7C).- Para iniciar uma monocultura de O. dioica,isolar 120 animais e transferir para um novo béquer contendo 5 L de fSW fresco(Figura 7B,C).
- Na manhã seguinte, procure machos totalmente maduros com gônados amarelos e fêmeas com ovos que aparecem como esferas douradas(Figura 8A,B).
- Faça um béquer de desova transferindo suavemente 15 machos e 30 fêmeas para um novo béquer contendo 2,5 L de fSW fresco com uma pipeta de 5 mL blunt-end.
NOTA: Se não houver machos e fêmeas suficientes, transfira o maior número possível de adultos para um béquer contendo 1 L de fSW e deixe-os desovar naturalmente. Para minimizar o estresse físico aos animais durante a transferência manual, eles devem ser lentamente siphoneados e liberados sob a superfície da água. - Deixe os animais desovar naturalmente para iniciar a próxima geração. As larvas de cauda devem aparecer aproximadamente 3 horas após a fertilização.
NOTA: A desova é realizada por animais totalmente maduros abandonando suas casas, nadando em direção à água superficial e liberando seus gametas. A fertilização bem sucedida pode ser confirmada extraindo 5-10 mL de água do mar do fundo do béquer de desova e identificando ovos com decotes sob um microscópio. - Na primeira manhã pós-desova (dia 1), uma nova geração de animais com casas infladas deve aparecer no béquer. Use um béquer portátil de 500 mL para transferir suavemente o conteúdo do béquer de desova em um novo béquer contendo 7,5 L de fSW fresco (totalizando 10 L). Despeje em um ângulo para evitar um movimento de respingo.
- Na segunda manhã (dia 2), transfira manualmente 150 animais para um novo béquer contendo 5 L de fSW fresco.
- Na terceira manhã (dia 3), transfira manualmente 120 animais para um novo béquer com 5 L de fSW fresco.
NOTA: Para sincronizar o desenvolvimento dos animais, é importante selecionar indivíduos com tamanhos semelhantes durante a transferência manual nos dias 2 e 3. Um máximo de 10 animais podem ser siphoneed em uma única transferência. - Na quarta manhã (dia 4), animais totalmente maduros devem aparecer. Repita o passo 5.1.3 para fechar o ciclo de vida.
NOTA: Uma bomba de alimentação automatizada pode ser configurada para alimentar os animais às 17h nos fins de semana sem a presença de funcionários de cultivo.
- Preparação diária de alimentos algas da cultura de trabalho
- Medir a absorvência da cultura de trabalho em 660 nm.
- Com base no Gráfico Diário de Alimentação, descubra quantas células algas precisam ser alimentadas para os animais de tamanho específico(Tabela 3).
- Utilizando as curvas de crescimento de algas(Figura 4),resolva as equações abaixo para calcular o volume de alimentos algas (mL) necessários em um determinado dia.
- Para calcular o volume de uma determinada alga necessária para um dia específico e tempo de alimentação, use a seguinte equação:
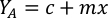
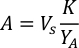
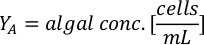
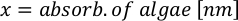
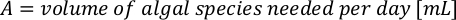
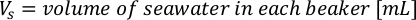
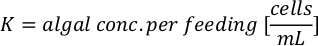
Onde YA é a concentração de algas em um determinado dia e A é o volume de algas necessárias por alimentação. Além disso, a relação linear entre YA a x,os valores para interceptação (c) e inclinação(m) são mostrados na Figura 4. Consulte a Tabela 3 para valores K. - Por exemplo, para calcular o volume de Isocrysis sp. necessário em uma alimentação de 9 AM do dia 3 animais mantidos em uma cultura de 5 L e com a absorvância de algas de 0,234 (medido em 660 nm), o seguinte foi calculado:
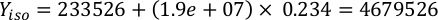
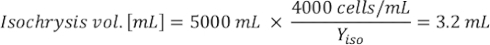
NOTA: Guarde essas equações em uma planilha para que a quantidade diária de alimentação seja calculada automaticamente com base em medidas de absorção, o tamanho dos animais e o volume de cultura da água do mar(Arquivo Suplementar 1).
- Para calcular o volume de uma determinada alga necessária para um dia específico e tempo de alimentação, use a seguinte equação:
- Transfira o volume calculado de algas para tubos de 50 mL, centrífuga a 5000 x g por 5 min a 20 °C.
- Remova o supernatante. Encha os tubos de volta ao volume original com fSW fresco, substituindo a antiga mídia alga.
- Armazene alimentos preparados na geladeira até estar pronto para ser usado para a próxima ração. Descarte a comida de algas velhas depois que novos alimentos são preparados na manhã seguinte.
- Carvão ativado (Opcional)
NOTA: 10 g de carvão ativado é adicionado a cada béquer de cultura para manter a qualidade da água. O carvão pode ser reutilizado até quatro vezes. Abra o saco de carvão lentamente para evitar que o pó de carvão entre nos béquers da cultura.- Transfira ~700 g de carvão ativado em um recipiente. Mergulhe em água doce (FW) por 48 horas e deixe-os se acomodarem na parte inferior.
- Enxágüe com FW para remover pó residual de carvão.
- Ferva o carvão em FW por 15-20 min. Retire do fogo e deixe esfriar.
- Enxágüe até que a maior parte do pó de carvão seja removida, e a água fique limpa.
- Armazene carvão limpo em 2 L béquer contendo fSW. Cubra o béquer para evitar que a poeira entre.
- Adicione carvão a cada novo béquer antes de transferir os animais.
Resultados
Oikopleura pode ser coletado de um barco ou de um porto por reboque lento e suave de uma rede de plâncton de malha de 100 μm com um cod-end não filtrante(Figura 5). Devido à natureza frágil dos animais, é importante evitar qualquer movimento que possa causar estresse físico, como manuseio áspero da rede ou respingos devido a um bolsão de ar preso no frasco de amostra.
É importante compreender o padrão sazonal das populações locais de Oikopleura, bem como as flutuações que acompanham as características físicas da água em um local de amostragem. A amostragem entre 2015 e 2019 revelou variação sazonal consistente na presença de O. dioica nos portos de Ishikawa e Kin em Okinawa (Figura 6). A temperatura da água do mar parece ser um fator importante. O. dioica foi a espécie dominante quando a água do mar superficial atingiu ≥28 °C, e O. longicauda coexistiu com O. dioica a temperaturas entre 24 °C e 27 °C; no entanto, O. longicauda dominou abaixo de 23 °C (Figura 6A). A mudança gradual na salinidade após vários dias consecutivos de chuva forte não se correlaciona com a abundância de O. dioica (Figura 6B).
Utilizando os procedimentos amostrais descritos acima, a maioria dos O. dioica que recuperamos foram entre os dias 2 e 3 do seu ciclo de vida de 4 dias(Figura 7C). Os machos maduros foram reconhecidos pela coloração amarela das gônadas, enquanto as gônadas fêmeas brilhavam ouro de ovos de 70-80 μm de diâmetro(Figura 8A,B). Imaturo O. dioica foram confirmados por duas células subcolais em suas caudas(Figura 8D). Outra espécie dominante nas águas locais, O. longicauda,eram semelhantes em tamanho e morfologia. Utilizamos os seguintes critérios para distinguir O. longicauda de O. dioica38,39,40: falta de células subcolais na cauda, presença de velum no tronco, e a presença de uma gônada hermafrodita(Figura 8E,F). As diferentes morfologias da cauda também são úteis para distinguir O. longicauda de O. dioica. Quando um animal nu intacto sem a casa era orientado lateralmente, a cauda de O. longicauda era mais reta com menos curvatura, dando-lhe uma aparência "mais dura" em comparação com a de O. dioica.
Os três fatores mais importantes para o estabelecimento de um sistema de cultura Oikopleura estável são (i) manter alta qualidade da água, (ii) identificar o regime alimentar ideal, e (iii) criar um béquer de desova com número suficiente de machos e fêmeas. A introdução de um sistema de filtro de várias etapas (Figura 1) melhorou a qualidade da água e a estabilidade da cultura. Um sistema de filtragem não é necessário para a água do mar artificial; no entanto, o custo, a disponibilidade e a conveniência da água do mar natural torna-se uma melhor opção para laboratórios situados perto da costa. Para estabelecer o regime alimentar, recomendamos medir as curvas de crescimento de algas que se aplicam às configurações individuais de laboratório, uma vez que as condições de temperatura e luz variam muito. Combinamos as curvas de crescimento com os cronogramas de alimentação publicados anteriormente para otimizar as concentrações e composições de alimentação de algas27 (Figura 4). Também seguimos um cronograma rigoroso de inoculação de algas para manter um fornecimento fresco de alimentos algas(Tabela 2). O sistema de alimentação automatizado nos permite manter um cronograma diário de alimentação consistente sem a presença da equipe de cultivo(Figura 2B).
Uma vez que as condições ideais de água do mar e alimentação são alcançadas, é importante iniciar novas gerações criando um béquer de desova com 15 machos e 30 fêmeas em 2,5 L de fSW. Isso garante uma boa concentração dos animais do Dia 1 na manhã seguinte, o que é suficiente para isolar 150 animais nos dias 2, 120 no dia 3 e 45 adultos maduros no dia 4 para desova. Se não houver machos e fêmeas suficientes no dia 4, colete e transfira o maior número possível de indivíduos maduros para 1 L de fSW e deixe-os desovar naturalmente na esperança de que haja larvas suficientes para levar para a próxima geração. Seguindo o protocolo fornecido, o ciclo de vida de O. dioica é de 4 dias a 23 °C (Figura 7C). Estabelecemos de forma confiável seis populações selvagens independentes de O. dioica,todas com duração superior a 20 gerações.
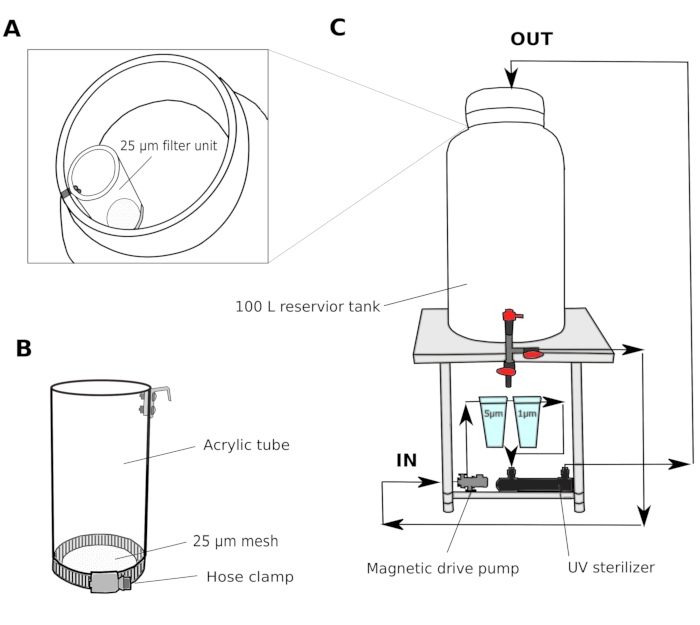
Figura 1: Esquema do sistema de filtro de água do mar.
(A e B) A água do mar é inicialmente filtrada através de uma unidade de filtro de 25 μm antes de entrar no tanque do reservatório (C) Uma bomba de acionamento magnético é usada para retirar a água do mar do tanque do reservatório. A água do mar é então empurrada através de dois filtros de polipropileno e um esterilizador UV antes de retornar ao tanque do reservatório. Clique aqui para ver uma versão maior desta figura.
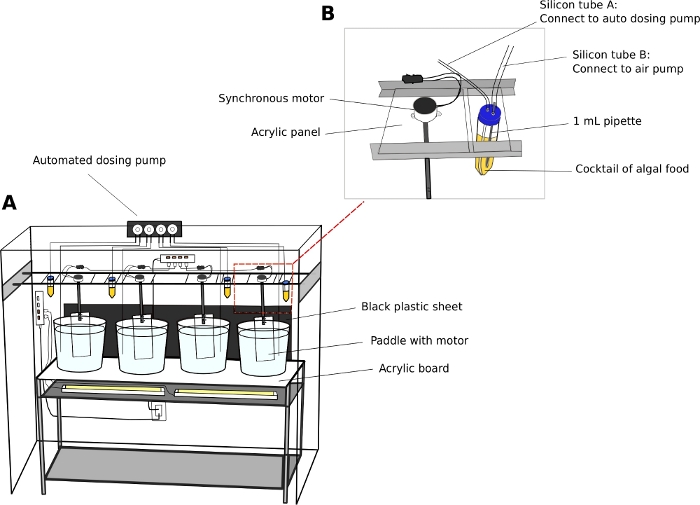
Figura 2: Sistema de cultura para O. dioica.
(A) Visão geral do sistema de cultura (B) Visão de perto do motor síncrona e do reservatório de algas para a bomba de dosagem automatizada. Os diâmetros internos dos tubos de silício A e B são de 2 mm e 4 mm, respectivamente. Clique aqui para ver uma versão maior desta figura.

Figura 3: Culturas de estoque para O. dioica.
Da esquerda- C. calcitrans, Isochrysis sp., Synechococcus sp., e R. reticulata depois de ser cultivado a 17 °C sob luz contínua por ~10 dias. Clique aqui para ver uma versão maior desta figura.
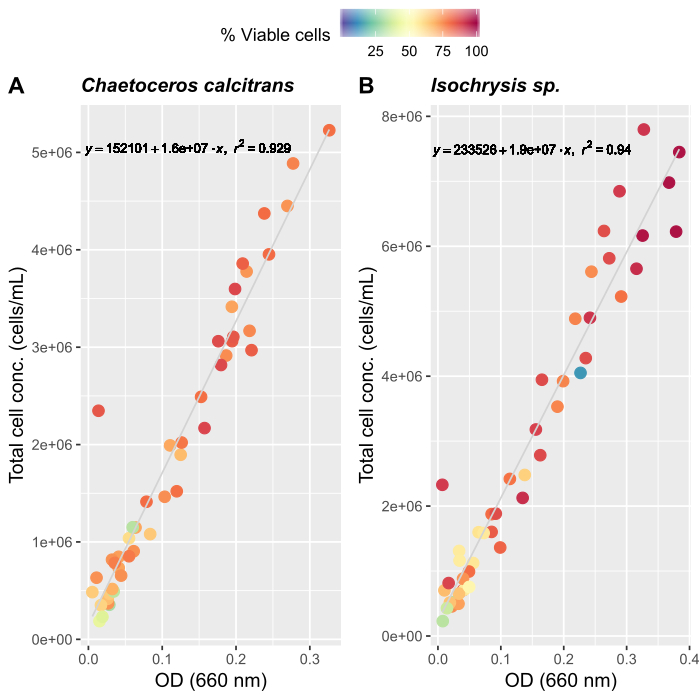
Figura 4: Curva de crescimento algal para duas das principais espécies alimentares, C. calcitrans e Isochrysis sp..
Dispersar parcelas de densidade óptica (OD) a 660 nm e concentrações totais de células para (A) C. calcitrans e (B) Isochrysis sp.. Cada ponto representa a média de três medidas. Um contador celular foi utilizado para determinar a porcentagem de células viáveis e concentrações celulares totais (células/mL). As medições foram registradas durante 20 dias (n = 47). Clique aqui para ver uma versão maior desta figura.
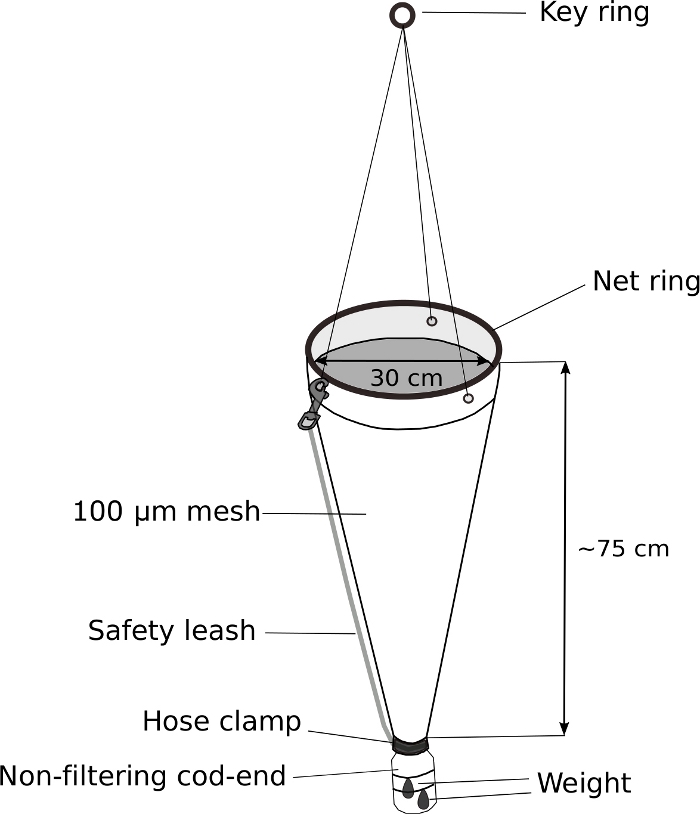
Figura 5: Rede de plâncton modificada para amostragem de Oikopleura.
A extremidade do bacalhau de uma rede de plâncton portátil (malha de 100 μm) é substituída por uma garrafa de lavagem de 500 mL. Um peso de 70 g é anexado ao bacalhau-end. Aproximadamente 5 m de corda está presa ao chaveiro. Uma coleira de segurança é anexada para proteger ainda mais o bacalhau. Clique aqui para ver uma versão maior desta figura.
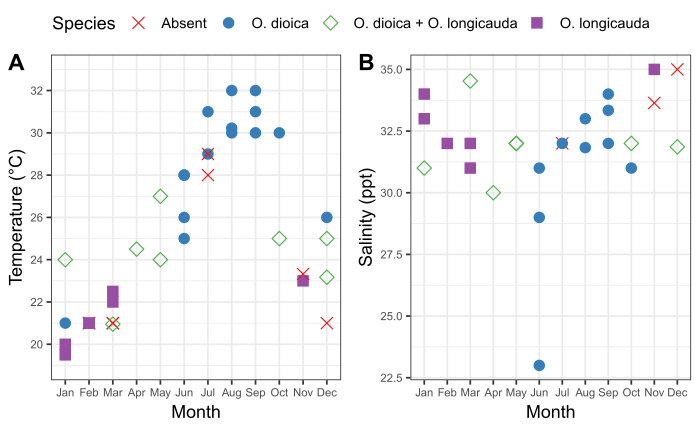
Figura 6: Sazonalidade de O. dioica em Okinawa.
Presença e ausência de O. dioica e O. longicauda em relação às mudanças sazonais na (A) temperatura e (B) salinidade nos portos de Ishikawa (26°25'39.3"N 127°49'56.6"E) e Kin (26°26'40.2"N 127°55'00.3"E) entre 2015-2019. Cada espécie foi registrada como presente se mais de 50 animais fossem contados manualmente. Foram registradas medidas de temperatura e salinidade da água superficial. Clique aqui para ver uma versão maior desta figura.
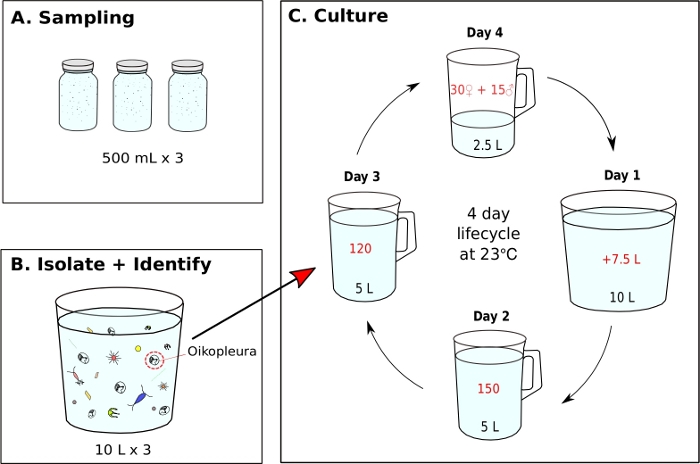
Figura 7: Gráfico de fluxo para iniciar a monocultura O. dioica.
(A) Três, 500 mL amostras de plâncton são coletadas de um local de amostragem (B) Cada frasco de amostra é diluído e O. dioica é isolado do resto do plâncton (C) Uma monocultura de O. dioica é iniciada transferindo manualmente 120 animais do Dia 3 para um novo béquer contendo 5 L de água do mar filtrada fresca (fSW). Montou um béquer de desova contendo 30 fêmeas, 15 machos e 2,5 L de fSW fresco. Na primeira manhã pós-desova (Dia1), esvazie cuidadosamente o béquer de desova com a nova geração de animais em um béquer contendo 7,5 L de fSW fresco. No segundo dia pós-desova (Dia 2), transfira 150 animais para um béquer contendo 5 L fSW fresco. No terceiro dia pós-desova (Dia 3), transfira 120 animais para um béquer contendo 5 L fSW fresco. No último dia (dia 4), montou um novo béquer de desova contendo 30 fêmeas, 15 machos e 2,5 L fSW frescos na preparação da próxima geração. Os animais têm um ciclo de vida de 4 dias a 23 °C. Clique aqui para ver uma versão maior desta figura.
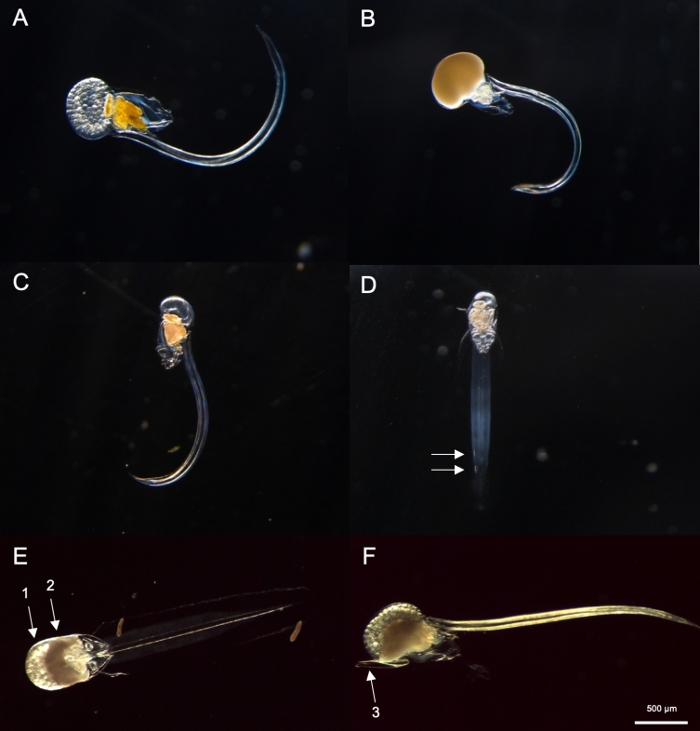
Figura 8: Identificação de Oikopleura spp. (A-D: O. dioica, E e F: O. longicauda).
(A) Fêmea O. dioica com ovos(B) Macho O. dioica com esperma (C) Visão lateral da imatura O. dioica (D) Visão ventral da imatura O. dioica com duas células subcolar indicadas com setas brancas(E) Visão ventral do maduro O. longicauda carregando óvulos (seta 1) e esperma (seta 2)(F) Vista lateral de O. longicauda mostrando velum (seta 3). Clique aqui para ver uma versão maior desta figura.
| Reagentes | Produtos químicos | Quantidade | Vol. final (mL) | Esterilização | Estoque / Aberto |
| Solução A | Na2EDTA | 45 g | 1000 | Autoclave | -20 °C / 4 °C |
| NaNO3 | 100 g | ||||
| H3BO3 | 33,6 g | ||||
| NaH2PO4 | 20 g | ||||
| MnCl2·4H2O | 0,36 g | ||||
| FeCl3·6H2O | 1,3 g | ||||
| Solução B | 1,0 mL | ||||
| Solução B | ZnCl2 | 2,1 g | 1000 | Autoclave | 4 °C / 4 °C |
| CoCl2·6H2O | 2,0 g | ||||
| (NH4)6Mo7O24·4H2O | 0,9 g | ||||
| CuSO4·5H2O | 2,0 g | ||||
| *HCl | - mL | ||||
| Vitamina | Tiamina (B1) · Hcl | 200 mgs | 1000 | Autoclave | -20 °C / 4 °C |
| Biotina | 1 mg | ||||
| Cobalamina (B12) | 1 mg | ||||
| Silicato de sódio | Na2Sio3 | 5% | 1000 | Filtro de 0,22 μm | 4 °C / 4 °C |
| Estreptomicina | C21H39N7O12 | 25 mg/mL | 50 | Filtro de 0,22 μm | -20 °C / -20 °C |
Tabela 1: Receita de reagentes necessários para a manutenção de alimentos de algas. Depois de dissolver todos os produtos químicos listados para a solução B, a HCL é adicionada até que a solução fique clara sem turbidez. Todos os reagentes são esterilizados por autoclaving (120 °C, 25 min) ou por uso de um filtro de 0,22 m. Todos os reagentes, exceto os estoques de vitaminas, são esterilizados após a adição de produtos químicos especificados. Para os estoques de vitaminas, autoclave a água primeiro, e depois dissolva o produto químico listado. As temperaturas de armazenamento do estoque e dos reagentes abertos estão listadas.
| Tipo de cultura | Algal Spp. | ASW (mL) | Vitamina | Solução A | Silicato de sódio | Estreptomicina | Algas (mL) / Tipo de cultura | Incubar / Loja | Freqüência |
| Cultura de ações | Chaeto | 60 | 1/2000 | 1/2000 | 1/4000 (Somente Chaeto) | 1/1000 (Todos, exceto Syn) | 0,03 / estoque | 17°C / 4°C | Quinzenal |
| Iso | 60 | 0,03 / estoque | |||||||
| Rinoceronte | 80 | 0,06 / estoque | |||||||
| Syn | 60 | 0,03 / estoque | |||||||
| Subcultura | Chaeto | 500 | 1/2000 | 1/2000 | 1/4000 (Somente Chaeto) | 1/1000 (Todos, exceto Syn) | 10 / estoque | 17°C / 17°C | Semanal |
| Iso | 500 | 10 / estoque | |||||||
| Rinoceronte | 500 | 20 / estoque | |||||||
| Syn | 500 | 10 / estoque | |||||||
| Cultura de trabalho | Chaeto | 400 | 1/2000 | 1/2000 | 1/4000 (Somente Chaeto) | 1/1000 (Todos, exceto Syn) | 100 / sub | RM / RM | A cada 4 dias |
| Iso | 400 | 100 / sub | |||||||
| Rinoceronte | 400 | 150 / sub | |||||||
| Syn | 400 | 100 / sub |
Tabela 2: Instrução para a manutenção de três tipos de cultura de algas. Adicione a quantidade especificada de suplementos a frascos contendo água do mar autoclavada. Inocular cada frasco com quantidade especificada de cultura alga. Incubar e armazenar culturas algas a temperaturas especificadas. Inocular a nova cultura de estoque e a subcultura da cultura de estoque anterior, e a nova cultura de trabalho da subcultura anterior. Inocular a nova cultura de estoque, a subcultura e a cultura de trabalho a cada duas semanas, uma semana e quatro dias, respectivamente. Esta programação fornece comida suficiente para aproximadamente 10 béquers da cultura O. dioica. Mantenha 2 – 3 conjuntos de cada tipo de cultura de algas como backups. RM – temperatura ambiente.
| Dia | Algal Spp. | 9H e 17H | 12:00 |
| 1 | Chaeto | — | — |
| Iso | 1000 | 2000 | |
| Syn | 20,000 | 40,000 | |
| 2 | Chaeto | 1000 | 2000 |
| Iso | 2000 | 2000 | |
| Rinoceronte | 1000 | 1000 | |
| 3 | Chaeto | 3000 | 4000 |
| Iso | 3000 | 4000 | |
| Rinoceronte | 1500 | 1500 | |
| 4 | Chaeto | 1000 | 2000 |
| Iso | 1000 | 2000 | |
| Rinoceronte | 1000 | 1000 |
Tabela 3: Concentração de algas por alimentação modificada a partir de Bouquet et al.27. Concentrações de algas (células mL-1) e espécies algas usadas para alimentação diária durante o ciclo de vida de 4 dias de Okinawa O. dioica.
Arquivo Suplementar 1: Gráfico de alimentação diário. As quantidades diárias de alimentação para cada béquer de cultura são calculadas automaticamente após a entrada em medições diárias de absorção de algas (DS), o tamanho dos animais (Dia) e o volume de água do mar (SW vol.) em cada béquer de cultura. As curvas de crescimento de R. reticulata e Synechococcus sp. foram adaptadas a partir de Bouquet et al.27. Clique aqui para baixar este arquivo.
Arquivo suplementar 2: Como conectar motor síncromo à pá acrílica. Aparafusar firmemente a raquete para o motor usando uma chave hexágona. Clique aqui para baixar este arquivo.
Discussão
Para facilitar a flexibilidade no estabelecimento da cultura O. dioica, é importante entender o habitat natural dos animais. Os dados sazonais fornecem informações sobre as faixas de parâmetros físicos, que podem ser usados para orientar as condições de cultivo de laboratório. Também ajuda a entender as flutuações sazonais na abundância de animais. Em Okinawa, O. dioica é mais confiável de junho a outubro. No entanto, na baía de Tóquio, as populações atingem o pico em fevereiro e41de outubro . Embora a cultura de O. dioica seja frequentemente relatada a 20 °C ou inferior27,28,29, Okinawan O. dioica mostra melhor sobrevivência em temperaturas acima de 20 °C; isso pode ser explicado pelo fato de que a temperatura mínima da água do mar em Okinawa é de ~20 °C(Figura 6). A abundância de O. dioica também pode ser influenciada pelas flores fitoplâncton42 e pela abundância de predadores43,44. Independentemente de onde O. dioica seja coletado, compreender a sazonalidade das populações locais maximiza a chance de amostragem e cultivo do sucesso.
Dada a estação e localização apropriadas, a amostragem líquida é uma maneira eficaz de coletar um grande número de Oikopleura com o mínimo esforço. Redes de plâncton com tamanho de malha menor (60-70 μm) também podem ser usadas para coletar todas as etapas dos animais. Animais totalmente maduros raramente são encontrados na rede, talvez devido à sua fragilidade no final do ciclo de vida. Portanto, a identificação das espécies seguidas pela amostragem é obtida pela observação microscópica das células subcorrdais. Indivíduos maduros geralmente aparecem um ou dois dias após a amostragem à medida que os animais continuam a crescer em laboratório. Embora a amostragem líquida seja eficiente, métodos alternativos de amostragem podem ser necessários em diferentes circunstâncias. Por exemplo, a amostragem líquida perto de áreas urbanas pode coletar um grande número de fitoplâncton, dificultando o isolamento de Oikopleura. Nesses casos, recomenda-se uma amostragem simples de baldes para coletar amostras de águas do mar ou barcos de áreas além do porto. Os resultados mostraram que a mudança gradual na salinidade devido aos dias consecutivos de chuva não afetou a abundância de O. dioica; no entanto, a amostragem da costa imediatamente após eventos climáticos extremos, como ciclones tropicais, deve ser evitada. Esses eventos causam mudanças biogeoquímicas repentinas e drásticas em um corpo de água abrigado45,46. O escoamento das águas pluviais pode transportar poluentes, sedimentos e nutrientes em excesso, que aumentam a turbidez e reduzem a qualidade da água47. O plâncton de alimentação por filtros, como o Oikopleura,pode ser especialmente suscetível a essas mudanças devido ao seu modo de alimentação e mobilidade limitada. Em tal circunstância, recomendamos adiar a amostragem por alguns dias até que as condições locais voltem ao normal.
A introdução de um sistema de filtro de várias etapas é essencial para manter pequenos organismos de alimentação de filtros, como o O. dioica. Usando água do mar mal filtrada (por exemplo, uma malha de 25 μm no sistema cultural anterior), a cultura era muitas vezes instável especialmente durante o verão, potencialmente devido à maior abundância de fitoplâncton. Embora alguns fitoplâncton sejam benéficos para o crescimento de O. dioica, outros produzem biotoxinas que podem causar desenvolvimento anormal de embriões O. dioica 48. Além disso, uma alta concentração de diatomás como chaetoceros spp. são potencialmente prejudiciais ao crescimento de O. dioica, pois podem possuir setae longo que pode entupir a casa e evitar alimentação eficiente49. Observamos frequentemente casas de pequenos animais sendo entupidos por C. calcitrans setae; portanto, agora alimentamos C. calcitrans apenas para animais no dia 2 ou mais(Tabela 3).
Embora não tenha sido um problema aqui, a cultura de O. dioica em larga escala pode sofrer quedas bruscas no tamanho da população devido a um gargalo genético; nesses casos, Martí-Solans et al.29 recomendam adicionar novos indivíduos selvagens à cultura a cada 20 gerações.
O sistema cultural Oikopleura é flexível. Uma cultura estável pode ser estabelecida dentro de uma semana. A cultura de longo prazo de O. dioica é possível em um orçamento modesto com equipamentos não especializados. O esforço diário necessário para a manutenção de 5-10 béquers de Oikopleura é geralmente menos de 2 horas com 2 pessoas. O. dioica também pode ser mantido em água do mar artificial, o que é benéfico para aqueles sem acesso à água do mar natural28. O armazenamento a longo prazo de alimentos algas é possível usando cultura sólida e criopreservação29. Além disso, o esperma de O. dioica pode ser criopreservado, e permanecer viável por mais de um ano50. Todos esses fatores significam que as culturas podem ser facilmente restabelecedas. Finalmente, experiência passada com cultivo acidental de Pleurobrachia sp. pode sugerir que o sistema de cultivo desenvolvido para Oikopleura poderia potencialmente ser estendido a uma comunidade mais ampla de frágeis organismos pelagicos.
O. dioica continua a fornecer informações poderosas sobre vários campos biológicos. Uma compreensão da sazonalidade local, um sistema de cultura meticuloso e alguns indivíduos dedicados permitem que a cultura eficaz seja estabelecida com pouco esforço. O sistema cultural Oikopleura fornece os recursos básicos para investigar uma ampla gama de campos biológicos relacionados à ecologia, desenvolvimento, genômica e evolução deste único chordate marinho.
Divulgações
O autor não tem nada a declarar.
Agradecimentos
Somos gratos a Garth Ilsley por seu apoio no estabelecimento do sistema cultural. Reconhecemos as contribuições de Ritsuko Suyama e Sylvain Guillot para os esforços de amostragem precoce e identificação de espécies. Agradecimentos especiais são devidos a Hiroki Nishida, Takeshi Onuma e Tatsuya Omotezako por seu generoso apoio e orientação durante todo o processo, incluindo o estabelecimento inicial do sistema local de cultivo e o compartilhamento de animais e cultura microalgal. Agradecemos também a Daniel Chourrout, Jean-Marie Bouquet, Anne Aasjord, Cristian Cañestro e Alfonso Ferrández-Roldán por compartilharem seus conhecimentos em amostragem e cultivo. Jai Denton, Charles Plessy e Jeffrey Jolly forneceram um feedback inestimável sobre o manuscrito. Charlotte West formulou uma equação generalizada para o cálculo de algas. Finalmente, agradecemos à OIST pelo financiamento, Mary Collins e o Comitê de Segurança de Trabalho de Campo da OIST por conselhos sobre procedimentos de amostragem segura, a equipe da loja de máquinas OIST para a construção de equipamentos de cultivo e amostragem, e Koichi Toda por fornecer água do mar.
Materiais
| Name | Company | Catalog Number | Comments |
| Activated charcoal | Sigma | C2764-2.5KG | |
| Alluminum pulley | Rainbow Products | 10604-10607 | |
| Biotin | Sigma | B4501-100MG | |
| Boric acid | Wako | 021-02195 | |
| Cobalamin (B12) | Sigma | V2876-100MG | |
| Cobalt(II) chloride hexahydrate | Wako | 036-03682 | |
| Copper(II) sulfate pentahydrate | Wako | 039-04412 | |
| Disodium edetate hydrate | Wako | 044-29525 | |
| Hexaammonium heptamolybdate tetrahydrate | Wako | 019-03212 | |
| Hexagon wrench | Anex | No.6600 | |
| Hydrochloric acid | Wako | 080-01066 | |
| Iron(III) chloride hexahydrate | Wako | 091-00872 | |
| Jebao programmable auto dosing pump | Jebao | DP-4 | |
| Magnet pump | REI-SEA | RMD-201 | |
| Manganese(II) chloride tetrahydrate | Wako | 134-15302 | |
| Polypropylene wound cartridge filter | Advantec | TCW-10N-PPS | |
| TCW-5N-PPS | |||
| TCW-1N-PPS | |||
| Screwless terminal block | SATO PARTS | SL4500 | |
| Simple plankton net | RIGO, Japan | 5512-C | |
| Sodium metasilicate | Sigma | 307815-1KG | |
| Sodium nitrate | Wako | 195-02545 | |
| Sodium phosphate monobasic anhydrous | MP Biomedicals | 194740 | |
| Streptomycin sulfate salt | Sigma | S6501-25G | |
| Synchronous electric motor | Servo | D5N6Z15M | |
| Thiamin hydrochloride | Wako | 201-00852 | |
| UV sterilizer | Iwaki | UVF-1000 | |
| Zinc chloride | MP Biomedicals | 194858 |
Referências
- Travis, J. Is It What We Know or Who We Know? Choice of Organism and Robustness of Inference in Ecology and Evolutionary Biology (American Society of Naturalists Presidential Address). The American Naturalist. 167 (3), 303-314 (2006).
- Jenner, R. A., Wills, M. A. The choice of model organisms in evo-devo. Nature Reviews Genetics. 8 (4), 311-314 (2007).
- Irigoien, X., Huisman, J., Harris, R. P. Global biodiversity patterns of marine phytoplankton and zooplankton. Nature. 429 (6994), 863-867 (2004).
- Wilson, S., Ruhl, H., Smith, J. Zooplankton fecal pellet flux in the abyssal northeast Pacific: A 15 year time-series study. Limnology and Oceanography. 58 (3), 881-892 (2013).
- Steinberg, D. K., Lomas, M. W., Cope, J. S. Long-term increase in mesozooplankton biomass in the Sargasso Sea: Linkage to climate and implications for food web dynamics and biogeochemical cycling. Global Biogeochemical Cycles. 26 (1), 1004 (2012).
- Lombard, F., Kiørboe, T. Marine snow originating from appendicularian houses: Age-dependent settling characteristics. Deep Sea Research Part I: Oceanographic Research Papers. 57 (10), 1304-1313 (2010).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 251-264 (1998).
- Hopcroft, R. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 45-57 (2005).
- Walters, T. L., Gibson, D. M., Frischer, M. E. Cultivation of the Marine Pelagic Tunicate Dolioletta gegenbauri (Uljanin 1884) for Experimental Studies. Journal of Visualized Experiments. (150), e59832 (2019).
- Deibel, D. Feeding mechanism and house of the appendicularian Oikopleura vanhoeffeni. Marine Biology. 93 (3), 429-436 (1986).
- Spada, F., et al. Molecular patterning of the oikoplastic epithelium of the larvacean tunicate Oikopleura dioica. Journal of Biological Chemistry. 276 (23), 20624-20632 (2001).
- Flood, P. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 59-85 (2005).
- Tokioka, T. Studies on the distribution of appendicularians and some thaliaceans of the North Pacific, with some morphological notes. Publication of the Seto Marine Biological Laboratory. (8), 351-443 (1960).
- Alldredge, A. L. Discarded appendicularian houses as sources of food, surface habitats, and particulate organic matter in planktonic environments. Limnology and Oceanography. 21 (1), 14-24 (1976).
- Clarke, C., Roff, J. C. Abundance and biomass of herbivorous zooplankton off Kingston, Jamaica, with estimates of their annual production. Estuarine, Coastal and Shelf Science. 31 (4), 423-437 (1990).
- Hopcroft, R. R., Roff, J. C. Zooplankton growth rates: extraordinary production by the larvacean Oikopleura dioica in tropical waters. Journal of Plankton Research. 17 (2), 205-220 (1995).
- Hopcroft, R. R., Roff, J. C. Production of tropical larvaceans in Kingston Harbour, Jamaica: are we ignoring an important secondary producer. Journal of Plankton Research. 20 (3), 557-569 (1998).
- Mochioka, N., Iwamizu, M. Diet of anguilloid larvae: leptocephali feed selectively on larvacean houses and fecal pellets. Marine Biology. 125 (3), 447-452 (1996).
- Sakaguchi, S. O., et al. Morphological identity of a taxonomically unassigned cytochrome c oxidase subunit i sequence from stomach contents of juvenile chum salmon determined using polymerase chain reaction. Fisheries Science. 83 (5), 757-765 (2017).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 25-34 (1998).
- Sato, R., Tanaka, Y., Ishimaru, T. House production by Oikopleura dioica (Tunicata, Appendicularia) under laboratory conditions. Journal of Plankton Research. 23 (4), 415-423 (2001).
- Flood, R., Deibel, D., Bone, Q. . The Biology of Pelagic Tunicates. , 105-124 (1998).
- Alldredge, A., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 309-326 (2005).
- Katija, K., Sherlock, R. E., Sherman, A. D., Robison, B. H. New technology reveals the role of giant larvaceans in oceanic carbon cycling. Science Advances. 3 (5), 1602374 (2017).
- Katija, K., Choy, C. A., Sherlock, R. E., Sherman, A. D., Robison, B. H. From the surface to the seafloor: How giant larvaceans transport microplastics into the deep sea. Science Advances. 3 (8), 1700715 (2017).
- Hidaka, K. Species composition and horizontal distribution of the appendicularian community in waters adjacent to the Kuroshio in winter-early spring. Plankton and Benthos Research. 3 (3), 152-164 (2008).
- Bouquet, J. M., et al. Culture optimization for the emergent zooplanktonic model organism Oikopleura dioica. Journal of Plankton Research. 31 (4), 359-370 (2009).
- Nishida, H. Development of the appendicularian Oikopleura dioica: culture, genome, and cell lineages. Development, Growth & Differentiation. 50, 239-256 (2008).
- Martí-Solans, J., et al. Oikopleura dioica culturing made easy: A Low-Cost facility for an emerging animal model in Evo Devo. Genesis. 53 (1), 183-193 (2015).
- Holland, L. Z. Tunicates. Current Biology. 26 (4), 146-152 (2016).
- Delsuc, F., Brinkmann, H., Chourrout, D., Philippe, H. Tunicates and not cephalochordates are the closest living relatives of vertebrates. Nature. 439 (7079), 965-968 (2006).
- Seo, H. C., et al. Miniature genome in the marine chordate Oikopleura dioica. Science. 294 (5551), 2506 (2001).
- Fredriksson, G., Olsson, R. The subchordal cells of Oikopleura dioica and O. albicans (Appendicularia, Chordata). Acta Zoologica. 72 (4), 251-256 (1991).
- Paffenhöfer, G. A. The cultivation of an appendicularian through numerous generations. Marine Biology. 22 (2), 183-185 (1973).
- Fenaux, R., Gorsky, G. Nouvelle technique d'élevage des appendiculaires. Rapports et Procés-Verbaux des Réunions-Commission Internationale pour l'Exploration Scientifique de la Mer Méditerranée. 29, 291-292 (1985).
- Fujii, S., Nishio, T., Nishida, H. Cleavage pattern, gastrulation, and neurulation in the appendicularian, Oikopleura dioica. Development Genes and Evolution. 218 (2), 69-79 (2008).
- Patry, W. L., Bubel, M., Hansen, C., Knowles, T. Diffusion tubes: a method for the mass culture of ctenophores and other pelagic marine invertebrates. PeerJ. 8, 8938 (2020).
- Fenaux, R. The classification of Appendicularia (Tunicata): history and current state. Memoires de I'Institut oceanographique. , (1993).
- Shiga, N., Chihara, M., Murano, M. . Illustrated Guide to Marine Plankton in Japan. , 1393-1414 (1997).
- Gorsky, G., Castellani, C., Castellani, C., Edwards, M. . Marine Plankton: A practical guide to ecology, methodology, and taxonomy. , 599-606 (2017).
- Sato, R., Ishibashi, Y., Tanaka, Y., Ishimaru, T., Dagg, M. J. Productivity and grazing impact of Oikopleura dioica (Tunicata, Appendicularia) in Tokyo Bay. Journal of Plankton Research. 30 (3), 299-309 (2008).
- Nakamura, Y., Suzuki, K., Suzuki, S. Y., Hiromi, J. Production of Oikopleura dioica (Appendicularia) following a picoplankton 'bloom'in a eutrophic coastal area. Journal of Plankton Research. 19 (1), 113-124 (1997).
- Nakamura, Y. Blooms of tunicates Oikopleura spp. and Dolioletta gegenbauri in the Seto Inland Sea, Japan, during summer. Hydrobiologia. 385 (1-3), 183-192 (1998).
- Uye, S. I., Ichino, S. Seasonal variations in abundance, size composition, biomass and production rate of Oikopleura dioica (Fol)(Tunicata: Appendicularia) in a temperate eutrophic inlet. Journal of Experimental Marine Biology and Ecology. 189 (1-2), 1-11 (1995).
- Tsuchiya, K., et al. Phytoplankton community response and succession in relation to typhoon passages in the coastal waters of Japan. Journal of Plankton Research. 36 (2), 424-438 (2014).
- Lopez-Lopez, L., et al. Effects of typhoons on gelatinous carnivore zooplankton off Northern Taiwan. Cahiers de Biologie Marine. 53, 349-355 (2012).
- Ares, &. #. 1. 9. 3. ;., et al. Extreme storm-induced run-off causes rapid, context-dependent shifts in nearshore subtropical bacterial communities. bioRxiv. , (2019).
- Torres-Águila, N. P., et al. Diatom bloom-derived biotoxins cause aberrant development and gene expression in the appendicularian chordate Oikopleura dioica. Communications Biology. 1 (1), 1-11 (2018).
- Troedsson, C., Frischer, M. E., Nejstgaard, J. C., Thompson, E. M. Molecular quantification of differential ingestion and particle trapping rates by the appendicularian Oikopleura dioica as a function of prey size and shape. Limnology and Oceanography. 52 (1), 416-427 (2007).
- Ouchi, K., Nishino, A., Nishida, H. Simple procedure for sperm cryopreservation in the larvacean tunicate Oikopleura dioica. Zoological Science. 28 (1), 8-11 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados