このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ショウジョウバエ幼虫を用いた熱遺伝学的神経細胞スクリーンにおけるマクロ栄養素摂取量の定量化
Erratum Notice
要約
ここで説明するプロトコルは、異なる大栄養素の質の食事にさらされた ショウジョウバエメラノガスター 幼虫によって定義された間隔内に食べられる食物の量の着色定量を可能にするプロトコルである。これらのアッセイは、神経細胞の熱遺伝学的スクリーンの文脈で行われる。
要約
飼育と摂食行動は、動物が発達、健康、フィットネスに不可欠なエネルギーと栄養素の源にアクセスすることを可能にします。これらの行動の神経調節を調査することは、栄養恒常性の基礎となる生理学的および分子的メカニズムの理解に不可欠である。このようなワーム、ハエ、魚などの遺伝的に難しい動物モデルの使用は、研究のこれらのタイプを大幅に容易にします。過去10年間、フルーツフライショウジョウバエメラノガスターは、摂食行動と採餌行動の神経制御を調査する神経生物学者によって強力な動物モデルとして使用されてきました。間違いなく貴重ですが、ほとんどの研究は大人のハエを調べます。ここでは、幼虫がタンパク質と炭水化物の含有量が異なる食事にさらされたときに摂食行動を制御する神経基質を調査するために、より単純な幼虫神経系を利用するプロトコルについて説明する。我々の方法は、神経細胞の熱遺伝学的活性化スクリーンの文脈で行われる定量的な無選択供給アッセイに基づいている。読み出しとして、1時間間隔で幼虫が食べる食物の量は、タンパク質と炭水化物(P:C)比が異なる3つの染料標識食餌の1つにさらされるときに使用された。このプロトコルの有効性は、幼虫ショウジョウバエの神経遺伝学的スクリーンの文脈で、異なる大栄養素の質の食事で食べられる食物の量を調節する候補神経集団を同定することによって実証される。また、試験した遺伝子型を分類して分類して、その遺伝子型を分類して分類することができました。文献で現在利用可能な方法の簡単なレビューに加えて、これらの方法の利点と限界が議論され、また、このプロトコルが他の特定の実験にどのように適応されるかについてのいくつかの提案が提供される。
概要
すべての動物は、生存、成長、および生殖に必要な量の栄養素を獲得するためにバランスのとれた食事に依存しています1.食べるものの選択は、満腹レベルのような動物の内部状態に関連する多数の相互作用要因と、食品品質2、3、4、5などの環境条件の影響を受ける。タンパク質と炭水化物は2つの主要な栄養素であり、そのバランスのとれた摂取量は動物の生理学的プロセスを維持するために不可欠です。したがって、摂食行動を制御し、これらの大栄養素のバランスのとれた摂取量を維持する神経機構の理解は非常に重要である。これは、寿命、胎児性、代謝の健康などの生命史の形質は、タンパク質摂取摂取量6、7、8、9、10のレベルによって直接影響を受けるからです。
哺乳類を含む複雑な動物との進化的に保存された摂食習慣を示すより単純でより難易な生物の使用は、この種の研究に不可欠である。重要なことに、これらの単純な動物モデルは、高価で倫理的かつ技術的により効果的な文脈で複雑な生物学的質問を解剖する良い機会を提供します。過去数十年の間に、 ショウジョウバエは、その強力な遺伝的ツールキット、複雑でステレオタイプな行動、哺乳類との末梢および栄養センシング機構の保存されたアーキテクチャを有し、行動神経生物学者11のための実りあるモデルとなっている。最終的には、より単純な神経系を持つこの動物の食物摂取量がどのように調節されているかを理解することで、人間の摂食障害の根底にある神経機能不全を解き始めることができると期待しています。
摂食行動のための神経基質の研究は、動物の食物摂取量を同時に測定しながら、その神経活動を操作できることに深く依存している。摂取される食品の量が最小限であるため、ハエが食べる食品の量を定量することは非常に困難であり、現在利用可能なすべての方法は重要な制限を提示します。従って、ゴールドスタンダードは、相補的方法論12の組み合わせを使用する。成虫ハエは歴史的に遺伝的および行動モデルとして支持されてきた。それにもかかわらず、ショウジョウバエ幼虫は、摂食行動をコードする神経基質を調査する機会も提供する。約12,000個のニューロンを持つ幼虫中枢神経系(CNS)は、約150,000個のニューロンを含む成人のそれよりも有意に複雑ではありません。幼虫の挙動は、より単純な機関車機能と感覚システムに依存しているため、この低い複雑さは数値だけでなく機能的でもあります。彼らの神経系の明らかな単純さにもかかわらず、幼虫はまだ完全な摂食行動を示し、ショウジョウバエの幼虫における食物摂取を定量化するいくつかの方法は5、13、14、15に記載されている。神経活動の操作と組み合わせることで、ショウジョウバエの幼虫は食物摂取の神経調節を理解するための非常に難解なモデルを構成することができる。
ここでは、異なる栄養素の質の食事にさらされた幼虫の食物摂取量を定量化するための詳細なプロトコルが提供されています。食事、いわゆるマクロ栄養素バランス食は、タンパク質および炭水化物の内容が異なり、特にタンパク質対炭水化物(P:C)比:1:1(タンパク質豊富な食事)、1:4(中間食)、および1:16(タンパク質貧しい食事)を 図1Aに示した。簡単に言えば、青色食品染料を染めたこれら3つのイソカロリックスクロース酵母(SY)ベースの食事を用いて定量的な無選択給餌アッセイを確立した。酵母エキスとショ糖はタンパク質と炭水化物源として使用され、両方とも炭水化物を含むため、P:C比の変動は、上記の16 と 図1Bに示すように、これら2つの成分のバランスを変化させることによって得られた。主な実験手順を示すプロトコルの概略図を 図 2に示します。
このプロトコルは、異なるP:C比の食事における幼虫摂食レベルの調節および熱遺伝学的神経細胞の文脈における特定の神経集団の役割を調査することを目的として設立された。過渡受容体ポテンシャル(TRP)ファミリーからよく特徴付けられた神経遺伝学的ツールを使用しました:ショウジョウバエ過渡受容体電位チャネル (dTRPA1), 温度と電圧ゲートカチオンチャネルであります, 周囲温度が25 °C17を超えて上昇したときに作用電位の発射を可能にします.dTRPA1トランスジーンを表現するために、我々はジャネリア研究キャンパス18、19でFlyLightプロジェクトの文脈で、ルービン研究所に設立されたショウジョウバエゲノムからのシス-調節領域に基づくGal4ラインを利用しました。
プロトコルは、ここで説明する、活性化画面のコンテキストで確立されているが、実験者が他の特定のニーズまたは興味に容易に適応させることができる、すなわち温度感受性神経サイレンサーShibireTS20を用いて抑制画面を実行し、dTRPA1に代わるものである。この他の適応については、プロトコルとディスカッションのセクションで説明します。
プロトコル
1. スクロース酵母(SY)ダイエットの準備
- すべての乾燥成分(寒天、酵母、スクロース)の重さを量り、栄養素バランスとL3飼育食餌を摂取します。1 Lの食品を調製するために必要な各成分のグラムの量を 図1Bに示します。
注:60mmペトリ皿を満たすには約13mLの食品が必要であることを考慮してください。 - すべての成分を滅菌蒸留水に溶かし(食品の準備に必要な水量の約50%を使用)、培地を5〜10分間かき混ぜます。
- 50分間オートクレーブ。
- 培地を冷やした後、ニパチンとプロピオン酸溶液を食事に加え、それぞれ3%と0.3%の最終濃度(v/v)で添加する。栄養素バランスダイエットに、青い食品染料を1%の最終濃度(v/v)に加えます。蒸留水で総量を完了します。
- 慎重に60ミリメートルペトリ皿に食餌を注ぎ、注いだ食品の量は、プレートのそれぞれでほぼ同じになるように。食事のP:C比でプレートにラベルを付けます。
注:摂食アッセイの日に栄養バランスの栄養を整えます。不可能な場合は、4°Cで、密閉容器に、最大3日間保存してください。より長い貯蔵期間は、あまりにも乾燥して硬い食事をレンダリングし、幼虫は媒体に穴を掘ることができません。
2. ペアレンタルラインの遺伝的十字架
注:遺伝的十字を設定するには、Gal4/UASシステム21を使用してください。このプロトコルでは、特定の神経集団における神経機能を活性化するために、UAS dTRPA1線17の女性処女が使用され、ジャネリアGal4線から男性に交配した(図2A)。使用される遺伝的制御は、DTRPA1線と「空のGAL4」ラインとの間の十字架の子孫であり、Rubin Gal4コレクションを生成するために使用されるベクターにGal4を運ぶが、規制断片は存在しない(attP2)22。神経抑制を促進するために、DTRPA1の代わりにシビレツ20をコードするUASラインを使用することができる。
- L3飼育ダイエットプレート付き60mm胚コレクションケージを設定し、アクティブな酵母ペーストを補います。
- 成人UAS dTRPA1女性処女とジャネリアGal4男性(5〜8歳)を胚採取ケージに移し、湿度60%、明暗サイクル12:12で25°Cで24-48時間の交配を可能にする(図2A)。60 mm胚コレクションケージの場合、1クロスあたり約100匹の処女メスと30人の男性を使用します。
- 交配期間の終わりに、遺伝的十字架に使用されるL3飼育ダイエットプレートを取り除き、捨てます。卵の産卵と幼虫のステージングを実行するために、新鮮なL3飼育ダイエットプレートに置き換えます。
3. 第3インスター幼虫(L3)の準備
- 交配した成体ハエを新鮮なL3飼育ダイエットプレートに移し、25°Cで3〜4時間産卵を可能にする(図2B)。すべてのプレートが遺伝子型、P:Cの食事と卵の産卵日の比率でラベル付けされていることを確認してください。
注:時間を節約するために、卵の余分な取り扱いを避けるL3飼育食に直接産卵を行います。小規模な遺伝子スクリーニングの場合、リンゴジュース寒天プレートを用いて産卵の最適化が得られる。 - 産卵期間の終わりに、ケージからプレートを取り出し、プラスチック製の蓋で覆います。酵母エキスを使用してL3の飼育プレートを補う場合は、産卵の終わりに残った酵母をすべて取り除くようにしてください。これは幼虫の成長の間に不一様な供給を避けるために重要である。
注:交配された成人は新鮮なL3飼育ダイエットプレートに移すことができるので、より多くの卵の産卵が行われ、より実験的な幼虫が得られる。連続した卵子は、1週間の間に同じ成人と一緒に行うことができます。 - 1プレート当たりの卵の数を推定し、幼虫密度をプレートあたり最大200個の胚に保ちます。この推定は、プレートの4分の1の胚数を数えることによって行うことができる。
注:過密プレートは幼虫の発達を遅らせ、幼虫の摂食行動に影響を与えます。 - L3飼育プレートを18°C(許容温度)、湿度60%、12:12の明暗サイクルでインキュベートし、幼虫が9日間成長することを可能にする(図2B)。
- 産卵(AEL)後の9日目に、試験する遺伝子型(および複製のために)のそれぞれから10 L3の3つのグループを収集する。さらに、「ゼロ染料食品」コントロールのために10 L3のグループを収集します。幼虫の採取は、卵の産卵を行うために使用される1日の同等の期間に行われることを確認してください(例えば、産卵が午前10時から午後2時の間に発生した場合は、同じ期間に9日間AELの間に幼虫を収集する)、できるだけ穏やかに、鉗子#5またはフェザーウェイト鉗子を使用して行われます。次のステップ(3.6)で示されるように、幼虫を直接移送します。
注:「ゼロ染料食品」コントロール動物は、摂食アッセイでは青色染料なしで食べ物を与えられる幼虫です。このコントロールは、幼虫抽出物の背景吸光度を除去するために不可欠です。 - 採取した実験幼虫を1mLの水を含むプラスチック製の皿重量ボートに移します。 図 3に示す指示に従って、L2 ではなく L3 が収集されていることを確認します。
注:水または1xリン酸緩衝生理食塩水(PBS)を含むプラスチックボートへのL3のコレクションは、授乳アッセイの開始前に幼虫を十分に水分補給し続けることが重要です。これは、異なる遺伝子型から複数の実験的なL3基が同時に収集されている場合に特に重要です。各グループの収集順序を追跡するので、各グループの食糧不足の期間の違いは最小限に抑えられます。このステップでのプラスチックボートの使用は幼虫が水浴に直接浮かぶようにする任意ステップ4.3を促進する。
4. 熱遺伝学的活性化と無選択給餌アッセイ
注:概日リズムに関連する可能性のある変動を最小限に抑えるために、1日とほぼ同じ時間に給餌アッセイを実行することをお勧めします。また、常に制御実験(UAS dTRPA1と「ゼロ染料食品」幼虫に交差した「空のGal4」ラインの子孫)を、目的の遺伝子型と並行して実行します。
- インキュベーターを30°C(非許容温度)に設定し、高湿度(少なくとも65%)を維持するアッセイ中の幼虫脱水を避けるために。
- 給餌アッセイを開始する前に、30°Cで30分間温めてアッセイプレートの温度を平衡化します。
- (オプション)実験幼虫を37°Cの水浴で2分間熱ショックを受けた。いくつかの水を含むプラスチック重量船の動物とこのステップを実行します。
注:このステップの目的は、摂食アッセイの開始以来、ニューロンの発火を促進することによってニューロン活性化を強化することである。 - 複数のタイマーを1時間の準備をしてください。使用されるタイマーの数は、試験対象の実験グループの数と、幼虫の取り扱いに関する実験者の熟練度に依存します。
注: 複数のタイマーを使用することは、すべての遺伝子型に対してアッセイの持続時間を一定に保つために重要です。 - プラスチックボートから水を慎重に排出し、湿らせた柔らかいブラシを使用して、L3グループをボートからアッセイプレートの中央に静かに移します。プレートの蓋を戻し、正確な1時間の給餌セッションを維持するために、各プレート(またはプレートのグループ)のタイマーを開始します。
- 幼虫が暗い中で30°Cで1時間餌を与えるようにします(図2C)。
注:暗闇の中でのアッセイのパフォーマンスは、食事が同じ染料濃度を含んでいるにもかかわらず、トーンが異なるように、食事全体の視覚的な手がかりの違いを制御するために重要です。 - プレートを氷浴に移して、給餌アッセイを停止します。氷を可能な限り押し下げて、プレートに安定した表面を提供します。
注:低温は、穴あけや掘削行動を阻害することによって、供給の終わりを促進します。幼虫のほとんどは、数分後に食品プレートを表面化し、次の手順で回復を促進します。
5. 食品染料抽出
- テストした10個のL3の各グループに2mLマイクロチューブを用意し、ほぼ同量の0.5mmガラスビーズ(マイクロチューブの底部を満たすのに十分)と300 μLの氷冷メタノールを含みます。ベンチクーラーを使用して、マイクロチューブを冷たく保ちます。
注意:メタノールは非常に可燃性と毒性があります。換気の良い場所で作業し、ニトリル手袋を着用するなど、この試薬の取り扱いに推奨されるすべての安全手順に従ってください。
注:メタノールの使用は、幼虫のサンプルを固定し、キューティクルのメラニン反応を避けるために重要です。 - #5またはフェザー級鉗子を使用して、10 L3のグループを送り込みアッセイプレートから慎重に回収し、水を含むアッセイプレートの蓋に移します。幼虫をすすいで体の破片を取り除き、幼虫を優しく取り扱い、怪我をしないようにします。各遺伝子型の回収された幼虫の数を複製ごとに記録し、幼虫1回当たりの平均食物摂取量を定量化できるようにします。
注:負傷した幼虫は、色分け定量には適さないため、キューティクルをメラナイズするので廃棄する必要があります。 - L3グループを5.1で用意した2mLマイクロチューブに移します。
- 幼虫組織をリセ化し、ステップ5.1で添加した組織ライザーとガラスビーズを用いた機械的なライシス法により、腸から食品染料を抽出する。(組織ライザーが利用できない場合は、均質化害虫を使用してください)。優先的に、このステップは4°C(図2D)で行います。
注: この手順の所要時間は、使用する機器によって異なります。従来の組織ライザーを用いて、1分分抽出で十分である。時間の制限の場合、プロトコルは、このステップの最後に一時停止し、後で続行することができます。サンプルは-20°Cで保存してください。 - 抽出物を 1.5 mL マイクロチューブを洗浄し、2 mL マイクロチューブを新しい 1.5 mL マイクロチューブに直接反転します。穏やかに行われる場合、ガラスビーズのほとんどは2 mLマイクロチューブの底に留まるでしょう。
- 抽出物を遠心分離して細胞の破片を取り除き、最大速度で10分間、4°Cで。
- 上清を集めて1.5 mLマイクロチューブを洗浄します。上清に細胞の破片がまだ見える場合は、ステップ 5.6 と 5.7 を繰り返します。
6. 食品消費の色分け定量
- 標準溶液を調製し、較正曲線を生成し、開始青色色素溶液のメタノールでシリアル1:2希釈を行う。ブランクとして、メタノールのみを使用してください。基準の濃度は、動物の食物摂取量のレベルに依存します。
注:ここで提示したパイロット画面の場合、幼虫抽出物に対して得られた色素濃度が0.02~1.93μL/mLの範囲であったため、メタノール中の2μL/mLブルー色素溶液の8連続希釈度の吸光度を測定した標準曲線を用いた。必要に応じて、実験試料の色素濃度に応じて、これらの溶液の濃度を増減する。 - 実験サンプル(ステップ5.7で得られた)の100μLを、標準およびブランク(ステップ6.1)を96ウェルマイクロプレートのウェルに移し、プレートリーダーを用いて600nmで吸光度を測定する(図2E)。背景吸光度を取り除くために、幼虫抽出物の「ゼロ」として青染めなしで食品に供給された幼虫から得られた抽出物の吸光度を測定する(「ゼロ染料食品制御」)。
- 標準曲線を生成し、各実験幼虫群から得られた吸光度値を、食物摂取量(mLの体積)と相関させる。ステップ5.2で各群に集められた幼虫の数を考慮に入れて、幼虫1人当たりの平均食物消費量を見つける
結果
ショウジョウバエ幼虫は、過剰な炭水化物23を摂取する費用でタンパク質の摂取量を調節する(図2Eの概略図)。実際には、このタンパク質摂取の優先順位付けは、他の多くの動物で観察されており、タンパク質利用24,25と呼ばれています。
この堅牢な摂食行動応答を利用して、行動?...
ディスカッション
このプロトコルを使用すると、異なるP:C組成の食事にさらされたときに、タンパク質と炭水化物の摂取量を調節する特定の神経集団の熱遺伝学的活性化の下で幼虫の能力をテストすることができます。この方法は、異なる栄養素の質の異なる食事全体の食物摂取量の制御に関連する神経集団を同定することを目的とした幼虫予備スクリーニングの文脈で試験された。この研究はまた、ショ
開示事項
著者らは開示するものは何もない。
謝辞
このプロトコルに記載されている実験装置の一部にアクセスを提供してくれたグルベンキアン・デ・シエンシア研究所(IGC)に感謝します。この研究は、ポルトガル科学技術財団(FCT)、LISBOA-01-0145-FEDER-007660によって支援されました。 PTDC/NEU- NMC/2459/2014,IF/00697/2014,ラカイシャHR17-00595をPMDに、オーストラリア研究評議会未来フェローシップ(FT170100259)からCKMへ。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Sarstedt AG & Co. | 72.690.001 | |
| 10xPBS | Nytech | MB18201 | |
| 2.0 mL microtubes | Sarstedt AG & Co. | 72.695.500 | |
| 60 mm petri dishes | Greiner Bio-one, Austria | 628161 | |
| 96 well microplates | Santa Cruz Biotechnology | SC-204453 | |
| Agar | Pró-vida, Portugal | ||
| Bench cooler | Nalgene, USA | Labtop Cooler 5115-0032 | |
| Blue food dye | Rayner, Billingshurst, UK | ||
| Cell disruption media | Scientific Industries, Inc. | 888-850-6208 | (0.5 mm glass beads) |
| Dish weight boats | Santa Cruz Biotechnology | SC-201606 | |
| Embryo collection cage for 60 mm petri dishes | Flystuff, Scientific Laboratory Supplies, UK | FLY1212 (59-100) | |
| Featherweight forceps | BioQuip Products, USA | 4750 | |
| Fly food for stocks maintenance | 1 L food contains: 10 g Agar, 100 g Yeast Extract, 50 g Sucrose, 30 mL Nipagin, 3 mL propionic acid | ||
| Forceps #5 | Dumont | 0108-5-PS | Standard tips, INOX, 11cm |
| Incubator | LMS Ltd, UK | Series 2, Model 230 | For thermogenetic feeding assay (30?C) |
| Incubator | Percival Scientific, USA | DR36NL | To stage larvae (19?C) |
| Janelia lines | Janelia Research Campus | Detailed information in Table 2 | |
| Macronutrient balancing diets | Composition and nutritional information in Figure 1 | ||
| Methanol | VWR | CAS number: 67-56-1 | |
| Nipagin (Methyl 4-hydroxybenzoate) | Sigma-Aldrich | H5501 | |
| Nitrile gloves | VWR, USA | ||
| Refrigerated centrifuge | Eppendorf, Germany | 5804 R / Serial number: 5805CI364293 | |
| Rubin Gal4 ines | Janelia Research Campus | Stoks available at Bloomington Drosophila Stock Center | |
| ShibireTS UAS line | Bloomington Drosophila Stock Center | BDSC number: 66600 | Provided by Carlos Ribeiro Group |
| Soft brushes | For sorting anaesthetised fruit flies | ||
| Spectrophotometer plate reader | Thermo Fisher Scientific | Multiskan Go 51119300 | |
| Stereo microscope | Nikon | 1016625 | |
| Sucrose | Sidul, Portugal | ||
| Third-instar larvae (L3) rearing diet | Composition and nutritional information in Figure 1 | ||
| Timer | |||
| Tissue lyzer / bead beater | MP Biomedicals, USA | FastPrep-24 6004500 | |
| TRPA1 UAS line | Bloomington Drosophila Stock Center | BDSC number: 26264 | Expresses TrpA1 under UAS control; may be used to activate neurons experimentally at 25 ?C |
| Water bath | Sheldon Manufacturing Inc., USA | W20M-2 / 03068308 / 9021195 | |
| Yeast extract | Pró-vida, Portugal | 51% Protein, 15% Carbohydrate |
参考文献
- Raubenheimer, D. . Nature of nutrition - a unifying framework from animal adaptation to human. , (2012).
- Carvahlo, M. J. a., Mirth, C. K. Coordinating morphology with behavior during development: an integrative approach from a fly perspective. Frontiers in Ecology and Evolution. , (2015).
- Steck, K., et al. Internal amino acid state modulates yeast taste neurons to support protein homeostasis in Drosophila. Elife. 7, 31625 (2018).
- Itskov, P. M., Ribeiro, C. The dilemmas of the gourmet fly: the molecular and neuronal mechanisms of feeding and nutrient decision making in Drosophila. Frontiers in Neuroscience. 7, 12 (2013).
- Bjordal, M., Arquier, N., Kniazeff, J., Pin, J. P., Leopold, P. Sensing of amino acids in a dopaminergic circuitry promotes rejection of an incomplete diet in Drosophila. Cell. 156 (3), 510-521 (2014).
- Grandison, R. C., Piper, M. D., Partridge, L. Amino-acid imbalance explains extension of lifespan by dietary restriction in Drosophila. Nature. 462 (7276), 1061-1064 (2009).
- Lee, K. P., et al. Lifespan and reproduction in Drosophila: New insights from nutritional geometry. Proceedings of the National Academy of Sciences of the United States of America. 105 (7), 2498-2503 (2008).
- Levine, M. E., et al. Low protein intake is associated with a major reduction in IGF-1, cancer, and overall mortality in the 65 and younger but not older population. Cell Metabolism. 19 (3), 407-417 (2014).
- Solon-Biet, S. M., et al. The ratio of macronutrients, not caloric intake, dictates cardiometabolic health, aging, and longevity in ad libitum-fed mice. Cell Metabolism. 19 (3), 418-430 (2014).
- Piper, M. D., et al. A holidic medium for Drosophila melanogaster. Nature Methods. 11 (1), 100-105 (2014).
- Jones, W. D. The expanding reach of the GAL4/UAS system into the behavioral neurobiology of Drosophila. BMB Reports. 42 (11), 705-712 (2009).
- Deshpande, S. A., et al. Quantifying Drosophila food intake: comparative analysis of current methodology. Nature Methods. 11 (5), 535-540 (2014).
- Neckameyer, W. S. A trophic role for serotonin in the development of a simple feeding circuit. Developmental Neuroscience. 32 (3), 217-237 (2010).
- Gasque, G., Conway, S., Huang, J., Rao, Y., Vosshall, L. B. Small molecule drug screening in Drosophila identifies the 5HT2A receptor as a feeding modulation target. Scientific Reports. 3, (2013).
- Schoofs, A., et al. Selection of motor programs for suppressing food intake and inducing locomotion in the Drosophila brain. PLoS Biology. 12 (6), 1001893 (2014).
- Pocas, G. M., Crosbie, A. E., Mirth, C. K. When does diet matter? The roles of larval and adult nutrition in regulating adult size traits in Drosophila melanogaster. Journal of Insect Physiology. , 104051 (2020).
- Hamada, F. N., et al. An internal thermal sensor controlling temperature preference in Drosophila. Nature. 454 (7201), 217-220 (2008).
- Pfeiffer, B. D., et al. Tools for neuroanatomy and neurogenetics in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 105 (28), 9715-9720 (2008).
- Jenett, A., et al. A GAL4-driver line resource for Drosophila neurobiology. Cell Reports. 2 (4), 991-1001 (2012).
- Kitamoto, T. Conditional modification of behavior in Drosophila by targeted expression of a temperature-sensitive shibire allele in defined neurons. Journal of Neurobiology. 47 (2), 81-92 (2001).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Shirangi, T. R., Stern, D. L., Truman, J. W. Motor control of Drosophila courtship song. Cell Reports. 5 (3), 678-686 (2013).
- Mirth, C. M. J. Food intake and food choice are altered by the developmental transition at critical weight in Drosophila melanogaster. Animal Behaviour. 126, 195-208 (2017).
- Simpson, S. J., Raubenheimer, D. Obesity: the protein leverage hypothesis. Obesity Reviews. 6 (2), 133-142 (2005).
- Raubenheimer, D., Simpson, S. J. Integrative models of nutrient balancing: application to insects and vertebrates. Nutrition Research Reviews. 10 (1), 151-179 (1997).
- Li, H. H., et al. A GAL4 driver resource for developmental and behavioral studies on the larval CNS of Drosophila. Cell Reports. 8 (3), 897-908 (2014).
- Bhatt, P. K., Neckameyer, W. S. Functional analysis of the larval feeding circuit in Drosophila. Journal of Visualized Experiments. (81), e51062 (2013).
- Wong, R., Piper, M. D. W., Blanc, E., Partridge, L. Pitfalls of measuring feeding rate in the fruit fly Drosophila melanogaster. Nature Methods. 5 (3), 214-215 (2008).
- Almeida-Carvalho, M. J., et al. The Ol1mpiad: concordance of behavioural faculties of stage 1 and stage 3 Drosophila larvae. Journal of Experimental Biology. 220, 2452-2475 (2017).
- Rodrigues, M. A., et al. Drosophila melanogaster larvae make nutritional choices that minimize developmental time. Journal of Insect Physiology. 81, 69-80 (2015).
- Wong, R., Piper, M. D., Wertheim, B., Partridge, L. Quantification of food intake in Drosophila. PLoS One. 4 (6), 6063 (2009).
- Wu, Q., et al. Developmental control of foraging and social behavior by the Drosophila neuropeptide Y-like system. Neuron. 39 (1), 147-161 (2003).
- Wu, Q., Zhang, Y., Xu, J., Shen, P. Regulation of hunger-driven behaviors by neural ribosomal S6 kinase in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 102 (37), 13289-13294 (2005).
- Lingo, P. R., Zhao, Z., Shen, P. Co-regulation of cold-resistant food acquisition by insulin- and neuropeptide Y-like systems in Drosophila melanogaster. Neuroscience. 148 (2), 371-374 (2007).
Erratum
Formal Correction: Erratum: Quantification of Macronutrients Intake in a Thermogenetic Neuronal Screen using Drosophila Larvae
Posted by JoVE Editors on 10/06/2020. Citeable Link.
An erratum was issued for: Quantification of Macronutrients Intake in a Thermogenetic Neuronal Screen using Drosophila Larvae. A figure was updated.
Figure 1 was updated from:
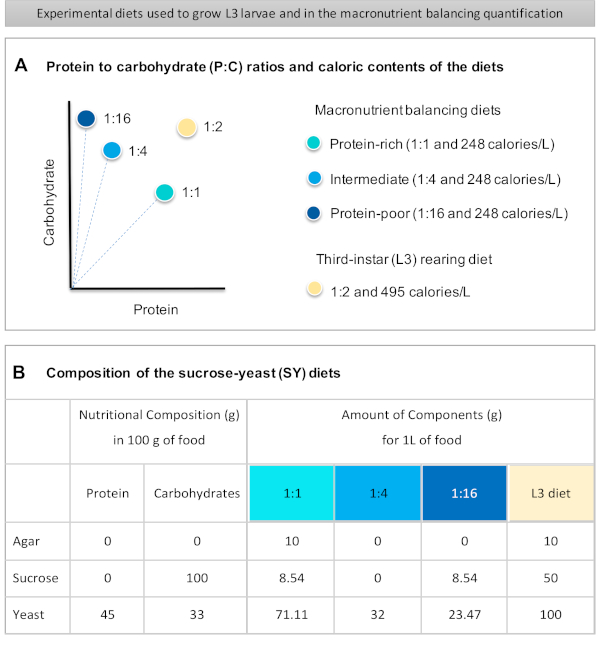
Figure 1: The sucrose-yeast (SY) diets used in our protocol. (A) The blue dots represent the isocaloric (248 calories/L) macronutrient balancing diets used in the feeding assay, which differ in the protein to carbohydrate (P:C) ratios: 1:1, 1:4 and 1:16. The beige dot represents the diet used to rear the experimental third-instar larvae (L3), which contained a P:C ratio of 1:2 and a caloric density of 495 calories/L. (B) Detailed composition and nutritional information of the sucrose-yeast (SY) based diets. The components are the same for all the diets: agar, sucrose and yeast. The amount in grams of the components needed to prepare 1 L of diet is shown. Note that 1% (v/v) of blue dye must be added to the macronutrient balancing diets and to the L3 rearing diet nipagin and propionic acid solutions must be added to a final concentration (v/v) of 3% and 0.3%, respectively. Please click here to view a larger version of this figure.
to:
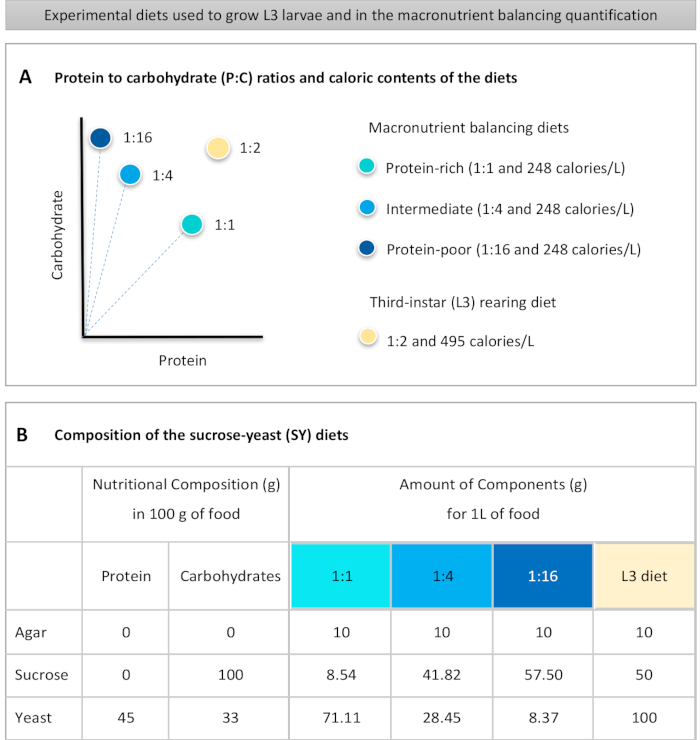
Figure 1: The sucrose-yeast (SY) diets used in our protocol. (A) The blue dots represent the isocaloric (248 calories/L) macronutrient balancing diets used in the feeding assay, which differ in the protein to carbohydrate (P:C) ratios: 1:1, 1:4 and 1:16. The beige dot represents the diet used to rear the experimental third-instar larvae (L3), which contained a P:C ratio of 1:2 and a caloric density of 495 calories/L. (B) Detailed composition and nutritional information of the sucrose-yeast (SY) based diets. The components are the same for all the diets: agar, sucrose and yeast. The amount in grams of the components needed to prepare 1 L of diet is shown. Note that 1% (v/v) of blue dye must be added to the macronutrient balancing diets and to the L3 rearing diet nipagin and propionic acid solutions must be added to a final concentration (v/v) of 3% and 0.3%, respectively. Please click here to view a larger version of this figure.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved