Method Article
Dissezione assistita da transilluminazione di stadi specifici del ciclo epiteliale seminifero del topo per analisi immunosottenifere a valle
In questo articolo
Riepilogo
Questo protocollo descrive la microdissezione assistita dalla transilluminazione di segmenti di tubuli seminiferi di topi adulti che rappresentano stadi specifici del ciclo epiteliale seminifero, e i tipi di cellule in esso, e la successiva immunostaining di preparati di zucca e segmenti di tubuli intatti.
Abstract
La spermatogenesi è un processo di differenziazione unico che alla fine dà origine a uno dei tipi cellulari più distinti del corpo, lo sperma. La differenziazione delle cellule germinali avviene nelle sacche citoplasmatiche delle cellule somatiche di Sertoli che ospitano da 4 a 5 generazioni di cellule germinali contemporaneamente e coordinano e sincronizzano il loro sviluppo. Pertanto, la composizione dei tipi di cellule germinali all'interno di una sezione trasversale è costante, e queste associazioni cellulari sono anche note come stadi (I-XII) del ciclo epiteliale seminifero. È importante sottolineare che gli stadi possono anche essere identificati da tubuli seminiferi intatti in base alle loro caratteristiche differenziali di assorbimento/dispersione della luce rivelate dalla transilluminazione, e al fatto che gli stadi si sus seguono lungo il tubulo in ordine numerico. Questo articolo descrive un metodo di microdisezione assistita da transilluminazione per l'isolamento di segmenti di tubuli seminiferi che rappresentano stadi specifici del ciclo epiteliale seminifero del topo. Il modello di assorbimento della luce dei tubuli seminiferi viene prima ispezionato al microscopio a dissezione, quindi i segmenti di tubuli che rappresentano stadi specifici vengono tagliati e utilizzati per applicazioni a valle. Qui descriviamo protocolli immunosottenibili per preparazioni di zucca specifiche dello stadio e per segmenti di tubuli intatti. Questo metodo consente a un ricercatore di concentrarsi su eventi biologici che si svolgono in specifiche fasi di spermatogenesi, fornendo così uno strumento unico per studi di sviluppo, tossicologici e citologici della spermatogenesi e dei meccanismi molecolari sottostanti.
Introduzione
La differenziazione delle cellule germinali maschili dalla spermatogonia diploide agli spermatozoi aploidi maturi, cioè la spermatogenesi, è unprocesso complesso che si svolge nell'epitelio dei tubuli seminiferi nei teste di un individuo sessualmente maturo1. I discendenti mitotici della spermatogonia A1 prima si dividono cinque volte per espandere la popolazione impegnata nella differenziazione, quindi entrano nella meiosi come spermatociti che alla fine danno origine a spermatidi aploidi. La differenziazione degli spermatidi rotondi in spermatozoi, cioè spermiogenesi, comporta complessi cambiamenti nella morfologia cellulare, tra cui la compattazione nucleare e la costruzione di strutture specifiche dello sperma come l'acrosoma eil flagello. Nel topo, l'intero processo di spermatogenesi richiede 35 giorni per completare2,3.
In qualsiasi luogo, l'epitelio seminifero ospita fino a cinque coorti di cellule germinali differenzianti più le cellule staminali/progenitrici germinali e le cellule somatiche di Sertoli1. Le cellule germinali differenzianti formano strati concentrici la cui composizione è prevedibile e le cellule aploidi in un dato fase di sviluppo si associano sempre a determinati tipi di spermatociti e spermatogonia4,5. Pertanto, qualsiasi sezione trasversale di un tubulo ospita coorti di cellule germinali di una composizione costante. Queste associazioni cellulari specifiche sono definite come gli stadi dell'epitelio seminifero. Le fasi di per sé non presentano stati stagnanti simili a check-point, ma si sviluppano continuamente man mano che la differenziazione delle coorti di cellule germinali progredisce insincronia 1,2,6. Nei topi, ci sono 12 stadi (I-XII)2 che sono disposti in modo segmentale lungo l'asse longitudinale del tubulo seminifero, e si sus seguono in ordine logico formando così l'onda dell'epitelio seminifero, o onda spermatogenica7,8,9 (Figura 1). Il completamento della spermatogenesi richiede quattro cicli e strati gerarchici o coorti di cellule germinali differenzianti all'interno di qualsiasi sezione trasversale del tubulo seminifero sono temporaneamente un ciclo seminifero l'uno dall'altro. La durata del ciclo dipende dalle specie e nel topo ogni ciclo richiede 8,6 giorni10.
Le fasi possono essere identificate sulla base della composizione cellulare e dell'organizzazione dell'epitelio seminifero sulle sezioniistologiche dei testicoli 5(figura 1 e figura 2). Tuttavia, l'analisi istologica è laboriosa, dispendiosa in termini di tempo e richiede fissaggio e colorazione e non può, quindi, essere applicata ai tessuti vivi. È importante sottolineare che la stadiazione può essere eseguita anche su tessuti viventi al microscopio a dissezione sfruttando modelli distinti di assorbimento/dispersione della luce esibiti da diverse fasi del ciclo (Figura 2). La capacità di ogni stadio di assorbire e disperdere la luce è relativa al livello di condensazione della cromatina degli spermatidi post-meiotici tardi che ogni dato stadio ospita e all'imballaggio di queste cellule infasci 7,11. La differenziazione spermatidi, cioè la spermiogenesi, è ulteriormente divisa in 16 fasi di sviluppo, tra cui8 passaggi di spermatidi rotondi (fase 1-8) e 8 passaggi di differenziazione spermatido allungante (fasi 9-16)(Figura 1). Gli spermatidi allunganti step 9-11 (stadio IX-XI) mostrano solo un basso livello di condensa di cromatina con conseguente assorbimento di una bassa quantità di luce. La condensazione della cromatina inizia nel passaggio 11 spermatidi (stadio XI) e gli spermatidi allunganti fase 15-16 (stadio IV-VIII) contengono cromatina completamente condensata e quindi mostrano un massimo assorbimento della luce(Figura 3). La cromatina deve essere condensata per essere ben imballata nella testa dello sperma. Altri fattori che contribuiscono al modello di assorbimento della luce sono la posizione degli spermatidi allunganti all'interno dell'epitelio (basale vs. apicale) e l'aggregazione di spermatidi allunganti (pronunciati negli stadi II-V)11 (Figura 3). I fasci sono visti come macchie al centro dei tubuli e come strisce sui bordi sotto un microscopio a dissezione e più condensata è la cromatina, più scura è la macchia / striscia11.
Questo articolo descrive l'uso del metodo di microdisezione assistita da transilluminazione per l'isolamento di segmenti di tubuli seminiferi che rappresentano fasi specifiche del ciclo epiteliale seminifero. Una volta isolati, i segmenti di tubuli a fasi possono essere soggetti a varie analisi a valle, tra cui analisi biochimiche dell'RNA e delle proteine12,13,14,15,citometria diflusso 16, coltura di tubuli ex vivo17 e immunostaining18. Qui forniamo anche protocolli dettagliati a valle per preparare monostrati schiacciati di segmenti di tubuli a fasi per l'analisi morfologica delle cellule vive e la successiva immunostaining, nonché immunosottenimenti a montaggio intero di segmenti di tubuli. Il flusso di lavoro in breve descritto nella figura 4.
Il metodo di microdisezione assistita da transilluminazione consente un'accurata identificazione e isolamento delle cellule germinali in specifiche fasi di differenziazione grazie alla composizione cellulare sincronizzata degli stadi. È importante sottolineare che consente anche lo studio di eventi dipendenti dallo stadio durante la spermatogenesi sul tessuto vivo. Data la mancanza di modelli scalabili in vitro per la spermatogenesi, questo metodo ha anche un vantaggio unico di consentire studi mirati di sviluppo a breve termine e tossicologici su segmenti di tubuli specifici per stadio ex vivo12,17. Mentre descriviamo il metodo qui per il topo, la stessa procedura può essere applicata a qualsiasi specie di mammiferi con disposizione longitudinale e segmentale di stadi epiteliali seminiferi, come ilratto 4,7,15,19,20.
Protocollo
Il mantenimento dei topi di laboratorio e di tutti gli esperimenti sugli animali è stato effettuato in conformità con le linee guida e le normative pertinenti per la cura e l'uso di animali da laboratorio nell'Università di Turku.
1. Preparazione di tubuli seminiferi per la microdisezione
- Sacrifica un topo maschio adulto (≥8 settimane, testicolo 80-120 mg a seconda del ceppo e dell'età) attraverso l'asfissia di CO2 seguita da lussazione cervicale.
NOTA: Il topo deve essere sessualmente maturo e preferibilmente di almeno 8 settimane. Il modello di transilluminazione dei topi giovani differisce dall'adulto perché l'onda dell'epitelio seminifero non è ancora stata completamente stabilita e la tempistica della prima ondata di spermatogenesi èdistinta 21,22. La mancanza di spermatidi allunganti nei topi maschi di 4 settimane impedisce il loro uso per la microdisezione assistita da transilluminazione. Possono essere utilizzati tutti i ceppi di topo che hanno una normale spermatogenesi. - Spruzzare l'addome ventrale con il 70% di etanolo. Aprire la cavità addominopelvica usando forbici sterili, facendo un'apertura a forma di V.
- Tirando sul cuscinetto grasso epididimale con forcep sterili, individuare i teste, sezionarli usando le forbici e posizionarli su una piastra di Petri sterile da 100 mm contenente PBS.
NOTA: Per mantenere la sterilità, assicurarsi che tutti i labware e gli strumenti chirurgici siano sterili. - L'uso di forbici a punta fine decapsula i testicoli tagliando una fessura nell'albuginea tunica,il foglio fibroso spesso che incapsula il testicolo. Quindi apri la tunica usando un paio di forcep. Forzare i tubuli premendo con le forcep e scartare la tunica.
NOTA: Durante lo scartamento della tunica, potrebbe essere utile per alcune applicazioni a valle che l'arteria testicolare venga rimossa insieme alla tunica. Evitare di danneggiare i tubuli seminiferi. - Spostare i tubuli seminiferi in una nuova piastra di Petri e versare abbastanza PBS sterile per coprire il fondo della piastra di Petri. Quindi, allontana delicatamente i tubuli ma evita di danneggiare i tubuli.
NOTA: Troppe sollecitazioni meccaniche influenzeranno il modello di transilluminazione e influenzeranno la vitalità del tessuto e la sua architettura cellulare. I tubuli possono anche essere lavorati per immunosottenimenti a montaggio intero da questo punto senza messa in scena (3B). A volte è sufficiente definire retrospettivamente lo stadio includendo anticorpi contro proteine espresse in spermatogonia differenziante, come SALL4, c-KIT e DNMT3A18,23. La densità della spermatogonia è un indicatore di stadio relativamente affidabile (figura 2).
2. Microdisezione assistita da transilluminazione
- Posizionare saldamente la piastra di Petri sotto un microscopio a dissezione toccarla sul palco.
NOTA: È importante nastro bene la piastra di Petri per prevenirne il movimento che potrebbe causare la miscelazione dei segmenti di tubuli seminiferi a fasi raccolti. - Per rivelare il modello di assorbimento della luce dei tubuli seminiferi sotto messa a fuoco, assicurarsi che il campione sia illuminato dal basso e che la luce passi attraverso il campione, cioè, sia transilluminato.
NOTA: La quantità di luce assorbita/dispersa è relativa al livello di condensazione della cromatina negli spermatidi allunganti e al loro raggruppamento all'interno del tubulo seminifero: più si condensa, più la luce viene assorbita, cioè, appare più scura. - Conoscere il modello di assorbimento della luce di diversi stadi, come descritto nella figura 2, figura 5A e figura S1 spostando accuratamente i fasci di tubuli utilizzando forcep fini.
NOTA: Le fasi si sus seguono sempre in ordine logico, formando l'onda dell'epitelio seminifero. Tuttavia, è importante sapere che la direzione dell'onda spermatogenica occasionalmente si inverte e poi ritorna di nuovo (nota anchecome modulazioni 4,9), a volte complicando la procedura. Inoltre, la lunghezza di ogni stadio, in termini di quanti mm di tubulo, varia considerevolmente. - Sollevare con cura il tubulo di interesse utilizzando le forcette con una punta agganciata, quindi tagliare un segmento di lunghezza appropriata utilizzando forbici a microdisezione (vedere Video supplementare 1). Un gancio sulla punta delle forcep facilita il sollevamento e la tenuta di un tubulo e aiuta a evitare di spremerlo.
NOTA: La lunghezza dei segmenti da tagliare dipende dalle applicazioni a valle. Per la raccolta di pezzi di tubuli raggruppati di uno stadio specifico per l'analisi di proteine o RNA12,13 (II–V, VII-VIII e IX-XI, Figura 5B) la lunghezza è tipicamente di 2-5 mm. Quando si utilizza l'estrazione standard fenolo-cloroformio, circa 200 ng di RNA possono essere derivati da 1 mm di tubulo. Per la colorazione a montaggio intero dei segmenti di tubuli a fasi, la lunghezza dei segmenti deve essere >5 mm. Per i preparati di zucca la lunghezza dei segmenti non deve superare 1-2 mm perché le celle al centro del segmento potrebbero non uscire se troppo lunghe. Utilizzare una scala mm sotto la piastra di Petri per una misurazione accurata della lunghezza del tubulo.
3. Immunostaining di diversi preparati
- Preparazione dello squash: verifica dello stadio e immunosocienza
NOTA: I pezzi di tubuli specifici dello stadio possono essere schiacciati su uno scivolo al microscopio con un vetro di copertura per eseguire analisi morfologiche delle cellule viventi mediante microscopia a contrasto di fase e successiva immunosocienza. Si consiglia a un principiante di utilizzare questo approccio per verificare le fasi quando si fa conoscenza con il metodo di microdisezione assistito da transilluminazione.- Raccogliere il segmento in un volume di 10 μL utilizzando una pipetta e spostarlo su uno scivolo al microscopio.
- Schiacciare il tubulo posizionando con cura un vetro di copertura (20 mm x 20 mm) sul tubulo. Di conseguenza, le cellule fluiranno fuori dal tubulo e formeranno un monostrato a cellule vive. Posizionare una carta da filtro sul bordo del vetro di copertura per facilitare la diffusione delle cellule. Evitare di schiacciare troppo le cellule per mantenerle in vita.
- Monitorare la diffusione delle cellule al microscopio. Utilizzare un microscopio a contrasto di fase con obiettivo 40x per verificare il riconoscimento dello stadio esaminando i tipi di cella presenti (Figura 2, Figura S2).
- Una volta che le cellule si sono diffuse per formare un monostrato rotondo da entrambe le estremità del tubulo, immergere lo scivolo in un contenitore contenente azoto liquido tenendolo con le punte. Tienilo sommerso per 10 s. In alternativa posizionare lo scivolo su una piastra di ghiaccio secco per il congelamento.
- Rimuovere il vetro di copertura capovolgendolo usando un bisturi.
- Senza indugio, procedere con la fissazione e posizionare rapidamente lo scivolo in un contenitore con il 90% di etanolo per 2-5 minuti.
NOTA: Assicurarsi che la preparazione della zucca non si scongeli prima di posizionarla al 90% di etanolo. Altri fissivi possono anche essere utilizzati, come l'acetone, per 10 minuti. - Asciugare all'aria e conservare a temperatura ambiente (RT) (fino a qualche giorno) o a -80 °C (a lungo termine).
- Per l'immunostaining, post-fissare i campioni in paraformaldeide al 4% (PFA) per 10 minuti a RT.
- Risciacquare in PBS e permeabilizzare con 0,1% Triton X-100 in PBS per 5 min.
- Risciacquare in PBS e disegnare un anello di grasso attorno a ciascun campione di zucca.
- Aggiungere 50-100 μL di BSA al 10% (albumina di siero bovino) nello 0,1% tween in PBS (PBST) all'interno dell'anello di grasso e bloccare i campioni per 30 minuti a RT.
- Rimuovere la soluzione BSA e incubare con un anticorpo primario diluito in BSA al 10% in PBST per 1 h a RT.
- Lavare 3 volte per 5 minuti con PBST.
- Incubare con un anticorpo secondario diluito nel 10% di BSA in PBST.
NOTA: Per macchiare gli acrosomi, i campioni possono essere incubati con anticorpo di agglutinina di arachidi con etichetta Rhodamina (PNA, 1:1000) nel 10% di BSA in PBST per 1 h a RT (Figura S3) invece di anticorpi primari e secondari specifici. - Lavare 3 volte per 5 minuti ciascuno con PBST, risciacquare con PBS e montare con un montante contenente DAPI.
- Immunosottenimento a montaggio intero dei tubuli seminiferi
NOTA: Il protocollo seguente descrive la colorazione a montaggio intero per i segmenti di tubuli a fasi (dal passaggio 2.4). Se un ricercatore desidera eseguire la colorazione a montaggio intero senza messa in scena (dal passaggio 1.5), prestare attenzione alle note nei punti 3.2.1 e 3.2.7.- Utilizzando una pipetta, trasferire i segmenti di tubuli (dal passo 2.4) in PBS ghiacciato in un tubo conico da 15 mL e consentire loro di sedimentare sul ghiaccio.
NOTA: Se si utilizzano tubuli non stanziati da 1.5., separare i tubuli in una piastra di Petri pipettando più volte su e indietro su una piastra inclinata. Utilizzare una pipetta da 1 mL con una punta di taglio. Questo passaggio ha lo scopo di aprire la struttura del tessuto. Tuttavia, evitare un'troppo pipettazione in quanto potrebbe danneggiare i tubuli. La sedimentazione dei tubuli richiederà alcune decine di secondi. Piccoli frammenti di tubuli, cellule interstiziali e detriti cellulari rimangono nel supernatante. - Rimuovere con cura il supernatante (SN) pipettando o con un aspiratore. Aggiungere 10 mL di PBS ghiacciato e mescolare per inversione.
- Lasciare sedimentare e quindi rimuovere SN come prima.
- Aggiungere 5 mL di PFA al 4% e fissare per 5 ore su un tavolo rotante (20-30 giri/min) a +4 °C.
NOTA: Il tempo di fissazione dipende dalle proteine di interesse e dalla loro localizzazione subcellulare. Per le proteine nucleari e citoplasmatiche, una fissazione di 2 ore è tipicamente sufficiente, tuttavia, marcatori di membrana, come GFRα1 (recettore della famiglia GDNF alfa 1; Figura 6A,B), beneficiare di una fissazione più lunga, fino a 6 ore. - Lasciare sedimentare, rimuovere SN (PFA) come prima e risciacquare brevemente aggiungendo 10 ml di PBS e invertendo il tubo.
- Lasciare sedimentare, rimuovere SN come prima e ripetere la fase di lavaggio PBS tre volte per almeno 10 minuti ciascuno su un tavolo rotante a +4 °C e procedere con la colorazione o conservare a +4 °C.
NOTA: Se le condizioni di lavoro sono sterili e pulite, i campioni possono essere conservati e utilizzati per almeno alcune settimane. In alternativa, aggiungere azide di sodio a una concentrazione finale dello 0,02% (w/v) da una soluzione stock del 2% per aiutare a preservare i tubuli prima della conservazione a +4 °C. - Utilizzando una pipetta da 1 mL, spostare 10-20 segmenti di tubuli fissi su un tubo a fondo tondo da 2 ml. Lasciare sedimentare e rimuovere SN.
NOTA: Se si lavora con lunghi tubuli che non sono stati messi in scena, versare i tubuli su una piastra di Petri e utilizzare forbici a microdissezione e segmenti tagliati a forza di circa 5-20 mm. Segmenti troppo lunghi si aggroviglieranno durante la procedura di colorazione, mentre i segmenti troppo corti vengono facilmente persi. - Aggiungere 1 mL di 2% BSA + 10% FBS (siero bovino fetale) nello 0,3% Tritone X-100 in PBS (PBSX). Bloccare per almeno 1 h su un tavolo rotante (20-30 giri/min) a RT.
- Risciacquare con 1 mL di PBSX, rimuovere LN mediante pipettazione e aggiungere 250 μL di anticorpo primario diluito in 1% di BSA in PBSX (1:100–1:2000 diluizione). Incubare per 2 ore a RT o durante la notte a +4 °C su un tavolo rotante (20-30 giri/min).
- Rimuovere la soluzione anticorpale con pipettando e risciacquare i tubuli con 1 mL di PBSX come sopra. Lavare tre volte per 1 h in PBSX su un tavolo rotante (20-30 giri/min) a RT.
NOTA: Dopo questo primo lavaggio il campione può essere lasciato durante la notte a +4 °C, se necessario. - Rimuovere l'SN e aggiungere 250 μL di anticorpo secondario diluito in 1% di BSA in PBSX (in genere 1:500 diluizione di un anticorpo con etichetta fluorescente). Coprire in lamina e incubare su un tavolo rotante (20-30 giri/min) a RT per 1 h.
- Ripetere il file 3.2.10.
- Infine rimuovere SN e versare i tubuli su uno scivolo al microscopio. Separare delicatamente e disporre i tubuli in strisce lineari utilizzando punte di caricamento in gel. Scolare il buffer in eccesso e aggiungere il supporto di montaggio e un coverslip.
NOTA: Evitare l'asciugatura dei tubuli mentre li si dispone. Nella maggior parte dei casi non è necessaria la contro-colorazione dei nuclei con DAPI. Sigillare il bordo del coperchio con smalto per unghie per evitare l'essiccazione e il deterioramento del campione. Le diapositive possono essere conservate per 1-2 settimane a +4 °C prima dell'imaging.
- Utilizzando una pipetta, trasferire i segmenti di tubuli (dal passo 2.4) in PBS ghiacciato in un tubo conico da 15 mL e consentire loro di sedimentare sul ghiaccio.
Risultati
Una corretta stadiazione assistita dalla trasilluminazione e la microdisezione dei tubuli seminiferi del topo dipendono principalmente dalla ricerca delle condizioni di illuminazione adeguate e di un microscopio a dissezione adeguato, e dalla capacità di riconoscere caratteristiche specifiche che caratterizzano ogni stadio. Gli stadi VII-VIII appaiono omogeneamente scuri perché contengono un elevato numero di spermatidi allungati completamente condensati allineati sulla superficie apicale dell'epitelio (Figura 5A e Figura S1). Dopo che gli spermatozoi maturi vengono rilasciati nel lume nello spermiazione, il tubulo appare molto pallido nelle fasi IX-XI a causa dell'assenza di spermatidi allungati condensati nell'epitelio. La caratteristica più semplice da identificare sui tubuli transilluminati è il punto di spermiazione (asterisco nella figura 5A e nella figura S1), cioè l'improvvisa transizione dalla zona scura (VII-VIII) alla zona pallida (IX-XI). La zona pallida è seguita dalla zona punti debole (XII-I). L'aspetto chiazzato ha origine dall'organizzazione di spermatidi allungati con cromatina condensata in fasci. I fasci diventano molto prominenti nella seguente zona spot forte (II-V). Inoltre, i fasci spermatidi migrano verso i nuclei cellulari sertoli che si trovano vicino alla lamina basale, che si riflette come aspetto a strisce del tubulo stadio II-V quando sono trasilluminati (Figura 2, Figura 5A, B e Figura S1). I fasci infine si disperdono allo stadio VI e gli spermatidi allungati condensatori si muovono vicino al lume per essere rilasciati dall'epitelio allo stadio VIII.
Lo stadio esatto del segmento dei tubuli può essere accuratamente verificato mediante microscopia a contrasto di fase di preparati per zucca(figura 2 e figura S2). Le fasi specifiche dei preparati di zucca sono riconosciute sulla base dello sviluppo acrosomale degli spermatidi rotondi della fase 1-8, dello stato della condensazione della cromatina negli spermatidi allunganti e della presenza di fasci spermatidi16 (figura 3 e figura S2). Inoltre, la presenza di precedenti tipi cellulari, come la spermatogonia di tipo B e gli spermatociti di leptotene o zigotene, che possono essere riconosciuti sulla base delle loro caratteristiche morfologiche, può essere utilizzata per supportare il riconoscimento dello stadio. Le dimensioni dei nuclei di pachytene spermatociti aumentano di dimensioni intorno allo stadio VI, il che può anche fornire ulteriore aiuto nella stadiazione.
I preparati di zucca a fasi possono essere utilizzati per studiare l'espressione e la localizzazione di proteine di interesse nell'epitelio seminifero usando l'immunostaining. Ciò consente un'analisi molto accurata dell'espressione specifica del tipo di cella a causa della composizione cellulare ben definita in ogni fase. L'espressione specifica dello stadio può essere ulteriormente aumentata co-colorazione dell'acrosoma (ad esempio, con PNA) che consente la visualizzazione di passaggi distinti di differenziazione spermatid rotonda. Immagini rappresentative di acrosomi macchiati di PNA in varie fasi sono fornite nella figura S3. La colorazione acrosomica può anche essere utilizzata per definire il palco retrospettivamente. Tuttavia, la stadiazione assistita dalla transilluminazione è un metodo considerevolmente più semplice e veloce per trovare lo stadio desiderato rispetto all'utilizzo di frammenti non ancorastati in modo casuale.
La colorazione a montaggio intero del tubulo seminifero viene tipicamente utilizzata per studiare i tipi di cellule che sono a contatto con la membrana basale dell'epitelio seminifero, sia sul lato tubolare (spermatogonia, spermatociti preleptotene e cellule di Sertoli; Figura 6A,B) o il lato interstiziale (cellule mioidi peritubulari e macrofagi peritubulari; Figura 6C e Figura S4A)24. Tuttavia, il metodo può anche essere utilizzato per studiare cellule o strutture che si trovano più in profondità nell'epitelio, come la barriera ematico-testicolo (Espin, Figura S4B) o le cellule germinali postmeiotiche (PNA marcatore acrosoma, Figura S4C). Se si utilizzano segmenti di tubuli non stampati, è possibile stimare retrospettivamente un dato stadio utilizzando un anticorpo contro una proteina che si esprime in spermatogonia differenziante (A1, A2, A3, A4, In e B;collettivamenteA diff ) (Figura 2). La stadiazione si basa quindi sulladensità di una diff sincreziale che subisce sei divisioni mitotiche in modo dipendente dallo stadio durante il primo ciclo di differenziazione spermatogenica1,raddoppiando così il numero di Adiff spermatogonia in sinctia dopoogni divisione 1,25. Tuttavia, la stadiazione retrospettiva è meno accurata della stadiazione assistita da transilluminazione perché non esistono marcatori specificiper generazioni distinte di diff A e lavalutazione della densità di diff A può essere soggetta a errori.

Figura 1: Mappa del ciclo epiteliale seminifero per la stadiazione della spermatogenesi del topo. Le colonne verticali mostrano associazioni cellulari in diverse fasi del ciclo epiteliale seminifero (contrassegnate con numeri romani I-XII). Le cellule germinali più immature sono in basso, mentre le più differenziate sono in alto. Per seguire i progressi della differenziazione delle cellule germinali, bisogna spostarsi da sinistra a destra e dal basso verso l'alto. Un ciclo dell'epitelio seminifero è una serie completa di stadi che si sus seguono in ordine numerico. Unaspermatogonia indifferenziata e indifferenziata; A1-4, tipo A1-A4 spermatogonia; In, spermatogonia intermedia; B, spermatogonia di tipo B; Pl, spermatociti di preleptotene; L, leptotene spermatociti; Z, zigotene spermatociti; P, pachytene spermatociti; D, spermatociti di diplotene; 2°, spermatociti secondari più divisioni meiotiche. I numeri arabi 1-16 si riferiscono ai passaggi della maturazione spermatido post-meiotica (spermiogenesi). Clicca qui per visualizzare una versione più grande di questa figura.
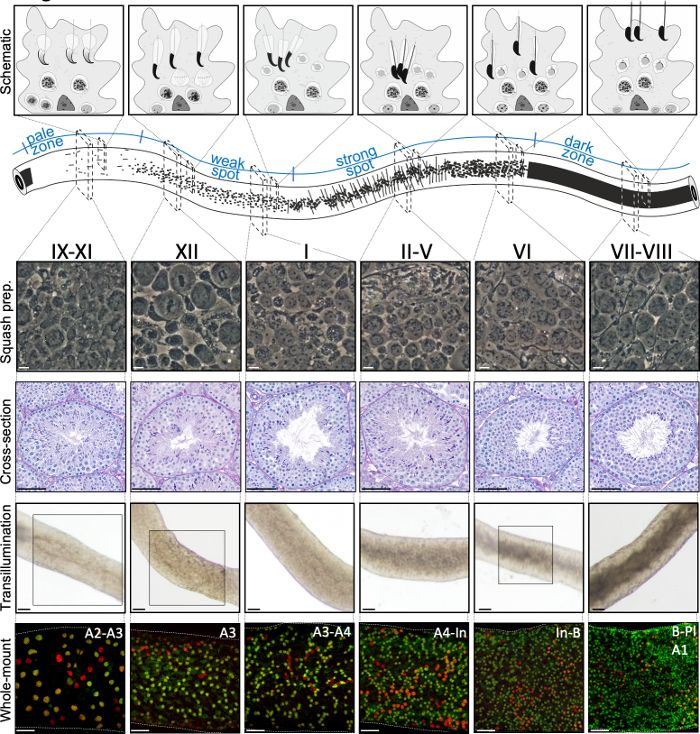
Figura 2: Associazioni cellulari nelle fasi del ciclo epiteliale seminifero del topo. Gli stadi del ciclo epiteliale seminifero si sus seguono in ordine logico, e quindi formano l'onda spermatogenica lungo l'asse longitudinale di un tubulo seminifero. Il pannello superiore illustra le associazioni delle cellule germinali in diversi stadi e la posizione dei tipi di cellule all'interno delle sacche citoplasmatiche delle cellule di Sertoli (grigio chiaro) nell'epitelio seminifero. L'illustrazione del tubulo seminifero visualizza l'onda spermatogenica e specifici modelli di transilluminazione delle zone pallide, deboli, punti forti e scure. Da ogni fase indicata, vengono mostrate immagini rappresentative a contrasto di fase delle cellule viventi di preparati di zucca e sezioni trasversali periodiche macchiate di acido-Schiff (PAS). I due pannelli inferiori mostrano segmenti di tubulo seminifero dopo la trasilluminazione (in alto) o la colorazione con anticorpi (in basso) contro SALL4 (rosso, un marcatore pan-spermatogoniale) e DNMT3A (verde, unmarcatore diff A). I modelli di transilluminazione per gli stadi IX-XI, XII e VI sono evidenziati con aree boxed. Sia il modello di assorbimento della luce (in alto) che la densità della spermatogonia differenziante positiva alla DNMT3A (in basso) possono essere usati per definire lo stadio (approssimativo) del ciclo seminifero. Le generazioni successivedi diff A sono indicate come spermatogonia di tipo A1-A4, intermedio (In) e di tipo B. La divisione di ciascuno si traduce nel raddoppio della densità cellulare spermatogoniale. La più alta densità cellulare sulla membrana basale dell'epitelio seminifero è osservata negli stadi VI-VIII quando si osservano spermatociti di preleptotene meiotico (Pl). Barre di scala: squash preparazione 10 μm, altri 50μm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Fasi della spermiogenesi. Caratteristiche distintive degli spermatidi a diversi passaggi della spermiogenesi. Clicca qui per visualizzare una versione più grande di questa figura.
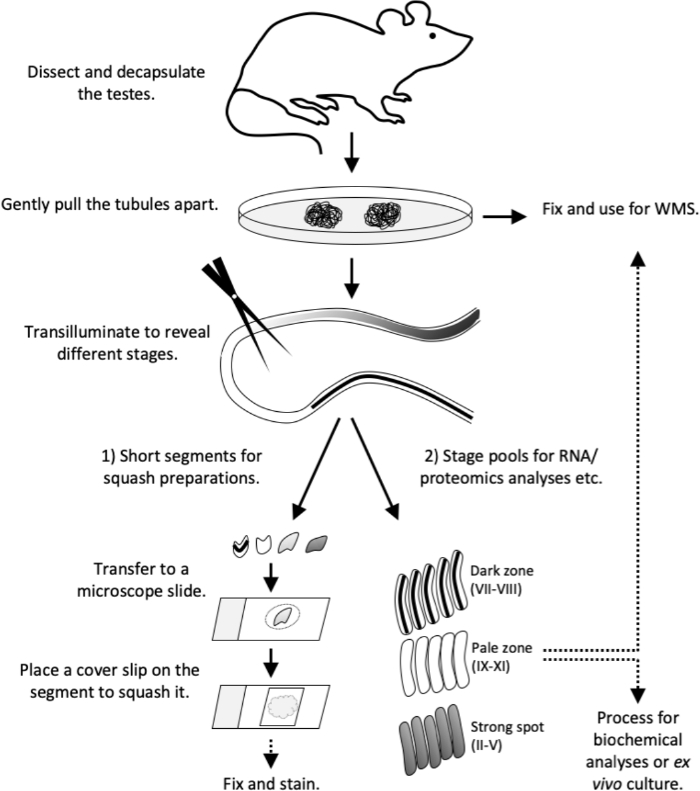
Figura 4: Flusso di lavoro di questo studio. Il modello di transilluminazione è stato completamente stabilito in un topo adulto (>di 8 settimane). Sacrificare il topo e procedere senza indugio con la dissezione e la decapsulazione del testicolo. Smontare delicatamente i tubuli su una piastra di Petri. Fissare i tubuli per le colorazioni a montaggio intero o procedere con la transilluminazione. Sotto la transilluminazione 1) tagliare segmenti di tubuli corti di stadio o di stadio specifico per preparati di zucca (controllo di qualità o per immunostaining) o 2) tagliare segmenti più lunghi per raccogliere pool di stadio per analisi di RNA e proteomica, coltura tissutale o per colorazioni a montaggio intero. Trasferire brevi segmenti di tubuli in uno scivolo al microscopio in un volume di PBS di 10 μL. Posizionare uno slittamento di copertura sul segmento per forzare le celle e formare un monostrato di cellule vive. Osservare i tipi di cellule al microscopio, quindi fissare e macchiare. WMS, colorazione a montaggio intero. Clicca qui per visualizzare una versione più grande di questa figura.
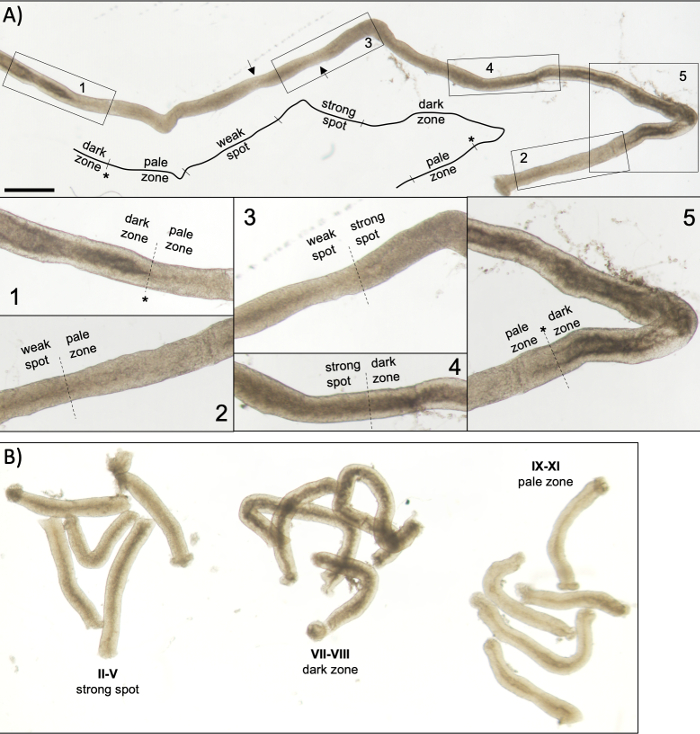
Figura 5: Tubulo seminifero di un topo adulto visto sotto microscopia a trasilluminazione. (A) Un lungo segmento di tubulo seminifero visto sotto transilluminazione che mostra l'onda dell'epitelio seminifero. Quattro zone distinte possono essere identificate in base alla compattazione della cromatina negli spermatidi e alla loro localizzazione all'interno dell'epitelio: zona scura (stadi VII-VIII), zona pallida (stadi IX-XI), zona punti debole (stadi XII-I) e zona spot forte (stadi II-VI). Asterisco, punto di spermiazione. Le frecce indicano due brevi segmenti all'interno della zona punti debole che hanno un aspetto pallido a causa delle sollecitazioni meccaniche sul tubulo. Barra di scala: 500 μm. Gli inserti 1-5 sono ingrandimenti più elevati da segmenti di tubuli selezionati. (B) Segmenti raggruppati di tubuli seminiferi che rappresentano gli stadi II-V (zona spot forte), VII-VIII (zona scura) e IX-XI (zona pallida). Clicca qui per visualizzare una versione più grande di questa figura.
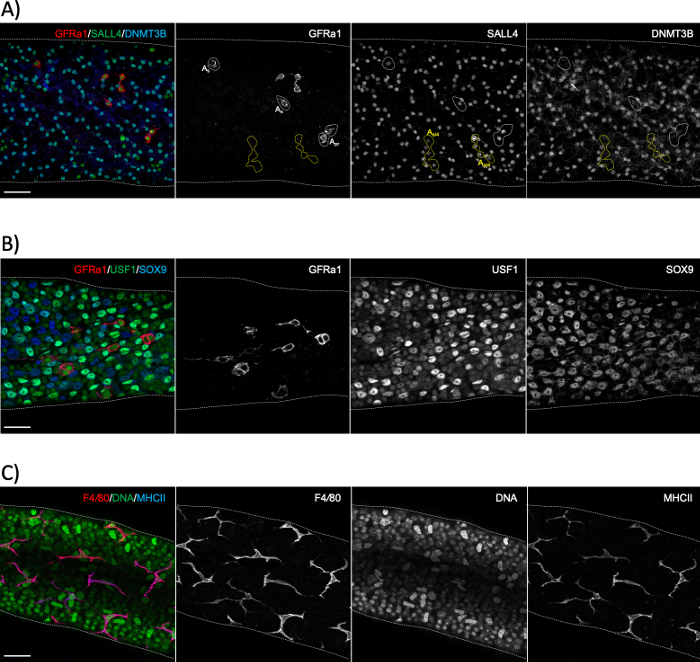
Figura 6: Immunosottenizioni a montaggio intero che utilizzano marcatori di macrofagi spermatogoniali, cellule di Sertoli e peritubulari. (A) Colorazione a montaggio intero per un segmento che rappresenta lo stadio XI-II con anticorpi contro GFRα1 (rosso), SALL4 (verde) e DNMT3B (blu). La colorazione rivela tre distinte popolazioni di spermatogonia: isolata singolarmente (As)o accoppiata (Apr)spermatogonia stelo indifferenziata (GFRα1+/SALL4+/DNMT3B-; aree punteggiate bianche), breve sincreziale (qui 4 cellule allineate; Aal4) spermatogonia progenitrice (GFRα1-/SALL4+/DNMT3B-; aree punteggiate gialle) e spermatogonia differenziante (GFRα1-/SALL4+/DNMT3B+). Le cellule SALL4+/DNMT3B+ sono spermatogonie di tipo A3-A4. (B) Tubulo seminifero a montaggio intero con anticorpi contro GFRα1 (rosso), USF1 (verde) e SOX9 (blu). GFRα1 macchia il sottoinsieme di staminali della spermatogonia. USF1 è espresso sia da spermatogonia che da cellule SOX9+ Sertoli. (C) I macrofagi peritubulari nei topi adulti sono positivi sia per F4/80 (rosso) che per MHCII (blu). DAPI macchia il DNA (verde). Nuclei grandi e luminosi sono nuclei cellulari mioidi peritubari. Barre di scala: 50 μm. Clicca qui per visualizzare una versione più grande di questa figura.
Figura S1: Un lungo segmento di tubulo seminifero visto sotto transilluminazione che mostra l'onda dell'epitelio seminifero. Quattro zone distinte possono essere identificate in base alla compattazione della cromatina negli spermatidi e alla loro localizzazione all'interno dell'epitelio: zona punti debole (stadi XII-I), zona spot forte (stadi II-VI), zona scura (stadi VII-VIII) e zona pallida (stadi IX-XI). Il punto di spermiazione (asterisco) può essere riconosciuto come la zona scura transita bruscamente nella zona pallida. Barra di scala: 500 μm. Gli inserti 1-4 sono ingrandimenti più alti da segmenti di tubuli selezionati. Clicca qui per scaricare questa cifra.
Figura S2: Microscopia a contrasto di fase di monostrati a cellule vive di diversi stadi del ciclo epiteliale seminifero. (A) Fase I. Gli spermatidi rotondi della fase 1 mancano ancora della struttura acrosomica. Sono caratterizzati da un piccolo nucleo rotondo (cerchi rossi) con un caratteristico singolo cromocentro (frecce bianche). Il corpo cromatoide è visibile nel citoplasma come granulo scuro a stretto contatto con la membrana nucleare (frecce blu). Il nucleo cellulare di Sertoli (cerchio bianco) contiene tre fuochi scuri: un grande nucleolo con due cromocentri satellitari. Le cellule di Sertoli non sono spesso viste nei preparati di zucca, ma occasionalmente scorrono fuori dal tubulo insieme alle cellule germinali. (B) Fase II-IV. Nel passaggio 4 spermatidi rotondi (cerchi rossi), la struttura acrosomica (frecce rosse) appare come una vescicola bianca leggermente appiattita attaccata all'involucro nucleare. Gli spermatidi allunganti formano fasci e hanno già uno spesso flagello (frecce bianche) che indica la presenza di una lucentezza mitocondriale nel pezzo centrale della coda dello sperma. I nuclei degli spermatociti pachytene (PSpc) sono circa il doppio di quelli degli spermatidi rotondi e sono caratterizzati da regioni di cromatina scura distribuite in tutto il nucleo. (C) Fase V-VI. Nel passaggio 5-6 spermatidi rotondi (cerchio rosso), l'acrosoma viene ulteriormente appiattito e si diffonde sul nucleo (frecce rosse). L'area dell'involucro nucleare di fronte all'acrosoma appare scura a causa della presenza dell'acroplaxoma, una piastra ricca di proteine tra la membrana acrosomica e la membrana nucleare. Gli spermatidi allunganti vengono rilasciati dai fasci (frecce bianche). Gli spermatociti pachytene (PSpc) sono frequentemente osservati nell'epitelio. (D)Fase VII-VIII. L'acrosoma (frecce rosse), un rivestimento scuro sull'involucro nucleare con ombre bianche, è completamente esteso e copre quasi l'intero lato apicale degli spermatidi rotondi del passo 7-8 (cerchi rossi). Questo stadio è caratterizzato da spermatidi maturi (frecce bianche) che possono essere abbondanti su molte parti della preparazione dello zucca. Il nucleo degli spermatociti pachytene (PSpc) cresce di dimensioni durante lo sviluppo e appare più grande nello stadio VII-VIII rispetto alle fasi precedenti. Le aree di cromatina scura all'interno del nucleo di spermatociti pachytene (PSpc) appaiono sfocate a causa dell'elevata attività trascrizionale e degli eventi meiotici. (E) Stadio X. I nuclei spermatidi step 10 (frecce bianche) hanno iniziato l'allungamento, ma la cromatina non si è ancora condensata. Gli acrosomi iniziano a formare un gancio sulla punta nucleare (freccia rossa). I nuclei degli spermatociti pachytene (PSpc) appaiono molto grandi mentre si preparano per le divisioni meiotiche. (F) Fase XII. Lo stadio XII è caratterizzato dalla presenza di placche meiotiche di metafase (cerchi tratteggiati bianchi). Piccole cellule rotonde con tipico modello di cromatina condensata sono gli spermatociti di zigotene (ZSpc), in cui i cromosomi sorelle si allineano per iniziare la formazione complessa sinaptonemica. Barre di scala: 10 μm. Clicca qui per scaricare questa cifra.
Figura S3: Identificazione dello stadio del ciclo epiteliale seminifero sulla base della colorazione acrosomica e nucleare. I preparati di zucca fissati con acetone erano macchiati con PNA coniugato con rhodamina e DAPI. Fase I: Sebbene non esista acrosoma negli spermatidi rotondi del passaggio 1, un acrosoma completamente sviluppato può essere rilevato negli spermatidi allunganti. Fasi II-IV: Lo sviluppo acrosomale inizia con la comparsa di granuli proacrosomali/acrosomali negli spermatidi rotondi. La vescicola acrosomica sulla superficie nucleare appare rotonda fino al passaggio 3 spermatidi, quindi appiattisce nel passaggio 4 spermatidi. Stadio V: L'angolo sottato dall'acrosoma si estende da 40 gradi ad un massimo di 95°. Stadi VI-VII: L'angolo sottato dall'acrosoma si estende da 95 gradi a 120 gradi. Stadi VIII-IX: L'acrosoma è completamente esteso nel passaggio 8 spermatidi (stadio VIII), e i nuclei si polarizzano sul lato apicale della cellula facendo contatto con la membrana plasmatica (non mostrato). Allo stadio IX il nucleo spermatidi si deforma; superfici dorsali e ventrali sono viste per la prima volta. Stadi X-XI: Gli spermatidi mostrano l'angolo dorsale. Fase XII: Questa fase è meglio caratterizzata dalla comparsa di divisioni meiotiche; le placche di metafase sono indicate con frecce bianche. Si vedono anche spermatidi allunganti con i loro acrosomi. Barre di scala: 10μm. Clicca qui per scaricare questa cifra.
Figura S4: Colorazione a montaggio intero per marcatori non convenzionali. (A) L'actina muscolare liscia alfa (aSMA) è espressa dalle cellule mioidi peritubulari. (B) Espin si localizza nelle giunzioni strette delle cellule sertoli e contribuisce alla barriera ematico-testicolo. (C) La PNA si localizza in acrosomi di spermatidi. Barre di scala: 50μm. Clicca qui per scaricare questa cifra.
Video supplementare 1: Taglio di un breve segmento di tubulo seminifero che rappresenta lo stadio VII-VIII. Clicca qui per scaricare questo video.
Discussione
Il metodo di microdisezione assistita da transilluminazione che abbiamo descritto sopra consente un approccio orientato allo stadio per lo studio della spermatogenesi. La spermatogenesi è un processo altamente sincronizzato, e tutti i passaggi chiave durante la differenziazione spermatogenica sono regolati ed eseguiti in modo dipendente dallo stadio, come l'impegno di differenziazione (nelle fasi VII-VIII), l'insorgenza della meiosi (VII-VIII), le divisioni meiotiche (XII), l'insorgenza dell'allungamento spermatido (VIII) e lo spermiazione (VIII)1,26,27. L'analisi orientata allo stadio fornisce un potente strumento per studiare questi particolari eventi che sono limitati a specifici passaggi di spermatogenesi e quindi trovati solo in fasi definite del ciclo epiteliale seminifero. Padroneggiare il metodo richiede un po 'di pratica e l'uso di un microscopio a dissezione di buona qualità e condizioni illuminanti adeguate sono fondamentali per il successo. L'implementazione di questo metodo come parte del toolkit quotidiano ha la capacità di migliorare notevolmente l'impatto e la rilevanza biologica della ricerca sulle funzioni riproduttive maschili consentendo una dissezione più accurata degli eventi molecolari durante la spermatogenesi.
Tutti i ceppi di topo WT che abbiamo studiato mostrano un modello di transilluminazione simile e mostrano associazioni cellulari conservate nelle fasi del ciclo epiteliale seminifero. A condizione che la differenziazione spermiogenica delle cellule germinali non sia grossolanamente diversa dai topi WT, lo stesso vale anche per tutti i modelli di topo knock-out che abbiamo studiato. Inoltre, può essere applicato ad altre specie che presentano una disposizione segmentale longitudinale degli stadi del ciclo epiteliale seminifero7. Tuttavia, le specie con stadi non segmentali (come l'umano) non possono essere utilizzate. Dato il ruolo essenziale della condensazione della cromatina negli spermatidi allunganti nella definizione del modello di transilluminazione, è chiaro che qualsiasi fraintendimento di questo processo inevitabilmente intaccherà l'implementazione di questo metodo. Nei topi giovani e nei giovani adulti (5-6 settimane) il modello di transilluminazione non è ancora stato pienamente stabilito e, pertanto, devono essere utilizzati solo topi di età superiore a 8 settimane. È anche importante tenere presente che spremere e tirare i tubuli inevitabilmente impatta sul modello di transilluminazione perché distorce l'architettura cellulare all'interno dell'epitelio seminifero.
I segmenti isolati di tubuli seminiferi possono anche essere coltivati consentendo l'osservazione ex vivo e la manipolazione di processi accoppiati alla spermatogenesi, compresa la meiosi. Per garantire la vitalità del tessuto e prevenire la degradazione dell'RNA e delle proteine, i campioni devono essere raccolti e lavorati non più di 2 ore dopo aver sacrificato il topo. Per la cultura ex vivo dei tubuli seminiferi, il tempo dal sacrificio all'inizio della cultura non dovrebbe superare 1 ora. L'integrità dei frammenti di tubuli può in genere essere mantenuta fino a 72 ore in vitro se raccolta correttamente.
Lo stadio del ciclo epiteliale seminifero può essere verificato e definito in modo ancora più accurato utilizzando la microscopia a contrasto di fase dei preparati di zucca16. La microscopia viene eseguita su cellule viventi, che fornisce una dimensione aggiuntiva nell'analisi e consente l'osservazione dei movimenti di organelli o cellule in fasi specifiche della spermatogenesi28,29,30. La microscopia a contrasto di fase fornisce una stadiazione esatta per la successiva immunostaining, che consente un'analisi molto dettagliata dell'espressione proteica e delle dinamiche di localizzazione durante la spermatogenesi, compresi i cambiamenti specifici dello stadio.
Mentre le cellule vengono rilasciate dal contesto epiteliale nei preparati di zucca, le immunosottenizioni a montaggio intero dei segmenti di tubuli consentono lo studio delle cellule spermatogeniche nel loro ambiente fisiologico. Pertanto, i preparati a montaggio intero possono fornire una migliore visualizzazione dell'architettura dei tubuli seminiferi e dei suoi contatti intercellulari rispetto all'immunostaining sulle sezioni trasversali. È importante sottolineare che la stadiazione assistita dalla transilluminazione dei segmenti di tubuli prima dell'immunosomozione rende l'approccio ancora più potente includendo informazioni sullo stadio specifico di un dato segmento. La colorazione a montaggio intero è uno strumento particolarmente utile per lo studio delle cellule alla periferia dei tubuli seminiferi, come le cellule mioidi peritubulari, i macrofagi peritubulari e la spermatogonia, ma potrebbe anche aprire nuove intuizioni sulla ricerca sulle cellule germinali meiotiche e postmeiotiche.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro fu supportato da sovvenzioni dell'Accademia di Finlandia [315948, 314387 a N.K.]; Fondazione Sigrid Jusélius [a N.K., J.T.]; Fondazione Emil Aaltonen [a J.-A.M., T.L.]; Programma di dottorato turco di medicina molecolare [S.C.-M., O.O.].
Materiali
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Sigma | A9647 | |
| cover glass 20x20 mm | Menzel Gläser | 11961988 | |
| Falcon conical tube 15-ml | Sarstedt | 62.554.502 | |
| fetal bovine serum (FBS) | Biowest | S1810 | |
| grease pen (ImmEdge) | Vector Laboratories | H-4000 | |
| microscope slide Superfrost Plus | Thermo Scientific | 22-037-246 | |
| Parafolmaldehyde (PFA) | Electron Microscopy Sciences | 15714 | |
| Petri dish (100-mm) | Greiner | 664160 | |
| phosphate-buffered saline (PBS) | Gibco | 11503387 | |
| ProLong Diamond Antifade Mountant | Thermo Fisher | P36962 | |
| rhodamine-labelled Peanut agglutinin (PNA) | Vector Laboratories | RL-1072 | |
| Triton X-100 | Sigma | 93443 | |
| Tween-20 | Sigma | P2287 |
Riferimenti
- Mäkelä, J. A., Toppari, J. Testis Physiology: Seminiferous Cycle. Encyclopedia of Reproduction. , (2018).
- Oakberg, E. F. Duration of spermatogenesis in the mouse and timing of stages of the cycle of the seminiferous epithelium. The American Journal of Anatomy. 99 (3), 507-516 (1956).
- Clermont, Y. Kinetics of spermatogenesis in mammals: seminiferous epithelium cycle and spermatogonial renewal. Physiological Reviews. 52 (1), 198-236 (1972).
- Perey, B., Clermont, Y., Leblond, C. The wave of the seminiferous epithelium in the rat. American Journal of Anatomy. 108 (1), 47-77 (1961).
- de Lima e Martins Lara, N., Costa, G., Avelar, G., Lacerda, S., Hess, R., França, L. Testis Physiology-Overview and Histology. Encyclopedia of Reproduction. , (2018).
- Leblond, C. P., Clermont, Y. Definition of the stages of the cycle of the seminiferous epithelium in the rat. Annals of the New York Academy of Sciences. 55 (4), 548-573 (1952).
- Parvinen, M. Regulation of the seminiferous epithelium. Endocrine Reviews. 3 (4), 404-417 (1982).
- Kotaja, N., et al. Preparation, isolation and characterization of stage-specific spermatogenic cells for cellular and molecular analysis. Nature Methods. 1 (3), 249-254 (2004).
- Nakata, H., Sonomura, T., Iseki, S. Three-dimensional analysis of seminiferous tubules and spermatogenic waves in mice. Reproduction. 154 (5), 569-579 (2017).
- Russell, L. D., Ettlin, R. A., SinhaHikim, A. P., Clegg, E. D. . Histological and histopathological evaluation of the testis. , (1990).
- Parvinen, M., Hecht, N. B. Identification of living spermatogenic cells of the mouse by transillumination-phase contrast microscopic technique for "in situ" analyses of DNA polymerase activities. Histochemistry. 71 (4), 567-579 (1981).
- Ventelä, S., Mäkelä, J. A., Kulmala, J., Westermarck, J., Toppari, J. Identification and regulation of a stage-specific stem cell niche enriched by Nanog-positive spermatogonial stem cells in the mouse testis. Stem Cells. 30 (5), 1008-1020 (2012).
- Faisal, I., et al. Transcription factor USF1 is required for maintenance of germline stem cells in male mice. Endocrinology. 160 (5), 1119-1136 (2019).
- Wright, W. W., et al. Identification of stage-specific proteins synthesized by rat seminiferous tubules. Biology of Reproduction. 29 (1), 257-270 (1983).
- Johnston, D. S., et al. Stage-specific gene expression is a fundamental characteristic of rat spermatogenic cells and Sertoli cells. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8315-8320 (2008).
- Toppari, J., Bishop, P. C., Parker, J. W., diZerega, G. S. DNA flow cytometric analysis of mouse seminiferous epithelium. Cytometry. 9 (5), 456-462 (1988).
- Mäkelä, J. A., et al. Hedgehog signalling promotes germ cell survival in the rat testis. Reproduction. 142 (5), 711-721 (2011).
- La, H. M., et al. Identification of dynamic undifferentiated cell states within the male germline. Nature Communications. 9 (1), 04827 (2018).
- Toppari, J., Parvinen, M. In vitro differentiation of rat seminiferous tubular segments from defined stages of the epithelial cycle morphologic and immunolocalization analysis. Journal of Andrology. 6 (6), 334-343 (1985).
- Parvinen, M., Vanha-Perttula, T. Identification and enzyme quantitation of the stages of the seminiferous epithelial wave in the rat. The Anatomical Record. 174 (4), 435-449 (1972).
- Kluin, P. M., Kramer, M. F., de Rooij, D. G. Spermatogenesis in the immature mouse proceeds faster than in the adult. International Journal of Andrology. 5 (3), 282-294 (1982).
- Yoshida, S., et al. The first round of mouse spermatogenesis is a distinctive program that lacks the self-renewing spermatogonia stage. Development. 133 (8), 1495-1505 (2006).
- Chan, A. L., et al. Germline stem cell activity is sustained by SALL4-dependent silencing of distinct tumor suppressor genes. Stem Cell Reports. 9 (3), 956-971 (2017).
- Lokka, E., et al. Generation, localization and functions of macrophages during the development of testis. Nat Commun. 11 (1), 4375 (2020).
- Mäkelä, J. A., Toppari, J. Testis physiology: Spermatogenic cell syncytium. Encyclopedia of Reproduction. , (2018).
- Griswold, M. D. Spermatogenesis: The commitment to meiosis. Physiological Reviews. 96 (1), 1-17 (2016).
- Mäkelä, J. A., Toppari, J. Spermatogenesis. Endocrinology of the Testis and Male Reproduction. , 1-39 (2017).
- Ventela, S., Toppari, J., Parvinen, M. Intercellular organelle traffic through cytoplasmic bridges in early spermatids of the rat: mechanisms of haploid gene product sharing. Molecular Biology of the Cell. 14 (7), 2768-2780 (2003).
- Parvinen, M., Parvinen, L. M. Active movements of the chromatoid body. A possible transport mechanism for haploid gene products. The Journal of Cell Biology. 80 (3), 621-628 (1979).
- Parvinen, M., Söderström, K. O. Chromosome rotation and formation of synapsis. Nature. 260 (5551), 534-535 (1976).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon