Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Nitrik Oksit ve Türevlerinin Otoksidasyon ve Nitroslu Bileşiklerden Tespiti için Kemilüminesans Bazlı Testler
Bu Makalede
Özet
Burada, nitrik oksit ve biyolojik olarak ilgili türevlerini, yüksek hassasiyete sahip kemilüminesans bazlı testler kullanarak tespit etmek için protokoller sunuyoruz.
Özet
İn vivo nitrik oksit (NO) aktivitesi, doğrudan etkilerinin, NO otoksidasyonundan üretilen türevlerinin etkisinin ve nitroslu bileşiklerin etkilerinin birleşik sonuçlarıdır. NO metabolitlerinin ölçülmesi, hem vasküler seviyelerde hem de diğer dokularda, özellikle de eksojen NO'nun uygulandığı deneysel ortamlarda NO aktivitesini incelemek için gereklidir. Ozon bazlı kemilüminesans testleri, hem sıvılarda (plazma, doku homojenatları, hücre kültürleri dahil) hem de gaz karışımlarında (örneğin, ekshale edilen nefes) NO ve NO metabolitlerinin hassas ölçümlerine izin verir. NO, uyarılmış bir durumda azot dioksit üretmek için ozon ile reaksiyona girer. Sonuçta ortaya çıkan ışık emisyonu, fotoalgılamaya ve numunenin NO içeriğini yansıtan bir elektrik sinyalinin üretilmesine izin verir. Aynı numuneden elde edilen alikotlar, nitrat, nitrit, S-nitrosotioller ve demir-nitrosil kompleksleri gibi spesifik NO metabolitlerini ölçmek için kullanılabilir. Ek olarak, hücresiz hemoglobin tarafından tüketilen NO, kemilüminesans analizi ile de ölçülür. Tüm bu tekniklerin bir örneği verilmiştir.
Giriş
Salvador Moncada ve Nobel ödüllü Robert Furchgott, Louis Ignarro ve Ferid Murad, nitrik oksidi (NO) daha önce bilinen endotel kaynaklı gevşeme faktörü (EDRF) olarak tanımladıklarından beri, NO'nun merkezi rolü vasküler biyoloji, nörobilimler, metabolizma ve konakçı yanıtı boyunca uzanan birkaç anahtar mekanizmada kurulmuştur 1,2,3,4,5,6,7 . NO gazının eksojen olarak uygulanması, yenidoğanda pulmoner hipertansiyona bağlı solunum yetmezliği için yerleşik bir tedavi haline gelmiştir8. Nitrik oksit gazı ayrıca solunum sinsityal virüs (RSV) enfeksiyonu, sıtma ve diğer enfektif hastalıkların, iskemi-reperfüzyon hasarının tedavisinde ve kalp cerrahisi geçiren hastalarda akut böbrek hasarının önlenmesinde araştırılmıştır 9,10,11,12. NO'nun seviyelerini, metabolitlerini ve hedef protein ve bileşiklerinin seviyelerini değerlendirmek için hassas ölçüm tekniklerine duyulan ihtiyaç, hem mekanik hem de girişimsel çalışmalardan kaynaklanmaktadır.
Yüksek reaktivitesi nedeniyle, NO, üretildiği ve / veya salındığı biyolojik matrise bağlı olarak farklı reaksiyonlara maruz kalabilir. Hemoglobin (Hb) veya diğer oksi-hemoproteinlerin yokluğunda, NO neredeyse tamamen nitrite (NO2-) oksitlenir.
2NO + O 2 → 2NO2
NO 2 + NO → N2O3
N 2 O3 + H 2 O →NO2- + H+
NO, azot dioksit(NO 2) üretmek için önce moleküler oksijen (O2) ile otoksidasyona tabi tutulur ve diazot trioksit (N 2O3) üretmek için NO2'ninkendisi ile reaksiyona girer. N2O3'ün bir molekülü, iki NO 2- molekülü ve bir proton (H +) 13 oluşturmak için su (H2O) ile reaksiyona girer. Tam kan14,15 içinde, NO ve NO 2- hızla nitrata (NO 3-) dönüştürülür, çünkü bu moleküller Hb'nin oksitlenmiş heme grupları [Hb-Fe2 + -O 2 veya oksihemoglobin (oksiHb)] ile NO3- vermek için hevesle reaksiyona girer. Bu reaksiyon, heme grubunun ferrik duruma [Hb-Fe3+ veya methemoglobin (metHb)] geçişi ile birleştirilir:
Hb-Fe2+-O2 + NO → Hb-Fe3+ NO3-
Kırmızı kan hücresi (RBC) bariyeri ve endotelin hemen bitişiğindeki boşluk, bu reaksiyonu sınırlayan ve endotel tarafından salınan NO'nun küçük bir kısmının EDRF16,17 olarak hareket etmesine izin veren ana faktörlerdir. Aslında, dolaşımdaki hücresiz Hb'nin deneysel ve klinik ortamlarda vazodilatasyonu bozduğu bilinmektedir17,18. RBC içinde, oksijenasyona ve NO 2- konsantrasyonuna bağlı olarak, NO'nun bir kısmı demir-nitrosil Hb (Hb-Fe 2 +-NO veya HbNO) oluşturmak için deoksihemoglobin (Hb-Fe 2 +) ile reaksiyona girer:
Hb-Fe2 + + NO → Hb-Fe2+-NO
RBC15,17'de, NO 2- Hb-Fe 2+'yı azaltarak Hb-Fe 2+'yı oluşturabilir ve bu da NO'nun salınımına yol açar ve bu da Hb-Fe2+-O2 (tercihen) veya Hb-Fe 2+'yı bağlar.
NO-türevlerinin üretimi kesinlikle tek yönlü olarak kabul edilmemelidir, çünkü NO, çeşitli dokularda ve farklı enzimlerde (örneğin, bağırsak bakterileri veya mitokondri içinde, özellikle hipoksik koşullar altında) NO-2- ve NO 3'ten rejenere edilebilir19,20.
Üretilen (veya uygulanan) değişken miktarda NO, esas olarak bir NO+ donör ara maddesi (Nuc-NO+-NO 2-) oluşturan bir nükleofil varlığındaN2O3'ten tiol transnitrozasyonu ile S-nitrosothiollerin aşağı akış üretimine yol açar:
N 2 O3 + RS- → RS-NO + NO2-
S-nitrosothiols üretimi için bir başka olasılık, oksitlenmiş tiollerin nitrosilasyonudur (oksitlenmiş bir tiol ile reaksiyona giren NO):
RS• + NO → RS-NO
Bu mekanizma ve NO2 ile doğrudan tiol oksidasyonu, yalnızca başka bir yerde21'de açıklanan çok özel koşullarda mümkün olabilir. S-nitrosothioller, S-nitrosoglutathione gibi hafif moleküllerden büyük tiol içeren proteinlere kadar uzanır. S-nitrosohemoglobin (S-NO-Hb), β zincirinde (β93C)22 korunmuş bir sistein kalıntısının bir tiol grubunun nitrozasyonu ile oluşur.
S-nitrosothiollerin üretimi ve metabolizması önemli düzenleyici mekanizmaların bir parçasıdır. Örnekler arasında glutatyon, kaspazlar, N-metil-D-Aspartat (NMDA) ve ryanodin reseptörlerinin23,24,25,26,27,28 regülasyonu sayılabilir. Daha önce in vivo olarak NO biyolojisinin önemli bir aracısı olarak kabul edilen nitrosated albümin (S-nitroso-albumin), herhangi bir spesifik ek biyolojik aktivite içermeyen bir NO / NO + taşıyıcısı gibi görünmektedir29.
NO konsantrasyonunu ve türevlerini biyolojik bir matris içindeki belirli bir biyolojik numuneden ölçerken, asitlik, oksijenasyon, sıcaklık ve reaktiflerin varlığı gibi özellikleri dikkate almak önemlidir. Örnekler arasında uygulanan eksojen NO donörleri ve akut inflamasyon durumunda, NO2ile reaksiyona giren hidrojen peroksit (H2 O2), peroksinitrit (ONOO-)21 gibi serbest radikallerin olağanüstü konsantrasyonunun oluşmasına yol açar. Kullanılan analitik yönteme ek olarak, numune hazırlama ve depolamanın analitik öncesi aşaması da esastır. İn vivo NO aktivitesini temsil etmeyen aşağı akış reaksiyonları tahmin edilmeli, dikkate alınmalı ve bloke edilmelidir. Geçerli bir örnek, ölçüm22 için hedeflendiğinde kan örneklerinin özel bir tedavisini gerektiren S-NO-Hb'nin dengesizliğidir.
Kemilüminesans bazlı testler, doku homojenatları30,31 dahil olmak üzere herhangi bir biyolojik sıvıdaki NO ve ana metabolitlerinin [NO2-, NO3-, S-NO ve demir-nitrosil kompleksleri (Fe-NO)] seviyelerini tespit etmek için altın standarttır. Bu yöntemler, NO'nun ozon (O3) ile reaksiyonunu barındıran ve uyarılmış bir durumda (NO2 •) NO2 üreten bir cihaz olan kemilüminesans dedektörüne (CLD) dayanır. NO2• gevşemesi, bir fotoçarpan tüpü tarafından algılanan bir ışık fotonunun emisyonuna neden olur ve örneklenen gaz karışımının NO içeriği ile doğru orantılı bir elektrik sinyali üretir32. CLD'nin basitleştirilmiş bir şeması temsil edilir.

Şekil 1: Nitrik oksit gazı için bir kemilüminesans dedektörünün basitleştirilmiş şeması. Nitrik oksidin (NO) kemilüminesans temelli tespiti, kemilüminesans dedektöründe (CLD) tanıtılan NO gaz molekülü başına bir fotonun stokiyometrik üretimidir. Kemilüminesans reaksiyonu, harici bir pompa ile bağlanarak negatif basınçta tutulan ve numune gazının sürekli ve sabit girişine izin veren dahili bir jeneratörden ozon (O3) ile beslenen belirlenmiş bir odada elde edilir. O3 üretimi, CLD ile bağlantılı özel bir O2 tankı tarafından sağlanan diyatomik oksijen (O2) gerektirir (diğer üreticiler ortam havasıyla çalışan CLD'ler sağlar). Reaksiyon odasında, örneklenen gazda bulunan her bir NO gazı molekülü, aktif durumda (NO2*) bir azot dioksit molekülü üretmek için oksijenle reaksiyona girer. Zemin durumuna geri dönerek, her NO2 * molekülü, reaksiyon odasına bitişik bulunan bir fotoçarpan tüpü (PMT) tarafından tespit edilen bir foton yayar. İlgili amplifikatör ve merkezi işlem ünitesi ile PMT, foton sayısı ve reaksiyon odasındaki NO moleküllerinin sayısı ile orantılı bir sinyal üretir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
CLD'nin numune girişi, sıvı numuneler için bir reaksiyon odası içeren bir cam eşya sistemine bağlanabilir. Sistem azot, helyum veya argon gibi inert bir gazla sürekli olarak temizlenir ve NO'yu reaksiyon odasından CLD'ye aktarır.
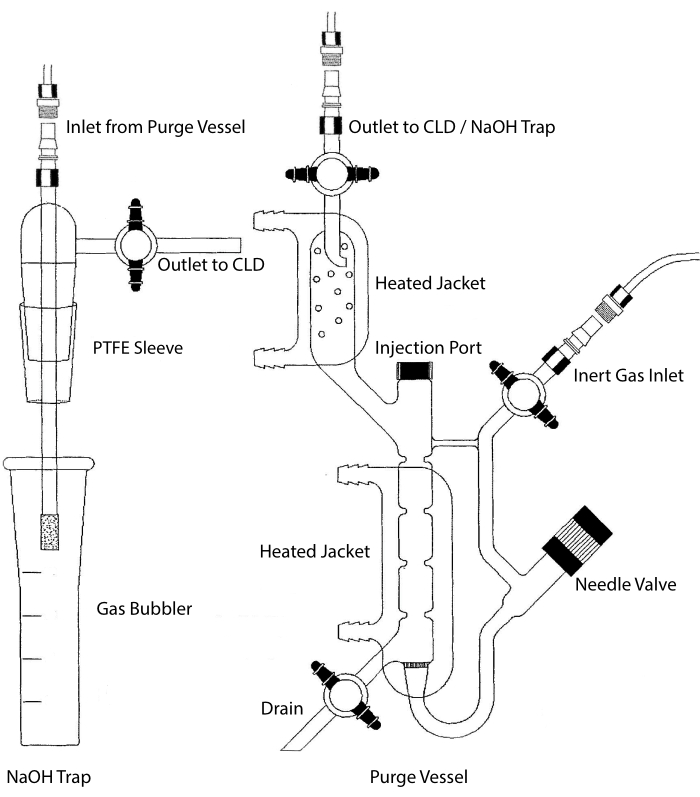
Şekil 2: Nitrik oksit gazının kemilüminesans bazlı tespiti için bir tahliye kabının yapısı Temizleme kabı (sağda), nitrik oksit (NO) gazının veya bir sıvı faz reaktifinden salındığında kolayca NO gazına dönüştürülebilen başka bir bileşiğin algılanmasına izin verir. İnert gaz girişi, Argon, Xeon veya diyatomik azot (N2) gibi inert bir gazın kaynağına (tankına) bağlanır. İğne valfi (sola açılır) boşaltma kabı içindeki basınç kontrolü için kullanılır ve kabı temizlemek için tamamen çıkarılabilir. Enjeksiyon portu, numune enjeksiyonu için membran septumlu bir kapakla kaplanmıştır. Membran sık sık değiştirilmelidir. Isıtmalı bir ceket reaksiyon odasını çevreler ve HCl testinde VCl3'ü gerçekleştirmek için bir sıcak su banyosuna bağlanır. Temizleme kabı çıkışı, kemilüminesans dedektörüne (CLD) veya NaOH tuzağına (HCl tahlillerinde VCl3 için gereklidir) bağlanır. Reaksiyon odası içeriğini boşaltmak için, önce inert gaz girişindeki ve boşaltma kabı çıkışındaki stopcock'ları kapatın, iğne valfini kapatın, enjeksiyon portundaki kapağı çıkarın ve son olarak tahliyede stopcock'u açın. HCl'nin aşındırıcılığı nedeniyle HCl tahlilindeki VCl3 gerçekleştirilirse, NaOH tuzağının (solda) temizleme kabı ile CLD arasına satır içi olarak yerleştirilmesi gerekir. CLD'ye bağlantı her zaman CLD ile boşaltma kabının çıkışı (veya kullanılıyorsa NaOH tuzağı) arasına yerleştirilecek yoğun alan dielektrik (IFD) filtresini gerektirir. IFD filtresi havadaki partikülleri uzaklaştırır ve sıvının tahliye kabından geçmesini durdurur. PTFE = politetrafloroetilen. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuç olarak, spesifik ve kontrollü bir kimyasal reaksiyon yoluyla NO'ya dönüştürülebilen herhangi bir bileşik, herhangi bir biyolojik sıvı ve doku homojenatında yüksek hassasiyetle tespit edilebilir24. Kemilüminesans yoluyla gaz fazı NO'nun doğrudan ölçümü hem deneysel hem de klinik ortamlarda gerçekleştirilir. Bu teknikler başka yerlerde kapsamlı bir şekilde tanımlanmıştır33,34,35. NO2-, S-nitrosothiols, S-nitrosated proteinler ve Fe-NO'ların ölçümü, tüm bu bileşiklerden stokiyometrik olarak NO gazını serbest bırakan triiyodür (I3-) ile bir reaksiyon karışımında numuneler eklenerek gerçekleştirilebilir:
I3- → I2 + I-
2NO 2− +2I− +4H+ → 2NO + I 2 +2H 2 O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
Ben3- NO 3-15 ile reaksiyona girmezken. Her bileşiğin hassas ölçümleri, numune alikotlarının merkürik klorürlü veya merkürik klorürsüz (HgCl2) asitlenmiş sülfanilamid (AS) ile ön işlemden geçirilmesiyle mümkün olur. Özellikle, AS ile ön işlem tüm NO2- içeriğini kaldırır. Sonuç olarak, CLD tarafından ölçülen NO içeriği yalnızca S-NO'ların ve Fe-NO'ların konsantrasyonunun toplamını yansıtır. AS enjeksiyonundan önce bir numune aliquot'a HgCl2'nin enjekte edilmesi, NO2- nin S-NO tarafından salınmasına neden olur. AS ile tedavi (NO2- çıkarılmasına yol açar), ölçülen NO içeriğinin sadece Fe-NO'ların konsantrasyonunu yansıtmasını sağlar. Değerlendirmeler arasındaki bir dizi çıkarma, üç NO türevinin kesin konsantrasyonunu hesaplamaya izin verir22.

Şekil 3: Asetik asit kemilüminesans testinde I3- için numune hazırlama adımları. Asetik asit kemilüminesans testinde I3- hazırlanması için sıralı adımlar gösterilmiştir. Işık korumalı santrifüj tüplerinin kullanılması gereklidir. Tüp 1, 2 ve 3, tahlili hazırlamak için kullanılanlardır. Nitrat (NO3-) ölçümü gerekiyorsa, HCl testinde VCl3 için başka bir örnek aliquot (tüp 4) gereklidir. Adımlar kırmızı renkli sayılarla gösterilir. Numune hacmini eklemeden önce fosfat tampon salin (PBS) veya HgCl2 ile belirtildiği gibi önceden doldurma (Adım 1). Numune hacmini (2) belirtildiği gibi ekleyin, girdap yapın ve oda sıcaklığında (RT) 2 dakika kuluçkaya yatırın. (3) PBS veya asitlenmiş sülfanilamid (AS) belirtildiği gibi, vorteks ekleyin ve RT'de 3 dakika boyunca inkübe edin. Tahlil ile ölçülen konsantrasyon, her tüp altında bildirilen bileşiklerin konsantrasyonunun toplamıdır. 1 numaralı tüp, nitrit (NO2-), S-nitrosothiols (S-NO) ve demir-nitrosil komplekslerinin (Fe-NO'lar) tek bir sinyal olarak ölçülmesine izin verecektir. Nitrat (NO 3-) ölçümü için, numuneler hem asetik asitte I 3- hem de HCl tahlillerinde VCl 3 ile çalıştırılmalı ve tüp 1'den elde edilen değer, tüp 4'ten elde edilenden çıkarılmalıdır. *Kalıntı NO2-, S-nitrosohemoglobin ve demir-nitrosil-hemoglobinin belirlenmesi için Hb analizi için kullanılması önerilen miktarlar. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
NO 3- ölçümü için, hidroklorik asit (HCl) içindeki Vanadyum (III) klorür (VCl3), CLD ile NO 3- stokiyometrik olarak NO 3- ölçümü için temizleme kabında NO- 3- 'ye dönüştürülmesi için kullanılır:
2 NO 3-+ 3V +3 + 2H 2 O →2NO+ 3VO2+ + 4H+
Yeterince hızlı bir dönüşüm elde etmek için, reaksiyonun 90-95 ° C'de yapılması gerekir. NO3'ten NO 2'ye indirgeme, HCl tarafından NO2'nin NO'ya indirgenmesi ile birleştirilir. Vanadyum metali ayrıca NO moiety22,36'larını serbest bırakan S-NO'ları azaltır. CLD tarafından HCl'de VCl 3 ile elde edilen nihai konsantrasyon, NO3-, NO2 ve diğer nitroslu bileşiklerin toplam konsantrasyonunu yansıtır. İkinci değerin I 3- ile CLD ile verilen konsantrasyondan çıkarılması, NO 3- konsantrasyon 36,37'nin hesaplanmasına izin verir (Şekil 3).
NO tüketim tahlilinde, (Z)-1-[2-(2-aminoetil)-N-(2-amonyoetil)amino]diazen-1-ium-1,2-diyol (DETA-NONOate) gibi NO donörleri tarafından temizleme kabında NO'nun sürekli salınması, enjekte edilen numunelerde hücresiz oksiHb'nin ölçülmesine izin veren kararlı bir sinyal üretir. Temizleme kabında tüketilen NO miktarı, numunedeki oksiHb miktarı ile stokiyometrik bir ilişki içindedir38.
Plazma örneklerinde NO2-, NO3-, S-nitrosothiols, demir-nitrosil kompleksleri ve hücresiz Hb ile NO tüketiminin ölçümü için protokoller gösterilmiştir. RBC ortamında NO ile ilgili çalışmalar, toplam Hb konsantrasyonu 15,22'nin belirlenmesi ile birlikte son derece kırılgan S-NO-Hb ve Hb-NO'yu ölçmek için dışlama kromatografisi ile birlikte spesifik numune muamelesi ve ardından dışlama kromatografisi gerektirir. Numune hazırlama, ölçümün düzeltilmesinde etkilidir. Tahlil sırasındaH2 O'da NO 2'ninönceden varlığı ve NO 2'nin salınması, S-NO-Hb 14,39 gibi yapay olarak daha yüksek konsantrasyonlarda NO türevlerinin ölçülmesine yol açabilir. Numune hazırlamanın önemli yönleri de sunulmaktadır.
Protokol
Bu protokolde belirtilen prosedürler Massachusetts Genel Hastanesi inceleme kuruluna uygundur. Kullanılan kan örnekleri önceki bir çalışma sırasında toplanmıştı ve mevcut amaç için tanımlanmamıştı18.
NOT: Boşaltma kabını, yıkamayı ve genel bakımı oluşturan boru ve cam eşyalar arasındaki optimum bağlantılarla ilgili özel rehberlik için üreticinin talimatlarına bakın. Cam eşyalara zarar vermemek için bağlantıların sağlam ve dikkatli bir şekilde yapılması gerekir. Cam tahliye kabının bileşenlerini tanımlayın: gaz giriş hattı, ısıtma ceketi ve kondenserli tahliye kabı, sodyum hidroksit (NaOH) gaz kabarcık tuzağı, tahliye kabı ile kabarcık arasındaki bağlantı hattı, yoğun bir alan dielektrik (IFD) filtresi ile donatılmış tahliye kabı çıkış gaz hattı (CLD'ye). Temizleme kabı ile CLD'nin numune girişi arasındaki bir IFD filtre hattı, sıvı formdaki NO metabolitleri (plazma, hücre kültürleri, doku homojenatları) her ölçüldüğünde (protokolde sunulan tüm tahliller) yerinde olmalıdır. Numune hazırlama, analiz edilen sıvı veya dokuya ve ilgili bileşiklere bağlıdır. Preanalitik aşamanın önemli yönleri bölüm 1 ve 2'de ele alınmıştır. Belirli tahliller için özel hazırlık adımları bölüm 3-5'te yer almaktadır. Bölüm 6-8 tüm tahliller için geçerlidir.
1. Özel reaktiflerin hazırlanması
NOT: Daha fazla ayrıntı için, önceki yayınlar 15,22'ye bakın.
- 500 mg sülfanilamidin 10 mL 1N HCl'ye çözündürülmesiyle NO2- giderimi için% 5 (290 mM) asitlenmiş sülfanilamid (AS) çözeltisi hazırlayın. Bu çözüm aylarca kararlıdır.
- 67.9 mg HgCl 2'yi 5 mL PBS'ye çözerek S-NO'lardan NO2- salınımı için 50 mM merkürik klorür (HgCl2) çözeltisi hazırlayın. Stok çözümünü ışıktan koruyun.
- Tiol gruplarını bloke etmek için 100 mM N-etilmaleimid (NEM) ve kırmızı hücre zarlarını çözündürmek için (İSTEĞE BAĞLI)% 10 nonilfenil-polietilen glikol çözeltisi (Nonidet p-40) ile birlikte Hb'yi oksitlemek için 800 mM ferrisiyanür [K3Fe (CN)6] ile NO2 bloke çözeltisi hazırlayın.
- 800mM'likbir nihai konsantrasyon elde etmek için deiyonize ve damıtılmış suya (ddH2O, litre başına 263.5 g toz) K 3 Fe (CN) 6 ekleyin.
- ddH 2 O çözeltisindeki 800 mM K3Fe (CN)6'yaNEM ekleyin (100 mM konsantrasyona sahip olmak için litre başına 12.5 g toz) ve tüm kristalleri çözmek için çözeltiyi karıştırın.
- 800 mM NEM K3Fe (CN)6 100 mM NEM çözeltisinin dokuz parçasına (litre başına 111 mL) % 10 NP-40'ın bir parçasını ekleyin ve iyice karıştırın (tam kan analizi için zorunlu adım).
- Stok çözeltilerinden 12 mM K3Fe (CN)6, 10 mM NEM, 100 μM dietilenetriaminepentaasetik asit (DTPA, metal şelatlama için) ve% 1 Nonidet p-40 deterjan içeren S-NO-Hb stabilizasyon çözeltisini hazırlayın.
- PBS'ye NEM kristalleri ekleyerek 200 mM'lik bir NEM çözeltisi hazırlayın (25 mg / mL, örneğin, 10 mL PBS'de 250 mg) ve tüm kristaller çözülene kadar (deney gününde yapılacak) çözeltiyi karıştırın.
- ddH 2 O'ya K 3 Fe(CN)6 ekleyerek 800 mM K3Fe(CN)6 çözeltisi hazırlayın (800 mM'lik nihai konsantrasyon elde etmek için 5 mL'lik ddH2O'da 263,5 mg/mL, örneğin 1,32 g) (deney gününde yapılacaktır).
- 200 mL ddH 2 O'ya 786 mg DTPA ekleyerek 10 mM DTPA stok çözeltisi hazırlayın ve DTPA'yı tamamen çözündürmek için 5N NaOH ilepH'ı7,0'a ayarlayın.
- 7,2 pH'ta 81,5 mL PBS'ye 5 mL 200 mM NEM çözeltisi, 1,5 mL 800 mM K3Fe(CN)6 çözeltisi ve 1 mL DTPA stok çözeltisi ekleyin ve son olarak, son hacmi 100 mL'ye getirmek için sonunda 11 mL'lik %10 NP-40 ekleyin.
2. Örnek toplama
NOT: Örnek toplama hakkında daha fazla ayrıntı için, daha önce yayınlanmış 15,22,40 numaralı eserlere bakın.
- Tam kan toplayın
- Heparin kaplı tüplerde kan toplayın, arteriyel damar yerine venöz tercih edin (özellikle gerekli olmadıkça) ve hemolizi en aza indirmek için en az 20 G veya daha büyük kateter veya iğne deliği ile venipunktur yerine kateter yerleştirmeyi tercih edin (mümkünse).
- Hemen NO2- bloke edici çözeltiyi (çözeltinin 1 kısmını 4 parça tam kana ekleyin), işlemi (bölüm 3 veya 4) veya dondurun ve -80 ° C'de saklayın.
- Plazma ve kırmızı kan hücrelerini (RBC'ler) toplayın
- Hemolizi en aza indirmek için arteriyel kan yerine venöz tercih eden heparin kaplı tüplerde (özellikle gerekli olmadıkça) ve hemolizi en aza indirmek için en az 20 G veya daha büyük iğnelerde kan toplayın ve 4 ° C'de 4000 x g'de hemen 5 dakika boyunca santrifüj yapın.
- Süpernatantı (plazma) NO2- bloke edici çözelti (süpernatanın 4 parçasına çözeltinin 1 kısmı) ile yeni bir tüp ve işlemde (bölüm 3 veya 4) karıştırın veya -80 ° C'de dondurun ve saklayın.
NOT: NO tüketim testi için, NO2- blokaj çözeltisi kullanılamaz. Tahlil, plazma ön işlemi olmadan yapılabilir. - RBC peletini alttan S-NO stabilizasyon çözeltisi ile önceden doldurulmuş yeni bir tüpe (bkz. adım 1.4) (1 mL pelet ila 9 mL çözelti) yeniden askıya alın ve 5 dakika boyunca inkübe edin.
- RBC lizatını, dışlama kromatografisi için daha önce ddH 2 O ile durulanmışG-25Sephadex polimeri ile boyutlandırma sütununda geçirin
- İşlemek için Hb fraksiyonunu toplayın (bölüm 4) ve Drabkin'in reaktifini kullanarak Hb konsantrasyonunu ölçün (Hb ölçümü için, daha önce yayınlanmış çalışma22'ye bakın).
NOT: Belirli bir doku/organı hazırlamak ve örneklemek için, hilumunu tanımlayın ve cerrahi olarak izole edin. Damarı kesin, arteri delin ve arter yoluyla heparinize salin (10 U / mL) enjekte edin. Tuzlu su venöz insizyonda geri akmaya başladığında dokuyu tüketin. 4 parça homojenize dokuya 1 parça NO2 bloke çözeltisi eklerken dokuyu mekanik bir homojenizatör ile homojenize edin.
3. HCl tahlil hazırlığında VCl3
NOT: HCl tahlil hazırlamada VCl3 hakkında daha fazla bilgi için, daha önce yayınlanmış37,41 numaralı çalışmalara bakın.
DİKKAT: Bu tahlil yapılırken NaOH tuzağı düzgün bir şekilde yerine getirilmezse CLD hasar görecektir. Bu, HCl'nin aşındırıcılığından kaynaklanmaktadır.
- Standart eğri için NO3- standart çözeltileri hazırlayın
- 0.1 M NaNO 3- elde etmek için 10 mL ddH2O'da 85 mg NaNO3'ü çözün (bu çözelti birkaç hafta boyunca stabil kalır).
- Plazma veya idrar numuneleri için bir kalibrasyon eğrisi gerçekleştirmek üzere ddH2O'da seyreltme yoluyla standartlar hazırlamak için stok çözeltisini kullanın ve 5 μM, 10 μM, 20 μM, 40 μM, 80 μM, 200 μM NaNO3 konsantrasyonları elde edin (hücre kültürleriyle çalışıyorsanız daha düşük konsantrasyonlar kullanın).
- VCl 3 (vanadyum klorür) doymuş çözeltisini NO3 için hazırlayın - boşaltma kabında azalma
DİKKAT: Su ve VCl3'ün reaksiyonu ekzotermiktir. Asit eklerken ve deneyin sonunda cam eşyaları durularken yüksek cam eşya sıcaklığına dikkat edin.- 1.6 g VCl 3'ü, önce temiz bir şişeye VCl3 ekleyerek, ardından 200 mL'lik 1 M HCl'yi ekleyerek 200mL'lik 1 M HCl'de çözün.
- Çözeltiyi filtre kağıdından vakumla filtreleyin (11 μm filtre kağıdı gibi, ancak herhangi bir filtre kağıdı kullanılabilir).
NOT: Filtrelenmiş çözelti berrak maviye dönerken, filtrelenmemiş VCl3 çözeltisi çözünmemiş parçacıklar nedeniyle kahverengidir. - Doymuş çözeltiyi alüminyum folyo veya politetrafloroetilen (PTFE) bant ile kaplı tutun, çünkü bileşik ışığa duyarlıdır.
- Dolaşımdaki su banyosunu hazırlayın
- Dolaşımdaki bir su banyosu cihazını temizleme kabının su ceketine bağlayın. Astarlamadan önce hatların kuru olduğundan emin olun.
- Su banyosunu 95 ° C'de başlatın ve hatların etrafına (yapışmayan) kağıt havlular uygulayarak su hatlarında sızıntı olmadığını doğrulayın.
- Gaz kabarcığı tuzağını kurun
- Kabarcığın PTFE manşonunun yerinde olduğunu ve hasar görmediğini doğrulayın.
- Gaz kabarcığını açın ve kabarcık tabanına 15 mL 1 M NaOH enjekte edin.
- Gaz kabarcığını yeniden konumlandırın ve alt kısmı üste doğru bastırarak ve iki parçayı hafifçe bükerek bağlantıyı sıkıca kapatın. Kabarcığın üstünü kuvvet uygulamadan döndürmenin imkansızlığı, doğru bir sızdırmazlık olduğunu gösterir.
- Temizleme kabının çıkışını gaz kabarcığı tuzağının girişine bağlayın.
4. I3- Asetik asit tahlil hazırlamada
NOT: Asetik asit tahlil hazırlığında I3- hakkında daha fazla bilgi için, daha önce yayınlanmış15,22,38,41,42 numaralı çalışmalara bakınız.
- NO2- için standart eğri hazırlayın
- 100 mM çözelti elde etmek için 10 mL ddH 2 O içinde 69 mg sodyum nitrit (NaNO2) çözerek bir stok çözeltisi hazırlayın. Bu çözüm, hava geçirmez bir kapta saklandığında, soğutulduğunda ve ışıktan korunduğunda kararlıdır.
- Stok çözeltisini 900 μL ddH2O ile önceden doldurulmuş 1,5 mL mikrosantrifüj tüpüne seri olarak seyreltin: İlk santrifüj tüpüne 100 μL stok çözeltisi ekleyin, karıştırın, etiketleyin ve ikinci tüp için tüpün 100 μL'sini kullanın, ardından 10 mM, 1 mM, daha sonra 100 μM ile sonuçlanan tekrarlayın.
- Kalibrasyon eğrisinde kullanılmak üzere 50 μM,25μM, 10 μM, 1 μM ve 500 nM NaNO 2 alikotları elde etmek için ddH2 O ile daha da seyreltin.
- Temizleme kabı için asetik asit içindeki I 3'ü hazırlayın (1 hafta boyunca oda sıcaklığında (RT) saklanabilir)22
- 40 mL ddH 2 O ve 140 mL asetik aside 2 g potasyum iyodür (KI) ve 1.3 g iyot (I2) ekleyin.
- Karışımı en az 30 dakika karıştırarak iyice karıştırın.
- NO2-, S-nitrosothiols (Hb toplanırsa S-NO-Hb) ve demir-nitrosil komplekslerinin (Hb toplanırsa Hb-NO) diferansiyel tayini için numuneleri hazırlayın (Şekil 3)
- Her bir numuneyi, ışık korumalı mikrosantrifüj tüplerinde 270 μL'lik (S-NO-Hb ve Hb-NO'yu ölçüyorsa 900 μL Hb) 3 alikota bölün, bunlardan 2'si 30 μL 1x PBS (S-NO-Hb ve Hb-NO'yu ölçüyorsa 100 μL) ve üçüncü tüpü 30 μL HgCl2 (S-NO-Hb ve Hb-NO'yu ölçüyorsa 100 μL) ile önceden doldurulur, vorteks ve RT'de 2 dakika boyunca inkübe edin (Şekil 3).
- Fe-NO'ları ölçmek için HgCl 2 ile numuneye (Hb-NO'lar için 100 μL) ve S-NO'ları ve Fe-NO'ları ölçmek için PBS eklenmiş olana (S-NO-Hb ve Hb-NO'lar için 100 μL) %5'lik 30 μL AS ekleyin ve NO2-, S-NO'lar ve Fe-NO'ları (Hb koleksiyonundan kalan NO 2- için 100 μL) ölçmek için 1x PBS ile önceden doldurulmuş olan üçüncüye 30 μL PBS ekleyin, S-NO ve Hb-NO). RT'de 3 dakika boyunca vorteks yapın ve kuluçkaya yatın (Şekil 3).
5. Hücresiz Hb kurulumu ile tüketim YOK
NOT: Daha fazla ayrıntı için, daha önce yayınlanmış olan38 numaralı çalışmaya bakın.
- Bilinen bir konsantrasyona sahip saflaştırılmış bir stok Hb çözeltisinden standart oksiHb çözeltileri hazırlayın
- Kalibrasyon eğrisi için kullanılacak çözeltileri elde etmek için ddH2O ilavesiyle stok çözeltisini 1,5 mL mikrosantrifüj tüplerine seri olarak seyreltin: 62 μM, 50 μM, 25 μM, 12,5 μM, 6,25 μM, 3,125 μM, 1,56 μM.
- DETA-NONOate çözümünü hazırlama
- 100 mM DETA-NONOate üretmek ve buz üzerinde tutmak için pH 7.4 PBS'de 610 μL 10 μM NaOH'ye 10 mg DETA-NONOate ekleyin.
6. Kemilüminesans dedektörünü (CLD) çalıştırın ve temizleme kabını hazırlayın
NOT: Temizleme kabının hazırlanması için, daha önce yayınlanmış olan43 numaralı çalışmaya bakınız.
- CLD'ye ve CLD'den ana bağlantıları doğrulayın
- Oksijen hattını CLD'ye bağlayın ve oksijen tankını CLD'nin üreticisi ile anlaşmaya varılan bir basınçta açın.
- Yoğun Alan Dielektrik (IFD) filtre hattının CLD'ye bağlı olduğundan ancak boşaltma kabına veya NaOH tuzağına bağlı olmadığından emin olun
- CLD'yi başlatın
- CLD arabiriminde, sıvı faz tahlilleri için algılama programını çalıştırmaya başlayın.
- Oksijen kaynağının yeterli olduğunu doğrulayın. Bu durumda, CLD girişinden numune almaya başarıyla başlayacak ve milivolt (0-5 mV) cinsinden bir sinyalle algılamayı gösterecektir. Aksi takdirde, CLD negatif bir tanılama sinyali ister.
- Temizleme kabını hazırlayın
- Her üç porttaki temizleme kabını kapatın: iğne valfini sağa tamamen vidalayın, giriş ve çıkış durdurma musluklarını kapatın.
- Kapağı temizleme kabından çıkarın ve numuneleri enjekte etmek için kullanılan şırınga iğnesinin sıvı kolonuna ulaşabilmesi için reaksiyon odasına (Tablo 1) planlanan tahile özgü yeterli miktarda reaktif ekleyin.
- İstenen kararlı bir taban çizgisinin varlığını doğrulayın (Tablo 1).
- Tahliye gazı akışını başlatın
- İnert gaz tankının (örneğin,N2) iki aşamalı bir regülatör ile donatıldığından emin olun ve inert gaz tankını geminin gaz girişine bağlayın.
- Gazı 1-5 psi regülatörde bir çıkış basıncı ile açın, boşaltma kabının girişini açın ve gaz girişine izin vermek için boşaltma kabının iğne valfini yavaşça açın. Temizleme kabı içindeki köpürmeyi doğrulayın.
- Gaz akışını ayarlama
- CLD tarafından ölçülen hücre basıncını, ortam havasını örnekleyen IFD filtre hattı ile kaydedin.
- Kapağı temizleme kabı üzerinde yeniden konumlandırın, IFD filtre hattını boşaltma kabına (veya HCl tahlilindeki VCl3'teki NaOH tuzağına) bağlayın ve temizleme kabının çıkışını açın.
- Ortam havasında kaydedilen CLD seviyesinde aynı hücre basıncına ulaşmak için iğne valfini kullanın.
7. Deney
NOT: Deneyle ilgili daha fazla ayrıntı için, daha önce yayınlanmış olan43 numaralı çalışmaya bakın.
- Kemilüminesans sinyal toplama programını başlatın
- CLD'nin seri bağlantı noktasını, bilgisayarın edinme programının yüklü olduğu seri bağlantı noktasına bağlayın.
- Analiz programını çalıştırın.
- Al'a tıklayın, .data dosyasını kaydetmek için klasörü seçin, dosya adını yazın ve Kaydet'e tıklayın.
NOT: Önceden ayarlanmış süre geçtiğinde kayıt otomatik olarak durduğundan, ekranda önceden ayarlanmış çalışma süresine dikkat edin. Gerekirse, önceden ayarlanmış çalışma süresi artırılabilir.
- Tekrarlanan numune enjeksiyonlarına hazırlanın
- Minimum ve/veya Maksimum düğmelerine tıklayarak ve ardından istenen değeri girerek hedeflenen taban çizgisi üzerinde kontrol sahibi olmak için ekrandaki voltaj ölçeğini ayarlayın.
- Şırıngayı numuneler arasında durulamak için ddH 2 O ile doldurulmuş20veya 50 mL'lik bir tüp bulundurun.
- Hazır bir kutu hassas görev mendili bulundurun.
- Numune enjeksiyonu
NOT: Kalibrasyon eğrisi için standart çözeltilerden başlayın (en az konsantre numunelerden en konsantre numunelere enjekte edin), ardından deney numunelerine geçin (bunu kopyalar veya üçlü olarak yapmayı düşünün).- Şırıngayı ddH2O ile en az iki kez veya daha fazla kez durulayın ve her numuneyi geri çekmeden önce (ve her enjeksiyondan sonra) ve bir görev silme işleminde engelsiz su tahliyesini her seferinde doğrulayın.
- Hem şırıngayı hem de tüpü yakın bir mesafede tutarken şırıngayı numune tüpüne yerleştirin, hava kabarcığı ve / veya homojenize edilmemiş katı parçaların sıkışmadığından emin olurken pistonu istenen hacme kadar çekin.
- Şırınganın ucunu bir görev sileceği ile temizleyin, ardından şırıngayı enjeksiyon portundaki septa kapağına yerleştirin ve şırınganın ucunun reaksiyon odasındaki sıvı fazda olduğunu doğruladıktan sonra enjekte edin.
- Yazılım programındaki enjeksiyonu işaretleyin ve bekleyin
- Enjeksiyonun sinyalde yukarı doğru bir değişikliğe neden olduğunu doğrulayın (Ek Şekil 1) (hücresiz Hb testi ile NO tüketiminde aşağı doğru) ve Örnek Adları'nın altındaki gri kutuyu tıklayarak örnek adını yazın, ardından İşaret Enjeksiyonu'na tıklayın.
NOT: Numune enjeksiyonu bir sinyal üretmezse şırınga tıkanıklığından şüphelenin. - Elektrik sinyalinin tekrar taban çizgisine ulaşmasını bekleyin (bu genellikle 3-4 dakika sürer). Bu süre, adım 7.3.1'i gerçekleştirmek için kullanılabilir.
- Enjeksiyonun sinyalde yukarı doğru bir değişikliğe neden olduğunu doğrulayın (Ek Şekil 1) (hücresiz Hb testi ile NO tüketiminde aşağı doğru) ve Örnek Adları'nın altındaki gri kutuyu tıklayarak örnek adını yazın, ardından İşaret Enjeksiyonu'na tıklayın.
- Deneyin sonuna kadar her enjeksiyon sırasında ve sonrasında adım 7.3 ve 7.4'te belirtilen tüm adımları tekrarlayın. Koruma çözümünün bir örneğini çalıştırmayı unutmayın (kullanılıyorsa)
- Denemeyi durdurma
- Sinyal alımını kesmek için DURDUR'a tıklayın, CLD'yi durdurun ve su banyosunu kapatın (NO3- ölçülürse).
- Gaz akışını kesin, iğne valfini açın, kapağı boşaltma kabından çıkarın, drenajın altına bir atık kabı yerleştirin ve boşaltma musluğunu açın.
NOT: Deneme 60 dakikadan daha uzun süre veri toplamayı gerektiriyorsa, 60 dakikalık çalışma süresinden sonra edinimi yeniden başlatmak (7.1.3 adımını tekrarlayın) ve yeni bir dosya oluşturmak gerekir.
8. Ölçümler ve hesaplamalar
NOT: Ölçümler ve hesaplamalar çevrimdışı yapılır ve farklı bir zamanda gerçekleştirilebilir.
- Çevrimdışı veri analizi için kemilüminesans toplama programını başlatın
- Programı başlatın ve İşlem'e tıklayın.
- Deneme dosyasını seçin ve ardından Aç'ı tıklayın.
- Her yönetim için eğrinin altındaki alanı hesaplayın
- Yazılım, her örnek uygulaması tarafından oluşturulan her dalganın taban çizgisini (Ek Şekil 2A, yatay sarı çizgi) ve tepe eksenini (dikey sarı çizgiler) ekranda otomatik olarak grafiklendirir: doğru konumlarını doğrulayın (veya her bir çizgiye tıklayıp fare veya oklarla hareket ettirerek ayarlayın) ve Eşik Tamam'a tıklayın (Ek Şekil 2B).
NOT: Hücresiz Hb ölçüm testi ile NO tüketiminde, yazılım tipik olarak numune enjeksiyonu tarafından oluşturulan dalga formunu doğru bir şekilde yakalamayı başaramaz. Her dalga formunu yakınlaştırarak, operatör alan hesaplamasında yazılıma kolayca yardımcı olabilir (Ek Şekil 2). - Yazılım, her örnek uygulamasının neden olduğu her zirvenin başlangıcını (dikey yeşil çizgi) ve sonunu (dikey kırmızı çizgi) otomatik olarak grafiklendirir: doğru konumlarını doğrulayın (veya her bir çizgiye tıklayıp fare veya oklarla hareket ettirerek ayarlayın) ve Entegre Et'e tıklayın (Ek Şekil 2C).
NOT: İzdeki bazı alanlar bu noktada yanlışlıkla enjeksiyon olarak tanımlanabilir ve bazı zirveler otomatik olarak iki kez sayılabilir. Her iki hata da adım 8.2.2 sırasında yeniden tanımlanabilir ve kaldırılabilir. - Yazılım, deney sırasında işaretlenen bir enjeksiyonu ve atanan adını takiben her sinyal alanını otomatik olarak eşleştirir: Sonraki Tepe ve Önceki Zirve'ye tıklayarak atanan adla her zirvede (sarı dikey bir çizgiyle gösterilir) gezinin, ardından ekrandaki tüm alanlar için hesaplamayı nihayet elde etmek için Tamam düğmesine tıklayın.
- Kullanıcı veya program tarafından yapılan tüm adlandırma veya eşleştirme hatalarını düzeltmek için, Ek Dosya 1'de belirtilen düğmeleri gerektiği gibi kullanın.
- Yazılım, her örnek uygulaması tarafından oluşturulan her dalganın taban çizgisini (Ek Şekil 2A, yatay sarı çizgi) ve tepe eksenini (dikey sarı çizgiler) ekranda otomatik olarak grafiklendirir: doğru konumlarını doğrulayın (veya her bir çizgiye tıklayıp fare veya oklarla hareket ettirerek ayarlayın) ve Eşik Tamam'a tıklayın (Ek Şekil 2B).
- Kalibrasyon eğrisi değerlerini bir elektronik tabloya aktarın ve doğrusal bir regresyon denklemi oluşturun (Ek Şekil 3)
- Verileri CLD programından kopyala-yapıştır yoluyla yeni bir elektronik tabloya aktarın. Veri sayfasındaki iki sütunu Örnek Konsantrasyonu ve Eğrinin Altındaki Alan olarak düzenleyin ve her iki sütuna da sıfırdan eşleşen bir değer ekleyin.
- İki sütunu seçin, > Dağılım Ekle'yi tıklayın, ardından Grafik Tasarımı menüsünün altında Grafik Öğesi Ekle > Eğilim Çizgisi > Doğrusal'ı seçin.
- Basit bir doğrusal kalibrasyon denklemi elde etmek için oluşturulan eğilim çizgisine sağ tıklayın, Eğilim Çizgisini Biçimlendir'e tıklayın, ardından Denklemleri Grafikte Görüntüle ve Eğilim Çizgisini Biçimlendir menüsünde R-kare değerini Grafikte Görüntüle seçeneklerine tıklayın.
- Konsantrasyonunu hesaplamak için her numunenin hesaplanan alanını aktarın (Ek Şekil 3)
- E-tablodaki her değeri raporlayın. Bir sonraki sütunda, enjekte edilen her numunenin konsantrasyonunu elde etmek için adım 8.3.3'ten elde edilen denklemi uygulayın; burada y, konsantrasyondur (yeni sütunun değeri) ve x, enjeksiyondan sonra ölçülen eğrinin altındaki alandır.
NOT: Koruma çözeltisinde ölçülen konsantrasyonu (kullanılıyorsa) dikkate almayı ve değerleri buna göre çıkarmayı unutmayın.
- E-tablodaki her değeri raporlayın. Bir sonraki sütunda, enjekte edilen her numunenin konsantrasyonunu elde etmek için adım 8.3.3'ten elde edilen denklemi uygulayın; burada y, konsantrasyondur (yeni sütunun değeri) ve x, enjeksiyondan sonra ölçülen eğrinin altındaki alandır.
Sonuçlar
Hücresiz Hb testi ile NO-tüketimi, bilinen hücresiz oksiHb konsantrasyonlarını içeren örneklerde kullanılmıştır (Şekil 4). Bir oksiHb hemi stokiyometrik olarak tahlilde bir NO molekülünü serbest bıraktığından, tahlil için kalibrasyon eğrisini oluşturmak için saflaştırılmış hücresiz oksiHb kullanılır (Ek Şekil 3).
Kalp cerrahisi sırasında kardiyopulmoner bypass'tan (KPB) çıkan hastalarda hücresiz Hb (kolorimetri...
Tartışmalar
Yüksek hassasiyet nedeniyle, NO ve ilgili bileşiklerin belirlenmesi için kemilüminesans bazlı testler yüksekNO2 kontaminasyon riskine sahiptir. Deneyde kullanılan her reaktif (özellikle NO 2- bloke edici çözelti) ve seyreltici (ddH 2 O dahil), arka plan sinyalini düzeltmek için NO2- içeriği açısından test edilmelidir. Nitrit, tam kanda yaklaşık 10 dakika yarı ömürlü bir yarı ömür ile son derece reaktiftir ve hızla...
Açıklamalar
L.B., hemoliz ve nitrik oksit üzerindeki çalışmaları için baş araştırmacı olarak K23 HL128882 / NHLBI NIH'den maaş desteği almaktadır. LB, George Mason Üniversitesi Mercatus Merkezi'ndeki "COVID-19 araştırması için Hızlı Hibeler" ve iNO Therapeutics LLC'den hibe aldı. B.Y., NHLBI/#R21HL130956 ve DOD/Cenevre Vakfı'ndan (W81XWH-19-S-CCC1, Log DM190244) gelen hibelerle desteklenmektedir. B.Y., MGH'de nitrik oksitin elektrik üretimi konusunda patent aldı.
L.B. ve B.Y., COVID-19 hastalığında NO teslimatı için patent başvurusunda bulundu PCT başvuru numarası: PCT / US2021 / 036269 7 Haziran 2021'de dosyalandı. RWC, düşük kaynak ortamlarında bulunan çocuklarda tüberkülozun merkezi olmayan teşhisini amaçlayan teknoloji geliştirme baş araştırmacısı olarak Unitaid'den maaş desteği almaktadır.
Teşekkürler
Bu makalede bildirilen protokoller, Dr. Warren Zapol'un Massachusetts Genel Hastanesi Anestezi Bölümü Kritik Bakımda Anestezi Araştırma Laboratuvarı'nın önceki bursiyerlerinin birikmiş katkılarıyla mümkün olmuştur. Dr. Akito Nakagawa, Francesco Zadek, Emanuele Vassena, Chong Lei, Yasuko Nagasaka, Ester Spagnolli ve Emanuele Rezoagli'nin katkılarını takdir ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetic Acid | Sigma | 45754 | 500 mL - liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL - liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL - liquid |
| Iodine | SAFC | 207772 | 100 g - solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g - solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g - crystalline |
| Nitric Oxide Analyzer + Bundle Software - Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% - 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g - powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g - solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g - crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump - Bundled with analyzer |
| Sodium Heparin - BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg - pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g - powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g - crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g - solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g - solid - Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
Referanslar
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3':5'-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır