このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒトオルガノイドと臓器オンチップ技術を組み合わせて腸領域特異的機能をモデル化
要約
生検由来の腸オルガノイドと臓器オンチップ技術は、領域特異的な腸機能を再要約するためにミクロ生理学的プラットフォームに組み合わされます。
要約
腸粘膜は、無数の重要な機能を果たす複雑な物理的および生化学的障壁である。それは微生物叢との共生関係を促進し、微生物の侵入を制限しながら、栄養素および生体異物の輸送、吸収および代謝を可能にする。様々な細胞型とその物理的および生化学的環境との間の機能的相互作用は、腸組織恒常性を確立し維持するために不可欠である。これらの複雑な相互作用と統合された腸内生理学を in vitroで モデル化することは、新しい治療標的および薬物候補の発見および開発方法を変革する可能性を秘めた手ごわい目標です。
オルガノイドとオルガン・オン・ア・チップ技術が最近組み合わされ、腸生理学および病態生理学の機能的側面を インビトロで研究するのに適したヒト関連腸チップが生成されました。小腸(十二指腸)および大腸の生検に由来するオルガノイドは、臓器チップの上部区画に播種され、各腸領域の明確な細胞、分子、および機能的特徴を維持しながら、単層として正常に拡張される。ヒト腸管組織特異的微小血管内皮細胞は、オルガンチップの底部区画に組み込まれ、上皮・内皮界面を再現する。この新規プラットフォームは、栄養素、薬物、および微生物への管腔曝露を容易にし、腸内輸送、透過性、および宿主 - 微生物相互作用の研究を可能にする。
ここでは、ヒト十二指腸(十二指腸チップ)および結腸(colon chip)を表す腸チップの樹立、ならびに連続的な流れおよび蠕動運動様変形下でのそれらのその後の培養のための詳細なプロトコルが提供される。我々は、プロトタイプ誘導物質および基質を用いて十二指腸チップにおける薬物代謝およびCYP3A4誘導を評価するための方法を示す。最後に、大腸チップ内のインターフェロンガンマ(IFNγ)媒介性バリア破壊(リーキーガット症候群)の in vitro モデリングのためのステップバイステップ手順を提供し、副細胞透過性の変化、サイトカイン分泌の変化、およびチップ内の細胞のトランスクリプトームプロファイリングを評価する方法を含む。
概要
人間の腸は、自己再生が可能な複雑でマルチタスクの器官です。それは小腸と大腸に分かれています。小腸の主な機能は、胃から来る食物をさらに消化し、すべての栄養素を吸収し、残渣を大腸に渡して水と電解質を回収することです。小腸はさらに、解剖学的に異なる複数の領域(十二指腸、空腸、回腸)に分割され、それぞれが特定の機能を実行するように適応されています。例えば、十二指腸は、空腸内のタンパク質、炭水化物、ビタミン、ミネラルを含む栄養素の適切な吸収を可能にするために、粥(胃の内容物)の分解を助けます。小腸のこの近位部は、腸管の薬物吸収および代謝の主要な部位でもあり、回腸および結腸1におけるそれらの発現と比較して、薬物代謝酵素(例えば、CYP3A4)の発現が高いことを特徴とする。栄養素の消化吸収におけるその主な役割に加えて、腸はまた、病原性微生物、微生物代謝産物、食事性抗原、および毒素などの潜在的に有害な管腔内容物に対する効果的な障壁でもある2,3。ヒトの結腸には、栄養、代謝、および免疫に多くの利点を提供する人体の全細胞のそれをはるかに超える多数の微生物が生息していることは注目に値する。したがって、腸上皮細胞によって形成される粘膜障壁の完全性の維持は、腸内微生物叢と宿主細胞との間の共生関係を物理的に分離して不必要な免疫細胞活性化を回避することを可能にするために重要である2。さらに、プログラムされた腸細胞死は、感染細胞が持続または増殖するのを防ぎ、それによって潜在的な病原体3を播種するのを防ぐ自己保護メカニズムとして重要な役割を果たし、4〜7日ごとに腸上皮の継続的な自己複製は、バリアの完全性および組織恒常性を保証する細胞喪失を補う。栄養吸収、バリア完全性、または腸細胞死および自己複製における不均衡を含む記載された腸機能の障害は、栄養失調および炎症性腸疾患(IBD)を含む様々な胃腸障害の発症をもたらし得る2,3。
これまで、動物モデルおよび形質転換癌由来腸細胞株は、ヒト腸組織の生理学的および病態生理学的機能を研究するために使用されてきた。しかし、2つの種の間に著しい格差が存在することによって引き起こされる、動物研究のヒトへの翻訳可能性に関するますます顕著な懸念は、ヒトに関連する代替方法の必要性を強調した4。一般的に使用される インビトロ 腸細胞株には、T84、Caco−2、およびHT29細胞が含まれる。それらは、腸管障壁機能および膜輸送の特定の態様を模倣するが、薬物代謝酵素5、表面受容体、およびトランスポーター4の発現の変化によって特徴付けられる。さらに、それらは腸セグメント特異性を欠いており、腸上皮の複雑さを再現することができず、各モデルは腸内に存在する5つの上皮細胞型のうちの1つしか含まない6。
最近、小腸および結腸7,8の新鮮な生検から確立されたヒト腸管オルガノイド培養物または人工多能性幹細胞(iPSC)9が、将来的に動物実験を補完し、減少させ、そしておそらく置き換える可能性のある代替実験モデルとして導入された。iPS細胞は非侵襲的な方法で入手することができますが、iPS細胞からオルガノイドを確立するには、複雑で長いプロトコル(いくつかの実験ステップを含む)を使用する必要があり、ヒト胎児組織に似た培養物を生成します。対照的に、生検由来オルガノイドは、腸組織の固有の再生能力を利用することができ、インビトロで無期限に継代および伝播することができるため、高度にスケーラブルである。重要なことに、生検由来オルガノイドは、それらが発達した一次組織の疾患および腸領域特異的特性を維持し、腸上皮の細胞多様性をエミュレートする。オルガノイドは、インビトロで患者固有のアバターとして使用して、さまざまな胃腸障害の生物学および病因を解明し、治療管理を改善することができます。腸オルガノイドは印象的な程度の生理学的機能を達成しているが、血管、結合組織、末梢神経、免疫細胞などの重要な間質成分の欠如や機械的刺激のために、天然の臓器の複雑さを再現できない。流れ、剪断応力、伸張、圧力などの機械的パラメータは、インビボでの組織形態形成および恒常性に影響を及ぼすことが知られており、インビトロでの細胞の成熟を改善することが以前に示されていた10、11、12、13。オルガノイド系のさらなる重要な欠点は、内腔、したがって上皮の頂端側にアクセスできないことである。これは、イオンおよび薬物トランスポーターの分極発現、宿主-マイクロバイオーム相互作用、および医薬品毒性試験に関連する様々なメカニズムを調査するための課題を提示する。最後に、オルガノイド培養物は、in vitro自己組織化プロセスおよび細胞運命の選択の確率的性質のために、サイズ、形態、および機能においてかなりのばらつきに苦しんでいる。したがって、疾患モデリング、薬物スクリーニング、再生医療における腸オルガノイドの可能性を最大限に引き出すためには、オルガノイド発生の変動性を低減し、管腔へのアクセスを改善し、欠損している細胞間相互作用を組み込む新しい戦略を探求する必要があります。
オルガンオンチップ技術は、インビトロで腸細胞培養物に機械的力および流体の流れを組み込むための多くの技術を導入している。しかし、初期の概念実証研究のほとんどは、十分な細胞多様性を示さなかった癌由来細胞株を使用していたため、これらの系の関連性は疑問視されてきた。最近、我々は腸オルガノイドと臓器オンチップ技術を相乗的に組み合わせ、各アプローチの最良の特徴を1つのin vitroシステムに組み込んだ14、15、16。得られた腸チップは、腸上皮の多細胞構造、上皮 - 内皮組織界面の存在、および流体の流れと伸張の機械的力を再現し、インビトロでの臓器レベルの機能のエミュレーションを可能にする。さらに、一次組織由来オルガノイド(ヒト腸のさまざまな領域からサンプリング可能)を出発材料として使用すると、ヒト十二指腸、空腸、回腸、結腸を表すチップを同様の播種および培養手順に従って確立できるため、このモデルの汎用性が向上します。重要なことに、腸チップは、腸バリアの完全性のリアルタイム評価を可能にします。ブラシ境界および薬物代謝酵素の活性;ムチンの生産;サイトカインの分泌;以前に発表された報告書で実証されているように、腸細胞と病原性および共生微生物との相互作用。特に、異なる個人の組織から生成されたオルガノイドを使用して腸チップが確立されたとき、これらのモデルは、様々な薬物および治療に対する機能的応答における予想されるドナー間変動性を捉えた。全体として、オルガノイドをOrgan-on-a-Chip技術とマージすることで、in vitro所見の生理学的関連性と精度、およびヒトへの外挿を改善できる、より高度でパーソナライズされたin vivo関連モデルへの扉が開かれます。ここでは、腸チップを確立し、2つの腸セグメントの生理学的機能の研究におけるその応用、すなわち十二指腸および結腸を確立するための詳細なプロトコルを提示する。まず、十二指腸チップ中の薬物代謝酵素CYP3A4の活性を評価するための方法、ならびにリファンピシンおよびビタミンD3などの原型化合物によるその誘導が記載されている。第二に、結腸チップの「リーキーガット」をモデル化するために必要なステップは、IBDの病因に関与する特徴的なサイトカインを使用して上皮障壁の破壊が行われているプロトコルに概説されている。簡単に述べると、ヒト生検に由来するオルガノイドは、インビトロで増殖させ、酵素消化を行い、チップの上部チャネルに導入する。成長因子富化培地との連続灌流の存在下で、それらは3Dアーキテクチャおよび容易にアクセス可能な頂端細胞表面を有するコンフルエントな上皮単分子層に発達する。底部には、「血管」チップコンパートメントが、小腸または大腸から単離された微小血管内皮細胞で播種される。上皮と内皮は多孔質の伸縮性膜によって分離されており、2つの組織間のパラクリン相互作用を促進し、周期的な変形を受けると、ヒト腸の蠕動運動様の動きをエミュレートする。共培養は、適切な細胞培養培地との管腔および血管灌流によって生じる動的流動条件下で維持される。最後に、オンチップまたはサンプリングされた細胞培養廃液から直接実行できる多数のタイプのアッセイおよびエンドポイント分析について説明します。
プロトコル
注:すべての細胞培養物は、適切な無菌技術を使用して処理する必要があります。
この研究で採用されたヒト腸オルガノイドはジョンズホプキンス大学から入手し、すべての方法は承認されたガイドラインおよび規制に従って実施された。すべての実験プロトコールは、ジョンズホプキンス大学施設内審査委員会(IRB #NA 00038329)によって承認されました。
細胞培養試薬の調製
- 製造業者の指示(材料表)に従ってヒトオルガノイド増殖培地を調製し、100μg/mLのプリモシンで補う。
- 製造業者の指示(材料表)に従ってヒト微小血管内皮細胞増殖培地を調製し、100μg/mlのプリモシンの代わりに1:20体積/体積FBSおよび50μg/mlを補充する。
- Y-27632(Rho-キナーゼ阻害剤)をDPBS中の滅菌0.1% BSAに再懸濁し、10mMストック溶液を調製した。滅菌マイクロチューブにアリコートし、-20°Cで最大6ヶ月間保存します。
- CHIR99021(GSK-3阻害剤)を滅菌ジメチルスルホキシド(DMSO)に再懸濁し、5mMストック溶液を調製した。滅菌マイクロチューブにアリコートし、-20°Cで最大6ヶ月間保存します。
- 1:1 vol/vol オルガノイド解離溶液(材料表)とDPBS溶液(材料表)を混合し、Y-27632の10 μMストック溶液で補うことにより、ヒトオルガノイド消化溶液を調製する。この試薬は、使用のたびに新鮮にする必要があります。
2. ヒト腸管微小血管内皮細胞(HIMECs)の培養
- チップ上に播種する7日前にHIMEC培養(材料表)を開始する。通路1〜6のHIMECのみがチップシーディングに使用できます。
- 5mLの付着因子溶液(材料表)をT150フラスコに加える。37°Cで1分間インキュベートし、溶液を捨てる。
- 室温で予め加温した19mLの内皮細胞増殖培地(ステップ1.2参照)をフラスコに加える。
- HIMECの凍結バイアル(200万細胞/バイアル)を37°Cの水浴中で解凍します。
- バイアルの内容物をフラスコに移し、フラスコを静かに揺らして細胞を均等に分配する。フラスコを37°Cのインキュベーターに一晩置き、内皮細胞が接着できるようにします。
- 培地を、翌日およびその後3日ごとに室温で予め加温した20mLの内皮細胞増殖培地と交換する。培養物は、チップ実験のための細胞収穫の日にコンフルエントの90%に達するべきである。
3. チップの微細加工と作製
- 商用サプライヤーからチップを入手してください(材料表)。チップを開梱し、正方形のペトリ皿(材料表)に置かれたチップクレードルに置きます。各チップキャリアの表側に実験条件のラベルを付けます(図1A)。
注:提示されたプロトコルは、特定の市販のチップおよび計装の使用に依存していますが、異なるベンダーを通じて提供されるいくつかのマイクロ流体デバイスがあり、代替の利点を提供する可能性がありますが、ストレッチを組み込む能力がありません。さらに、Organs-on-Chipsの微細加工は、Huh et al.21に記載されている手順に従って「社内」で行うことができます。
4. 膜の活性化とECMコーティング
- 活性化溶液の調製
- 使用前にER-1およびER-2試薬(材料表)を室温にして平衡化してください。ER-1は光に敏感で、暗闇の中で取り扱う必要があります。
- ER-1を10mLのER-2試薬に再構成して最終濃度0.5mg/mLにし、ER-1が完全に溶解していることを確認する。
- サーフェスの活性化
- 50 μLのER-1溶液をチップの両方のチャネルに静かに押し込みます(図1A)。
- アスピレーターを使用して、チップの表面から余分なER-1溶液を除去します。
- チップを検査して、すべてのチップがER-1ソリューションを受け取っていることを確認します。気泡の場合は、気泡が完全に除去されるまでER-1溶液をさらに導入してください。
- UVランプチャンバー(材料表)内のチップを15分間インキュベートします。UVランプがコンシステント設定に設定されていることを確認します。
- ER-1活性化チップをバイオセーフティキャビネット(BSC)に戻します。両方のチャネルからER-1ソリューションを吸引します。ER-1溶液の残留物を200μLのER-2で洗浄する。
- 200 μL の滅菌ダルベッコのリン酸緩衝生理食塩水 (DBPS) をチャネル (材料表) に通し、次のステップまで DBPS をチャネルに残します。
- 細胞外マトリックス(ECM)および膜コーティングの調製
- ECMコンポーネントのストックソリューションの調製
- 滅菌細胞培養グレードの水(材料表)を使用して、コラーゲンIV(材料表)およびフィブロネクチン(材料表)を最終濃度1mg / mLに再構成する。アリコートを用意し、使用時まで-20°Cで保管してください。
- 膜コーティング用ECM作業溶液の調製
- コーティングする12チップごとに、上部および下部チャネル用に各ECM溶液1.5mLを調製する。ECMソリューションは、常に使用直前に準備する必要があります。
- 上部チャネルでは、コラーゲンIVと可溶化基底膜マトリックス(BMM)(材料表)を滅菌低温DBPSにそれぞれ200 μg/mLおよび100 μg/mLで混合します。下部チャネルについては、コラーゲンIVとフィブロネクチンを滅菌コールドDPBSにそれぞれ200μg/mLおよび30μg/mLで混合します。
- チップのECMコーティング
- チップの両方のチャネルからDBPSを吸引し、各チャネルに適したECM動作ソリューションと交換します(図1A)。
- 各チップを調べて、コーティング溶液を受け取ったことを確認します。気泡の場合は、すべての気泡が完全に除去されるまで、より多くのコーティング溶液を押してください。
- 滅菌DPBSをチップクレードルに加え、チップを入れたシャーレを37°Cのインキュベーターに入れます。ECMタンパク質が活性化PDMS膜とイオン結合を形成できるように一晩インキュベートする。所望により、細胞は、チップのコーティング後2時間から1日の間、いつでも播種することができる。あるいは、コーティングされたチップを4°Cで一晩保存し、その後37°Cで一晩インキュベートしてチップを播種することもできます。
- ECMコンポーネントのストックソリューションの調製
5. チップ下部チャネルへの腸内血管内皮細胞(HIMECs)の播種
注:小腸および結腸HIMECは、それぞれ十二指腸および結腸チップの下部チャネルに播種される。
- チップの準備
- ECMコーティングされたチップをBSCに移します。チップの両方のチャネルからECMコーティングを穏やかに吸引し、次に、それぞれ200μLのオルガノイド増殖培地および内皮細胞増殖培地で両方のチャネルを洗浄する。
- 洗浄したチップを37°Cのインキュベーターに保管し、内皮細胞の播種を進めます。
- 内皮細胞を採取する
- HIMEC培養フラスコをBSCに持ち込み、滅菌DPBSを使用して洗浄する。
- フラスコに3mLの解離溶液を加え、37°Cのインキュベーターに2分間入れて、細胞を完全に剥離できるようにします。
- 細胞を15 mLの円錐形チューブに集め、10 mLに達するまで内皮細胞増殖培地を加えます。細胞計数用の細胞懸濁液のサンプル15〜20μL。150 x g で5分間遠心分離する。
- 上清を慎重に吸引し、内皮細胞増殖培地中でHIMECを8-10 x106 cells/mLの密度に再懸濁します。
- チップの底チャネルに内皮細胞をシードする
- チップの入ったシャーレをBSCに持ってきて、1,000 μLのピペットを使用して下部チャンネルからすべてのメディアを静かに取り出します。
- 10 ~ 15 μL の HIMEC 懸濁液をチップの底部チャネルに導入します。シード直後にチップを検査して、最適なシーディング密度(カバレッジの80%~90%)とチャネル内の均一な細胞分布を確認します(図1D)。播種密度が予想よりも高いか低いか、または不均一な場合は、200μLの内皮細胞増殖培地でチャネル2xを洗浄し、播種手順を繰り返します。
- 6つのチップの各バッチを播種した直後にシャーレを反転させて、PDMS膜の底面側への内皮細胞付着を可能にする。シャーレを37°Cのインキュベーターに30分~1時間、または下部チャネルのHIMECが膜に付着するまで入れます(図1D)。
- チップを洗う
- 200 μL の内皮細胞増殖培地を下部チャネルの入口に静かに押し込み、付着していない細胞を除去し、培地中の栄養素を補充します。
- 5 μM CHIR99021 および 10 μM Y-27632 を添加した 200 μL のオルガノイド増殖培地で、上部チャネルに付着しなかった細胞を洗い流します。
- チップを37°Cのインキュベーターに入れ、上皮細胞の播種に進みます。
6. チップの上部チャネルにおけるオルガノイド断片の播種
注:様々な腸領域の生検から単離されたオルガノイドは、腸チップ7内で培養することができる。ヒト腸管陰窩の単離およびオルガノイド培養物の確立のために藤井らに記載されている手順に従う22。ここで、十二指腸および結腸オルガノイドは、それぞれ十二指腸および結腸チップを生成するために使用される。オルガノイドの形成と増殖におけるバッチ間およびドナー間の変動性が高いことを考えると、オルガノイド浮遊培養(24ウェルプレート形式)における細胞密度のパイロット評価を実行して、800万細胞/mLの最適な播種密度を達成することが示唆される。
- 静的オルガノイド培養の細胞数/ウェルのパイロット評価。
注:以下の手順は、チップ播種に必要なオルガノイド浮遊培養のウェル数を決定することのみを目的としています。得られた単一細胞は、チップシーディングに使用しないでください。- オルガノイド培養プレートの3つのウェルから上清を慎重に吸引する。氷冷BMM解離溶液(材料表)を各ウェルに500μL加え、プラスチックスクレーパーを使用して可溶化BMMをプラスチックから剥離する。
- オルガノイド懸濁液を、氷冷 1,000 μL ピペットを使用して滅菌低タンパク質結合円錐管に集めます。氷上で60分間インキュベートし、チューブを静かに振って15分ごとに混合する。300 x g で 4°C で 5 分間遠心分離します。
- 上清を吸引し、2mLのトリプシンを加える。37°Cで30分間インキュベートしてオルガノイドを単一細胞レベルまで消化し、10mLの完全なオルガノイド増殖培地を加えて酵素反応を停止します。300 x g で 4°C で 5 分間遠心分離します。
- 細胞ペレットを1mLの完全なオルガノイド増殖培地に再懸濁し、標準的な方法に従って血球計数器を用いて細胞の総数をカウントする。
- オルガノイド断片の調製およびチップへの播種
メモ:次の手順を使用して、チップの上部チャネルに十二指腸オルガノイドまたは結腸オルガノイドを播種することができます。in vivo関連3D細胞アーキテクチャを有する上皮単分子層の確立は、フロー15,23の存在およびオルガノイド断片の播種の成功に左右される。- 静的オルガノイド培養のウェル数から培地を慎重に吸引し、ステップ6.1で決定したように、最終的に800万細胞/mLの播種密度を達成するのに十分である。氷冷BMM解離溶液500μLを各ウェルに加える。
- 可溶化BMMをプラスチックスクレーパーまたは1,000μLピペットを使用してウェルの表面から取り外します。懸濁液を15mLの低タンパク質結合円錐管に集める。
- 懸濁液を氷上に60分間保存し、チューブを静かに振盪して15分ごとに混合する。300 x g で4°Cで5分間遠心分離に進みます。 明確に定義されたオルガノイドペレットは、遠心分離後に見えるべきである。細胞ペレットの上方に透明ゲル層(可溶化BMMの残渣)が観察される場合(図1B)、以下のステップに進む。
- 上清と細胞ペレットを混合し、等量のBMM解離溶液をチューブに加える。氷上でさらに10分間穏やかに混合して保存し、300 x g で4°Cで5分間遠心分離に進みます。
- 必要に応じて、可溶化BMM残基が存在しないまでステップ6.2.3.1を繰り返します。
- 上清を捨て、オルガノイドペレットをオルガノイド消化液で再懸濁する(ステップ1.5参照)。十分な量のオルガノイド消化溶液を使用して、ペレットの完全な浸漬を確実にする。2mLの溶液は、約2,400〜12,000個の中型オルガノイドに適している(図1D、播種後)。37°Cで1〜3分間インキュベートする。
- 高度なDMEM/F-12をチューブに加え、酵素反応を停止します。使用した消化液の4倍の容量を使用してください。300 x g で 4°C で 5 分間遠心分離します。
- 上清を吸引し、オルガノイド断片ペレットを5 μM CHIR99021および10 μM Y-27632を添加した完全なオルガノイド増殖培地に再懸濁して、800万細胞/mLを達成します。懸濁液の360 μLアリコートを滅菌1.5 mL低タンパク質結合チューブに調製して、壁への付着による細胞密度の低下を防ぎます。
- コーティングされたチップの上部チャネルから媒体を取り外します。各チップの上部チャネルに30μLの細胞懸濁液を加える。チップを37°Cのインキュベーターで一晩インキュベートし、オルガノイドフラグメントがECMコーティング膜に付着できるようにします(図1D)。
7.腸チップの動的培養 - 流れと蠕動運動の開始、および維持
- 培地調製と脱気
- チップを通る一定の層流を維持するには、媒体の温度を室温に平衡化させ、真空ポンプとPVDFフィルター円錐管を使用して真空駆動ろ過を10分間行います(メディア脱気)。
- ポータブルモジュールのプライミング
注:ポータブルモジュールは、チップと培養モジュールの間のインターフェースとして機能するリザーバであり、培地のサンプリングと投与を繰り返すことができます。- BSCでポータブルモジュールを開き、ポータブルモジュールの位置合わせ専用のコンテナである培養モジュールトレイに置きます。
- 5 μM CHIR99021 および 10 μM Y-27632 を添加した平衡化済み完全オルガノイド増殖培地 3 mL を上部入口リザーバーに、3 mL の事前平衡化内皮細胞増殖培地を下部入口リザーバーに加えます(図1C)。それぞれの出口リザーバに同じ培地を300μL加える。
- トレイを37°Cのインキュベーターに持ってきて、培養モジュールにスライドさせます(図1C)。カルチャ モジュールの画面上のコントロールを使用して、"プライム サイクル" (1 分の長さ) を実行します。ステータスバーに「準備完了」と表示されると、プライムサイクルが完了します。プライムサイクルを繰り返して、チップを正常に接続するのに十分な液滴が形成されていることを確認します。
- すべてのポータブルモジュールがプライミングされ、メディア液滴が見えることを確認します。
- フローの紹介
注:フローは通常、オルガノイド断片を播種してから24時間後に開始され、腸上皮細胞が膜にしっかりと付着することを可能にする。- 播種したチップの両方のチャネルを200 μLのそれぞれの培地で洗浄し、気泡または細胞破片を除去します。洗浄後、ポートにメディアの小さな液滴を残します。チップキャリアをノートブックモジュールに差し込みます(図1C)。
- ポータブルモジュールをトレイの上に置き、次に培養モジュールに入れます。培養モジュールの画面上のコントロールを使用して、適切なオルガンチップ培養条件(流速およびストレッチ)をプログラムします。
メモ: 標準的な十二指腸および大腸チップの培養条件では、上部チャネルと下部チャネルの両方で、流量をそれぞれ 30 μL/h15 および 60 μL/h16 に設定します。ただし、各チャンネルの流量は独立して制御され、0 ~ 1,000 μL/h の範囲で設定できます。シリンジポンプまたはペリスタルティックポンプを使用して、ここで紹介する培養モジュールの代わりに、マイクロ流体チップに層流を導入することができます。しかし、チューブとコネクタを使用したチップとポンプ間の信頼性の高い流体接続の確立は、複数のチップの同時灌流が必要な場合、技術的に困難な場合があります。 - ポータブルモジュールとチップ内の培養培地を加圧して気泡の核生成を防ぐ「調節サイクル」(長さ2時間)を開始します。プログラムされた条件は、規制サイクルの完了後に再開されます。
- メディアの変更
- 両方のチャネルに新鮮な培地を用意し、2 mLの新鮮な培地を入口リザーバに添加して48時間ごとに補充します(図1C)。
- 培養モジュールを一時停止し、トレイをBSCに持参します。すべての貯水池で培地を吸引し、新鮮な培地を補充します。トレイを元に戻し、フローを再開します。
- ストレッチの導入
注:周期株を塗布する前に、細胞が100%コンフルエントまで成長できるようにします。ストレッチは、典型的には、流体培養の開始後3日または48時間後に播種後3日目に導入される。0.2または0.15Hzの周波数で2%環状株が、十二指腸11 および結腸24腸チップに対して、それぞれ、初期24 時間にわたって適用される。その後、腸チップ培養の残りの期間を10%にさらに増加させ、 インビボで 腸上皮細胞が経験する環状株によく似ています(図1D)25。培養モジュールは、2%〜12%の環状株および最大0.4Hzの周波数の適用をサポートできます。- 進行中の流体培養にストレッチを導入するには、培養モジュールを一時停止します。画面上のコントロールを使用して、ストレッチ設定を 2% ストレッチ、0.2 Hz、または 0.15 Hz 周波数に変更し、培養モジュールを再起動します。
- 24 時間経過したら、手順 7.5.1 を繰り返して、10% のストレッチ、0.2 Hz、または 0.15 Hz の周波数を適用します。
8. 十二指腸チップ内のプロトタイプCYP誘導物質を用いたCYP450誘導
注:シトクロムP450(CYP450)誘導アッセイは、試験化合物が特定のCYP450酵素のmRNAレベルおよび/または触媒活性を増加させるかどうかを評価することを可能にする。ここでは、業界標準およびレギュレーター推奨イン ビトロ CYP誘導物質、リファンピシン(RIF)および1,2-ジヒドロキシビタミンD3(VD3)によるCYP3A4誘導の評価のためのプロトコルについて記載する。提示された方法は、ヒト腸組織においてCYP450の異なるアイソフォームを誘導する様々な試験化合物の可能性を同定するために使用され得る。プライマーおよびプローブ基質の特定のセットは、評価される各酵素アイソフォームについて選択する必要があるであろう。
- CYP誘導物質への曝露
- 滅菌DMSOを使用して、20 mM RIF、100 mM VD3、および200 mM テストステロン(材料表)のストック溶液を調製します。
注意: テストステロンは、スケジュールIIIの規制物質です。取り扱い中は規制上の手順に従ってください。 - ストック溶液を完全なオルガノイド増殖培地および内皮細胞増殖培地で希釈して、20μM RIF、100nmol/LのVD3を達成することによって、CYP誘導剤を含む投薬培地を調製する。DMSOの0.1%を達成するために、それぞれの媒体中のDMSOを希釈することによって、車両制御を準備する。
- 培養モジュールを一時停止し、トレイをBSCに持参します。すべての入口リザーバ内の培地を、インデューサーまたはビヒクルコントロールを含む2mLの投薬培地と交換します。ポータブルモジュールを培養モジュールに戻して、30 μL/h でフローを再開します。
- 24時間後、培地を誘導溶液と交換し、ステップ8.1.2-8.1.3を繰り返します。誘導溶液は毎日新鮮に調製し、実験の過程で24時間ごとに補充する必要があり、これは典型的には48〜72時間の長さである。
- 滅菌DMSOを使用して、20 mM RIF、100 mM VD3、および200 mM テストステロン(材料表)のストック溶液を調製します。
- プロトタイプ基質(テストステロン)とのインキュベーション
- 収穫当日に、テストステロンのプローブ基質溶液を対応するインデューサーとともにAdvanced DMEM/F12に調製し、最終濃度200μMを得ます。
- トレイをBSCに持ってきて、すべてのリザーバから投薬媒体を吸引します。上部および下部の入口リザーバを洗浄し、それぞれ温かいアドバンスト DMEM/F12 培地および内皮細胞増殖培地と交換します。
- リザーバから洗浄媒体を取り出し、ステップ8.2.1で調製した1mLのプローブ基質溶液と交換する。チップを1,000 μL/hの高流量で5分間灌流し、上部と下部の両方の出口リザーバを吸引します。チップを培養モジュールに戻し、300 μL/h の一定の流れの下で 1 時間インキュベートします。
- データ解析
- LCMS分析のためのサンプル収集
- 予め標識された1.5mLチューブにアセトニトリルと0.1%ギ酸を含む停止溶液200μLをアリコートし、氷上に置く。LCMS停止溶液の組成は、分析する必要がある基質に基づいて変化し得る。
- 1時間の治療が完了したら、流れを止め、トレイをBSCに戻します。上部出口リザーバから100 μLの廃液を回収し、停止溶液を含む対応するチューブに追加します(図2A)。チューブを直ちにドライアイスの上に置きます。分析に進む前に、サンプルを-80°Cに保管してください。
- HPLCまたはLC-MS/MS技術を使用してサンプルを抽出し、分析し、代謝産物-6β-ヒドロキシテストステロン(6β-OH-T)の形成をモニタリングします。CYP酵素活性は、pmol/min/mgタンパク質として表すことができ、pmolは反応中に形成される代謝産物(6β-OH-T)の量を指す。チップ当たりの総タンパク質量(タンパク質;mg)は、ステップ8.3.2に記載されるブラッドフォードアッセイを実行することによって決定される。

フォールド誘導活性は、CYP活性(誘導)/CYP活性(ビヒクル)によって計算される。 - mRNA 分析のためにサンプルを収集する場合は、ステップ 8.3.3 を参照してください。
- タンパク質発現解析のための細胞の溶解
注:オンチップの細胞からのタンパク質抽出は、プロテアーゼおよびホスファターゼ阻害剤を添加したタンパク質溶解バッファーを使用して行われます(材料表)。抽出されたタンパク質は、次いで、ブラッドフォードアッセイを用いて定量され、下流分析に使用される。- チップをポータブルモジュールから取り外し、ペトリ皿に入れます。両方のチャンネルを200μLの滅菌DPBSで洗浄します。
- 下部チャンネルの出口を 200 μL のフィルターピペットチップで塞ぎます。50 μLの解離溶液を底部チャネルを通して灌流し、室温で2分間インキュベートする。
- 内皮細胞の完全な剥離を確認するために検査する。ピペットを1〜2回上下させ、解離溶液をチャネルから取り除いた。洗浄を繰り返します。
- 上部チャンネルの出口を 200 μL のフィルターピペットチップで塞ぎます。75 μL のタンパク質溶解バッファーをトップチャネルに灌流します。ピペットチップを挿入したままにし、上部チャネル入口を塞ぎ、室温で5分間インキュベートする。ピペットを5〜10回上下させ、予め標識された1.5mLチューブに細胞溶解物を回収する。
- ステップ 8.3.2.4 を繰り返します。細胞の完全な剥離が観察されるまで。細胞溶解物を同じ1.5 mLチューブに集め、分析まで-80°Cで保存します。
- 標準的な方法に従ってタンパク質画分を抽出し、ブラッドフォードアッセイ(材料表)を使用して総タンパク質を定量する。
- 遺伝子発現解析のための細胞の溶解
注:RNA抽出用のオンチップ細胞溶解は、0.1%2-メルカプトエタノールを添加したRNA溶解バッファーを使用して達成できます(材料表)。また、NGSおよびマイクロアレイ解析に適した高品質のRNAを高収率で必要とする場合は、フェノールベースのRNA溶解バッファーを使用することもできます。- ステップ8.3.2.1から8.3.2.2に従って、腸チップを溶解用に準備します。
- 200 μL のフィルターピペットチップを使用して、上部チャネルの出口をふさいでください。150 μL の RNA 溶解バッファーをトップチャネルに灌流します。ピペットチップを挿入したままにして、上部チャンネルの入口を塞ぎます。室温で2分間インキュベートする。フェノール系RNA溶解バッファーを使用した溶解には、350 μLの試薬を使用してください。
- ピペットを5〜10回上下させ、予め標識された1.5mLチューブに細胞溶解物を集める。別の150 μLのRNA溶解バッファーでステップを繰り返し、収集します。細胞溶解液を分析まで-80°Cで保存する。その後のRNAシーケンシング解析の場合は、溶解後1ヶ月以内に解析を進めてください。
- RNA精製キットを用いて細胞溶解物から全RNAを抽出する。
- 逆転写酵素キットを用いてcDNAに逆転写し、リアルタイムPCRサイクラーと適切なプライマーおよびバッファーを用いてリアルタイムPCRを行う。2-ΔΔCt 法を用いて結果を定量化する。
- LCMS分析のためのサンプル収集
9. 結腸チップ中の炎症誘発性サイトカインを用いた上皮バリアの破壊
注:このプロトコルは、サイトカインインターフェロンγ(IFNγ)26、27、28、29による腸上皮関門の破壊を記載している。サイトカインは、腸上皮細胞上のIFNγ受容体の基底側側発現を与えられた結腸チップの底チャネルに投与される。 炎症誘発刺激は、Pアプリが0.5 x 10-6 cm/s未満に安定するとすぐに、培養5日目にチップに導入されます。同様の投薬レジメンを、他の炎症誘発性サイトカインおよびバリア破壊剤に使用することができる。
- IFNγによる刺激
- 滅菌細胞培養水にIFNγ(材料表)の原液100μg/mLを調製した。実験中、原液を-80°Cで保存します。各実験では、常にIFNγの新鮮なストックを使用し、3回以上の凍結および融解サイクルを避けてください。
- 脱気した内皮細胞増殖培地で原液を希釈してIFNγ投与液を調製し、終濃度10~100ng/mLとする。
- トレイをBSCに持ち込み、底チャネル入口リザーバから培地を取り出し、3mLのIFNγ含有培地と交換します。IFNγ投与培地を毎日リフレッシュする。
- トレイを培養モジュールに入れ、チップを1,000 μL/hの高流速で5分間灌流してIFNγ処理を開始します。流速を60 μL/hに戻して流体培養を続けます。
- データ解析
- 上皮バリア機能の評価。上皮の見かけの透過性(Papp)、またはバリア機能は、IFNγによる培養後処理の様々な時点で、チャネルの入口および出口の両方のリザーバの流出培地において測定することができる。蛍光トレーサーは、Pアプリの評価の4時間前にトップチャネルオルガノイド増殖培地に添加する必要があります。典型的には、3kDaデキストランカスケードブルーが蛍光トレーサーとして使用され、24時間前に培地中に添加される。
- 培養モジュールを一時停止し、トレイをBSCに持参します。
- ラベルを付け、1ウェルあたり100 μLのDPBSを含む96ウェル黒壁プレートを作製した。200 μLのマルチチャネルピペットを使用して、すべてのリザーバから50 μLの流出液を収集し、それぞれのウェルに追加します(図2B)。
- 標準曲線を作製するには、100 μg/mLの3 kDaデキストランカスケードブルーを含む培地をDPBSで1:3に希釈します。続いてDPBSで内皮細胞増殖培地の3倍希釈を用いて段階希釈を行う。
- プレートリーダーを用いて375 nm励起および420 nm発光時の蛍光を読み取る。測定されたOD値を使用して、次のように見かけの透磁率(Papp)を計算します。
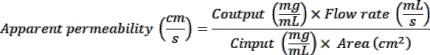
- オンチップの細胞の免疫蛍光染色
- 各チャンネルに200 μLのDPBSを使用して、3回洗浄します。
- 各チャネルに200μLの固定液(DPBS中の4%PFA)を灌流する。室温で15分間インキュベートする。
- 洗浄ステップ 9.2.2.1 を繰り返します。この段階では、洗浄したチップは4°Cで最大7日間保存できます。
- 各チャネルについて、200 μLの透過液(DPBS中の10%正常ロバ血清(NDS)中の0.1% Triton-X 100)を用いて細胞を透過除去する。室温で30分間インキュベートする。洗浄ステップ 9.2.2.1 を繰り返します。
- 各チャネルに 200 μL のブロッキング溶液 (DPBS で 10% NDS) を使用して、チップ上のセルをブロックします。室温で1時間インキュベートする。
- 抗体溶液中の一次抗体(DPBS中の5%NDS)を以下のように希釈する:抗ゾヌラオクルーデンス1(ZO-1)(1:100、上皮タイトジャンクションマーカー)、抗オクルージン(1:100、上皮タイトジャンクションマーカー)、抗クローディン4(1:100、上皮タイトジャンクションマーカー)、抗E-カドヘリン(1:100、上皮付着接合マーカー(材料表)。200 μLの一次抗体溶液を各チャネルを通して灌流し、4°Cで一晩インキュベートする。 洗浄ステップ 9.2.2.1 を繰り返します。
- 二次抗体を抗体溶液(DPBS中の1:300、5%NDS)で希釈する。この溶液の200μLを各チャネルを通して灌流し、室温で2時間インキュベートする。洗浄ステップ 9.2.2.1 を繰り返します。所望により、細胞骨格マーカーであるファロイジンを二次抗体溶液に添加することができる。
- DPBS中で50μg/mLの4',6-ジアミジノ-2-フェニルインドール(DAPI)溶液を調製し、それを使用して各チャネルを通して200μLを灌流する。室温で15分間インキュベートする。洗浄ステップを繰り返します。この時点で、染色されたチップは4°Cで最大14日間保存できます。
- カスパーゼ3切断の評価
- ステップ8.3.2に記載されるように上皮細胞のタンパク質の総量を単離し、定量する。洗浄ステップを省略する 8.3.2.1.サンプルをDPBSで最終濃度400μg/mLに希釈します。
- 製造業者のプロトコールに従ってカスパーゼ3検出キットを用いて総および切断されたカスパーゼ3のレベルを定量する。
- 炎症誘発性サイトカイン分泌の評価
- 結腸チップの両方のチャネルの出口から収集された流出液を使用して、製造業者が提供するプロトコルに従って、分泌された急性期炎症誘発性サイトカインを定量する。V-PLEX血管損傷パネル2ヒトキットの5倍希釈とV-PLEXヒト炎症誘発性パネルIIの2倍希釈を行います。
- 上皮バリア機能の評価。上皮の見かけの透過性(Papp)、またはバリア機能は、IFNγによる培養後処理の様々な時点で、チャネルの入口および出口の両方のリザーバの流出培地において測定することができる。蛍光トレーサーは、Pアプリの評価の4時間前にトップチャネルオルガノイド増殖培地に添加する必要があります。典型的には、3kDaデキストランカスケードブルーが蛍光トレーサーとして使用され、24時間前に培地中に添加される。
結果
図1D は、腸チップ培養のタイムラインを要約し、チップ上に播種する前および播種時の腸内皮細胞およびオルガノイドを示す。さらに、十二指腸チップと結腸チップとの間の明確な形態学的差異を示し、十二指腸チップにおける絨毛様の形成の存在によって強調され、小腸アーキテクチャの代表である。
図3A、Bは、
ディスカッション
臓器オンチップ技術と腸オルガノイドの組み合わせは、ヒトの腸内生理学および病態生理学の正確なモデリングに有望である。ここでは、マイクロ流体デバイスで共培養された生検由来小腸または結腸上皮と腸微小血管内皮細胞を含む腸チップの樹立のためのシンプルで堅牢なステップバイステッププロトコル( 図1に概説)を提供する。このチップベースのヒト腸のシミ...
開示事項
Gauri Kulkarni、Athanasia Apostolou、Lorna Ewart、Carolina Lucchesi、Magdalena Kasendraは、Emulate Inc.の現在または以前の従業員であり、株式を保有する可能性があります。Emulate Inc.は、オルガンチップデバイスを製造する会社であり、この記事に記載されている作業に関連する特許を公開しています。
謝辞
腸生検由来オルガノイドを提供してくれたMark Donowitz教授と、チップ、ポータブル、培養モジュールの科学的なイラストレーションをデザインしてくれたBrett Clairに感謝します。残りの科学イラストはすべてBioRenderを使用して生成されました。
資料
| Name | Company | Catalog Number | Comments |
| small intestine Human Intestinal Microvascular Endothelial Cells | AlphaBioRegen | ALHE15 | 0.5 cells M/ml ; cryopreserved |
| colon Human Intestinal Microvascular Endothelial Cells | AlphaBioRegen | ALHE16 | 0.5 cells M/ml ; cryopreserved |
| Biopsy-derived Human Duodenal Organoids | John Hopkin's University | - | The organoids were provided by Professor Mark Donowitz (Institutional Review Board Number: NA_00038329). |
| Biopsy-derived Human Colonic Organoids | John Hopkin's University | - | The organoids were provided by Professor Mark Donowitz (Institutional Review Board Number: NA_00038329). |
| Zoë CM-1™ Culture Module | Emulate Inc. | - | Culture module |
| Orb-HM1™ Hub Module | Emulate Inc. | - | 5% CO2, vacuum stretch, and power supply |
| Chip-S1™ Stretchable Chip | Emulate Inc. | - | Organ-Chip |
| Pod™ Portable Modules | Emulate Inc. | - | Portable module |
| UV Light Box | Emulate Inc. | - | - |
| Chip Cradle | Emulate Inc. | - | 1 per square culture dish |
| Steriflip®-HV Filters | EMD Millipore | SE1M003M00 | 0.45 μm PVDF filter |
| Square Cell Culture Dish (120 x 120 mm) | VWR | 82051-068 | - |
| Handheld vacuum aspirator | Corning | 4930 | - |
| Aspirating pipettes | Corning / Falcon | 357558 | 2 mL, polystyrene, individually wrapped |
| Aspirating tips | - | Sterile (autoclaved) | |
| Serological pipettes | - | 2 mL, 5 mL, 10 mL, and 25 mL low endotoxin, sterile | |
| Pipette | P20, P200, P1000 and standard multichannel | ||
| Pipette tips | P20, P200, and P1000. | ||
| Conical tubes (Protein LoBind® Tubes) | Eppendorf | 0030122216; 0030122240 | 15 mL, 50 mL tubes |
| Eppendorf Tubes® lo-bind | Eppendorf | 022431081 | 1.5 mL tubes |
| 96 wells black walled plate | - | - | for epithelial permeability analysis |
| Microscope (with camera) | - | - | For bright-field imaging |
| Water bath (or beads) | - | - | Set to 37°C |
| Vacuum set-up | - | - | Minimum pressure: -70 kPa |
| Cell scrapers | Biotium | 220033 | |
| T75 flasks | BD Falcon | 353136 | Cell culture flask |
| Emulate Reagent-1 (ER-1) | Emulate Inc. | - | Chip coating solution |
| Emulate Reagent-2 (ER-2) | Emulate Inc. | - | Chip coating solution |
| Dulbecco’s PBS (DPBS) | Corning | 21-031-CV | 1X |
| Cell Culture Grade Water | Corning | MT25055CV | |
| Trypan blue | Sigma | 93595 | For cell counting |
| TryplE Express | ThermoFisher Scientific | 12604013 | Organoids dissociation and endothelium cells detachment solution |
| Advanced DMEM/F12 | ThermoFisher Scientific | 12634028 | Medium |
| IntestiCult™ Organoid Growth Medium (Human) | Stem Cell technologies | 06010 | Organoid Growth Medium |
| Endothelial Cell Growth Medium MV 2 | Promocell | C-22121 | Endothelial medium |
| Fetal bovine serum (FBS) | Sigma | F4135 | Serum |
| Primocin™ | InvivoGen | ANT-PM-1 | antimicrobial agent |
| Attachment Factor™ | Cell Systems | 4Z0-210 | coating solution for flask |
| Matrigel - Growth Factor Reduced | Corning | 356231 | Solubilized basement membrane matrix |
| Collagen IV | Sigma | C5533 | ECM component |
| Fibronectin | Corning | 356008 | ECM component |
| Y-27632 | Stem Cell technologies | 72304 | organoid media supplement |
| CHIR99021 | Reprocell | 04-0004-10 | organoid media supplement |
| Cell Recovery Solution | Corning | 354253 | Basement mebrane matrix dissociationsolution |
| Bovine Serum Albumin (BSA) | Sigma | A9576 | 30%, Sterile |
| Cell Culture Grade Water | Corning | MT25055CV | Sterile, Water |
| DMSO | Sigma | D2650 | solvent |
| 3KDa Dextran Cascade Blue | Invitrogen | D7132 | 10 mg powder |
| Rifampicin (RIF) | Sigma | Cat# R3501 | CYP inducer |
| Testosterone hydrate | Sigma | T1500 | CYP substrate |
| 1,25-dihyroxy Vitamin D3 (VD3) | Sigma | Cat# D1530 | CYP inducer |
| Acetonitrile with 0.1% (v/v) Formic acid | Sigma | 159002 | LCMS stop solution |
| IFNγ | Peprotech | 300-02 | |
| 4% Paraformaldehyde (PFA) | EMS | 157-4 | Fixative |
| Triton-X 100 | Sigma | T8787 | |
| Normal Donkey Serum (NDS) | Sigma | 566460 | |
| anti-Occludin | ThermoFisher Scientific | 33-1500 | tight junctions marker |
| anti-Claudin 4 | ThermoFisher Scientific | 36-4800 | tight junctions marker |
| anti-E-cadherin | Abcam | ab1416 | epithelial adherens junctions marker |
| anti-VE-cadherin | Abcam | ab33168 | endothelial adherent junctions marker |
| anti- Zonula Occludens 1 (ZO-1) | Thermo Fischer | 339194 | tight junctions marker |
| DAPI | ThermoFisher Scientific | 62248 | nuclear stain |
| 2-mercaptoethanol | Sigma | M6250 | |
| PureLink RNA Mini Kit | Invitrogen | 12183020 | RNA lysis, isolation and purification kit |
| SuperScript™ IV VILO™ Master Mix | Invitrogen | 11756050 | reverse transcriptase kit |
| TaqMan™ Fast Advanced Master Mix | Applied Biosystems | 4444557 | qPCR reagent |
| QuantStudio™ 5 Real-Time PCR System | Applied Biosystems | A28573 | Real-time PCR cycler |
| 18S primer | ThermoFisher Scientific | Hs99999901_s1 | Eukaryotic 18S rRNA |
| CYP3A4 primer | ThermoFisher Scientific | Hs00604506_m1 | Cytochrome family 3 subfamily A member 4 |
| Pierce™ Coomassie Plus (Bradford) Assay Kit | ThermoFisher Scientific | 23236 | Protein quantification kit |
| MSD Tris lysis buffer | Meso Scale Diagnostics | R60TX-3 | Protein lysis buffer |
| Cleaved/Total Caspase-3 Whole Cell Lysate Kit | Meso Scale Diagnostics | K15140D | Caspase 3 detection kit |
| V-PLEX Vascular Injury Panel 2 Human Kit | Meso Scale Diagnostics | K15198D | |
| V-PLEX Human Proinflammatory Panel II (4-Plex) | Meso Scale Diagnostics | K15053D | |
| Zeiss LSM 880 | Zeiss | - | Confocal microscope |
| Zeiss LD plan-Neofluar 20x/0.40 Korr M27 | Zeiss | - | 20X long-distance objective lenses |
| Zeiss AXIOvert.A1 | Zeiss | - | Brightfield microscope |
| Zeiss LD A-Plan 10X/0.25 Ph1 | Zeiss | - | 10X objective lenses |
参考文献
- Fritz, A., et al. Expression of clinically relevant drug-metabolizing enzymes along the human intestine and their correlation to drug transporters and nuclear receptors: An intra-subject analysis. Basic and Clinical Pharmacology and Toxicology. 124 (3), 245-255 (2019).
- Okumura, R., Takeda, K. Maintenance of intestinal homeostasis by mucosal barriers. Inflammation and Regeneration. 38 (1), 1-8 (2018).
- Delgado, M. E., Grabinger, T., Brunner, T. Cell death at the intestinal epithelial front line. FEBS Journal. 283 (14), 2701-2719 (2016).
- Mestas, J., Hughes, C. C. W. Of mice and not men: Differences between mouse and human immunology. The Journal of Immunology. 172 (5), 2731-2738 (2004).
- Sun, H., Chow, E. C. Y., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: Usefulness and limitations. Expert Opinion on Drug Metabolism and Toxicology. 4 (4), 395-411 (2008).
- Yu, H., et al. The contributions of human mini-intestines to the study of intestinal physiology and pathophysiology. Annual Review of Physiology. 79, 291-312 (2017).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470 (7332), 105-110 (2011).
- Durel, J. F., Nerurkar, N. L. Mechanobiology of vertebrate gut morphogenesis. Current Opinion in Genetics and Development. 63, 45-52 (2020).
- Gayer, C. P., Basson, M. D. The effects of mechanical forces on intestinal physiology and pathology. Cellular Signalling. 21 (8), 1237-1244 (2009).
- Xu, Y., et al. Mechanical stimulation activates Piezo1 to promote mucin2 expression in goblet cells. Journal of Gastroenterology and Hepatology (Australia). 36 (11), 3127-3139 (2021).
- Navabi, N., McGuckin, M. A., Lindén, S. K. Gastrointestinal cell lines form polarized epithelia with an adherent mucus layer when cultured in semi-wet interfaces with mechanical stimulation. PLoS One. 8 (7), 68761 (2013).
- Kasendra, M., et al. Development of a primary human Small Intestine-on-a-Chip using biopsy-derived organoids. Scientific Reports. 8 (1), 1-14 (2018).
- Kasendra, M., et al. Duodenum intestine-chip for preclinical drug assessment in a human relevant model. eLife. 9, 50135 (2020).
- Apostolou, A., et al. A novel microphysiological colon platform to decipher mechanisms driving human intestinal permeability. Cellular and Molecular Gastroenterology and Hepatology. 12 (5), 1719-1741 (2021).
- Jalili-Firoozinezhad, S., et al. Author correction: A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nature Biomedical Engineering. 3 (7), 583 (2019).
- Yin, J., et al. Fluid shear stress enhances differentiation of jejunal human enteroids in Intestine-Chip. American Journal of Physiology-Gastrointestinal and Liver Physiology. 320 (3), 258-271 (2021).
- Sontheimer-Phelps, A., et al. Human colon-on-a-chip enables continuous in vitro analysis of colon mucus layer accumulation and physiology. Cellular and Molecular Gastroenterology and Hepatology. 9 (3), 507-526 (2020).
- Tovaglieri, A., et al. Species-specific enhancement of enterohemorrhagic E. coli pathogenesis mediated by microbiome metabolites. Microbiome. 7 (1), 43 (2019).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nature Protocols. 10 (10), 1474-1485 (2015).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Sarna, S. K. Colonic motility: From bench side to bedside. Morgan & Claypool Life Sciences. , (2010).
- Basson, M. D. Paradigms for mechanical signal transduction in the intestinal epithelium - category: Molecular, cell, and developmental biology. Digestion. 68 (4), 217-225 (2003).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. The American Journal of Pathology. 166 (2), 409-419 (2005).
- Nava, P., et al. Interferon-γ regulates intestinal epithelial homeostasis through converging β-Catenin signaling pathways. Immunity. 32 (3), 392-402 (2010).
- Madara, J. L., Stafford, J. Interferon-γ directly affects barrier function of cultured intestinal epithelial monolayers. Journal of Clinical Investigation. 83 (2), 724-727 (1989).
- Bruewer, M., et al. Proinflammatory cytokines disrupt epithelial barrier function by apoptosis-independent mechanisms. The Journal of Immunology. 171 (11), 6164-6172 (2003).
- Jones, S. C., et al. Adhesion molecules in inflammatory bowel disease. Gut. 36 (5), 724-730 (1995).
- Uhlar, C. M., Whitehead, A. S. Serum amyloid A, the major vertebrate acute-phase reactant. European Journal of Biochemistry. 265 (2), 501-523 (1999).
- Pérez-González, C., Ceada, G., Matejčić, M., Trepat, X. Digesting the mechanobiology of the intestinal epithelium. Current Opinion in Genetics & Development. 72, 82-90 (2022).
- In, J., et al. Enterohemorrhagic escherichia coli reduces mucus and intermicrovillar bridges in human stem cell-derived colonoids. Cellular and Molecular Gastroenterology and Hepatology. 2 (1), 48-62 (2016).
- Grassart, A., et al. Bioengineered human organ-on-chip reveals intestinal microenvironment and mechanical forces impacting shigella infection. Cell Host and Microbe. 26 (3), 435-444 (2019).
- Kerns, S. J., et al. Human immunocompetent organ-on-chip platforms allow safety profiling of tumor-targeted t-cell bispecific antibodies. eLife. 10, 67106 (2021).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Ingber, D. E. Reverse engineering human pathophysiology with organs-on-chips. Cell. 164 (6), 1105-1109 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved