Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento de pequeños folículos preantrales del ovario bovino mediante una combinación de fragmentación, homogeneización y filtración en serie
En este artículo
Resumen
Avanzar en el estudio de la foliculogénesis preantral requiere métodos eficientes de aislamiento de folículos de ovarios individuales. Aquí se presenta un protocolo mecánico simplificado para el aislamiento de folículos de ovarios bovinos utilizando un cortador de tejido y homogeneizador. Este método permite la recolección de un gran número de folículos preantrales viables de un solo ovario.
Resumen
Comprender el proceso completo de la foliculogénesis de mamíferos es crucial para mejorar las tecnologías de reproducción asistida en ganado, humanos y especies en peligro de extinción. La investigación se ha limitado principalmente a los folículos preantrales y preantrales grandes debido a la dificultad en el aislamiento de folículos preantrales más pequeños, especialmente en mamíferos grandes como las especies bovinas. Este trabajo presenta un enfoque eficiente para recuperar un gran número de pequeños folículos preantrales de un solo ovario bovino. La corteza de los ovarios bovinos individuales se cortó en cubos de 500 μm usando un picador de tejido y se homogeneizó durante 6 minutos a 9,000-11,000 rpm usando una sonda de 10 mm. Los residuos grandes se separaron del homogeneizado con un paño de queso, seguido de una filtración en serie a través de filtros celulares de 300 μm y 40 μm. El contenido retenido en el colador de 40 μm se enjuagó en una placa de búsqueda, donde se identificaron los folículos y se recogieron en una gota de medio. La viabilidad de los folículos recolectados se probó mediante tinción de azul de tripano. Este método permite el aislamiento de un gran número de pequeños folículos preantrales viables de un solo ovario bovino en aproximadamente 90 minutos. Es importante destacar que este método es completamente mecánico y evita el uso de enzimas para disociar el tejido, lo que puede dañar los folículos. Los folículos obtenidos utilizando este protocolo se pueden utilizar para aplicaciones posteriores, como el aislamiento de ARN para RT-qPCR, la inmunolocalización de proteínas específicas y el cultivo in vitro .
Introducción
Los folículos ováricos son las unidades funcionales del ovario, responsables de la producción del gameto (ovocito), así como de las hormonas críticas para la función reproductiva y la salud en general. Los folículos primordiales se forman en el ovario durante el desarrollo fetal o en el período neonatal dependiendo de la especie1, y constituyen la reserva ovárica de una hembra. El crecimiento folicular comienza con la activación de los folículos primordiales que salen de la piscina de descanso y entran en la fase de crecimiento. La foliculogénesis preantral, que abarca todas las etapas del folículo antes del desarrollo del antro, es un proceso altamente dinámico que requiere cambios morfológicos y metabólicos sincrónicos en el ovocito y las células de la granulosa circundantes, impulsados por una estrecha comunicación entre estos dos tipos celulares 2,3. Los folículos preantrales constituyen la mayoría de las unidades foliculares que se encuentran en el ovario en un momento dado4. Se estima que el desarrollo a través de las etapas preantral de la foliculogénesis es varias semanas más largo que el desarrollo antral 5,6, y este tiempo es necesario para que el ovocito y las células somáticas adquieran la madurez suficiente para entrar en la etapa final de desarrollo (es decir, la etapa antral) y prepararse para la ovulación, la fertilización y el desarrollo embrionario 7,8,9.
Gran parte del conocimiento actual sobre la foliculogénesis preantral ovárica proviene de modelos de ratón10,11,12,13, debido en parte a la facilidad para recuperar un gran número de estos folículos de un ovario más pequeño y menos fibroso. Aunque los informes de aislamiento de un gran número de folículos preantrales de ovarios bovinos datan de aproximadamente 30 años14, una comprensión más completa sobre los procesos que regulan el desarrollo de estos folículos en etapa temprana ha permanecido sin realizar, en gran parte debido a la falta de métodos optimizados, eficientes y repetibles para recuperar un número suficiente de folículos preantrales viables, particularmente en las primeras etapas de desarrollo. Con el creciente interés en preservar la reserva ovárica para su uso futuro en reproducción asistida en humanos, las vacas se convierten en un modelo atractivo debido a su estructura ovárica más similar15. Sin embargo, el ovario bovino es marcadamente más rico en colágeno en comparación con el ovario del ratón16, lo que hace que el aislamiento mecánico utilizando métodos descritos para el ratón sea muy ineficiente. Los esfuerzos para ampliar las técnicas de preservación de la fertilidad incluyen el crecimiento completo in vitro de los folículos preantrales hasta la etapa antral, seguido de la maduración in vitro (MIV) de los ovocitos adjuntos, la fertilización in vitro (FIV) y la producción y transferencia de embriones17. Hasta ahora, todo este proceso solo se ha logrado en ratones18. En bovinos, el progreso hacia el crecimiento folicular in vitro se limita a unos pocos informes con etapas foliculares variables al inicio del cultivo, así como duración variable del cultivo entre los protocolos17,19.
Los métodos descritos en la literatura para la recolección de folículos preantrales del ovario bovino han utilizado principalmente técnicas mecánicas y enzimáticas, aisladas o en combinación 2,14,17,20. El primer informe de un protocolo para el aislamiento del folículo preantral bovino utilizó un homogeneizador tisular y filtración seriada para procesar ovarios enteros20. Este estudio fue seguido por informes que combinaron procedimientos mecánicos y enzimáticos que utilizaron colagenasa14. Un tema recurrente cuando se utiliza colagenasa para digerir el tejido ovárico es el riesgo potencial de daño de la membrana basal folicular, que puede comprometer la viabilidad del folículo 14,21,22,23. Por lo tanto, se han empleado diferentes combinaciones de métodos mecánicos, como el uso de un picador de tejidos y pipeteo repetido o un picador de tejidos combinado con homogeneización20,24,25,26. Otra técnica mecánica que se ha descrito utiliza agujas para diseccionar folículos preantrales directamente del tejido ovárico, lo que es especialmente útil para aislar folículos secundarios más grandes (>200 μm). Sin embargo, este proceso requiere mucho tiempo, es ineficiente para aislar folículos preantrales más pequeños y depende del conjunto de habilidades cuando se intenta en ovarios bovinos 19,27,28.
Aprovechando las diferentes técnicas descritas en la literatura, este protocolo tuvo como objetivo optimizar el aislamiento de folículos preantrales de ovarios bovinos individuales de una manera simple, consistente y eficiente que evite la incubación en soluciones enzimáticas. La mejora de los métodos para aislar los folículos preantrales brindará la oportunidad de mejorar la comprensión de esta etapa de la foliculogénesis y permitirá el desarrollo de sistemas de cultivo efectivos para desarrollar folículos preantrales hasta la etapa antral. Los procedimientos detallados descritos en este documento para el aislamiento de folículos preantrales de un mamífero grande como la especie bovina serán vitales para los investigadores que buscan estudiar la foliculogénesis temprana en una especie no murina que sea traducible a los humanos.
Protocolo
Los ovarios bovinos (Bos taurus) se obtuvieron de un matadero local y se transportaron al laboratorio dentro de las 6 h posteriores a la recolección. Debido a la gran cantidad de animales procesados en la instalación, se desconoce la edad, la raza y la etapa del ciclo estral de los animales. Debido a que no se utilizaron animales vivos en estos experimentos, no se requirió un protocolo aprobado de cuidado y uso de animales.
1. Preparación de equipos y reactivos
- Cubra una sección de 2 pies de ancho de un banco de laboratorio con papel de banco.
- Obtener un mango de bisturí, una hoja de bisturí estéril, hemostático, un par de pinzas de disección, una jeringa luer-lock de 20 ml, una aguja de 18 G, dos vasos de precipitados de 200 ml, un matraz Erlenmeyer de 500 ml, un embudo de plástico de 104 mm de diámetro, una tabla de cortar de plástico, una capa de estopilla de 22 cm2 (la gasa se puede esterilizar en autoclave antes de su uso) por ovario que se esté procesando, un filtro de células de 300 μm y un filtro de células de 40 μm (consulte la Tabla de materiales).
- Transfiera todo el equipo al papel de banco.
- Use el hemostático para colocar la hoja de bisturí en el mango del bisturí. Alinee la base angular de la hoja con el indicador en ángulo del mango y, a continuación, deslice la hoja en la ranura del mango.
- Colocar el embudo en el erlenmeyer y cubrir la abertura del embudo con la gasa.
- Coloque un tubo cónico de 50 ml por ovario para procesarlo en un baño de agua o perlas a 38.5 ° C.
- Coloque una placa de Petri cuadrada de 100 mm x 15 mm por ovario que se esté procesando en un calentador de portaobjetos ajustado a 38,5 °C.
- Agregue 10 ml de penicilina-estreptomicina (PenStrep; 10,000 U/ml de penicilina y 10,000 μg/ml de estreptomicina) a 1 L de 1x solución salina tamponada con fosfato (PBS). Caliente el PBS + PenStrep en un baño de agua o perlas a 38,5 °C al menos 2 h antes del procesamiento del ovario.
NOTA: La solución PBS + PenStrep es imprescindible para lavar los ovarios cuando se cultivarán folículos aislados, y todavía se recomienda para cualquier experimento posterior para mitigar la contaminación microbiana. - Para recolectar el filtrado de ovario procesado, use medio de lavado de folículos (FWM) que consiste en TCM199 con sales de Hank (consulte la Tabla de materiales) que contiene 3 mg / ml de albúmina sérica bovina (BSA), 25 mM de tampón HEPES, 100 UI de penicilina / 100 μg / ml de estreptomicina, 1 mM de piruvato de sodio (NaPyr) y 100 nM de aminoácidos no esenciales (NEAA).
- Transfiera TCM199 estéril, una botella de 250 ml y un cilindro graduado de 100 ml a un gabinete de bioseguridad (BSC). Transfiera 194 ml de TCM199 a la botella.
- Retire el vaso de precipitados de TCM199 del BSC y llévelo a una placa de agitación. Agregue 600 mg de BSA, 1.19 g de tampón HEPES y una barra de agitación esterilizada en autoclave a la botella y revuelva hasta que se disuelva.
- Una vez que el tampón BSA y HEPES se hayan disuelto completamente, agregue 1 N hidróxido de sodio (NaOH) al medio hasta que alcance un pH de 7.6-7.8, medido por un medidor de pH.
- Limpie la botella de mediano, un dispositivo de filtración al vacío, cuatro tubos cónicos de 50 ml y las botellas de PenStrep, NaPyr y NEAA con etanol al 70% antes de transferirlo al BSC.
- Agregue 2 ml de PenStrep (10,000 U/ml de penicilina y 10,000 μg/ml de estreptomicina), 100 mM de NaPyr y 100x NEAA al frasco de TCM199 + 3 mg/ml BSA + 25 mM de HEPES. Filtrar estéril el medio final y alícuota en los tubos cónicos de 50 ml. Conservar el medio a 4 °C durante un máximo de 2 semanas.
- Calentar un tubo cónico de 50 ml de medio por cada dos ovarios en un baño de perlas ajustado a 38.5 °C al menos 1 h antes del procesamiento del ovario.
2. Configuración del cortador de tejidos
- Asegúrese de que el cortador de pañuelos (consulte Tabla de materiales) esté enchufado y encendido.
- Ajuste el grosor de la rebanada a 500 μm, la perilla de control de fuerza de la cuchilla a 20° y la perilla de control de velocidad a 90° según las especificaciones del fabricante.
- Inserte una placa de Petri de plástico de 60 mm en el soporte de la placa e inserte el soporte de la placa en su escenario.
- Levante el brazo de corte tan alto como sea posible girando la perilla de operación manual en el sentido de las agujas del reloj.
- Con pinzas, coloque una cuchilla de afeitar de doble filo (consulte Tabla de materiales) en el tornillo insertado en el brazo de cortar. Coloque el cierre de la cuchilla sobre la cuchilla y asegúrelo con la arandela y la tuerca. Deja la tuerca un cuarto suelta.
- Gire la perilla de operación manual hasta que el brazo de corte encaje la cuchilla sobre la placa de Petri. Apriete la tuerca el resto del camino con el descabellado.
- Levante el brazo de corte tan alto como sea posible usando la perilla de operación manual. Mueva la perilla de liberación de la mesa completamente hacia la izquierda hasta que encaje en su lugar.
3. Preparación de los ovarios
- Transfiera los ovarios en el laboratorio a PBS + PenStrep estéril caliente (38,5 °C).
NOTA: Se recomienda procesar los ovarios para el aislamiento del folículo tan pronto como sea posible después de la extracción del animal. En este protocolo, los ovarios se procesaron dentro de las 6 h posteriores a la recolección. Los ovarios se transportaron desde el matadero hasta el laboratorio en termos que contenían solución salina estéril al 0,9% a aproximadamente 38,5 °C. - Si es posible, seleccione ovarios pequeños (≤ 4 cm x 3 cm x 3 cm) que contengan folículos antrales pequeños (3-5 mm), sin folículos antrales grandes (≥8 mm) y sin cuerpo lúteo prominente (Figura 1). Estos criterios se recomiendan para garantizar que se incluya una cantidad mínima de restos no foliculares, como células estromales y matriz extracelular, en la placa cuadrada resultante que contiene folículos aislados.
NOTA: Los folículos antrales se pueden identificar como estructuras vesiculares esféricas llenas de líquido en la superficie del ovario. Los cuerpos lúteos se pueden identificar como estructuras rígidas rojas, naranjas o amarillas que sobresalen de la superficie del ovario. - Use tijeras para eliminar cualquier exceso de tejido conectivo y grasa de los ovarios.
- Lave los ovarios durante 30 s en etanol al 70% en un vaso de precipitados.
- Lave los ovarios 3 veces durante 2 minutos cada uno en vasos de precipitados de PBS + PenStrep tibios (38.5 ° C), usando PBS fresco + PenStrep para cada lavado.
- Mantenga los ovarios en PBS + PenStrep calientes (38.5 °C) hasta que estén listos para su procesamiento.
NOTA: La distancia entre el laboratorio y la fuente del ovario puede ser variable. Por lo tanto, es importante completar el protocolo de manera oportuna para garantizar el mantenimiento de la viabilidad folicular.
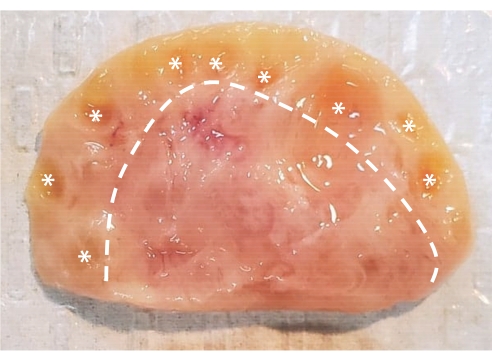
Figura 1: Anatomía del ovario bovino. El ovario bovino consta de dos regiones principales encerradas en una capa epitelial. La corteza, compuesta por el tejido a la izquierda de la línea discontinua, contiene folículos ováricos desde la etapa primordial hasta la etapa antral. Los folículos preantrales son demasiado pequeños para verlos a simple vista; Los folículos antrales están marcados con asteriscos. La médula, compuesta por el tejido a la derecha de la línea discontinua, contiene vasos sanguíneos, vasos linfáticos y nervios. Haga clic aquí para ver una versión más grande de esta figura.
4. Procedimiento de corte
NOTA: Solo procese un ovario a la vez. Procese los ovarios rápidamente para evitar disminuciones de temperatura, lo que puede afectar la viabilidad del folículo.
- Transfiera un ovario a la tabla de cortar en el papel de banco (Figura 2A) y prepare el cortador de tejidos (Figura 2B).
- Usando fórceps y un bisturí, corte el ovario por la mitad y retire la médula de cada mitad, dejando solo la corteza a un grosor de aproximadamente 1 mm como se muestra en la Figura 2C.
- Corte el ovario por la mitad longitudinalmente desde un sitio de unión del ligamento hasta el sitio de unión opuesto.
- Mantenga una mitad del ovario en la tabla de cortar para ser procesada y vuelva a colocar la otra mitad del ovario en PBS + PenStrep caliente (38.5 ° C).
- Con la médula expuesta hacia arriba, corte a lo largo de la curvatura del ovario aproximadamente a 2 mm de distancia de la superficie del ovario sin cortar a través de la corteza.
- Use la rebanada a lo largo de la curvatura del ovario como guía para profundizar la rebanada, aún siguiendo la curvatura del ovario para separar la corteza de la médula.
- Diseccionar y desechar cualquier cuerpo lúteo del ovario cortando a lo largo del borde del cuerpo lúteo.
- Voltea el ovario hasta la mitad para que el epitelio mire hacia arriba y usa el bisturí para terminar de cortar la médula lejos de la corteza. Recorte cualquier tejido conectivo blanco restante alrededor del borde de la pieza del ovario que estaba conectada a los ligamentos.
- Una vez que se extirpa la mayor parte de la médula, use el bisturí para cortar la corteza a aproximadamente 1 mm de grosor. Manipule el bisturí con pequeños movimientos de ida y vuelta para afeitar el resto de la médula.
NOTA: La médula es la porción interna del ovario que contiene vasos sanguíneos grandes. La corteza es la porción externa del ovario, que se encuentra directamente debajo del epitelio superficial más externo. La corteza tiene aproximadamente 1 mm de espesor en el ovario bovino, y por lo tanto cortar el ovario a un grosor de 1 mm eliminará la médula.
- Corte la corteza en trozos de no más de 2,5 cm x 2,5 cm. Mantenga las piezas de la corteza en PBS + PenStrep calientes (38.5 ° C) hasta que estén listas para cortar.
- Llene un vaso de precipitados con al menos 50 ml de PBS + PenStrep tibio (38,5 °C) y obtenga una pipeta de transferencia de plástico.
- Transfiera una sola pieza de corteza a la placa de Petri en el cortador de tejidos y humedezca el tejido con tres o cuatro gotas de PBS + PenStrep tibio (38.5 ° C).
- Mantenga el pedazo de tejido firme con un par de pinzas y presione el botón de reinicio una vez para encender el cortador de pañuelos. Estabilice la placa de Petri con una mano mientras continúa estabilizando el tejido con los fórceps. Mueva los fórceps a lo largo del tejido según sea necesario para evitar que la cuchilla golpee los fórceps. Las tiras resultantes tendrán aproximadamente 500 μm de longitud.
- Una vez que toda la pieza de corteza se haya cortado en tiras, use la perilla del soporte de la cuchilla para levantar la cuchilla de la placa de Petri y las pinzas para eliminar cualquier tejido de la cuchilla.
- Gire el soporte de la placa 90°.
- Presione el botón de reinicio una vez. Estabilice la placa de Petri con una mano mientras usa las pinzas para empujar las tiras de tejido en el camino de la cuchilla.
- Pase la cuchilla completamente a través de las tiras de tejido. Use la perilla del soporte de la cuchilla para levantar la cuchilla de la placa de Petri y las pinzas para eliminar cualquier tejido de la cuchilla.
- Utilice la pipeta de transferencia y el PBS + PenStrep tibio (38,5 °C) para lavar el tejido picado (tamaño final del tejido: cubos de 500 μm x 500 μm x 1 mm) en un tubo cónico precalentado (38,5 °C) de 50 ml. Devolver el tubo cónico al baño de agua o de cuentas para mantener caliente el tejido picado (38,5 °C).
- Use el desguazador de tuercas para quitar la tuerca del brazo de corte y retire la arandela y el cierre de la cuchilla. Con pinzas, retire la cuchilla del brazo de corte, voltéela para que el borde no utilizado quede hacia la placa de Petri y colóquela nuevamente en el brazo de cortar. Vuelva a colocar el cierre de la cuchilla, la arandela y la tuerca, y restablezca la perilla de liberación de la mesa como se describe en los pasos 2.5-2.7.
- Repita los pasos 4.5-4.12 para todas las piezas restantes de corteza del ovario, reemplazando las cuchillas por otras nuevas después de que se haya utilizado cada filo de corte.
- Deseche todas las cuchillas usadas en un recipiente de plástico para objetos punzantes de paredes duras.
5. Procedimiento de homogeneización
- Asegúrese de que la unidad homogeneizadora (consulte la Tabla de materiales) esté enchufada y que la velocidad esté ajustada a la segunda barra (9,000-11,000 rpm). Inserte la sonda del generador de 10 mm en la unidad de acuerdo con las especificaciones del fabricante.
- Ajuste un temporizador durante 1 minuto e inserte la sonda en el tubo cónico de 50 ml que contiene el tejido cortado de un ovario (paso 4.11) y suficiente PBS + PenStrep para llenar el tubo hasta la línea de 25 ml. La profundidad a la que se inserta la sonda debe ser 1/3 de la altura del líquido medida desde el fondo de la cámara. Coloque la sonda ligeramente descentrada para minimizar el vórtice.
- Encienda el temporizador y encienda el homogeneizador. Asegúrese de que la parte inferior de la sonda no toque el tubo y manténgalo quieto mientras el homogeneizador está encendido.
- Después de 1 minuto de homogeneización, retire la sonda del tubo. Con pinzas, retire cualquier tejido conectivo que obstruya los orificios de ventilación y el espacio entre la cuchilla del rotor y el tubo del rotor. Si algún pedazo de corteza está atascado en la sonda, retírelos con fórceps y colóquelos nuevamente en el tubo.
- Repita los pasos 5.2-5.4 5 veces adicionales para un total de 6 minutos de homogeneización.
- Coloque el tubo con tejido homogeneizado en el agua o en el baño de cuentas para mantener el tejido caliente (38,5 °C). Después de procesar el último ovario, desmonte, limpie y seque inmediatamente la sonda del generador de acuerdo con las especificaciones del fabricante.
6. Procedimiento de filtración
- Verter el tejido disperso en el embudo cubierto de estopilla insertado en el matraz Erlenmeyer. Enjuague el contenido del tubo en el embudo con PBS + PenStrep tibio (38,5 °C) hasta que no queden fragmentos de tejido en el tubo.
- Forzar los fragmentos de tejido para que pasen a través de los orificios de la tela girando la gasa alrededor de los fragmentos de tejido y apretando hasta que todo el exceso de líquido y tejido se elimine de la gasa.
- Vuelva a abrir la gasa sobre el embudo, enjuague la gasa con PBS + PenStrep con una pipeta de transferencia y vuelva a exprimir cualquier fragmento de tejido residual a través del paño.
- Use un hemostático para sostener el filtro de células de 300 μm sobre un vaso de precipitados de 200 ml. Vierta el filtrado en el erlenmeyer a través del filtro celular. Enjuagar el contenido del matraz en el colador celular utilizando PBS + PenStrep tibio (38,5 °C) hasta que no queden fragmentos de tejido.
- Si el colador de células se obstruye con tejido, golpee suavemente el filtro de células contra el vaso de precipitados para asegurarse de que todo el líquido se haya filtrado en el vaso de precipitados, y luego gire el filtro de celda boca abajo y golpee los restos de tejido grandes en el papel de banco. Devuelva el colador celular sobre el vaso de precipitados y continúe vertiendo el filtrado a través de él. Repita según sea necesario hasta que se haya filtrado todo el filtrado del erlenmeyer.
- Use un hemostático para sostener el filtro de células de 40 μm sobre un segundo vaso de precipitados de 200 ml. Vierta el filtrado en el vaso de precipitados de 200 ml a través del filtro celular. Enjuague el contenido del vaso de precipitados en el colador celular utilizando PBS + PenStrep tibio (38,5 °C) hasta que no queden fragmentos de tejido. No deseche el contenido del filtro celular de 40 μm.
- Ajuste la aguja de 18 G a la jeringa de 20 ml. Llene la jeringa con FWM. Gire el filtro de células de 40 μm boca abajo sobre una placa de Petri cuadrada y use la jeringa para lavar el contenido del filtro celular en el plato. Vuelva a llenar la jeringa y enjuague el colador celular según sea necesario hasta que no queden fragmentos de tejido.
NOTA: Por lo general, 25 ml de FWM es suficiente para enjuagar completamente el contenido del filtro celular de 40 μm.

Figura 2: Configuración del espacio de trabajo para el procesamiento de ovarios y el flujo de trabajo del protocolo. (A) Configuración del banco para cortar los ovarios antes de picar y para filtrar el homogeneizado del ovario. (B) Montaje del picador de tejidos y homogeneizador, con soporte de espuma de poliestireno para reducir las vibraciones de la etapa del homogeneizador. (C) Esquema que ilustra el flujo de trabajo para el procesamiento de un ovario completo. Los ovarios se recortan del exceso de tejido conectivo y luego se cortan por la mitad, y la médula se elimina hasta que queda una rebanada de corteza de ~ 1 mm de espesor. La corteza se corta en trozos de 2,5 cm x 2,5 cm y se corta en un picador de tejido ajustado a un intervalo de corte de 500 μm. Las piezas se homogeneizan y el homogeneizado se filtra a través de una gasa seguida de filtración a través de filtros celulares de 300 μm y 40 μm. El contenido del filtro de células de 40 μm se enjuaga en una placa de Petri cuadrada, que se busca folículos utilizando un microscopio estereoscópico. Creado con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
7. Búsqueda y recolección de folículos
- Transfiera la placa de Petri cuadrada (paso 6.6) a un estereoscopio con una platina calentada ajustada a 38,5 °C. La ampliación del estereoscopio debe establecerse entre 1.25x y 3.2x dependiendo de la preferencia del buscador.
- Pipetear 10 μL gotas de FWM en una placa de Petri de 60 mm y cubrir las gotas con aceite mineral para evitar que se sequen. Coloque la placa de Petri con gotas de medios en una placa de calentamiento a 38,5 °C.
NOTA: Se puede usar una placa de 4 pocillos para recolectar folículos. Agregue 500 μL de medios de lavado a uno o dos pocillos. Colocar en la placa de calentamiento a 38,5 °C. - Obtenga un émbolo y una punta de micropipeta.
NOTA: Se recomienda una micropipeta de vidrio de 1-5 μL (ver Tabla de materiales) porque es menos probable que los folículos se adhieran a la pipeta de vidrio y se pierdan cuando se transfieren entre soluciones. También es un instrumento lo suficientemente pequeño como para permitir micromanipulaciones más fáciles y precisas de los folículos. - Identifique los folículos de la placa de Petri cuadrada y transfiéralos a las gotas de medios (FWM) utilizando la micropipeta. Es probable que muchos folículos estén incrustados en restos de tejido y pueden recuperarse utilizando uno de los dos métodos que se describen a continuación.
NOTA: Los folículos son oblongos, en lugar de esferas perfectas, y típicamente tienen un ovocito, que se presenta como un círculo blanco sólido en contrastes más oscuros, hacia el centro del folículo (Figura 3A-C). Tenga cuidado de evitar confundir los folículos con los ovocitos desnudos. Los ovocitos tienden a ser esferas perfectas y están rodeados por una membrana gruesa y clara (la zona pelúcida). Se puede usar un microscopio invertido con un aumento de 10x (o mayor) para un examen más detallado de los folículos (Figura 3D).- Separe cuidadosamente los folículos de los residuos utilizando la punta de la micropipeta o agujas finas (27 G).
- Alternativamente, use una pipeta de vidrio Pasteur con una bombilla de goma para tomar y expulsar los desechos en el plato varias veces para desalojar los folículos de los desechos.
- Trabaje rápidamente, no tomando más de 30 minutos, para buscar en la placa de Petri para ayudar a preservar la viabilidad del folículo.
- Coloque un máximo de solo cinco folículos por gota de 10 μL, ya que una densidad más alta puede aumentar la probabilidad de que los folículos se adhieran entre sí.
8. Prueba de viabilidad de exclusión del azul de tripano
NOTA: Use la tapa de una placa de Petri o una placa de 4 pocillos para todos los pasos siguientes, ya que los folículos se adhieren menos al plástico de la tapa que al plástico del plato real.
- Prepare PBS + 0.2% polivinilpirrolidona (PVP) disolviendo 100 mg de PVP en 50 ml de PBS.
NOTA: PVP se utiliza aquí para reducir la probabilidad de que los folículos se adhieran a la placa. - Utilice la micropipeta para transferir todos los folículos (promedio de 40) de las gotas de medios a una gota de 50 μL de PBS + 0,2% PVP.
- Lave los folículos 2 veces transfiriéndolos secuencialmente a gotas frescas de 50 μL de PBS + 0,2% PVP.
- Transfiera los folículos a una caída de 285 μL de PBS + 0,2% PVP.
- Añadir 15 μL de azul de tripano a la gota de 285 μL de PBS + 0,2% PVP (concentración final de 0,05% de azul de tripano) y mezclar cuidadosamente la gota con una punta de pipeta de 200 μL fijada a 100 μL.
NOTA: Si utiliza la placa de 4 pocillos para la prueba de viabilidad de tripano, agregue 475 μL de PBS + 0,2% de PVP y 25 μL de azul de tripano a un pocillo. - Incubar los folículos durante 1 minuto en la gota de azul de tripano, y luego transferir los folículos a una gota de 50 μL (o 500 μL de pozo) de PBS + 0,2% PVP.
- Lave los folículos 3 veces de acuerdo con el paso 8.3 con gotas frescas de 50 μL (o 500 μL por pocillo) de PBS + 0.2% PVP.
- Deseche los folículos que aún aparecen azules después de tres lavados en PBS + 0.2% PVP, ya que estos no son viables. Cualquier folículo que no conserve la coloración azul después de tres lavados es viable y puede usarse para inmunofluorescencia, cultivo u otros procedimientos (Figura 3E). Congelar rápidamente los folículos en nitrógeno líquido y almacenar a -80 °C hasta su uso adicional si es necesario.
- Realizar análisis de RT-qPCR y tinción de inmunofluorescencia de los folículos como se describe en los pasos 9 y 10.

Figura 3: Folículos aislados y prueba de exclusión de azul de tripano. (A-C) Los folículos aislados fueron fotografiados a través de un microscopio estereoscópico a varios aumentos. (A) Folículos aislados entre los desechos dentro de la placa de búsqueda inicial. Los folículos individuales están marcados en rojo. Barra de escala = 2.000 μm. (B) Folículos aislados y desechos dentro de una gota de medio de lavado de folículos cubierto con aceite mineral. Barra de escala = 1.000 μm. (C) Folículos aislados sin residuos a mayor aumento. Barra de escala = 1.000 μm. (D) Folículos aislados fotografiados usando un microscopio de campo claro invertido. Barra de escala = 100 μm. (E) Imágenes representativas de folículos viables (no teñidos) y no viables (tinción azul) fotografiados utilizando un microscopio de campo claro invertido y un objetivo 20x. Barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
9. Análisis RT-qPCR
- Aislar el ARN de folículos viables (a partir del paso 8.8) utilizando un reactivo de aislamiento de ARN (consulte la Tabla de materiales). Purifique el ARN y trátelo con DNasa utilizando un kit de limpieza disponible comercialmente (consulte la Tabla de materiales) de acuerdo con las instrucciones del fabricante.
- Eluya el ARN con 14 μL de agua libre de RNasa y cuantifique usando un espectrofotómetro. El ARN se puede almacenar a -80 °C hasta la síntesis de ADNc.
- Realice la síntesis de ADNc a partir de cantidades iguales de ARN extraído de folículos primarios y secundarios tempranos, utilizando un kit de síntesis de ADNc disponible comercialmente (consulte la Tabla de materiales) de acuerdo con las instrucciones del fabricante. Incubar la mezcla de reacción durante 5 min a 25 °C seguida de 60 min a 42 °C, luego terminar la reacción calentando a 70 °C durante 5 min.
- Realice RT-qPCR con el ADNc sintetizado (5 ng por reacción) y cebadores (Tabla 1) utilizando una mezcla de reacción disponible comercialmente (ver Tabla de materiales). Utilice condiciones de ciclo térmico: 30 s a 95 °C para la activación de la polimerasa, seguido de 40 ciclos de amplificación, donde cada ciclo incluyó 15 s a 95 °C para la desnaturalización y 30 s a 60 °C para el recocido/extensión. Analice la RT-qPCR cuantificando los valores del umbral del ciclo (Ct) y/o vea los productos de PCR mediante electroforesis en gel de agarosa.
NOTA: La expresión de transcripción del marcador de células de la granulosa FSHR y el marcador de células germinales DAZL se evaluaron en este estudio. Los genes de referencia fueron H2A y ACTB. - Ejecute un análisis de la curva de fusión aumentando la temperatura desde 65 °C en incrementos de 0,5 °C cada 5 s hasta que alcance los 95 °C.
10. Análisis de inmunofluorescencia
- Arreglar folículos viables (a partir del paso 8.8) durante 15 min en una caída de 100 μL de paraformaldehído (PFA) al 4% (v/v) a temperatura ambiente (RT), seguido de lavar 3x en gotas de 100 μL de PBS + 0,1% BSA + 0,1% Tween 20.
- Bloquear los folículos durante 1 h en RT en un tampón de bloqueo que consiste en 1x PBS + 5% (v/v) de suero de burro normal (NDS). Después del bloqueo, incubar los folículos durante la noche a 4 °C en una gota de 100 μL de 4 μg/ml de anticuerpo CX37 antihumano de conejo o 4 μg/ml de isotipo de conejo IgG (control negativo) diluido en tampón de bloqueo.
- Lave los folículos 3 veces en gotas de 100 μL de PBS + 0.1% BSA + 0.1% Tween 20, y luego incubarlos durante 1 h en RT en la oscuridad en una gota de 100 μL de 2 μg / ml de anticuerpo secundario AlexaFluor 488 burro-conejo diluido en tampón de bloqueo.
- Incubar los folículos durante 5 min en RT en la oscuridad en una gota de 100 μL de 1 μg/mL Hoechst 33342 diluido en tampón de bloqueo para marcar el ADN.
- Transfiera los folículos a una gota de 5 μL de medios de montaje (consulte la Tabla de materiales) en un portaobjetos de microscopio de vidrio y cúbralos con un cubierto. Deje que los portaobjetos se curen en RT durante la noche, seguido de sellar con esmalte de uñas. Guárdelos a 4 °C hasta obtener imágenes.
- Imagen de todas las diapositivas dentro de las 48 h posteriores al deslizamiento de la cubierta. Realice imágenes utilizando un microscopio de epifluorescencia invertida (consulte la Tabla de materiales) bajo filtros DAPI (excitación 380 nm y emisión 450 nm) y FITC (excitación 470 nm y emisión 525 nm).
- Fija el tiempo de exposición para ambos canales. Ajuste el tiempo de exposición de FITC (CX37) en función del control negativo del isotipo de conejo. Utilice un objetivo de 20x y el canal DAPI establecido en un tiempo de exposición de 50 ms para identificar los folículos marcados con isotipo de conejo.
- Imagen de estos folículos bajo el canal FITC y disminuya el tiempo de exposición hasta que se elimine toda la señal verde de fondo. Tenga en cuenta este tiempo de exposición.
- Imagen de todos los folículos marcados con anticuerpos CX37 utilizando el tiempo de exposición establecido para el canal FITC del isotipo y el tiempo de exposición de 50 ms para el canal DAPI.
- Procesar la intensidad de la señal, medida por el área gris media después del umbral, utilizando un programa de procesamiento de imágenes por computadora29 (ver Tabla de materiales).
- Ajuste el archivo tiff de la imagen DAPI para cada folículo de modo que se describa todo el folículo. Utilice la función Analizar partículas del programa para seleccionar todo el folículo como región de interés (ROI).
- Abra el archivo tiff de la imagen FITC para el folículo correspondiente y superponga el ROI generado a partir de la imagen DAPI sobre la imagen FIFC. Utilice la función Medir del programa para cuantificar el área gris media de la imagen FIFC, que representa la intensidad de la señal.
Resultados
Descripción general y pasos críticos
Usando este protocolo, los folículos preantrales bovinos pequeños pueden aislarse de manera confiable de ovarios individuales en números experimentalmente relevantes. De un total de 30 réplicas, se obtuvo un promedio de 41 folículos por réplica, con un rango de 11 a 135 folículos (Figura 4A). En 14 réplicas, los folículos se caracterizaron para la etapa de desarrollo como se describió anteriormente26...
Discusión
El presente protocolo detalla un método reproducible para recuperar folículos preantrales en etapa temprana, específicamente en etapas primarias y secundarias tempranas, del ovario bovino. Este protocolo se basa en informes anteriores 20,25,30,34,35,36 y proporciona optimizaciones que resultan en el aislamiento de un número significativo de folículos de un ovario individual.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este proyecto fue parcialmente financiado por el proyecto multiestatal W4112 del USDA y el premio Jastro Shields de UC Davis a SM.
Los autores desean extender su agradecimiento a Central Valley Meat, Inc. por proporcionar los ovarios bovinos utilizados en todos los experimentos. Los autores también agradecen a Olivia Silvera por su ayuda con el procesamiento de los ovarios y el aislamiento del folículo.
Materiales
| Name | Company | Catalog Number | Comments |
| 5-3/4" Soda Lime Disposable Glass Pasteur Pipette | Duran Wheaton Kimble | 63A54 | Pasteur pipette that can be used to dislodge follicles from debris while searching within the petri dish |
| 16% Paraformaldehyde | Electron Microscopy Sciences | 15710 | Diluted to 4%; fixation of follicles for immunostaining |
| 20 mL Luer-lock Syringe | Fisher Scientific | Z116882-100EA | Syringe used with the 18 G needle to dislodge follicles from the 40 μm cell strainer |
| #21 Sterile Scalpel Blade | Fisher Scientific | 50-365-023 | Used to cut the ovaries and remove the medula |
| 40 μm Cell Strainer | Fisher Scientific | 22-363-547 | Used to filter the filtrate from the 300 μm cell strainer |
| 104 mm Plastic Funnel | Fisher Scientific | 10-348C | Size can vary, but ensure the cheese cloth is cut appropriately and that the ovarian homogenate will not spill over |
| 300 μm Cell Strainer | pluriSelect | 43-50300-03 | Used to filter the filtrate from the cheese cloth |
| 500 mL Erlenmeyer Flask | Fisher Scientific | FB500500 | Funnel and flask used to catch filtrate from the cheese cloth |
| Air-Tite Sterile Needles 18 G | Thermo Fisher Scientific | 14-817-151 | 18 G offers enough pressure to dislodge follicles from the 40 μm cell strainer |
| Air-Tite Sterile Needles 27 G 13 mm | Fisher Scientific | 14-817-171 | Needles that can be used to manipulate any debris in which follicles are stuck |
| BD Hoechst 33342 Solution | Fisher Scientific | BDB561908 | Fluorescent DNA stain |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7030-100G | Component of follicle wash media |
| Cheese Cloth | Electron Microscopy Sciences | 71748-00 | First filtering step of the ovarian homogenate meant to remove large tissue debris |
| Classic Double Edge Safety Razor Blades | Wilkinson Sword | N/A | Razor blades that fit the best in the McIlwain Tissue Chopper and do not dull quickly |
| Donkey-Anti-Rabbit Secondary Antibody, Alexa Fluor 488 | Fisher Scientific | A-21206 | Secondary antibody for immunostaining |
| Eisco Latex Pipette Bulbs | Fisher Scientific | S29388 | Rubber bulb to use with Pasteur pipettes |
| HEPES Buffer | Sigma-Aldrich | H3375 | Component of follicle wash media |
| Homogenizer | VWR | 10032-336 | Homogenize the ovarian tissue to release follicles |
| ImageJ/Fiji | NIH | v2.3.1 | Software used for analysis of fluorescence-immunolocalization |
| McIlwain Tissue Chopper | Ted Pella | 10184 | Used to cut ovarian tissue small enough for homogenization |
| Microscope - Stereoscope | Olympus | SZX2-ILLT | Dissection microscope used for searching and harvesting follicles from the filtrate |
| Microscope - Inverted | Nikon | Diaphot 300 | Inverted microscope used for high magnification brightfield visualization of isolated follicles |
| Microscope - Inverted | ECHO | Revolve R4 | Inverted microscope used for high magnification brightfield and epifluorescence visualization of isolated follicles |
| Mineral Oil | Sigma-Aldrich | M8410-1L | Oil to cover the drops of follicle wash medium to prevent evaporation during searching |
| Non-essential Amino Acids (NEAA) | Gibco | 11140-050 | Component of follicle wash medium |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-001 | Reagent for immunostaining blocking buffer |
| Nunc 4-well Dishes for IVF | Thermo Fisher Scientific | 144444 | 4-well dishes for follicle isolation and washing |
| Penicillin-Streptomycin Solution 100x | Gibco | 15-140-122 | Component of follicle wash medium |
| Petri Dish 60 mm OD x 13.7 mm | Ted Pella | 10184-04 | Petri dish that fits the best in the McIlwain Tissue Chopper |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP665-1 | Washing buffer for ovaries and follicles |
| Plastic Cutting Board | Fisher Scientific | 09-002-24A | Cutting board of sufficient size to safely cut ovaries |
| Polyvinylpyrrolidone (PVP) | Fisher Scientific | BP431-100 | Addition of PVP (0.1% w/v) to PBS prevents follicles from sticking to the plate or each other |
| ProLong Gold Antifade Mountant | Thermo Fisher Scientific | P36930 | Mounting medium for fluorescently labeled cells or tissue |
| Qiagen RNeasy Micro Kit | Qiagen | 74004 | RNA column clean-up kit |
| R | The R Foundation | v4.1.2 | Statistical analysis software |
| Rabbit-Anti-Human Cx37/GJA4 Polyclonal Antibody | Abcam | ab181701 | Cx37 primary antibody for immunostaining |
| RevertAid RT Reverse Transcription Kit | Thermo Fisher Scientific | K1691 | cDNA synthesis kit |
| Rstudio | RStudio, PBC | v2021.09.2 | Statistical analysis software |
| Sodium Hydroxide Solution (1N/Certified) | Fisher Scientific | SS266-1 | Used to increase media pH to 7.6-7.8 |
| Sodium Pyruvate (NaPyr) | Gibco | 11360-070 | Component of follicle wash medium |
| Square Petri Dish 100 mm x 15 mm | Thermo Fisher Scientific | 60872-310 | Gridded petri dishes allow for more efficient identification of follicles |
| SsoAdvanced Universal SYBR Green Supermix | BioRad | 1725271 | Mastermix for PCR reaction |
| Steritop Threaded Bottle Top Filter | Sigma-Aldrich | S2GPT02RE | Used to sterilize follicle wash medium |
| SYBR-safe DNA gel stain | Thermo Fisher Scientific | S33102 | Staining to visual PCR products on agarose gel |
| TCM199 with Hank’s Salts | Gibco | 12-350-039 | Component of follicle wash medium |
| Triton X-100 | Fisher Scientific | BP151-100 | Detergent for immunostaining permeabilization buffer |
| Trizol reagent | Thermo Fisher Scientific | 15596026 | RNA isolation reagent |
| Trypan Blue Solution, 0.4% | Gibco | 15-250-061 | Used for testing viability of isolated follicles |
| Tween 20 | Detergent for immunostaining wash buffer | ||
| Warmer Plate Universal | WTA | 20931 | Warm plate to keep follicles at 38.5 °C while searching under the microscope |
| Wiretrol II Calibrated Micropipets | Drummond | 50002-005 | Glass micropipettes to manipulate follicles |
Referencias
- Fortune, J. E., Yang, M. Y., Allen, J. J., Herrick, S. L. Triennial reproduction symposium: The ovarian follicular reserve in cattle: What regulates its formation and size. Journal of Animal Science. 91 (7), 3041-3050 (2013).
- Fair, T., Hulshof, S. C., Hyttel, P., Greve, T., Boland, M. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anatomy and Embryology. 195 (4), 327-336 (1997).
- Jaffe, L. A., Egbert, J. R. Regulation of mammalian oocyte meiosis by intercellular communication within the ovarian follicle. Annual Review of Physiology. 79, 237-260 (2017).
- Driancourt, M. A., Reynaud, K., Cortvrindt, R., Smitz, J. Roles of KIT and KIT LIGAND in ovarian function. Reviews of Reproduction. 5 (3), 143-152 (2000).
- Lussier, J. G., Matton, P., Dufour, J. J. Growth rates of follicles in the ovary of the cow. Journal of Reproductive Fertility. 81 (2), 301-307 (1987).
- Aerts, J. M. J., Bols, P. E. J. Ovarian follicular dynamics: a review with emphasis on the bovine species. Part I: Folliculogenesis and preantral follicle development. Reproduction in Domestic Animals. 45 (1), 171-179 (2010).
- Sugiura, K., Pendola, F. L., Eppig, J. J. Oocyte control of metabolic cooperativity between oocytes and companion granulosa cells: energy metabolism. Developmental Biology. 279 (1), 20-30 (2005).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biology of Reproduction. 73 (2), 351-357 (2005).
- Sugimura, S., et al. Amphiregulin co-operates with bone morphogenetic protein 15 to increase bovine oocyte developmental competence: effects on gap junction-mediated metabolite supply. Molecular Human Reproduction. 20 (6), 499-513 (2014).
- Edson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Matzuk, M. M., Burns, K. H. Genetics of mammalian reproduction: modeling the end of the germline. Annual Review of Physiology. 74, 503-528 (2012).
- McGee, E. A., Raj, R. S. Regulators of ovarian preantral follicle development. Seminars in Reproductive Medicine. 33 (3), 179-184 (2015).
- Chen, Y., et al. The factors and pathways regulating the activation of mammalian primordial follicles in vivo. Frontiers in Cell and Developmental Biology. 8, 575706 (2020).
- Figueiredo, J. R., et al. Development of a combined new mechanical and enzymatic method for the isolation of intact preantral follicles from fetal, calf and adult bovine ovaries. Theriogenology. 40 (4), 789-799 (1993).
- Sirard, M. A. The ovarian follicle of cows as a model for human. Animal Models and Human Reproduction. , 127-144 (2017).
- Parkes, W. S., et al. Hyaluronan and collagen are prominent extracellular matrix components in bovine and porcine ovaries. Genes. 12 (8), 1186 (2021).
- Araújo, V. R., Gastal, M. O., Figueiredo, J. R., Gastal, E. L. In vitro culture of bovine preantral follicles: a review. Reproductive Biology and Endocrinology. 12 (1), 1-14 (2014).
- Eppig, J. J., Schroeder, A. C. Capacity of mouse oocytes from preantral follicles to undergo embryogenesis and development to live young after growth, maturation, and fertilization in vitro. Biology of Reproduction. 41 (2), 268-276 (1989).
- McLaughlin, M., Telfer, E. E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Nuttinck, F., Mermillod, P., Massip, A., Dessy, F. Characterization of in vitro growth of bovine preantral ovarian follicles: A preliminary study. Theriogenology. 39 (4), 811-821 (1993).
- Demeestere, I., et al. Effect of preantral follicle isolation technique on in-vitro follicular growth, oocyte maturation and embryo development in mice. Human Reproduction. 17 (8), 2152-2159 (2002).
- Fattahi, A., et al. Optimization of porcine ovarian follicle isolation methods for better developmental potential. Tissue Engineering Part A. 26 (13-14), 712-719 (2020).
- Nagashima, J. B., Hill, A. M., Songsasen, N. In vitro development of mechanically and enzymatically isolated cat ovarian follicles. Reproduction and Fertility. 2 (1), 35-46 (2021).
- Lucci, C. M., Rumpf, R., Figueiredo, J. R., Báo, S. N. Zebu (Bos indicus) ovarian preantral follicles: Morphological characterization and development of an efficient isolation method. Theriogenology. 57 (5), 1467-1483 (2002).
- Langbeen, A., et al. Characterization of freshly retrieved preantral follicles using a low-invasive, mechanical isolation method extended to different ruminant species. Zygote. 23 (5), 683-694 (2014).
- Candelaria, J. I., Denicol, A. C. Characterization of isolated bovine preantral follicles based on morphology, diameter and cell number. Zygote. 28 (2), 154-159 (2020).
- vanden Hurk, R., et al. Ultrastructure and viability of isolated bovine preantral follicles. Human Reproduction Update. 4 (6), 833-841 (1998).
- Paes, V. M., et al. Effect of heat stress on the survival and development of in vitro cultured bovine preantral follicles and on in vitro maturation of cumulus-oocyte complex. Theriogenology. 86 (4), 994-1003 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Aguiar, L. H., Hyde, K. A., Pedroza, G. H., Denicol, A. C. Heat stress impairs in vitro development of preantral follicles of cattle. Animal Reproduction Science. 213, 106277 (2020).
- Kristensen, S. G., Ebbesen, P., Andersen, C. Y. Transcriptional profiling of five isolated size-matched stages of human preantral follicles. Molecular and Cellular Endocrinology. 401, 189-201 (2015).
- Candelaria, J. I., Rabaglino, M. B., Denicol, A. C. Ovarian preantral follicles are responsive to FSH as early as the primary stage of development. Journal of Endocrinology. 247 (2), 153-168 (2020).
- Nuttinck, F., et al. Comparative immunohistochemical distribution of Connexin 37 and Connexin 43 throughout folliculogenesis in the bovine ovary. Molecular Reproduction and Development. 57 (1), 60-66 (2000).
- Itoh, T., Hoshi, H. Efficient isolation and long-term viability of bovine small preantral follicles in vitro. In Vitro Cellular and Developmental Biology-Animal. 36 (4), 235-240 (2000).
- Saha, S., Shimizu, M., Geshi, M., Izaike, Y. In vitro culture of bovine preantral follicles. Animal Reproduction Science. 63 (1-2), 27-39 (2000).
- Bus, A., et al. Preservation of connexin 43 and transzonal projections in isolated bovine pre-antral follicles before and following vitrification. Journal of Assisted Reproduction and Genetics. 38 (2), 479-492 (2021).
- Gougeon, A., Ecochard, R., Thalabard, J. C. Age-related changes of the population of human ovarian follicles: increase in the disappearance rate of non-growing and early-growing follicles in aging women. Biology of Reproduction. 50 (3), 653-663 (1994).
- Xu, D., et al. Raf-ERK1/2 signaling pathways mediate steroid hormone synthesis in bovine ovarian granulosa cells. Reproduction in Domestic Animals. 54 (5), 741-749 (2019).
- Santos, R. R., et al. Cryopreservation of ovarian tissue: an emerging technology for female germline preservation of endangered species and breeds. Animal Reproduction Science. 122 (3-4), 151-163 (2010).
- Leonel, E. C. R., Lucci, C. M., Amorim, C. A. Cryopreservation of human ovarian tissue: a review. Transfusion Medicine and Hemotherapy. 46 (3), 173-181 (2019).
- Bus, A., Langbeen, A., Martin, B., Leroy, J. I. M. R., Bols, P. E. J. Is the pre-antral ovarian follicle the 'holy grail' for female fertility preservation. Animal Reproduction Science. 207, 119-130 (2019).
- Chen, J., et al. Optimization of follicle isolation for bioengineering of human artificial ovary. Biopreservation and Biobanking. , (2021).
- Chiti, M. C., et al. A modified and tailored human follicle isolation procedure improves follicle recovery and survival. Journal of Ovarian Research. 10 (1), 1-9 (2017).
- Kristensen, S. G., Rasmussen, A., Byskov, A. G., Andersen, C. Y. Isolation of pre-antral follicles from human ovarian medulla tissue. Human Reproduction. 26 (1), 157-166 (2011).
- Oktay, K., et al. Isolation and characterization of primordial follicles from fresh and cryopreserved human ovarian tissue. Fertility and Sterility. 67 (3), 481-486 (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados