A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقييم فعالية الأحماض البيروكسي العضوية للقضاء على الأغشية الحيوية للألبان باستخدام نهج يجمع بين الطرق الثابتة والديناميكية
In This Article
Summary
يصف هذا البروتوكول نهجا يجمع بين الأساليب الثابتة والديناميكية لتقييم فعالية أحماض البيروكسي العضوية للقضاء على الأغشية الحيوية في صناعة الألبان. ويمكن أيضا استخدام هذا النهج لاختبار فعالية التركيبات البيولوجية أو الكيميائية الجديدة لمكافحة الأغشية الحيوية.
Abstract
إن وجود الأغشية الحيوية في صناعة الألبان هو مصدر قلق كبير ، لأنها قد تؤدي إلى إنتاج منتجات ألبان غير آمنة ومعدلة بسبب مقاومتها العالية لمعظم إجراءات التنظيف المكاني (CIP) المستخدمة بشكل متكرر في مصانع المعالجة. لذلك ، من الضروري تطوير استراتيجيات جديدة لمكافحة الأغشية الحيوية لصناعة الألبان. يهدف هذا البروتوكول إلى تقييم فعالية أحماض البيروكسي العضوية (أحماض peracetic و perpropionic و perlactic ومطهر تجاري قائم على حمض البيراسيتيك) للقضاء على الأغشية الحيوية لمنتجات الألبان باستخدام مزيج من الطرق الثابتة والديناميكية. تم اختبار جميع المطهرات على أقوى البكتيريا المنتجة للأغشية الحيوية في غشاء حيوي واحد أو مختلط باستخدام الحد الأدنى من تركيز استئصال الأغشية الحيوية (MBEC) ، وهي طريقة فحص ثابتة عالية الإنتاجية. وقد نجح وقت التلامس البالغ 5 دقائق مع المطهرات بالتركيزات الموصى بها في القضاء على كل من الأغشية الحيوية المفردة والمختلطة. الدراسات جارية حاليا لتأكيد هذه الملاحظات باستخدام مفاعل الأغشية الحيوية التابع لمركز السيطرة على الأمراض (CDC) ، وهي طريقة ديناميكية لتقليد الظروف في الموقع . يتيح هذا النوع من المفاعلات الحيوية استخدام سطح من الفولاذ المقاوم للصدأ ، والذي يشكل معظم المعدات والأسطح الصناعية. يبدو أن النتائج الأولية من المفاعل تؤكد فعالية الأحماض البيروكسي العضوية ضد الأغشية الحيوية. يمكن استخدام النهج المشترك الموصوف في هذه الدراسة لتطوير واختبار تركيبات بيولوجية أو كيميائية جديدة للسيطرة على الأغشية الحيوية والقضاء على الكائنات الحية الدقيقة.
Introduction
صناعة الألبان هي قطاع صناعي رئيسي في جميع أنحاء العالم ، بما في ذلك في كندا ، حيث يوجد أكثر من 10,500 مزرعة ألبان تنتج ما يقرب من 90 مليون هكتار من الحليب كل عام1. على الرغم من متطلبات النظافة الصارمة المفروضة في صناعة الألبان ، بما في ذلك في مصانع المعالجة ، يشكل الحليب وسيلة استزراع كبيرة للكائنات الحية الدقيقة ، وبالتالي ، من المحتمل أن تحتوي منتجات الألبان على كائنات دقيقة ، بما في ذلك التلف أو الكائنات الحية الدقيقة المسببة للأمراض. هذه مسببات الأمراض يمكن أن تسبب أمراض مختلفة. على سبيل المثال ، يمكن أن تسبب السالمونيلا sp. والليستيريا المستوحدة التهاب المعدة والأمعاء والتهاب السحايا ، على التوالي2. يمكن أن تؤثر الكائنات الحية الدقيقة التالفة على الجودة والخصائص الحسية لمنتجات الألبان عن طريق إنتاج الغازات أو الإنزيمات خارج الخلية أو الأحماض3. يمكن أيضا تغيير مظهر ولون الحليب ، على سبيل المثال بواسطة Pseudomonas spp.4.
يمكن لبعض هذه الكائنات الحية الدقيقة تشكيل الأغشية الحيوية على أسطح مختلفة ، بما في ذلك الفولاذ المقاوم للصدأ. هذه الأغشية الحيوية تمكن من استمرار وتكاثر الكائنات الحية الدقيقة على سطح المعدات ، وبالتالي تلوث منتجات الألبان5. كما أن الأغشية الحيوية إشكالية بسبب قدرتها على إعاقة انتقال الحرارة وتسريع تآكل المعدات ، مما يؤدي إلى استبدال المعدات قبل الأوان ، وبالتالي إلى خسائر اقتصادية6.
تسمح إجراءات التنظيف المكاني (CIP) لصناعة الأغذية بالتحكم في نمو الكائنات الحية الدقيقة. تتضمن هذه الإجراءات الاستخدام المتسلسل لهيدروكسيد الصوديوم وحمض النيتريك وأحيانا المطهرات التي تحتوي على حمض هيبوكلوروس وحمض البيراسيتيك 7,8. على الرغم من أن حمض هيبوكلوروس فعال للغاية ضد الكائنات الحية الدقيقة ، إلا أنه يتفاعل أيضا مع المواد العضوية الطبيعية ، مما يتسبب في تكوين منتجات ثانوية سامة9. حمض البيراسيتيك لا يولد منتجات ثانوية ضارة10 ؛ ومع ذلك ، فإن فعاليتها ضد الأغشية الحيوية في صناعة الأغذية متغيرة للغاية10,11. في الآونة الأخيرة ، تمت دراسة الأحماض البيروكسي الأخرى ، بما في ذلك أحماض البيروبيون والبيرلاكتيك ، لنشاطها المضاد للميكروبات ، ويبدو أنها بديل جيد للتحكم في نمو الميكروبات في الأغشية الحيوية12,13.
لذلك ، تهدف هذه الدراسة إلى تقييم فعالية أحماض البيروكسي العضوية (أحماض peracetic و perpropionic و perlactic ومطهر قائم على حمض البيراسيتيك) للقضاء على الأغشية الحيوية لمنتجات الألبان باستخدام نهج يجمع بين الحد الأدنى من تركيز استئصال الأغشية الحيوية (MBEC) ، وطريقة فحص ثابتة عالية الإنتاجية ، ومفاعل الأغشية الحيوية لمركز السيطرة على الأمراض (CDC) ، وهي طريقة ديناميكية تحاكي في الموقع شروط. يشار إلى اختبار MBEC فيما يلي باسم "ألواح المعايرة الدقيقة للغشاء الحيوي" في البروتوكول. يوضح البروتوكول المقدم هنا والنتائج التمثيلية فعالية أحماض البيروكسي العضوية وتطبيقها المحتمل للتحكم في الأغشية الحيوية الميكروبية في صناعة الألبان.
Protocol
يتطلب العمل الوارد في هذه المقالة مختبرا للسلامة الأحيائية من المستوى 2 وقد تمت الموافقة عليه سابقا (المشروع رقم 119689) من قبل لجنة السلامة الأحيائية المؤسسية بجامعة لافال.
ملاحظة: يمثل المخطط الانسيابي في الشكل 1 ملخصا للمنهجية التي تجمع بين النهج الثابتة والديناميكية التي استخدمت لتقييم فعالية الأحماض البيروكسي العضوية في القضاء على الأغشية الحيوية.
1. تحضير المواد
- العزلات الميكروبية
- قم بتشغيل خزانة السلامة البيولوجية (BSC) قبل 15 دقيقة من الاستخدام ، وقم بتنظيفه بمحلول كحول بنسبة 70٪ (v / v).
- بمجرد أن يصبح BSC معقما ، ضع قارورة من العزلة الميكروبية ليتم اختبارها (Pseudomonas azotoformans أو Brevundimonas vesicularis في هذه الدراسة) ، وحلقة تلقيح ، وأنبوب سعة 15 مل مملوء ب 10 مل من مرق الصويا التربتي المعقم (TSB) ، وخلاط دوامة. قبل وضعه في BSC ، قم بتطهير جميع المواد بالكحول.
- دوامة قارورة عزل الميكروبية لتجانس الثقافة.
- نقل 20 ميكرولتر من العزلة الميكروبية بشكل معقم إلى 10 مل من TSB المعقم الموجود في أنبوب سعة 15 مل واحتضانه عند 30 درجة مئوية لمدة 16-24 ساعة مع التقليب عند 160 دورة في الدقيقة.
تنبيه: يجب استخدام B. vesicularis في مختبر الاحتواء من المستوى 2 وفقا للمبادئ التوجيهية المطلوبة للتعامل مع الكائنات المسببة للأمراض. يجب أن يكون المعالج مدربا بشكل صحيح ويجب أن يرتدي نظارات السلامة والقفازات ومعطف.
- المطهرات
- لتحضير محلول حمض البيروكسيس العضوي (60 مل)، أضف 24 مل من بيروكسيد الهيدروجين و36 مل من الحمض (حمض الخليك أو البروبيونيك أو حمض اللاكتيك) إلى دورق إرلنماير سعة 250 مل. ثم أضف حجما محددا مسبقا يبلغ 10 M من حمض الكبريتيك (655 ميكرولتر لحمض البيراسيتيك ، 635 ميكرولتر لحمض البيربروبيونيك ، أو 715 ميكرولتر لحمض البيرلاكتيك). رج القارورة برفق لتختلط ، وضع القارورة في حمام مائي 30 درجة مئوية داخل الغطاء الكيميائي. احتضان القارورة لمدة 2 أيام ، مع خلط لطيف كل صباح.
ملاحظة: تم توفير المطهر التجاري القائم على حمض البيراسيتيك (انظر جدول المواد) مباشرة من قبل الشركة المصنعة.
تنبيه: يجب استخدام المطهرات تحت غطاء كيميائي. يجب ارتداء نظارات السلامة والقفازات طوال مدة التجربة. لمزيد من المعلومات حول المطهرات ، يرجى الرجوع إلى ورقة بيانات سلامة المواد ذات الصلة. - قم بإجراء معايرة بيروكسيد الهيدروجين كما هو موضح أدناه.
- ضع دورقا فارغا سعة 300 مل على ميزان تحليلي (انظر جدول المواد) وقم بسحب الميزان. قم بوزن حوالي 0.23 جم من المطهر في الدورق ولاحظ الوزن الدقيق المضاف. أضف 100 غرام من محلول حمض الكبريتيك البارد 1 N إلى الدورق ، وأضف قضيب تقليب مغناطيسي إلى الدورق ، وضعه على طبق تحريك.
- دع المحلول يحرك حتى التجانس الكامل. بعد ذلك ، أضف ثلاث قطرات من محلول مؤشر الحديدين (0.1٪ بالوزن في H2O) في الدورق ، وقم بالمعايرة بمحلول كبريتات السيريوم 0.1 N حتى يتغير المحلول من لون السلمون الوردي إلى اللون الأزرق الفاتح. لاحظ حجم محلول كبريتات السيريوم المضاف.
- احسب النسبة المئوية لبيروكسيد الهيدروجين باستخدام الصيغة التالية:
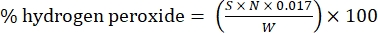 مكافئ (1)
مكافئ (1)
حيث S هو حجم محلول كبريتات السيريوم المضاف ، N هو الحالة الطبيعية لمحلول كبريتات السيريوم (0.1 N) ، W هو وزن العينة (~ 0.2300 جم) ، و 0.017 = (1 mol H 2 O 2/2 mol Ce) × (34.0147 g H 2 O2 /1 mol H 2 O)2× (1 لتر / 1000 مل)
- قم بإجراء معايرة الأحماض البيروكسي العضوية كما هو موضح أدناه.
- أضف 20 مل من محلول يوديد البوتاسيوم 7.5٪ (وزن / حجم) في كأس زجاجية. قم بالمعايرة ببطء باستخدام محلول ثيوكبريتات الصوديوم 0.1 نيوتن حتى يبدأ اللون الأزرق للمحلول في التحول إلى اللون البني/البرتقالي الباهت.
- أضف 2 مل من محلول النشا (1 بالوزن في H2O) إلى الدورق وقم بمعايرة محلول ثيوسلفات الصوديوم 0.1 N حتى يتغير المحلول من الأسود إلى البرتقالي. لاحظ حجم محلول ثيوسلفات الصوديوم المستخدم.
- احسب النسبة المئوية للبيروكسي العضوي بالصيغة التالية:
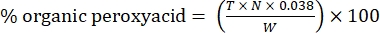 مكافئ (2)
مكافئ (2)
حيث T هو حجم محلول ثيوسلفات الصوديوم المستخدم ، N هو الحالة الطبيعية لمحلول ثيوسلفات الصوديوم (0.1 N) ، W هو وزن العينة (~ 0.2300 جم) ، و 0.038 = (1 مول CH 3 COOOH / 1 mol I 2) × (1 mol I 2/2 mol S2 O 3) × (76.06 جم / 1 مول CH3COOOH) × (1 لتر / 1000 مل)
ملاحظة: كرر الخطوتين 1.2.2 والخطوة 1.2.3 مع عينتين أخريين لإجراء كل اختبار في ثلاث نسخ.
- لتحضير محلول حمض البيروكسيس العضوي (60 مل)، أضف 24 مل من بيروكسيد الهيدروجين و36 مل من الحمض (حمض الخليك أو البروبيونيك أو حمض اللاكتيك) إلى دورق إرلنماير سعة 250 مل. ثم أضف حجما محددا مسبقا يبلغ 10 M من حمض الكبريتيك (655 ميكرولتر لحمض البيراسيتيك ، 635 ميكرولتر لحمض البيربروبيونيك ، أو 715 ميكرولتر لحمض البيرلاكتيك). رج القارورة برفق لتختلط ، وضع القارورة في حمام مائي 30 درجة مئوية داخل الغطاء الكيميائي. احتضان القارورة لمدة 2 أيام ، مع خلط لطيف كل صباح.
2. تشكيل الأغشية الحيوية المفردة والمختلطة
- لوحات المعايرة الدقيقة للغشاء الحيوي
- دوامة الأنبوب الذي يحتوي على المستنبتة البكتيرية (20 ميكرولتر من السلالة + 10 مل من وسط TSB ، أعدت في الخطوة 4.1.1). قم بإجراء التخفيف التسلسلي والطلاء على أجار الصويا التربتيك (TSA) لتحديد عدد الخلايا البكتيرية (cfu) للثقافة الليلية. ثم نقل 100 ميكرولتر من المستنبت بشكل معقم إلى 10 مل من وسط TSB المعقم (لتركيز نهائي يبلغ حوالي 2 × 107 cfu / mL).
ملاحظة: بالنسبة للفحص مع المفاعل الحيوي ، يتم نقل حجم 100 ميكرولتر من العزلة الميكروبية إلى 100 مل من TSB المعقم. - دوامة الأنبوب. لكل بكتيريا، انقل المستنبتة البكتيرية المخففة إلى صفيحة المعايرة الدقيقة للغشاء الحيوي (150 ميكرولتر لكل بئر) في ثلاث نسخ باستخدام ماصة متعددة القنوات. تحميل 150 ميكرولتر من وسيط TSB في ثلاثة آبار جديدة لتكون بمثابة أدوات تحكم. احتضان لوحة المعايرة الدقيقة للغشاء الحيوي (انظر جدول المواد) عند 30 درجة مئوية لمدة 24 ساعة دون تحريك.
ملاحظة: بالنسبة لمقايسات الأغشية الحيوية المختلطة، أضف 75 ميكرولتر من كل معلق لحجم إجمالي قدره 150 ميكرولتر. تحتوي لوحة المعايرة الدقيقة للغشاء الحيوي على أوتاد في أغطيتها ، تتشكل عليها الأغشية الحيوية.
- دوامة الأنبوب الذي يحتوي على المستنبتة البكتيرية (20 ميكرولتر من السلالة + 10 مل من وسط TSB ، أعدت في الخطوة 4.1.1). قم بإجراء التخفيف التسلسلي والطلاء على أجار الصويا التربتيك (TSA) لتحديد عدد الخلايا البكتيرية (cfu) للثقافة الليلية. ثم نقل 100 ميكرولتر من المستنبت بشكل معقم إلى 10 مل من وسط TSB المعقم (لتركيز نهائي يبلغ حوالي 2 × 107 cfu / mL).
- مفاعل حيوي
- قم بتنظيف أجزاء المفاعل الحيوي وتجفيفها بالهواء (انظر جدول المواد) باتباع تعليمات الشركة المصنعة ، واستمر في إعداد المفاعل كما هو موضح أدناه.
- أولا ، ضع الشفرة المسطحة داخل الدورق الزجاجي سعة 1 لتر (المفاعل الحيوي) ، والذي يتم توصيله بحامله بواسطة قضيب مغناطيسي ، وحافظ على الإعداد في وضع رأسي عن طريق القضيب البلاستيكي المتصل على الجانب الداخلي لغطاء المفاعل الحيوي.
- ضع القسائم أو الشرائح المصنوعة من الفولاذ المقاوم للصدأ (انظر جدول المواد) على قضبان البولي بروبلين باستخدام مفك البراغي ، وأدخلها في الفتحات الموجودة في الغطاء ، دون وضع دبابيس المحاذاة في الشقوق ، للسماح للبخار بالخروج أثناء التعقيم.
- قم بتغطية جميع فتحات المفاعل الحيوي بورق الألمنيوم ، ولف بقية المعدات ، وهي الأنابيب L / S 18 (ID = 7.9 مم) و L / S 16 (ID = 3.1 مم) ، وكسر التدفق الزجاجي ، وأغطية الحاويات ، والمفكات ، والملقط ، ومرشحات 0.2 ميكرومتر ، بورق الألمنيوم.
ملاحظة: أدخل أنبوب السيليكون (انظر جدول المواد) في الشوكة الموجودة على السطح الداخلي لغطاء الحاوية المتوسطة. - الأوتوكلاف المفاعل الحيوي الذي تم إعداده في دورة جافة عند 121 درجة مئوية لمدة 20 دقيقة.
- إجراء تشكيل الأغشية الحيوية في المفاعل الحيوي في وضع الدفعات (الخطوة الأولى).
- في BSC ، قم بتوصيل أحد طرفي الأنبوب L / S 18 بفوهة مخرج المفاعل الحيوي ، واحتفظ بالطرف الآخر ملفوفا بورق الألمنيوم للحفاظ على العقم.
- قم بإزالة قسيمة واحدة أو حامل منزلق من غطاء المفاعل الحيوي وضعه في أنبوب معقم سعة 50 مل. بعد ذلك ، املأ دورق المفاعل الحيوي ب 340 مل من وسط TSB 300 ملغم / لتر من خلال الفتحة التي كان يشغلها القضيب باستخدام ماصة مصلية سعة 50 مل.
- قم بتلقيح وسط الاستزراع في المفاعل الحيوي ب 1 مل من المحلول البكتيري (~ 108 cfu / mL من P. azotoformans) باستخدام ماصة 5 مل من خلال نفس الفتحة المستخدمة سابقا ، ثم ضع القضيب مرة أخرى في موضعه الأصلي. ضع القضبان الموضوعة بالفعل في فتحات الغطاء بحيث تتناسب المسامير مع الشقوق الخاصة بها.
- ضع مرشح تطهير الهواء البكتيري 0.2 ميكرومتر في نهاية الأنبوب بأصغر قطر ، والذي يقع على غطاء المفاعل الحيوي. يظل الأنبوب الآخر من نفس القطر متصلا بشكل دائم بغطاء لولبي معدني أو سدادة سيليكون تغلق بإحكام.
- ضع المفاعل الحيوي لمدة 24 ساعة فوق صفيحة التسخين المحددة عند 30 درجة مئوية وحركه عند 130 دورة في الدقيقة.
ملاحظة: بالنسبة لتكوين الأغشية الحيوية متعددة الأنواع ، استخدم حجما متساويا من المزارع البكتيرية المختلفة للحصول على حجم إجمالي قدره 1 مل للقاح.
- إجراء تكوين الأغشية الحيوية في المفاعل الحيوي في وضع التدفق المستمر (الخطوة الثانية).
- ضع كاربوي يحتوي على 18 لترا من الماء المقطر المعقم في BSC ، وأضف 2 لتر من 1000 مجم / لتر وسط استزراع TSB للحصول على تركيز نهائي قدره 100 مجم / لتر.
- قم بتغطية الحاوية بغطاءها المعقم ، الذي يتصل به أنبوبان. الأول هو أنبوب سيليكون مثبت على الوجه الداخلي للغطاء ويستخدم لضخ الوسط. يتم توصيل الأنبوب الثاني (L / S 16) بالمنفذ الخارجي للسماح للسائل بالتدفق نحو المفاعل الحيوي. ضع مرشح 0.2 ميكرومتر في الأنبوب الثاني على غطاء الحاوية المتوسطة.
- قم بتوصيل هذا الأنبوب الثاني بالمضخة التمعجية وانضم إلى الطرف الآخر بفاصل التدفق الزجاجي ، والذي يتم إدخاله بعد ذلك في الأنبوب الأكبر على غطاء المفاعل الحيوي.
- استخدم كاربوي 20 لترا آخر لجمع النفايات السائلة من المفاعل الحيوي. قم بتوصيل نهاية الأنبوب المتصل بفوهة مخرج المفاعل الحيوي بغطاء حاوية النفايات. أدخل مرشح 0.2 ميكرومتر في الأنبوب المتاح على غطاء هذه الحاوية.
- ابدأ تشغيل المضخة التمعجية بمعدل تدفق 11.3 مل / دقيقة ، واترك النظام يعمل لمدة 24 ساعة.
ملاحظة: تم تحديد معدل التدفق (11.3 مل / دقيقة) لوسط الاستزراع أو الحليب المستخدم أثناء تكوين الأغشية الحيوية في المفاعل الحيوي بقسمة 340 مل (وهو ما يتوافق مع حجم السائل داخل المفاعل) على وقت الإقامة البالغ 30 دقيقة.
- استعادة الغشاء الحيوي البكتيري.
- قم بإيقاف تشغيل المضخة التمعجية وتوقف عن تحريك وتسخين المفاعل الحيوي.
- قم بإزالة كل قضيب بعناية من المفاعل الحيوي ، وشطف القسائم أو الشرائح 3x في 40 مل من PBS للقضاء على بكتيريا العوالق. بعد ذلك ، حرر القسائم أو الشرائح في أنابيب مخروطية معقمة سعة 50 مل تحتوي على 40 مل من PBS باستخدام مفك براغي مناسب. دوامة الأنابيب لمدة 30 ثانية ، ونقلها إلى رف وضعت في حمام صوتي ، وصوتنة الأنابيب في 40 كيلو هرتز لمدة 30 ثانية (الأمر الذي يتطلب 110 واط من الطاقة). كرر هذه العملية 3x.
- اجمع معلقات الأغشية الحيوية الرقيقة سعة 40 مل في أنابيب مخروطية معقمة سعة 50 مل ، ثم اشطف القسائم أو الشرائح ب 2 مل من محلول PBS المعقم. استرجع سائل الشطف هذا وأضفه إلى تعليق الأغشية الحيوية الذي تم جمعه بالفعل.
- تعداد البكتيريا القابلة للحياة في الغشاء الحيوي: باستخدام تعليق الأغشية الحيوية الذي تم الحصول عليه ، قم بإجراء تخفيفات تسلسلية بمقدار 10 أضعاف ، ثم قم بلوحة 100 ميكرولتر من التخفيفات 10−5 و 10−6 على TSA في ثلاث نسخ. احتضان الألواح عند 30 درجة مئوية لمدة 24 ساعة. احسب عدد المستعمرات الموجودة على ألواح الآجار ، واحسب الكثافة البكتيرية على القسائم والشرائح (البكتيريا اللاطئة القابلة للحياة) وفقا ل ASTM E2562-1714 باستخدام الصيغة التالية:
 مكافئ (3)
مكافئ (3)
حيث X هو عدد وحدات تكوين المستعمرة (CFU) ، B هو الحجم المطلي (0.1 مل) ، V هو الحجم الذي يتم فيه تعليق الغشاء الحيوي (محلول المخزون) ، A هو سطح القسيمة أو الشريحة التي يغطيها الغشاء الحيوي ، و D هو عامل التخفيف.
- قم بتنظيف أجزاء المفاعل الحيوي وتجفيفها بالهواء (انظر جدول المواد) باتباع تعليمات الشركة المصنعة ، واستمر في إعداد المفاعل كما هو موضح أدناه.
3. التقييم الكمي لفعالية الأحماض البيروكسي العضوية في القضاء على الأغشية الحيوية
- لوحات المعايرة الدقيقة للغشاء الحيوي
- أضف 200 ميكرولتر من المحلول الملحي المخزن بالفوسفات (1x PBS) إلى ثلاثة آبار من صفيحة دقيقة مكونة من 96 بئرا.
- نقل غطاء الصفيحة الدقيقة للغشاء الحيوي ، مع الأغشية الحيوية التي تشكلت على الأوتاد ، إلى الصفيحة الدقيقة المكونة من 96 بئرا والتي تحتوي على PBS لمدة 10 ثوان من أجل غسل الأغشية الحيوية والقضاء على بكتيريا العوالق.
- تحضير المطهرات بالتركيزات المطلوبة (على سبيل المثال ، 25 جزء في المليون ، 50 جزء في المليون ، 500 جزء في المليون ، 1000 جزء في المليون ، 5000 جزء في المليون ، 10000 جزء في المليون ، و 25000 جزء في المليون من المادة الفعالة).
ملاحظة: يتم إجراء جميع التخفيفات بشكل معقم باستخدام الماء المقطر المعقم. - أضف 200 ميكرولتر من كل تركيز من المطهر إلى آبار صفيحة معايرة دقيقة جديدة مكونة من 96 بئرا في ثلاث نسخ. انقل غطاء لوحة المعايرة الدقيقة للغشاء الحيوي إلى صفيحة المعايرة الدقيقة المكونة من 96 بئرا والتي تحتوي على المطهرات، واحتضن الصفيحة في درجة حرارة الغرفة لوقت التعرض المطلوب.
- أضف 200 ميكرولتر من مرق تحييد Dey-Engley إلى آبار صفيحة عيار دقيقة جديدة مكونة من 96 بئرا. انقل غطاء لوحة المعايرة الدقيقة للغشاء الحيوي على صفيحة العيار الدقيق ذات 96 بئرا التي تحتوي على مرق التحييد. ختم لوحة microtiter مع parafilm ، ووضعها في صوتنة الحمام في 40 كيلو هرتز لمدة 30 دقيقة.
- بعد 30 دقيقة ، قم بإزالة لوحة العيار الدقيق من جهاز الصوتيات وإزالة parafilm. نقل 100 ميكرولتر من العمود الأول من لوحة 96 بئرا التي تحتوي على الأغشية الحيوية المنفصلة بعد صوتنة إلى الصف الأول من لوحة معايرة دقيقة جديدة ذات 96 بئرا.
- أضف 180 ميكرولتر من 1x PBS المعقم إلى آبار الصفيحة الدقيقة الجديدة المكونة من 96 بئرا (المحضرة في الخطوة 3.1.6) ، باستثناء الصف الأول. نقل 20 ميكرولتر من محلول الأغشية الحيوية من الصف الأول إلى الآبار في الصف الثاني التي تحتوي على 180 ميكرولتر من 1x PBS (الصف 2 ، التخفيف: 10−1). بعد ذلك ، انقل 20 ميكرولتر من السائل الموجود في الصف الثاني إلى الآبار في الصف التالي الذي يحتوي على 180 ميكرولتر من 1x PBS (الصف 3 ، التخفيف: 10−2). كرر نفس الإجراء للحصول على التخفيفات بين 10−5 و 10−7.
- تلقيح 100 ميكرولتر من التخفيفات على TSA ، واحتضان الألواح وفقا للمعايير المطلوبة لنمو كل بكتيريا.
- بعد الحضانة ، احسب cfus واحسب كثافة log 10 لكل ربط وتخفيض log10 عند كل تركيز مطهر باستخدام المعادلات التالية:
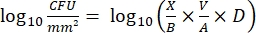 مكافئ (4)
مكافئ (4)
حيث X هي وحدات تشكيل المستعمرة المحسوبة في البقعة ، B هي الحجم المطلي (0.01 mL) ، V هو حجم البئر (0.20 mL) ، A هي مساحة سطح الوتد (46.63 mm2) ، و D هي التخفيف.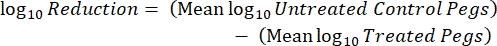 مكافئ (5)
مكافئ (5) - كرر كل تجربة 3 مرات في أيام مستقلة.
ملاحظة: "الحد الأدنى من تركيز المطهر الذي يقضي على الغشاء الحيوي" ، أو MBEC ، يتوافق مع أقل تركيز مطهر لا يظهر أي نمو بكتيري.
- مفاعل حيوي
ملاحظة: يتم اتباع إجراء معيار ASTM E2871-1915 لإجراء هذا الاختبار باستخدام P. azotoformans PFlA1.- ابدأ بتشكيل الأغشية الحيوية على القسائم في المفاعل الحيوي ، كما هو موضح في الخطوة 2.2. بعد ذلك ، قم بإزالة القضيب الذي يحمل القسائم وشطفه داخل أنبوب مخروطي يحتوي على 30 مل من PBS.
- قم بإسقاط كل قسيمة في أنبوب مخروطي معقم سعة 50 مل باستخدام مفك البراغي ، ثم أضف 4 مل من محلول البيروكسي أسيد العضوي المناسب أو PBS للتحكم. احتضن لمدة 5 دقائق ، ثم أضف 36 مل من مرق Dey-Engley المعادل. دوامة لمدة 30 ثانية ، ثم صوتنة عند 40 كيلو هرتز لمدة 30 ثانية باستخدام حمام صوتي. كرر العملية 3x للحصول على تعليق الأغشية الحيوية.
- وبالمثل ، شطف جميع قضبان أخرى واستعادة الأغشية الحيوية من القسائم. إجراء التخفيفات التسلسلية لمعلق الأغشية الحيوية واللوحة 0.1 مل على وسط TSA. احتضان الألواح عند 30 درجة مئوية لمدة 24 ساعة.
- بعد الحضانة ، عد cfus ، ثم احسب كثافة الأغشية الحيوية لكل قسيمة (Eq. 6) ، ومتوسط كثافة اللوغاريتم (LD) لكل مجموعة من ثلاث كوبونات من نفس القضيب ، بما في ذلك المعالجة والتحكم (Eq. 7) ، وتقليل السجل للمطهر (Eq. 8) باستخدام المعادلات التالية:
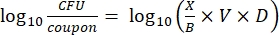 مكافئ (6)
مكافئ (6)
حيث X هو متوسط وحدات تشكيل المستعمرة المحسوبة / القسيمة ، B هو الحجم المطلي (0.1 مل) ، V هو حجم المطهر أو PBS بالإضافة إلى المعادل (40 مل) ، و D هو التخفيف.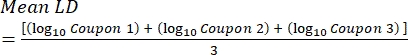 مكافئ (7)
مكافئ (7)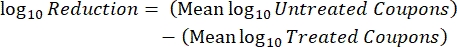 مكافئ (8)
مكافئ (8)
4. التقييم النوعي لفعالية أحماض البيروكسي العضوية في القضاء على الأغشية الحيوية
ملاحظة: بعد المعالجة بالمطهرات (الخطوة 3.1.1 إلى الخطوة 3.1.5) ، تم تحضير وتحليل الأغشية الحيوية P. azotoformans التي تشكلت على أوتاد لوحة المعايرة الدقيقة للغشاء الحيوي بالطريقة الثابتة من خلال الملاحظة على المجاهر الإلكترونية الماسحة والمجاهر متحدة البؤر.
- المجهر الإلكتروني الماسح (SEM)
- أضف 200 ميكرولتر من 1x PBS إلى ثلاثة آبار من صفيحة دقيقة ذات 96 بئرا. انقل الغطاء من لوحة المعايرة الدقيقة للغشاء الحيوي (الخطوة 3.1.5) إلى الصفيحة الدقيقة المكونة من 96 بئرا والتي تحتوي على برنامج تلفزيوني ، واتركه في درجة حرارة الغرفة لمدة 10 ثوان للتخلص من مرق Dey-Engley المعادل.
- قم بإزالة الأوتاد من لوحة المعايرة الدقيقة للغشاء الحيوي باستخدام كماشة أنف إبرة معقمة. ضع كل ربط في قنينة فارغة تحت غطاء محرك السيارة ، وأضف المثبت الأساسي (5٪ جلوتارالدهيد في 0.1 M Na cacodylate buffer pH 7.5) إلى كل قارورة. قم بتغطية كل قارورة واحتضانها عند 4 درجات مئوية لمدة 24 ساعة.
- بعد الحضانة ، صب المثبت باستخدام ماصة ، وتخلص من جميع النفايات السائلة في حاوية مناسبة. قم بإزالة أغطية كل قارورة وضعها في غطاء لتجف في الهواء لمدة 72 ساعة.
- قم بتركيب العينات على بذرة الألومنيوم (انظر جدول المواد) عن طريق تطبيق راتنجات الايبوكسي (انظر جدول المواد) على السطح العلوي المسطح لكل كعب. ثم ، لصق بعناية الأوتاد على بذرة مع ملقط.
- قم بتعدين العينات باستخدام مفرش الذهب EMS950x + 350s (انظر جدول المواد) لمدة 4 دقائق عند ضغط الأرجون 2 × 10−1 بار وتيار 20 مللي أمبير. قم بإجراء التأريض المناسب عن طريق طلاء جانب الوتد غير المعرض للذهب بالطلاء الفضي (انظر جدول المواد).
- احصل على صور على مجهر إلكتروني ماسح باستخدام واجهة مستخدم التحكم في SEM الإصدار 6.28 (انظر جدول المواد). كان جهد التسارع المستخدم في هذه الدراسة 15 كيلو فولت ، وكان التكبير 300x و 2000x.
- الفحص المجهري متحد البؤر
- أضف 200 ميكرولتر من 1x PBS إلى ثلاثة آبار من صفيحة عيار 96 بئرا. انقل الغطاء من الصفيحة الدقيقة للغشاء الحيوي إلى الصفيحة المكونة من 96 بئرا والتي تحتوي على PBS ، واتركها لمدة 10 ثوان للتخلص من مرق Dey-Engley المعادل.
- تحضير محاليل بقع الفلورسنت بإضافة 3 ميكرولتر من صبغة الفلورسنت الخضراء و 3 ميكرولتر من صبغة الفلورسنت الحمراء (انظر جدول المواد) إلى 1 مل من الماء المعقم.
- أضف 200 ميكرولتر من محلول التلوين إلى بئر واحد من صفيحة عيار 96 بئرا. انقل الغطاء من لوحة المعايرة الدقيقة للغشاء الحيوي إلى اللوحة المكونة من 96 بئرا والتي تحتوي على محلول التلطيخ. قم بتغطية لوحة المعايرة الدقيقة للغشاء الحيوي بورق الألمنيوم ، واحتضان العينة لمدة 20-30 دقيقة في درجة حرارة الغرفة.
- أضف 200 ميكرولتر من الماء المعقم إلى آبار صفيحة دقيقة مكونة من 96 بئرا. بعد ذلك ، انقل الغطاء من الصفيحة الدقيقة للغشاء الحيوي إلى الصفيحة الدقيقة المكونة من 96 بئرا والتي تحتوي على الماء ، واتركها حتى المراقبة.
- تصور الأغشية الحيوية المتكونة على الأوتاد باستخدام مجهر المسح بالليزر متحد البؤر (انظر جدول المواد) بهدف DIC للزيت 63x / 1.40. الحصول على الصور باستخدام البرامج المرتبطة (انظر جدول المواد). كانت الأطوال الموجية للإثارة الفلورية المستخدمة في بقع الفلورسنت الخضراء والحمراء 482 نانومتر و 490 نانومتر على التوالي.
ملاحظة: للحصول على أفضل النتائج ، قم بقص الوتد ووضعه في طبق بتري 60 مم واملأ الطبق بالماء المعقم.
النتائج
يظهر تحليل SEM وجود الأغشية الحيوية التي تنتجها P. azotoformans PFl1A على أوتاد الصفائح الدقيقة للغشاء الحيوي (الشكل 2A). يمكن ملاحظة بنية بيوفيلم ثلاثية الأبعاد. تم تحديد P. azotoformans PFl1A سابقا كمنتج قوي للأغشية الحيوية (A570 > 1.5) باستخدام 96 لوحة عيار ميكرو12.
Discussion
كان اختبار MBEC (فحص الصفائح الدقيقة للغشاء الحيوي) أول طريقة يتم التعرف عليها كاختبار قياسي للقضاء على الأغشية الحيوية بواسطة ASTM17. أظهرت دراستنا وغيرها أن هناك خطوتين حاسمتين عند استخدام هذا الفحص: خطوة الصوتنة (الوقت والطاقة) ووقت العلاج المطهر18. اقترح ستيوارت وب...
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم تضارب في المصالح.
Acknowledgements
تم دعم هذا البحث من قبل اتحاد البحوث والابتكارات في مجال الصناعة الحيوية في كيبيك (CRIBIQ) (2016-049-C22) ، Agropur ، Groupe Sani Marc ، ومجلس أبحاث العلوم الطبيعية والهندسة في كندا (NSERC) (RDCPJ516460-17). نشكر تيريزا بانيكوني على المراجعة النقدية للمخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 µm filters | Corning | 09-754-28 | diameter: 50 mm, PTFE- Membrane |
| 316 stainless-steel disc coupon | Biosurface Technologies Corporation | RD128-316 | |
| 316 stainless-steel slide coupon | Biosurface Technologies Corporation | CBR 2128-316 | |
| 96-microtiter plate | Corning | 07-200-89 | cell Culture-Treated, flat-Bottom Microplate |
| Acetic acid | Sigma Aldrich | 27225 | store at RT |
| Aluminium stubs | Electron Microscopy Science | 75830-10 | 32x5mm |
| Aqueous glutaraldehyde EM Grade 25% | Electron Microscopy Sciences | 16220 | store at -20 °C |
| AB204-S/FACT Analytical balance | Mettler Toledo | AB204-S | |
| Bacterial Vent Filter (0.45 µm) | Biosurface Technologies Corporation | BST 02915 | |
| BioDestroy | Groupe Sani Marc | 09-10215 | commercial peracetic acid-based disinfectant, store at RT |
| Carboy LDPE 20 L | Cole Parmer | 06031-52 | |
| CDC biofilm reactor | Biosurface Technologies Corporation | CRB 90 | bioreactor |
| Cerium (IV) sulphate | Thermo Scientific | 35650-K2 | store at RT |
| Confocal laser scanning microscope LSM 700 | Zeiss | LSM 700 | |
| Dey-Engley neutralizing broth | Millipore | D3435-500G | store at 4 °C |
| EMS950x + 350s gold sputter | Electron Microscopy Sciences | ||
| Epoxy resin | Electron Microscopy Sciences | 14121 | with BDMA |
| Ethyl alcohol 95%, USP | Greenfield global | P016EA95 | store at RT |
| Ferroin indicator solution | Sigma Aldrich | 318922-100ML | store at RT |
| Filling/venting cap | Cole Parmer | RK-06258-00 | |
| FilmTracer LIVE/DEAD Biofilm Viability Kit | Invitrogen | L10316 | fluorescent cell viability kit (SYTO 9: green fluorescent stain, Propidium iodide: red fluorescent stain), store at - 20 °C |
| Glass flow break | Biosurface Technologies Corporation | FB 50 | |
| Gold with silver paint | Electron Microscopy Sciences | 12684-15 | |
| Heating plate set | Biosurface Technologies Corporation | 110V Stir Plate | |
| Hex screwdriver | Biosurface Technologies Corporation | CBR 5497 | |
| Hydrogen peroxide | Sigma | 216763 | store at 4 °C |
| Inoculating loops | VWR | 12000-812 | sterile, 10 µl |
| Lactic acid | Laboratoire MAT | LU-0200 | store at RT |
| MASTERFLEX L/S 7557-04 W/ 7557-02 with EASY-LOAD II peristaltic pump and 77200-50 Head | Cole Parmer | 77200-60 | |
| MBEC (Minimum Biofilm Eradication Concentration) assay biofilm inoculator with a 96-well base | Innovotech | 19111 | Biofilm microtiter plate |
| Oxford agar base | Thermo Scientific | OXCM0856B | store at 4 °C |
| Plastic coupon holder | Biosurface Technologies Corporation | CBR 2203 | |
| Plastic slide holder rod | Biosurface Technologies Corporation | CBR 2203-GL | |
| Potassium iodide | Fisher Chemical | P410-500 | store at RT |
| Precision slotted screwdriver (1.5 mm x 40 mm) | Wiha | 26015 | |
| Propionic acid | Laboratoire MAT | PF-0221 | store at RT |
| Sartorius BCE822-1S Entris® II Basic Essential Toploading Balance | Cole Parmer | UZ-11976-3 | |
| Scanning electron microscope JSM-6360LV model | JEOL | JSM-6360LV | SEM and user control interface |
| Screw cap tube, 15 mL | Sarstedt | 62.554.205 | (LxØ): 120 x 17 mm, material: PP, conical base, transparent, HD-PE |
| Screw cap tube, 50 mL | Sarstedt | 62.547.205 | (LxØ): 114 x 28 mm, material: PP, conical base, transparent, HD-PE |
| Sodium Cacodylate Trihydrate | Electron Microscopy Sciences | 12300 | store at -20 °C |
| Sodium thiosulfate | Thermo Scientific | AC124270010 | store at RT |
| Sonication bath | Fisher | 15-336-122 | 5,7 L |
| Starch solution | Anachemia | AC8615 | store at RT |
| Sulfuric acid | Sigma Aldrich | 258105-500ML | store at RT |
| Tryptic soy agar | BD Bacto | DF0369-17-6 | store at RT |
| Tryptic soy broth | BD Bacto | DF0370-17-3 | store at RT |
| Tubing Masterflex L/S 16 25' | Cole Parmer | MFX0642416 | |
| Tubing Masterflex L/S 18 25' | Cole Parmer | MFX0642418 | |
| Tygon SPT-3350 silicon tubing | Saint-Gobain | ABW18NSF | IDx OD: 1/4 in.x 7/16 in. |
| Vortex | Cole Parmer | UZ-04724-00 | |
| Water bath | VWR | 89202-970 | |
| Zen software | Zeiss |
References
- Canada's dairy industry at a glance. Canadian Dairy Information Centre Available from: https://agriculture.canada.ca/en/canadas-agriculture-sectors/animal-industry/canadian-dairy-information-centre/canadas-dairy-industry-glance (2017)
- Oliver, S. P., Jayarao, B. M., Almeida, R. A. Foodborne pathogens in milk and the dairy farm environment: food safety and public health implications. Foodborne Pathogens and Disease. 2 (2), 115-129 (2005).
- Fondation de technologie laitière du Québec. . Science et technologie du lait. 3rd edn. , (2018).
- Evanowski, R., et al. Short communication: Pseudomonas azotoformans causes gray discoloration in HTST fluid milk. Journal of dairy science. 100, 7906-7909 (2017).
- Bower, C. K., McGuire, J., Daeschel, M. A. The adhesion and detachment of bacteria and spores on food-contact surfaces. Trends in Food Science & Technology. 7 (5), 152-157 (1996).
- Gupta, S., Anand, S. Induction of pitting corrosion on stainless steel (grades 304 and 316) used in dairy industry by biofilms of common sporeformers. International Journal of Dairy Technology. 71 (2), 519-531 (2018).
- Marchand, S., et al. Biofilm formation in milk production and processing environments; Influence on milk quality and safety. Comprehensive Reviews in Food Science and Food Safety. 11 (2), 133-147 (2012).
- Silva, H. O., et al. Efficiency of different disinfectants on Bacillus cereus sensu stricto biofilms on stainless-steel surfaces in contact with milk. Frontiers in Microbiology. 9, 2934 (2018).
- Sedlak, D. L., von Gunten, U. Chemistry. The chlorine dilemma. Science. 331 (6013), 42-43 (2011).
- vander Veen, S., Abee, T. Mixed species biofilms of Listeria monocytogenes and Lactobacillus plantarum show enhanced resistance to benzalkonium chloride and peracetic acid. International Journal of Food Microbiology. 144 (3), 421-431 (2011).
- Saa Ibusquiza, P., Herrera, J. J., Cabo, M. L. Resistance to benzalkonium chloride, peracetic acid and nisin during formation of mature biofilms by Listeria monocytogenes. Food Microbiology. 28 (3), 418-425 (2011).
- Goetz, C., Larouche, J., Velez Aristizabal, M., Niboucha, N., Jean, J. Efficacy of organic peroxyacids for eliminating biofilm preformed by microorganisms isolated from dairy processing plants. Applied and Environmental Microbiology. 88 (4), 0188921 (2022).
- Vimont, A., Fliss, I., Jean, J. Study of the virucidal potential of organic peroxyacids against norovirus on food-contact surfaces. Food and Environmental Virology. 7 (1), 49-57 (2015).
- ASTM E2562-17. Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown with High Shear and Continuous Flow using CDC Biofilm Reactor. ASTM International Available from: https://www.astm.org/e2562-17.html (2017)
- ASTM E2871-19. Standard Test Method for Evaluating Disinfectant Efficacy Against Pseudomonas aeruginosa Biofilm Grown in CDC Biofilm Reactor Using Single Tube Method. ASTM International Available from: https://www.astm.org/e2871-19.html (2019)
- Niboucha, N., et al. Comparative study of different sampling methods of biofilm formed on stainless-steel surfaces in a CDC biofilm reactor. Frontiers in Microbiology. 13, 892181 (2022).
- ASTM E2799-17. Standard Test Method for Testing Disinfectant Efficacy against Pseudomonas aeruginosa Biofilm using the MBEC Assay. ASTM International Available from: https://www.astm.org/e2799-17.html (2022)
- Parker, A. E., et al. Ruggedness and reproducibility of the MBEC biofilm disinfectant efficacy test. Journal of Microbiological Methods. 102, 55-64 (2014).
- Stewart, P. S., Parker, A. E. Measuring antimicrobial efficacy against biofilms: A meta-analysis. Antimicrobial Agents and Chemotherapy. 63 (5), 00020 (2019).
- Lindsay, D. K., Fouhy, K., Loh, M., Malakar, P. The CDC biofilm bioreactor is a suitable method to grow biofilms, and test their sanitiser susceptibilities, in the dairy context. International Dairy Journal. 126, 105264 (2022).
- Buckingham-Meyer, K., Goeres, D. M., Hamilton, M. A. Comparative evaluation of biofilm disinfectant efficacy tests. Journal of Microbiological Methods. 70 (2), 236-244 (2007).
- Goeres, D. M., et al. Statistical assessment of a laboratory method for growing biofilms. Microbiology (Reading). 151, 757-762 (2005).
- Williams, D. L., Woodbury, K. L., Haymond, B. S., Parker, A. E., Bloebaum, R. D. A modified CDC biofilm reactor to produce mature biofilms on the surface of peek membranes for an in vivo animal model application. Current Microbiology. 62 (6), 1657-1663 (2011).
- Pieranski, M. K., Rychlowski, M., Grinholc, M. Optimization of Streptococcus agalactiae biofilm culture in a continuous flow system for photoinactivation studies. Pathogens. 10 (9), 1212 (2021).
- Mendez, E., Walker, D. K., Vipham, J., Trinetta, V. The use of a CDC biofilm reactor to grow multi-strain Listeria monocytogenes biofilm. Food Microbiology. 92, 103592 (2020).
- Salgar-Chaparro, S. J., Lepkova, K., Pojtanabuntoeng, T., Darwin, A., Machuca, L. L. Nutrient level determines biofilm characteristics and subsequent impact on microbial corrosion and biocide effectiveness. Applied and Environmental Microbiology. 86 (7), 02885 (2020).
- Goeres, D. M., Simoes, M., Borges, A., Chaves Simoes, L., et al. Design and Fabrication of Biofilm Reactors. Recent Trends in Biofilm Science and Technology. , 71-88 (2020).
- Fjeld, C. S., Schüller, R. B. Biofilm formation during hexadecane degradation and the effects of flow field and shear stresses. Annual Transactions - The Nordic Rheology Society. 21, 341-346 (2013).
- Gilmore, B. F., Hamill, T. M., Jones, D. S., Gorman, S. P. Validation of the CDC biofilm reactor as a dynamic model for assessment of encrustation formation on urological device materials. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 93 (1), 128-140 (2010).
- Picioreanu, C., van Loosdrecht, M. C., Heijnen, J. J. Two-dimensional model of biofilm detachment caused by internal stress from liquid flow. Biotechnology and Bioengineering. 72 (2), 205-218 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved