Method Article
Neuromodulazione ad ultrasuoni focalizzati di colture neurali umane in vitro in array di microelettrodi multi-pozzetto
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per l'utilizzo di un sistema ad alto rendimento che consente il monitoraggio e la quantificazione degli effetti neuromodulatori degli ultrasuoni focalizzati sui neuroni delle cellule staminali pluripotenti indotte dall'uomo (HiPSC).
Abstract
Gli effetti neuromodulatori degli ultrasuoni focalizzati (FUS) sono stati dimostrati in modelli animali e il FUS è stato utilizzato con successo per trattare il movimento e i disturbi psichiatrici negli esseri umani. Tuttavia, nonostante il successo della FUS, il meccanismo alla base dei suoi effetti sui neuroni rimane poco compreso, rendendo difficile l'ottimizzazione del trattamento attraverso la regolazione dei parametri FUS. Per colmare questa lacuna di conoscenza, abbiamo studiato i neuroni umani in vitro utilizzando neuroni coltivati da cellule staminali pluripotenti indotte dall'uomo (HiPSC). L'utilizzo di HiPSC consente lo studio dei comportamenti neuronali specifici dell'uomo sia in stati fisiologici che patologici. Questo rapporto presenta un protocollo per l'utilizzo di un sistema ad alto rendimento che consente il monitoraggio e la quantificazione degli effetti neuromodulatori della FUS sui neuroni HiPSC. Variando i parametri FUS e manipolando i neuroni HiPSC attraverso modifiche farmaceutiche e genetiche, i ricercatori possono valutare le risposte neurali e chiarire gli effetti neuromodulatori di FUS sui neuroni HiPSC. Questa ricerca potrebbe avere implicazioni significative per lo sviluppo di terapie sicure ed efficaci basate su FUS per una serie di disturbi neurologici e psichiatrici.
Introduzione
Gli ultrasuoni focalizzati (FUS) sono una promettente modalità di neuromodulazione che consente la stimolazione non invasiva a profondità centimetriche con risoluzione sub-millimetrica 1,2,3. Nonostante questi punti di forza, l'impatto clinico della FUS è limitato, in parte a causa della mancanza di conoscenze sul suo meccanismo d'azione. Senza una solida base teorica, i ricercatori e i clinici incontrano difficoltà nell'adattare la terapia per soddisfare le esigenze specifiche dei singoli pazienti in condizioni variabili. Un'importante teoria proposta da Yoo et al.4 suggerisce che i canali ionici meccanosensibili siano responsabili dell'attivazione dei neuroni. Tuttavia, questa teoria non riesce a spiegare l'attivazione del FUS nei neuroni cerebrali umani, che mancano di questi canali5. Questa ambiguità limita l'utilizzo della FUS in clinica, in quanto preclude la regolazione dei parametri della FUS per ottimizzare i risultati del trattamento.
Precedenti studi correlati hanno impiegato una serie di approcci per indagare i meccanismi fisiologici alla base della FUS e per determinare i parametri di stimolazione ottimali. Un passo cruciale in questo processo prevede il monitoraggio delle risposte neuronali come feedback, che può essere ottenuto attraverso metodi che coinvolgono il monitoraggio ion-gate, come l'imaging ionicocalcio 4, l'imaging ottico1 e la registrazione elettrofisiologica ex vivo (ad esempio, elettromiografia6 o elettrofisiologia pelle-nervo7). Tuttavia, la maggior parte di questi studi utilizza neuroni non umani o approcci in vivo, che possono introdurre ulteriori variazioni a causa di controlli non ottimali. Al contrario, l'utilizzo di elettrodi per misurare i segnali neuronali nei neuroni in vitro delle cellule staminali pluripotenti indotte dall'uomo (HiPSC) offre misurazioni più sensibili e un maggiore controllo sull'ambiente sperimentale. In questo lavoro, è stato sviluppato un sistema in vitro che utilizza array di micro-elettrodi (MEA) per misurare le risposte elettriche dei neuroni HiPSC a seguito di stimolazione FUS, come mostrato nella Figura 1. Questo sistema consente ai ricercatori della comunità di monitorare le risposte neuronali quando si variano i parametri degli ultrasuoni (ad esempio, frequenza, durata del burst, intensità). Inoltre, questo sistema consente un elevato livello di controllo della sensibilità neuronale agli stimoli fisici (ad esempio, temperatura, pressione e cavitazione)8,9, poiché la funzionalità dei canali ionici dei neuroni può essere manipolata geneticamente e farmacologicamente (ad esempio, utilizzando il gadolinio per inibire i canali ionici)10,11,12. Questo controllo a livello molecolare può aiutare a chiarire i meccanismi alla base degli effetti neuromodulatori della FUS.
Protocollo
1. Preparazione dei materiali
- Aspirare il terreno di coltura e utilizzarlo per riempire un singolo pozzetto in una piastra di coltura neuronale a 24 pozzetti con MEA incorporato (Figura 2A). Coltura e induzione dei neuroni seguendo il protocollo pubblicato da Taga et al.13.
- Sterilizzare l'interfaccia del parafilm, l'elastico e il cono FUS con la sua membrana di gomma utilizzando etanolo al 70% per 10 minuti e posizionarli nella cappa aspirante per il successivo assemblaggio.
- Degassare 300 mL di acqua deionizzata e 50 mL di gel di accoppiamento. Centrifugare l'acqua e il gel a 160 x g per 5 minuti per evitare di indurre la cavitazione all'interno del mezzo di accoppiamento.
NOTA: La fonte originale delle HiPSC proviene da linee cellulari GM01582 e CIPS. In media, è possibile raggiungere una densità di 5 x 104 motoneuroni e 2,5 x 104 astrociti per pozzetto14.
2. Collegamento e configurazione delle periferiche
- Fissare il cono FUS al trasduttore utilizzando viti e sigillare il cono con una membrana di gomma flessibile in una cappa sterile ventilata. Riempire il cono con l'acqua degassata e deionizzata (DG-DI) del passaggio 1.3 e garantire l'assenza di bolle nel cono per evitare la cavitazione.
- Utilizzare un'asta filettata personalizzata per fissare il supporto stampato in 3D a un telaio (Figura 2B). Posizionare il telaio in modo tale che la testa del trasduttore FUS si trovi sopra il pozzetto che verrà stimolato.
- Utilizzare un elastico per fissare il parafilm sul pozzetto sulla piastra MEA a 24 pozzetti contenente il terreno e le HiPSC.
- Preparare il sistema FUS collegando l'elettronica del driver back-end del trasduttore a ultrasuoni, in questo caso l'uscita di potenza del trasduttore (TPO; Figura 3A), a una presa di corrente da 100-240 V (Figura 3B, Connessione 6) e collegando la rete corrispondente al TPO e al trasduttore FUS (Figura 3B, Connessione 1 e Connessione 2, rispettivamente). La rete di corrispondenza garantisce un efficiente accoppiamento elettrico tra il trasduttore e il TPO.
- Collegare il sistema MEA a una presa di corrente (100-240 V) (Figura 3B, Collegamento 5). Collegare la porta di sincronizzazione del sistema MEA al TPO (Figura 3B, Connessione 3). Questa connessione sincronizzerà l'acquisizione dei dati da parte del sistema MEA con la stimolazione FUS.
- Posizionare la piastra MEA a 24 pozzetti nel sistema MEA e rimuovere il coperchio per consentire il contatto diretto tra il trasduttore e il pozzetto. Posizionare il trasduttore 5-10 mm sopra la piastra del pozzetto per lasciare spazio al gel di accoppiamento degassato, come descritto al punto 3.2 (Figura 3A e Figura 2B).
3. Stimolazione e acquisizione del segnale neuronale
- Impostare i parametri FUS sul pannello di controllo TPO (Tabella 1).
- Applicare il gel di accoppiamento sopra il parafilm e abbassare il trasduttore FUS nel gel di accoppiamento, assicurando il contatto con il gel con bolle d'aria minime (Figura 2A).
- Avviare la registrazione del sistema MEA facendo clic sul pulsante Start nell'interfaccia utente.
- Avviare la sonicazione FUS premendo il pulsante in basso a destra sul TPO (Figura 3A, Etichetta 7) e attendere almeno 5 minuti tra ogni ciclo di sonicazione per consentire ai neuroni di tornare a uno stato di base.
- Utilizzare l'impulso di trigger generato dal sistema FUS per allineare la sequenza di stimolazione FUS alla registrazione MEA (Figura 3B, Collegamento 3).
4. Elaborazione e analisi dei dati
- Trasferire i dati dal sistema MEA al computer utilizzando una connessione USB (Figura 3B, Connessione 4). Per iniziare, fare clic sul pannello Configurazione esperimento . Successivamente, scegli il tipo di dati che desideri registrare. In questo caso, si consigliano picchi grezzi. Infine, assegna un nome al file e seleziona la posizione desiderata all'interno dell'unità disco per completare il trasferimento.
NOTA: i seguenti passaggi possono essere eseguiti eseguendo lo script Python rilasciato in https://github.com/Rxliang/FUSNeuromod. - Leggere i dati di ciascuno dei 16 elettrodi.
- Applicare un filtro passa-banda di Butterworth con una larghezza di banda da 5 Hz a 3 kHz con un ordine di Butterworth di 8.
NOTA: Per ottimizzare questi valori, è fondamentale tenere conto della velocità di attivazione delle celle specifiche e del numero di celle coinvolte. Moltiplicando questi 2 valori, si può stimare la velocità di attivazione complessiva della popolazione cellulare nell'esperimento. - Applicare un filtro gaussiano con σ = 3 per attenuare il segnale.
NOTA: Il parametro può essere ottimizzato in base ai valori consigliati dal sistema MEA, poiché un livellamento eccessivo può causare una distorsione dei dati dopo l'acquisizione e un livellamento insufficiente introdurrebbe rumore indesiderato. - Impostare una soglia per rilevare i picchi potenziali pari a 5 volte la deviazione standard del segnale livellato gaussiano.
- Calcola la frequenza di attivazione dividendo il numero di picchi registrati in una finestra di 50 ms su tutti i 16 canali per la lunghezza della finestra (ad esempio, 50 ms). Spostare la finestra lungo il segnale al fotogramma successivo e ripetere il calcolo della velocità di sparo (Figura 1 supplementare).
- Analizza il segnale leggendo il tempo di sonicazione FUS dai dati trasferiti in base alla variazione della velocità di accensione associata al FUS.
5. Pulizia e riutilizzo delle piastre MEA multipozzetto
- Una volta completati gli esperimenti, utilizzare una pipetta per rimuovere con cautela il terreno dai pozzetti nella piastra a più pozzetti, facendo attenzione a evitare la superficie dell'elettrodo.
- Aggiungere 2 mL di acqua DG-DI per pozzetto. Aspirare e ripetere una volta.
- Per rimuovere cellule e detriti, aggiungere una miscela di 1 g di detergente enzimatico Terg-A-Zyme con 10 mL di acqua DG-DI sterile (0,3 mL per pozzetto) nella piastra. Lasciare incubare per una notte a temperatura ambiente (RT).
- Il giorno seguente, rimuovere la soluzione dai pozzetti e sciacquarli con 1 mL di acqua sterile DG-DI.
- Incubare la piastra a più pozzetti per 5-7 minuti e aspirare. Ripeti questo passaggio 5 volte.
- Aggiungere 0,5 mL di acqua DG-DI sterile per pozzetto. Registrare la linea di base della piastra a più pozzetti pulita per verificare che la piastra MEA sia pulita. Una piastra pulita dovrebbe presentare modelli di rumore gaussiano con bassi valori di intensità.
- Conservare la piastra a più pozzetti pulita a 4 °C fino a quando non è pronta per essere riutilizzata. Cambiare l'acqua in cui sono conservati i MEA almeno una volta al mese.
Risultati
In sintesi, presentiamo un protocollo che consente il monitoraggio in vitro della neuromodulazione FUS utilizzando neuroni coltivati da HiPSC. La piattaforma complessiva del sistema per stimolare i neuroni indotti da HiPSC e registrare le corrispondenti risposte elettriche per l'analisi è delineata nella Figura 1. Questo studio si concentra sulla stimolazione FUS dei neuroni e sulla registrazione delle risposte elettriche in un sistema MEA, come mostrato nella Figura 2. I componenti periferici dei sistemi FUS e MEA e le loro connessioni sono illustrati nella Figura 3.
La caratterizzazione del punto focale viene eseguita prima degli esperimenti neuronali per garantire che il fondo del pozzo sia completamente coperto dal punto focale FUS. La visualizzazione della macchia focale su fogli termocromici, come mostrato in Figura 4, deve essere eseguita per valutare il sistema FUS. Dopo la caratterizzazione del punto focale, è necessario eseguire le fasi di post-elaborazione, tra cui il filtraggio, la soglia e il calcolo della velocità di attivazione, riassunte nella Figura 5 e nella Figura 6. Questi passaggi sono essenziali per recuperare segnali utili filtrando il rumore dall'ambiente e, quindi, per ottenere informazioni sui cambiamenti dell'attività neuronale causati dalla FUS. I grafici raster nella Figura 6A-B mostrano i picchi rilevati in ciascun canale. Poiché l'intero fondo del pozzetto si trova all'interno del punto focale del trasduttore FUS, ci si aspetta che il FUS alteri la velocità di accensione su tutti gli elettrodi. Questo cambiamento nella frequenza di attivazione è visualizzato nel grafico della frequenza di attivazione mostrato nella Figura 6C, che mostra che i parametri di stimolazione scelti hanno provocato un aumento della frequenza di attivazione neuronale. In particolare, la frequenza di accensione pre-FUS (cioè di base) era di 140 Hz ± 116,7 Hz, mentre la frequenza di accensione post-FUS era di 786 Hz ± 419,4 Hz con FUS a onda continua. Inoltre, la Figura 6C mostra come l'alterazione dei parametri FUS (ad esempio, l'utilizzo di FUS a onda pulsata invece di onda continua) possa alterare l'entità del cambiamento nella velocità di attivazione, nonché modificare la quantità di tempo prima che i neuroni ritornino al loro stato basale. L'ecografia focalizzata a bassa intensità (LIFU) non provoca un riscaldamento significativo delle colture, soprattutto se confrontata con l'ecografia focalizzata ad alta intensità, che intende ottenere una lesione termica. L'assenza di variazioni di temperatura clinicamente impattanti è supportata da calcoli teorici e simulazioni (Figura 2 supplementare). Anche in casi estremi dei parametri sperimentali FUS elencati nella Tabella 1, è stato possibile osservare solo un minimo aumento della temperatura di circa 0,04 °C.
L'uso di un grafico della frequenza di attivazione consente di quantificare gli effetti neuromodulatori della FUS e può essere utilizzato per differenziare tra risposte eccitatorie e inibitorie. Un vantaggio significativo della piastra MEA multipozzetto è che può essere riutilizzata più volte per studiare diversi stati neuronali e parametri di stimolazione in modo ad alto rendimento.
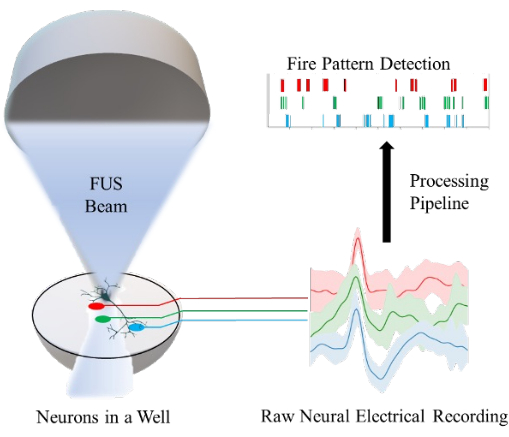
Figura 1: Panoramica della piattaforma in vitro per la neuromodulazione a ultrasuoni focalizzati (FUS) di neuroni in un pozzetto e la misurazione della loro attività neuronale utilizzando un array di microelettrodi. Ogni elettrodo (linee rosse, verdi e blu) registra da una popolazione di neuroni all'interno di un singolo pozzetto. Viene implementata una pipeline di elaborazione per convertire le registrazioni elettriche neuronali grezze nel rilevamento di modelli di attivazione neuronale. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Neuromodulazione FUS con un array di microelettrodi multi-pozzetto (MEA). (A) Schema del setup per la neuromodulazione FUS con un MEA multi-pozzetto. Le onde acustiche generate dal trasduttore FUS si propagano attraverso un cono FUS riempito con acqua degassata e vengono accoppiate mediante gel ad ultrasuoni. Il parafilm è fissato al pozzetto utilizzando un elastico per evitare la contaminazione. La piastra MEA invia registrazioni elettriche dai neuroni al sistema MEA. (B) Una fotografia del trasduttore FUS sulla piastra multipozzetto contenuta nel sistema MEA. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Configurazione della piattaforma in vitro . (A) La parte anteriore della configurazione della piattaforma in vitro . L'uscita di potenza del trasduttore (TPO; a sinistra) viene utilizzata per programmare i parametri FUS. Il sistema MEA (a destra) registra l'attività elettrica dei neuroni nella piastra del pozzetto, che sono neuromodulati dal trasduttore FUS. (B) Il retro della configurazione della piattaforma in vitro con connessioni dalla rete corrispondente (1) al TPO e (2) al trasduttore. (3) La connessione dal sistema MEA al TPO sincronizza l'acquisizione dei dati. (4) La connessione dal sistema MEA al computer per il trasferimento dei dati. (5) Il collegamento dell'alimentazione al sistema MEA. (6) Il collegamento di alimentazione al sistema FUS. (7) Il pulsante di sonicazione. Fare clic qui per visualizzare una versione più grande di questa figura.
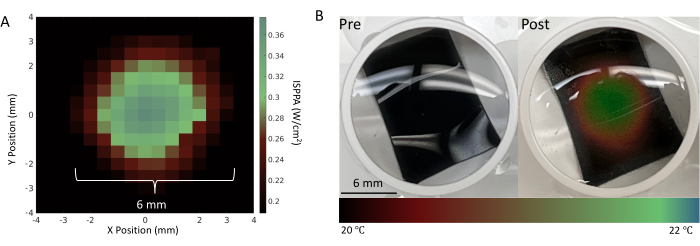
Figura 4: Caratterizzazione del trasduttore FUS. (A) Una mappa della pressione della macchia focale utilizzando i parametri FUS dettagliati nella Tabella 1 misurati dal sistema AMPLITUDE15. (B) Pre- e post-sonicazione di un foglio termocromico posto sul fondo di un pozzo utilizzando la configurazione sperimentale mostrata nella Figura 3. Il foglio termocromico cambia colore in risposta alle variazioni di temperatura, il che fornisce una convalida visiva della stimolazione riuscita nella posizione dei neuroni. L'intensità media massima dell'impulso di picco spaziale (ISPPA) di 30 W/cm2 e la sonicazione continua di 3 minuti sono state regolate per modificare drasticamente la temperatura locale per una migliore visualizzazione di tale punto focale. Fare clic qui per visualizzare una versione più grande di questa figura.
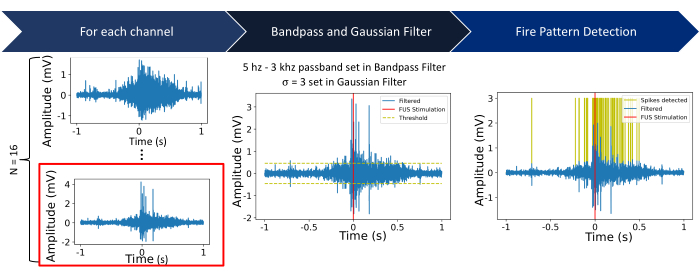
Figura 5: Pipeline di elaborazione. Passo 1: Le registrazioni elettriche grezze vengono acquisite da N = 16 canali. I passaggi successivi mostrano il processo utilizzando il canale 16 (evidenziato in rosso). Passo 2: Per ogni canale, viene applicato un filtro passa-banda Butterworth (passa-banda da 5 Hz a 3 kHz), seguito da un filtro gaussiano (σ = 3). Una soglia è impostata come cinque volte la deviazione standard del segnale all'interno di una finestra di 2 s centrata all'inizio della sonicazione. Fase 3: I segnali al di sopra o al di sotto della soglia sono caratterizzati da picchi. Fare clic qui per visualizzare una versione più grande di questa figura.
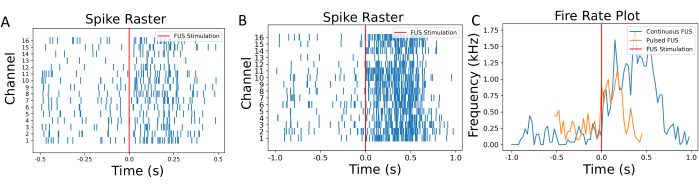
Figura 6: Grafici raster e velocità di sparo. (A) Grafico raster dei picchi rilevati in ciascun canale in funzione del tempo di sonicazione. Il tempo di stimolazione FUS è annotato da una linea rossa. (B) Grafico raster di neuroni in diverse impostazioni FUS con FUS continuo per il confronto. (C) La cadenza di sparo è stata calcolata utilizzando una finestra scorrevole di 50 ms. Le frequenze medie di attivazione prima e dopo le neuromodulazioni FUS erano rispettivamente di 140 Hz e 786 Hz. Con il FUS pulsato, le velocità medie di sparo erano di 230 Hz e 540 Hz. È stato osservato che un'attivazione più breve e una minore variazione della velocità sono indotte da questo insieme di stimolazione FUS variabile. Il processo di calcolo della velocità di sparo è descritto in dettaglio nella Figura 1 supplementare. Fare clic qui per visualizzare una versione più grande di questa figura.
| Parametro | Valore |
| Potenza massima/Ch. | 1.200 W |
| Peffettivo | 0,749 W/canale. |
| ISPPA | 10,79 W/cm2 |
| ISPTA | 0,05 W/cm2 |
| Lunghezza burst | 0,100 millimetri |
| Frequenza | 250,00 kHz |
| Fuoco | 39.800 millimetri |
| Periodo | 20.000 ms |
| Temporizzatore | 60.000 secondi |
Tabella 1: Parametri degli ultrasuoni focalizzati (FUS) impostati sul TPO per lo studio presentato nella Figura 4.
Figura 1 supplementare: Elaborazione dal grafico raster alla velocità di attivazione. Passo 1: Contare i picchi tra tutti i canali per ottenere il numero di conteggio all'interno di una determinata finestra temporale. Nota: In questo caso, è stata scelta una finestra scorrevole più grande (impostata a 0,1 s) per una migliore illustrazione. Passaggio 2: converti i picchi per lunghezza della finestra in picchi al secondo (ad esempio, qui, moltiplica i conteggi per 10 per convertire in hertz [Hz], quindi dividi per 1.000 per ottenere il valore in kilohertz [kHz]). Fase 3: La curva della velocità di sparo acquisita di conseguenza. Un toolkit open source, insieme ai dati campionati, è disponibile su GitHub (https://github.com/Rxliang/FUSNeuromod). Fare clic qui per scaricare il file.
Figura 2 supplementare: Profilo di temperatura del risultato della simulazione dell'onda K di LIFU16. Sulla base della mappa dell'intensità acustica mostrata in Figura 4, il risultato della simulazione dell'onda K suggerisce un aumento massimo della temperatura di 0,04 °C all'interno della regione centrale della zona focale (raggio: 2 mm) utilizzando il caso estremo dei parametri FUS sperimentali elencati nella Tabella 1. Fare clic qui per scaricare il file.
Discussione
Questo manoscritto descrive un nuovo metodo che può essere utilizzato per registrare l'attività neuronale nelle HiPSC durante la neuromodulazione FUS. Questo protocollo è generalizzabile a diversi trasduttori FUS e sistemi MEA. Per replicare i risultati osservati con il protocollo descritto, il ricercatore deve assicurarsi che il punto focale del trasduttore sia maggiore dell'area del fondo del pozzo MEA. Inoltre, se vengono utilizzate diverse linee cellulari neuronali, i parametri del filtro devono essere regolati sulla risposta in frequenza prevista per le cellule all'interno del pozzetto. Se non è possibile ottenere risultati rappresentativi, si dovrebbe prendere in considerazione la possibilità di modificare i parametri di cui sopra (ad esempio, la lunghezza di scoppio, l'intensità, il ciclo di lavoro, ecc.).
Sebbene questo lavoro abbia dimostrato un aumento della velocità di attivazione dopo la stimolazione FUS, è necessario raccogliere ulteriori dati per dimostrare la ripetibilità di questo risultato prima di trarre conclusioni. Questo protocollo eredita i limiti dei sistemi MEA, che in genere presentano punti deboli derivanti dalla registrazione diretta del segnale di corrente del microelettrodo. Sebbene il contatto diretto con il neurone fornisca una migliore sensibilità, può alterare la cellula e influire sulla precisione della misurazione. Inoltre, a causa delle piccole dimensioni dei pozzetti, il nostro sistema non include il tessuto periferico, che può anche svolgere un ruolo nella neuromodulazione17. Ciò può limitare l'applicabilità delle conclusioni tratte da questa configurazione agli ambienti in vivo . Per studiare risposte di rete più complesse, è necessario progettare un sistema MEA a densità di canale più elevata per migliorarne la sensibilità18. Sono state identificate diverse direzioni future per questo sistema proposto, tra cui l'utilizzo di un portale 3D per sostenere il trasduttore e garantire un posizionamento accurato19. Ulteriori miglioramenti potrebbero essere apportati per quanto riguarda l'algoritmo di post-elaborazione, incluso l'utilizzo di un algoritmo di ordinamento a picco20 per classificare i singoli neuroni. Questo processo sarebbe utile per districare le risposte dei neuroni multi-unità in studi futuri sui meccanismi della FUS. Ancora più importante, è essenziale incorporare ulteriori modalità di stimolazione, come stimoli chimici, elettrici e ottici, per chiarire i meccanismi sottostanti. Questi metodi possono alterare le proprietà e i comportamenti neuronali, ad esempio inibendo specifici canali ionici15 o modificando le caratteristiche della membrana21. Modulando i principali fattori all'interno della via di segnalazione ipotizzata, i ricercatori possono identificare i contributi di ciascun fattore in ambienti controllati e, in definitiva, far luce sulle complesse interazioni in gioco.
La stimolazione elettrica22 è una delle tecniche più consolidate per la neuromodulazione, con una lunga storia di applicazioni di successo in ambito clinico e di ricerca. Al contrario, FUS e optogenetica23 sono modalità relativamente nuove che hanno attirato l'attenzione negli ultimi anni. I principali vantaggi della FUS sono la sua non invasività e la capacità di stimolare i neuroni a profondità che possono essere difficili da raggiungere con altre tecniche, tra cui la stimolazione elettrica e l'optogenetica. Tuttavia, come l'optogenetica24, la FUS ha alcune limitazioni legate alla modellazione della propagazione delle onde e delle risposte neuronali associate. Catturare la complessità delle proprietà acustiche eterogenee dei tessuti in vivo può essere difficile, il che porta a incertezze nel campo di pressione e, di conseguenza, nelle risposte neuronali. Questa difficoltà nel modellare con precisione queste proprietà rappresenta una sfida quando si ottimizza la tecnica per specifiche applicazioni del mondo reale. Le complessità intrinseche sottolineano l'importanza di sistemi in vitro come quello in questo studio, in quanto consentono lo studio diretto delle risposte in condizioni di intensità acustica controllata.
In conclusione, questo sistema fornisce una piattaforma in vitro ad alto rendimento per studiare gli effetti neuromodulatori della FUS sui neuroni umani. Con questo sistema, i meccanismi d'azione della FUS possono essere esplorati misurando le risposte elettriche dei neuroni umani quando esposti a diversi livelli e tipi di stimolazione in un ambiente controllato. Pertanto, offre un valido strumento supplementare ai modelli umani e animali comunemente utilizzati sul campo.
Divulgazioni
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che possa essere interpretata come un potenziale conflitto di interessi. Amir Manbachi insegna e fornisce consulenza per BK Medical (GE Healthcare) e Neurosonics Medical ed è inventore di una serie di tecnologie FUS in attesa di brevetto. Betty Tyler ha finanziamenti per la ricerca da NIH ed è co-proprietaria di Accelerating Combination Therapies (comprese azioni o opzioni). Ashvattha Therapeutics Inc. ha concesso in licenza uno dei suoi brevetti ed è azionista di Peabody Pharmaceuticals.
Riconoscimenti
Amir Manbachi e Nitish Thakor riconoscono il sostegno finanziario della Defense Advanced Research Projects Agency, DARPA, Award Contract: N660012024075. Inoltre, Amir Manbachi riconosce il sostegno finanziario del Johns Hopkins Institute for Clinical and Translational Research (ICTR) Clinical Research Scholars Program (KL2), amministrato dal National Center for Advancing Translational Sciences (NCATS), National Institutes of Health (NIH). Nitish Thakor riconosce il sostegno finanziario del National Institutes of Health (NIH): R01 HL139158-01A1 e R01 HL071568-15.
Materiali
| Name | Company | Catalog Number | Comments |
| MEA System | Axion Biosystem Inc. | Maestro Edge | Sampling Rate: 11500 Hz |
| MEA Plate | Axion Biosystem Inc. | CytoView MEA | Electrode and Well: 16 electrodes in 24 wells |
| Well plate Interface | Amcor Inc. | Parafilm PM996; P7793 | Thickness: 127 µm |
| CO2 Tank and Regulator for culture | AirGas Inc./ Harris Inc. | 9296NC | Concentration: 5% |
| Culture Media | ThermoFisher Inc. | Laminin; 23017-015 | Concentration: 1 µg/mL |
| HiPSC Neurons | Peprotech | CIPS and GM01582 Derived; 450-10 | Concentration: 10 ng/mL (Refer Taga et al [2021]13) |
| Transducer | Sonic Concepts Inc. | CTX250; 008 | Center Frequency: 250 kHz |
| Matching Network | Sonic Concepts Inc. | CTX250; NFS102v2 | Impedance: 50 Ω |
| Transducer Power Output (TPO) | Sonic Concepts Inc. | Version 4.1; 020 | Frequency: From 250 kHz to 2.5 MHz |
| Membrane | McMaster Inc. | Silicone Rubber; 5542N115 | Thickness: 0.0127 cm |
| Coupling Gel | Parker Laboratory Inc. | Aquasonic 100; B08DDWG GXB | Viscosity: 130,000–185,000 cops |
| Connection to Probe holder | McMaster Inc. | Steal Threaded Rod; 90322A661 | Length: 1–1/2" Long |
| Centrifuge | ThermoFisher Inc. | Sorvall Legend X1R; 75004261 | Max acceleration: 10–25,830 x g |
| Hydrophone | Sonic Concepts Inc. | Y-104; 009 | Range: 50 kHz–1.9 MHz |
| Water Tank | Sonic Concepts Inc. | WT | Size: 30 cm x 30 cm x 30 cm |
| Water Conditioning Unit | Sonic Concepts Inc. | WCU; SN006 | Flow Velocity: 50 mL/s maximum |
| Oscilloscope | Rohde-Schwarz Inc. | RTC1002 | Sampling rate: Up to 50 MHz |
| Stage | Sonic Concepts Inc. | MicroStage; 2 | Accuracy: 1 µm |
| Thermochromic sheet | TIPTEMP Inc. | Liquid Crystal Sheet; TLCSEN337 | Range: 22–24 °C |
| Computer | Microsoft Surface | Surface Pro | CPU i5 1035G4: 3.7 GHz |
| Data Transfer Software | Mathworks Inc. | MATLAB | Version 2021b |
| Processing Software | Python Software Foundation | Python | Version 3.7.10 |
Riferimenti
- Kamimura, H. A. S., Conti, A., Toschi, N., Konofagou, E. E. Ultrasound neuromodulation: Mechanisms and the potential of multimodal stimulation for neuronal function assessment. Frontiers in Physics. 8, 150 (2020).
- Manbachi, A., Kempski, K. M., Curry, E. J. . The Abundant Promise of Ultrasound in Neurosurgery: A Broad Overview and Thoughts on Ethical Paths to Realizing Its Benefits. , (2022).
- . Handbook for Clinical Ultrasound.Beginner's Guide to Fundamental Physics & Medical Ultrasound Applications. Audible Available from: https://www.audible.com/pd/Handbook-for-Clinical-Ultrasound-Audiobook/B0983XJY83 (2021)
- Yoo, S., Mittelstein, D. R., Hurt, R. C., Lacroix, J., Shapiro, M. G. Focused ultrasound excites cortical neurons via mechanosensitive calcium accumulation and ion channel amplification. Nature Communications. 13 (1), 493 (2022).
- Szczot, M., Nickolls, A. R., Lam, R. M., Chesler, A. T. The form and function of PIEZO2. Annual Review of Biochemistry. 90, 507-534 (2021).
- Kim, H., et al. Miniature ultrasound ring array transducers for transcranial ultrasound neuromodulation of freely-moving small animals. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 12 (2), 251-255 (2019).
- Hoffman, B. U., et al. Focused ultrasound excites action potentials in mammalian peripheral neurons in part through the mechanically gated ion channel PIEZO2. Proceedings of the National Academy of Sciences of the United States of America. 119 (21), e2115821119 (2022).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews Neuroscience. 13 (12), 867-878 (2012).
- Collins, M. N., Legon, W., Mesce, K. A. The inhibitory thermal effects of focused ultrasound on an identified, single motoneuron. eNeuro. 8 (2), (2021).
- Chalfie, M. Neurosensory mechanotransduction. Nature Reviews. Molecular Cell Biology. 10 (1), 44-52 (2009).
- Launay, P., et al. TRPM4 Is a Ca2+-activated nonselective cation channel mediating cell membrane depolarization. Cell. 109 (3), 397-407 (2002).
- Cain, S. M., Snutch, T. P. Contributions of T-type calcium channel isoforms to neuronal firing. Channels. 4 (6), 475-482 (2010).
- Taga, A., et al. Establishment of an electrophysiological platform for modeling ALS with regionally-specific human pluripotent stem cell-derived astrocytes and neurons. Journal of Visualized Experiments. (174), e62726 (2021).
- Taga, A., et al. Role of human-induced pluripotent stem cell-derived spinal cord astrocytes in the functional maturation of motor neurons in a multielectrode array system. Stem Cells Translational Medicine. 8 (12), 1272-1285 (2019).
- Manuel, T. J., et al. Ultrasound neuromodulation depends on pulse repetition frequency and can modulate inhibitory effects of TTX. Scientific Reports. 10 (1), 15347 (2020).
- Treeby, B. E., Cox, B. T. k-wave: Matlab toolbox for the simulation and reconstruction of photoacoustic wave fields. J. Biomed. Opt. 15 (2), 021314 (2010).
- Akhtar, K., et al. Noninvasive peripheral focused ultrasound neuromodulation of the celiac plexus ameliorates symptoms in a rat model of inflammatory bowel disease. Experimental Physiology. 106 (4), 1038-1060 (2021).
- Smirnova, L., et al. Organoid intelligence (OI): The new frontier in biocomputing and intelligence-in-a-dish. Frontiers in Science. 1, 1017235 (2023).
- Saccher, M., et al. Focused ultrasound neuromodulation on a multi-well MEA. Bioelectronic Medicine. 8 (1), 2 (2022).
- Yger, P., et al. A spike sorting toolbox for up to thousands of electrodes validated with ground truth recordings in vitro and in vivo. eLife. 7, e34518 (2018).
- Babakhanian, M., et al. Effects of low intensity focused ultrasound on liposomes containing channel proteins. Scientific Reports. 8, 17250 (2018).
- Liang, R., et al. Designing an Accurate Benchtop Characterization Device: An acoustic measurement platform for localizing and implementing therapeutic ultrasound devices and equipment (amplitude). 2022 Design of Medical Devices Conference. , (2022).
- Ko, H., Yoon, S. -. P. Optogenetic neuromodulation with gamma oscillation as a new strategy for Alzheimer disease: A narrative review. Journal of Yeungnam Medical Science. 39 (4), 269-277 (2022).
- White, M., Mackay, M., Whittaker, R. G. Taking optogenetics into the human brain: Opportunities and challenges in clinical trial design. Open Access Journal of Clinical Trials. 2020, 33-41 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon