Method Article
استخدام دماغ جنين الفرخ كنموذج للتحليلات داخل الجسم الحي وخارج الجسم الحي لسلوك خلايا الورم الأرومي الدبقي البشري
In This Article
Summary
تستخدم أجنة الكتاكيت لدراسة أورام الدماغ بالورم الأرومي الدبقي البشري (GBM) في البويضات وفي الثقافات المشتركة لشرائح الدماغ خارج الجسم الحي. يمكن تسجيل سلوك خلية GBM عن طريق الفحص المجهري بفاصل زمني في الثقافات المشتركة خارج الجسم الحي ، ويمكن تحليل كلا المستحضرين عند نقطة النهاية التجريبية عن طريق تحليل مفصل 3D متحد البؤر.
Abstract
كان جنين الفرخ نظاما نموذجيا مثاليا لدراسة تطور الفقاريات ، خاصة للتلاعب التجريبي. تم توسيع استخدام جنين الفرخ لدراسة تكوين أورام الدماغ بالورم الأرومي الدبقي البشري (GBM) في الجسم الحي وغزو الخلايا السرطانية في أنسجة المخ المحيطة. يمكن تشكيل أورام GBM عن طريق حقن معلق للخلايا الموسومة بالفلورسنت في البطين E5 للدماغ المتوسط (القفص البصري) في البيض.
اعتمادا على خلايا GBM ، تتشكل الأورام المدمجة بشكل عشوائي في البطين وداخل جدار الدماغ ، وتغزو مجموعات من الخلايا أنسجة جدار الدماغ. يمكن تلطيخ أقسام الأنسجة السميكة (350 ميكرومتر) من E15 tecta الثابتة مع الأورام للكشف عن أن الخلايا الغازية غالبا ما تهاجر على طول الأوعية الدموية عند تحليلها عن طريق إعادة بناء ثلاثية الأبعاد لصور z-stack متحدة البؤر. يمكن زراعة شرائح الدماغ المتوسط والدماغ الأمامي E15 الحية (250-350 ميكرومتر) على إدخالات غشائية ، حيث يمكن إدخال خلايا GBM ذات العلامات الفلورية في مواقع غير عشوائية لتوفير ثقافات مشتركة خارج الجسم الحي لتحليل غزو الخلايا ، والذي يمكن أن يحدث أيضا على طول الأوعية الدموية ، على مدى حوالي 1 أسبوع. يمكن مراقبة هذه الثقافات المشتركة خارج الجسم الحي بواسطة الفحص المجهري الفاصل الزمني الفلوري واسع المجال أو متحد البؤر لمراقبة سلوك الخلية الحية.
يمكن بعد ذلك تثبيت الشرائح المستزرعة بشكل مشترك وتلطيخها وتحليلها بواسطة الفحص المجهري متحد البؤر لتحديد ما إذا كان الغزو قد حدث على طول الأوعية الدموية أو المحاور أم لا. بالإضافة إلى ذلك ، يمكن استخدام نظام الاستزراع المشترك للتحقيق في التفاعلات المحتملة بين الخلايا والخلايا عن طريق وضع مجاميع من أنواع وألوان مختلفة من الخلايا في مواقع دقيقة مختلفة ومراقبة حركات الخلايا. يمكن إجراء العلاجات الدوائية على مزارع خارج الجسم الحي ، في حين أن هذه العلاجات غير متوافقة مع نظام البويضات . يسمح هذان النهجان المتكاملان بإجراء تحليلات مفصلة ودقيقة لسلوك خلايا GBM البشرية وتكوين الورم في بيئة دماغية فقارية يمكن التلاعب بها بشكل كبير.
Introduction
غالبا ما تستخدم الدراسات المختبرية لسلوكيات الخلايا السرطانية لتشريح الآليات المحتملة التي تعمل أثناء السلوك الأكثر تعقيدا الذي يتم ملاحظته أثناء تكوين الورم وغزو الخلايا في نماذج xenograft في الجسم الحي. على سبيل المثال ، مع الورم الأرومي الدبقي (GBM) ، كشفت الدراسات في المختبر عن آليات لكيفية عمل L1CAM المحتمل أثناء تكوين الورم وغزو الدماغ في نموذج ورم دماغي جديد لجنين الفرخ1،2،3،4،5. على الرغم من أن التجارب في المختبر وفي الجسم الحي تكمل بعضها البعض بطرق مفيدة ، إلا أنها تترك فجوة كبيرة في كيفية ارتباط النتائج. على سبيل المثال ، تعد التحليلات الميكانيكية لحركة خلية GBM على طبق حالة مصطنعة للغاية ، ويمكن لنماذج xenograft في الجسم الحي أن تكشف فقط عن تحليلات ثابتة لنقطة زمنية أو نقطة نهاية لتكوين الورم وسلوك الخلية. في الدراسات في الجسم الحي ، لا تصلح الدراسات التي تستخدم القوارض أو أجنة الكتاكيت بسهولة لمراقبة سلوك الخلية بينما تغزو الخلايا أنسجة المخ في نماذج الطعم الأجنبي هذه. ومع ذلك ، فقد أظهر نموذج الطعم الأجنبي لجنين الفرخ أن بروتين الالتصاق L1CAM يلعب دورا محفزا في القدرة الغازية لخلايا T98G GBM البشرية 2,5.
يمكن التوصل إلى حل مناسب لهذه المشكلة عن طريق سد الطرق في الجسم الحي وفي المختبر باستخدام نموذج زراعة شريحة الدماغ العضوي ، والذي يشار إليه باسم نموذج خارج الجسم الحي . في هذا النموذج خارج الجسم الحي ، يمكن الحفاظ على أنسجة المخ الحية بسمك عدة مئات من الميكرونات لمدة تصل إلى بضعة أسابيع ، مما يجعل من الممكن زرع الخلايا السرطانية ، ومراقبة سلوكها في الأنسجة الفعلية بمرور الوقت ، ثم إجراء تحليل أكثر تفصيلا للعلامات في نقطة نهاية التجربة.
كانت إحدى طرق زراعة الشرائح العضوية الشائعة هي زراعة عدة مئات من شرائح الدماغ التي يبلغ سمكها ميكرون فوق غشاء مسامي شفاف أو شفاف ، مما يترك الأنسجة معرضة للهواء ، مع السماح لوسائط المغذيات بالحفاظ على الأنسجة من أسفل الغشاء (راجع Stoppini et al.6). تم استخدام أشكال مختلفة من هذه الطريقة لدراسات مختلفة ، بما في ذلك استخدام وسائط مختلفة أو إدخالات غشاء مختلفة. تشتمل إدخالات الأغشية المختلفة على إدراج غشاء مسامي (0.4 ميكرومتر) بقطر 30 مم في طبق استزراع 35 مم 6 ، وإدخالات زراعة الخلايا (0.4 ميكرومتر) لألواح6 آبار7. تشمل الوسائط المختلفة 50٪ MEM / HEPES + 25٪ مصل حصان معطل حراريا + 25٪ محلول ملح متوازن هانكس (HBSS) 8 ، وسائط مصل مخفضة بنسبة 50٪ + 25٪ مصل حصان + 25٪ HBSS9 ، بالإضافة إلى أخرى. إذا تم استخدام غشاء شفاف أو شفاف جنبا إلى جنب مع خلايا GBM ذات العلامات الفلورية ، فيمكن تصوير هذه الثقافات من الأسفل باستخدام مجهر مضان واسع المجال أو متحد البؤرمقلوب 10،11،12،13،14،15.
في حين تم إنشاء العديد من نماذج زراعة شرائح الدماغ العضوي في الجسم الحي باستخدام القوارض ، كما هو مذكور أعلاه ، فإن جنين الفرخ (جالوس جالوس) لم يتم استغلاله بشكل كاف لهذه الأغراض. ومع ذلك ، فقد ثبت أن جنين الفرخ قادر على استخدامه كنموذج للطعم الأجنبي في الجسم الحي لدراسة غزو كل من الورم الدبقي البشري والجرذ1،2،5. أظهرت الخلايا المطعمة ب Xenografted في أدمغة أجنة الفرخ أنماط غزو مماثلة لتلك التي لوحظت في نماذج القوارض ، مما يدعم استخدام أجنة الكتاكيت كنموذج في الجسم الحي لتحليل الخلايا السرطانية GBM. كما أن أجنة الكتاكيت غير مكلفة ، ويمكن الحفاظ عليها بسهولة أكبر من القوارض (أي في قشور البيض في حاضنة المختبر) ، ويسهل التعامل معها ، مما يجعلها خيارا جذابا لدراسات GBM قصيرة المدى في الجسم الحي. وصفت مقالة حديثة استخدام مزارع شرائح دماغ جنين الفرخ لتشكيل ونمو المحاور العصبية أثناء نمو الدماغ الطبيعي حيث كانت الشرائح قابلة للحياة لمدة 7 أيام على الأقل16. ومع ذلك ، فإن استخدام مثل هذه الثقافات شريحة دماغ جنين الفرخ للتحليل خارج الجسم الحي لسلوك خلية GBM في بيئة الأنسجة غير موجود. في هذه المقالة ، تم وصف كل من زرع خلايا GBM البشرية والخلايا الجذعية GBM (GSCs) في دماغ جنين الفرخ المبكر في الجسم الحي ، وكذلك إدخال خلايا GBM في مزارع شرائح دماغ جنين الفرخ الحية خارج الجسم الحي. كما يتم توفير بعض الأمثلة التمثيلية للأورام الناتجة وأنماط غزو الخلايا التي تم الحصول عليها من هذه المستحضرات.
Protocol
لم تكن هناك حاجة إلى تصريح أو موافقة في جامعة ديلاوير لتنفيذ هذا العمل.
1. حقن خلية GBM في كتكوت البصري
- تحضير خلايا GSCs و GBM للحقن
- ثقافة GSCs في وسائط GSC (الجدول 1). أنشأت الثقافة خطوط خلايا GBM في وسائط GBM (الجدول 1).
- شطف الخلايا على لوحات مع محلول ملحي معقم الفوسفات (PBS) ووضع 1 مل من محلول التربسين في طبق 10 سم. اتركيه في حاضنة زراعة الخلايا لمدة 2-3 دقائق حتى تبدأ الخلايا في الانفصال.
- قم بتعطيل التربسين عن طريق إضافة 10 مل من وسائط الاستزراع المناسبة المحتوية على المصل في طبق 10 سم وافصل الخلايا عن طريق السحب لأعلى ولأسفل. ضع تعليق الخلية في أنبوب طرد مركزي مخروطي سعة 15 مل.
- قم بإذابة الخلايا عن طريق الطرد المركزي عند 800 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- قم بنضح الوسائط من حبيبات الخلية باستخدام ماصة زجاجية دقيقة يمكن التخلص منها متصلة بدورق ذراع جانبي ومضخة تفريغ. أعد تعليق الخلايا في وسائط نمو مناسبة إلى تركيز 10000 خلية لكل ميكرولتر وضعها في أنبوب microfuge أو أنبوب صغير لولبي على الجليد.
- امزج الخلايا مع كمية صغيرة من صبغة FCF الخضراء السريعة المعقمة بنسبة 1٪ (استخدم نسبة 5 ميكرولتر من الصبغة / 100 ميكرولتر من تعليق الخلية).
- حقن خلايا GBM في القفص البصري E5 في البيض. انظر الشكل التكميلي 1.
- احتضان بيض الدجاج المخصب في حاضنة بيض مرطبة ، مع توجيه الطرف المدبب لأسفل ، عند 37.5 درجة مئوية (اليوم الأول من الحضانة هو اليوم الجنيني 0 [E0]). في اليوم السادس من الحضانة (E5) ، تعقيم قشر البيض عن طريق الرش مع الإيثانول 70 ٪.
- باستخدام شمعة البيض ، تتبع على طول محيط الفضاء الجوي فوق الجنين بقلم رصاص وقم بتغطية المنطقة المحددة بشريط شفاف.
- باستخدام مقص منحني ، قم بقص المنطقة المتتبعة برفق ، مع الحرص على عدم قطع الأغشية الجنينية أو الأوعية الدموية ، وتجاهل الجزء العلوي من قشر البيض.
- ضع بضع قطرات من المحلول الملحي أو وسائط زراعة الخلايا على غشاء الفضاء الجوي لتبلله حتى ينفصل بسهولة. باستخدام ملقط دقيق ، اخترق بعناية غشاء الفضاء الهوائي فوق الجزء العلوي من الجنين ، وقم بإزالته ، وحدد موقع رأس جنين الفرخ.
- استخدم ملقط رفيع للإمساك بغشاء السلى الشفاف الذي يحيط بالجنين على الفور لوضع الرأس بحيث يمكن حقن القفص البصري بالخلايا. بيد واحدة ، استخدم الملقط الناعم للتمسك بالسلى للحفاظ على الرأس في مكانه أثناء عملية الحقن. احرص على عدم إتلاف الأوعية الدموية خارج الجنين في الغشاء المشيمي الألانتوي على صفار البيض.
ملاحظة: يتطلب الإجراء أعلاه بعض الممارسة لتكون قادرا على الإمساك بكفاءة بغشاء السلى الصافي الذي يحيط بالجنين بشكل وثيق ، لأنه غير مرئي حتى يتم الإمساك به وسحبه. تدرب على استخدام ملقط دقيق للاستيلاء على السلى الصافي الذي يحيط بالجنين على الفور. - امسك الرأس بثبات عن طريق إمساك غشاء السلى بالملقط الرفيع. باستخدام ماصة زجاجية دقيقة ومضخة بيكوب هوائية ، قم بحقن حوالي 50000 خلية في 5 ميكرولتر من وسائط زراعة الخلايا المناسبة في التيكتوم البصري (5 ميكرولتر حوالي 1/2 من ماصة دقيقة مملوءة).
ملاحظة: انظر Cretu et al.1 للحصول على صورة لجنين E5 تم حقنه بخلايا GBM الممزوجة بالصبغة. - ضع بضع قطرات من الأمبيسلين 50 مجم / مل فوق الجنين.
- غطي الفتحة الموجودة في الجزء العلوي من البيض بشريط شفاف واتركها في المرطب حتى E15 للتشريح.
2. تشريح مناطق الدماغ من أجنة E15
ملاحظة: يشبه تشريح أدمغة E15 هنا للتثبيت ذلك الموصوف في الخطوة 8.2 لشرائح الدماغ الحية ، ولكن لا يجب إجراء التشريح هنا في ظل ظروف معقمة.
- قطع الشريط حول الجزء العلوي من قذيفة ، مما يسمح للوصول إلى الجنين.
- قطع رأس الجنين في الرقبة ووضع الرأس في طبق 10 سم مع محلول Tyrodes المعقم الخالي من الكالسيوم والمغنيسيوم (CMF Tyrode's). انظر الشكل التكميلي 2.
- باستخدام ملقط رفيع ، قشر الجلد الذي يغطي الدماغ للكشف عن الأم الجافية الأساسية. إزالة عظام الجمجمة المشكلة على الجانبين الأيسر والأيمن من الدماغ. عظام الجمجمة المشكلة لا تغطي بعد غالبية الدماغ.
- استخدم ملقط مدبب ناعم برفق لتمزيق السحايا التي تغطي مركز الدماغ وقشره إلى كل جانب للكشف عن الدماغ.
- استخدم ملقط منحني لجرف الدماغ من الأسفل وسحبه برفق من تجويفه.
- تشريح الدماغ إلى أجزائه: الدماغ الأمامي ، tecta ، المخيخ.
- قم بإزالة الأم التي تعلوها الحنون من القفص باستخدام ملقط ناعم. لاحظ أن الحنون ينفصل بسهولة عن التكتا ، ولكن ليس عن الدماغ الأمامي أو المخيخ. قم بإزالة الحنون من الدماغ الأمامي عن طريق لمسه أو لفه على قطعة صغيرة من ورق الترشيح.
- ضع مناطق الدماغ المشرحة في طبق صغير.
- ضع مناطق الدماغ للتثبيت في بئر صفيحة 24 بئرا وقم بتثبيتها في 2٪ بارافورمالدهايد (PFA) في 0.1 متر من محلول كاكوديلات الصوديوم. اتركيه لمدة 24 ساعة على الأقل عند 4 درجات مئوية.
- بعد التثبيت ، شطف الأنسجة في 3x PBS على الأقل 1 ساعة قبل التضمين في أجار.
3. تضمين وتقطيع مناطق الدماغ المحصودة
- سخن محلول من 3.5٪ أجار و 8٪ سكروز في برنامج تلفزيوني حتى يذوب واحتفظ به في درجة حرارة الانصهار.
- باستخدام ملقط منحني كمغرفة ، التقط برفق إما القفص البصري أو منطقة الدماغ الأمامي لدماغ جنين الفرخ ، وامسحه قليلا على ورق الترشيح لإزالة السائل الزائد لضمان التصاق الآجار بسطح الدماغ الخارجي.
- باستخدام ماصة نقل معقمة ، املأ القالب بمحلول أجار.
ملاحظة: يمكن صنع قالب بسيط عن طريق تشكيل رقائق الألومنيوم حول جسم مناسب الحجم ، مثل كتل تقطيع الأنسجة المعدنية الصغيرة المستطيلة الاهتزازية. - ضع منطقة الدماغ في أجار ، واترك الآجار يتصلب تماما.
- قم بإزالة ورق الألمنيوم من حول الدماغ المضمن وقم بقص الآجار الزائد حول الجانبين باستخدام شفرة حلاقة أو مشرط.
- ضع قطرة من غراء cyanoacrylate على مربع الفولاذ المقاوم للصدأ في صينية التقطيع ، ضع كتلة الأغاروز مع الدماغ على الغراء ، واترك الغراء يترابط لمدة 1 دقيقة. ضع الدرج في ظرف تقطيع الأنسجة الاهتزازي ، وشد الدرج واملأه بما يكفي من PBS لتغطية الجزء العلوي من كتلة أجار.
- قطع شرائح الدماغ على قطاعة الأنسجة تهتز بسمك 350 ميكرومتر باستخدام شفرة حلاقة فولاذية.
- عندما يتم قطع شرائح الدماغ وتطفو بحرية في صينية التقطيع ، استخدم ملعقة لغرف الشرائح وإزالتها من الدرج. حرك القسم برفق من الملعقة إلى طبق بتري 10 سم مع برنامج تلفزيوني حتى تطفو الأقسام بحرية.
ملاحظة: قد ينفصل الآجار المحيط بشريحة الدماغ إذا لم يتم تنظيف الدماغ بشكل كاف بورق الترشيح لإزالة السائل الزائد قبل التضمين. في حالة حدوث ذلك ، يمكن إزالة أنسجة المخ بلطف من الآجار المتصلب وإعادة دمجها بعد النشاف المناسب للسائل الزائد.
4. شرائح الدماغ المناعية مع الخلايا السرطانية
- باستخدام مجهر ستيريو مجهز ب epifluorescence ، قم بفحص شرائح فردية في طبق 10 سم واحدا تلو الآخر لوجود أو عدم وجود خلايا سرطانية.
- تحضير كمية كافية من محلول ملحي مخزن بالفوسفات مع 0.1٪ Triton X-100 و 5٪ مصل الماعز العادي (PBSTG) (انظر الجدول 1) للتلطيخ المناعي وشطف الشرائح المراد تلوينها بالمناعة.
- نصف ملء الآبار في لوحة 24 بئرا التي سيتم استخدامها لتلطيخ أقسام الدماغ مع برنامج تلفزيوني.
- قم بقص زوايا الآجار حول شرائح الدماغ بحافة ملعقة أو مشرط ، وضعها برفق في الآبار التي تحتوي على برنامج تلفزيوني.
- نضح PBS واستبدله ب 350 ميكرولتر من محلول تلطيخ الأجسام المضادة الأولي في PBSTG (على سبيل المثال ، 2 ميكروغرام / مل UJ127 في PBSTG).
- احتضان لمدة 24 ساعة في غرفة باردة مع تحريض لطيف بحيث ينظر إلى شريحة تتحرك بحرية داخل البئر.
- بعد 24 ساعة ، قم بإزالة محلول الأجسام المضادة الأساسي وشطف 3 × 1 ساعة مع PBSTG في غرفة باردة مع الإثارة.
- عند الانتهاء من الشطف، احتضان 350 ميكرولتر/بئر من محلول تلطيخ الأجسام المضادة الثانوي في PBSTG (على سبيل المثال، تخفيف 1/200 من البيوتين-GAM في PBSTG). احتضان لمدة 20 ساعة في غرفة باردة مع الإثارة.
ملاحظة: إذا كنت قد تخلت عن الخطوة الثالثة واحتضنت بالجسم المضاد الثانوي المحتوي على الفلوروكروم في هذه الخطوة ، فقم بتغطيتها للحماية من الضوء أثناء الحضانة الآن ثم انتقل إلى الخطوة 4.11. - قم بإزالة محلول الأجسام المضادة الثانوي وشطف 3 × 1 ساعة في PBSTG في غرفة باردة مع الإثارة.
- إزالة PBSTG واحتضان في محلول ثلاثي (على سبيل المثال ، 1: 250 تخفيف اليكسا فلور 647 ستربتافيدين في PBSTG). إذا رغبت في ذلك ، قم بتلطيخ النوى في هذه الخطوة بإضافة 0.1 ميكروغرام / مل بيسبنزيميد إلى الخليط. احتضان لمدة 20 ساعة في غرفة باردة مع الإثارة.
- قم بإزالة المحلول الثلاثي وشطف 3 × 1 ساعة في PBSTG في غرفة باردة مع الإثارة.
- اتركه في برنامج تلفزيوني حتى يصبح جاهزا للتركيب على شرائح المجهر.
5. تصاعد شرائح على شرائح المجهر
- قم بإعداد العديد من شرائح المجهر حيث توجد أقسام لتركيبها.
- لكل شريحة ، ضع شريطا بطول 50 مم بسمك 10 مل (254 ميكرومتر) من شريط كهربائي من الفينيل على قطعة من parafilm.
- باستخدام ثقب مربع 1 سم × 1 سم ، قم بعمل ثقب في وسط الشريط الكهربائي والبارافيلم.
- اسحب الشريط من البارافيلم وضعه أعلى شريحة المجهر ، مع ترك مساحة لوضع العلامات على الشريحة.
- باستخدام ماصة صغيرة ، ضع قطرة أو قطرتين من وسائط التثبيت المضادة للتلاشي في الفتحة المربعة في وسط الشريط الكهربائي.
- استخدم ملعقة منحنية لرفع قسم تقطيع الأنسجة الاهتزازي المطلوب من PBSTG وإزالة الرطوبة تماما بمسح مختبر نظيف أو قطعة من ورق الترشيح.
- المس حافة الشريحة بقطرة الحامل واستخدم ملعقة أخرى لتحريك القسم برفق في وسائط التركيب.
- قم بتغطية القسم ببضع قطرات أخرى من الحامل وضع بعناية غطاء 24 مم × 30 مم (سمك # 1.5) أعلى القسم والتركيب.
- أغلق حواف الغطاء بطلاء الأظافر لإبقائه في مكانه.
6. الفحص المجهري متحد البؤر لشرائح الدماغ الثابتة
- استخدم مضان واسع المجال للعثور على أورام الفلورسنت في شريحة الدماغ المركبة باستخدام العدسة الموضوعية المناسبة ومجموعة (مجموعات) المرشح.
ملاحظة: يمكن أن تكون بعض الأورام كبيرة جدا ويمكن رؤيتها بسهولة مع هدف 4x ، بينما قد تتطلب الخلايا المفردة هدف 10x. - قم بالتبديل إلى الفحص المجهري متحد البؤر باستخدام عدسة موضوعية مناسبة وليزر (ليزر) وحجم الثقب وإعدادات الكاشف. لاتباع هذا البروتوكول ، استخدم هدفا 20x (الفتحة العددية [N.A.] = 0.75) للتصوير الروتيني وهدف زيت 60x (N.A. = 1.40) للتصوير عالي الدقة.
- قم بتعيين الحدود العلوية والسفلى للمحور z وحجم الخطوة (للحالة المحددة وفقا لتعليمات الشركة المصنعة للمجهر متحد البؤر) للحصول على أقسام بصرية. الحصول على مجموعة z من المقاطع البصرية.
- استخدم برنامج المجهر متحد البؤر لإنشاء عرض حجم 3D للورم ، وفقا لتعليمات الشركة المصنعة.
7. إعداد كروي
- إنشاء ألواح بولي (2-هيدروكسي إيثيل ميثاكريلات) (بولي هيما)
- قم بإنشاء محلول من 10 ميكروغرام / مل بولي هيما في 95٪ إيثانول ، وقم بتغطية أطباق بتري 35 مم (أو أطباق زراعة الخلايا) ب 1 مل من هذا المحلول.
- دع الأطباق تجلس على هزاز مكشوف طوال الليل في درجة حرارة الغرفة لتطوير طلاء لسطح الطبق.
ملاحظة: سوف يتبخر المذيب ويترك طبقة شفافة على الطبق ، والتي قد تبدو غير متساوية ، ولكن هذا لن يؤثر على القدرة على صنع كرويات الخلية. - بعد التجفيف ، قم بتعقيم الأطباق المفتوحة تحت ضوء الأشعة فوق البنفسجية في خزانة السلامة الحيوية لمدة 1 ساعة. استبدل الأغطية بعد التعقيم. الأطباق المطلية جاهزة الآن للاستخدام.
- تلطيخ DiD الفلوري للفحص المجهري بفاصل زمني
ملاحظة: هذا القسم مخصص لتلطيخ الخلايا المفردة بصبغة الفلورسنت DiD لاستخدامها في صنع كرويات ، مما يحسن تصور حركة الخلية للتصوير المباشر بفاصل زمني.- تعليق الخلايا في وسط ثقافة خالية من المصل.
- أضف 5 ميكرولتر من مخزون DiD / مل من تعليق الخلية واخلطه برفق عن طريق الماصة. احتضان لمدة 20 دقيقة على 37 درجة مئوية.
- جهاز طرد مركزي تعليق الخلية المسمى عند 800 × جم عند 5 درجات مئوية لمدة 5 دقائق.
- نضح الطافع وإعادة تعليق الخلايا في وسائط دافئة لشطفها.
- كرر هذا الطرد المركزي وشطف الخطوة مرتين أخريين.
ملاحظة: إذا رغبت في ذلك ، انتقل إلى الخطوة 7.3.6 لعمل كرويات مباشرة بعد هذه العملية.
- صنع كرويات الخلية
- قم بتسخين محلول التربسين / حمض الإيثيلين ديامينيترايتيك (EDTA) بنسبة 0.25٪ إلى 37 درجة مئوية.
- GSCs المستنبتة في وسائط GSC17 (الجدول 1) وخلايا غلويما خبيثة U-118 (MG) في وسط زراعة U-118 (انظر الجدول 1). استخدم طبقا متقاربا بطول 10 سم لإعداد طبق واحد 35 مم من الأجسام الكروية. أضف عوامل نمو bFGF (10 نانوغرام / مل التركيز النهائي) و TGF-α (20 نانوغرام / مل التركيز النهائي) إلى GSCs في البداية ثم كل 3 أيام.
ملاحظة: كانت الخلايا المستخدمة في الدراسة الحالية هي GSC15-2 / K72 الخضراء ، والأخضر GSC16-4 / K72 ، والأحمر U-118 / L1LE / mCherry2x ، والأحمر U-118 / 1879 / mCherry2x. يجب أن تكون صفيحة واحدة من الأجسام الكروية كافية لوحين من 6 آبار من شرائح الدماغ على إدراج الغشاء. - شطف الخلايا على لوحات مع PBS معقمة ووضع 1 مل من محلول التربسين على طبق 10 سم. ضع في حاضنة زراعة الخلايا لمدة 2-3 دقائق حتى تبدأ الخلايا في الانفصال.
- قم بتعطيل التربسين عن طريق إضافة 10 مل من وسائط الاستزراع المناسبة المحتوية على المصل في طبق 10 سم وافصل الخلايا عن طريق السحب لأعلى ولأسفل. ضع تعليق الخلية في أنبوب طرد مركزي مخروطي سعة 15 مل.
- قم بإذابة الخلايا بالطرد المركزي عند 800 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- نضح الوسائط من حبيبات الخلية وأعد تعليق الخلايا في 10 مل من الوسائط.
- ضع 2 مل من معلق الخلية على كل طبق مطلي ببولي هيما 35 مم وأضف 2 مل إضافية من الوسائط المناسبة للحصول على 4 مل من إجمالي الوسائط لكل طبق. في حالة استخدام GSCs ، أضف عوامل النمو.
- احتضان الخلايا في حاضنة الخلايا حتى تصل الركام إلى حجم 100-200 ميكرومتر ، والذي يمكن أن يكون 1-2 أيام اعتمادا على كثافة الخلايا المطلية.
8. تشريح دماغ جنين الفرخ الحي وتقطيع تقطيع الأنسجة الاهتزازية
- التحضير للتشريح
- قم بإعداد لوحة إدخال غشاء بوليستر 6 آبار مع 1 مل من وسائط زراعة شريحة الدماغ (انظر الجدول 1) أسفل إدخال الغشاء.
- تعقيم منطقة العمل والأدوات بنسبة 70 ٪ من الإيثانول.
- ضع لوحة إدخال 6 آبار على الجليد أثناء إجراء التشريح.
- تحضير 100 مل من وسائط تقطيع تقطيع الأنسجة الاهتزازية (الجدول 1) ووضعها على الثلج.
- ضع قنينة من 4٪ أغاروز منخفض الذوبان في برنامج تلفزيوني في حمام مائي حتى يذوب في سائل (حوالي 50 درجة مئوية).
- املأ حوض تقطيع الأنسجة المهتز بالثلج.
- تشريح دماغ جنين الفرخ العقيم E14 / 15
- باستخدام شمعة البيض ، تتبع على طول محيط الجيب الهوائي فوق الجنين E14 أو E15 بقلم رصاص وقم بتغطية المنطقة المحددة بشريط شفاف.
- باستخدام مقص منحني أو ناعم ، قم بقص المنطقة التي تم تتبعها برفق ، مع الحرص على عدم قطع غشاء الجنين أو الأوعية الدموية ، وتجاهل القطعة العلوية من الصدفة.
- باستخدام ملقط منحني ، قم بإزالة غشاء الفضاء الهوائي فوق الجزء العلوي من الجنين وحدد موقع رأس جنين الفرخ.
- قطع رأس الجنين ووضع الرأس في طبق 10 سم مع محلول CMF معقم بارد. انظر الشكل التكميلي 2.
- باستخدام ملقط دقيق معقم ، قشر الجلد الذي يغطي الدماغ للكشف عن الأم الجافية الأساسية. إزالة عظام الجمجمة المشكلة على الجانبين الأيسر والأيمن من الدماغ. عظام الجمجمة المشكلة لا تغطي بعد غالبية الدماغ.
- استخدم ملقط مدبب ناعم (# 5 أو # 55) لتمزيق السحايا التي تغطي مركز الدماغ وقشره إلى كل جانب للكشف عن الدماغ.
- باستخدام ملقط منحني ناعم ، اغرف الدماغ لأعلى من أسفل الجبهة واسحبه برفق من تجويفه.
- تشريح الدماغ إلى أجزائه الرئيسية الثلاثة: الدماغ الأمامي ، الدماغ المتوسط (tecta البصري) ، المخيخ. استشر أطلس تطور الفرخ ، إذا لزم الأمر.
- قم بإزالة الأم التي تعلوها الحنون من القفص باستخدام ملقط ناعم.
ملاحظة: ينفصل الحنون بسهولة عن القفص الصدري ، ولكن ليس عن الدماغ الأمامي أو المخيخ. يمكن إزالة الحنون من الدماغ الأمامي عن طريق لمسه أو لفه على شاش معقم. - ضع مناطق الدماغ المشرحة في طبق معقم صغير على الجليد.
- تضمين وتقطيع الدماغ
- باستخدام ملقط منحني كمغرفة ، التقط برفق إما القفص البصري أو منطقة الدماغ الأمامي وامسحه قليلا على شاش معقم لإزالة السائل الزائد لضمان التصاق الأغاروز بسطح الدماغ الخارجي.
- باستخدام ماصة نقل معقمة ، املأ القالب بأغاروز منخفض الذوبان. قم بإعداد قالب بسيط عن طريق تشكيل رقائق الألومنيوم حول جسم مناسب الحجم. يتم استخدام كتلة تقطيع الأنسجة المعدنية الصغيرة المستطيلة بشكل روتيني ككائن. انظر الشكل التكميلي 3.
- ضع منطقة الدماغ بسرعة في الأغاروز واتركها تتصلب (حوالي 4-5 دقائق) على الجليد.
ملاحظة: قد يغرق الدماغ في قاع القالب قبل أن تصلب الأغاروز. إذا حدث هذا ، انتظر 1 دقيقة للسماح للأجار بالبدء في التماسك ، ثم ضع منطقة الدماغ في الأغاروز. حاول تعليق منطقة الدماغ مباشرة في منتصف الأغاروز. - قم بإزالة رقائق الألومنيوم من حول الدماغ المضمن في الأغاروز المتصلب وقم بقص الأغاروز الزائد حول الجانبين باستخدام شفرة حلاقة أو مشرط معقم.
- ضع قطرة من غراء cyanoacrylate على مربع الفولاذ المقاوم للصدأ في طبق / صينية التقطيع ، ضع كتلة الأغاروز مع الدماغ ، واترك الغراء يترابط لمدة 1 دقيقة. ضع الطبق / الدرج في ظرف تقطيع الأنسجة الاهتزازي ، وشد الدرج واملأه بوسائط التقطيع لتغطية الجزء العلوي من كتلة الأغاروز.
- قم بقص الأجزاء الموجودة على قطاعة الأنسجة الاهتزازية عند 250-350 ميكرومتر باستخدام سكين الياقوت ، والذي تم الإبلاغ عن أنه يؤدي إلى تلف الأنسجة الحية أقل من شفرة الحلاقة الفولاذية.
- عندما يتم قطع شرائح الدماغ وتطفو بحرية في صينية التقطيع ، استخدم ملعقة معقمة لغرف الشريحة وإزالتها من الدرج. حرك الجزء برفق من الملعقة وعلى ملحق الغشاء باستخدام ملعقة معقمة أخرى.
ملاحظة: عادة ، يمكن وضع شريحتين أو ثلاث شرائح دماغية على كل إدخال غشاء ، إذا رغبت في ذلك. قد ينفصل الأغاروز المحيط بشريحة الدماغ إذا لم يتم مسح الدماغ بشكل كاف بشاش معقم لإزالة السائل الزائد. إذا استمر حدوث ذلك بعد النشاف الكافي قبل التضمين ، فالتقط الشريحة برفق بدون الأغاروز المحيط وحركها على ملحق الغشاء. - ضع صفيحة 6 آبار من شرائح الدماغ على حشوات غشائية في حاضنة زراعة الخلايا عند 37 درجة مئوية و 5٪ CO2.
- في اليوم التالي للطلاء ، استخدم ماصة باستور معقمة لشفط الوسائط من أسفل الملحق (توجد فجوات في جوانب الإدخالات للسماح للماصة بالوصول إلى الوسائط أدناه). أضف 1 مل من وسائط الشرائح الطازجة إلى كل بئر أسفل ملحق الغشاء. استمر في تغيير الوسائط كل يوم بعد ذلك.
- انتظر بضعة أيام حتى تلتصق شرائح الدماغ بقوة بإدخالات الغشاء ويبدو أنها تتسطح إلى حد ما. هذه علامة على أن الشرائح قابلة للحياة وجاهزة لإدخال خلايا GBM.
9. إدخال خلية GBM على شرائح الدماغ
- طريقة كروية
- بعد أن يصل حجم كرويات الخلية إلى 150-200 ميكرومتر ، استخدم ماصة صغيرة 20 ميكرولتر مضبوطة على 5 ميكرولتر لإزالة واحد إلى عدة كرويات من طبق الاستزراع الخاص بهم. انظر الشكل التكميلي 3.
- اطرد الوسائط برفق باستخدام كرويات على شريحة الدماغ المطلوبة.
ملاحظة: يجب أن تكون كرويات الخلية مرئية في طرف الماصة. سيؤدي استخدام طرف ماصة واضح إلى تسهيل رؤيتها في الحافة. إذا سقط الكروي من شريحة الدماغ عند إطلاق السائل ، فيجب استخدام رمش معقم بالإيثانول ملتصق بعصا قضيب خشبية رقيقة لدفع الكروي برفق إلى شريحة الدماغ. - اسمح للكرويات بالثقافة على شرائح الدماغ لمدة 2-5 أيام.
ملاحظة: يبدو أن القيد هنا هو التدهور النهائي للأوعية الدموية وخلايا الدماغ في الشريحة. ستظهر الأوعية الدموية المتدهورة ككرات متقطعة في الشريحة عند تلطيخها بالصفيحة.
- طريقة لكمة الخزعة
- اسمح لشرائح الدماغ بالالتصاق عن طريق الظهور وكأنها تتسطح على إدخال الغشاء (قد يستغرق 2-5 أيام في الثقافة).
- قم بإذابة مصفوفة الخلية على الجليد.
- في خزانة السلامة الحيوية لزراعة الخلايا ، قم بتوصيل لكمة خزعة معقمة قطرها 1 مم بأنبوب شفاط مفرغ.
- المس شريحة الدماغ برفق باستخدام لكمة الخزعة لإنشاء ثقب 1 مم في وسط شريحة الدماغ.
ملاحظة: سيتم استنشاق الأنسجة الموجودة في لكمة الخزعة في الثقب بواسطة الفراغ. - تحضير معلق مصفوفة الخلية عن طريق التربسين طبق 60٪ -70٪ متلاقى 10 سم من الخلايا وتعليقه في 10 مل من الوسائط ؛ ثم امزج 1 مل من هذا المعلق مع 100 ميكرولتر من المصفوفة.
- باستخدام ماصة دقيقة 20 ميكرولتر ، ضع 1 ميكرولتر من خليط مصفوفة الخلية في كل ثقب في شرائح الدماغ.
- بعد الانتهاء من وضع خليط الخلية ، ضع طبق شرائح الدماغ مع الخلايا المدمجة مرة أخرى في الحاضنة ، واسمح للمصفوفة بالتصلب والخلايا لغزو شريحة الدماغ المحيطة.
10. مجهر الفاصل الزمني مضان واسع المجال
- ضع شريطا قابلا للإزالة حول حافة اللوحة المكونة من 6 آبار لمنع تبخر الوسائط ، مما يترك فجوة صغيرة على جانب واحد لتبادل الغازات.
- ضع الألواح في غرفة استزراع مخصصة على مرحلة آلية قابلة للتعديل على مجهر التألق المقلوب.
ملاحظة: تم الاحتفاظ بالغرفة في الظروف الجوية بنسبة 5٪ CO2 و 95٪ هواء باستخدام وحدة تحكم في حقن الغاز ، وتم الحفاظ على درجة الحرارة عند 37 درجة مئوية مع جهاز تحكم في درجة حرارة الهواء الدافئ وإدخال مرحلة يتم التحكم في درجة حرارته. انظر Fotos et al.18 للحصول على تفاصيل حول النظام المستخدم هنا. - باستخدام برنامج التحكم المجهري المناسب ، قم بإنشاء جدول اقتناء بفاصل زمني يجمع صور الفلورسنت للمناطق ذات الأهمية مرة كل 10 دقائق لمدة 20 ساعة.
ملاحظة: إذا تم استخدام ملصق الفلورسنت الأخضر في الخلايا (على سبيل المثال ، بروتين الفلورسنت الأخضر [GFP]) ، فاستخدم الحد الأدنى من ضوء الإثارة الأزرق المطلوب لتصور الخلايا لمنع السمية الضوئية. لا يبدو أن التسميات الحمراء (على سبيل المثال ، mCherry) والأحمر البعيد (على سبيل المثال ، DiD) تعاني من هذه المشكلة المحتملة بسبب إثارة الطول الموجي الأطول.
11. شرائح الدماغ المناعية بعد الفحص المجهري بفاصل زمني
ملاحظة: تم تحسين بروتوكول التلوين المناعي هذا لتلطيخ الأوعية الدموية باللامينين والنوى بالبيسبنزيميد. استخدم الأجسام المضادة المناسبة للجزيء (الجزيئات) المطلوب من الاهتمام.
- قم بشفط الوسائط من أسفل ملحق الغشاء باستخدام ماصة باستور ، وضع 1 مل من 2٪ PFA في 0.1 متر من محلول كاكوديلات الصوديوم أسفل الملحق و 1 مل أعلى الملحق لتغطية شريحة الدماغ. دع الشرائح تثبت طوال الليل عند 4 درجات مئوية.
- قم بإزالة المثبت من أسفل إدخال الغشاء وأي مثبت متبقي على شريحة الدماغ (يميل المثبت إلى التسرب من خلال إدخال الغشاء إلى البئر أدناه).
- أخرج الملحق بشرائح من البئر مقاس 35 مم وضعها في طبق بلاستيكي أكبر.
- قم بإعداد صفيحة من 24 بئرا عن طريق إضافة 350 ميكرولتر من PBS إلى أكبر عدد ممكن من الآبار مثل شرائح الدماغ (شريحة واحدة / بئر عند تلطيخ المناعة).
- باستخدام ملعقة رفيعة ، قم بإزالة الأغاروز برفق من حول شريحة الدماغ دون فصل شريحة الدماغ عن إدخال الغشاء. تأكد من أن الأغاروز ينفصل عن الحافة الخارجية لشريحة الدماغ بسهولة. إذا لم يكن كذلك ، اترك الأغاروز متصلا بشريحة الدماغ.
- باستخدام مشرط حاد ، قم بقطع الغشاء المحيط بشريحة الدماغ حتى تصبح الشريحة ذات الغشاء الأساسي خالية من بقية الإدخال. التقط الغشاء بشريحة الدماغ المرفقة ، باستخدام ملقط دقيق للإمساك بالغشاء ، وضعه في بئر من لوحة 24 بئرا في برنامج تلفزيوني.
- شطف شرائح 3x مع PBS أكثر من 1 ساعة في الغرفة الباردة مع التحريض اللطيف المستمر أو هزاز ، بحيث تتحرك شريحة داخل البئر.
- أثناء الشطف ، قم بإعداد محلول الأجسام المضادة الأساسي.
- خفف مضاد اللامينين إلى 2 ميكروغرام / مل في PBSTG (انظر الجدول 1).
- قم بإزالة برنامج تلفزيوني من الآبار واحتضانه طوال الليل في محلول الأجسام المضادة الأولية في غرفة باردة مع تحريض لطيف.
- بعد 20 ساعة على الأقل من الحضانة ، قم باستنشاق محلول الأجسام المضادة الأساسي وشطف الأقسام 3x لمدة 1 ساعة في PBSTG.
- أثناء الشطف ، قم بإعداد محلول الأجسام المضادة الثانوي.
- تمييع الفلورسنت-GAM مع الفلوروكروم المحدد اللازم لتخفيف 1: 200 في PBSTG جنبا إلى جنب مع تركيز 0.1 ميكروغرام / مل من ثنائي بنزيميد.
- إزالة PBSTG واحتضان بين عشية وضحاها في غرفة باردة مع التحريض في محلول الأجسام المضادة الثانوية الفلورية.
- قم بإزالة الجسم المضاد الثانوي وشطف 2x على 1 ساعة في PBSTG و 1x على 1 ساعة في PBS.
- اتركه في PBS حتى يصبح جاهزا للتركيب على شرائح المجهر (القسم 5) وعرضه.
النتائج
تظهر هنا أشكال متعددة لإظهار بعض النتائج التمثيلية التي تم الحصول عليها من إجراء الحقن في الجسم الحي في القفص البصري (الشكل 1 والشكل 2) ، وزراعة شرائح الدماغ الحية وتقييم صلاحيتها (الشكل 3) ، وإنشاء مزارع شرائح الدماغ خارج الجسم الحي وزرع الخلايا ذات العلامات الفلورية باستخدام طريقة لكمة الخزعة (الشكل 4) ، وتوليد كرويات الخلايا عن طريق زراعة الخلايا على poly-HEMA (الشكل 5) ، وإنشاء ثقافات مشتركة لشريحة الدماغ خارج الجسم الحي مع كرويات الخلايا وتسجيل سلوك الخلية الغازية باستخدام مجهر الفاصل الزمني البؤري 4D (الشكل 6) ، وتحليل سلوك الخلايا الغازية من الأجسام الكروية بالنسبة للأوعية الدموية في مستحضرات شرائح الدماغ الثابتة (الشكل 7 والشكل 8). هذه النتائج ليست شاملة بأي حال من الأحوال ، ولكنها تقدم أمثلة جيدة لما يمكن الحصول عليه باستخدام دماغ جنين الفرخ كنموذج للطعم الأجنبي لأبحاث GBM البشرية.
يوضح الشكل 1 بعض النتائج التمثيلية للأورام التي تشكلت في القفص البصري في الجسم الحي بعد حقن GSCs التي تعبر عن GFP. تلتصق GSCs بسطح البطين وتشكل أوراما غازية في جدار الدماغ. من الواضح أن GSCs موجودة بالقرب من الأوعية الدموية ويبدو أنها تهاجر على طولها. يتم إعطاء أفلام عرض الحجم ثلاثي الأبعاد الدوار للشرائح الثابتة والملطخة بالمناعة لأورام GSC في الجسم الحي في الفيديو التكميلي S1 والفيديو التكميلي S2 والفيديو التكميلي S3 والفيديو التكميلي S4. في هذه التجربة ، تم استخدام أربعة ألوان لتحديد خمس ميزات (GSCs الخضراء ، والنوى البيضاء ، والأوعية الدموية البيضاء ، والأزرق integrin alpha-6 ، وإما Sox2 الأحمر أو nestin الأحمر).
يوضح الشكل 2 بعض النتائج التمثيلية للأورام التي تشكلت في القفص البصري في الجسم الحي بعد حقن GSCs التي تعبر عن GFP الممزوج بخلايا U-118 / L1LE2 التي تعبر عن mCherry بسبب نقل ناقل الفيروسات القهقرية. كشفت هذه التجارب أنه نظرا لأن هذه الأورام تشكلت من تعليق مختلط الخلايا ، فقد حدث الفرز بحيث توجد GSCs إما في المحيط أو المركز ، بينما تتكون خلايا U-118 إما من نواة داخلية أو قشرة خارجية ، اعتمادا على خط GSC المحدد.
يوضح الشكل 3 نتائج الجدوى لمزارع شرائح الدماغ خارج الجسم الحي. بعد أسبوع واحد في الثقافة ، كشف التثبيت والمناعة للامينين عن العديد من الأوعية الدموية السليمة والتعبير عن Sox2 ، وكلاهما استخدم هنا لإثبات صلاحية شريحة الدماغ. أظهر هذا أنه يمكن زراعة شرائح دماغ جنين الفرخ على إدخالات الغشاء لمدة 2 أسابيع تقريبا وتبقى قابلة للحياة مع الأوعية الدموية ذات المظهر الطبيعي وتعبير عامل النسخ.
يوضح الشكل 4 نتائج إدخال "مقابس" خلايا U-118 / L1LE / mCherry الحمراء (مختلطة مع مصفوفة) في شرائح الدماغ خارج الجسم الحي بعد إنشاء تجاويف في الشرائح باستخدام طريقة لكمة الخزعة. غزت خلايا U-118 بوضوح أنسجة المخ ، وأحيانا على نطاق واسع ، وغالبا على طول الأوعية الدموية. ومع ذلك ، لم يكن غزو الخلية موحدا حول محيط الخلايا المدخلة. في بعض الأحيان ظهرت الأوعية الدموية تالفة أو غائبة في شرائح معينة ، ويفترض أن ذلك يرجع إلى الصدمة الإضافية لطريقة الثقب أو طول الوقت في الثقافة. أظهر هذا أنه يمكن استخدام طريقة لكمة الخزعة / سدادة الخلية لإدخال خلايا GBM في مواقع محددة في شريحة دماغية مستزرعة خارج الجسم الحي ، حيث تغزو الخلايا بعد ذلك شريحة الدماغ.
يوضح الشكل 5 كرويات حية في الثقافة والعديد من الأمثلة على مضان المجال الواسع للكرويات الحية لخلايا GBM التي يتم إدخالها على شرائح الدماغ خارج الجسم الحي لتجارب الفاصل الزمني. يتم إعطاء أفلام غزو الخلايا من الأجسام الكروية إلى شريحة الدماغ في الفيديو التكميلي S5 والفيديو التكميلي S6. أظهر هذا أن كرويات الخلايا هي طريقة ناجحة أخرى لإدخال خلايا GBM أو GSCs في مواقع محددة من شريحة الدماغ خارج الجسم الحي ، ويمكن مراقبة سلوك الخلية الغازية عن طريق الفحص المجهري الفلوري واسع المجال ، على الرغم من أن دقة الخلايا الفردية يمكن أن تكون ضعيفة.
يوضح الشكل 6 صورا ثابتة لتجارب الفاصل الزمني متحد البؤر لغزو خلايا GSC16-4 / GFP الحية و U-118 / L1LE / mCherry في شرائح الدماغ. تم الحصول على صور z-stack متحدة البؤر كل 10 دقائق على مدار 20 ساعة في تجربة الفاصل الزمني متعددة النقاط. يتم عرض أفلام غزو الخلايا من الأجسام الكروية إلى شرائح الدماغ المأخوذة كمكدسات z متحدة البؤر بمرور الوقت في الفيديو التكميلي S7 والفيديو التكميلي S8 والفيديو التكميلي S9 والفيديو التكميلي S10 والفيديو التكميلي S11. كشفت هذه التجربة أن التصوير بالفاصل الزمني متحد البؤر كان متفوقا على مضان المجال الواسع لتتبع السلوك الغازي للخلايا الفردية. كانت خلايا U-118 / L1LE أكثر توغلا بشكل ملحوظ من خلايا GSCs في ظل هذه الظروف. هذا واضح حتى في الصور الثابتة ، حيث يتم تحديد موقع GSCs بشكل مركزي أكثر وخلايا U-118 أكثر تشتتا.
يوضح الشكل 7 عدة أمثلة على شرائح الدماغ / المستحضرات الكروية خارج الجسم الحي ، حيث تم وضع اثنين من الكرويات المختلفة ذات العلامات المنفصلة (U-118 / L1LE / mCherry الكروية و GSC16-4 / GFP) على شرائح الدماغ ، ونمت لعدة أيام ، ثم تم تثبيتها لاحقا ، وملطخة بالمناعة للامينين ، وتم تصويرها عن طريق التقسيم البصري على مجهر متحد البؤر. كشف هذا أن كلا النوعين من الخلايا غزا شريحة الدماغ وسافرا على طول الأوعية الدموية. عندما كانت الأنواع المختلفة من الكرات قريبة بما يكفي للاتصال ببعضها البعض ، بدا أن هناك القليل ، إن وجد ، من غزو نوع واحد من الخلايا إلى كروية من نوع الخلية الآخر ، وظلت الكائنات الكروية منفصلة.
يوضح الشكل 8 عدة أمثلة على شرائح الدماغ خارج الجسم الحي / المستحضرات الكروية حيث تم وضع كرويات "من نوع الخلايا المختلطة" المتولدة في الثقافة باستخدام نوعين مختلفين من الخلايا (U-118 / L1LE / mCherry الممزوج ب GSC16-4 / GFP) على شرائح الدماغ ، ونمت لعدة أيام ، ثم تم تثبيتها لاحقا ، وملطخة بالمناعة للامينين ، وتم تصويرها عن طريق التقسيم البصري على مجهر متحد البؤر. كشف هذا أن خلايا U-118 / L1LE / mCherry الحمراء هاجرت من الكرويات وانتشرت بشكل أكثر وضوحا من خلايا GSC16-4 / GFP الخضراء ، والتي تميل إلى البقاء في كتل بالقرب من مركز الأجسام الكروية. بالإضافة إلى ذلك ، تم تلطيخ خلايا U-118 / L1LE / mCherry أيضا ب DiD بحيث يمكن مقارنة الملصقين المنفصلين (mCherry و DiD) مباشرة في الاستعدادات الثابتة خارج الجسم الحي. لا يزال من الممكن اكتشاف ملصق DiD ، حتى في الخلايا المفردة التي غزت شريحة الدماغ. ومع ذلك ، كان هذا كما puncta داخل الخلايا.
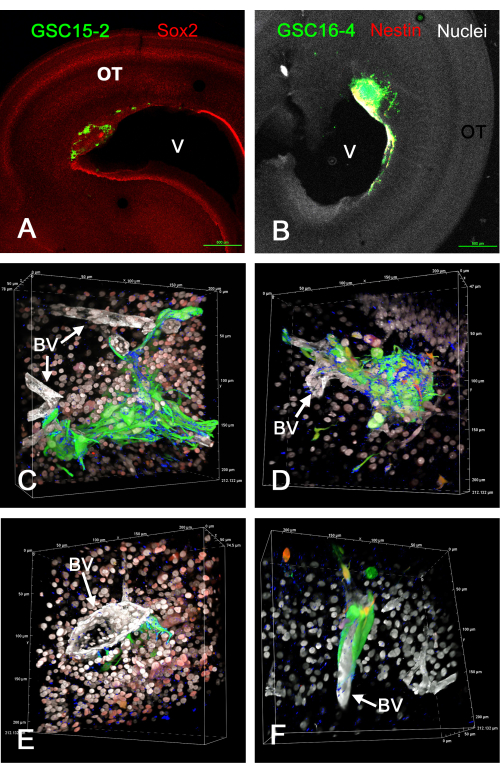
الشكل 1: الأورام في E15 الناتجة عن حقن GSCs في القفص البصري E5 في الجسم الحي. GSCs خضراء بسبب تعبير GFP. تظهر خلايا GSC15-2 في اللوحات A و C و E ، وتظهر خلايا GSC16-4 في اللوحات B و D و F. (أ) منظر منخفض التكبير للصمت البصري مع وجود ورم بالقرب من البطين (V). يظهر تلطيخ Sox2 باللون الأحمر ، مما يلطخ معظم نوى خلايا OT. (B) صورة مشابهة ل A ولكن مع خلايا GSC16-4 ملطخة أيضا ب nestin باللون الأحمر ، والتي يمكن أن تظهر صفراء أو بيضاء في الصورة بسبب خلط الألوان والتعرض للصورة. تظهر نوى OT بيضاء بسبب تلطيخ مضاد مع ثنائي بنزيميد. (سي إف) وجهات نظر مختلفة من عروض الحجم المتولدة من مداخن z باستخدام هدف غمر الزيت 60x. تظهر نوى الخلية بيضاء بسبب تلطيخ بيسبنزيميد ، وبعضها يظهر باللون الأحمر في اللوحتين C و E بسبب التلوين المناعي ل Sox2. تلطيخ أحمر في لوحات D و F هو من تلطيخ ل nestin. لاحظ أنه نظرا ل "Alpha Blending" لعروض الحجم في برنامج المجهر متحد البؤر ، لا تمتزج الألوان كما لو كانت تستخدم أقصى إسقاط كثافة ، ويسود اللون الأكثر انتشارا ويحجب اللون الأقل كثافة. الأوعية الدموية ملطخة باللون الأبيض بسبب التلوين المناعي للامينين. يظهر تلطيخ علامة GSC integrin alpha-6 باللون الأزرق ، ويظهر مثقوبا على أسطح GSC. تظهر مقاييس الميكرون على طول حواف تجسيد وحدة التخزين. يتم عرض مقاطع الفيديو الخاصة بتدوير عروض وحدات التخزين في اللوحات C-F في الفيديو التكميلي S1 والفيديو التكميلي S2 والفيديو التكميلي S3 والفيديو التكميلي S4. قضبان المقياس = 500 ميكرومتر (أ ، ب). الاختصارات: GSCs = الخلايا الجذعية للورم الأرومي الدبقي. OT = القفص البصري ؛ GFP = بروتين الفلورسنت الأخضر ؛ BV = الأوعية الدموية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
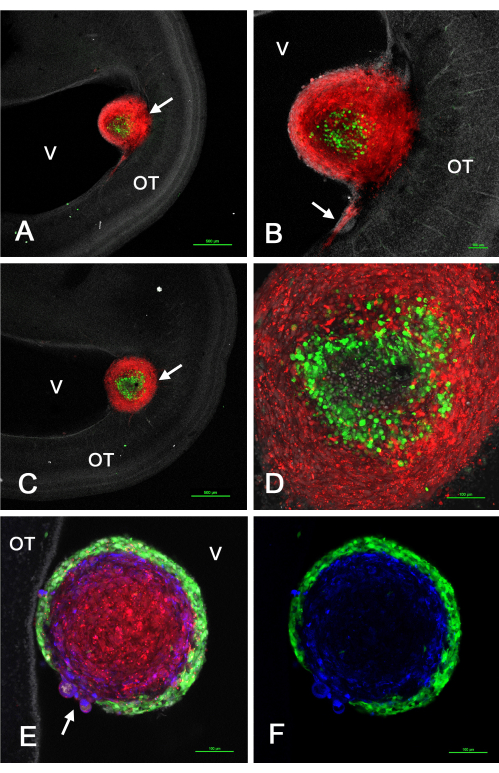
الشكل 2: الأورام في E15 الناتجة عن خليط من خلايا GSCs و U-118 GBM المحقونة في القفص البصري E5. GSCs خضراء بسبب تعبير GFP وخلايا U-118 / L1LE حمراء بسبب تعبير mChere. يتم عرض GSC15-2 في اللوحات A-D ، ويظهر GSC16-4 في اللوحات E و F. (أ) مستوى z أحادي متحد البؤر منخفض التكبير لورم خلوي مختلط (سهم) بالقرب من البطين. النوى بيضاء اللون مع ثنائي بنزيميد. (ب) تكبير أعلى (هدف 10x) للورم الموضح في A مع غزو خلايا U-118 الحمراء إلى OT بالقرب من سطح البطين. (ج) مستوى مختلف قليلا من المقطع البصري عن المستوى الموجود في A يوضح الورم (السهم) مغروسا أعمق في جدار OT. (د) الحد الأقصى للإسقاط (هدف 20x) لمستويات z متعددة للورم في C تظهر تفاصيل الخلايا التي تم فرزها داخل الورم. (E) صورة واحدة من المستوى z (هدف 20x) لورم مختلط مع خلايا GSC16-4 ، مما يدل على أن الفرز داخل الورم حدث في نمط معاكس من خلايا GSC15-2 ، مع تكوين GSCs الخضراء قشرة رقيقة وحتى محيطة بخلايا U-118 الحمراء. لا تظهر منطقة تعلق الورم بجدار OT في هذه الطائرة z. لاحظ منطقة الورم حيث يوجد انقطاع في قشرة GSC مع انتفاخ خلايا U-118 / L1LE من خلال (السهم). يظهر التلوين المناعي ل L1CAM باللون الأزرق. (F) نفس الصورة كما في E ، ولكن تظهر فقط GSCs الخضراء وتلطيخ L1CAM الأزرق. قضبان المقياس = 500 ميكرومتر (A ، C) ، 100 ميكرومتر (B ، D ، E ، F). الاختصارات: GSCs = الخلايا الجذعية للورم الأرومي الدبقي. OT = القفص البصري ؛ GFP = بروتين الفلورسنت الأخضر ؛ V = البطين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
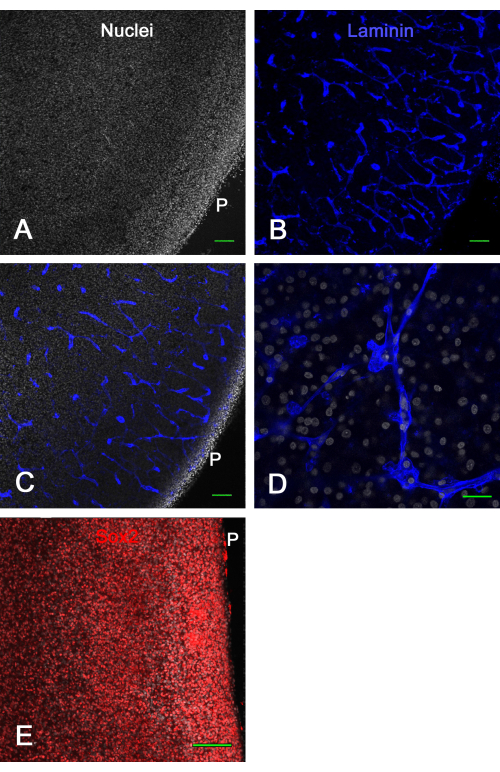
الشكل 3: صلاحية شرائح القفص البصري خارج الجسم الحي بعد 1 أسبوع في الثقافة. تم استزراع شرائح القفص البصري E14 على إدخالات غشائية لمدة أسبوع واحد ثم تم تثبيتها وتطوينها. تظهر في A و B صور متحدة البؤر (هدف 10x) لشريحة دماغية ملطخة بالنوى مع ثنائي بنزيميد (A) ومناعية للامينين (B) ، والتي تظهر بوضوح الأوعية الدموية الطبيعية السليمة مقسمة بصريا في تكوينات مختلفة بحكم تلطيخ اللامينين. (ج) صورة متحدة البؤر مشابهة لتلك الموضحة في اللوحتين (أ) و(ب)؛ حيث تكون النوى وتلطيخ اللامينين مرئيين. (د) صورة متحدة البؤر ذات تكبير أعلى (60 ضعفا من هدف الزيت) توضح تفاصيل التلوين النووي والصفيح. (ه) صورة الإسقاط القصوى لمكدس z متحد البؤر (هدف 20x) لشريحة الدماغ الملطخة لعامل النسخ Sox2 باللون الأحمر والنوى الكلية مع ثنائي بنزيميد باللون الأبيض. لاحظ أن غالبية النوى تظهر تلطيخ Sox2 ، كما هو موضح في الجسم الحي (انظر الشكل 1). أشرطة المقياس = 100 ميكرومتر (أ ، ب ، ج ، ه) ، 25 ميكرومتر (د). اختصار: P = سطح بيال. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
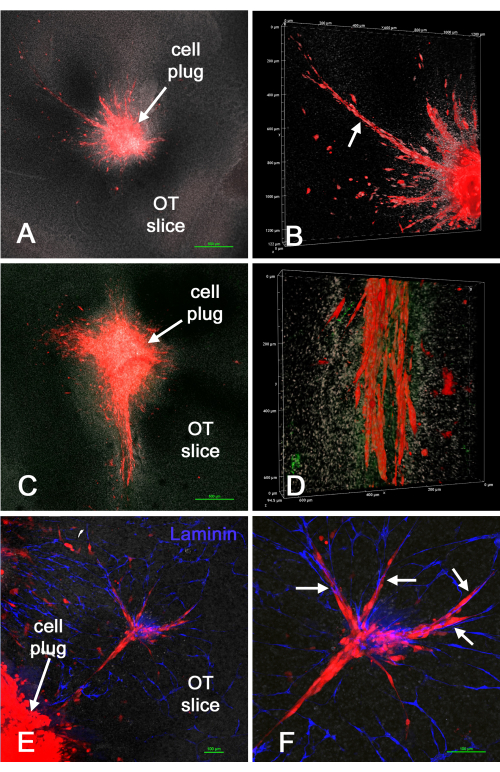
الشكل 4: خلايا U-118 / mCherry موضوعة في شريحة دماغية خارج الجسم الحي عبر طريقة لكمة الخزعة. تم إنشاء تجاويف في شرائح الدماغ باستخدام لكمة خزعة 1 مم ، ثم تم زرع خلايا U-118 / L1LE / mCherry الحمراء الممزوجة بالمصفوفة ك "سدادة". بعد عدة أيام ، تم إصلاح شرائح الدماغ ، وملطخة بالمناعة للامينين ، وتركيبها على شرائح لتحليل المجهر متحد البؤر. تظهر اللوحتان A و C صورا منخفضة التكبير ومتحدة التركيز وأحادية المستوى z (هدف 4x) ل "الورم" الناتج والخلايا المحيطة التي غزت شريحة الدماغ. (B) عرض حجم مكدس z من التحضير في اللوحة A بتكبير أعلى (هدف 20x) ، يظهر غزوا واسع النطاق لخلايا U-118 (السهم). (د) تظهر الصورة تجسيدا مماثلا لحجم الجزء السفلي من الخلايا الغازية على نطاق واسع كما هو موضح في اللوحة C. يظهر تلطيخ اللامينين باللون الأخضر ، ولكن لا توجد أوعية دموية واضحة واضحة. (ه) توضح الصورة جزءا من سدادة خلوية ومجموعة من الخلايا التي غزت شريحة الدماغ، بالإضافة إلى تلطيخ اللامينين للأوعية الدموية باللون الأزرق. (F) تكبير أعلى للخلايا الغازية الموضحة في اللوحة E ، ويمكن رؤية الخلايا بوضوح محاذاة على طول الأوعية الدموية (الأسهم). تظهر جميع اللوحات تلطيخا نوويا أبيض مضادا مع ثنائي بنزيميد. قضبان المقياس = 500 ميكرومتر (A ، C) ، 100 ميكرومتر (E ، F). مقياس اللوحات B و D على طول محاور تجسيد وحدة التخزين. اختصار: OT = القفص البصري. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: كرويات الخلايا الحية في الثقافة وصور مضان واسعة المجال لخلايا GBM الحية في شرائح الدماغ خارج الجسم الحي. تظهر في اللوحتين A و B صور تباين الطور (باستخدام هدف 10x على مجهر مقلوب) لخلايا U-118 / L1LE GBM (A) و GSCs (B) تنمو على شكل كرويات (أسهم). يظهر في خلفية اللوحة A عدم التساوي خارج التركيز لطلاء poly-HEMA الذي يمكن أن يحدث على طبق زراعة الخلايا. تظهر في اللوحات C-F صور مضان واسعة المجال لكرويات الخلايا U-118 / L1LE والخلايا الغازية (الأسهم) أثناء تجربة الفاصل الزمني لمراقبة السلوك الحي للغزو في شرائح خارج الجسم الحي (باستخدام هدف 20x على نظام مجهر مخصص بفاصل زمني18). في اللوحتين C و E ، يتم تلطيخ الخلايا بصبغة الغشاء الفلوري الأحمر المتطرف DiD ، وفي اللوحتين D و F ، يتم تصوير الخلايا عبر تعبير mCherry الأحمر. قضبان المقياس = 100 ميكرومتر. توجد مقاطع الفيديو الخاصة بتجارب الفاصل الزمني الفلوري واسع المجال الموضحة في اللوحتين C و D في الفيديو التكميلي S5 والفيديو التكميلي S6 ، على التوالي. الاختصارات: GBM = ورم أرومي دبقي. GSCs = الخلايا الجذعية GBM ؛ S = كروي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
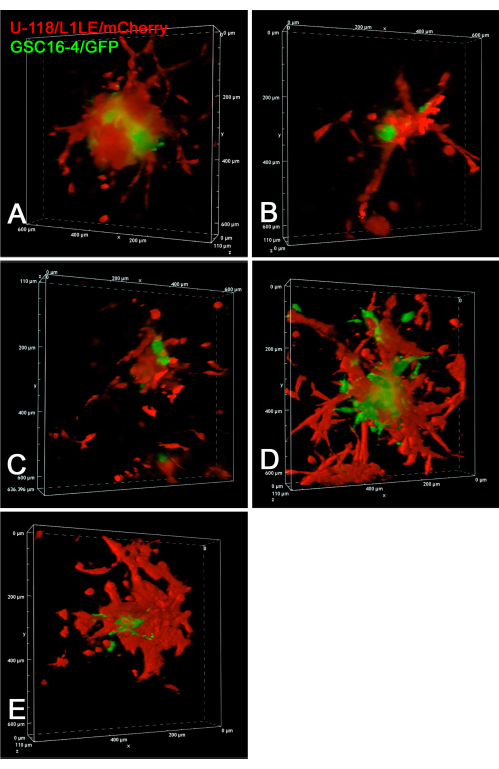
الشكل 6: حجم عرض صور الفاصل الزمني 4D متحد البؤر لخلايا GSCs و GBM الحية. تظهر في جميع اللوحات صور نقطة النهاية لخمس غروات كروية مختلطة الخلايا مختلفة على شرائح دماغية منفصلة. بالنسبة للوحات A-E ، تم الحصول على صور z-stack متحدة البؤر بخطوات 10 ميكرومتر كل 10 دقائق على مدار 20 ساعة. تضمنت الاستعدادات شرائح الدماغ مع كرويات الخلايا المختلطة المزروعة من خلايا U-118 / L1LE / mCherry الحمراء وخلايا GSC16-4 / GFP الخضراء. تم التقاط صور متحدة البؤر بينما تم زرع شرائح الدماغ على إدخالات غشائية في طبق زراعة خلايا بلاستيكية من 6 آبار باستخدام عدسة موضوعية لمسافة العمل الطويلة جدا (ELWD) 20x (0.45 NA) ، والتي وفرت مسافة العمل الإضافية المطلوبة. تم إنشاء عروض الحجم باستخدام برنامج المجهر متحد البؤر "Alpha Blending" ، والذي يعطي تأثير 3D واضح. يتم عرض مقاطع الفيديو ذات الفاصل الزمني لوحدات التخزين متحدة البؤر هذه بمرور الوقت في الفيديو التكميلي S7 والفيديو التكميلي S8 والفيديو التكميلي S9 والفيديو التكميلي S10 والفيديو التكميلي S11. الاختصارات: GBM = ورم أرومي دبقي. GSCs = الخلايا الجذعية GBM ؛ GFP = بروتين الفلورسنت الأخضر ؛ NA = الفتحة العددية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
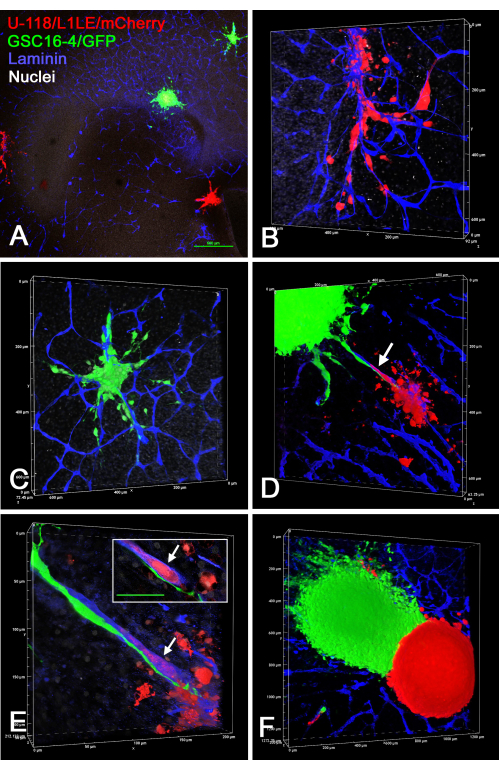
الشكل 7: صور متحدة البؤر لشرائح الدماغ الثابتة مع خلايا GBM الغازية من كرويات من أنواع مختلفة من الخلايا. تتكون الكرويات الخضراء من خلايا GSC16-4 / GFP وتتكون الكرات الحمراء من خلايا U-118 / L1LE / mCherry . تظهر في اللوحات A-F وجهات نظر مختلفة لشرائح الدماغ ، حيث تم استزراع العديد من الكرويات الحمراء والخضراء لعدة أيام قبل التثبيت والتلطيخ المناعي للامينين (الأزرق). اللوحات A-C هي من نفس شريحة OT حيث تم التقاط A بهدف 4x ، واللوحات B و C عبارة عن حجم تكبير أعلى (هدف 20x) للخلايا التي غزت شريحة الدماغ من اثنين من الكرويات الموضحة في اللوحة A. من الواضح أن كلا النوعين من الخلايا غزا الأنسجة على طول الأوعية الدموية. تظهر اللوحة D تجسيدا حجميا (هدف 20x) لشريحة دماغية مختلفة حيث توجد كرويتان مختلفتان بالقرب من بعضهما البعض ، وترى خلايا من كليهما تهاجر على طول نفس الوعاء الدموي الموجود بينهما (السهم). اللوحة E عبارة عن حجم تكبير عالي (هدف زيت 60x) يكشف أن الخلايا الخضراء تهاجر على طول السطح الخارجي للوعاء الدموي ، بينما تهاجر الخلية الحمراء داخل الوعاء الدموي (السهم). يظهر الجزء الداخلي مقطعا بصريا واحدا من المستوى z ، حيث تكون الخلية الحمراء محاطة بوضوح بتلطيخ أزرق للوعاء الدموي (السهم) ، ومن الواضح أن الخلية الخضراء خارج الأوعية الدموية. شريط المقياس في أقحم = 50 ميكرومتر. تظهر اللوحة F تجسيد حجم (هدف 10x) لشريحة الدماغ الأمامي مع اثنين من كرويات ملونة مختلفة بشكل وثيق. حدث القليل جدا ، إن وجد ، من غزو خلوي إلى آخر ، وكانت هناك حدود حادة بينهما. توضح اللوحات A و B و C و E أيضا تلطيخا نوويا أبيض مضادا مع ثنائي بنزيميد. شريط المقياس = 500 ميكرومتر (A). توجد موازين اللوحات B-F على طول محاور تجسيد الحجم. الاختصارات: GBM = ورم أرومي دبقي. GSCs = الخلايا الجذعية GBM ؛ GFP = بروتين الفلورسنت الأخضر ؛ OT = القفص البصري. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
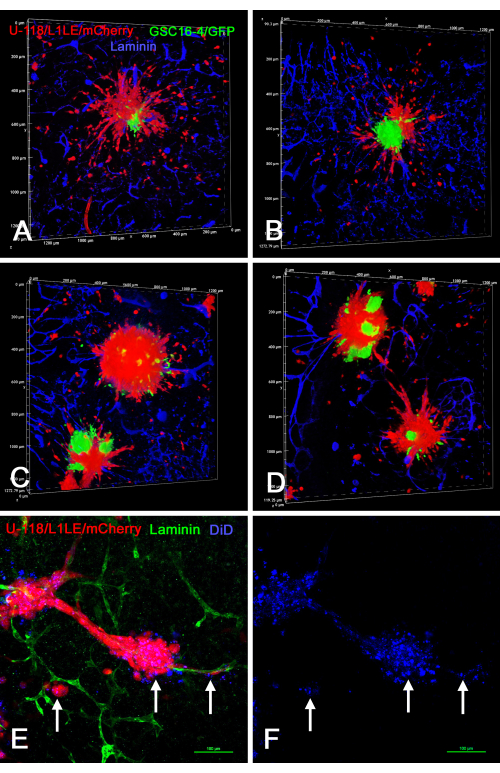
الشكل 8: صور متحدة البؤر لشرائح دماغية ثابتة مع خلايا GBM الغازية من كرويات الخلايا المختلطة وكرويات موسومة ب DiD. تظهر اللوحات A-D حجم شرائح الدماغ التي تحتوي على كرويات مختلطة الخلايا تتكون من خلايا GSC16-4 / GFP الخضراء وخلايا U-118 / L1LE / mCherry الحمراء. تفرقت العديد من خلايا U-118 الحمراء من الكرويات وغزت شريحة الدماغ في جميع الاتجاهات ، في حين أن GSCs الخضراء لم تتفرق وبقيت في المواقع المركزية للكرويات. تظهر اللوحات E و F تحضيرا لشريحة خارج الجسم الحي مع كرويات U-118 / L1LE / mCherry حمراء موسومة أيضا بصبغة غشاء حمراء بعيدة DiD (كما هو موضح باللون الأزرق). بعد التثبيت ، تم تطويع الشريحة للامينين باللون الأخضر. كان ملصق DiD مرئيا في الخلايا الحمراء كتلطيخ مثقوب (سهام) وكان مرئيا حتى في الخلايا التي انتشرت من الأجسام الكروية على طول الأوعية الدموية. لا يظهر التلوين النووي المضاد مع ثنائي بنزيميد في هذا الشكل بحيث يكون التلوين الآخر أكثر وضوحا. أشرطة المقياس = 100 ميكرومتر (E ، F). الاختصارات: GBM = ورم أرومي دبقي. GSCs = الخلايا الجذعية GBM ؛ GFP = بروتين الفلورسنت الأخضر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| متوسطة / حل | تكوين | ||
| وسائل الإعلام GSC | 1: 1 خليط من DMEM / F12 ، مصل بقري جنيني 1٪ (FBS) ، 15 مللي مول HEPES buffer ، 2 mM L-glutamine ، 100 ميكروغرام / مل بنسلين-ستربتومايسين (قلم / جردية) ، 2٪ مكمل B27 بدون فيتامين أ ، و 2.5 ميكروغرام / مل هيبارين. | ||
| GBM وسائل الإعلام | DMEM (نسبة عالية من الجلوكوز) ، 10٪ FBS ، قلم / بكتيريا ، و 2 مللي مول من الجلوتامين. | ||
| المخزن المؤقت للتثبيت | 2٪ PFA في محلول كاكوديلات الصوديوم 0.1 متر | ||
| تضمين الوسيط | 3.5٪ أجار وسكروز 8٪ في برنامج تلفزيوني | ||
| بست جي | 0.1٪ Triton X-100 + 5٪ مصل الماعز العادي (NGS) في برنامج تلفزيوني | ||
| U-118 MG وسط زراعة الخلايا | DMEM + 10٪ FBS + قلم / بكتيريا + L- الجلوتامين | ||
| وسائط ثقافة شريحة الدماغ | 50٪ MEM + 25٪ HBSS + 25٪ مصل حصان + B27 + قلم / بكتيريا + L-glut + 15 mM HEPES عازلة | ||
| تهتز الأنسجة تقطيع وسائل الإعلام | متوسط 199 + قلم / بكتيريا + 15 مللي متر HEPES عازلة | ||
الجدول 1: تكوين الوسائط والمخازن المؤقتة المستخدمة في هذا البروتوكول.
الشكل التكميلي 1: الحقن في القفص البصري E5. (أ) بعد قطع ثقب في قشر البيض فوق الفضاء الهوائي، وترطيب غشاء الفضاء الجوي بمحلول ملحي أو وسط، يزال الغشاء بالملقط الرفيع. (ب) لحقن الخلايا في القفص البصري، يضغط السلى ويمسك بملقط رفيع لوضع الرأس بحيث يمكن الوصول إلى القفص البصري. ثم يتم إدخال الماصة الدقيقة في القفص البصري ويتم حقن الخلايا بالضغط فيه. (ج) بعد حقن الخلايا، تضاف بضع قطرات من محلول الأمبيسلين أعلى الجنين باستخدام حقنة وإبرة رفيعة. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 2: تشريح مناطق الدماغ E15. (أ) بعد قطع الرأس، يوضع رأس الجنين E15 في طبق به محلول CMF معقم. (ب) ثم يزال الجلد الذي يغطي الدماغ باستخدام ملقط رفيع. (ج) بعد ذلك، تزال عظمتا الجمجمة من نصفي الكرة المخية الأمامية. (د) بعد ذلك، تزال الطبقة الجافية من النسيج الضام برفق من الدماغ الأمامي المحيط والمخيخ المحيطين به. (ه) بعد ذلك، يزال الدماغ بأكمله من الرأس عن طريق إخراجه برفق من تجويف الدماغ من الأسفل باستخدام ملقط منحني. (F ) يظهر المنظر الظهري للدماغ الذي تمت إزالته بالكامل مع الدماغ الأمامي (FB) والقفص البصري (OT) والمخيخ (CB). (ز ) ثم يتم تشريح الدماغ المعزول إلى نصفي الدماغ الأمامي (FB) ، ونصفي الكرة المخية البصري (OT) ، والمخيخ (CB) باستخدام مقص دقيق. (H ) ثم يتم إزالة حنون النسيج الضام الرقيق بسهولة من نصفي الكرة الأرضية البصري (OT) باستخدام ملقط دقيق. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 3: تضمين وتقطيع الحاجز البصري E15 ووضع كرويات الخلية. (أ) يغمر نصف الكرة الأرضية البصري في أغاروز منخفض الذوبان باستخدام ملقط منحني. (ب) بعد أن يصلب الأغاروز على الجليد ، يتم قطع الكتلة التي تحتوي على القفص البصري ولصقها على قاعدة الفولاذ المقاوم للصدأ في طبق / صينية التقطيع. (ج) بعد أن يجف الغراء ، يتم وضع طبق / صينية التقطيع في ظرف تقطيع الأنسجة الاهتزازية وتملأ بوسائط التقطيع الباردة. ثم يتم قطع الشرائح بسكين الياقوت من كتلة الأنسجة المغمورة. سوف تطفو الشرائح المقطعة في الطبق / الصينية ويمكن إزالتها باستخدام ملعقة. (د) تتم إزالة الشرائح المقطعة من الطبق / الصينية وتوضع مباشرة على حشوات غشائية مع وسائط زراعة شرائح أساسية في لوحة متعددة الآبار. (ه) بعد زراعة كرويات الخلايا على أطباق مغلفة ببولي هيما، تتم إزالة كروية من الطبق في الحد الأدنى من الوسائط باستخدام 20 ميكروبيتور. (F) ثم توضع الكروية المعزولة مباشرة على شريحة الدماغ في الحد الأدنى من الوسط. (ز) إذا سقط الكروي من شريحة الدماغ بسبب تدفق الوسائط ، فيمكن دفعه مرة أخرى إلى شريحة الدماغ باستخدام رمش ملتصق بعصا خشبية. الرجاء الضغط هنا لتنزيل هذا الملف.
الفيديو التكميلي S1: فيديو لعرض حجم التكبير العالي لورم صغير GSC15-2 في E15. GSCs خضراء بسبب تعبير GFP. يتوافق الفيديو مع الشكل 1C ويظهر خلايا GSC15-2. يعرض الفيديو دوران تجسيد وحدة التخزين الناتج عن مكدس z باستخدام هدف غمر الزيت 60x. تظهر نوى الخلية بيضاء بسبب تلطيخ بيسبنزيميد ، وبعضها يظهر باللون الأحمر بسبب التلوين المناعي ل Sox2. لاحظ أنه نظرا ل "Alpha Blending" لعروض الحجم في برنامج المجهر متحد البؤر ، لا تمتزج الألوان كما لو كانت تستخدم أقصى كثافة إسقاط ، ويسود اللون الأكثر كثافة ويحجب اللون الأقل كثافة. الأوعية الدموية ملطخة باللون الأبيض بسبب التلوين المناعي للامينين. يظهر تلطيخ علامة GSC integrin alpha-6 باللون الأزرق ويظهر مثقوبا على أسطح GSC الخضراء. تظهر مقاييس الميكرون على طول حواف تجسيد وحدة التخزين. الرجاء الضغط هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S2: فيديو لعرض حجم التكبير العالي لورم GSC16-4 صغير في E15. GSCs خضراء بسبب تعبير GFP. يتوافق الفيديو مع الشكل 1D ويظهر خلايا GSC16-4. يعرض الفيديو دوران تجسيد وحدة التخزين الناتج عن مكدس z باستخدام هدف غمر الزيت 60x. تظهر نوى الخلية بيضاء بسبب تلطيخ ثنائي بنزيميد ، وتظهر بعض GSCs حمراء بسبب التلوين المناعي للعش. لاحظ أنه نظرا ل "Alpha Blending" لعروض الحجم في برنامج المجهر متحد البؤر ، لا تمتزج الألوان كما لو كانت تستخدم أقصى كثافة إسقاط ، ويسود اللون الأكثر كثافة ويحجب اللون الأقل كثافة. الأوعية الدموية ملطخة باللون الأبيض بسبب التلوين المناعي للامينين. يظهر تلطيخ علامة GSC integrin alpha-6 باللون الأزرق ويظهر مثقوبا على أسطح GSC الخضراء. تظهر مقاييس الميكرون على طول حواف تجسيد وحدة التخزين. الرجاء الضغط هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S3: يعرض الفيديو ذو الحجم العالي التكبير لورم GSC15-2 الصغير في E15. GSCs خضراء بسبب تعبير GFP. يتوافق الفيديو مع الشكل 1E ويظهر خلايا GSC15-2. يعرض الفيديو دوران تجسيد وحدة التخزين الناتج عن مكدس z باستخدام هدف غمر الزيت 60x. تظهر نوى الخلية بيضاء بسبب تلطيخ بيسبنزيميد ، وبعضها يظهر باللون الأحمر بسبب التلوين المناعي ل Sox2. لاحظ أنه نظرا ل "Alpha Blending" لعروض الحجم في برنامج المجهر متحد البؤر ، لا تمتزج الألوان كما لو كانت تستخدم أقصى كثافة إسقاط ، ويسود اللون الأكثر كثافة ويحجب اللون الأقل كثافة. الأوعية الدموية ملطخة باللون الأبيض بسبب التلوين المناعي للامينين. يظهر تلطيخ علامة GSC integrin alpha-6 باللون الأزرق ويظهر مثقوبا على أسطح GSC الخضراء. تظهر مقاييس الميكرون على طول حواف تجسيد وحدة التخزين. الرجاء الضغط هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S4: يعرض فيديو بحجم التكبير العالي لأورام GSC16-4 الصغيرة في E15. GSCs خضراء بسبب تعبير GFP. يتوافق الفيديو مع الشكل 1F ويظهر خلايا GSC16-4. يعرض الفيديو دوران تجسيد وحدة التخزين الناتج عن مكدس z باستخدام هدف غمر الزيت 60x. تظهر نوى الخلية بيضاء بسبب تلطيخ بيسبنزيميد ، وبعضها يظهر باللون الأحمر بسبب التلوين المناعي للنستين. لاحظ أنه نظرا ل "Alpha Blending" لعروض الحجم في برنامج المجهر متحد البؤر ، لا تمتزج الألوان كما لو كانت تستخدم أقصى كثافة إسقاط ، ويسود اللون الأكثر كثافة ويحجب اللون الأقل كثافة. الأوعية الدموية ملطخة باللون الأبيض بسبب التلوين المناعي للامينين. يظهر تلطيخ علامة GSC integrin alpha-6 باللون الأزرق ويظهر مثقوبا على أسطح GSC الخضراء. تظهر مقاييس الميكرون على طول حواف تجسيد وحدة التخزين. الرجاء الضغط هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S5: فيديو لخلايا GBM الحية في شريحة الدماغ خارج الجسم الحي . يتوافق الفيديو مع الشكل 5C ويظهر صورا مضان واسعة المجال لكرويات الخلايا U-118 / L1LE والخلايا الغازية أثناء تجربة الفاصل الزمني لمراقبة السلوك الحي للغزو في شريحة خارج الجسم الحي (باستخدام هدف 20x على نظام مجهر مخصص بفاصل زمني). تم تلطيخ خلايا U-118 / L1LE بصبغة غشاء الفلورسنت الحمراء المتطرفة DiD. تم الحصول على الصور بكاميرا أحادية اللون. الرجاء الضغط هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S6: فيديو لخلايا GBM الحية في شريحة الدماغ خارج الجسم الحي . يتوافق الفيديو مع الشكل 5D ويظهر صورا مضان واسعة المجال لكرويات الخلايا U-118 / L1LE والخلايا الغازية أثناء تجربة الفاصل الزمني لمراقبة السلوك الحي للغزو في شريحة خارج الجسم الحي (باستخدام هدف 20x على نظام مجهر مخصص بفاصل زمني). تم تصوير الخلايا عبر تعبير mCherry الأحمر. تم الحصول على الصور بكاميرا أحادية اللون. الرجاء الضغط هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S7: فيديو من حجم عرض صور الفاصل الزمني 4D متحد البؤر من GSCs الحية وخلايا GBM. يتوافق الفيديو مع الشكل 6 أ. تم الحصول على صور z-stack متحدة البؤر بخطوات 10 ميكرومتر كل 10 دقائق على مدار 20 ساعة. كان التحضير لشريحة دماغية مع كرويات مختلطة الخلايا مزروعة من خلايا U-118 / L1LE / mCherry الحمراء وخلايا GSC16-4 / GFP الخضراء. تم التقاط صور متحدة البؤر أثناء زراعة شريحة الدماغ على إدخال غشائي في طبق زراعة خلايا بلاستيكية مكون من 6 آبار باستخدام عدسة موضوعية ELWD 20x (0.45 NA) ، والتي وفرت مسافة العمل الإضافية المطلوبة. تم إنشاء عرض وحدة التخزين باستخدام برنامج المجهر متحد البؤر "Alpha Blending" ، والذي يعطي تأثير 3D واضح. تظهر مقاييس الميكرون على طول حواف تجسيد وحدة التخزين. من الأفضل ملاحظة الفيديو عن طريق سحب شريط تمرير تقدم الفيديو يدويا في مشغل الفيديو ذهابا وإيابا لمراقبة حركة الخلية بدلا من السماح لمشغل الفيديو بالمتابعة بسرعته البطيئة العادية. الرجاء الضغط هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S8: فيديو لحجم عرض صور الفاصل الزمني 4D متحد البؤر لخلايا GSCs و GBM الحية. يتوافق الفيديو مع الشكل 6B. تم الحصول على صور z-stack متحدة البؤر بخطوات 10 ميكرومتر كل 10 دقائق على مدار 20 ساعة. كان التحضير لشريحة دماغية مع كرويات مختلطة الخلايا مزروعة من خلايا U-118 / L1LE / mCherry الحمراء وخلايا GSC16-4 / GFP الخضراء. تم التقاط صور متحدة البؤر أثناء زراعة شريحة الدماغ على إدخال غشائي في طبق زراعة خلايا بلاستيكية مكون من 6 آبار باستخدام عدسة موضوعية ELWD 20x (0.45 NA) ، والتي وفرت مسافة العمل الإضافية المطلوبة. تم إنشاء عرض وحدة التخزين باستخدام برنامج المجهر متحد البؤر "Alpha Blending" ، والذي يعطي تأثير 3D واضح. تظهر مقاييس الميكرون على طول حواف تجسيد وحدة التخزين. من الأفضل ملاحظة الفيديو عن طريق سحب شريط تمرير تقدم الفيديو يدويا في مشغل الفيديو ذهابا وإيابا لمراقبة حركة الخلية بدلا من السماح لمشغل الفيديو بالمتابعة بسرعته البطيئة العادية. الرجاء الضغط هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S9: فيديو لحجم عرض صور الفاصل الزمني 4D متحد البؤر لخلايا GSCs و GBM الحية. يتوافق الفيديو مع الشكل 6C. تم الحصول على صور z-stack متحدة البؤر بخطوات 10 ميكرومتر كل 10 دقائق على مدار 20 ساعة. كان التحضير لشريحة دماغية مع كرويات مختلطة الخلايا مزروعة من خلايا U-118 / L1LE / mCherry الحمراء وخلايا GSC16-4 / GFP الخضراء. تم التقاط صور متحدة البؤر أثناء زراعة شريحة الدماغ على إدخال غشائي في طبق زراعة خلايا بلاستيكية مكون من 6 آبار باستخدام عدسة موضوعية ELWD 20x (0.45 NA) ، والتي وفرت مسافة العمل الإضافية المطلوبة. تم إنشاء عرض وحدة التخزين باستخدام برنامج المجهر متحد البؤر "Alpha Blending" ، والذي يعطي تأثير 3D واضح. تظهر مقاييس الميكرون على طول حواف تجسيد وحدة التخزين. من الأفضل ملاحظة الفيديو عن طريق سحب شريط تمرير تقدم الفيديو يدويا في مشغل الفيديو ذهابا وإيابا لمراقبة حركة الخلية بدلا من السماح لمشغل الفيديو بالمتابعة بسرعته البطيئة العادية. الرجاء الضغط هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S10: فيديو لحجم عرض صور الفاصل الزمني 4D متحد البؤر لخلايا GSCs و GBM الحية. يتوافق الفيديو مع الشكل 6D. تم الحصول على صور z-stack متحدة البؤر بخطوات 10 ميكرومتر كل 10 دقائق على مدار 20 ساعة. كان التحضير لشريحة دماغية مع كرويات مختلطة الخلايا مزروعة من خلايا U-118 / L1LE / mCherry الحمراء وخلايا GSC16-4 / GFP الخضراء. تم التقاط صور متحدة البؤر أثناء زراعة شريحة الدماغ على إدخال غشائي في طبق زراعة خلايا بلاستيكية مكون من 6 آبار باستخدام عدسة موضوعية ELWD 20x (0.45 NA) ، والتي وفرت مسافة العمل الإضافية المطلوبة. تم إنشاء عرض وحدة التخزين باستخدام برنامج المجهر متحد البؤر "Alpha Blending" ، والذي يعطي تأثير 3D واضح. تظهر مقاييس الميكرون على طول حواف تجسيد وحدة التخزين. من الأفضل ملاحظة الفيديو عن طريق سحب شريط تمرير تقدم الفيديو يدويا في مشغل الفيديو ذهابا وإيابا لمراقبة حركة الخلية بدلا من السماح لمشغل الفيديو بالمتابعة بسرعته البطيئة العادية. الرجاء الضغط هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S11: فيديو لحجم عرض صور الفاصل الزمني 4D متحد البؤر لخلايا GSCs و GBM الحية. يتوافق الفيديو مع الشكل 6E. تم الحصول على صور z-stack متحدة البؤر بخطوات 10 ميكرومتر كل 10 دقائق على مدار 20 ساعة. تضمن التحضير شريحة دماغية مع كرويات مختلطة الخلايا مزروعة من خلايا U-118 / L1LE / mCherry الحمراء وخلايا GSC16-4 / GFP الخضراء. تم التقاط صور متحدة البؤر أثناء زراعة شريحة الدماغ على إدخال غشائي في طبق زراعة خلايا بلاستيكية مكون من 6 آبار باستخدام عدسة موضوعية ELWD 20x (0.45 NA) ، والتي وفرت مسافة العمل الإضافية المطلوبة. تم إنشاء عرض وحدة التخزين باستخدام برنامج المجهر متحد البؤر "Alpha Blending" ، والذي يعطي تأثير 3D واضح. تظهر مقاييس الميكرون على طول حواف تجسيد وحدة التخزين. من الأفضل ملاحظة الفيديو عن طريق سحب شريط تمرير تقدم الفيديو يدويا في مشغل الفيديو ذهابا وإيابا لمراقبة حركة الخلية بدلا من السماح لمشغل الفيديو بالمتابعة بسرعته البطيئة العادية. الرجاء الضغط هنا لتنزيل هذا الفيديو.
Discussion
تتضمن الخطوات الحاسمة في بروتوكول حقن الخلايا في بطين الدماغ المتوسط (الصمام البصري) عدم إتلاف الأوعية الدموية في الغشاء المشيمي النخاعي في البويضة أو المحيطة بالجنين قبل الحقن وأثناءه ، على الرغم من أن الغشاء السلوي المحيط بالجنين مباشرة يمكن سحبه برفق وتثبيته لوضع الرأس عند حقن الخلايا في الدماغ المتوسط. السلى صلب نسبيا ويمكن سحبه بالملقط الدقيق لوضع الرأس وتثبيته بيد واحدة ، لحقن الخلايا باليد الأخرى في القفص البصري ، وهو الهيكل الكبير المستدير في منتصف الدماغ. بشكل عام ، تتراوح صلاحية الأجنة المحقونة من 25٪ إلى 75٪ ، اعتمادا على عوامل غير معروفة ، وعمليا كل جنين يبقى على قيد الحياة يحتوي على ورم صغير على الأقل في القفص البصري. تشمل الخطوات الحاسمة في توليد شرائح دماغية قابلة للحياة تنشيف أنسجة السائل الزائد بحيث يلتصق الأغاروز بالدماغ أثناء التقطيع وللحفاظ على برودة الأنسجة والشرائح حتى توضع على الغشاء الملحق. نظرا لأن أنواع الخلايا المختلفة تشكل كرويات بشكل مختلف (في السرعة والحجم) ، يجب تحسين كثافة الخلايا المطلية على ألواح poly-HEMA وطول الوقت قبل حصاد الكائنات الكروية لكل نوع من الخلايا.
لم يخضع العمل هنا لدراسة طولية رسمية لصلاحية شريحة الدماغ. استخدم Yang et al. ثقافات شريحة دماغ جنين الفرخ مماثلة لتلك المستخدمة هنا وأظهر صلاحية جيدة للشرائح لمدة 7 أيامعلى الأقل 16. أظهر العمل السابق أنه عندما تم الاحتفاظ بأنسجة OT في وسائط دون المستوى الأمثل ، ظهرت العديد من نوى pyknotic في الأنسجة ، والتي لم تحدث في الشرائح في العمل هنا. بالإضافة إلى ذلك ، عندما تتدهور الشرائح في ظروف دون المستوى الأمثل ، تتفتت الأوعية الدموية وتظهر كصفوف من المجالات الإيجابية لللامينين (غير معروضة). وبالتالي ، على الرغم من أن الجدوى هنا لم يتم التحقق منها بطرق مثل الفيزيولوجيا الكهربية أو تعبير caspase-3 النشط ، لم يظهر هنا أي من مؤشرات موت الخلايا التي شوهدت في ظل ظروف ثقافة دون المستوى الأمثل.
تم التركيز على OT لتجارب أورام المخ في الجسم الحي لأنها المنطقة الأكثر سهولة في الحقن مع أكبر بطين. في E5 ، وهو آخر يوم يكون فيه الجنين صغيرا بما يكفي ليظل متاحا فوق صفار البيض ، يجب إجراء الحقن في البطين ، لأن جميع مناطق الدماغ ليست أكثر من منطقة بطين رقيقة. ومع ذلك ، فإن هذه الحقن تؤدي بنجاح إلى أورام مدمجة مع خلايا تغزو حمة الدماغ. في بعض الأحيان ، توجد الأورام الناتجة في الدماغ الأمامي أو المخيخ ، لكن هذا ليس شائعا. تم استخدام شرائح خارج الجسم الحي من القفص البصري E15 بشكل أساسي للتجارب هنا ، بحيث يمكن ربط نتائج الزراعة المشتركة خارج الجسم الحي بتجارب الحقن في الجسم الحي. ومع ذلك ، فإن شرائح الدماغ الأمامي مناسبة أيضا ولها مساحة سطح أكبر وبطين رقيق جدا مقارنة بالقفص البصري ، مما قد يجعل الدماغ الأمامي أكثر ملاءمة للمزارع المشتركة خارج الجسم الحي التي لا ترتبط بالحقن في الجسم الحي.
لقد ثبت هنا أن الحقن في الجسم الحي ، متبوعا بتثبيت الأنسجة ، وتقسيم تقطيع الأنسجة الاهتزازي ، والتلطيخ المناعي للامينين والعلامات الأخرى ، أدى إلى صور عالية الدقة لخلايا GBM و GSCs في أنسجة المخ على مقربة من الأوعية الدموية. تم تسهيل القدرة على تحديد العلاقات المتبادلة بين الخلايا السرطانية والأوعية الدموية إلى حد كبير من خلال إنشاء عروض حجم 3D من مداخن z من المقاطع البصرية متحدة البؤر باستخدام برنامج متحد البؤر وتعليمات الشركة المصنعة. كان التصوير بفاصل زمني باستخدام الفحص المجهري الفلوري واسع المجال للخلايا المصنفة GFP و mCherry و DiD ممكنا. ومع ذلك ، فإن الخلايا المهاجرة التي كانت على مقربة من الأجسام الكروية شديدة الفلورسنت كانت محجوبة في بعض الأحيان بسبب "التوهج" من الكروية. يمكن تقليل هذا التأثير غير المرغوب فيه إلى حد ما عن طريق ضبط أوقات التعرض بعناية لجمع صور واسعة النطاق. أدى التصوير بفاصل زمني باستخدام مكدسات Z متحدة البؤر بمرور الوقت (4D) إلى القضاء على التوهج خارج التركيز البؤري من الأجسام الكروية وأدى إلى خلايا مهاجرة محددة بدقة ذات خلفية داكنة. لم يتم وصف ذلك في البروتوكول ، ولكن تم تنفيذه بشكل مشابه لتصوير الفاصل الزمني واسع المجال ، والذي تم إجراؤه أثناء وجود شرائح الدماغ على إدخالات الغشاء الشفاف في لوحة بلاستيكية ذات 6 آبار. على الرغم من أن التصوير الفاصل الزمني متحد البؤر ينتج عنه صور أكثر وضوحا بشكل ملحوظ للخلايا الفردية وسلوكها ، فإن تجربة الفاصل الزمني متعددة النقاط التي تجمع مداخن z من 10 طائرات z / نقطة ، على فترات 10 دقائق على مدار 20 ساعة ، هي استخدام مكثف لجلفانومتر رأس المسح. وبما أن هذا يمكن أن يقلل بشكل كبير من عمر الجلفانومتر، فإن هذه الطريقة تستخدم بحكمة.
على الرغم من أن نظام جنين الفرخ مناسب جدا لكل من الحقن في الجسم الحي وتجارب الزراعة المشتركة خارج الجسم الحي التي تبحث في سلوك خلية GBM ، إلا أن هناك العديد من القيود على هذا النظام النموذجي. كما هو الحال مع أي نظام طعم أجنبي ، فإن البيئة التي تزرع فيها الخلايا البشرية ليست الدماغ البشري ، ولكن يبدو أن سلوك خلية GBM يحاكي ذلك في نماذج القوارض وفي المرضى من البشر. بعد إجراء تجارب الحقن في الجسم الحي على E5 ، يسمح عادة للأورام بالتشكل لمدة 10 أيام ، حتى E15. من الواضح أن هذا ليس وقتا كافيا لدراسة جميع جوانب تكوين الورم وغزو الخلايا. ومع ذلك ، فقد ثبت هنا أن الأورام الصلبة تتشكل في حمة الدماغ ، وتتفاعل الخلايا وتعيد ترتيب نفسها داخل الورم ، ويحدث غزو دماغي كبير على طول الأوعية الدموية ومنتشر خلال هذه الفترة الزمنية القصيرة نسبيا. هناك قيد آخر على نظام جنين الفرخ في الجسم الحي وهو أنه غير مناسب للأدوية أو العلاجات الأخرى بسبب الصفار الكبير والدورة الدموية خارج الجنين التي تعمل أثناء نمو جنين الفرخ. قد تؤدي العلاجات الدوائية السائلة الموضعية إلى تركيز متغير للغاية وغير معروف في الدماغ بسبب الانتشار بعيدا عن الجنين إلى كتلة صفار أكبر بكثير. وبالمثل ، فإن حقن الأدوية في الوريد في الجهاز الدوري خارج الجنين الدقيق للغاية من شأنه أن يتسرب أو ينتشر خارج الأوعية الدموية ويؤدي أيضا إلى تركيزات غير معروفة في الدماغ. هذا هو أحد الأسباب الرئيسية لاعتماد طريقة زراعة الشرائح خارج الجسم الحي - بحيث لا يمكن فقط ملاحظة سلوك الخلية وتتبعه عبر الفحص المجهري بفاصل زمني ، ولكن أيضا حتى يمكن اختبار العلاجات التي نجحت في تغيير سلوك خلية GBM في الطبق4 في بيئة أنسجة المخ الأكثر صلة.
ينظر إلى تطوير نظام نموذج ورم الدماغ التقويمي لجنين الفرخ على أنه إضافة مهمة للأنظمة والأدوات المتاحة لدراسة تكوين ورم GBM وسلوك الخلايا الغازية. من المحتمل أن يكون بيض الدجاج المخصب متاحا بسهولة في معظم المناطق ، فهو غير مكلف مقارنة بالقوارض ، ولا توجد تكاليف لرعاية الحيوانات ، والأجنة مرنة للغاية ومقاومة للعدوى (أي أن معظم العمل يتم على سطح الطاولة) ، والأجنة قابلة للتلاعب بدرجة كبيرة ويمكن زراعتها في ثقافة بدون قشرة19 ، ولا تعتبر أجنة الكتاكيت فقارية وبالتالي لا تتطلب موافقة IACUC من خلال إرشادات المعاهد الوطنية للصحة (المتطلبات المؤسسية قد تختلف). وبالتالي ، فإن هذه المزايا المتعددة تجعل نظام جنين الفرخ جذابا للغاية إذا حصر المرء أسئلته وتجاربه في تلك التي تقع ضمن حدوده. تم إجراء العديد من دراسات خلايا GBM من قبل الآخرين باستخدام جنين الفرخ ، ولكن هذه الدراسات استخدمت بشكل حصري تقريبا الغشاء المشيمي الألانتوي (CAM) للجنين 20،21،22،23،24،25،26،27،28،29 وبرعم الأطراف30، وليس الدماغ. كان هناك أيضا تقرير عن زرع الورم الأرومي النخاعي في دماغ الفرخ على E231. مما لا شك فيه أن استخدام جنين الفرخ كنظام نموذج xenograft لتقويم العظام ، كما هو موضح هنا ، يجب أن يسفر عن نتائج أكثر أهمية لبيولوجيا ورم GBM البشري من الدراسات التي تستخدم CAM.
على الرغم من أن هذه الدراسات قد بدأت فقط في الاستفادة الكاملة من نظام نموذج ورم دماغ جنين الفرخ لدراسات خلية GBM البشرية وسلوك GSC ، فمن المأمول أن يقوم الآخرون بتوسيع الاستخدامات وإيجاد المزيد من التطبيقات المحتملة. يمكن للمرء أن يتخيل أن هذا النظام لن يكشف فقط عن الآليات التي تنظم تكوين ورم GBM وسلوك الخلية ، ولكنه سيسمح أيضا بإجراء اختبار ما قبل السريري لعقاقير ومواد معينة على خلايا مرضى معينين. على سبيل المثال ، إذا تم إعداد مزارع شرائح الدماغ مسبقا ، فيمكن وضع الخلايا السرطانية أو القطع من عمليات استئصال الورم الجراحية أو عضويات GBM32 المشتقة من المريض مباشرة في الثقافة المشتركة خارج الجسم الحي ، ويمكن تقييم العلاجات المختلفة في غضون أيام. وبالمثل ، يمكن حقن خلايا المريض المنفصلة مباشرة في الدماغ المتوسط E5 في البويضات لتقييم قدرتها على تكوين الأورام وغزو حمة الدماغ. وبالتالي ، من المأمول أن تؤدي أوصاف الأساليب والنتائج التمثيلية هنا إلى تسهيل وتشجيع زيادة استخدام هذا النظام غير المستغل بشكل كبير لأبحاث سرطان الدماغ.
Disclosures
ليس لدى أي من المؤلفين أي تضارب في المصالح.
Acknowledgements
تم تمويل هذا العمل جزئيا من خلال منحة إلى D.S.G. من المعهد الوطني للسرطان (R03CA227312) ومنحة سخية من مؤسسة ليزا دين موسلي. تم الحصول على عينات GBM الحية بموافقة المريض من خلال مركز شراء الأنسجة التابع لمركز هيلين إف جراهام للسرطان ومعهد الأبحاث. تم توفير التمويل ل A.R. من قبل المركز الوطني لموارد البحوث والمركز الوطني لتطوير العلوم الانتقالية ، المعاهد الوطنية للصحة (UL1TR003107). تم تقديم زمالات بحثية صيفية للطلاب الجامعيين إلى NP و AL و ZW و KS من قبل برنامج الأبحاث الجامعية بجامعة ديلاوير.
Materials
| Name | Company | Catalog Number | Comments |
| 1 cm x 1 cm square hole paper punch | Birabira | N/A | |
| 1 mm biopsy punch pen | Robbins Instruments | 20335 | |
| 6 well insert plate (Corning Transwell) | Millipore Sigma | CLS3450 | |
| 9" Disposable Pasteur Pipets | Fisher Scientific | 13-678-20C | |
| 15 mL centrifuge tubes | Fisher Scientific | 05-539-12 | |
| 24 well plate | Corning Costar | 3526 | |
| 50 mL centrifuge tubes | Fisher Scientific | 05-539-9 | |
| Agar | Fisher BioReagents | BP1423-500 | for embedding fixed brains |
| Alexafluor 488-conjugated GAM IgG | Jackson Immunoresearch | 115-605-146 | |
| Alexafluor 647-conjugated GAM IgG | Jackson Immunoresearch | 115-545-146 | |
| Aluminum foil | ReynoldsWrap | N/A | |
| Ampicillin | Sigma Aldrich | A-9518 | |
| anti-integrin alpha-6 monoclonal antibody GOH3 | Santa Cruz Biotechnology | sc-19622 | |
| anti-L1CAM monoclonal antibody UJ127 | Santa Cruz Biotechnology | sc-53386 | |
| anti-laminin monoclonal antibody | Developmental Studies Hybridoma Bank | 3H11 | |
| anti-nestin monoclonal antibody 10c2 | Santa Cruz Biotechnology | sc-23927 | |
| anti-Sox2 monoclonal antibody E-4 | Santa Cruz Biotechnology | sc-365823 | |
| B27 supplement without vitamin A | GIBCO | 17504-044 | |
| bisbenzimide (Hoechst 33258) | Sigma-Aldrich | B2883 | nuclear stain |
| Cell culture incubator | Forma | standard humidified CO2 incubator | |
| Centrifuge | Beckman Coulter | ||
| Confocal microscope | Nikon Instruments | C2si+ | With custom-made cell incubator chamber |
| Confocal microscope objective lenses | Nikon Instruments | Plan Apo lenses, except S Plan Fluor ELWD 20x 0.45 NA objective lens for confocal time-lapse imaging | |
| Confocal microscope software | Nikon Instruments | NIS Elements | Version 5.2 |
| Curved foreceps | World Precision Intruments | 504478 | |
| Curved scissors | Fine Science Tools | ||
| Curved spatula | Fisher Scientific | 14-375-20 | |
| Cyanoacrylate glue | Krazy Glue | KG-585 12R | |
| D-Glucose | Millipore Sigma | G8270 | |
| DiD far red fluorescent dye | Invitrogen | V22887 | Vybrant DiD |
| DMEM | Sigma Aldrich | D5671 | |
| DMEM/F12 | Sigma Aldrich | D8437 | |
| DMSO | Sigma Aldrich | D4540 | |
| Dulbecco's Phosphate buffered saline (PBS) | Sigma Aldrich | P5493-1L | |
| egg incubator | Humidaire | ||
| electrical tape (10 mil thick/254 µm) | Scotch | N/A | |
| Ethanol 200 proof | Decon Laboratories | 2701 | |
| Fast green FCF dye | Avocado Research Chemicals | 16520 | |
| FBS | Gemini Bio-products | 900-108 | |
| filter paper | Fisher Scientific | ||
| Gauze | Dynarex | 3353 | |
| Glass Capillaries for microinjection | World Precision Instruments | TW100-4 | |
| Glycerol | Fisher BioReagents | BP228-1 | for mounting media |
| GSCs (human glioblastoma stem cells) | Not applicable | Isolated from patient GBM specimens in Galileo laboratory in GSC media and then transduced with a GFP encoding lentiviral vector. Cells used were between passage 10 and 30. | |
| Hanks Balanced Salt Solution (HBSS) | Corning | 21-020-CV | |
| Hemacytometer | Hausser scientific | ||
| Heparin | Fisher Scientific | BP2524-100 | |
| HEPES buffer | Sigma Aldrich | H0887 | |
| Horse Serum (HI) | Gibco | 26050-088 | |
| Human FGF-2 | BioVision | 4037-1000 | |
| Human TGF-α | BioVision | 4339-1000 | |
| Inverted phase contrast microscope | Nikon Instruments | TMS | for routine viewing of cultured cells |
| KCl | Fisher Scientific | BP366 | |
| KH2PO4 | Fisher Scientific | P284 | |
| Laboratory film | Parafilm | ||
| Labquake Shaker | LabIndustries | T400-110 | |
| L-Glut:Pen:Strep | Gemini Bio-products | 400-110 | |
| Low-melt agarose | Fisher Scientific | BP1360 | for embedding live brains |
| Matrix | Corning Matrigel | 354234 | |
| Medium 199 | GIBCO | 11150-059 | |
| MEM | Corning | 10-010-CV | |
| Metal vibratome block | |||
| Micropipette tips (20, 200, 1,000 µL) | Fisherbrand | ||
| Micropipettors (20, 200, 1,000 µL) | Gilson | ||
| Microscope Coverglass (no. 1.5 thickness) | Fisherbrand | 12544A | |
| NaCl | Fisher Scientific | S271 | |
| NaH2PO4 + H2O | Fisher Scientific | S369 | |
| NaHCO3 | Fisher Scientific | BP328 | |
| Normal goat serum | Millipore Sigma | 526-M | |
| N-propyl gallate | Sigma Aldrich | P3130 | for mounting media |
| Parafilm | Parafilm | ||
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| PBS | Sigma Aldrich | P5493-1L | |
| Pencil | |||
| Plain Microscope slides | Fisherbrand | 12-550-A3 | |
| Plastic 35 mm Petri dish | Becton Dickinson | 351008 | |
| pneumatic picopump | World Precision Intruments | PV830 | |
| Poly(2-hydroxyethyl methacrylate) (poly-HEMA) | Sigma Aldrich | P-3932 | |
| razor blade- double edge | PACE | for cutting fixed brain slices | |
| sapphire knife | Delaware Diamond Knives | for cutting live brain slices | |
| Scalpel | TruMed | 1001 | |
| Sodium cacodylate buffer 0.2 M pH 7.4 | Electron Microscopy Sciences | 11652 | |
| Specimen chamber for vibratome | custom-made | ||
| Stereo Dissecting Microscope | Nikon Instruments | SMZ1500 | Equipped with epifluorescence |
| straight foreceps | World Precision Intruments | 500233 | |
| straight scissors | Fine Science Tools | ||
| Sucrose | Mallinckrodt | 7723 | |
| Time-lapse fluorescence microscope (widefield fluorescence) | Nikon Instruments | TE2000-E | With custom-made cell incubator chamber (see Fotos et al., 2006) |
| Tissue culture dish polystyrene 100 mm | Thermo Fisher Scientific | 130182 | for cell culturing |
| Tissue culture dish polystyrene 60 mm | Becton Dickinson | 353004 | for cell culturing |
| Transfer pipette | American Central Scientific Co. | FFP011 | |
| Transparent tape | Scotch | ||
| Triton X-100 | Sigma Aldrich | T-8787 | |
| Trypsin (0.25%) + 2.21 mM EDTA | Corning | 25-053-CI | |
| U-118 MG human GBM cell line | ATCC | HTB-15 | Cells were transduced with a lentiviral vector encoding the entire ectodomain sequence of the L1CAM adhesion protein and then with lentiviral vector pUltra-hot encoding mCherry. Passage numbers are unknown. |
| Vacuum pump | Cole-Parmer | EW-07532-40 | "Air Cadet" |
| Vibrating tissue slicer | Vibratome | 3000 | for cutting live and fixed brain slices |
References
- Cretu, A., Fotos, J. S., Little, B. W., Galileo, D. S. Human and rat glioma growth, invasion, and vascularization in a novel chick embryo brain tumor model. Clinical & Experimental Metastasis. 22 (3), 225-236 (2005).
- Yang, M., et al. L1 stimulation of human glioma cell motility correlates with FAK activation. Journal of Neuro-Oncology. 105 (1), 27-44 (2011).
- Mohanan, V., Temburni, M. K., Kappes, J. C., Galileo, D. S. L1CAM stimulates glioma cell motility and proliferation through the fibroblast growth factor receptor. Clinical & Experimental Metastasis. 30 (4), 507-520 (2013).
- Anderson, H. J., Galileo, D. S. Small-molecule inhibitors of FGFR, integrins and FAK selectively decrease L1CAM-stimulated glioblastoma cell motility and proliferation. Cellular Oncology. 39 (3), 229-242 (2016).
- Pace, K. R., Dutt, R., Galileo, D. S. Exosomal L1CAM stimulates glioblastoma cell motility, proliferation, and invasiveness. International Journal of Molecular Sciences. 20 (16), 3982 (2019).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. Journal of Neuroscience Methods. 37 (2), 173-182 (1991).
- Ohnishi, T., Matsumura, H., Izumoto, S., Hiraga, S., Hayakawa, T. A novel model of glioma cell invasion using organotypic brain slice culture. Cancer Research. 58 (14), 2935-2940 (1998).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Aaberg-Jessen, C., et al. Invasion of primary glioma- and cell line-derived spheroids implanted into corticostriatal slice cultures. International Journal of Clinical and Experimental Pathology. 6 (4), 546-560 (2013).
- Matsumura, H., Ohnishi, T., Kanemura, Y., Maruno, M., Yoshimine, T. Quantitative analysis of glioma cell invasion by confocal laser scanning microscopy in a novel brain slice model. Biochemical and Biophysical Research Communications. 269 (2), 513-520 (2000).
- Ren, B., et al. Invasion and anti-invasion research of glioma cells in an improved model of organotypic brain slice culture. Tumori. 101 (4), 390-397 (2015).
- Fayzullin, A., et al. Time-lapse phenotyping of invasive glioma cells ex vivo reveals subtype-specific movement patterns guided by tumor core signaling. Experimental Cell Research. 349 (2), 199-213 (2016).
- Jensen, S. S., et al. Establishment and characterization of a tumor stem cell-based glioblastoma invasion model. PloS One. 11 (7), e0158746 (2016).
- Marques-Torrejon, M. A., Gangoso, E., Pollard, S. M. Modelling glioblastoma tumour-host cell interactions using adult brain organotypic slice co-culture. Disease Models & Mechanisms. 11 (2), 031435 (2018).
- Tamura, R., et al. Visualization of spatiotemporal dynamics of human glioma stem cell invasion. Molecular Brain. 12 (1), 45 (2019).
- Yang, C., et al. Organotypic slice culture based on in ovo electroporation for chicken embryonic central nervous system. Journal of Cellular and Molecular Medicine. 23 (3), 1813-1826 (2019).
- Murrell, W., et al. Expansion of multipotent stem cells from the adult human brain. PloS One. 8 (8), e71334 (2013).
- Fotos, J. S., et al. Automated time-lapse microscopy and high-resolution tracking of cell migration. Cytotechnology. 51 (1), 7-19 (2006).
- Tufan, A. C., Akdogan, I., Adiguzel, E. Shell-less culture of the chick embryo as a model system in the study of developmental neurobiology. Neuroanatomy. 3 (1), 8-11 (2004).
- Shoin, K., et al. Chick embryo assay as chemosensitivity test for malignant glioma. Japanese Journal of Cancer Research. 82 (10), 1165-1170 (1991).
- Hagedorn, M., et al. Accessing key steps of human tumor progression in vivo by using an avian embryo model. Proceedings of the National Academy of Sciences. 102 (5), 1643-1648 (2005).
- Balciūniene, N., et al. Histology of human glioblastoma transplanted on chicken chorioallantoic membrane. Medicina. 45 (2), 123-131 (2009).
- De Magalhães, N., et al. Applications of a new In vivo tumor spheroid based shell-less chorioallantoic membrane 3-D model in bioengineering research. Journal of Biomedical Science and Engineering. 3 (1), 20-26 (2010).
- Szmidt, M., et al. Morphology of human glioblastoma model cultured in ovo. Journal of Veterinary Research. 56 (2), 261-266 (2012).
- Jaworski, S., et al. Comparison of tumor morphology and structure from U87 and U118 glioma cells cultured on chicken embryo chorioallantoic membrane. Journal of Veterinary Research. 57 (4), 593-598 (2013).
- Yuan, Y. J., Xu, K., Wu, W., Luo, Q., Yu, J. L. Application of the chick embryo chorioallantoic membrane in neurosurgery disease. International Journal of Medical Sciences. 11 (12), 1275-1281 (2014).
- Urbańska, K., et al. The effect of silver nanoparticles (AgNPs) on proliferation and apoptosis of in ovo cultured glioblastoma multiforme (GBM) cells. Nanoscale Research Letters. 10, 98 (2015).
- DeBord, L. C., et al. The chick chorioallantoic membrane (CAM) as a versatile patient-derived xenograft (PDX) platform for precision medicine and preclinical research. American Journal of Cancer Research. 8 (8), 1642-1660 (2018).
- Han, J. M., Jung, H. J. Synergistic anticancer effect of a combination of berbamine and arcyriaflavin A against glioblastoma stem-like cells. Molecules. 27 (22), 7968 (2022).
- Ruiz-Ontañon, P., et al. Cellular plasticity confers migratory and invasive advantages to a population of glioblastoma-initiating cells that infiltrate peritumoral tissue. Stem Cells. 31 (6), 1075-1085 (2013).
- Cage, T. A., et al. Distinct patterns of human medulloblastoma dissemination in the developing chick embryo nervous system. Clinical & Experimental Metastasis. 29 (4), 371-380 (2012).
- Darrigues, E., et al. Biobanked glioblastoma patient-derived organoids as a precision medicine model to study inhibition of invasion. International Journal of Molecular Sciences. 22 (19), 10720 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved