このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
末梢神経刺激と制御可能なパルスパラメータの組み合わせ 感覚運動の制御と学習をプローブするための経頭蓋磁気刺激
要約
短潜時求心性抑制(SAI)は、感覚運動の統合をプローブするための経頭蓋磁気刺激プロトコルです。この記事では、SAIを使用して、感覚運動行動中の運動野の収束感覚運動ループを研究する方法について説明します。
要約
熟練した運動能力は、感覚求心性を適切な運動コマンドに効率的に統合することに依存します。求心性抑制は、熟練した運動行動中の感覚運動統合に対する手続き的および宣言的影響を調査するための貴重なツールを提供します。この原稿では、感覚運動統合を理解するための短潜時求心性抑制(SAI)の方法論と貢献について説明しています。SAIは、経頭蓋磁気刺激(TMS)によって誘発される皮質脊髄運動出力に対する収束求心性ボレーの効果を定量化します。求心性ボレーは、末梢神経の電気刺激によって引き起こされます。TMS刺激は、その求心性神経が機能する筋肉で信頼性の高い運動誘発反応を引き出す一次運動野上の場所に送達されます。運動誘発反応の阻害の程度は、運動皮質に収束する求心性ボレーの大きさを反映しており、中枢GABA作動性およびコリン作動性の寄与を含む。SAIへのコリン作動性の関与により、SAIは感覚運動能力および学習における宣言的-手続き的相互作用の可能性のあるマーカーとなる。最近では、SAIのTMS電流方向を操作して、熟練した運動行動のための一次運動野の異なる感覚運動回路の機能的重要性を区別するための研究が開始されています。最先端の制御可能なパルスパラメータTMS(cTMS)を使用して追加のパルスパラメータ(パルス幅など)を制御する機能は、TMS刺激によってプローブされる感覚運動回路の選択性を高め、感覚運動制御と学習のより洗練されたモデルを作成する機会を提供しました。そこで本稿では,cTMSを用いたSAI評価に焦点を当てる.ただし、ここで概説した原則は、従来の固定パルス幅TMS刺激装置および長期潜時求心性阻害(LAI)などの他の形態の求心性阻害を使用して評価されたSAIにも適用されます。
概要
複数の感覚運動ループが運動皮質に収束し、脊髄運動ニューロンおよび介在ニューロンへの錐体路突起を形作る1。しかし、これらの感覚運動ループがどのように相互作用して皮質脊髄投射と運動行動を形成するかは未解決の問題のままです。短潜時求心性抑制(SAI)は、運動皮質出力における収束感覚運動ループの機能特性を調べるためのツールを提供します。SAIは、運動皮質経頭蓋磁気刺激(TMS)と対応する末梢求心性神経の電気刺激を組み合わせたものです。
TMSは、ヒトの脳内で錐体運動ニューロンをシナプス的に安全に刺激する非侵襲的な方法です2,3。TMSでは、頭皮に配置されたコイル状のワイヤーに大きな過渡電流を流します。電流の過渡的な性質は、急速に変化する磁場を作り出し、脳4に電流を誘導する。単一のTMS刺激の場合、誘導電流は、錐体運動ニューロン5〜7への一連の興奮性入力を活性化する。生成された興奮性入力の強度が十分である場合、下降活動は運動誘発電位(MEP)として知られる対側の筋肉反応を誘発します。MEPの潜時は、皮質運動伝導時間8を反映しています。MEPの振幅は、皮質脊髄ニューロン9の興奮性を指標化する。MEPを誘発する単一のTMS刺激は、コンディショニング刺激10、11、12によって先行することもできる。これらのペアパルスパラダイムは、皮質脊髄出力に対するさまざまな介在ニューロンプールの影響を指標化するために使用できます。SAIの場合、末梢電気調整刺激は、運動皮質興奮性に対する求心性ボレーの影響を調べるために使用される11、13、14、15。TMS刺激と末梢電気刺激の相対的なタイミングは、運動皮質に対するTMS刺激の作用を運動皮質への求心性投射の到着と一致させます。遠位上肢筋のSAIの場合、正中神経刺激は通常、TMS刺激に18〜24ミリ秒先行します11、13、15、16。同時に、SAIは、末梢刺激によって誘発される求心性ボレーの強度が増加するにつれて増加する13,17,18。
運動皮質への求心性投射の外因性特性との強い関連にもかかわらず、SAIは多くの運動制御プロセスに関与する可鍛性現象です。例えば、SAIは、差し迫った運動の前にタスク関連筋肉で減少するが、隣接するタスク無関係な運動表現19、20、22では維持される。タスク関連性に対する感度は、望ましくないエフェクター動員を減少させることを目的とする周囲阻害メカニズム23を反映すると仮定される。より最近では、タスク関連エフェクタにおけるSAIの減少は、予想される感覚求心性21を抑制し、感覚運動計画および実行中の修正を容易にするように設計された運動関連ゲーティング現象を反映し得ることが提案された24。特定の機能的役割に関係なく、SAIは手先の器用さおよび処理効率の低下と相関している25。SAIの変化は、高齢者26の転倒リスクの増加、パーキンソン病26、27、28および局所性手ジストニア29の感覚運動機能の低下にも関連しています。
臨床的および薬理学的証拠は、SAIを媒介する阻害経路が中枢コリン作動性調節に感受性であることを示している30。例えば、ムスカリン性アセチルコリン受容体アンタゴニストスコポラミンを投与すると、SAI31が減少する。対照的に、アセチルコリンエステラーゼ阻害剤を介してアセチルコリンの半減期を増加させると、SAI32,33が増強されます。薬理学的証拠と一致して、SAIは、覚醒34、報酬35、注意の割り当て21、36、37、および記憶38、39、40を含む、中枢コリン作動性の関与を伴ういくつかの認知プロセスに敏感である。SAIは、アルツハイマー病41,42,43,44,45,46,47、パーキンソン病(軽度認知障害)48,49,50、軽度認知障害47などのコリン作動性ニューロンの喪失に関連する認知障害を有する臨床集団においても変化します。51,52。さまざまなγアミノ酪酸A型(GABAA)受容体サブユニットタイプに対する異なる親和性を持つさまざまなベンゾジアゼピンによるSAIの差動調節は、SAI阻害経路が他の形態のペアパルス阻害を媒介する経路とは異なることを示唆しています30。例えば、ロラゼパムはSAIを減少させるが、短間隔皮質阻害(SICI)を増強する53。ゾルピデムはSAIを低下させますが、SICI53にはほとんど効果がありません。.ジアゼパムはSICIを増加させるが、SAI53にはほとんど影響を与えない。GABAA受容体機能のこれらの正のアロステリックモジュレーターによるSAIの減少は、GABAが脳幹および皮質54におけるアセチルコリンの放出を制御するという観察と相まって、GABAが感覚運動皮質に投射するコリン作動性経路を調節してSAI55に影響を与えるという仮説につながった。
最近、SAIは、手続き型運動制御プロセスを設定する感覚運動ループと、手続き型プロセスを明示的なトップダウン目標および認知制御プロセスに合わせる感覚運動ループとの間の相互作用を調査するために使用されています21,36,37,38。SAI31における中心的なコリン作動性の関与は、SAIが手続き的感覚運動制御および学習に対する実行的影響を指標化する可能性があることを示唆している。重要なことに、これらの研究は、異なるTMS電流方向を使用してSAIを評価することにより、特定の感覚運動回路に対する認知の固有の効果を特定し始めています。SAI研究は通常、後前(PA)誘導電流を採用していますが、前後(AP)誘導電流を採用しているSAI研究はほんの一握りです55。しかし、TMSを使用して、SAI評価中にPA電流と比較してAPを誘導することは、異なる感覚運動回路を動員する16、56。例えば、AP感受性であるがPA感受性ではない感覚運動回路は、小脳変調によって変化する37、56。さらに、AP感受性であるがPA感受性ではない感覚運動回路は、注意負荷36によって変調される。最後に、注意および小脳の影響は、同じAP感受性感覚運動回路に収束し、これらの回路における不適応変化をもたらす可能性がある37。
TMS技術の進歩は、シングルパルス、ペアパルス、および反復アプリケーションの間に使用されるTMS刺激の構成を操作するためのさらなる柔軟性を提供する57、58。制御可能なパルスパラメータTMS(cTMS)刺激器は現在、世界中で研究用に市販されており、これらはパルス幅および形状に対する柔軟な制御を提供する57。柔軟性の向上は、それぞれがTMS刺激の別々の位相を担当する2つの独立したコンデンサの放電時間を制御することから生じます。刺激の二相性または単相性の性質は、M比と呼ばれるパラメータである各コンデンサからの相対放電振幅によって支配されます。cTMSの研究では、パルス幅操作と異なる電流方向を組み合わせて、従来のTMS刺激装置で使用される固定パルス幅(70-82μs)59,60が、SAI56中に機能的に異なる感覚運動回路の組み合わせを動員する可能性が高いことを実証しました。したがって、cTMSは、感覚運動のパフォーマンスと学習におけるさまざまな収束感覚運動ループの機能的重要性をさらに解きほぐすためのエキサイティングなツールです。
この原稿は、感覚運動行動中の末梢電気刺激とcTMSを統合する感覚運動統合を研究するためのユニークなSAIアプローチを詳述しています。このアプローチは、進行中の感覚運動行動中の皮質脊髄出力を支配する運動皮質の選択された介在ニューロン集団に対する求心性投射の効果を評価することにより、典型的なSAIアプローチを改善します。比較的新しいものですが、cTMSは、典型的な集団と臨床集団における感覚運動統合を研究する上で明確な利点を提供します。さらに、現在のアプローチは、従来のTMS刺激装置での使用や、長期求心性促進(LAI)13 や短遅延求心性促進(SAF)15などの他の形態の求心性抑制および促進を定量化するために容易に適合させることができます。
プロトコル
以下のプロトコールは、種々の実験に適用することができる。提供された情報は、SAIを使用して、有効または無効の合図プローブに対する指の反応中の感覚運動統合を定量化する実験の詳細を示しています。このプロトコルでは、SAIはタスクなしで評価され、次に合図された感覚運動タスク中に同時に評価され、次にタスクなしで再度評価されます。cTMS刺激装置は、市販の任意の従来のTMS刺激装置で置き換えることができる。しかしながら、従来のTMS刺激装置のパルス幅は、特定のハードウェア59、60に応じて70〜82μsの間で固定されるであろう。この研究は、ウォータールー大学の研究倫理局によって承認されました。すべての参加者は書面によるインフォームドコンセントを提供した。
1. ハードウェア/ソフトウェア要件
注: 図1 は、末梢の電気刺激装置とTMS刺激装置をコンピューター制御の感覚運動タスクと統合するためのハードウェア要件の概略図を示しています。 図2A は、PA誘導電流とAP誘導電流に対するSAIのセットアップを示しています。図 2B は、合図された感覚運動課題の一連の事象およびSAI評価の相対的タイミングを示す。参加者に対するTMSコイルの向きを追跡するための定位誘導システムは、コイル位置および軌道61の変動に関連する生理学的応答における試行ごとの変動を減少させるために強く推奨される。
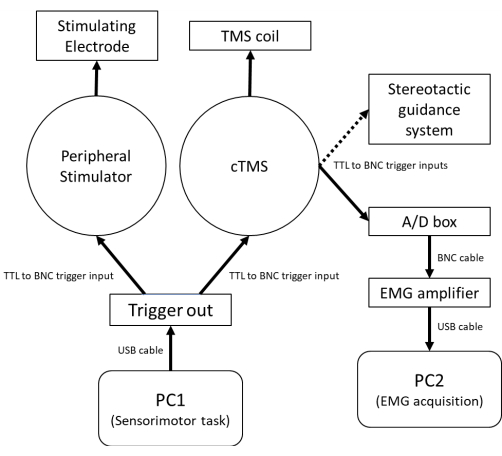
図1:安静時および同時感覚運動行動中のSAIを評価するために使用されるハードウェアの概略図。PC1は、感覚運動タスクとcTMS刺激/末梢電気刺激のタイミングを制御するために使用され、USBケーブルを介して5V TTL出力トリガを生成できるデジタル-アナログコンバータに接続されています。無条件試験の場合、デジタル入出力チャンネル1からのトリガはBNCケーブルを介してcTMS刺激装置に送られます。条件付き試験では、cTMS刺激装置に送られるデジタル入出力チャネル1からのトリガーの前に、デジタル入出力チャネル2から末梢電気刺激装置へのトリガーが続きます。cTMSユニットのトリガーアウトチャネルからのBNCケーブルがEMGシステムのアナログ-デジタルボードに送信され、PC2のEMG取得ソフトウェアによるEMGアンプの記録とデータの表示/保存がトリガーされます。cTMSトリガーアウトからのオプションのBNCケーブルも定位ガイダンスシステムに送られ、cTMS刺激時のコイル位置と軌道を記録します。略語:PC =パーソナルコンピュータ。USB =ユニバーサルシリアルバス。TTL =トランジスタ-トランジスタロジックトリガーケーブル;BNC = バヨネット ニール コンセルマン コネクタ;cTMS =制御可能なパルスパラメータ経頭蓋磁気刺激装置;TMS =経頭蓋磁気刺激;A / D =アナログ-デジタル;筋電図=筋電図検査。この図の拡大版を表示するには、ここをクリックしてください。
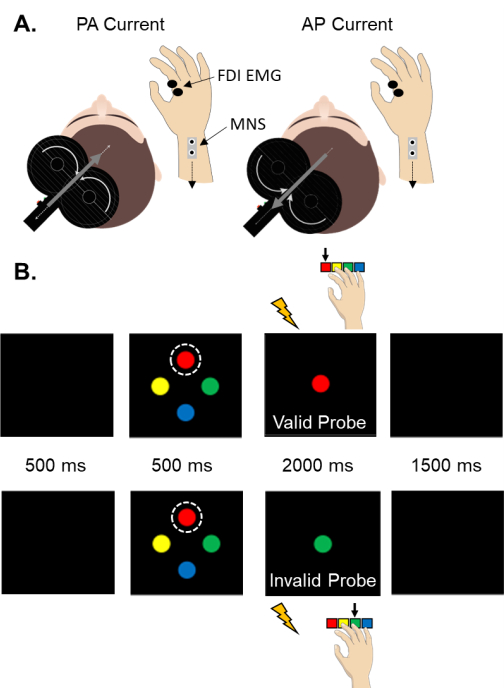
図2:SAIのセットアップと感覚運動タスク 。 (A)FDI筋肉におけるSAIの評価のためのセットアップの概略図。注目すべきことに、脳内の誘導電流はTMSコイル内の電流の方向と反対です。(B)有効な人差し指キュー(上)と無効な人差し指キュー(下)の裁判の描写。キューは常に一番上の刺激として描かれます(破線の円で強調表示されます)。キューの色は、特定の指の応答に対応します。参加者は、プローブの色にできるだけ迅速かつ正確に反応するように指示されました。キューとプローブは任意の色にすることができます。有効なキューの確率は70%でした。無効な手がかりは試験の30%で発生した。略語:SAI =短潜時求心性阻害;PA =後前部;AP =前後;FDI =最初の背側骨間;筋電図検査;MNS = 正中神経刺激。 この図の拡大版を表示するには、ここをクリックしてください。
- 1台のパーソナルコンピュータ(PC1)に、2つのデジタル出力チャンネルを備えたUSB(またはシリアルポート)デジタルアナログボード を介して 感覚運動タスクを制御するソフトウェアを装備します。
- 無条件のcTMS刺激と、刺激間間隔(ISI)が21ミリ秒の末梢電気刺激によって条件付けられるcTMS刺激の順序を制御するためのタスクなしのソフトウェアルーチンを設定します。任意の2つの刺激(例えば、条件付きまたは無条件)間の間隔を、5〜8秒の持続時間を有する矩形分布を用いてランダム化する。
- ルーチンが無条件刺激に対してcTMSユニットのポートにあるトリガに1つのデジタル出力トリガを送信することを確認します。ルーチンが、条件付き刺激のためにcTMSユニットと末梢電気刺激装置に別々のデジタル出力を送信することを確認してください。
- 末梢刺激装置へのトリガーがcTMSトリガーより21ミリ秒先行していることを確認してください。無条件刺激と条件付き刺激の数が8〜24であることを確認してください。理想的には、無条件試験と無条件試験の順序をランダム化する必要があります。
- 感覚運動タスクを制御するためのソフトウェアルーチンを設定します。このソフトウェアが、cTMSおよび周辺機器の電気刺激装置に送信されるデジタル出力トリガーを、動作中の特定のポイントにタイムロックすることを確認してください。
注:概説された実験では、合図された感覚運動課題を使用しました(図2B)。末梢刺激装置およびcTMS刺激装置へのトリガーは、矩形分布を用いて応答キュー開始後225〜275ミリ秒で発生するように計時した。このタイミングの目的は、応答キューと事前準備キューの妥当性に基づいて感覚運動統合の変化を評価することであり、これはすべての試験の70%で有効であった。 - 2台目のパーソナルコンピュータ(PC2)に、アナログ-デジタルコンバータに接続された2チャンネル筋電図(EMG)アンプを装備します。デジタル-アナログコンバーターに、EMGをTMS刺激にタイムロックするためのデジタル入力チャネルがあることを確認してください。PC2にEMGデータ収集ソフトウェアが装備されており、TMS誘発筋反応が記録されていることを確認します。
注意: PC1を使用して、感覚運動タスクを制御し、EMGを記録できます。ただし、研究者は、TMS刺激装置、末梢刺激装置、およびEMGシステムへのトリガーのタイミングを個別に検証する必要があります。1台のPCに複数のデバイスが接続されると、中央処理装置の競合の可能性が高まり、イベント・マーカーの相対的なタイミングが不安定になります。 - 次の設定でEMGデータ収集ソフトウェアをセットアップします:3つの記録チャンネル、2つのEMG、1つの入力トリガー、TTLトリガーの周りの-0.3秒から0.5秒のエポックで記録をトリガー、1,000倍のEMG増幅率、4,000Hzのサンプリングレート、3Hz〜1kHzのバンドパスフィルター、およびメインフィルター(オプション)。
メモ: 現在のプロトコルでは、エポックド記録方式が使用されています。EMG取得ソフトウェアは、EMG信号を継続的に監視します。ただし、TMS刺激にタイムロックされたエポックされたデータのみが表示され、記録されます。 - PC1からの1つのデジタル出力チャンネルをcTMS刺激装置のトリガ入力に接続します。PC1からの2番目のデジタル出力チャンネルを周辺機器の電気刺激装置のトリガ入力に接続します。PCのオペレーティングシステムを使用する場合は、PC1からの2つのデジタル出力の相対タイミングを個別に確認します。
- トリガー出力をEMGシステムのデジタル入力に接続します。定位誘導システムを用いる場合、誘導システムに出力されるトリガを分割して、cTMS刺激時のcTMSコイルの試行位置によって試行を記録することができるかもしれない。
2.参加者のスクリーニングとインフォームドコンセント
- TMS 9,62,63,64,65に対する禁忌について参加者をスクリーニングします。
- 研究の目的と手順について参加者に知らせます。機関の倫理審査委員会が承認した同意文書に概説されているリスクを確認します。潜在的なリスクに関する質問に答えます。研究手順を開始する前に、書面によるインフォームドコンセントを取得してください。
3.筋電図(EMG)電極の配置
- 参加者に、肘を椅子の腕に乗せて実験用の椅子に座り、手首/手が机のワークスペースに快適に置かれるように曲げるように指示します。必要に応じて、椅子と机のワークスペースの高さを調整します。
- 丸い綿パッドの上に置かれた穏やかな研磨クリームを使用して、最初の背側骨間(FDI)、外転筋ポリシスブレビス(APB)、および尺骨茎状突起の皮膚をきれいにします。アルコール準備パッドを使用して残留物を拭き取ります。
- 各筋肉について、使い捨てのAg-AgCl接着電極を1つずつ筋肉の腹の上に置きます。参照として、近くの骨のランドマークに2番目の電極を配置します。最後に、尺骨茎状突起に1つの追加のAg-AgCl接着電極を配置して、接地として機能します。
注:一般的なFDI参照部位は、手の橈骨側の第2近位指節骨の基部にある骨の隆起です。一般的なAPB参照部位は、親指の橈骨側の近位指節骨の骨の隆起です。 - 電極の各ペアとアースをEMGアンプとデータ収集システムに接続します。FDI にはチャネル 1 を使用し、APB にはチャネル 2 を使用します。
4.周辺電気刺激装置の電極配置
- 周辺刺激装置のデジタル出力トリガーをEMGシステムのトリガー入力チャネルに接続して、周辺刺激が配信されたときにEMG記録をトリガーします。
- 穏やかな研磨クリームを使用して、前腕の内側の皮膚をきれいにします。手首の屈曲のしわから始めて、近位~6 cmまで伸ばします。手首の正中線から前腕の橈骨側までの領域にクリーニングを拡張します。アルコール準備パッドを使用して残留物を拭き取ります。
- 再利用可能な刺激バー電極に導電性ゲルを塗布します。陽極と陰極の接点の金属ディスクを覆うのにちょうど十分なゲルを使用してください。刺激電極を手首の手のひら側の皮膚の上に置き、カソードをアノードに近位にします。カソードを放射状茎状突起のわずかに内側と近位に配置します。
- 過度のゲルを使用しないでください。ゲルがアノード端子とカソード端子の間にブリッジを作成する場合は、電極を洗浄してすべてのゲルを取り除き、再塗布します。アノードとカソードの間のゲルブリッジは、皮膚に沿ってかなりの電流をそらし、正中神経を刺激することを困難にします。
- 周辺刺激装置で、刺激タイプセレクターを単相に設定し、刺激持続時間を200μsに設定し、適切な電圧とアンペア数を選択して、乗算係数を再確認します。ここで使用したハードウェアの電圧(Vmax)は200Vに設定し、初期アンペア数は0.05 x 10 mAでした。
- 刺激電極を保持したまま、定電流刺激装置のトリガースイッチを押して単一の電気刺激を送ります。次に、APB筋肉とEMGディスプレイ(チャネル2)を視覚的に検査して、筋肉収縮の証拠を探します。M波として知られる筋肉収縮は、電気刺激による運動軸索の直接活性化によって誘発され、末梢電気刺激アーチファクトの6〜9ミリ秒後に発生するはずです。
- 筋肉収縮の証拠がない場合は、指または電極のすぐ下にチクチクする感覚が放射されているのを感じたかどうかを参加者に尋ねます。最適な位置は、現在の刺激強度で最も重要なAPB筋収縮を誘発する電極位置になります。
- 感覚が報告されない場合、または感覚が電極のすぐ下の皮膚に限定されている場合は、参加者が指/親指まで広がるチクチクする感覚を報告するまで、アンペア数を0.05刻み(10倍)で増やします。親指以外の数字で放射感覚が報告されている場合は、感覚が親指に放射されるまで電極を放射状に動かして電極の位置を変更します。
- 刺激電極の最適な位置が決まったら、3本のテープで電極を手首に固定します。最初のピースを電極の中央に配置し、2番目と3番目のピースを使用して電極の上部と下部を固定します。
注意: 経験に基づいて、最初にテープのバンドを電極の背面に固定してから、テープを電極の側面から皮膚まで流すことをお勧めします。このアプローチは、電極を固定し、実験中の横方向の動きの可能性を最小限に抑えるようです。 - 電極を固定した後、TMS刺激中に使用される望ましい手足の向きを想定するように参加者に依頼します。親指のけいれんがまだ誘発されていることを確認してください。
5.正中神経刺激強度の決定
- 0.2mVのM波が誘発されるまで末梢刺激強度のアンペア数を調整して末梢刺激閾値を決定する37,56。M波が3回の連続した刺激で目的の0.2mVの目標振幅を超える場合は、アンペア数を下げます。M波が後続の3つの刺激で目的の0.2mVターゲット振幅を下回っている場合は、アンペア数を増やします。しきい値は、M波が0.2mVを超える最初のアンペア数の値です。
注意: 一般的な代替手段は、強度を知覚感覚しきい値の3倍または運動しきい値11,16,17,66,67,68の1倍に設定することです。感覚閾値は、参加者が10の電気刺激のうち5つで感覚を正しく報告する刺激強度です。運動閾値は、10回の刺激のうち5回で目に見えるけいれんが誘発される刺激強度です。
6. 経頭蓋磁気刺激に最適なコイル軌道の決定
- テンプレート磁気共鳴画像(MRI)ファイルを使用して、参加者の位置とコイルの向きを監視するための新しい定位誘導システムプロジェクトファイルを作成します。次に、TMS刺激装置からのデジタル出力トリガーをEMGシステムのトリガー入力チャネルに接続して、TMS刺激が配信されたときにEMG記録をトリガーします。
注:利用可能な場合は、被験者固有のMRIを使用できます。ただし、MEPは、運動皮質刺激研究に最適なコイル位置を決定するのに十分です。 - ガイダンスシステムのコイルトラッキングツールをPA TMSコイルに取り付けます。コイルキャリブレーションツールを使用して、コイルトラッキングツールの向きをTMSコイルの中点にキャリブレーションします。PA コイルと同じジオメトリの AP コイルに対して 2 番目のコイル トラッキング ツールを使用して、この手順を繰り返します。
- 2つのEMG電極を使用して、ガイダンスシステムの被験者追跡ツールを参加者の額に貼り付けます。細い先端のドライイレースマーカーまたはアイライナーアプリケーターを使用して、鼻先の中央、鼻、および左右の耳介前くぼみにマーキングを配置します。ガイダンスシステムの被写体キャリブレーションツールを使用して、各マーカーの位置に触れて記録します。
- 参加者の頭にコイルを置き、コイルの軌跡を記録して、初期コイル位置を設定します。コイルの中心面が頭皮に接していることを確認します。コイルの正中線を参加者の頭の中央矢状面に45°合わせます。
- 運動皮質ホットスポットの開始近似値を得るには、頂点から5 cm前方、頂点から5 cm外側の点を結ぶ接線を想像し、接線に沿って前点から約2 cmの位置に70 mmのコイルを配置します。
注:反対側の手の遠位筋の皮質運動ホットスポットを近似する別のアプローチは、実験者が左人差し指(参加者の左運動皮質を刺激する場合)を頭の頂点に置き、左手の親指を左耳の前耳介点に置くことです。人差し指中手指節関節の位置を使用して、コイルの中心を配置するおおよその位置を視覚化できます。
- 運動皮質ホットスポットの開始近似値を得るには、頂点から5 cm前方、頂点から5 cm外側の点を結ぶ接線を想像し、接線に沿って前点から約2 cmの位置に70 mmのコイルを配置します。
- cTMS刺激装置で、パルスタイプセレクターを単相陽性に設定して、下にある神経組織にPA電流を誘導します。次に、M比を0.2に設定し、刺激強度(パワーとも呼ばれます)を最大刺激装置出力の30%に設定します。最後に、パルス幅(正の位相幅とも呼ばれます)を120 μs(スタディで使用される最長のパルス幅)に設定します。
注:PA誘導電流を使用して決定されたコイル位置と軌道は、AP誘導電流16、36、37、38、56、69に使用されます。 - 参加者がFDI筋のわずかな収縮(最大自発的収縮の~5%-10%)を維持しながら、3〜5回のTMS刺激を提供します。運動誘発電位(MEP)が誘発されない場合は、刺激装置の強度を10%増加させ、3〜5回の追加のTMS刺激を提供します。
- 少なくとも0.2 mVのMEPがすべての刺激に一貫して引き出されるまで、または刺激装置の強度が最大刺激装置出力の60%〜70%に達するまで、前の手順を繰り返します。信頼できるMEPが引き出されない場合は、刺激パラメータを一定に保ち、TMS刺激装置を元の刺激部位の周り~2cmの直径の円を描くように動かします。元の円のどのポイントでも信頼できる MEP が引き出されない場合は、円の直径を 1 cm 増やします。
- 信頼性の高いMEPが引き出されたら、刺激パラメータを一定に保ち、TMS刺激装置を現在のコイル位置の北、東、南、西に2cm動かして、FDIモーターホットスポットを確認します。各位置70で3〜5個のTMS刺激を送達する。4つの象限のいずれかで一貫して大きなMEPが引き出された場合、新しいコイルの位置と軌道を記録します。新しいコイルの位置と軌道を皮質運動のホットスポットとして使用します。
7.経頭蓋磁気刺激の刺激強度の決定
- 無料で入手できるTMSモーターしきい値評価ツール(MTAT 2.1)71,72,73を起動して、1 mV(1 mVしきい値)16,67,74のMEPを引き出すために必要な刺激強度を決定します。推定方法を [事前情報なし] に設定し、[開始] をクリックします。
注:現在のプロトコルでは、1 mV16のTMS強度を使用しています。ただし、一部の研究では、強度を個人の安静時運動閾値の120%に設定することを好みます。AP 電流の場合、1 mV MEP が得られない場合があります。このような場合、最大MEPが少なくとも0.5mVであれば、AP刺激構成によって誘発される最大MEPを引き出す刺激器出力を決定します。 - 120 μsのパルス幅で使用可能な最大刺激装置出力を決定します。次に、変換チャートを使用して、刺激装置出力の範囲を0から100に再スケーリングし、刺激装置出力がMTAT 2.1ソフトウェアのスケールと一致するようにします。
注:現在の研究で使用されているモデルでは、パルス幅120μsの最大刺激装置出力は50%です。したがって、MTAT 2.1ソフトウェアによって提供される値は2で除算され、刺激装置に設定された値を決定します。パルス幅が70μsの場合、最大刺激出力は66%であるため、MTAT 2.1ソフトウェアによって提供されるすべての値に0.66が乗算されます(最も近い0.5%に丸められます)。パルス幅が30μsの場合、最大刺激出力は100%です。したがって、スケーリング調整は必要ありません。 - TMS刺激装置強度をMTAT 2.1ソフトウェアによって示される最大刺激装置出力の初期パーセンテージに設定し、単一のTMS刺激を提供します。TMS刺激後の20〜50ミリ秒の時間範囲で記録されたMEPが1 mVを超える場合は、 Y キーを押して「はい」を示します。記録されたMEPが1mV未満の場合は、 N キーを押して「いいえ」を示します。MTATソフトウェアによって表示される刺激強度が黒から緑に変わるまで、この手順を繰り返します。
メモ: MTAT 2.1 ソフトウェアによって示される初期値は常に 37% です。パルス幅が120μsの場合、実際の刺激器値は18.5%です。パルス幅が70μsの場合、実際の刺激器値は24%です。パルス幅が30μsの場合、刺激器の値は37%です。 - 現在の方向と刺激持続時間の組み合わせごとに繰り返します。AP電流の場合は、コイルを物理的に回転させてPA電流を180°誘導して電流方向を180°回転させるか、AP電流を誘導するために製造されたカスタムコイルを使用します。
注:複数のTMS電流方向とパルス幅を使用する場合、すべてのしきい値は、データ収集の前、またはプロトコルで電流方向とパルス幅の特定の組み合わせを使用する直前に決定される場合があります。
8.短遅延求心性抑制(タスクベースラインなし)
- 脳内のPA電流を誘導するコイルをcTMS刺激装置に取り付けます。パルスタイプを単相-陽性に設定し、M比を0.2に設定します。パルス幅を120μsに設定します。最後に、刺激強度をステップ7で決定した1mVの閾値に設定します。
注:PAとAPの両方の電流方向を使用する場合は、ステップ8が実行される順序を参加者間でランダム化する必要があります。複数のパルス幅を使用する場合は、ステップ8を実行する順序を参加者間で相殺する必要があります。PA120 およびAP30 は、記載された実験において採用された唯一の現在の構成であった。 - 末梢電気刺激強度をステップ5で求めた強度に設定する。次に、PC1 でタスクなしのソフトウェア ルーチンを起動します。次に、末梢電気刺激とTMS刺激の間の刺激間間隔を21msに設定します。
- TMSコイルを、手順6で決定したFDIモーターホットスポットの上に配置します。参加者にFDI筋のわずかな収縮(最大自発的収縮の~5%-10%)を保持するように依頼します。次に、PC1でノータスクソフトウェアを実行して、ペリフェラル刺激装置とcTMS刺激装置の両方をトリガーします。
- 脳に AP 電流を誘導するコイルを使用して、AP30 電流設定の手順を繰り返します。
注: 時間が許せば、実験の最後にタスクなしのベースラインを繰り返すことをお勧めします。SAIベースラインを提供し、グループ間の既存の違いを確立するために、タスクなしの前後のSAI評価を強くお勧めします(該当する場合)。
9.短潜時求心性抑制(感覚運動課題)
- PAコイルをcTMS刺激装置に取り付けます。パルスタイプを単相-陽性に設定し、M比を0.2に設定します。パルス幅を120μsに設定します。最後に、刺激強度をステップ7で決定した1mVの閾値に設定します。
注:複数のTMS電流構成(PA120、AP30など)を使用する場合、感覚運動タスク中に採用される現在の構成は、参加者間で相殺する必要があります。タスクなしのベースライン評価の順序を決定するために使用したのと同じカウンターバランシングを使用することをお勧めします。 - 末梢電気刺激強度をステップ5で求めた強度に設定する。次に、PC1で感覚運動タスクソフトウェアルーチンを起動します。末梢電気刺激とTMS刺激の間の刺激間間隔を21ミリ秒に設定します。
- TMSコイルを、手順6で決定したFDIモーターホットスポットの上に配置します。参加者にFDI筋のわずかな収縮(最大自発的収縮の~5%-10%)を保持するように依頼します。
- 感覚運動タスクソフトウェアルーチンを実行して感覚運動タスクを制御し、行動ロックされたデジタルトリガーを末梢およびcTMS刺激装置に送信します。無条件および条件付きの試行の望ましい回数を、条件ごとに8〜24刺激の間に保ちます。
- コイルを使用して AP30 電流設定の手順を繰り返し、脳に AP 電流を誘導します。
10. データ処理と分析
- EMGデータをオフラインで視覚的に検査し、刺激前EMGの二乗平均平方根(刺激開始までの-50)が基準振幅を超える痕跡を破棄します。各試行の二乗平均平方根誤差は、次のように計算します。
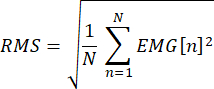
ここで、 N は-50から刺激開始までのデータポイントの数であり、EMGはポイント nの電圧です。安静時の筋肉で実施されるSAIの場合、10〜15μVの基準振幅を使用します。わずかな緊張性収縮で評価されたSAIについては、研究中に収縮レベルが監視されたと仮定して、すべての試験の平均RMSEに2つの標準偏差を加えた基準振幅を使用します。 - 各試行について、FDIのピークツーピークMEP振幅を、チャネル1 70のTMS刺激アーチファクト後20ミリ秒から50ミリ秒の間の時間枠における最小値と最大値の差として計算します。
- 条件付け試験では、APBのピークtoピークM波振幅を、チャンネル2の末梢刺激アーチファクトの5 msから15 ms後のピークtoピーク振幅として計算します。
注:ピークtoピークM波振幅の計算は、実験全体を通して刺激強度が条件全体で変化しなかったことを確認する方法です。 - TMS電流方向、パルス幅、および動作条件の組み合わせごとに、無条件および条件付き試行の平均MEP振幅と条件付き試行の平均M波を計算します。
- 以下の式を使用して、各参加者の条件付きMEP振幅を無条件MEP振幅の比率として表します。
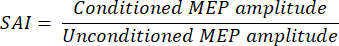
注:比率が低いほど、より強力な阻害を反映しています。.比率に 100% を掛けることは、条件付き MEP 振幅を無条件 MEP 振幅のパーセンテージとして表すのが一般的です。 - TMSの現在の方向、パルス幅、および行動条件の組み合わせごとに、すべての参加者の平均を計算します。これらの値を報告してください。平均値は通常報告されますが、可能な場合は個々のデータを数値で示します。
結果
図3 は、PA120-およびAP30-(下付き文字はパルス幅を示す)誘導電流を使用して、感覚運動タスク中にFDI筋に誘発された単一の参加者からの無条件および条件付きMEPの例を示しています。中央の列の棒グラフは、無条件試験と無条件試験の生の平均ピークtoピークMEP振幅を示しています。右側の棒グラフは、同じ参加者のPA120およびAP30誘発電流...
ディスカッション
ここで説明するSAI法は、感覚運動のパフォーマンスと学習に役割を果たす神経経路のサブセットを調査します。参加者が制御された感覚運動タスクを実行している間にSAIを評価することは、健康な集団と臨床集団の運動出力を形成するために運動皮質脊髄ニューロンに収束する多数の感覚運動ループの複雑な寄与を解きほぐすために重要です。例えば、同様の方法論は、手続き型運動制御プ?...
開示事項
著者は開示するものは何もありません。
謝辞
著者らは、自然科学工学研究評議会(NSERC)、カナダイノベーション財団(CFI)、およびS.K.M.に授与されたオンタリオ研究基金(ORF)からの資金提供を認めています。
資料
| Name | Company | Catalog Number | Comments |
| Acquisition software (for EMG) | AD Instruments, Colorado Springs, CO, USA | PL3504/P | LabChart Pro version 8 |
| Alcohol prep pads | Medline Canada Corporation, Mississauga, ON, Canada | 211-MM-05507 | Alliance Sterile Medium, Antiseptic Isopropyl Alcohol Pad (200 per box) |
| Amplifier (for EMG) | AD Instruments, Colorado Springs, CO, USA | FE234 | Quad Bio Amp |
| Cotton round | Cliganic, San Francisco, CA, USA | CL-BE-019-6PK | Premium Cotton Rounds (6-pack, 90 per package) |
| cTMS coils | Rogue Research, Montréal, QC, Canada | COIL70F80301 | 70 mm Medium Inductance Figure-8 coil |
| cTMS coils | Rogue Research, Montréal, QC, Canada | COIL70F80301-IC | 70 mm Medium Inductance Figure-8 coil (Inverted Current) |
| cTMS stimulator | Rogue Research, Montréal, QC, Canada | CTMSMU0101 | Elevate cTMS stimulator |
| Data acquisition board (for EMG) | AD Instruments, Colorado Springs, CO, USA | PL3504 | PowerLab 4/35 |
| Digital to analog board | National Instruments, Austin, TX, USA | 782251-01 | NI USB-6341, X Series DAQ Device with BNC Termination |
| Dispoable adhesive electrodes (for EMG) | Covidien, Dublin, Ireland | 31112496 | Kendal 130 Foam Electrodes |
| Electrogel | Electrodestore.com | E9 | Electro-Gel for Electro-Cap (16 oz jar) |
| Nuprep | Weaver and Company, Aurora, CO, USA | 10-30 | Nuprep skin prep gel (3-pack of 4 oz tubes) |
| Peripheral electrical stimulator | Digitimer, Hertfordshire, UK | DS7R | DS7R High Voltage Constant Current Stimulator |
| Reusable bar electrode | Electrodestore.com | DDA-30 | Black Bar Electrode, Flat, Cathode Distal |
| Software (for behaviour and stimulator triggering) | National Instruments, Austin, TX, USA | 784503-35 | Labview 2020 |
| TMS stereotactic coil guidance system | Rogue Research, Montréal, QC, Canada | KITBSF0404 | BrainSight Neuronavigation System |
| Transpore tape | 3M, Saint Paul, MN, USA | 50707387794571 | Transpore Medical Tape (1 in x 10 yds) |
参考文献
- Bizzi, E., Ajemian, R. From motor planning to execution: a sensorimotor loop perspective. Journal of Neurophysiology. 124 (6), 1815-1823 (2020).
- Chen, R. Studies of human motor physiology with transcranial magnetic stimulation. Muscle & Nerve Supplement. 9, S26-S32 (2000).
- Hallett, M. Transcranial magnetic stimulation: A primer. Neuron. 55 (2), 187-199 (2007).
- Hallett, M. Transcranial magnetic stimulation and the human brain. Nature. 406 (6792), 147-150 (2000).
- Day, B. L., et al. Electric and magnetic stimulation of human motor cortex - Surface EMG and single motor unit responses. Journal of Physiology. 412, 449-473 (1989).
- Di Lazzaro, V., et al. Comparison of descending volleys evoked by transcranial magnetic and electric stimulation in conscious humans. Electroencephalography and Clinical Neurophysiology/Electromyography and Motor Control. 109 (5), 397-401 (1998).
- Di Lazzaro, V., Rothwell, J. C. Corticospinal activity evoked and modulated by non-invasive stimulation of the intact human motor cortex. Journal of Physiology. 592 (19), 4115-4128 (2014).
- Chen, R., et al. The clinical diagnostic utility of transcranial magnetic stimulation: Report of an IFCN committee. Clinical Neurophysiology. 119 (3), 504-532 (2008).
- Rossini, P. M. Non-invasive electrical and magnetic stimulation of the brain, spinal cord, roots and peripheral nerves: Basic principles and procedures for routine clinical and research application. An updated report from an I.F.C.N. Committee. Clinical Neurophysiology. 126 (6), 1071-1107 (2015).
- Kujirai, T., et al. Corticocortical inhibition in human motor cortex. The Journal of Physiology. 471, 501-519 (1993).
- Tokimura, H., et al. Short latency inhibition of human hand motor cortex by somatosensory input from the hand. The Journal of Physiology. 523, 503-513 (2000).
- Nakamura, H., Kitagawa, H., Kawaguchi, Y., Tsuji, H. Intracortical facilitation and inhibition after transcranial magnetic stimulation in conscious humans. The Journal of Physiology. 498, 817-823 (1997).
- Chen, R., Corwell, B., Hallett, M. Modulation of motor cortex excitability by median nerve and digit stimulation. Experimental Brain Research. 129 (1), 77-86 (1999).
- Asmussen, M. J., Jacobs, M. F., Lee, K. G., Zapallow, C. M., Nelson, A. J. Short-latency afferent inhibition modulation during finger movement. PLoS One. 8 (4), e60496 (2013).
- Devanne, H. Afferent-induced facilitation of primary motor cortex excitability in the region controlling hand muscles in humans. European Journal of Neuroscience. 30 (3), 439-448 (2009).
- Ni, Z., et al. Transcranial magnetic stimulation in different current directions activates separate cortical circuits. Journal of Neurophysiology. 105 (2), 749-756 (2011).
- Bailey, A. Z., Asmussen, M. J., Nelson, A. J. Short-latency afferent inhibition determined by the sensory afferent volley. Journal of Neurophysiology. 116 (2), 637-644 (2016).
- Fischer, M., Orth, M. Short-latency sensory afferent inhibition: conditioning stimulus intensity, recording site, and effects of 1 Hz repetitive TMS. Brain Stimulation. 4 (4), 202-209 (2011).
- Voller, B., et al. Short-latency afferent inhibition during selective finger movement. Experimental Brain Research. 169 (2), 226-231 (2006).
- Asmussen, M. J., et al. Modulation of short-latency afferent inhibition depends on digit and task-relevance. PLoS One. 9 (8), e104807 (2014).
- Suzuki, L. Y., Meehan, S. K. Attention focus modulates afferent input to motor cortex during skilled action. Human Movement Science. 74, 102716 (2020).
- Bonassi, G., et al. Selective sensorimotor modulation operates during cognitive representation of movement. Neuroscience. 409, 16-25 (2019).
- Beck, S., Hallett, M. Surround inhibition in the motor system. Experimental Brain Research. 210 (2), 165-172 (2011).
- Seki, K., Fetz, E. E. Gating of sensory input at spinal and cortical levels during preparation and execution of voluntary movement. Journal of Neuroscience. 32 (3), 890-902 (2012).
- Young-Bernier, M., Davidson, P. S., Tremblay, F. Paired-pulse afferent modulation of TMS responses reveals a selective decrease in short latency afferent inhibition with age. Neurobiology of Aging. 33 (4), 1-11 (2012).
- Pelosin, E., et al. Attentional control of gait and falls: Is cholinergic dysfunction a common substrate in the elderly and Parkinson's disease. Frontiers in Aging Neuroscience. 8, 104 (2016).
- Dubbioso, R., Manganelli, F., Siebner, H. R., Di Lazzaro, V. Fast intracortical sensory-motor integration: A window into the pathophysiology of Parkinson's disease. Frontiers in Human Neuroscience. 13, 111 (2019).
- Oh, E., et al. Olfactory dysfunction in early Parkinson's disease is associated with short latency afferent inhibition reflecting central cholinergic dysfunction. Clinical Neurophysiology. 128 (6), 1061-1068 (2017).
- Richardson, S. P., et al. Changes in short afferent inhibition during phasic movement in focal dystonia. Muscle & Nerve. 37 (3), 358-363 (2008).
- Ziemann, U., et al. TMS and drugs revisited 2014. Clinical Neurophysiology. 126 (10), 1847-1868 (2015).
- Di Lazzaro, V. Muscarinic receptor blockade has differential effects on the excitability of intracortical circuits in the human motor cortex. Experimental Brain Research. 135 (4), 455-461 (2000).
- Di Lazzaro, V., et al. Neurophysiological predictors of long term response to AChE inhibitors in AD patients. Journal of Neurology, Neurosurgery and Psychiatry. 76 (8), 1064-1069 (2005).
- Fujiki, M., Hikawa, T., Abe, T., Ishii, K., Kobayashi, H. Reduced short latency afferent inhibition in diffuse axonal injury patients with memory impairment. Neuroscience Letters. 405 (3), 226-230 (2006).
- Koizume, Y., Hirano, M., Kubota, S., Tanaka, S., Funase, K. Relationship between the changes in M1 excitability after motor learning and arousal state as assessed by short-latency afferent inhibition. Behavioral Brain Research. 330, 56-62 (2017).
- Thabit, M. N., et al. Momentary reward induce changes in excitability of primary motor cortex. Clinical Neurophysiology. 122 (9), 1764-1770 (2011).
- Mirdamadi, J. L., Suzuki, L. Y., Meehan, S. K. Attention modulates specific motor cortical circuits recruited by transcranial magnetic stimulation. Neuroscience. 359, 151-158 (2017).
- Mirdamadi, J. L., Meehan, S. K. Specific sensorimotor interneuron circuits are sensitive to cerebellar-attention interactions. Frontiers in Human Neuroscience. 16, 920526 (2022).
- Suzuki, L. Y., Meehan, S. K. Verbal working memory modulates afferent circuits in motor cortex. European Journal of Neuroscience. 48 (10), 3117-3125 (2018).
- Mineo, L., et al. Modulation of sensorimotor circuits during retrieval of negative autobiographical memories: Exploring the impact of personality dimensions. Neuropsychologia. 110, 190-196 (2018).
- Bonnì, S., Ponzo, V., Di Lorenzo, F., Caltagirone, C., Koch, G. Real-time activation of central cholinergic circuits during recognition memory. European Journal of Neuroscience. 45 (11), 1485-1489 (2017).
- Nardone, R., et al. Abnormal short latency afferent inhibition in early Alzheimer's disease: A transcranial magnetic demonstration. Journal of Neural Transmission. 115 (11), 1557-1562 (2008).
- Nardone, R., Bratti, A., Tezzon, F. Motor cortex inhibitory circuits in dementia with Lewy bodies and in Alzheimer's disease. Journal of Neural Transmission. 113 (11), 1679-1684 (2006).
- Di Lazzaro, V., et al. In vivo cholinergic circuit evaluation in frontotemporal and Alzheimer dementias. Neurology. 66 (7), 1111-1113 (2006).
- Di Lazzaro, V., et al. Functional evaluation of cerebral cortex in dementia with Lewy bodies. NeuroImage. 37 (2), 422-429 (2007).
- Di Lazzaro, V., et al. In vivo functional evaluation of central cholinergic circuits in vascular dementia. Clinical Neurophysiology. 119 (11), 2494-2500 (2008).
- Marra, C., et al. Central cholinergic dysfunction measured "in vivo" correlates with different behavioral disorders in Alzheimer's disease and dementia with Lewy body. Brain Stimulation. 5 (4), 533-538 (2012).
- Mimura, Y., et al. Neurophysiological biomarkers using transcranial magnetic stimulation in Alzheimer's disease and mild cognitive impairment: A systematic review and meta-analysis. Neuroscience & Biobehavioral Reviews. 121, 47-59 (2021).
- Yarnall, A. J., et al. Short latency afferent inhibition: a biomarker for mild cognitive impairment in Parkinson's disease. Movement Disorders. 28 (9), 1285-1288 (2013).
- Celebi, O., Temuçin, C. M., Elibol, B., Saka, E. Short latency afferent inhibition in Parkinson's disease patients with dementia. Movement Disorders. 27 (8), 1052-1055 (2012).
- Martin-Rodriguez, J. F., Mir, P. Short-afferent inhibition and cognitive impairment in Parkinson's disease: A quantitative review and challenges. Neuroscience Letters. 719, 133679 (2020).
- Nardone, R., et al. Short latency afferent inhibition differs among the subtypes of mild cognitive impairment. Journal of Neural Transmission. 119 (4), 463-471 (2012).
- Tsutsumi, R., et al. Reduced interhemispheric inhibition in mild cognitive impairment. Experimental Brain Research. 218 (1), 21-26 (2012).
- Di Lazzaro, V., et al. Segregating two inhibitory circuits in human motor cortex at the level of GABAA receptor subtypes: A TMS study. Clinical Neurophysiology. 118 (10), 2207-2214 (2007).
- Giorgetti, M., et al. Local GABAergic modulation of acetylcholine release from the cortex of freely moving rats. European Journal of Neuroscience. 12 (6), 1941-1948 (2000).
- Turco, C. V., Toepp, S. L., Foglia, S. D., Dans, P. W., Nelson, A. J. Association of short- and long-latency afferent inhibition with human behavior. Clinical Neurophysiology. 132 (7), 1462-1480 (2021).
- Hannah, R., Rothwell, J. C. Pulse duration as well as current direction determines the specificity of transcranial magnetic stimulation of motor cortex during contraction. Brain Stimulation. 10 (1), 106-115 (2017).
- Peterchev, A. V., D'Ostilio, K., Rothwell, J. C., Murphy, D. L. Controllable pulse parameter transcranial magnetic stimulator with enhanced circuit topology and pulse shaping. Journal of Neural Engineering. 11 (5), 056023 (2014).
- Peterchev, A. V., Murphy, D. L., Lisanby, S. H. Repetitive transcranial magnetic stimulator with controllable pulse parameters (cTMS). Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2010, 2922-2926 (2010).
- Rothkegel, H., Sommer, M., Paulus, W., Lang, N. Impact of pulse duration in single pulse TMS. Clinical Neurophysiology. 121 (11), 1915-1921 (2010).
- MagPro Family User Guide. MagVenture A/S Available from: https://tsgdoc.socsci.ru.nl/images/a/ac/Magpro_family.pdf (2022)
- Bashir, S., Edwards, D., Pascual-Leone, A. Neuronavigation increases the physiologic and behavioral effects of low-frequency rTMS of primary motor cortex in healthy subjects. Brain Topography. 24 (1), 54-64 (2011).
- Rossi, S., Hallett, M., Rossini, P. M., Pascual-Leone, A. Screening questionnaire before TMS: An update. Clinical Neurophysiology. 122 (8), 1686 (2011).
- Keel, J. C., Smith, M. J., Wassermann, E. M. A safety screening questionnaire for transcranial magnetic stimulation. Clinical Neurophysiology. 112 (4), 720 (2001).
- Wassermann, E. M. Risk and safety of repetitive transcranial magnetic stimulation: report and suggested guidelines from the International Workshop on the Safety of Repetitive Transcranial Magnetic Stimulation, June 5-7, 1996. Electroencephalography and Clinical Neurophysiology. 108 (1), 1-16 (1998).
- Rossi, S., et al. Safety and recommendations for TMS use in healthy subjects and patient populations, with updates on training, ethical and regulatory issues: Expert guidelines. Clinical Neurophysiology. 132 (1), 269-306 (2021).
- Udupa, K., Ni, Z., Gunraj, C., Chen, R. Effects of short latency afferent inhibition on short interval intracortical inhibition. Journal of Neurophysiology. 111 (6), 1350-1361 (2013).
- Udupa, K., Ni, Z., Gunraj, C., Chen, R. Interactions between short latency afferent inhibition and long interval intracortical inhibition. Experimental Brain Research. 199 (2), 177-183 (2009).
- Turco, C. V., El-Sayes, J., Fassett, H. J., Chen, R., Nelson, A. J. Modulation of long-latency afferent inhibition by the amplitude of sensory afferent volley. Journal of Neurophysiology. 118 (1), 610-618 (2017).
- Sakai, K., et al. Preferential activation of different I waves by transcranial magnetic stimulation with a figure-of-eight-shaped coil. Experimental Brain Research. 113 (1), 24-32 (1997).
- Groppa, S., et al. A practical guide to diagnostic transcranial magnetic stimulation: Report of an IFCN committee. Clinical Neurophysiology. 123 (5), 858-882 (2012).
- . ClinicalResearcher.org Available from: https://www.clinicalresearcher.org/software.htm (2022)
- Awiszus, F. TMS and threshold hunting. Supplements to Clinical Neurophysiology. 56, 13-23 (2003).
- Silbert, B. I., Patterson, H. I., Pevcic, D. D., Windnagel, K. A., Thickbroom, G. W. A comparison of relative-frequency and threshold-hunting methods to determine stimulus intensity in transcranial magnetic stimulation. Clinical Neurophysiology. 124 (4), 708-712 (2013).
- Cash, R. F., Isayama, R., Gunraj, C. A., Ni, Z., Chen, R. The influence of sensory afferent input on local motor cortical excitatory circuitry in humans. Journal of Physiology. 593 (7), 1667-1684 (2015).
- Hayes, K. D., Khan, M. E. R., Barclay, N. E., Meehan, S. K. The persistent effects of sports-related concussion during adolescence on sensorimotor integration. Canadian Association for Neuroscience Meeting. , (2022).
- Turco, C. V., et al. Short- and long-latency afferent inhibition; Uses, mechanisms and influencing factors. Brain Stimulation. 11 (1), 59-74 (2018).
- Casula, E. P., Rocchi, L., Hannah, R., Rothwell, J. C. Effects of pulse width, waveform and current direction in the cortex: A combined cTMS-EEG study. Brain Stimulation. 11 (5), 1063-1070 (2018).
- D'Ostilio, K., et al. Effect of coil orientation on strength-duration time constant and I-wave activation with controllable pulse parameter transcranial magnetic stimulation. Clinical Neurophysiology. 127 (1), 675-683 (2016).
- Barclay, N. E., Graham, K. R., Hayes, K. D., Meehan, S. K. Program No. 474.08.The contribution of oscillatory activity to the modulation of different sensorimotor circuits under varying working memory load. Society for Neuroscience Annual Meeting. , (2022).
- Dubbioso, R., Raffin, E., Karabanov, A., Thielscher, A., Siebner, H. R. Centre-surround organization of fast sensorimotor integration in human motor hand area. NeuroImage. 158, 37-47 (2017).
- Adams, F. C., et al. Tactile sensorimotor training does not alter short- and long-latency afferent inhibition. Neuroreport. 34 (3), 123-127 (2023).
- Paparella, G., Rocchi, L., Bologna, M., Berardelli, A., Rothwell, J. Differential effects of motor skill acquisition on the primary motor and sensory cortices in healthy humans. Journal of Physiology. 598 (18), 4031-4045 (2020).
- Deveci, S., et al. Effect of the brain-derived neurotrophic factor gene Val66Met polymorphism on sensory-motor integration during a complex motor learning exercise. Brain Research. 1732, 146652 (2020).
- Turco, C. V., Locke, M. B., El-Sayes, J., Tommerdahl, M., Nelson, A. J. Exploring behavioral correlates of afferent inhibition. Brain Sciences. 8 (4), 64 (2018).
- Mang, C. S., Bergquist, A. J., Roshko, S. M., Collins, D. F. Loss of short-latency afferent inhibition and emergence of afferent facilitation following neuromuscular electrical stimulation. Neuroscience Letters. 529 (1), 80-85 (2012).
- Mirdamadi, J. L., Block, H. J. Somatosensory changes associated with motor skill learning. Journal of Neurophysiology. 123 (3), 1052-1062 (2020).
- Bologna, M., et al. Bradykinesia in Alzheimer's disease and its neurophysiological substrates. Clinical Neurophysiology. 131 (4), 850-858 (2020).
- Schirinzi, T. Amyloid-mediated cholinergic dysfunction in motor impairment related to Alzheimer's disease. Journal of Alzheimer's Disease. 64 (2), 525-532 (2018).
- Cohen, L. G., Starr, A. Localization, timing and specificity of gating of somatosensory evoked potentials during active movement in man. Brain. 110 (2), 451-467 (1987).
- Brown, K. E., et al. The reliability of commonly used electrophysiology measures Active and resting motor threshold are efficiently obtained with adaptive threshold hunting. Brain Stimulation. 10 (6), 1102-1111 (2017).
- Turco, C. V., Pesevski, A., McNicholas, P. D., Beaulieu, L. D., Nelson, A. J. Reliability of transcranial magnetic stimulation measures of afferent inhibition. Brain Research. 1723, 146394 (2019).
- Rehsi, R. S., et al. Investigating the intra-session reliability of short and long latency afferent inhibition. Clinical Neurophysiology Practice. 8, 16-23 (2023).
- Toepp, S. L., Turco, C. V., Rehsi, R. S., Nelson, A. J. The distribution and reliability of TMS-evoked short- and long-latency afferent interactions. PLoS One. 16 (12), e0260663 (2021).
- Alle, H., Heidegger, T., Krivanekova, L., Ziemann, U. Interactions between short-interval intracortical inhibition and short-latency afferent inhibition in human motor cortex. Journal of Physiology-London. 587 (21), 5163-5176 (2009).
- Noda, Y., et al. A combined TMS-EEG study of short-latency afferent inhibition in the motor and dorsolateral prefrontal cortex. Journal of Neurophysiology. 116 (3), 938-948 (2016).
- Noda, Y. Reduced prefrontal short-latency afferent inhibition in older adults and its relation to executive function: A TMS-EEG study. Frontiers in Aging Neuroscience. 9, 119 (2017).
- Noda, Y., et al. Reduced short-latency afferent inhibition in prefrontal but not motor cortex and its association with executive function in schizophrenia: A combined TMS-EEG study. Schizophrenia Bulletin. 44 (1), 193-202 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved