Method Article
تسجيل التهاب الجهاز العصبي المركزي وإزالة الميالين وإصابة المحور العصبي في التهاب الدماغ والنخاع المناعي الذاتي التجريبي
In This Article
Summary
يعمل التهاب الدماغ والنخاع المناعي الذاتي التجريبي (EAE) كنموذج حيواني للتصلب المتعدد. توضح هذه المقالة طريقة لتسجيل التهاب الحبل الشوكي وإزالة الميالين وإصابة المحور العصبي في EAE. بالإضافة إلى ذلك ، يتم تقديم طريقة لتحديد مستويات ضوء الخيوط العصبية القابلة للذوبان في مصل الفئران ، مما يسهل تقييم إصابة المحور العصبي في الفئران الحية.
Abstract
التهاب الدماغ والنخاع المناعي الذاتي التجريبي (EAE) هو نموذج شائع قائم على المناعة للتصلب المتعدد (MS). يمكن أن يحدث هذا المرض في القوارض عن طريق التحصين النشط بمكونات البروتين في غمد المايلين ومساعد فرويند الكامل (CFA) أو عن طريق نقل الخلايا التائية المستجيبة الخاصة بالمايلين من القوارض المحضرة ببروتين المايلين / CFA إلى القوارض الساذجة. عادة ما يتم تسجيل شدة EAE على مقياس سريري مكون من 5 نقاط يقيس درجة الشلل الصاعد ، ولكن هذا المقياس ليس مثاليا لتقييم مدى التعافي من EAE. على سبيل المثال ، تظل الدرجات السريرية مرتفعة في بعض نماذج EAE (على سبيل المثال ، نموذج البروتين السكري قليل التغصن المايلين [MOG] الناجم عن الببتيد من EAE) على الرغم من حل الالتهاب. وبالتالي ، من المهم استكمال التسجيل السريري بالتسجيل النسيجي ل EAE ، والذي يوفر أيضا وسيلة لدراسة الآليات الأساسية للإصابة الخلوية في الجهاز العصبي المركزي (CNS).
هنا ، يتم تقديم بروتوكول بسيط لإعداد وتلوين الحبل الشوكي وأقسام الدماغ من الفئران وتسجيل الالتهاب وإزالة الميالين وإصابة المحور العصبي في الحبل الشوكي. يمكن أيضا تطبيق طريقة تسجيل تسلل الكريات البيض في الحبل الشوكي لتسجيل التهاب الدماغ في EAE. كما تم وصف بروتوكول لقياس ضوء الشعيرات العصبية القابلة للذوبان (sNF-L) في مصل الفئران باستخدام مقايسة الجزيئات الصغيرة (SIMOA) ، والتي توفر ملاحظات حول مدى إصابة الجهاز العصبي المركزي بشكل عام في الفئران الحية.
Introduction
التهاب الدماغ والنخاع المناعي الذاتي التجريبي (EAE) هو نموذج الفئران الأكثر شيوعا لمرض إزالة الميالين البشري ، التصلب المتعدد (MS) 1. علم الأمراض الالتهابية الكلاسيكي لمرض التصلب العصبي المتعدد ، بما في ذلك تسلل IFN-γ (جاما) والخلايا التائية المساعدة المنتجة ل IL-172 ، وتسلل الخلايا الوحيدة الالتهابية3 ، وتشكيل آفات مزيل الميالين الالتهابية حول الأوعية الدموية وشبه السحائية4 ، وحدوث إصابة محورية4 في الجهاز العصبي المركزي (CNS) ، لوحظ أيضا في EAE5،6،7،8،9. جعل التشابه في آليات المناعة بين EAE و MS EAE نموذجا مناسبا قبل السريري لاختبار فعالية وآليات عمل عدد من العلاجات المعتمدة على المناعة لمرض التصلب العصبي المتعدد ، بما في ذلك ناتاليزوماب ، فينجوليمود ، ثنائي ميثيل فومارات ، وخلات جلاتيرامر (تمت مراجعته في1،5). تقوم بعض أنظمة EAE بنمذجة جوانب أخرى من أمراض التصلب العصبي المتعدد التدريجي بخلاف الإصابة المحورية ، بما في ذلك تطور الالتهاب السحائي الفرعي في الدماغ ، وإزالة الميالين المزمن ، وضمور الحبل الشوكي ، والمشبك ، وفقدان الخلايا العصبية6،10،11،12. وبالتالي ، فإن EAE له فائدة لفحص فعالية العلاجات الوقائية العصبية لمرض التصلب العصبي المتعدد.
يتم تحفيز EAE في القوارض بعدة طرق. التحصين النشط هو طريقة الحث الأكثر شيوعا ويتضمن تحصين القوارض بمستضدات المايلين (إما البروتينات الكاملة أو الببتيدات) المستحلبة في CFA المكملة بالمتفطرة السلية المقتولة بالحرارة 13. اعتمادا على سلالة الفأر ، يتم إعطاء سم السعال الديكي (PTX) أيضا في اليوم 0 واليوم 2 من التحصين لزيادة تغلغل المرض13. يمكن أيضا تحفيز EAE عن طريق نقل الخلايا التائية الخاصة بالمايلين التي تم الحصول عليها من الفئران المحضرة بالمايلين / CFA إلى الفئران السليمة14 أو يمكن أن تتطور تلقائيا في الفئران التي تفرط في التعبير عن مستقبلات الخلايا التائية المحددة لمستضدات المايلين الرئيسية5.
عادة ما يتم تسجيل شدة مرض EAE وتطوره باستخدام مقياس سريري منفصل من 5 نقاط: 1 - عرج الذيل ، 2 - ضعف الأطراف الخلفية أو القدم ، 3 - الشلل التام في أحد الأطراف الخلفية أو كليهما ، 4 - ضعف الأطراف الأمامية ، 5 - المحتضرين أو الميتين13. نظام التسجيل السريري هذا سليم في توثيق تطور الشلل الصاعد الذي يحدث في بداية المرض ولكنه أقل حساسية في التقاط مدى الشفاء من الهجمات الالتهابية للجهاز العصبي المركزي. على سبيل المثال ، يتم تعيين درجة 2 على مقياس EAE لكل من الفئران التي تتنقل بصعوبة والفئران التي تتنقل بسهولة ولكنها تظهر ضعفا في الإمساك بالقدم. يمكن أن تظل الدرجات عالية في مرحلة ما بعد الحادة من EAE بسبب وجود إصابة أو فقدان محور عصبي دائم ، على الرغم من حل الاستجابة الالتهابية9. كانت هناك مجموعة متنوعة من المحاولات لتطوير أنظمة تسجيل أكثر دقة ، واختبارات سلوكية ، ومقاييس الأطراف الخلفية وقوة القبضة ، وأنظمة مراقبة الأشعة تحت الحمراء لالتقاط الاختلافات في العجز السريري بشكل أفضل في EAE9،16،17،18 ؛ ومع ذلك ، فإن مقاييس التسجيل الأكثر تعقيدا هذه لا تميز مساهمة الالتهاب مقابل إصابة الأنسجة في العجز العصبي الأساسي. وبالتالي ، فإن النهج القياسي الذهبي لتسجيل شدة EAE هو إجراء كل من التسجيل السريري والنسيجي.
هنا ، يتم وصف بروتوكول لكيفية تشريح وتضمين الحبل الشوكي للفأر وعينات الدماغ في البارافين بطريقة تلتقط العملية العشوائية لتشكيل الآفة التي تحدث في EAE. يتم تقديم بروتوكول أيضا حول كيفية تلطيخ الأقسام باستخدام Luxol fast blue (LFB) ، الذي تم إنشاؤه في الأصل بواسطة Kluver و Barrera19 ، والذي يكتشف المايلين في الجهاز العصبي المركزي. المقاطع إما ملطخة ب LFB وحده (لتحليل إزالة الميالين) أو ملطخة بالهيماتوكسيلين ويوزين (H&E) للمساعدة في تصور الآفات الالتهابية وتسجيلها. يتم توفير بروتوكولات أيضا لتحديد وجود الكريات البيض الكلية (CD45) ، وفقدان المايلين ، وعدد المحاور المصابة (SMI-32) في الحبل الشوكي باستخدام الأجسام المضادة المتاحة تجاريا ، وتقنيات الكيمياء المناعية (IHC) ، والبرامج المتاحة للجمهور. يمكن أيضا تطبيق البروتوكول المستخدم لتحديد كريات الدم البيضاء في الحبل الشوكي لتحديد كريات الدم البيضاء في الدماغ.
التقييم النسيجي لفقدان المحور العصبي والإصابة في الدماغ أكثر صعوبة نسبيا منه في الحبل الشوكي لأن مساحات المادة البيضاء في الدماغ لا تعمل بالتوازي مع بعضها البعض. ظهر قياس ضوء الخيوط العصبية في المصل (sNF-L) كعلامة حيوية واعدة لإصابة الخلايا العصبية في MS20,21. وقد وسعت الدراسات الحديثة هذه التكنولوجيا إلىEAE 22،23،24. هنا ، يتم تقديم طريقة لقياس ضوء الخيوط العصبية في الدم (sNF-L) في الفئران الحية باستخدام مقايسة الجزيئات الصغيرة (SIMOA). لا تتطلب هذه الطريقة سوى كمية صغيرة من المصل ويمكن إجراؤها على الفئران الحية في نصف يوم فقط ، مما يوفر ملاحظات سريعة حول كيفية تأثير العلاج المختبر على إصابة الجهاز العصبي المركزي بشكل عام. يمكن تطبيق جميع الطرق الموضحة هنا على الفئران من أي جنس أو سلالة.
Protocol
تم إجراء جميع التجارب التي أجريت على الفئران بموجب بروتوكولات استخدام المعتمدة من قبل لجنة رعاية في Unity Health Toronto ، وفقا للمبادئ التوجيهية التي وضعها المجلس الكندي لرعاية. تأكد من ارتداء معطف المختبر والقفازات الواقية والنظارات طوال إجراءات المختبر.
1. حصاد وتثبيت الدماغ والحبل الشوكي
- القتل الرحيم للفأر وفقا للسياسات المؤسسية. ضع الماوس عرضة على طاولة تشريح وقطع رأسه باستخدام مقص جراحي (قطع لأسفل).
- باستخدام ملقط Adson (في اليد غير المهيمنة) ، أمسك الجلد أعلى رأس الماوس. ثم قم بعمل شق 2.5 سم في الجلد أعلى الرأس باستخدام مقص جراحي.
- استخدم الأصابع لدفع الجلد على الرأس بشكل جانبي لتصور الجمجمة الكامنة.
- ثبت رأس الماوس عن طريق الإمساك بمآخذ العين باستخدام ملقط Adson القياسي.
- باستخدام مقص ناعم (اليد المهيمنة) ، قم بعمل قصاصات صغيرة في الجمجمة على طول خط الوسط من العمود الفقري العنقي إلى المصابيح الشمية.
ملاحظة: قم بتضمين بضعة ملليمترات فقط من أطراف المقص أسفل الجمجمة في المرة الواحدة لتجنب إتلاف الدماغ الأساسي. - استخدم ملقط Adson مع الأسنان لعكس الجمجمة بشكل جانبي للكشف عن الدماغ الأساسي.
- امسك الرأس باستخدام اليد غير المهيمنة. عقد مقص مغلقة (اليد المهيمنة) ، يغرف الحبل الشوكي من العمود الفقري العنقي ودفع الدماغ بلطف من الجمجمة ، وقطع الأعصاب القحفية.
- ضع الدماغ في أنبوب مخروطي يحتوي على 10 مل من الفورمالين المخزن المحايد بنسبة 10٪ والذي يحمل معرف.
- شق الفراء على طول خط الوسط من جذع الفأر من الرقبة إلى الذيل.
- استخدم الأصابع لدفع الجلد بشكل جانبي لتصور العمود الفقري.
- باستخدام مقص جراحي ، قم بقص العمود الفقري لأسفل عند المستوى الذي تلتصق فيه عظم الفخذ بالورك.
- استخدم المقص الجراحي لقطع جدار الجسم على كل جانب من العمود الفقري من الورك إلى الرقبة. تقليم أي أعضاء متصلة.
- ضع العمود الفقري الذي يحتوي على الحبل الشوكي في نفس أنبوب الفورمالين الذي يحتوي على الدماغ. اسمح للدماغ والعمود الفقري بالإصلاح لمدة 5-7 أيام.
ملاحظة: توقيت التثبيت مهم. لن تعمل بعض الأجسام المضادة إذا كانت الأنسجة ثابتة بشكل مفرط. إذا كانت الأنسجة غير ثابتة ، فمن الصعب بثق الحبل الشوكي من العمود الفقري في الخطوة 2.
2. حز ومعالجة الحبل الشوكي والدماغ
ملاحظة: تحدث الخطوات التالية في غطاء الدخان. قبل البدء ، قم بإعداد أطباق بتري نظيفة مقاس 2 × 10 سم ، وقارورة Erlenmeyer مزودة بقمع مبطن بورق ترشيح ، ومشارطين (أحدهما لقطع العظام والآخر لقطع أنسجة الجهاز العصبي المركزي) ، وورق عدسة ، وقلم رصاص ، وأشرطة تضمين ، وأوعية عينات مملوءة مسبقا بنسبة 10٪ من الفورمالين.
- باستخدام المقص ، قم بقص قطعة صغيرة من ورق العدسة (بنفس العرض ولكن ضعف طول الكاسيت) وضعها في طبق بتري واحد.
- قم بتسمية شريط كاسيت بلاستيكي بمعرف العينة باستخدام قلم رصاص.
- صب الأنبوب الذي يحتوي على الدماغ الثابت والعمود الفقري في القمع. نقل العمود الفقري والدماغ إلى طبق بتري فارغة.
ملاحظة: سوف يتسرب الفورمالين المستخدم إلى دورق Erlenmeyer ويمكن إعادة استخدامه في الخطوة 2.13. - قسم الدماغ بشكل كبير إلى ست قطع إكليلية باستخدام مشرط. اصنع ذيلية مقطوعة واحدة للمخيخ ، وواحدة في منتصف المخيخ ، وواحدة فقط منضدية للمخيخ ، وقطعتين في الدماغ المنقاري المتبقي ، مما يخلق 3 شرائح إكليلية إضافية متساوية السماكة.
- باستخدام الملقط ، انقل عينات الدماغ إلى نصف ورقة العدسة في طبق بتري.
- قطع الحبل الشوكي إلى ثلاث قطع باستخدام مشرط: يتم إجراء القطع الأول في الجزء السفلي من القفص الصدري ، ويتم القطع الثاني أسفل الانحناء في العمود الفقري العنقي.
- باستخدام نفس المشرط ، قم بقص قطعة العمود الفقري العجزي في الطرف الذيلي حتى يمكن تصور الحبل الشوكي.
- التقط العمود الفقري الصدري (اليد غير المهيمنة). امسك ملقط Adson بأسنان مغلقة بإحكام (اليد المهيمنة) وادفع طرف الملقط برفق إلى الفتحة الأصغر للعمود الفقري باستخدام حركة التواء لطيفة. يجب أن يخرج الحبل من الطرف الآخر.
ملاحظات: أي أداة مستديرة بحجم الحبل الشوكي ستعمل لهذا الغرض. إذا لم يخرج الحبل الشوكي بشكل طبيعي ، فلا تجبره. بدلا من ذلك ، استخدم مقصا ناعما لقص العظام على طول جانب العمود الفقري وعكسه مفتوحا للكشف عن الحبل الشوكي. بدلا من ذلك ، إصلاح الحبل الشوكي والدماغ لبضعة أيام إضافية في الفورمالين. ومع ذلك ، يجب تطبيق نفس وقت التثبيت على جميع العينات لتجنب إدخال تباين في تلطيخ الأجسام المضادة. - التقط ملقط Adson القياسي (اليد المهيمنة). لا تزال تمسك قطعة الحبل الشوكي باليد الأقل هيمنة ، استخدم الملقط لسحب الحبل الناشئ برفق من العمود. ضع قطعة الحبل الشوكي في طبق بتري الذي يحتوي على ورق العدسة.
- كرر هذه العملية لقطع العمود القطني / العجزي وعنق الرحم.
- قسم قطع الحبل الشوكي الثلاثة (عنق الرحم والصدر وأسفل الظهر / العجز) إلى قطع مقطعية أصغر باستخدام مشرط. قطع ما لا يقل عن 15 قطعة ، يجب أن يكون سمك كل منها أقل من 2 مم.
ملاحظة: تأكد من أن الأجزاء أقصر من عرضها ، مما سيجعل المقاطع تسقط بسهولة أكبر في المقطع العرضي أثناء عملية التضمين في الخطوة 3. - رتب قطع الحبل الشوكي على نفس النصف من ورقة العدسة التي تحتوي على قطع الدماغ. قم بطي ورق العدسة لوضع قطع المناديل في شطيرة وضعها في الدرج الملصق.
ملاحظة: يمنع ورق العدسة قطع الأنسجة الصغيرة من الهروب من الدرج أثناء المعالجة. - انقل الكاسيت إلى جرة عينة تحتوي على فورمالين معاد تدويره أو طازج.
- كرر الخطوات 2.1 إلى 2.13 للعينات المتبقية.
- بعد 5-7 أيام من التثبيت ، انقل الكاسيت من حاوية العينات إلى حمام الفورمالين الأول في معالج الأنسجة الأوتوماتيكي (انظر جدول المواد). قم بتشغيل معالج الأنسجة طوال الليل وفقا للبرنامج الموضح في الجدول التكميلي 1. يتم الاحتفاظ العينات في شمع البارافين الدافئ حتى التضمين.
3. تضمين وقطع أقسام الدماغ والحبل الشوكي
- انقل الكاسيتات من المعالج إلى غرفة التخزين الدافئة لمحطة تضمين البارافين (انظر جدول المواد).
- قم بتضمين المقاطع العرضية للحبل الشوكي والدماغ من كل فأر في كتلة بارافين واحدة على النحو التالي (الشكل 1):
- أولا ، صب شمع البارافين فقط لتغطية الجزء السفلي من القالب. باستخدام ملقط رفيع ، ضع القطع المستعرضة للدماغ الإكليلي والحبل الشوكي في البارافين في قاع القالب.
- انقل القالب إلى سطح التبريد لعدة ثوان لتثبيت قطع الدماغ والحبل الشوكي في مكانها. حرك القالب مرة أخرى إلى السطح الساخن واملأه إلى الأعلى بالبارافين الساخن.
- ضع غطاء الكاسيت (المسمى بمعرف العينة) أعلى القالب. صب المزيد من البارافين فوق غطاء الكاسيت. انقل القالب إلى محطة التبريد للسماح للشمع بالتماسك (يبرد لمدة 30-60 دقيقة).
ملاحظة: يتطلب تضمين أقسام الحبل الشوكي ممارسة. لتحسين النجاح ، استخدم أطوالا أقصر من الحبل الشوكي (<2 مم) حيث من المرجح أن تقع في المقطع العرضي. يمكن ارتداء عدسات العين الجراحية للمساعدة في تمييز ما إذا كانت قطع الحبل الشوكي في المقطع العرضي. - جبل كتلة البارافين على ميكروتوم دوار. تقليم كتلة حتى تظهر الأنسجة ذات الأهمية في قسم البارافين.
- قطع شرائط 5 ميكرومتر من أقسام كل كتلة ونقلها إلى حمام مائي 42 درجة مئوية.
- اجمع الأقسام على الشرائح وضع الشرائح في رف شرائح زجاجي.
- تخبز المقاطع على حرارة 37 درجة مئوية في فرن جاف طوال الليل. بارد الشرائح قبل الشروع في تلطيخ.
4. إزالة البارافين والإماهة من الأقسام استعدادا للتلطيخ
ملاحظة: يتم تنفيذ الخطوات في غطاء الدخان. قبل البدء ، تحضير حمامات المذيبات. تحضير 5 لتر من 1x PBS (1 L ddH2O ، 8 g NaCl ، 0.2 g KCl ، 1.44 g Na2HPO4 ، 0.24 g KH2PO4 ؛ pH = 7.4) مع 0.05٪ Tween-20 (PBS-T) لجميع خطوات الغسيل.
- قم بإزالة البارافين عن طريق وضع شرائح في حمامين متتاليين من الزيلين أو مذيب غير قائم على الزيلين على شاكر لمدة 5 دقائق لكل منهما مع تحريك لطيف.
- إعادة ترطيب الأنسجة عن طريق نقل الشرائح عبر الحمامات المتتالية من النسب المئوية التنازلية من الإيثانول: 2 × 100٪ إيثانول (5 دقائق لكل منهما) ، 2 × 95٪ إيثانول (3 دقائق لكل منهما) ، و 1 × 70٪ إيثانول (3 دقائق). احتفظ بنسبة 95٪ من الإيثانول لتلطيخ LFB ، وأعد ترطيبه إلى 70٪ من الإيثانول ، واحتفظ به في PBS-T للكيمياء الهيستولوجية المناعية (IHC).
5. LFB للمايلين مع H&E
- تحضير محلول من 0.1 ٪ LFB (0.2 غرام LFB ، انظر جدول المواد ، 200 مل 95 ٪ الإيثانول ، 0.5 مل حمض الخليك الجليدي). امزج وتصفية في قارورة إرلنماير. تخزينها في زجاجة داكنة حتى الاستخدام.
- انقل المقاطع من 95٪ إيثانول إلى رف منزلق زجاجي يتم وضعه في طبق تلطيخ يحتوي على LFB. غطي الطبق وأغلقه بغشاء البارافين لمنع التبخر.
- احتضان الأقسام في فرن 56 درجة مئوية طوال الليل (بحد أقصى 16 ساعة).
- في صباح اليوم التالي ، انقل الشرائح إلى حمام ddH2O مع الاستمرار.
- وفي الوقت نفسه ، قم بإعداد (1) محلول كربونات الليثيوم الطازج بنسبة 0.05٪ (0.05 جم كربونات الليثيوم ، 100 مل ddH2O) ؛ (2) محلول Eosin Y (أضف 2 جم من ملح eosin إلى 40 مل ddH20 واخلطه حتى يذوب ثم اخلطه مع 160 مل من الإيثانول بنسبة 95٪).
- تحضير الحمامات التالية: 1 × كربونات الليثيوم ، 3 × 70٪ إيثانول ، 3 × 95٪ إيثانول ، 2 × 100٪ إيثانول ، 3 × ddH20. ضع الحمامات حسب ترتيب الاستخدام (انظر الجدول التكميلي 2).
- اتبع الخطوات الموضحة في الجدول التكميلي 2.
- بعد أن تجف الشرائح ، تصور الآفات المزيلة للميالين تحت المجهر.
6. LFB للمايلين دون H& E
- تنفيذ هذا الإجراء تلطيخ لتحليل المايلين.
ملاحظة: الإجراء مطابق للخطوة 5 (انظر الجدول الإضافي 2) ، ولكن له تدفق عمل مختصر. بعد الخطوة 4، تابع الإجراء بدءا من الخطوة 10.
7. استرجاع المستضد وتبريد البيروكسيديز للبقع المناعية الكيميائية (IHC)
ملاحظة: قبل البدء ، قم بإعداد 100 مل من بيروكسيد الهيدروجين في الميثانول (1 جزء 30٪ محلول بيروكسيد الهيدروجين في 9 أجزاء 100٪ ميثانول ، في غطاء دخان). تحضير 1 لتر من محلول سترات 10 مللي متر مع Tween-20 (2.94 جم من سترات الصوديوم ، مذابة في 1 لتر من ddH20 في دورق على لوحة التحريك ، وجلب الرقم الهيدروجيني إلى 6.0 ، وإضافة 500 ميكرولتر من Tween-20). قم بإعداد PBS-T (انظر الخطوة 4). تتم جميع عمليات الغسيل في حمامات PBS-T مع تحريض لطيف (على شاكر) ما لم يذكر خلاف ذلك.
- إخماد البيروكسيديز الداخلي عن طريق وضع الشرائح في بيروكسيد الهيدروجين 3٪ في الميثانول لمدة 15 دقيقة (في غطاء الدخان). اغسل الشرائح مرتين في PBS-T (2 دقيقة لكل منهما).
- انقل الشرائح إلى حامل منزلق معدني وضعها في 1 لتر من محلول السيترات في قدر الضغط. أغلق الغطاء وأضف سدادة مطاطية أعلى فتحة تهوية البخار.
- يطهى على درجة حرارة عالية في الميكروويف حتى تنبثق اللسان الأصفر في قدر الضغط ، مما يشير إلى الوصول إلى أقصى ضغط. يطهى لمدة 5 دقائق إضافية بأقصى ضغط ، ثم أخرج قدر الضغط من الميكروويف باستخدام قفازات واقية.
- قم بإزالة الضغط عن طريق إزالة السدادة. قم بإزالة الغطاء واترك الشرائح تبرد في المخزن المؤقت للسيترات لمدة 20 دقيقة ثم تابع طريقة التلوين المطلوبة.
تنبيه: قف عند إطلاق البخار لأنه قد يتسبب في إصابة حروق.
8. CD45 الكيمياء الهيستولوجية المناعية
ملاحظة: يتم استخدام طريقة IHC هذه لتصور تسلل الكريات البيض. يتم الجمع بين خطوات حجب avidin / biotin مع خطوات الحجب وحضانة الأجسام المضادة الأولية.
- تحضير المخزن المؤقت للحظر (2٪ BSA ، 2٪ مصل أرنب في 1x PBS).
- انقل الشرائح إلى صينية منزلقة زجاجية واغسلها مرتين باستخدام PBS-T (2 دقيقة لكل منها). تحضير محلول أفيدين / مانع (4 قطرات / مل من أفيدين في 2٪ BSA / 2٪ مصل أرنب في 1 × PBS ، انظر جدول المواد).
- جفف PBS-T الزائد حول الأنسجة باستخدام ورق مناديل معملي. باستخدام قلم كاره للماء ، ارسم دائرة حول الأنسجة وضع الشريحة في الغرفة الرطبة.
- ضع محلول avidin / الحجب على كل قسم (400 ميكرولتر / شريحة).
- غطي الحجرة الرطبة واحتضنها لمدة 30 دقيقة في درجة حرارة الغرفة. خلال هذه الخطوة ، قم بإعداد الجسم المضاد ل CD45 (الجدول التكميلي 3) في منع المخزن المؤقت الذي يحتوي على البيوتين (4 قطرات / مل من البيوتين ، 2٪ BSA / 2٪ مصل أرنب في 1x PBS).
- اضغط على حل الحظر من الشريحة على مناديل مختبرية خالية من النسالة. ربت حول الأنسجة باستخدام مناديل معملية لإزالة السوائل الزائدة.
- ضع الشريحة مرة أخرى في غرفة رطبة. أضف 400 ميكرولتر من محلول الأجسام المضادة CD45 (انظر جدول المواد) إلى القسم. احتضان بين عشية وضحاها في 4 درجة مئوية في غرفة رطبة مغطاة.
- في اليوم التالي ، قم بتصريف الأجسام المضادة الأولية واغسل الشرائح 3 × في PBS-T (5 دقائق لكل منهما).
- جفف المنطقة المحيطة بالقسم باستخدام مختبر خال من النسالة ثم أضف 400 ميكرولتر من الأجسام المضادة الثانوية (1: 200 تخفيف في المخزن المؤقت للحظر) على كل قسم. احتضان في درجة حرارة الغرفة لمدة 1 ساعة.
- وفي الوقت نفسه ، قم بإعداد كاشف ABC (انظر جدول المواد) بإضافة 2 قطرات من الكاشف A إلى 5 مل من 1x PBS واخلطها. أضف 2 قطرات من الكاشف B إلى نفس المحلول واخلطه (تحضير ~ 30 دقيقة قبل الاستخدام).
- اغسل الشرائح في 3 تغييرات من 1x PBS-T (5 دقائق لكل منها) وضع الشرائح في غرفة رطبة.
- أضف كاشف ABC سعة 400 ميكرولتر إلى الأقسام. غطي الحجرة الرطبة واحتضنها لمدة 30 دقيقة في درجة حرارة الغرفة.
- اغسل الشرائح في 3 تغييرات من 1x PBS-T (5 دقائق لكل منهما). وفي الوقت نفسه ، قم بإعداد كمية مناسبة من محلول DAB في أنبوب طرد مركزي سعة 15 مل مغطى بالرقائق وفقا لتعليمات الشركة المصنعة (انظر جدول المواد).
- خذ شريحة واحدة وركز على قسم الحبل الشوكي تحت المجهر. أضف 400 ميكرولتر DAB إلى الشريحة وابدأ مؤقت المختبر.
- تصور القسم أثناء تطويره وإيقاف المؤقت عندما تكون الكريات البيض بنية. انقل الشريحة إلى حمام ddH20 لإيقاف التفاعل. يمسك في الماء لمدة 5 دقائق. يتم استخدام نفس وقت التطوير للشرائح المتبقية.
تنبيه: DAB مادة مسرطنة. تخلص من نفايات DAB وما بعد DAB ddH2O كنفايات خطرة. - ينزلق Counterstain مع الهيماتوكسيلين من ماير لمدة ~ 4-10 دقائق (انظر الجدول التكميلي 2). شطف الشرائح تحت ماء الصنبور الجاري لمدة 10 دقائق.
- يجفف في 95٪ إيثانول (1 × 3 دقائق) ، يليه إيثانول مطلق 100٪ (2 × 3 دقائق لكل منهما).
- بالانتقال إلى غطاء الدخان ، انقل الشرائح إلى زيلين أو مذيب بديل للزيلين لمدة 5 دقائق. Coverslip مع تصاعد المتوسطة ، والسماح للشرائح لتجف لمدة 1-2 أيام في غطاء الدخان.
تنبيه: في حالة استخدام الزيلين ، استخدم قفازات مزدوجة وملقط للتعامل مع الشرائح عند انزلاق الغطاء ، لأنه سام ويمكن أن يذيب القفازات. - نظف الشرائح باستخدام الزيلين وامسحها ضوئيا باستخدام ماسحة ضوئية للشرائح بتكبير 20 ضعفا.
9. SMI-32 IHC للتلف المحوري
ملاحظة: يستخدم هذا البروتوكول الجسم المضاد SMI-32 للفأر ، والذي يتفاعل ضد الخيوط العصبية غير المفسفرة الثقيلة ، والتي يمكن أن تتراكم في المحاور المصابة25. نظرا لأن هذا الجسم المضاد قد تم رفعه في الماوس ويكتشف مستضد الماوس ، فمن المستحسن استخدام مجموعة الماوس على الماوس (MOM). في هذا الإجراء ، تتم خطوة حجب avidin / biotin كخطوة منفصلة عن حضانة الأجسام المضادة الأولية. قبل البدء في هذا البروتوكول ، قم بإزالة البارافين وإعادة الترطيب وإخماد نشاط البيروكسيديز الداخلي المنشأ وإجراء استرجاع المستضد كما هو موضح في الخطوة 4 والخطوة 7.
- اغسل المقاطع مرتين باستخدام 2 × PBS-T (2 دقيقة لكل منهما). قم بإزالة السائل الزائد حول الأقسام باستخدام نسيج مختبري وارسم دائرة حول الأنسجة باستخدام قلم كاره للماء.
- أضف 400 ميكرولتر عازلة مانعة (2٪ (وزن / حجم) مصل الماعز في 1x PBS-T) مع أفيدين (4 قطرات / مل) إلى الأقسام. احتضان لمدة 15 دقيقة في درجة حرارة الغرفة.
- اغمس الشرائح مرتين في 1x PBS-T. أضف 400 ميكرولتر من المخزن المؤقت المانع مع البيوتين (4 قطرات / مل) إلى الشريحة واحتضانها لمدة 15 دقيقة في درجة حرارة الغرفة.
- اغسل الشرائح في حمام 1 × PBS-T لمدة 2 دقيقة. وفي الوقت نفسه ، قم بإعداد كاشف حجب MOM عن طريق إضافة قطرتين من محلول المخزون (انظر جدول المواد) إلى 2.5 مل من 1x PBS.
- أضف 400 ميكرولتر من كاشف MOM إلى القسم. احتضان لمدة 1 ساعة في درجة حرارة الغرفة.
- اغسل الشرائح مرتين في حمام 1x PBS-T لمدة 2 دقيقة. وفي الوقت نفسه ، قم بإعداد مخفف MOM بإضافة 300 ميكرولتر من محلول مخزون تركيز البروتين إلى 3.75 مل من 1x PBS.
- أضف 400 ميكرولتر من مادة MOM المخففة واحتضانها لمدة 5 دقائق في درجة حرارة الغرفة. وفي الوقت نفسه تمييع الجسم المضاد SMI-32 (انظر جدول المواد) في مخفف MOM.
- اضغط على المادة المخففة من الشرائح وأضف 400 ميكرولتر من محلول الأجسام المضادة SMI-32 إلى القسم. غطي الحجرة الرطبة واحتضانها لمدة 30 دقيقة في درجة حرارة الغرفة.
- اغسل الشرائح مرتين في حمام PBS-T 1x لمدة 2 دقيقة ، كل منها مع تحريض لطيف. وفي الوقت نفسه ، قم بتخفيف كاشف العمل IgG المضاد للفأر MOM في المادة المخففة (10 ميكرولتر من المخزون في 2.5 مل من المادة المخففة).
- أضف 400 ميكرولتر من كاشف العمل IgG المضاد للماوس لكل شريحة. احتضان لمدة 10 دقائق.
- اغسل الشرائح مرتين في حمام 1x PBS-T لمدة 2 دقيقة لكل منهما. استمر في التلوين باتباع الخطوات الموضحة في بروتوكول التلوين CD45 (الخطوة 8.11 - 8.19).
10. تسجيل LFB و H&E لوجود آفات مزيل للميالين
ملاحظة: فيما يلي نهج تحليلي يمكن تطبيقه للحصول على رؤى سريعة حول شدة إزالة الميالين الالتهابية. يتم إجراء هذا التحليل في أقسام من الحبل السري تم أخذ عينات منها على مستويات مختلفة (عنق الرحم والصدر وأسفل الظهر ، على الأقل 3 أقسام لكل / مستوى). ارجع إلى أطلس ألين للدماغ للحبل الشوكيللفأر 26 للمساعدة في تحديد المستوى التشريحي للحبل الشوكي. يتطلب هذا التحليل ملفات TIFF. إذا كانت الصور الممسوحة ضوئيا بتنسيق .czi ، فاتبع الإرشادات الواردة في الجدول التكميلي 4 لتحويل ملفات czi إلى ملفات TIFF.
- افتح صورة TIFF للقسم المراد تحليلها عن طريق سحب الملف وإفلاته في ImageJ. راقب قسم الحبل الشوكي في 4 أرباع: الظهرية والجانبية اليسرى والجانبية اليمنى والأمامية (الشكل 2 أ ، ب).
- سجل لوجود آفات مزيل للميالين في كل ربع كما هو موضح في الشكل 2.
ملاحظة: ينتج عن وجود آفة درجة 1 في هذا الربع ، ليصبح المجموع 4 نقاط محتملة لكل قسم. يتم تعيين درجة 1 حتى لو كانت هناك آفات متعددة داخل الربع. - اجمع كل النقاط لكل فأر واقسمها على العدد الإجمالي للأرباع التي تم أخذ عينات منها للحصول على جزء من الأرباع ذات الآفات السحائية الفرعية.
11. حساب جزء مساحة تلطيخ LFB في المادة البيضاء للحبل الشوكي
ملاحظة: يقيس هذا التحليل النسبة المئوية لجزء مساحة المادة البيضاء للحبل الشوكي الملطخة ب LFB.
- افتح مقطعا ملطخا ب LFB تم حفظه كملف TIFF عن طريق سحب/إفلات الملف في ImageJ.
- انقر فوق Image > اكتب > 8 بت لإنتاج صورة بمقياس رمادي. انقر فوق الصورة > ضبط عتبة >. اضبط شريط التمرير السفلي بحيث يلتقط التراكب الأحمر جميع المناطق المظلمة (الميالين) التي تراها العين (الشكل 2C - E). انقر فوق تطبيق.
- انقر فوق تحليل أدوات > > إدارة عائد الاستثمارr لفتح مدير عائد الاستثمار.
- حدد أداة الرسم المضلع على شريط أدوات ImageJ. تسمح أداة الرسم هذه بتحديد منطقة من الحبل الشوكي باستخدام فأرة الكمبيوتر.
- حدد المنطقة الظهرية للحبل الشوكي وأضف المضلع إلى مدير عائد الاستثمار بالنقر فوق t على لوحة المفاتيح.
- حدد المنطقة الأمامية الجانبية للمادة البيضاء للحبل الشوكي وأضف المضلع إلى مدير عائد الاستثمار.
ملاحظة: عند التتبع ، استبعد الأوعية الدموية الكبيرة ، والتمزقات في الأنسجة ، والتحف ، والمناطق المجاورة للقرن الظهري (الشكل 2A ، B السهم) ، والتي عادة ما تكون أقل ميالين. كن دقيقا قدر الإمكان عند التتبع لأن تضمين الكثير من الخلفية البيضاء سيؤدي إلى تحريف النتائج. - انقر فوق تحليل > تعيين القياسات وحدد كسر المنطقة.
- انقر فوق قياس في مدير عائد الاستثمار. سيعطي هذا جزءا من المنطقة المحددة الملطخة ب LFB.
- من مربع النتائج الذي تم إنتاجه حديثا ، انسخ القيم إلى Excel وأغلق نافذة الصورة. احسب متوسط ٪ مساحة الكسر الملطخة للمناطق الظهرية والبطنية الجانبية. متوسط هذه للحصول على قيمة لهذا القسم.
- كرر الخطوات من 11.1 إلى 11.9 للأقسام العنقية والصدرية والقطنية (N = 3 / المستوى / الفأر).
- احسب متوسط النسبة المئوية لكسر الميالين لجميع الأقسام لكل ماوس. يتم تقدير النسبة المئوية لإزالة الميالين بطرح النسبة المئوية لمساحة التلوين من 100.
12. تحليل عدد خلايا CD45 + و SMI-32 + البيضاوي المحوري
- اسحب صورة TIFF الملطخة CD45 أو SMI-32 وأفلتها في ImageJ. انقر فوق تحليل > تعيين مقياس > > عمومي موافق لتعيين شريط المقياس عبر جميع الصور. لاحظ أن هذا يتم فقط للصورة الأولى.
- حدد أداة رسم المضلع وتتبع حول المادة الرمادية باستخدام فأرة الكمبيوتر. انقر فوق تحليل > قياس وتسجيل النتائج في Excel ك "منطقة المادة الرمادية".
- مع بقاء المضلع المرسوم على الصورة ، قم بإزالة المادة الرمادية من الصورة بالنقر فوق مفتاح الحذف (لوحة المفاتيح). هذا الإجراء يترك فقط المادة البيضاء المراد تحليلها.
- حدد مقطع الحبل الشوكي بالكامل باستخدام أداة رسم المضلع . استبعد أي مناطق من الأنسجة مفقودة أو تالفة.
- انقر فوق تحليل > قياس وتسجيل النتائج ك "إجمالي مساحة الأنسجة" في ملف Excel.
- انقر على الصورة > اللون > فك الالتفاف اللوني. من النافذة المنسدلة المتجهات ، حدد H DAB. ستظهر ثلاث نوافذ جديدة - احتفظ بنافذة اللون البني (قناة DAB) واحذف نوافذ الصور الأخرى.
- انقر فوق الصورة > ضبط > العتبة. اضبط المنزلق السفلي لضبط عتبة الصورة بحيث يلتقط التراكب الأحمر نفس القدر من التلوين البني المكتشف بالعين. انقر فوق تطبيق.
- انقر فوق عملية > مستجمعات المياه الثنائية >. في هذه الخطوة ، قارن بين الصورة الأصلية والصورة الثنائية للتأكد من توافقهما.
- انقر فوق تحليل > تحليل الجسيمات. حدد إظهار التراكب وقم بتعديل الإعدادات: الحجم = 5 - 150 ميكرومتر2 ، الدائرية = 0.4 - 1. انقر فوق موافق.
ملاحظة: تسمح هذه الإعدادات بتضمين الخلايا الفردية ومجموعات الخلايا الصغيرة التي لم يتم تقسيمها باستخدام وظيفة مستجمعات المياه بدلا من استبعادها في التحليل. - في نافذة النتائج ، سجل الرقم الأخير في العمود الموجود في أقصى اليسار في Excel ، والذي يمثل إجمالي عدد الجسيمات. ثم احسب مساحة المادة البيضاء (إجمالي مساحة الأنسجة - مساحة المادة الرمادية بالملليمتر2). التعبير عن إجمالي عدد الجسيمات لكل منطقة مادة بيضاء (العد / مم2).
- كرر الخطوات لكل صورة RGB محفوظة. بمجرد تحليل جميع أقسام الحبل الشوكي لفأر واحد ، قم بحساب متوسط عدد الجسيمات لكل نسيج مم2 لهذا الفأر.
ملاحظة: يمكن أيضا تطبيق سير العمل المستخدم لتحليل كريات الدم البيضاء في الحبل الشوكي على مناطق الدماغ.
13. قياس sNF-L باستخدام مقايسة SIMOA
- جمع 100-200 ميكرولتر دم من الفئران الحية عن طريق النزيف الصافن باستخدام أنابيب ميكروتينر شعرية أو عن طريق ثقب القلب باستخدام حقنة وإبرة 25 غرام (إجراء طرفي). بالنسبة للأخير ، انقل الدم إلى أنبوب طرد مركزي صغير سعة 1.5 مل.
- اترك الدم يتجلط في درجة حرارة الغرفة لمدة 30-60 دقيقة.
- عينات الطرد المركزي عند 2660 × جم لمدة 5 دقائق عند 4 درجات مئوية وماصة الجزء العلوي (المصل) في أنبوب طرد مركزي دقيق جديد. يحفظ السيروم على حرارة -80 درجة مئوية حتى يصبح جاهزا للاستخدام.
- التحضير: اسمح لأجهزة المعايرة وأدوات التحكم (مجموعة مقايسة NF-light ، انظر جدول المواد) بالتسخين إلى درجة حرارة الغرفة لمدة 1 ساعة قبل الاستخدام. أخرج ركيزة الإنزيم (RGP) من الثلاجة وضعها في حمام مائي بدرجة حرارة 30 درجة مئوية لمدة 30 دقيقة على الأقل ، دوامة كل 10 دقائق.
- قم بإذابة عينات المصل على الثلج. بمجرد إذابتها ، قم بأخذ عينات الدوامة وأجهزة الطرد المركزي برفق عند 10000 × جم لمدة 5 دقائق لتكسير أي حطام.
- تحميل اللوحة: دوامة المعايرات والضوابط. قم بتحميل أجهزة المعايرة في نسختين ، وعناصر التحكم في نسختين ، وعينات المصل في نسختين على لوحة 96 بئرا المرفقة مع المجموعة. يتم تخفيف عينات المصل بنسبة 1: 3 مع توفير مادة مخففة في المجموعة. ختم اللوحة.
- قم بتشغيل جهاز SIMOA (انظر جدول المواد) بترتيب الكمبيوتر والبرنامج ثم الجهاز. اسمح للجهاز بتهيئة صيانة بدء اليوم وتشغيلها.
- دوامة الخرز المغناطيسي لمدة 30 ثانية.
- تحميل علامة تبويب الكواشف على الشاشة ، والنقر المزدوج على موضع الحامل حيث سيتم وضع زجاجة الكاشف ، ثم مسح الرمز الشريطي للزجاجة.
- ضع الخرزات المغناطيسية في وضع الاهتزاز على الرف (المواضع 1-3).
- استمر في تحميل الكاشف وكاشف SBG وكاشف RGP في الجهاز.
- انقر فوق الإعداد على البرنامج. تأكد من أن وضع العينة على اللوحة. في علامة التبويب تشغيل الإعداد، قم بتسمية التجربة.
- قم بتعيين الآبار على اللوحة لأجهزة المعايرة على النحو التالي: انقر فوق البئر ، ثم حدد الفحص. حدد معايرة A ثم انقر فوق تصاعدي. قم بتمييز الآبار A1-8 ثم انقر فوق النسخ المتماثلة (2) لتعيين إحداثيات أجهزة المعايرة المراد تشغيلها في نسختين. تشغيل باستخدام بروتوكول أنيق.
ملاحظة: ارجع إلى شهادة التحليل (موقع الشركة المصنعة) للحصول على تركيزات كل معاير لكل رقم دفعة معين. بمجرد تعيين الآبار ، لا يمكن التنقل بعيدا عن هذه الشاشة دون فقد العمل ، حتى يتم قفل اللوحة في مكانها. - قم بتعيين العينات باتباع الخطوات التالية:
- من أسفل يمين الشاشة ، انقر فوق الزر لتعيين العينات. تسليط الضوء على الآبار حيث توجد العينات.
- تحقق من الفحص المراد تشغيله من القائمة ، واختر عدد النسخ المتماثلة ، وحدد التخفيف على متن الطائرة بمقدار 4x.
- مع استمرار تمييز الآبار ، أدخل بادئة لمعرف العينة ورقم البداية ثم انقر فوق إنشاء لإنتاج معرفات متسلسلة للعينات. كرر الخطوات لعينات التحكم.
- قم بتحميل اللوحة في حامل اللوحة (A1 إلى A12).
- في واجهة الشاشة ، انقر فوق عينات البرمجة المنجزة وانتقل إلى علامة التبويب موارد النظام. تأكد من امتلاء جميع حاويات الكاشف وحاويات النفايات فارغة.
- انقر فوق تشغيل.
- عند اكتمال التشغيل ، تحقق من منحنى المعايرة ضمن علامة التبويب "تقليل البيانات" عن طريق تحديد الفحص واسم اللوحة.
- انتقل إلى "سجل التشغيل" واستخدم الفلاتر للعثور على أحدث تشغيل. حدد تشغيل ثم جميع النتائج. انقر فوق تصدير ، واحفظ ملف .csv. انقر فوق تقرير ثم حدد تقرير معايرة الدفعات وحدد التشغيل الأخير. معاينة التقرير وتصديره.
- قم بتشغيل صيانة نهاية اليوم الموصى بها من قبل الشركة المصنعة. قم بإيقاف تشغيل البرنامج والجهاز ثم الكمبيوتر.
النتائج
يوضح الشكل 3 تمثيلا ل IHC وتلطيخ الأنسجة الكيميائية ، مع أمثلة على كل من آفات EAE الحادة (اليسرى) والقديمة (يمين). يظهر تلطيخ CD45 التمثيلي مع تلطيخ الهيماتوكسيلين المضاد في الشكل 3 أ ، ب. يوضح الشكل 3C-F أمثلة على تلطيخ LFB ب (الشكل 3C ، D) أو بدون (الشكل 3E ، F) المضاد H& E. على الرغم من أن الهيماتوكسيلين ليس خاصا بالخلايا المناعية ، إلا أن نوى الخلايا المناعية تلطخ بشكل أغمق ويمكن تمييزها عن الخلايا المقيمة في الجهاز العصبي المركزي. يوضح الشكل 3G ، H تلطيخا تمثيليا لمحاور SMI-32 + ، ملطخة بالهيماتوكسيلين. لاحظ زيادة ظهور هذه البقعة في آفات EAE القديمة.
تلف المسارات الميالينية هو الأكثر انتشارا في الحبل الشوكي في الفئران النشطة EAE وهذا هو المحرك الرئيسي للشلل في هذا المرض 7,9. وبالتالي ، فإن تسجيل وجود التهاب وتلف الأنسجة في الحبل الشوكي له الأولوية في التحليلات النسيجية. تحدث آفات EAE بشكل متقطع في مناطق مختلفة (أمامية أو جانبية أو ظهرية) (الشكل 2 أ ، ب) وعلى مستويات مختلفة (العجز ، أسفل الظهر ، الصدر ، عنق الرحم) من الحبل الشوكي. تضمن طريقة التضمين الموصوفة أخذ عينات جيدة من الآفات في جميع أنحاء الحبل. يتم تضمين أقسام أكثر من تحليلها ، حيث يمكن أن تتلف بعض الأقسام في عملية المعالجة أو التقسيم. لضمان أخذ عينات تمثيلية ، يتم تحليل ما لا يقل عن 3 أقسام تمثيلية على مستويات عنق الرحم والصدر وأسفل الظهر من الحبل الشوكي لكل فأر. يتم تعمية هوية كل عينة حتى لا يكون الشخص الذي يجري التحليل متحيزا عند اختيار أقسام تمثيلية للتحليل.
للحصول على رؤى سريعة حول الاختلافات في الشدة النسيجية ل EAE ، يمكن للمرء أن يسجل لوجود آفات إزالة الميالين تحت السحائية في أرباع الحبل الشوكي في أقسام مختارة (الشكل 2 أ ، ب). هذه طريقة سريعة يمكن إجراؤها على الصور الممسوحة ضوئيا أو باستخدام المجهر الضوئي. هذا التحليل حساس بما يكفي للكشف عن الاختلافات في شدة EAE النسيجية بين المجموعات عندما يكون EAE شديدا في مجموعة واحدة وخفيفا في مجموعة أخرى. على سبيل المثال ، في التجربة في الشكل 4 ، تم تحفيز EAE في أنثى النوع البري (WT) والفئران مع حذف في OGR1 (OGR1 KO) باستخدام MOG p35-55 / CFA بالإضافة إلى PTX. أصيبت الفئران في مجموعة WT ب EAE شديد مع شلل كامل ، في حين أن مجموعة خروج المغلوب OGR1 أصيبت بمرض خفيف. يتوافق هذا الاختلاف في النتيجة السريرية مع اختلاف في جزء الأرباع التي تحتوي على آفات سحائية فرعية (الشكل 4C).
من المهم استكمال تسجيل الآفات المزيلة للميالين بجزء مساحة النسبة المئوية لتلطيخ المايلين لالتقاط مدى فقدان المايلين و / أو المحاور العصبية الميالينية أثناء هجوم المناعة الذاتية. في المثال الوارد في الشكل 4 ، اختلفت نسبة المايلين أيضا بشكل ملحوظ بين الفئران OGR1 و WT (الشكل 4D). يرتبط جزء المايلين في المائة أيضا ارتباطا كبيرا بدرجة EAE التراكمية في الفئران المصابة ب EAE (الشكل 4E) ، وبالتالي فهو بمثابة مقياس جيد لتلف الأنسجة الكلي في هذا المرض. لاحظ أن هذا البروتوكول لا يميز شدة صبغة المايلين. إذا كانت هذه هي النتيجة المرجوة ، فيجب على المرء إجراء تلطيخ مناعي لبروتينات المايلين مثل بروتين البروتيوليبيد أو بروتين المايلين الأساسي وقياس شدة هذا التلطيخ.
في الحالة التي يكون فيها EAE شديدا في كلتا المجموعتين المقارنتين ، سيحتوي جزء أعلى من أرباع الحبل الشوكي على آفات التهابية / مزيل للميالين. في هذه الحالة ، فإن النهج الأكثر حساسية لتسجيل الالتهاب هو حساب عدد كريات الدم البيضاء CD45 + لكل مم2 مادة بيضاء (انظر التلوين التمثيلي في الشكل 3 أ). يكتشف استنساخ الأجسام المضادة CD45 الموصوف هنا جميع كريات الدم البيضاء المتسللة ، ويلطخ فقط الخلايا الدبقية الصغيرة العرضية التي تنظم تعبير CD45 في EAE (انظر السهم المفتوح في الشكل 3B) وبالتالي فهي مفيدة في التقاط تسلل الخلايا المناعية الطرفية.
في دراسات EAE طويلة المدى (>20 يوما) ، يوصى بإجراء تحليل لإصابة المحور العصبي. يعد تلطيخ SMI-32 في أقسام الحبل الشوكي طريقة حساسة للكشف عن المحاور التالفة. على الرغم من أن الالتهاب في الحبل الشوكي ينحسر مع مرور الوقت ويمكن للمحاور العصبية التي تم تجنيبها إعادة الميالين ، فإن المحاور الباقية تظهر مدى تفاضلي للإصابة المتبقية9 (الشكل 3G ، H). على سبيل المثال ، في نموذج MOG p35-55 الناجم عن EAE في الفئران C57BL6 / J ، فإن مدى إصابة المحور العصبي وفقدانه هو محرك للدرجات السريرية بعد أن هدأت العملية الالتهابية9. يوضح الشكل 5 مثالا على ذلك في تجربة EAE في ذكور وإناث الفئران WT والفئران التي تعاني من نقص في جين يسمى دلتا مستقبلات التكاثر البيروكسيسوم المنشط (PPAR-delta) في المقصورة النخاعية (LysMCre: Ppardfl / fl). في الذكور ، استعادت الفئران WT وظيفة الأطراف الخلفية ، ومع ذلك ظلت الدرجات السريرية مرتفعة في الذكور LysMCre: Ppardfl / fl group. على النقيض من ذلك ، في التجربة التي أجريت على الإناث ، حصلت كلتا المجموعتين التجريبيتين على درجات عالية طوال الوقت. للوهلة الأولى ، أشارت هذه النتيجة إلى أن PPAR-delta كان له تأثير خاص بالجنس في EAE. ومع ذلك ، كشف التسجيل المرضي للحبل الشوكي أن الفئران من كلا الجنسين في مجموعة LysMCre: Ppardfl / fl قد زادت من إصابة المحور العصبي مقارنة بنظيراتها من WT (الشكل 5B). من المحتمل ألا يلاحظ تأثير النمط الجيني على الدرجات السريرية في الإناث لأن إناث الفئران WT تميل إلى إظهار إصابة محورية متزايدة ، والتي تتجلى في عجز عصبي مزمن.
في هذه التجربة نفسها ، تم العثور على إناث إناث LysMCre: Ppardfl / fl إناث الفئران لديها تسلل أكثر شمولا للخلايا التائية في المخيخ ، مما يوفر مثالا على كيف يمكن أن يكون تسجيل التهاب الدماغ مفيدا في EAE. في EAE ، يوجد الالتهاب في الدماغ في الغالب في المخيخ وجذع الدماغ (الشكل 6A ، D ، G) ، ولكن يمكن العثور عليه أيضا في السحايا (يظهر تحت الحصين في الشكل 6C) ، بالقرب من البطينين (الشكل 6F) ، ومسارات المادة البيضاء الأخرى بما في ذلك العصب البصري والجسم الغروي (الشكل 6B ، E). يتم تسجيل التهاب الدماغ في منطقة معينة من الدماغ (على سبيل المثال ، المادة البيضاء المخيخية) عن طريق حساب عدد خلايا CD45 لكل مم2 منطقة الأنسجة باستخدام نفس المنهجية الموضحة لبروتوكول الحبل الشوكي. في طريقة الكسب الموضحة هنا، يوجد قطع في منتصف المخيخ، وهو ما يوفر منظور المخيخ وساق الدماغ كما هو موضح في الشكل 6 أ.
أصبح قياس sNF-L باستخدام مقايسة SIMOA علامة حيوية مفيدة لتقييم الإصابة المحورية المستمرة والاستجابات للعلاج في MS20،21،27،28 الانتكاسي. يمكن تطبيق نفس مجموعة فحص SIMOA المستخدمة لقياس بشر sNF-L لقياس الماوس sNFL22،23،24. لاستكشاف مدى جودة أداء هذا الفحص في الكشف عن الإصابة المحورية في EAE ، تم قياس sNF-L في إناث الفئران C57BL6 / J في نقطة نهاية تجربة EAE وتمت مقارنة المستويات بتلك الموجودة في الفئران الضابطة الصحية المتطابقة مع الجنس والتي لم يكن لديها EAE. وجد أن الفئران المصابة ب EAE لديها مستويات أعلى بكثير من sNF-L مقارنة بالفئران السليمة (الشكل 7A) وترتبط هذه المستويات بكثافة محاور SMI-32 + في الحبل الشوكي (الشكل 7B). بالمقارنة مع التسجيل النسيجي للإصابة المحورية ، فإن اختبار SIMOA أسرع (من نزيف الفئران إلى النتائج التي يمكن تحقيقها في ما يزيد قليلا عن نصف يوم) وبالتالي يوفر ردود فعل سريعة حول كيفية عمل العلاج في الفئران الحية. يتميز هذا الفحص أيضا بأنه يعكس إصابة المحور العصبي في كل من الحبل الشوكي والدماغ.

الشكل 1: كتلة البارافين التمثيلية لأقسام الدماغ والحبل الشوكي. يتم تضمين أقسام الدماغ الإكليلية الخمسة والمقاطع العرضية للحبل الشوكي (بسمك 1.5-2 مم) في نفس الكتلة بحيث يمكن قطعها في قسم واحد. يجب تضمين ما لا يقل عن 15 قسما من الحبل الشوكي ، مما يسمح بالاختيار المناسب للأقسام للتحليل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
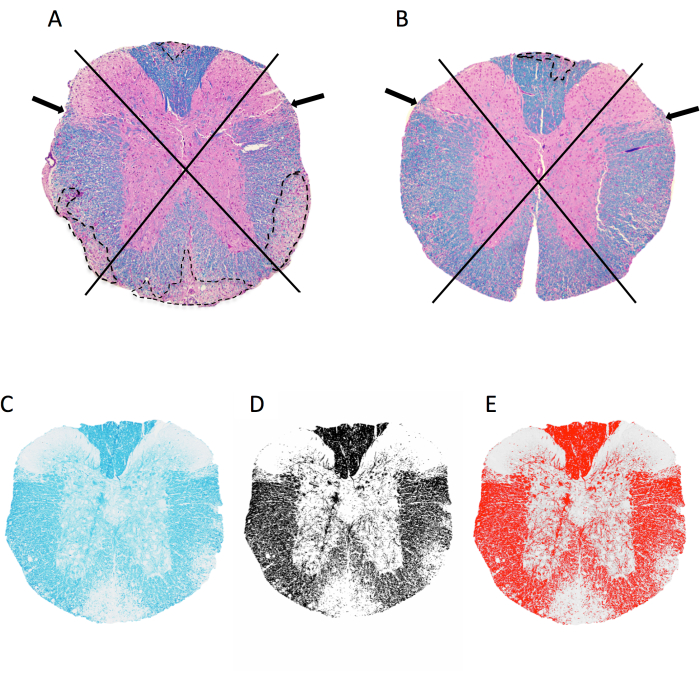
الشكل 2: تسجيل الالتهاب السحائي والنسبة المئوية لمنطقة الميالين على مستوى الحبل الشوكي الصدري. (أ ، ب) عرض صور للحبل الشوكي الصدري من أنثى فأر C57BL6 / J مع EAE الناجم عن MOG p35-55 الملون ب LFB / H&E. الموضح هو النهج المستخدم لتصور الأرباع وأمثلة الآفات المزيلة للميالين (تتبع في خط منقط). يحتوي الفأر في A على 4 من 4 أرباع مع آفات مزيل للميالين متقاربة ، بينما يحتوي الماوس في B على 1 من 4 أرباع متأثرة. يعاني الفأر في B من بعض الالتهابات في الأرباع الأخرى ، لكن هذا لم يتجلى في آفة متقاربة وبالتالي لم يتم تسجيله. (ج–ه) مثال على صورة LFB والصورة ذات التدرج الرمادي والعتبة في imageJ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
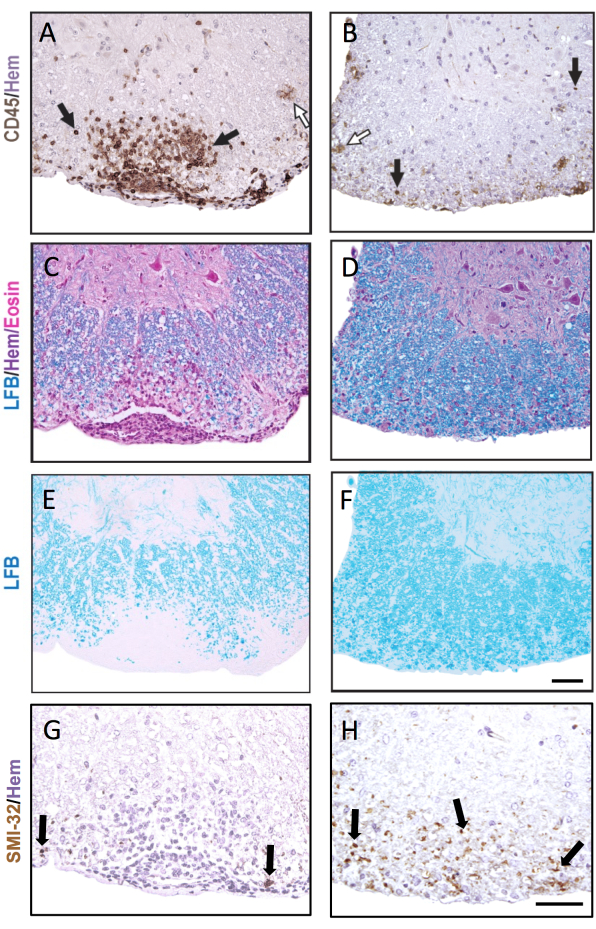
الشكل 3: أقسام الحبل الشوكي ملطخة ب CD45 و LFB H&E و LFB و SMI-32. أمثلة على آفة سحائية فرعية مبكرة (A ، C ، E ، G) ومتأخرة (B ، D ، F ، H) في الحبل الشوكي ملطخة بالجسم المضاد CD45 (A ، B) ، LFB / H &E (C ، D) ، LFB وحده (E ، F) ، والجسم المضاد SMI-32 (G ، H). توضح الأسهم السوداء أمثلة على الخلايا الملطخة بكل جسم مضاد. تظهر الأسهم البيضاء الخلايا الدبقية الصغيرة المفترضة التي تم تلطيخها ك CD45 +. شريط المقياس = 50 ميكرومتر. يوضح هذا الشكل تلطيخا تمثيليا للآفات في الحبل الشوكي لأنثى فأر C57BL6 / J أثناء EAE ويسلط الضوء على كيف يمكن أن يكون علم الأمراض مختلفا عبر أقسام الحبل الشوكي المختلفة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
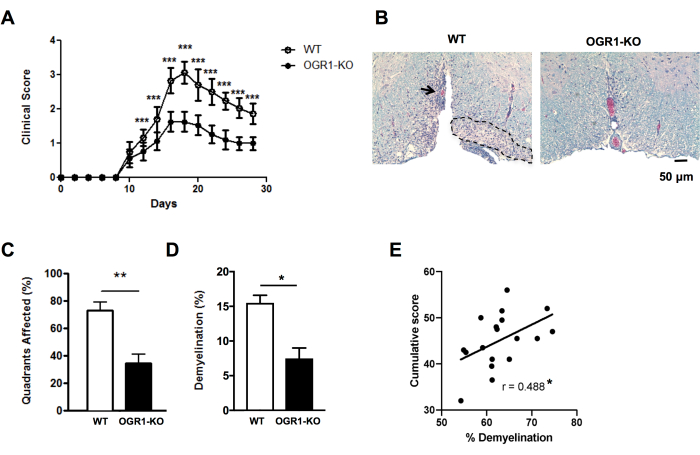
الشكل 4: تطبيق التهديف للآفات والنسبة المئوية لإزالة الميالين في EAE. يظهر مثال على تجربة EAE حيث طورت إناث الفئران التي تعاني من نقص في جين المستقبلات المقترنة بالبروتين G (OGR1) في سرطان المبيض على خلفية C57BL6 / J EAE سريري أقل حدة من إناث الفئران C57BL6 / J من النوع البري (WT). تم تحفيز EAE عن طريق التحصين باستخدام MOG p35-55 / CFA بالإضافة إلى PTX وتم تسجيل الفئران وفقا للمقياس السريري التالي: 1 = شلل الذيل. 2 = ضعف الأطراف الخلفية والقدم ، 3 = شلل الأطراف الخلفية ، 4 = ضعف الأطراف الأمامية ، 5 = احتضار. (أ) متوسط + درجات SEM السريرية للفئران بمرور الوقت. (ب) الموضح مثال على تلطيخ LFB/H&E في الحبل الشوكي البطني. شريط المقياس = 50 ميكرومتر. (ج) متوسط + أرباع النسبة المئوية SEM التي تحتوي على آفات مزيل للميالين. د: المتوسط + نسبة إزالة الميالين في كل مجموعة. (E) تظهر نتيجة من تجربة أخرى في EAE المستحث ب MOG p35-55 في الفئران C57BL6 / J حيث تم جمع درجات EAE للفئران الفردية على مدار 30 يوما من الملاحظة وكانت مرتبطة بنسبة إزالة الميالين في الحبل الشوكي. تم إجراء الارتباطات باستخدام اختبار سبيرمان. اللوحات في (A-D) مقتبسة من Souza C et al.29. البيانات الواردة في (ه) هي بيانات أصلية. *ف<0.05، **ف<0.01، ***ف<0.001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
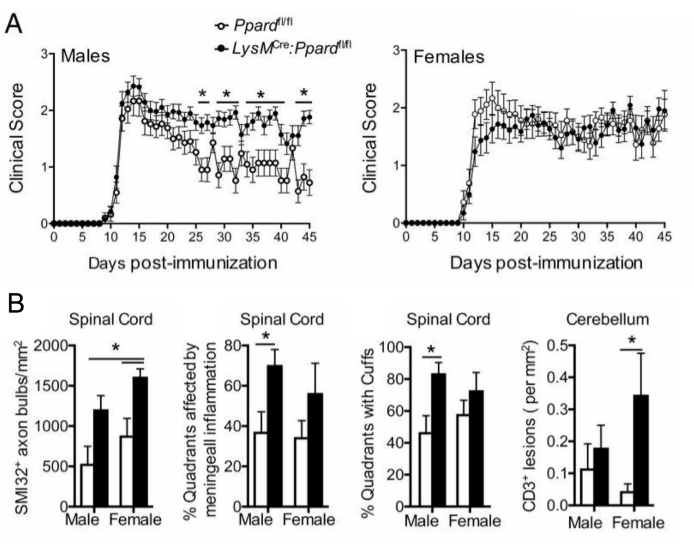
الشكل 5: تطبيق تلطيخ SMI-32 لفهم تأثير النمط الجيني على النمط الظاهري EAE السريري. يوضح هذا الشكل مثالا على تجربة EAE حيث تم تحصين النوع البري من الذكور والإناث (يحمل أليل Ppard) والفئران الطافرة Ppard الخاصة بالنخاعي (LysMCre: Ppardfl / fl) على خلفية C57BL6 / J باستخدام MOG p35-55 / CFA و PTX وتمت متابعتها لمدة 45 يوما. (أ) يوضح متوسط + الدرجات السريرية SEM للفئران. (B) يظهر متوسط + نتائج SEM للتسجيل النسيجي لعدد محاور SMI-32 + في الحبل الشوكي ، والأرباع٪ مع الآفات تحت السحائية ، والأرباع المئوية مع الأصفاد المحيطة بالأوعية الدموية ، والآفات #CD3 في المخيخ لكل مم2 الأنسجة. أظهرت هذه التجربة تأثير النمط الجيني على تلطيخ SMI-32. هذا الرقم مقتبس من دروهوميريكي. وآخرون.15. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
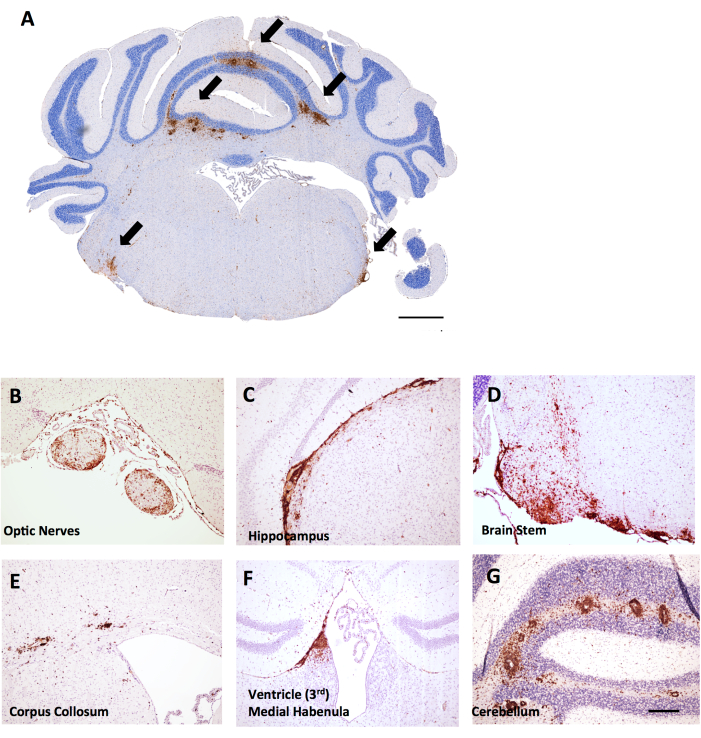
الشكل 6: أمثلة على تلطيخ CD45 + / الهيماتوكسيلين في أقسام إكليل الدماغ في EAE الناجم عن MOG p35-55 في إناث الفئران C57BL6 / J. تظهر آفات CD45+ باللون البني. أ: آفات CD45+ في جذع الدماغ للأقسام الإكليلية. شريط المقياس = 150 ميكرومتر. (ب–ز) أمثلة على آفات CD45 + في الأعصاب البصرية (B) ، والامتدادات السحائية تحت الحصين (C) ، وجذع الدماغ (D) ، والجسم الغروي (E) ، والحبال الإنسي بالقرب من البطين (F) ، والمخيخ (G). شريط المقياس: (B-G) = 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
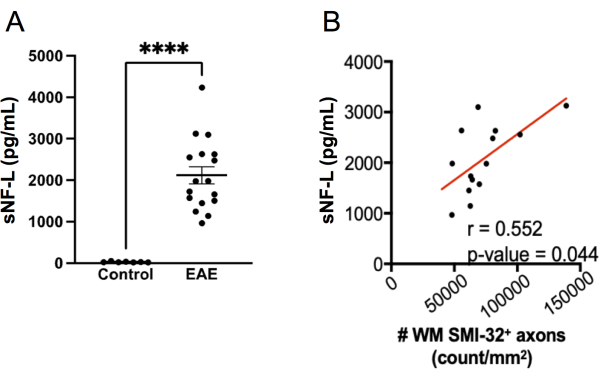
الشكل 7: مستويات sNF-L في المصل في EAE المستحث ب MOG p35-55. (أ) مستويات مصل NFL التي تم جمعها من إناث التحكم وفئران EAE في نقطة نهاية تجربة واحدة. تم تحليل البيانات باستخدام اختبار مان ويتني ثنائي الذيل. (**** قيمة p < 0.0001). (ب) قطعت أجزاء الحبل الشوكي عند نقطة النهاية وصبغت ب SMI-32. تم تحديد عدد الخلايا الإيجابية لكل منطقة أنسجة المادة البيضاء وربطها بمصل NF-L عند نقطة النهاية باستخدام اختبار سبيرمان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول التكميلي 1: وصف الحمامات المستخدمة في معالجة الأنسجة. يتم نقل الكاسيت تلقائيا عبر هذه السلسلة من الحمامات باستخدام معالج آلي. الرجاء الضغط هنا لتنزيل هذا الملف.
الجدول التكميلي 2: خطوات تلطيخ Luxol Fast Blue و Hematoxylin و Eosin. يوضح هذا الجدول ترتيب الخطوات في بروتوكول تلطيخ Luxol Fast Blue و Hematoxylin و Eosin. الرجاء الضغط هنا لتنزيل هذا الملف.
الجدول التكميلي 3: الأجسام المضادة المستخدمة في تلطيخ المناعة الكيميائية. الموصوفة هي الأجسام المضادة المستخدمة في هذا البروتوكول وكذلك تلك التي يمكن استخدامها لمزيد من استكشاف الالتهاب ، microgliosis ، و astrogliosis. الرجاء الضغط هنا لتنزيل هذا الملف.
الجدول التكميلي 4: كيفية تحويل ملفات .czi إلى ملفات TIFF. لاحظ أنه من الأفضل استخدام صورة عالية الدقة ، ولكن يمكن حفظ الصور متوسطة الدقة بدلا من ذلك إذا كانت الذاكرة العاملة للكمبيوتر محدودة. من الضروري استخدام صور بنفس الدقة عبر التحليلات. لاحظ أيضا أن الصورة الأخيرة للسلسلة هي تسمية الشريحة. تجنب قراءة الملصق للتأكد من أن التحليل أعمى. 30,31 الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يعد التلوين النسيجي للحبل الشوكي أداة مهمة في تقييم شدة مرض EAE ، لا سيما في الحالات التي توجد فيها اختلافات بين مجموعات العلاج في مدى الشفاء من المرض في مرحلة ما بعد الحادة من المرض. يساعد تلطيخ تسلل الخلايا المناعية (CD45) والمايلين (LFB) وإصابة المحور العصبي (SMI-32) على توصيف السبب الكامن وراء تغيير الدرجات السريرية في الفئران. يوفر بروتوكول التلوين النسيجي الموصوف هنا منظورا للالتهاب بالإضافة إلى مدى إصابة المايلين والمحور العصبي. علاوة على ذلك ، فإن النتائج الموضحة تثبت صحة قياس sNF-L كطريقة لتقييم مدى الضرر العصبي الكلي في EAE.
تتمثل المعلمات الحاسمة لهذا التحليل في التأكد من أن الباحثين أعمى عن هوية الأقسام وأن هناك عينات مكافئة في كل مستوى من مستويات الحبل الشوكي عبر الفئران المختلفة. وذلك لأن شدة الالتهاب يمكن أن تكون أكبر في المستويات المنخفضة من الحبل السري. معلمة مهمة أخرى هي حجم المجموعات التجريبية. عادة ما يتم حصاد الحبل الشوكي والأدمغة من 6-8 فئران لكل مجموعة عند نقطة النهاية لرؤية اختلافات كبيرة بين المجموعات ذات العلاجات أو الأنماط الجينية ذات أحجام التأثير المتواضعة. من المهم أيضا التأكد من أن الفئران المختارة ، عند حساب متوسطها ، لديها درجات متوسطة تمثيلية للمجموعة بأكملها. فيما يتعلق باستكشاف الأخطاء وإصلاحها ، فإن المشكلة الشائعة التي يواجهها أولئك الذين يفتقرون إلى الخبرة في البروتوكول هي أن الحبل الشوكي ثابت لفترة زمنية غير كافية ولا يمكن بثقه بسهولة من العمود الفقري. إذا كانت هذه هي الحالة ، يمكن تشريح الحبل الشوكي يدويا من العمود عن طريق القص على طول العمليات الشائكة باستخدام مقص دقيق وفتح العمود للكشف عن الحبل الشوكي. بدلا من ذلك ، يمكن إصلاح الأنسجة لبضعة أيام إضافية دون التدخل في نجاح تلطيخ الأجسام المضادة. استنساخ الأجسام المضادة الموصوفة هنا تعمل في الأنسجة الثابتة تصل إلى 2 أسابيع في الفورمالين.
يتطلب تضمين قطع الحبل الشوكي مهارة وممارسة. يوصى بارتداء عدسات العين وتوجيه مصباح فوق محطة التضمين لتصور أفضل لما إذا كانت الأقسام تسقط في المقطع العرضي أو في المقطع الطولي. إن الحفاظ على أطوال قطع الحبل الشوكي عند أقل من 2 مم أثناء الكسب سيساعدها على السقوط في المقطع العرضي. هناك مشكلة شائعة أخرى يواجهها المستخدمون الأقل خبرة وهي أن LFB يتبخر أثناء الحضانة الليلية ، تاركا نصف الشريحة ملطخة والنصف الآخر غير ملوث. لتجنب التبخر ، يجب إغلاق طبق تلطيخ الزجاج بغشاء لدن بالحرارة ثم غلاف بلاستيكي. في حالة حدوث التبخر وكانت المقاطع ملطخة بشكل غير متساو ، يوصى بإزالة اللون الأزرق تماما من الشرائح بكربونات الليثيوم وإعادة تلطيخها مرة أخرى في LFB طوال الليل. هناك مشكلة شائعة أخرى وهي أن المستخدمين لا يقومون بإزالة اللون الأزرق تماما من المادة الرمادية بعد LFB. من الأهمية بمكان فحص الأقسام الفردية تحت المجهر للتأكد من الوصول إلى قدر كاف من إزالة اللون الأزرق قبل الشروع في الخطوات الأخرى في البروتوكول. بالإضافة إلى ذلك ، على الرغم من أن بقع CD45 و SMI-32 IHC تعمل بقوة ، إلا أنه لا يزال من المهم استكشاف تركيزات الأجسام المضادة وإصلاحها في التجارب الأولية لكل دفعة جديدة من الأجسام المضادة يتم تلقيها. يمكن القيام بذلك عن طريق اختبار مجموعة متنوعة من تركيزات الجسم المضاد في قسم التحكم الإيجابي (الحبل الشوكي EAE). يجب أن يتضمن التلوين لأول مرة أيضا تحكما سلبيا يتكون من جسم مضاد ثانوي وحده دون إضافة جسم مضاد أولي. أخيرا ، من الأهمية بمكان في تحليل الصور عتبة الصور الفردية لأن التلوين يمكن أن يكون غير متساو عبر الشرائح أو الأقسام.
يستخدم هذا البروتوكول البرامج المتاحة مجانا. إذا لم يكن لدى المرء إمكانية الوصول إلى معالج أو مضمن أو ميكروتوم ، فيمكن الحصول على هذه الخطوات إلى نواة علم الأمراض في المستشفى التي تقدم هذه الخدمات. أيضا ، إذا لم يكن لدى المرء إمكانية الوصول إلى ماسح الشرائح ، فيمكن للمرء استخدام مجهر ضوئي مزود بكاميرا فيديو لحفظ صور TIFF للحبل الشوكي أو مناطق الدماغ. لسير العمل القائم على المجهر ، التقط أقسام LFB أو LFB / H&E بطاقة منخفضة (تكبير 40x) ولتلوين CD45 و SMI-32 ، تخيل أربع نوافذ على الأقل متمركزة في الأجزاء البطنية والظهرية والجانبية من الحبل الشوكي (تكبير 200x ل CD45 وتكبير 400x ل SMI-32). يمكن إجراء تحليل الصور على هذه الصور لتحديد التلوين بطريقة مماثلة كما هو موضح.
يعتمد قرار النهج النسيجي الذي يجب اتباعه لتسجيل EAE على مدى اختلاف الدرجات السريرية بين المجموعات. على سبيل المثال ، إذا كانت هناك اختلافات جذرية في النتيجة السريرية EAE (حصلت مجموعة واحدة على EAE والأخرى لم تحصل عليها) ، فإن هذا يتعلق عادة بالاختلافات في الالتهاب المحيطي. في هذه الحالة ، يكون تسجيل وجود آفات مزيل للميالين على الأقسام الملطخة ب LFB / H &E كافيا وسيكشف عن الاختلافات بين المجموعات. إذا كانت المجموعات أكثر تشابها في النتيجة السريرية في البداية وكانت هناك اختلافات بدلا من ذلك في مدى الشفاء السريري (مثل التجربة في الشكل 5 أ) ، فمن الأفضل تطبيق سير العمل النسيجي الكامل الموضح هنا ، بما في ذلك تسجيل التهاب الدماغ في جذع الدماغ والمخيخ ، لتمييز ما إذا كانت الاختلافات المزمنة للمرض تتعلق بالاختلافات في الالتهاب أو تلف الأنسجة. إذا تم العثور على اختلافات في الالتهاب كما تم تقييمها من خلال حساب CD45 ، فيمكن إجراء المزيد من دراسات IHC لتلطيخ الخلايا التائية (المضادة ل CD3) ، وتسلل الخلايا الوحيدة / الضامة (Mac3) والدبقية الصغيرة (Iba-1 / TMEM119) (مستنسخات الأجسام المضادة الموصى بها موجودة في الجدول التكميلي 3). ينعكس تنشيط الخلايا الدبقية الصغيرة من خلال زيادة شدة تلطيخ Iba-1 على الخلايا الدبقية الصغيرة Iba-1 + TMEM-19 + ذات العلامات المزدوجة وزيادة تراجع عمليات الخلايا الدبقية الصغيرة التي يمكن تقييمها من خلال تحليل Sholl في الأقسام32. علاوة على ذلك ، يمكن تطبيق تقنيات مثل قياس التدفق الخلوي أو تسلسل الحمض النووي الريبي أحادي الخلية لإجراء توصيف أعمق لتواتر ونمط ظاهري مجموعات المناعة في الدماغ والحبل الشوكي.
يعد عد محاور SMI-32 + طريقة حساسة للكشف عن إصابة المحور العصبي في EAE32,33 وفي MS34. SMI-32 ، الذي يكتشف الشكل غير المفسفر من الخيوط العصبية الثقيلة أو المتوسطة يتراكم في المصابيح النهائية للخلايا العصبية المعبرة. بديل للكشف عن المحاور المصابة هو تلطيخ ببروتين السلائف الأميلويد (APP) الذي يمكن أن يتراكم في المحاور نتيجة لتعطل نقل المحورالعصبي 33. نمط تلطيخ SMI-32 و APP على الرغم من أن كلاهما يعكس إصابة محور عصبي ، إلا أنهما لا يتداخلان عادة ، مما يشير إلى أنهما يكتشفان أمراضا مختلفة33. يمكن للمرء أيضا استكمال المقاييس النسيجية لإصابة المحور العصبي عن طريق قياس sNF-L ، وهو مقياس سريع وحساس للإصابة المحورية المستمرة في كل من الحبل الشوكي والدماغ. يوفر ميزة أنه يمكن القيام به في نصف يوم في الفئران الحية. عيب هذه الطريقة هو أن المجموعات باهظة الثمن والآلة متخصصة للغاية. تقدم الشركة التي تبيع مجموعة sNF-L رسوما مقابل الخدمة لأولئك الذين ليس لديهم إمكانية الوصول إلى جهاز SIMOA. بديل لتقييم إصابة المحور العصبي هو تسجيل فقدان المحور إما عن طريق حساب المحاور العصبية في الأجزاء الملطخة باللون الأزرق من التولويدين من الحبل الشوكي12 أو حساب حزم الخيوط العصبية المكتشفة بواسطة SMI-31 في مناطق المادة البيضاء للحبل الشوكي32. كلاهما نهج أكثر شاقة من قياس SMI-32 أو sNF-L.
إذا اختلفت الدرجات السريرية ل EAE بين المجموعات ، ولكن تسجيل الالتهاب وإزالة الميالين وإصابة المحور العصبي لا يكشف عن الاختلافات بين المجموعات ، فقد يكون من المفيد تلطيخ تنشيط الخلايا النجمية باستخدام GFAP (انظر الجدول التكميلي 3 لاستنساخ الأجسام المضادة الموصى به). يرتبط تنشيط الخلايا النجمية بزيادة تلطيخ GFAP وقد ثبت أن هذا يرتبط بتقدم EAE في بعض نماذج EAE بما في ذلك EAE المزمن في DArat 35.
في الختام ، يصف هذا البروتوكول الطرق ويوفر سير عمل تحليلي لإجراء التسجيل النسيجي ل EAE.
Disclosures
شانون دن تستشير ل FSD Lucid Psycheceuticals.
Acknowledgements
نشكر الدكتور ريموند سوبل (جامعة ستانفورد) على إظهار طريقته في تحقيق وإصلاح أقسام الدماغ والحبل الشوكي. نشكر كايل روبرتون وميلان جانجولي من مركز تورنتو لعلم الظواهر لتعلم طريقة التضمين وقطع العديد من أقسام الدماغ والحبل الشوكي. نشكر الدكتور ماثيو كوسيك والدكتور روبرت فوجينامي (جامعة يوتا) على مشاركة بروتوكولاتهما لتسجيل الالتهاب تحت السحائي وحول الأوعية الدموية في الحبل الشوكي. نشكر شالينا عثمان على مشاركة استنساخ الجسم المضاد CD45. نشكر Xiofang Lu على التدريب على معالج الأنسجة ومحطة تضمين الأنسجة وصيانة هذه المعدات في مركز أبحاث كينان للبحوث الطبية الحيوية في مستشفى سانت مايكل. تم دعم هذا العمل من خلال منحة طبية حيوية من MS Canada (إلى SED). يتم دعم كارمن أوتشيفيري من قبل منحة دراسية من حكومة كندا. يتم دعم نوريا ألفاريز سانشيز من قبل زمالة كينان لما بعد الدكتوراه.
Materials
| Name | Company | Catalog Number | Comments |
| 10% Neutral Buffered Formalin | Sigma Aldrich | HT501128-4L | Used to fix spinal cord and brain specimens |
| 1000 mL Glass Beaker | Pyrex | 1000 | |
| 15 mL Falcon Tube | Starstedt | 62.554.100 | Fixing and storing spinal cord and brain |
| 250 mL Erlenmeyer Flask | Pyrex | 4980 | |
| 500 mL Glass Beaker | Pyrex | 1003 | |
| 92 mm x 16 mm Petri Dishes | Starstedt | 82-1473-001 | Used in the tissue grossing procedure |
| 95% Ethyl Alcohol | Commercial Alcohols | P016EA95 | Dehydration and rehydration steps |
| ABC Elite Kit | Vector Labratories | PK6100 | Used for immunohistochemistry labeling |
| Aqua Hold 2 PAP Pen | Cole Parmer | UZ-75955-53 | Used for drawing around tissue sections in Immunohistochemical Staining |
| Avidin/Biotin Blocking Kit | Vector Labratories | SP-2001 | |
| Biosafety Cabinet | Any | ||
| Biotinylated rabbit anti-rat IgG | Vector Labratories | BA-4000 | Used for CD45 staining |
| C57BL6/J Mice | Jackson Laboratory | Stock # 664 | These mice were used in experiments shown in paper. |
| Centrifuge | Thermo Fisher Scientific | Sorvall ST Plus | |
| CitriSolv | Fisher Scientific | 04-355-121 | Used for de-waxing. Is an alternative to xylene |
| DAB Kit | Vector Labratories | SK-4100 | Used for developing in immunohistochemistry |
| ddH2O | - | - | |
| Disposable Scalpel | Magna | M92-10 | Used for grossing spinal cord and brain |
| DWK Life Sciences (Wheaton) glass staining dish | Cole Parmer | UZ-48585-60 | Used for histochemical staining and washes |
| DWK Life Sciences (Wheaton) glass staining rack | Cole Parmer | 10061392 | Used for immunohistochemistry and histochemistry |
| Eosin Y | Bioshop | 173772-87-1 | Stains cytoplasm |
| Feather Microtome Blades | Fisher Scientific | 12-634-1C | Used for sectioning paraffin |
| Filter Paper | Whatman | 1001110 | Used to filter the formalin (during grossing) and the luxol fast blue |
| Fine Surgical Scissors | Fine Science Tools | 14160-10 | Used to snip brain and the skull |
| Fumehood | Any | ||
| Gibco DPBS | Fisher Scientific | 14190944 | |
| Glacial Acetic Acid | BioShop | ACE333.4 | Used in the luxol fast blue staining procedure |
| Histoplex Histology Containers | Starplex Scientific | 565-060-26 | Fixing spinal cord and brain |
| Hydrogen Peroxide | Fisher Chemicals | H325-500 | Used to remove endogenous peroxidase in the tissue |
| ImageJ | NIH | https://imagej.nih.gov/ij/download.html | |
| Kimtech Science Kimwipes | Kimberly Clark Professional | 34155 | Used for immunohistochemistry |
| Lens paper | VWR | 52846-001 | Used for trapping spinal cord species in cassette during processing |
| Light microscope | Any | ||
| Lithium carbonate | Sigma Aldrich | 554-13-3 | De-blueing after luxol fast blue staining |
| Luxol blue | Sigma Aldrich | 1328-51-4 | Stains CNS myelin |
| M.O.M Immunodetection Kit | Vector Labratories | BMK-2202 | Used to stain SMI-32 |
| Methanol | Fisher Chemicals | A454.2 | Used for fixation |
| Mayer's Hematoxylin | Electron Microscopy Sciences | 26381-02 | Stains nuclei |
| Micro-Adson Forceps with Teeth | Fine Science Tools | 11027-12 | Used for reflecting the skull during dissections |
| Microcentrifuge | Eppendorf | Model 5417R | |
| Microvette Capillary Tubes CB 300 Z | Starstedt | 16.440.100 | Used for blood collection |
| Micrscope Cover Glass | Fisher Scientific | 12545A | Used for coverslipping |
| Mini Shaker | VWR | 12620-938 | Used for making buffers |
| NF light kit | Quanterix | 103186 | This kit can be used for detection of mouse or human soluble neurofilament in serum |
| Nitrile Gloves | VWR | 76307-462 | Safety |
| Normal Goat Serum | Vector Labratories | S-1000 | Blocking reagent |
| Normal Rabbit Serum | Vector Labratories | S-5000 | Blocking reagent |
| OmniSette Tissue Cassettes | Fisher Scientific | M4935FS | Used for embedding spinal cord and brain |
| p1000 Pipette and Tips | various | ||
| p200 Pipette and Tips | various | ||
| Paraffin Embedding station | Leica Biosystems | Model EG1160 | |
| Paraplast Tissue Infiltration/Embedding Medium | Leica Biosystems | 39601006 | Used for embedding spinal cord and brain |
| Permount Mounting Medium | Fisher Chemicals | SP15-100 | Used for mounting coverslips on slides |
| pH meter | Fisher Scientific | 13636AB315B | Used for pHing buffers |
| Plastic Transfer Pipettes | Fisher Scientific | 13-711-20 | Used for pHing buffers |
| Potassium Chloride | BioShop | 7447-40-7 | Used for making PBS |
| Potassium Phosphate Monobasic | BioShop | 7778-77-0 | Used for making PBS |
| Pressure Cooker | Nordic Ware | Tender Cooker | |
| Purified rat anti-mouse CD45 | Vector Labratories | 553076 | Detects leukocytes |
| Reagent grade alcohol 100% | VWR | 89370-084 | Dehydration and rehydration steps |
| Reagent grade alcohol 70% | VWR | 64-17-5 | Dehydration and rehydration steps |
| Rotary Microtome | Leica Biosystems | Model RM2235 | |
| Simoa Machine | Quanterix | HD-X | |
| Slide Scanner | Zeiss | AxioScan.Z1 | |
| SMI-32 mouse IgG1 antibody | Biolegend | 801701 | Detects damaged axons |
| Sodium Chloride | BioShop | 7647-14-5 | Used for making PBS |
| Sodium Phosphate Dibasic | Bioshop | 7558-79-4 | Used for making PBS |
| Standard Adson Forceps | Fine Science Tools | 11150-10 | Used for dissection steps |
| Superfrost Plus Microscope slides | Fisher Scientific | 12-550-15 | Used to collect sections |
| Surgical Tough Cuts | Fine Science Tools | 14110-15 | Used to cut through the spine, body wall, and skin |
| Tissue Processor | Leica Biosystems | Model TP1020 | |
| Tri-soldium citrate | Thermo Fisher Scientific | 03-04-6132 | Used for antigen retrieval |
| Tween-20 | BioBasic | 9005-64-5 | Used for washing sections |
| X-P Pierce XP-100 plate seal | Excel Scientific | 12-140 | Used for the sNF-L Assay |
| Xylene | Fisher Chemicals | 1330-20-7 | Used for de-waxing and clearing sections |
| Funnel | Cole Parmer | RK-63100-64 | Used to filter formalin before grossing tissue |
| Stir Plate | Any | Used to make solutions | |
| Oven | Any | Used to bake tissue sections after cutting | |
| Parafilm | Bemis | 13-374-10 | Used to seal LFB staining dish |
| Microwave | Any | Timing may vary depending on the microwave model | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | 9048-46-8 | Used to make blocking buffer |
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 05-408--129 | Used to store mouse serum samples |
| Vortex | Any | Used to prepare samples for sNF-L assay | |
| Waterbath | Any | Used to warm enzyme substrate for sNF-L assay |
References
- Constantinescu, C. S., Farooqi, N., O'Brien, K., Gran, B. Experimental autoimmune encephalomyelitis (EAE) as a model for multiple sclerosis (MS). Br J Pharmacol. 164 (4), 1079-1106 (2011).
- Rasouli, J., et al. Expression of GM-CSF in T is increased in multiple sclerosis and suppressed by IFN-beta therapy. J Immunol. 194 (11), 5085-5093 (2015).
- Zrzavy, T., et al. Loss of 'homeostatic' microglia and patterns of their activation in active multiple sclerosis. Brain. 140 (7), 1900-1913 (2017).
- Kutzelnigg, A., Lassmann, H. Pathology of multiple sclerosis and related inflammatory demyelinating diseases. Handb Clin Neurol. 122, 15-58 (2014).
- Glatigny, S., Bettelli, E. Experimental autoimmune encephalomyelitis (EAE) as animal models of multiple sclerosis (MS). Cold Spring Harb Perspect Med. 8 (11), (2018).
- Kipp, M., Nyamoya, S., Hochstrasser, T., Amor, S. Multiple sclerosis animal models: A clinical and histopathological perspective. Brain Pathol. 27 (2), 123-137 (2017).
- Nikic, I., et al. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat Med. 17 (4), 495-499 (2011).
- Croxford, A. L., et al. The cytokine GM-CSF the inflammatory signature of CCR2+ monocytes and licenses autoimmunity. Immunity. 43 (3), 502-514 (2015).
- Jones, M. V., et al. Behavioral and pathological outcomes in MOG 35-55 experimental autoimmune encephalomyelitis. J Neuroimmunol. 199 (1-2), 83-93 (2008).
- Zuo, M., et al. Age-dependent gray matter demyelination is associated with leptomeningeal neutrophil accumulation. JCI Insight. 7 (12), 158144 (2022).
- Bannerman, P. G., et al. Motor neuron pathology in experimental autoimmune encephalomyelitis: Studies in thy1-yfp transgenic mice. Brain. 128, 1877-1886 (2005).
- Cahill, L. S., et al. Aged hind-limb clasping experimental autoimmune encephalomyelitis models aspects of the neurodegenerative process seen in multiple sclerosis. Proc Natl Acad Sci U S A. 116 (45), 22710-22720 (2019).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1810-1819 (2006).
- Stromnes, I. M., Goverman, J. M. Passive induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1952-1960 (2006).
- Drohomyrecky, P. C. Peroxisome proliferator-activated receptor-delta acts within peripheral myeloid cells to limit the expansion of myelin-reactive T cells during experimental autoimmune encephalomyelitis (EAE). J. Immunol. 10, 2588-2601 (2019).
- Osorio-Querejeta, I., et al. The innovative animal monitoring device for experimental autoimmune encephalomyelitis ("I am D EAE"): A more detailed evaluation for improved results. Mult Scler Relat Disord. 63, 103836 (2022).
- Wang, C., et al. Induction and diverse assessment indicators of experimental autoimmune encephalomyelitis. J Vis Exp. (187), e63866 (2022).
- Shahi, S. K., Freedman, S. N., Dahl, R. A., Karandikar, N. J., Mangalam, A. K. Scoring disease in an animal model of multiple sclerosis using a novel infrared-based automated activity-monitoring system. Sci Rep. 9, 19194 (2019).
- Kluver, H., Barrera, E. A method for the combined staining of cells and fibers in the nervous system. J Neuropathol Exp Neurol. 12 (4), 400-403 (1953).
- Disanto, G., et al. Serum neurofilament light: A biomarker of neuronal damage in multiple sclerosis. Ann Neurol. 81 (6), 857-870 (2017).
- Novakova, L., et al. Monitoring disease activity in multiple sclerosis using serum neurofilament light protein. Neurology. 89 (22), 2230-2237 (2017).
- Pouzol, L., et al. Act-1004-1239, a first-in-class CXCR7 antagonist with both immunomodulatory and promyelinating effects for the treatment of inflammatory demyelinating diseases. FASEB J. 35 (3), 21431 (2021).
- Breakell, T., et al. Obinutuzumab-induced B-cell depletion reduces spinal cord pathology in a CD20 double transgenic mouse model of multiple sclerosis. Int J Mol Sci. 21 (18), 6864 (2020).
- Aharoni, R., et al. Neuroprotective effect of glatiramer acetate on neurofilament light chain leakage and glutamate excess in an animal model of multiple sclerosis. Int J Mol Sci. 22 (24), 13419 (2021).
- Sternberger, L. A., Sternberger, N. H. Monoclonal antibodies distinguish phosphorylated and nonphosphorylated forms of neurofilaments in situ. Proc Natl Acad Sci U S A. 80 (19), 6126-6130 (1983).
- Kuhle, J., et al. Serum neurofilament is associated with progression of brain atrophy and disability in early MS. Neurology. 88 (9), 826-831 (2017).
- Benkert, P., et al. Serum neurofilament light chain for individual prognostication of disease activity in people with multiple sclerosis: A retrospective modelling and validation study. Lancet Neurol. 21 (3), 246-257 (2022).
- D'Souza, C. A., et al. OGR1/GPR68 modulates the severity of experimental autoimmune encephalomyelitis and regulates nitric oxide production by macrophages. PLoS One. 11 (2), 0148439 (2016).
- Doroshenko, E. R., et al. Peroxisome proliferator-activated receptor-delta deficiency in microglia results in exacerbated axonal injury and tissue loss in experimental autoimmune encephalomyelitis. Front Immunol. 12, 570425 (2021).
- Soulika, A. M., et al. Initiation and progression of axonopathy in experimental autoimmune encephalomyelitis. J Neurosci. 29 (47), 14965-14979 (2009).
- Trapp, B. D., et al. Axonal transection in the lesions of multiple sclerosis. N Engl J Med. 338 (5), 278-285 (1998).
- Lassmann, H., Bradl, M. Multiple sclerosis: Experimental models and reality. Acta Neuropathol. 133 (2), 223-244 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved