Method Article
Floresan Mikroskop ile görselleştirme Tek molekül DNA replikasyonu
Özet
Bu protokol, gerçek zamanlı olarak bireysel replisomes DNA replikasyonu görselleştirmek için basit bir tek-molekül floresan mikroskopi tekniği gösterir.
Özet
Biz tek-molekül düzeyinde DNA replikasyonu gözlemlemek için basit bir floresan mikroskopi tabanlı gerçek zamanlı bir yöntem açıklanmaktadır. Dairesel, çatallı DNA örneğinin Fonksiyonlu bir cam lamel bağlı ve yaygın çoğaltma proteinleri ve nükleotidler (Şekil 1) girişten sonra çoğaltılır. Büyüyen ürün, çift iplikli DNA (dsDNA) laminer akış ile genişletilmiş ve intercalating boya kullanılarak görüntülenmiştir. Gerçek zamanlı olarak artan DNA sonu pozisyon ölçme çoğaltma oranının kesin tespiti (Şekil 2) sağlar. Ayrıca, tamamlanan DNA ürünlerin uzunluğu çoğaltma processivity raporlar. Bu deney, çok kolay ve hızlı bir şekilde gerçekleştirilen ve sadece makul ölçüde duyarlı bir kamera ile bir floresan mikroskop gerektirir.
Protokol
Tek bir molekül çoğaltma deneyi yapmadan önce, birkaç malzemeleri önceden hazırlıklı olmak gerekir.
1. DNA replikasyonu Şablonu
Çoğaltma reaksiyonu substrat standart moleküler biyoloji teknikleri 1,2 kullanılarak hazırlanmış bir biotinlenmiş, kuyruklu M13 yuvarlanma daire.
Malzemeler: M13mp18 tek iplikli DNA, biotinlenmiş kuyruk oligonükleotid astar (5'-Biotin-T 36 AATTCGTAAT CATGGTCATAGCTGTTTCCT-3 '), T7 DNA polimeraz, Isı blok, izoamil / Fenol Alkol / Kloroform
- TBS tampon (330 nM kuyruk oligo, 33 nM M13) oligo 10 kat daha fazla ekleyerek, M13 biotinlenmiş kuyruk oligo Tavlama.
- 65 ° C ısı bloğu karışımı ısıtın. Isıtmalı, ısı bloğu kapatın ve yavaş soğutma astar düzgün tavlama için izin.
- Astarlanmalıdır M13 64 nM T7 DNA polimeraz ve T7 çoğaltma tampon dNTP ve MgCl 2 içeren bir karışıma ekleyin.
- 37 ° C de 12 dakika reaksiyon inkübe ve 100 mM EDTA ile soğutun.
- Purify doldurulmuş ürün DNA, fenol / kloroform / izoamil alkol ekstraksiyonu ve TE tampon ya da başka bir uygun depolama tampon dialyze ve DNA konsantrasyonu (M13 astarlanmalıdır herhangi bir kalıntı kurtarmak için her organik faz geri-extract) belirlemek.
- Bir şablon hazırlık iterasyon kolayca tek-molekül deneyler binlerce yüzlerce yeterli, nanomolar konsantrasyon şablonu birkaç mililitre yapabilirsiniz.
2. Fonksiyonlu lameller
DNA cam lamel eklemek için, cam, daha sonra biotinlenmiş PEG moleküllere birleştiğinde bir aminosilane, ilk işlevselleştirildiyse. Bu kaplama yüzeyi 1,3 ile non-spesifik etkileşimler, DNA ve çoğaltma proteinler azaltmaya yardımcı olur .
Malzemeler: Cam lamelleri, Boyama kavanoz, 3-aminopropyltriethoxysilane, metoksi-PEG5k-NHS ester, Biotin-PEG5k-NHSester, Aseton, 1M KOH, Etanol, Fırın, Banyo sonikatör
- Cam kavanoz boyama ve etanol ile kavanoz dolum onları yerleştirerek lamelleri iyice temizleyin. 30 dakika boyunca sonikasyon ve kavanoz yıkayın ve 1 M KOH ile doldurun. 30 dakika hem yıkar tekrarlayın sonikasyon.
- Ilk işlevsellik tepki için, tüm su izlerini kaldırılması gerekir. 10 dakika aseton ve sonikasyon kavanozları doldurun. Aseton ile kavanoz tekrar durulayın.
- 2% v / v aseton silan reaktif bir çözüm hazırlayın. Boyama kavanoz ekleyin ve 2 dakika boyunca ajitasyon. Bu reaksiyon çiftler cam aminosilane alkoksi grup, bir sonraki kaplin adım için bir reaktif amin bırakarak. Büyük bir su fazlalığı ile reaksiyon Quench.
- 110 ° C'de 30 dakika fırında pişirme tarafından lamelleri kurulayın.
- 100 mM NaHCO 3 pH 8.2 50:1 metoksi: biotin PEG karışımı hazırlayın. Amaç yaklaşık% 0.2 w / v biotinlenmiş PEG.
- Pipet 100 mcL kuru Silanlanmış lamel ve yer üstünde başka bir lamel üzerine PEG karışımı. Bir cam lamel spacer dahil lamelleri ayrılması sağlayacaktır.
- 3 saat PEG çözüm lamelleri inkübe edin, sonra her çift lamelleri ayrı ve suyla iyice yıkayın. Sadece bir kez yan PEG ile kaplı olacak gibi lamelleri yan Fonksiyonlu tutmak için dikkatli olun.
- Vakum altında lamelleri ve mağaza kurulayın. Yüzeyler en az ayda bir sabit kalır, bu yüzden onlarca lamelleri bir toplu yapılan ve gerektiği gibi kullanılabilir.
Bu malzemeler, vaktinden önce ve sonra her bir deney için kullanılan olmalıdır. Her tek-molekül denemeyi başlatmak için, akış odasına montaj başlar.
3. Akış Odası Hazırlık
Deney Fonksiyonlu lamel, çift taraflı bant, kuvars slayt ve boru ile yapılan basit bir akış odası kullanılarak yapılır. Bir akış odası, tek tek her molekülün deney 1,4 için hazırlanmıştır.
Malzemeler: Çift taraflı bant, Razor bıçak, boru, Hızlı kuru epoksi delikli Kuvars slayt işlevselleştirildiyse lamel (bkz. yukarıda), Streptavidin çözümü (1 mg / mL PBS içinde 25 mcL), Boru, tampon Engelleme (20 mM Tris pH: 7.5, 2 mM EDTA, 50 mM NaCl, 0.2 mg / ml BSA,% 0.005 Tween-20)
- Sonraki adımlar için herhangi bir hava kabarcıklarını çıkarmak için bir desikatörde 20-25 mL engelleme tampon koyarak başlayın.
- PEG-Fonksiyonlu lamel alın ve PBS-seyreltilmiş streptavidin çözüm yüzey üzerinde 125 yayıldı. Streptavidin yüzey biotins bağlamak için izin odasının diğer bölümlerine hazırlarken, 20 dakika boyunca inkübe bırakın.
- Çift taraflı bir parçasınıd bant kuvars slayt boyutuna uyacak. Akış odasının bir taslak bant (1 mg / ml) çizilebilir, böylece bir kalem ile kaset üzerine boru delik konumunu işaretleyin.
- Delikleri etrafında 2 mm genişliğinde dikdörtgen olun. Bu akış kanalı olarak hizmet verecek, bu yüzden etrafında düz saplı boru giriş ve çıkış yapmak ve odayı terk emin olun. İsterseniz, birden fazla kanal ya da farklı boyutlarda kullanılabilir.
- Kanal içine herhangi bir yapışkan çıkıntı emin olmak için düz ve temiz kesim, çizilen taslak boyunca kesin.
- Kuvars iyice kullanarak aseton veya etanol önceki akış hücresi inşaat yapıştırıcı çıkarmak için temizleyin.
- Kanal anahat iyi hizalama, bir tarafı yapışkanlı arka kaldırmak ve kuvars slayt üzerine bandı dikkatlice yerleştirin. Giriş ve çıkış delikleri unblocked kalmaya ihtiyacı gibi, bant düzgün hizalamak için dikkatli olun.
- Akış hücresi giriş ve çıkış boru uzunlukları kesin. Bu tüp odası dibine düz basın böylece ilgili bir 30 ° açı tüp sonuna kesmek için yardımcı olur. Sonraki adımlar akış hücresi kolay eki için askıya destek çeşit tüpler yerleştirin.
- Streptavidin kaplı lamel su ile iyice durulayın ve basınçlı hava kullanarak kurutun. Yalnızca tek taraflı Fonksiyonlu olduğunu unutmayın; lamel üzerinde açmak için dikkatli olun. Teyp yedekleme diğer tarafına çıkartın ve kuvars slayt lamel üzerine yerleştirin.
- Yapıştırıcı sıkışıp herhangi bir hava hafifçe dışarı itmek için lamel basın. Bu akış kanalı içine almak herhangi bir hava kabarcıkları önlemeye yardımcı olacaktır.
- Epoksi ile odasının yanında Seal. Kesilmiş boru epoksi ile kuvars ve mühür deliklere yerleştirin. Bu, birkaç dakika kurumasını gerekiyor.
- Kuruduktan sonra, bazı gazlar engelleme tampon tüplerinden biri aracılığıyla çekerek yüzey engelleme başlar. 21-gauge iğne, 0,76 mm boru içinde mükemmel uyum sağlar. Hava kabarcıklarını çıkarmak için birkaç kez yıkayın ve odasının en az yarım saat süreyle inkübe izin.
4. Tek Molekül Çoğaltma Deney
Malzemeler: Hazır akış odası, SYTOX Portakal, TIRF mikroskop, 532 nm lazer, CCD kamera, görüntü elde etme yazılımı ile bilgisayar, Rolling daire DNA substrat Çoğaltma proteinleri
- Akış hücresi bloke edildikten sonra, her şeyi tek-molekül denemenize başlamaya hazır.
- Akış hücresi ve mikroskop sahne üzerine yerleştirin. Sahne klipler ile yerine oda tutun ve akış kanalı düz y ekseni boyunca yerleştirilmiş olduğundan emin olun.
- Daha büyük çaplı bir konektörü tüp veya bir iğne kullanarak şırınga pompası akış hücresi çıkış borusunun bağlayın. Tampon engelleme giriş yerleştirin ve şırınga, tüp içindeki herhangi bir havayı çıkarmak için geri çekin. Çıkış borusunun nazik bir fiske akış hücresi sıkışmış olan herhangi bir hava kabarcığı temizlenmesine yardımcı olacaktır.
- 1 ml engelleme tampon stok DNA şablonu pM 25 sulandırınız. DNA iyi bir yüzey kaplama izin orta akış hızında odasına Akış. 0.025 ml / dk 30 dakika iyi çalışır. Bu lamelleri her parti için yüzeyde ya da deney için kaç istenilen kaç DNA molekülleri dayalı çeşitli olabilir.
- DNA sonra, aşırı DNA engelleme tampon kullanarak yıkayın. Tüm serbest DNA kurtulmak için en az 200 akış hücre hacimleri için yıkayın.
- Çoğaltma tampon gaz alma başlayın. E. için coli çoğaltma deneyler, bunu 37 ° ° C ısıtılmış akış odasında kabarcıkları riskini azaltmak için.
- Lazer ve kamera açın. Soğutmalı CCD kullanılmadan önce sıcaklığa ulaşması gerekiyor.
- Eğer 37 ° C deney yapan, ısıtıcı açmak. Amacı, akış hücresi ile temas ya da daha sonra bir ısı banyosu olacaktır emin olun.
- Yıkama ve gaz alma sonra, reaksiyon hazırlanabilir. Mix nükleotidler, DTT ve çoğaltma tampon SYTOX. Sonra proteinler ekleyin ve hafifçe karıştırın.
- Akış hücresi içine reaksiyon karışımının akış. Bu akış hızı dsDNA germek için yeterli olması gerekir. 2 mm genişliğinde, 100 mikron uzun boylu akış kanalı için 0.04 ml / dak iyi çalışır.
- Karışımı için odasına girin ve görüntüleme başlamak için zaman tanıyın. Iyi bir ipucu, kanalın yan görüş alanını taşımak ve yapıştırıcı malzeme odaklanmak. Bu odaklama için yüzeye yakın sağlayacaktır.
- Lazer gücü, mikroskop odak ve TIRF açısını ayarlayın. Lekeli DNA herhangi bir photocleavage önlemek için düşük güç tutun. DNA replikasyon oranına bağlı olarak birkaç dakika için 1-5 kare / saniye edinin. Arzu edilirse, daha uzun çoğaltma yörüngeleri ya da daha fazla molekülleri görmek için yeni bir alana taşımak için tekrarlayın.
- Reaksiyon karışımı neredeyse boş sonra, S ile daha fazla tampon akışı iyi bir fikirdirYTOX bakış diğer alanlarını görmek için. Farklı çoğaltılır moleküllerin birden fazla görüntü almak processivity belirlenmesi için istatistikleri sağlar.
5. Temsilcisi Sonuçlar
Aktif kopyalayan moleküller kolayca boyanan DNA büyüyen çizgiler olarak görülür. Deneylerde, M13 substrat 25 pM akan bir görüş 60x, 125 mm x 125 mm alan (Şekil 1) 100-1000 molekülleri verir. E. kullanarak çoğaltma deneyler az 37 coli replisome proteinler ° C (Ayrıntılar için malzemeler), görüş alanı başına 5-50 kopyalayan moleküller verir . T7 replisome, çok daha verimli yüzey başlatan eşdeğer konsantrasyonlarda, biz bir alan çoğaltmak moleküllerin>% 70 gözlemlemek. Bu koşullar, tek tek moleküllerin çözmek ve analiz etmek için zor olduğu kadar yüksek bir ürün yoğunluğu verim, böylece daha az protein konsantrasyonları T7 deneyler yapılmaktadır.
Veri Analizi: oran veri elde etmek için, sadece DNA vs zaman son nokta arsa ve eğimi hesaplamak (Şekil 2) . Processivity için DNA toplam uzunluğu belirler. Bu iki numaraları baz çifti dönüştürülmesi gerekir. Deneme yapmadan önce, uygun büyütme kameranın piksel büyüklüğünü bilmeli. Basepair dönüşüm için iyi bir tahmin sadece DNA kristalografik uzunluğu, 2.9 bp / nm göre dönüştürme. Ancak, laminer akış tamamen DNA streç olmaz, bir DNA uzunluğu kalibrasyon, uzunluğu bilinen DNA, örneğin 48.502 bp λ DNA biotinlenmiş oligo akış hücresi takılarak ve onun SYTOX lekeli uzunluk ölçüm yapılmalıdır çoğaltma deney için kullanılan akış hızı. Baz çifti / piksel sayısını belirleyen çoğaltma oranları ve processivities doğru hesaplama sağlayacaktır. Oranı ve processivity dağılımları (Şekil 2) 1 komplo sağlayan, çok sayıda fotoğraf ve film çekmek çok sayıda ürün molekülünün sağlayacaktır .
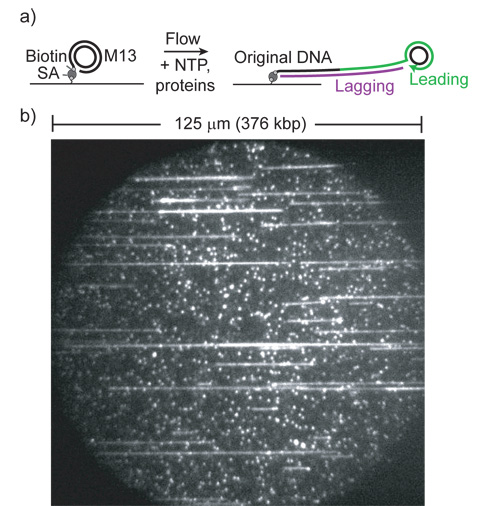
Şekil 1: (Ref itibaren 1) a) haddeleme daire çoğaltma tahlil Cartoon. (SA, streptavidin). Önde gelen iplikli sentezi daire ve yüzey birbirine bağlayan kuyruk uzanır. Kuyruk gecikmeli iplikçik polimeraz dsDNA dönüştürülür ve laminer akış gergin.
b) Örnek SYTOX Orange ve 532 nm eksitasyon ile görüş alanı. Küçük floresan noktalar gergin olmayan çoğaltılmış substratlar. Ürünlerin aşırı uzunluğu ve alan başına ürünleri (> 5000 gibi alanlarda her bir akış hücresi içerir) çok sayıda unutmayın.

Şekil 2: (Ref adapte 1) a, b) T7 (a) ve E. tipik kopyalayan moleküllerin Kymographs coli (b) deneyler. c) a) ve b) moleküllerin Endpoint yörüngeleri zaman karşı çizilen. Yörüngeler çoğaltma oranlarını elde etmek için lineer regresyon ile donatılmıştır. Gösterilen örnekler 99.4 baz puan (bp) -1 ve 467,1 bp s -1. ) 25.3 ± 1.7 kbç (T7), 85.3 ± 6.1 kbç (E. coli: d) çoğaltma ürünleri uzunluğu dağılımları, processivity elde etmek için tek bir üstel bozulma ile uygun . e) tek bir molekül yörüngeleri kuru dağılımları, tek bir Gauss uygun. Şu anlama gelir: 75.9 ± 4.8 bp s -1 (T7), 535,5 ± 39 baz puan (bp) -1 (E. coli).
Tartışmalar
Bir kritik kontrol ilgi çoğaltma proteinler, leke, SYTOX Orange etkisini inceliyor. Bunu yapmanın kolay bir yolu olarak tanımlanan akış hücresi değil SYTOX ihmal çoğaltma deney yapmaktır. Reaksiyon karışımı odasına akardı sonra, DNA boyama ve çoğaltılmış moleküllerin uzunluğu dağılımı incelemek için SYTOX ile tampon ekleyin. Alternatif olarak, standart dökme reaksiyonlar SYTOX çoğaltma hızı ve verimliliği üzerinde herhangi bir etkisi kontrol etmek için kullanılabilir.
Burada tarif edilen deney, sadece tek bir akış kanalı kullanır. Bu multi-kanal akışı odaları oluştururken veya PDMS veya benzer mikroakışkan cihazlar kullanarak kolayca değiştirilebilir. Kanal sayısının artırılması, protein konsantrasyonları, mutantlar, ya da inhibitör molekülleri tarama büyük ölçüde kolaylaştırır ve çoğaltma veri toplama hızı artmaktadır.
Bahsettiğimiz gibi, E. gerçekleştirmek coli çoğaltma deneyler 37 ° ° C ev yapımı alüminyum akış hücresi ısıtıcı, rezistif bir ısıtma elemanı (kartuş ısıtıcı) ve değişken güç kaynağı. Bu iyi bir sıcaklık kararlılığı sağlar ve objektif bir ısıtıcı satın önler. Isıtıcı kalibre etmek için, biz sadece bir kuvars akışını hücrenin üst merkezinde bir delik delinmiş bir termokupl akış kanalı içine eklenen ve normal olarak tampon akıyordu. Artan gerilimler akış hücresi tampon sıcaklık ölçüm doğru ısıtma sağlar.
Teşekkürler
Samir Hamdan, bu tekniğin geliştirilmesi destekli E. coli proteinler Prof. Nick Dixon laboratuar, Wollongong Üniversitesi ve T7 proteinler, Harvard Tıp Fakültesi'nden Prof. Charles Richardson . Çalışma Ulusal Sağlık Enstitüleri (AMvO için GM077248) ve Jane Tabut Childs Vakfı (JJL) tarafından desteklenmektedir.
Malzemeler
T7 Çoğaltma: 5 mM dithiothreitol ile 40 mM Tris, pH 7.5, 50 mM potasyum glutamat, 10 mM magnezyum klorür, 100 mg / ml BSA, 600 mcM dNTP, 300 mcM ATP, 300 mcM CTP, ve 15 nM SYTOX Turuncu hemen önce eklendi kullanın. 5 nM GP4 (hexamer), 40 nM polimeraz (1:1 GP5:: tiyoredoksin), 360 nm gp2.5 1,5 Proteinler olarak eklenir.
E. coli Çoğaltma: 50 mM HEPES pH 7.9, 12 mM magnezyum asetat, 80 mM potasyum klorür, 100 mg / ml BSA ile 10 mM dithiothreitol, 40 mcM dNTP, 200 mcM rNTPs, ve 15 nM SYTOX Turuncu hemen önce eklendi. Proteinler eklendi: 30 nM DnaB (hexamer), 180 nM DnaC (monomer), 30 nM αεθ, 15 nM τ 2 γ 1 δδ'χψ veya τ 3 δδ'χψ, 30 nM β (dimer), 300 nM DnaG, 250 nM SSB (tetramer), 20 nM PriA, 40 Nm PriB, 320 Nm PRIC, 480 nM DNAT 1,6
Referanslar
- Tanner, N. A., et al. Real-time single-molecule observation of rolling-circle DNA replication. Nucleic Acids Res. 37, e27(2009).
- Tabor, S., Huber, H. E., Richardson, C. C. Escherichia coli thioredoxin confers processivity on the DNA polymerase activity of the gene 5 protein of bacteriophage t7. J Biol Chem. 262, 16212-16223 (1987).
- Sofia, S. J., Premnath, V. V., Merrill, E. W. Poly(ethylene oxide) grafted to silicon surfaces: Grafting density and protein adsorption. Macromolecules. 31, 5059-5070 (1998).
- Tanner, N. A., van Oijen, A. M. Single-molecule observation of prokaryotic DNA replication. DNA replication: Methods and protocols. Vengrova, S., Dalgaard, J. Z. 521, Humana Press. New York. 397-410 (2009).
- Hamdan, S. M., Loparo, J. J., Takahashi, M., Richardson, C. C., van Oijen, A. M. Dynamics of DNA replication loops reveal temporal control of lagging-strand synthesis. Nature. 457, 336-339 (2009).
- Heller, R. C., Marians, K. J. Replication fork reactivation downstream of a blocked nascent leading strand. Nature. 439, 557-562 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır