Method Article
Визуализация одиночных молекул ДНК репликации с помощью флуоресцентной микроскопии
Резюме
Этот протокол демонстрирует простой одной молекулы флуоресцентной микроскопии технику для визуализации репликации ДНК отдельных replisomes в реальном времени.
Аннотация
Мы опишем простой флуоресцентной микроскопии основе в режиме реального времени метод для наблюдения репликации ДНК в одной молекуле уровне. Круглой, раздвоенный матричной ДНК прикрепляется к функционализированных покровного стекла и широко реплицировать после введения репликации белков и нуклеотидов (рис. 1). Растущий продукт двухцепочечной ДНК (дц) продолжается с ламинарным потоком и визуализируется с помощью интеркалирующих красителя. Измерение положения растущей ДНК конца в режиме реального времени позволяет осуществлять точное определение скорости репликации (рис. 2). Кроме того, длина готовый материал ДНК отчеты о processivity репликации. Этот эксперимент может быть выполнен очень легко и быстро, и требует только флуоресцентного микроскопа с достаточно чувствительной камерой.
протокол
Перед выполнением одной молекулы репликации эксперимента, несколько материалов должны быть готовы заранее.
1. Шаблон репликации ДНК
Субстрат для репликации реакция биотинилированного, хвостатые M13 по кругу катания подготовлен с использованием стандартных методов молекулярной биологии 1,2.
Материалы: M13mp18 одноцепочечных ДНК, Биотинилированные грунтовки олигонуклеотидных хвост (5'-биотин-T 36 AATTCGTAAT CATGGTCATAGCTGTTTCCT-3 '), Т7 ДНК-полимеразы, тепло блок, фенол / изоамиловый спирт / Хлороформ
- Отжиг биотинилированного олиго хвоста до M13, добавив 10-кратное превышение олиго в TBS буфера (330 нМ хвост олиго, 33 нМ M13).
- Нагрейте смесь до 65 ° С в тепло блока. Как только нагревается, включить отопление блокируют и позволяют медленного охлаждения правильно отжига праймера.
- Добавить загрунтовать M13 к смеси 64 нм Т7 ДНК-полимеразы и репликация T7 буфер, содержащий дНТФ и MgCl 2.
- Инкубируйте реакции при 37 ° С в течение 12 минут и утолить с 100 мМ ЭДТА.
- Purify заполненные продуктом ДНК с фенол / хлороформ / изоамиловый добычи алкоголя и диализировать в ТЕ буфера или другого подходящего буфера хранения и определения концентрации ДНК (Back-экстракт каждой органической фазы на возмещение любых остаточных загрунтовать M13).
- Один итерации шаблона подготовки может легко сделать несколько миллилитров наномолярных шаблон концентрации, достаточной для сотен до тысяч одиночных молекул экспериментов.
2. Функциональные Покровные
Для крепления ДНК, чтобы стекло покровное, стекло первой функционализированных аминосиланом, который затем связан с биотинилированного молекул ПЭГ. Это покрытие помогает уменьшить неспецифические взаимодействия ДНК и репликацию белков с поверхностью 1,3.
Материалы: стекло покровные, Окрашивание банки, 3-аминопропилтриэтоксисилана, метокси-PEG5k-NHS сложный эфир, биотин-PEG5k-NHSester, ацетон, 1М КОН, этанол, духовка, ванны sonicator
- Тщательно очистить стекла покровные, помещая их в банки и окрашивание заполнения банки с этанолом. Разрушать ультразвуком в течение 30 минут и промыть банки и залить 1 М КОН. Разрушать ультразвуком в течение 30 минут и повторите стирок.
- Для первой реакции функционализации, все следы воды должны быть удалены. Заполнить банки с ацетоном и разрушать ультразвуком в течение 10 мин. Промойте банки снова с ацетоном.
- Подготовка 2% об. / решение силана реагента в ацетоне. Добавить в окрашивании банки и агитировать за 2 минуты. Эта реакция пары алкокси группа аминосиланом к стеклу, оставляя реактивную амин для следующего шага связи. Quench реакции с большим избытком воды.
- Сухие покровные по выпечке их при температуре 110 ° С в духовке в течение 30 минут.
- Подготовка 50:1 метокси: биотин PEG смеси в 100 мМ NaHCO 3 рН 8,2. Стремитесь к примерно 0,2% мас. / биотинилированного ПЭГ.
- Внесите 100 мкл смеси ПЭГ на сухую silanized покровное и место другое покровное на вершине. В том числе прокладку стекло покровное позволит разделение покровные.
- Инкубируйте покровных в решении PEG на 3 часа, затем отделить каждую пару покровные и мыть широко водой. Будьте осторожны, чтобы сохранить покровные функционализированных стороной вверх, как только один раз из сторон будет покрыта ПЭГ.
- Сухие покровные и хранить в условиях вакуума. Поверхности остается стабильным в течение по крайней мере месяц, так что десятки покровные могут быть сделаны в партии и используются по мере необходимости.
Эти материалы должны быть сделаны заранее, а затем использоваться для каждого эксперимента. Для начала каждый молекулы эксперимента, можно приступить к сборке проточную камеру.
3. Подготовка потока палаты
Эксперимент проводится с помощью простой камеры поток, построенный с функциональными покровное, двусторонняя лента, кварц слайдов и трубопроводов. Один поток камера готова к каждой отдельной молекулы 1,4 эксперимент.
Материалы: Двусторонняя лента, лезвие бритвы, кварцевый слайд с отверстиями для шлангов, Quick-сухой эпоксидные, функционализированных покровное (см. выше), Стрептавидином решение (25 мкл 1 мг / мл в PBS), шланги, Блокировка буфера (20 мМ Трис рН 7,5, 2 мМ EDTA, 50 мМ NaCl, 0,2 мг / мл BSA, 0,005% Твин-20)
- Начнем с размещения 20-25 мл блокирующего буфера в эксикаторе, чтобы удалить пузырьки воздуха для последующего шага.
- Возьмите PEG-функционализированных покровное и распространение 125 из PBS-разбавленный стрептавидин решение по поверхности. Оставьте это для инкубации в течение 20 минут при подготовке других частях камеры, что позволяет стрептавидин для связывания поверхности biotins.
- Отрежьте кусок двухстороннимг ленту, чтобы соответствовать размеру кварцевых слайда. Отметьте положение трубки отверстий на ленте с карандашом, так что контур потока камера может быть обращено на ленту (1 мг / мл).
- Сделайте 2 мм широкий прямоугольник вокруг отверстия. Это будет служить течения в канале, так что не забудьте сделать прямые стороны и оставить место вокруг трубы входе и выходе. При желании, несколько каналов или разных размеров могут быть использованы.
- Вырезать по обращено наброски, делая прямые, чистые пропилы, чтобы убедиться, нет клея выступает в канал.
- Чистый кварц тщательно с использованием ацетона или этанола, чтобы удалить клей от предыдущей конструкции ячейки потока.
- Найти лучшее выравнивание канала контур, удалить одну сторону клеем поддержки и осторожно поместите ленту на кварц слайда. Будьте осторожны, чтобы выровнять ленты должным образом, как входное и выходное отверстия должны оставаться разблокированы.
- Листы из трубки для входа и выхода потока клетки. Это помогает сократить конец трубки примерно на 30 градусов так, чтобы трубка не будет давить квартира против дно камеры. Место трубок на какую-то поддержку приостановить их для легкого крепления к проточной ячейки в следующих шагах.
- Промыть покрытых стрептавидином покровное тщательно промыть водой и сухим сжатым воздухом. Помните, что только одна сторона функционализированных, будьте осторожны, чтобы не повернуть покровное старше. Удалите другой стороне ленты поддержки и место кварца слайд на покровное.
- Слегка нажмите на покровное выдвинуть какие-либо воздух, находящийся в клей. Это поможет избежать воздушных пузырей попасть в поток канала.
- Печать стороны камеры с эпоксидной смолой. Вставьте вырезать трубки в отверстия кварца и уплотнение в месте с эпоксидной смолой. Это должно высохнуть в течение нескольких минут.
- После высыхания, начать блокирование поверхности, потянув некоторые из дегазированной блокирующего буфера через одну из труб. 21-иглы прекрасно вписывается в 0,76 мм трубы. Промойте несколько раз, чтобы удалить пузырьки воздуха, и позволяют камере для инкубации, по крайней мере полчаса.
4. Одиночных молекул репликации Эксперимент
Материалы: Подготовлено камере поток, SYTOX Orange, TIRF микроскоп, 532 нм лазер, ПЗС-камера, компьютер с изображением приобретение программного обеспечения, Rolling круга ДНК субстрата, белки репликации
- После проточной ячейки был заблокирован, все готово, чтобы начать одиночных молекул эксперимента.
- Возьмите проточной ячейки и поместить его на предметный столик микроскопа. Держите камеру в месте с этапа клипы и быть уверенным, что поток канала находится прямо по оси ординат.
- Подключите выход проточной ячейки трубки шприцевой насос использованием большего диаметра трубки разъем или иглы. Место входа в блокирующем буфере и отступить от шприца, чтобы удалить воздух в трубке. Нежным движением отводной трубки поможет очистить любые воздушные пузыри захваченных в проточной ячейке.
- Развести шаблон фондовом ДНК до 25 часов в 1 мл блокирующего буфера. Поток в камере при умеренном расходе, чтобы хорошее покрытие поверхности ДНК. 0,025 мл / мин в течение 30 минут работает хорошо. Это может быть изменена в зависимости от количества молекул ДНК на поверхности для каждой партии покровные или сколько желательны для эксперимента.
- Как только ДНК находится, промыть избыток ДНК с использованием блокирующего буфера. Вымойте, по крайней мере 200-клеточной поток объемах, чтобы избавиться от всех свободных ДНК.
- Начните дегазации репликации буфера. Для E. Эксперименты кишечной репликации, сделать это при 37 ° С, чтобы уменьшить риск пузырьков в камере нагревается потоком.
- Включите лазер и камера. Охлаждением ПЗС необходимо достичь температуры, прежде чем он может быть использован.
- При выполнении 37 ° C эксперимент, включите обогреватель. Убедитесь, что цель находится в контакте с проточной ячейки или это будет радиатора позже.
- После промывки и дегазации, реакция может быть подготовлен. Смешайте нуклеотидов, DTT, и SYTOX в репликации буфера. Затем добавить белки и аккуратно перемешать.
- Поток реакционной смеси в потоке клеток. Это скорость потока должна быть достаточной, чтобы растянуть двухцепочечной ДНК. Для 2-мм, 100-мкм высокий течения в канале 0,04 мл / мин работает хорошо.
- Подождите, пока смесь, чтобы войти в камеру и начинаем съемки. Хороший совет является перемещение поля зрения в сторону канала и сосредоточить внимание на клейкое вещество. Это будет гарантировать, вы находитесь рядом с поверхностью для фокусировки.
- Отрегулируйте мощность лазера, микроскоп фокус и TIRF углом. Держите низкое напряжение, чтобы избежать любых photocleavage из окрашенных ДНК. Приобретать на 1-5 кадров / сек в течение нескольких минут в зависимости от скорости репликации ДНК. При желании повторить, чтобы получить больше траектории репликации или переехать в новое поле, чтобы видеть больше молекул.
- Затем реакционную смесь почти пуст, это хорошая идея, чтобы поток в более буфер с SYTOX, чтобы увидеть другие поля зрения. Взяв несколько изображений различных репликации молекул предоставляет статистику для processivity определения.
5. Представитель Результаты
Активно репликации молекул, как легко видеть, как рост линий из цветного ДНК. В наших экспериментах, струящиеся 25 рм M13 подложки дает 100-1000 молекул в 60x, 125 мкм и длиной 125 мкм поле зрения (рис. 1). Выполнение репликации экспериментов с использованием E. кишечной replisome белков при температуре 37 ° С (см. Материалы для подробной информации) дает 5-50 репликации молекул в поле зрения. На эквивалентной концентрации T7 replisome, который инициирует на подложке намного более эффективно, мы наблюдаем> 70% молекул в поле репликации. Эти условия дают плотность продукта настолько высока, что отдельные молекулы трудно решить и проанализировать, так T7 эксперименты проводятся при более низких концентрациях белка.
Анализ данных: Чтобы получить скорость передачи данных, просто участок конечной точкой ДНК в зависимости от времени и вычислить наклон (рис. 2). Для processivity, определять общая длина ДНК. Оба эти числа должны быть преобразованы в пар оснований. Перед проведением эксперимента, вы должны знать, размер пикселя камера на должном увеличении. Для преобразования basepair, хорошей оценкой просто преобразования на основе кристаллографической длины ДНК, 2,9 б.п. / нм. Тем не менее, ламинарный поток не будет полностью растянуть ДНК, так что калибровка ДНК длина должна быть выполнена с известными ДНК длиной, например, 48 502 б.п. λ ДНК, прикрепив ее к проточной ячейке с биотинилированного олиго и измерения его SYTOX окрашенных длины Скорость потока используется для репликации эксперимента. Определение количества базовых пар / пиксел позволит точный расчет ставки и репликации processivities. Принимая многочисленные изображения и фильмы обеспечит большое количество продукта молекулы, что позволяет построение курса и processivity распределения (рис. 2) 1.
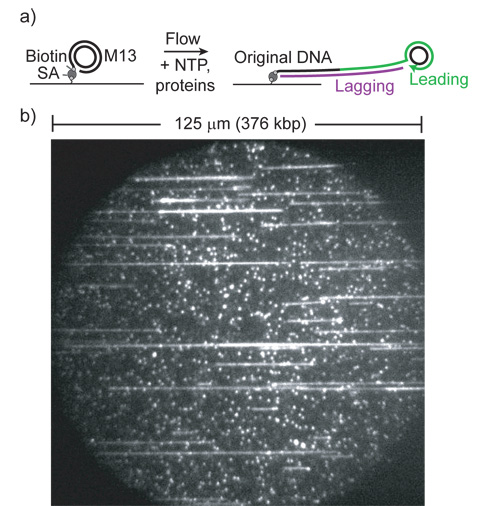
Рисунок 1: (Из работы 1.)) Мультфильм подвижного круга репликации анализа. (SA, стрептавидин). Ведущий-нить синтез расширяет хвост связь круга и поверхностью. Хвост превращается в дц по отстающим прядь полимеразы и растягивается ламинарного потока.
б) Пример поле зрения с SYTOX оранжевой и 532 нм возбуждения. Малый флуоресцентные пятна привязаны, невоспроизводимого субстратов. Обратите внимание на крайнюю длину продуктов и большое количество продуктов на поле (каждый поток ячейка содержит> 5000 таких полей).

Рисунок 2: (взято из работы 1.), Б) Kymographs типичных репликации молекул из T7 () и Е. палочка (б) эксперименты. в) Конечная точка траектории молекул из а) и б) построены зависимости от времени. Траектории оснащены линейной регрессии для получения репликации ставок. Показано примеры 99,4 б.п. с -1 и 467,1 б.п. с -1. г) Длина распределения продуктов репликации, пригодный для одной экспоненты распада для получения processivity: 25,3 ± 1,7 т.п.н. (Т7), 85,3 ± 6,1 т.п.н. (кишечная палочка). д) Скорость распределения одной траектории молекулы, подходят с одним Гаусса. Средства: 75,9 ± 4,8 б.п. с -1 (Т7), 535,5 ± 39 б.п. с -1 (кишечная палочка).
Обсуждение
Одним из важнейших контроль изучает влияние пятно, SYTOX Orange, на репликацию белков, представляющих интерес. Простой способ сделать это, чтобы выполнять репликацию эксперимент в проточной ячейки, как описано, но с пропуском SYTOX. После реакции смесь протекает через камеру, добавить буфера с SYTOX для окрашивания ДНК и изучить распределение длин реплицированных молекул. Кроме того, стандартные реакции масса может быть использована для проверки какой-либо эффект от SYTOX на скорость репликации и эффективности.
Эксперимент, описанный здесь, использует только один канал потока. Это может быть легко изменена путем создания многоканальных камер потока или с использованием PDMS или аналогичных микрожидкостных устройств. Увеличение количества каналов значительно облегчает скрининг белков концентрациях, мутанты, или ингибитор молекул и увеличивает скорость сбора репликации данных.
Как уже упоминалось, мы выполняем Е. кишечной репликации эксперименты при температуре 37 ° С, используя самодельный алюминия проточной ячейке нагревателя, резистивный нагревательный элемент (картридж обогреватель) и переменной питания. Это дает хорошую стабильность температуры и позволяет избежать покупки цель нагревателя. Для калибровки нагревателя, мы просто просверлил отверстие в центре верхней ячейке кварца потока, вставлены термопары в поток канала и текла буфера, как обычно. Измерение буфера проточной ячейки температуры на повышение напряжения позволяет точно отопления.
Благодарности
Самир Хамдан помогал в разработке этой техники. E. кишечной белки из лаборатории профессора Ника Диксон, Университет Wollongong, и Т7 белки от профессора Чарльза Ричардсон, Гарвардской медицинской школы. Работа поддержана Национальным институтом здоровья (GM077248 к AMvO) и Джейн Фонда Гроб Чайлдс (мк).
Материалы
T7 репликации: 40 мМ Трис рН 7,5, 50 мМ калий глутамат, 10 мМ хлорид магния, 100 мкг / мл BSA, 5 мМ дитиотреитол, 600 мкМ дНТФ, 300 мкМ АТФ, 300 мкм CTP, и 15 нМ SYTOX оранжевой добавил непосредственно перед использования. Белки добавлены: 5 нМ GP4 (гексамера), 40 нМ полимеразы (1:1 GP5: тиоредоксин), 360 нм gp2.5 1,5.
Кишечная палочка Репликация: 50 мМ HEPES рН 7,9, 12 мМ ацетат магния, 80 мМ хлористого калия, 100 мкг / мл BSA 10 мМ дитиотреитол, 40 мкМ дНТФ, 200 мкМ rNTPs и 15 нМ SYTOX оранжевой добавил непосредственно перед употреблением. Белки добавлены: 30 нМ DnaB (гексамера), 180 нм DnaC (мономера), 30 нМ αεθ, 15 нМ τ 2 γ 1 δδ'χψ или τ 3 δδ'χψ, 30 нМ β (димер), 300 нм DnaG, 250 нМ SSB (тетрамер), 20 нМ PRIA, 40 нМ Приб, 320 нМ PRIC, 480 нМ DNAT 1,6
Ссылки
- Tanner, N. A., et al. Real-time single-molecule observation of rolling-circle DNA replication. Nucleic Acids Res. 37, e27(2009).
- Tabor, S., Huber, H. E., Richardson, C. C. Escherichia coli thioredoxin confers processivity on the DNA polymerase activity of the gene 5 protein of bacteriophage t7. J Biol Chem. 262, 16212-16223 (1987).
- Sofia, S. J., Premnath, V. V., Merrill, E. W. Poly(ethylene oxide) grafted to silicon surfaces: Grafting density and protein adsorption. Macromolecules. 31, 5059-5070 (1998).
- Tanner, N. A., van Oijen, A. M. Single-molecule observation of prokaryotic DNA replication. DNA replication: Methods and protocols. Vengrova, S., Dalgaard, J. Z. 521, Humana Press. New York. 397-410 (2009).
- Hamdan, S. M., Loparo, J. J., Takahashi, M., Richardson, C. C., van Oijen, A. M. Dynamics of DNA replication loops reveal temporal control of lagging-strand synthesis. Nature. 457, 336-339 (2009).
- Heller, R. C., Marians, K. J. Replication fork reactivation downstream of a blocked nascent leading strand. Nature. 439, 557-562 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены